TOKSISITAS LOGAM BERAT Cu PADA BERBAGAI pH
TERHADAP KONSUMSI OKSIGEN DAN RESPON
HEMATOLOGI IKAN NILA GIFT (Oreochromis sp)
ADE YULITA HESTI LUKAS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2010
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Toksisitas Logam Berat Cu pada Berbagai pH Terhadap Konsumsi Oksigen dan Respon Hematologi Ikan Nila gift (Oreochromis sp) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2010
Ade Yulita Hesti Lukas NRP C151080061
ABSTRACT
ADE YULITA HESTI LUKAS. Toxicity of Copper Element at Various pH Value on Oxygen Consumption and Haematology Responses of Nile Tilapia (Oreochromis sp). Under direction of DANIEL DJOKOSETIYANTO, and TATAG BUDIARDI
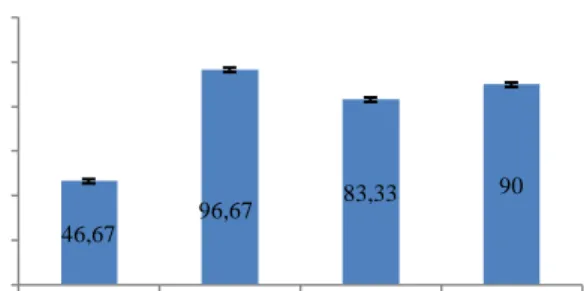
Copper is one of the essential element useful for metabolism of aquatic organisms. Its usually used to control growth of algae and pathogenic bacteria in aquatic environment, but it can be toxic if in large quantities. The pH value is very influential on copper specification in water. The aim of this research was to analyse the toxicity of copper element at various pH on oxygen consumption and haematology responses of nile tilapia. This results can be used as information for aquaculturists and the society at large on copper toxicity incase of change in the water pH value. The results of this research indicates that significant difference in all the blood parameters (average erythrocyte, leucocyte, Hct, Hb and leucocyte differentiation) between treatments (p<0,05) with preference, decreases with decrease in pH value. Based on filaments histology analysis results indicates that infection on gill filament, kidney and skin hence interferes with the rate of oxygen consumption and abnormality in the blood of specimen. Fish survival rate in the P1 (pH 5±0,5) 46.67% was lower than in other treatments. Accumulation of
copper due to decrease in water pH also decreases oxygen consumption rate, as well as blood parameters.
RINGKASAN
ADE YULITA HESTI LUKAS. Toksisitas Logam Berat Cu Pada Berbagai pH Terhadap Konsumsi Oksigen dan Respon Hematologi Ikan Nila Gift (Oreochromis sp). Dibimbing oleh DANIEL DJOKOSETIYANTO, dan TATAG BUDIARDI
Tembaga merupakan suatu unsur yang sangat penting dan berguna untuk metabolisme bagi organisme perairan. Bagi makhluk hidup, tembaga berperan khususnya dalam beberapa kegiatan enzim pernapasan sebagai tirosinase dan silokron oksidasi. Beberapa penelitian melaporkan bahwa defisiensi Cu dapat menurunkan jumlah sel T-limposit dan menghambat respon poliklonal sel T dan B mitogenesis, serta respon antibodi, dan dapat menurunkan aktivitas sel pagosit untuk membunuh mikroba, sehingga hewan menjadi lebih peka terhadap infeksi penyakit. Pemberian Cu dalam waktu lama meskipun dalam dosis rendah, dapat merusak kemampuan sel imun untuk berproliferasi (memperbanyak diri) baik sel T ataupun sel B poliklonal mitogen.
Tembaga (Cu) dapat masuk ke lingkungan perairan melalui bermacam-macam jalur dan sumber, baik secara alamiah maupun non alamiah. Tembaga sulfat (CuSO4) biasanya pada kolam-kolam budidaya digunakan untuk
mengontrol pertumbuhan alga dan beberapa bakteri patogen, namun dalam konsentrasi berlebih, tembaga (Cu) dapat bersifat racun bagi ikan. Pengaruh tembaga terhadap lingkungan akuatik sangat kompleks dan sangat bergantung pada karakteristik fisika-kimia air. Nilai pH sangat berpengaruh terhadap spesifikasi tembaga dalam air. Keberadaan tembaga (Cu) yang berlebih dalam air akan mengganti kedudukan Zn dalam insang sehingga menghambat kerja dari enzim karbonik anhidrase dalam proses respirasi. Enzim karbonik anhidrase adalah enzim yang mengandung Zn yang berfungsi mendehidrasi asam bikarbonat (HCO3-) menjadi karbondioksida (CO2
Tujuan penelitian ini adalah untuk menganalisis toksisitas logam berat Cu pada berbagai pH terhadap tingkat konsumsi oksigen, jumlah sel darah merah (eritrosit), jumlah sel darah putih (leukosit), kadar hematokrit, kadar hemoglobin, diferensiasi leukosit, kerusakan jaringan dan kelangsungan hidup ikan nila gift. Manfaat penelitian ini diharapkan dapat menjadi sumber informasi bagi pelaku budidaya perikanan dan masyarakat pada umumnya mengenai bahaya toksisitas Cu dalam perairan apabila terjadi perubahan pH dan bahayanya bagi manusia, sehingga diharapkan dapat meningkatkan teknik pengelolaan perairan budidaya secara berkelanjutan dan lestari.
). Apabila fungsi enzim karbonik anhidrase terganggu maka proses pertukaran gas dari dalam tubuh ikan dengan lingkungan juga akan terganggu.
Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap, dengan 4 perlakuan, 4 kontrol dan 3 kali ulangan. Untuk perlakuan P1)
nilai pH 5±0,5 + Cu 0,3 mg/L, perlakuan P2) nilai pH 6±0,5 + Cu 0,3 mg/L,
perlakuan P3) nilai pH 7±0,5 + Cu 0,3 mg/L, perlakuan P4) nilai pH 8±0,5 + Cu
pH 5±0,5 tanpa Cu, K2) kontrol 2 nilai pH 6±0,5 tanpa Cu, K3) kontrol 3 nilai pH
7±0,5 tanpa Cu, dan K4
Hasil penelitian menunjukkan bahwa kelangsungan hidup tertinggi terjadi pada P
) kontrol 4 nilai pH 8±0,5 tanpa Cu.
2 (pH 6±0,5) yaitu sebesar 96,67% dan terendah pada P1
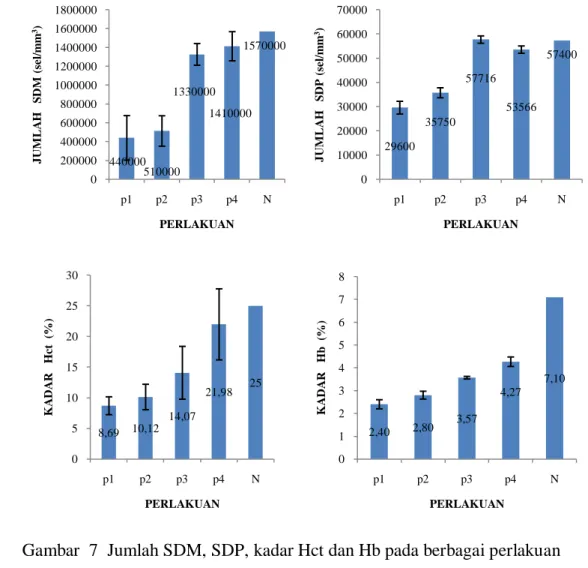
Hasil penelitian menunjukkan adanya perbedaan nyata semua parameter gambaran darah (jumlah sel darah merah, sel darah putih, kadar hematokrit, hemoglobin dan diferensiasi leukosit) dan tingkat konsumsi oksigen antar perlakuan (P<0,05) dengan kecenderungan menurun dengan menurunnya pH media. Jumlah sel darah merah ikan nila terendah pada perlakuan P
(pH 5±0,5) yaitu sebesar 46,67%. Penambahan logam Cu pada air ber-pH rendah (5±0,5) menyebabkan kemampuan tingkat konsumsi oksigen dan respon hematologi ikan terganggu. Penyebabnya adalah kerusakan yang terjadi pada jaringan tubuh seperti insang, kulit dan ginjal yaitu berupa mineralisasi dan kerusakan lainnya sehingga mengganggu aktifitas hidup ikan (menurunnya kemampuan menyerap oksigen, kelainan pada darah, dan nafsu makan menurun).
1 yaitu sebesar
0,44x106 sel/mm3, kemudian perlakuan P2 sebesar 0,51x106 sel/mm3, perlakuan
P3 sebesar 1,33x106 sel/mm3, dan perlakuan P4 sebesar 1,41x106 sel/mm3,
sedangkan jumlah sel darah merah pada ikan normal adalah sebesar 1,57x106 sel/mm3. Jumlah sel darah putih ikan nila tertinggi terdapat pada perlakuan P3
yaitu sebesar 5,77x104 sel/mm3, kemudian perlakuan P4 sebesar 5,36x104
sel/mm3, perlakuan P2 sebesar 3,57x104 sel/mm3 dan perlakuan P1 sebesar
2,96x104 sel/mm3, sedangkan pada ikan normal adalah sebesar 5,74x104 sel/mm3. Kadar hematokrit terendah terdapat pada perlakuan P1 yaitu sebesar 8,69%,
kemudian perlakuan P2 sebesar 10,12%, perlakuan P3 sebesar 14,07% dan
perlakuan P4 sebesar 21,98% sedangkan kadar hematokrit ikan normal adalah
25%. Kadar hemoglobin terendah terdapat pada perlakuan P1 yaitu sebesar 2,4%,
kemudian perlakuan P2 sebesar 2,8%, perlakuan P3 sebesar 3,57% dan perlakuan
P4 sebesar 4,27%, sedangkan pada ikan normal adalah sebesar 7,1%. Diferensiasi
leukosit terdiri dari netrofil, trombosit, monosit, dan limposit. Kadar netrofil terendah terdapat pada perlakuan P4 yaitu sebesar 6%, kemudian perlakuan P3
sebesar 7%, perlakuan P2 sebesar 8,67% dan perlakuan P1 sebesar 10,67%,
sedangkan pada ikan normal adalah 4%. Kadar trombosit terendah terdapat pada perlakuan P4 yaitu sebesar 6%, kemudian P3 sebesar 6,33%, perlakuan P2 sebesar
7% dan perlakuan P1 sebesar 10%, sedangkan pada ikan normal adalah sebesar
3%. Kadar monosit tertinggi terdapat pada perlakuan P1 yaitu sebesar 24%,
kemudian perlakuan P2 sebesar 18%, perlakuan P3 sebesar 16% dan perlakuan P4
sebesar 14,67%, sedangkan pada ikan normal sebesar 10%. Kadar limposit terendah terdapat pada perlakuan P1 yaitu sebesar 55,33%, kemudian perlakuan
P2 sebesar 66,33%, perlakuan P3 sebesar 70,67% dan perlakuan P4
Dari hasil histologi jaringan insang ditemukan adanya kerusakan terparah terjadi pada perlakuan P
sebesar 73,33%, sedangkan pada ikan normal adalah sebesar 83%.
1, kemudian perlakuan P2, perlakuan P4 dan kerusakan
terendah terdapat pada perlakuan P3. Jaringan ginjal menunjukkan kerusakan
terparah pada perlakuan P1, kemudian perlakuan P2, perlakuan P3, dan terendah
pada perlakuan P4. Jaringan kulit hanya mengalami hemorage (pendarahan)
dengan kondisi terparah pada perlakuan P1, kemudian perlakuan P2, perlakuan P3
Penurunan tingkat konsumsi oksigen ikan sangat berhubungan dengan kerusakan jaringan insang yang dialami. Hasil penelitian menunjukkan bahwa tingkat konsumsi oksigen terendah terjadi pada perlakuan P1, kemudian perlakuan
P2, perlakuan P4, dan tertinggi pada perlakuan P3
Pencemaran logam berat Cu pada perairan umum dapat membahayakan biota yang hidup dalam perairan tersebut, walaupun dalam dosis yang rendah. Keadaan ini dapat diperparah dengan adanya fluktuasi pH air yang terjadi secara tiba-tiba, sehingga perlu diperhatikan pH dari perairan tersebut.
.
Kata kunci : Cu, berbagai pH, konsumsi oksigen, respon hematologi
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB
TOKSISITAS LOGAM BERAT Cu PADA BERBAGAI pH
TERHADAP KONSUMSI OKSIGEN DAN RESPON
HEMATOLOGI IKAN NILA GIFT (Oreochromis sp)
ADE YULITA HESTI LUKAS
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2010
Judul Tesis : Toksisitas Logam Berat Cu pada Berbagai pH terhadap Konsumsi Oksigen dan Respon Hematologi Ikan Nila Gift (Oreochromis sp)
Nama : Ade Yulita Hesti Lukas NRP : C151080061
Disetujui :
Komisi Pembimbing
Prof. Dr. Ir. D. Djokosetiyanto, DEA.
Ketua Anggota
Dr. Ir. Tatag Budiardi, M.Si.
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Ilmu Akuakultur,
Prof. Dr. Ir. Enang Harris, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan YME atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Nopember 2009 ini ialah perubahan nilai pH, dengan judul Toksisitas Logam Berat Cu pada Berbagai pH terhadap Konsumsi Oksigen dan Respon Hematologi Ikan Nila Gift (Oreochromis sp).
Terima kasih yang setulusnya penulis ucapkan kepada komisi pembimbing Bapak Prof. Dr. Ir. D. Djokosetyanto, DEA dan Bapak Dr. Ir. Tatag Budiardi, M.Si yang telah meluangkan waktu dan banyak memberi saran, bimbingan, arahan serta motivasi. Ucapan terima kasih yang setulusnya juga penulis sampaikan kepada Bapak Dr.Ir. Nur Bambang Priyo Utomo, M.Si selaku penguji luar komisi yang telah meluangkan waktu dan telah bersedia untuk menjadi penguji. Di samping itu, penghargaan penulis sampaikan kepada Pak Ranta, Pak Jajang, Pak Wasjan dan juga Kang Abe yang telah membantu selama pengumpulan data. Terima kasih yang sebesarnya kepada Universitas Nusa Cendana (Undana) yang telah memberikan kesempatan penulis untuk melanjutkan studi di Institut Pertanian Bogor (IPB). Ungkapan terima kasih juga disampaikan kepada Beasiswa Program Pasca Sarjana (BPPS), dan Pemerintah Daerah Nusa Tenggara Timur (NTT) yang telah membantu penulis dalam pembiayaan perkuliahan dan penelitian. Ungkapan terima kasih yang setulusnya kepada orang tua tercinta Alm. Bapak Hendrik Lukas, mama Yuliana Lukas, suamiku Yosias Mangi, dan anakku tercinta Gilang yang telah mendukung dan selalu mendoakan, serta adik-adikku (Septi, Dian, Ana dan Arni), kakak-kakakku (Kak Abe, Kak Heni, Kak Winand, Kak Ellent, Kak Jemi, Kak Lola, Kak Sam, Kak Hana dan Kak Susan) dan keponakan-keponakanku (Weni, Wini, Wira, Revin, Widya, Reva, Grace, Moreno, dan Aurel) serta teman-teman persekutuan oikumene (Bang Yafet sekeluarga, Ko Husin sekeluarga, teman-teman FTTI, Linda, Agus, Ceria, Jems, Kak Adi, Kak Imel, Pak Elmo dan semuanya) juga semua teman-teman akuakultur 2008 terutama minor lingkungan (Riza, Bunda, Pak Gian, Edo, Pak Supay, Pak Sumo, Pak Is, Pak Kadir, Isye dan Pak Mardin) dan ibu Agnet serta adik ku Gloria atas segala bantuan, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2010
RIWAYAT HIDUP
Penulis dilahirkan di Kupang pada tanggal 10 Juli 1979 dari ayah alm. Drs. Hendrik Lukas dan ibu Yuliana Lukas-Bengoe. Penulis merupakan anak ke enam dari sembilan bersaudara.
Tahun 1997 penulis lulus dari SMU Negeri 1 Kupang dan pada tahun yang sama lulus seleksi masuk Universitas Nusa Cendana melalui jalur penelusuran minat dan kemampuan (PMDK) Undana. Penulis memilih program studi Budidaya Akuakultur, Jurusan Perikanan dan Ilmu Kelautan, Fakultas Pertanian.
Tahun 2006 penulis diterima sebagai salah satu staf pengajar pada lingkungan Undana Fakultas Pertanian, Jurusan Perikanan dan Ilmu Kelautan dan pada tahun 2008 penulis diberikan kesempatan untuk melanjutkan studi dan diterima sebagai salah satu mahasiswa sekolah Pascasarjana, Institut Pertanian Bogor mayor Ilmu Akuakultur, dengan bantuan biaya dari BPPS.
DAFTAR ISI Halaman I. II. III. DAFTAR TABEL ... DAFTAR GAMBAR ... DAFTAR LAMPIRAN ... PENDAHULUAN 1.1 Latar Belakang ... 1.2 Perumusan Masalah ... 1.3 Tujuan Penelitian ... 1.4 Manfaat Penelitian ... 1.5Hipotesis ... TINJAUAN PUSTAKA
2.1 Kondisi Lingkungan Ikan Nila Gift ... 2.2 Distribusi dan Akumulasi Pencemar Logam oleh
Hewan Air ………. 2.3 Toksisitas Tembaga (Cu) ……….. 2.4 Kualitas Air ………... 2.4.1 Karbondioksida ……… 2.4.2 Oksigen Terlarut (DO) ……….
` 2.4.3 Suhu ……….
2.4.4 Nilai pH ……… 2.4.5 Total Amonia Nitrogen TAN ……….. 2.4.6 Hidrogen Sulfida (H2
2.5 Histopatologi dan Gambaran Darah Ikan ………. S) ………...
2.6.1 Histopatologi Ikan ………... 2.6.2 Gambaran Darah Ikan ……….. 2.6 Toksisitas Cu terhadap Konsumsi Oksigen dan Respon Hematologi ……… METODE PENELITIAN
3.1 Waktu dan Tempat ... 3.2 Alat dan Bahan ... 3.3 Prosedur Penelitian ... 3.3.1 Penelitian Pendahuluan ... 3.3.1.1 Uji Toksisitas Cu ... 3.3.1.2 Uji Nilai pH ... 3.3.2 Penelitian Inti ... 3.3.2.1 Uji Pengaruh ... 3.3.2.2 Tingkat Konsumsi Oksigen ... 3.3.2.3 Prosedur Pengukuran Kualitas Air ... 3.3.2.4 Tahap Analisis Darah ... 3.3.2.5 Uji Histopatologi ... 3.4 Rancangan Percobaan ... 3.5 Analisis Data ... xiv xv xvi 1 3 3 4 4 5 5 6 7 7 8 8 9 9 10 10 10 11 14 15 15 15 15 15 16 17 17 17 18 18 20 21 22
IV.
V.
HASIL DAN PEMBAHASAN
4.1 Uji Pendahuluan ... 4.1.1 Toksisitas Cu ... 4.1.2 Nilai pH ... 4.2 Pengaruh Toksisitas Cu pada Berbagai pH ... 4.2.1 Kualitas Air dan Kandungan Cu dalam Air ... 4.2.2 Kandungan Cu dalam Hati Ikan... 4.2.3 Analisis Histopatologi Ikan Nila ... 4.2.4 Gambaran Darah... 4.2.5 Kelangsungan Hidup ... 4.2.6 Tingkat Konsumsi Oksigen ... KESIMPULAN DAN SARAN
5.1 Kesimpulan ... 5.2 Saran ... DAFTAR PUSTAKA ... LAMPIRAN ... 23 23 23 24 24 26 26 32 36 37 38 38 39 42
xiv
DAFTAR TABEL
Halaman 1 2 3 4 5 6 7 8 9 10Kelangsungan hidup (%) ikan nila pada uji toksisitas Cu dengan konsentrasi yang berbeda ….………..
Rata-rata nilai kualitas air pada media pemeliharaan selama Penelitian ………...………...
Rata-rata kandungan Cu dalam air media pemeliharaan ………...
Kandungan Cu dalam hati ikan ………..
Perubahan histologi insang ikan nila ……….
Perubahan histologi pada ginjal ikan nila ……….
Rata-rata SDM, SDP, Hct, dan Hb setiap perlakuan pada
akhir penelitian ………...
Rata-rata diferensiasi leukosit (%) setiap perlakuan pada akhir penelitian ………
Rata-rata kelangsungan hidup ikan nila pada akhir penelitian …..
Tingkat konsumsi oksigen ikan nila pada akhir penelitian ………
23 24 25 26 27 30 33 35 36 37
xv
DAFTAR GAMBAR
Halaman 1 2 3 4 5 6 7 8 9 10 11Gambaran jaringan insang pada akhir penelitian ………
Histologi insang ikan normal ………...
Gambaran jaringan ginjal pada akhir penelitian ………..
Gambaran jaringan ginjal normal ………
Gambaran jaringan kulit ikan nila yang mengalami pendarahan.
Jaringan kulit ikan normal ………..
Jumlah SDM, SDP, kadar Hct dan Hb pada berbagai perlakuan.
Bentuk sel darah dalam diferensiasi leukosit ………..
Kadar diferensiasi leukosit ikan nila pada akhir penelitian …….
Tingkat kelangsungan hidup ikan nila pada akhir penelitian …..
Grafik tingkat konsumsi oksigen pada ikan nila ……….
28 29 31 31 32 32 34 35 36 37 37
xvi
DAFTAR LAMPIRAN
Halaman
1
2
Analisis statistik data gambaran darah ………..
Analisis statistik tingkat konsumsi oksigen ……….….
43
I. PENDAHULUAN
1.1 Latar Belakang
Tembaga merupakan suatu unsur yang sangat penting dan berguna untuk metabolisme bagi organisme perairan. Batas konsentrasi tertinggi dari unsur ini yang berpengaruh terhadap air berkisar antara 1–5 mg/L. Bagi makhluk hidup, tembaga berperan khususnya dalam beberapa kegiatan enzim pernapasan sebagai tirosinase dan silokron oksidasi. Beberapa penelitian melaporkan bahwa defisiensi Cu dapat menurunkan jumlah sel T-limposit dan menghambat respon poliklonal sel T dan B mitogenesis, serta respon antibodi. Selain itu juga dapat menurunkan aktivitas sel pagosit untuk membunuh mikroba, sehingga hewan menjadi lebih peka terhadap infeksi penyakit. Selanjutnya dinyatakan bahwa pemberian Cu dalam waktu lama meskipun dalam dosis rendah, dapat merusak kemampuan sel imun untuk berproliferasi (memperbanyak diri), baik sel T maupun sel B poliklonal mitogen. Wedemeyer (1996) menyatakan bahwa keberadaan logam berat (Cu, Hg) dalam perairan dapat mengganggu sistem pembentukan enzim ATP-ase.
Tembaga (Cu) dapat masuk ke lingkungan perairan melalui bermacam-macam jalur dan sumber, baik secara alamiah maupun non alamiah. Tembaga yang masuk ke perairan secara alamiah, berasal dari pengikisan batuan mineral yang menjadi debu dan partikel-partikel tembaga dalam lapisan udara yang terbawa oleh hujan lalu masuk ke dalam perairan (Marganof 2003). Secara non alamiah, tembaga masuk ke tatanan alamiah sebagai akibat dari aktivitas manusia seperti: buangan industri, pertambangan Cu, industri galangan kapal dan bermacam-macam aktivitas pelabuhan lainnya yang dapat mempercepat terjadinya peningkatan kelarutan Cu dalam badan perairan.
Tembaga sulfat (CuSO4) biasanya pada kolam-kolam budidaya digunakan
untuk mengontrol pertumbuhan alga dan beberapa bakteri patogen, namun dalam jumlah yang tinggi, tembaga (Cu) dapat bersifat racun bagi ikan (Carvalho dan Fernandes 2006). Pengaruh tembaga terhadap lingkungan akuatik sangat kompleks dan sangat bergantung pada karakteristik fisika-kimia air. Nilai pH sangat berpengaruh terhadap spesifikasi tembaga dalam air.
2
Ikan-ikan di perairan tropis lebih resistant (kebal) terhadap toksisitas Cu dibandingkan dengan ikan-ikan sub-tropis. Nilai LC50 Cu adalah 0,1 mg/L (ppm)
(Wedemeyer 1996). Sedangkan menurut Moore (1991) pada perairan alami, kadar tembaga biasanya < 0,02 mg/L. Nilai LC50
Logam tembaga (Cu) termasuk dalam logam klas B yang sangat reaktif terhadap ligan sulfur dan nitrogen. Unsur Zn didalam tubuh ikan berfungsi meningkatkan fungsi enzim karbonik anhidrase pada insang untuk menyerap oksigen. Apabila ikatan Zn itu diganti dengan Cu, maka fungsi enzim karbonik anhidrase juga akan menurun. Apabila ikatan Zn tersebut diganti Co, maka fungsi enzim menurun menjadi 56%, dan bila diganti Ni, Cd, Mn, dan Cu dalam bentuk substansi molekul, fungsinya sangat menurun menjadi kurang dari 4%. Ikatan logam kelas B sangat penting bagi fungsi normal metaloenzim. Bilamana metaloenzim disubsitusi oleh logam yang bukan semestinya, maka akan menyebabkan protein mengalami deformasi sehingga mengakibatkan menurunnya kemampuan katalitik enzim tersebut, dan terjadi gangguan pada sistem biokimiawi berupa perubahan struktur morfologi insang. Selanjutnya Wedemeyer (1996) menyatakan, bahwa sebagian besar CO
tembaga bagi avertebrata air tawar dan laut biasanya < 0,5 mg/L, sedangkan terhadap ikan-ikan air tawar biasanya berkisar antara 0,02 – 1,0 mg/L. Hal ini diduku ng oleh hasil penelitian Sumoharjo (2007) yang menyatakan bahwa konsentrasi 0,7629 ppm dapat menyebabkan mortalitas hewan uji sebesar 50% (lethal median concentrate).
2 yang terlarut dalam plasma akan
disirkulasi kembali menuju insang dalam bentuk asam bikarbonat (HCO3-).
Ketika darah melewati insang, dengan cepat enzim karbonik anhidrase mendehidrasi HCO3- menjadi CO2, yang kemudian akan didifusikan keluar ke air.
Karbondioksida yang bersenyawa dengan air akan membentuk asam karbonat (H2CO3) sehingga menghasilkan kondisi asam di perairan melalui disosiasi ion
H+ dan HCO3-. Semakin tinggi konsentrasi CO2 di perairan, maka semakin
banyak kandungan H2CO3 yang terbentuk sehingga kondisi perairan menjadi
semakin asam. Boyd (1982) menyatakan bahwa perairan yang diperuntukkan bagi perikanan sebaiknya memiliki kadar CO2 bebas <5 mg/L, namun sebagian
organisme akuatik masih dapat bertahan hidup hingga kadar karbondioksida bebas mencapai 60 mg/L. Pada nilai pH < 10, keberadaan CO2, CO32-, dan HCO3- ,
3
sangat menentukan daya penyangga dari bahan air tertentu, yang dapat bergabung dengan kation-kation Cu2+, Mg2+, K+, dan Na+
Berdasarkan penelitian yang telah dilakukan oleh Carvalho dan Fernandes (2006) mengenai pengaruh suhu terhadap toksisitas tembaga pada pH rendah (4,5) dan pH tinggi (8,0) terhadap respon hematologi, diperoleh bahwa pada pH 4,5 dan pH 8,0 LC
.
50-96 jam pada suhu yang sama berbeda nyata, namun pada suhu air
20ºC dan 30ºC pada pH air yang sama tidak berbeda nyata. Pada penelitian ini agen tembaga yang digunakan adalah CuSO4.5H2O, untuk menurunkan pH
perairan digunakan H2SO4 dan menaikkan pH perairan digunakan NaOH.
1.2 Perumusan Masalah
Perubahan nilai pH sangat berpengaruh terhadap spesifikasi tembaga dalam air. Keberadaan tembaga yang berlebih dalam air akan mengganti kedudukan Zn dalam insang sehingga dapat mengganggu aktivitas insang dalam mengambil oksigen dan dapat merusak kemampuan sel imun dalam darah untuk berproliferasi (memperbanyak diri). Namun seberapa besar toksisitas logam berat Cu pada berbagai pH terhadap konsumsi oksigen, kadar hematokrit, kadar hemoglobin, jumlah sel darah merah (eritrosit), jumlah sel darah putih (leukosit), diferensiasi leukosit, kerusakan jaringan dan kelangsungan hidup ikan nila gift belum diketahui secara pasti.
1.3 Tujuan Penelitian
Tujuan penelitian ini adalah untuk menganalisis toksisitas logam berat Cu pada berbagai pH terhadap laju konsumsi oksigen, kadar hematokrit, kadar hemoglobin, jumlah sel darah merah (eritrosit), jumlah sel darah put ih (leuko sit), diferensiasi leukosit, kerusakan jaringan dan kelangsungan hidup ikan nila gift.
1.4 Manfaat Penelitian
Hasil penelitian bermanfaat sebagai informasi bagi pelaku budidaya perikanan dan masyarakat pada umumnya mengenai bahaya toksisitas Cu dalam perairan apabila terjadi perubahan pH perairan dan bahayanya bagi manusia apabila mengkonsumsi ikan yang mengandung Cu dalam tubuhnya, sehingga
4
diharapkan dapat meningkatkan teknik pengelolaan perairan budidaya secara berkelanjutan dan lestari.
1.5 Hipotesis
Keberadaan Cu dalam perairan pada nilai pH tertentu akan mempengaruhi aktifitas insang dalam menyerap oksigen dan memberikan respon negatif terhadap hematologi serta mempengaruhi kelangsungan hidup ikan nila gift.
II. TINJAUAN PUSTAKA
2.1 Kondisi Lingkungan Ikan Nila Gift
Ikan nila gift merupakan golongan ikan euryhalien, pada salinitas > 29 ppt ikan ini masih dapat bertumbuh dengan baik tetapi tidak dapat berkembang biak. Ikan ini tumbuh baik pada lingkungan perairan bersuhu antara 27 - 33ºC, dengan kadar oksigen terlarut > 2 mg/L, pH 6 – 8,3, alkalinitas 90 – 190 mg/L, kesadahan 62 – 79 mg/L CaCO3 (Anggarwati 1991).
2.2 Distribusi dan Akumulasi Pencemar Logam oleh Hewan Air
Logam berat yang mencemari perairan akan mencemari juga biota air yang hidup didalamnya. Logam yang esensial maupun yang tidak esensial yang masuk ke dalam tubuh makhluk hidup akan terserap dan terdistribusi ke dalam jaringan serta tertimbun dalam jaringan tertentu. Logam yang esensial diperlukan oleh tubuh dalam jumlah yang sedikit untuk proses enzimatik. Tubuh makhluk hidup biasanya memiliki kemampuan mentoleransi logam yang tidak diperlukan tubuh (racun) melalui proses ekskresi tubuh, namun kelebihannya akan berakibat toksik bagi makhluk hidup itu sendiri (Darmono 1995).
Distribusi dan akumulasi logam berbeda-beda untuk setiap organisme air, hal ini dipengaruhi oleh jenis dan konsentrasi logam dalam air, pH, dan fase pertumbuhan. Dengan adanya bahan beracun dalam perairan akan mengakibatkan terjadinya penurunan jumlah jenis dan populasi organisme yang peka, dan akan meningkatkan jumlah populasi organisme yang tahan terhadap tingkat pencemaran yang telah terjadi.
Suatu pencemar yang memiliki daya tahan yang tinggi terhadap penghancuran dan pembuangan dalam suatu makhluk hidup akan cenderung terakumulasi mencapai kepekatan yang relatif tinggi (Palar 1994). Selanjutnya Hutagalung (1991) menyatakan bahwa akumulasi terjadi karena logam berat dalam tubuh organisme cenderung membentuk senyawa kompleks dengan zat-zat organik yang terdapat dalam tubuh organisme, sehingga logam berat terfiksasi dan tidak diekskresikan oleh organisme yang bersangkutan.
6
2.3 Toksisitas Tembaga (Cu)
Logam dalam jaringan organisme akuatik menurut Simkiss dan Mason (1984) dibagi menjadi dua tipe utama, yaitu logam tipe klas A seperti Na, K, Ca, dan Mg yang pada dasarnya bersifat elektrostatik dan pada larutan garam berbentuk ion hidrofilik, dan logam tipe klas B seperti Cu, Zn, dan Ni yang merupakan komponen kovalen dan jarang berbentuk ion bebas. Logam klas B ini, bila masuk ke dalam sel hewan biasanya selalu proposional dengan tingkat konsentrasi logam dalam air sekitarnya, sehingga logam dapat terikat dengan adanya ligan dalam sel.
Tembaga dengan nama kimia Cupprum dilambangkan dengan Cu. Dalam tabel periodik unsur-unsur kimia tembaga menempati posisi dengan nomor atom (NA) 29 dan mempunyai bobot atom (BA) 63,546. Cu merupakan unsur tambahan yang terdapat di alam dan dapat ditemukan dalam bentuk persenyawaan atau dalam senyawa padat dalam bentuk mineral.
Tembaga merupakan suatu unsur yang sangat penting dan berguna untuk metabolisme. Batas konsentrasi dari unsur ini yang berpengaruh terhadap air berkisar antara 1 – 5 mg/L yang merupakan konsentrasi tertinggi. Dalam industri, tembaga banyak digunakan dalam industri cat, industri fungisida serta dapat digunakan sebagai katalis, baterai elektroda, sebagai pencegah pertumbuhan lumut. Bagi makhluk hidup, tembaga berperan khususnya dalam beberapa kegiatan seperti enzim pernapasan sebagai tirosinase dan silokron oksidasi.
Biota perairan sangat peka terhadap kelebihan Cu dalam perairan tempat hidupnya. Konsentrasi Cu terlarut yang mencapai 0,01 ppm dapat menyebabkan kematian bagi fitoplankton. Jenis-jenis yang termasuk keluarga krustase akan mengalami kematian dalam waktu 96 jam, bila konsentrasi Cu terlarut berada dalam kisaran 0,17-1,00 ppm. Dalam waktu yang sama, biota yang tergolong ke dalam keluarga moluska akan mengalami kematian bila Cu yang terlarut dalam badan perairan berada dalam kisaran 0,16-0,5 ppm. Konsentrasi Cu yang berada dalam kisaran 2,5–3,0 ppm dalam badan perairan dapat membunuh ikan-ikan (Palar 1994). Moore (1991) menyatakan bahwa toksisitas tembaga (EC50) bagi
7
tembaga bagi avertebrata air tawar dan laut biasanya < 0,5 mg/L, sedangkan terhadap ikan-ikan air tawar biasanya berkisar antara 0,02 – 1,0 mg/L.
Kehadiran Cu di suatu perairan dalam konsentrasi tertentu sangat penting bagi fungsi-fungsi fisiologis dari jaringan kehidupan dan proses-proses biokimia lainnya (Chapman 1992). Pada tumbuhan air, termasuk algae, tembaga berperan sebagai penyusun plastocyanin yang berfungsi dalam transpor elektron dalam proses fotosintesis. Selain itu juga tembaga ditemukan dalam protein plasma seperti seruloplasmin yang berperan dalam pembebasan Fe (besi) dari sel plasma. Apabila masuk dalam perairan yang alkalis, ion tembaga akan mengalami presipitasi dan mengendap sebagai tembaga hidroksida dan tembaga karbonat (Wedemeyer 1996).
Logam berat masuk ke dalam jaringan tubuh makhluk hidup melalui beberapa jalan, yaitu: saluran pernafasan, pencernaan dan penetrasi melalui kulit. Di dalam tubuh hewan logam diabsorpsi darah, berikatan dengan protein darah yang kemudian didistribusikan ke seluruh jaringan tubuh. Akumulasi logam yang tertinggi biasanya dalam detoksikasi (hati) dan ekskresi (ginjal). Akumulasi logam berat dalam tubuh organisme tergantung pada konsentrasi logam berat dalam air/lingkungan, suhu, keadaan spesies dan aktifitas fisiologis (Connel dan Miller 1995).
2.4 Kualitas Air 2.4.1 Karbondioksida
Sebagian besar permukaan air memiliki konsentrasi karbondioksida yang sangat sedikit (1-2 mg/L) yang berasal dari atmosfer, proses dekomposisi mikroba, atau dari proses respirasi yang dilakukan oleh mikroorganisme, algae, dan tanaman air lainnya. Level CO2 dapat meningkat ketika terjadi hujan asam
atau masuknya aliran air yang bercampur dengan mineral-mineral karbonat. Namun, sumber utama CO2 dalam kolam adalah berasal dari hasil metabolisme
ikan. Karbondioksida sangat mudah larut dalam suatu larutan. Pada umumnya, perairan alami mengandung karbondioksida sebesar 2 mg/liter. Pada konsentrasi yang tinggi (> 12 mg/liter), karbondioksida dapat beracun, karena keberadaannya dalam darah dapat menghambat pengikatan oksigen oleh hemoglobin (Boyd
8
1990). Selanjutnya dinyatakan bahwa, kebanyakan spesies budidaya dapat bertahan pada air yang memiliki konsentrasi CO2
Lingkungan perairan dengan konsentrasi CO
lebih dari 60 mg/L apabila masih terdapat DO dalam jumlah tinggi.
2 yang tinggi, dapat
menghalangi respirasi CO2 pada insang ikan sehingga dapat menyebabkan
kekurangan O2, hal ini disebabkan karena insang ikan sangat tergantung pada
perbedaan kadar konsentrasi CO2 di dalam darah dengan air untuk memindahkan
gas. Kadar CO2 yang tinggi dapat mengurangi jumlah CO2
Nilai pH menentukan batas toksisitas CO
yang dapat dipindahkan.
2 terlarut. Pada pH di bawah 5,
sebagian besar karbondioksida terlarut berada dalam bentuk CO2, pada nilai pH
antara 7-9 berbentuk sebagai HCO3-, dan pada pH diatas 11 sebagai ion CO32-.
2.4.2 Oksigen Terlarut (DO)
Konsentrasi DO yang terlalu rendah dapat menyebabkan gangguan kesehatan pada ikan, seperti hypoxia, anorexia, respiratori stres, pingsan, dan pada akhirnya dapat menyebabkan kematian. Beberapa spesies tilapia menunjukkan kemampuan bertahan hidup dengan baik pada konsentrasi DO 1 mg/L (Uchida dan King 1962; Denzer 1968, diacu dalam Stickney 1979).
Masuknya oksigen kedalam perairan melalui difusi pasif dari atmosfer, suatu proses yang terjadi akibat perbedaan tekanan parsial oksigen dalam air dan udara (Wedemeyer 1996). Selanjutnya Boyd (1982) menyatakan bahwa kelarutan oksigen dalam air dipengaruhi oleh suhu, salinitas, agitasi dan tekanan. Pengaruh tekanan udara terhadap oksigen terlarut yaitu mempercepat proses kelarutan dan pelepasan oksigen.
2.4.3 Suhu
Suhu berpengaruh secara langsung maupun tidak langsung terhadap aktifitas enzim, tingkat metabolisme dan kadar oksigen. Tingkat penyerapan racun dapat lebih tinggi dengan adanya kenaikan suhu. Kenaikan suhu di atas kisaran toleransi organisme dapat meningkatkan laju metabolisme, seperti pertumbuhan,
9
reproduksi dan aktifitas organisme. Pada spesies perairan tropis memiliki suhu optimal >25ºC (Stickney 1979).
2.4.4 Nilai pH
Nilai pH merupakan suatu ekspresi dari konsentrasi ion hidrogen (H+) dan menjelaskan logaritma negatif (-log [H+]) dari aktifitas ion hidrogen . Jika terjadi penurunan pH dari 6 ke 5 artinya terjadi peningkatan kepekatan ion H+
Nilai pH sangat penting sebagai parameter kualitas air karena mengontrol tipe dan laju kecepatan reaksi beberapa bahan di dalam air. Selain itu ikan dan makhluk-makhluk akuatik lainnya hidup pada selang pH tertentu, sehingga dengan diketahuinya nilai pH maka dapat diketahui apakah air tersebut sesuai atau tidak untuk menunjang kehidupan organisme akuatik.
sebanyak 10 kali lipat. Kisaran pH di bawah 4,0 menyebabkan ikan mengalami kematian, dan pada pH 2,0-5,0 tidak dapat memijah. Swingle 1961; Mount 1973, diacu dalam Boyd 1988 menyatakan, bahwa titik mati asam dan basa untuk ikan masing-masing antara pH 4 dan pH 9. Namun demikian, jika perairan lebih asam dari pH 6,5 atau lebih basa dari pH 9,5 untuk waktu yang lama, maka pertumbuhan dan reproduksi akan menurun.
Perubahan nilai pH mempengaruhi toksisitas suatu senyawa kimia dan juga tembaga (Cu). Nilai pH 7 merupakan nilai pH optimum yang baik bagi pertumbuhan dan reproduksi ikan, pada kondisi ini perairan berada dalam keadaan stabil.
2.4.5 Total Amonia Nitrogen (TAN)
Amonia yang terkandung di perairan berasal dari perombakan bahan organik dan pengeluaran hasil metabolisme ikan maupun biota akuatik lainnya melalui ginjal dan insang. Kadar total amonia (TAN) dalam bentuk NH3 maupun
NH4+ di dalam suatu perairan dipengaruhi juga oleh pH dari perairan tersebut.
Pada pH 7 atau kurang dari 7, nilai TAN di perairan lebih banyak dalam bentuk terionisasi yang bersifat kurang toksik. Sebaliknya pada pH lebih dari 7, TAN lebih banyak dalam bentuk yang tidak terionisasi (bebas) yang bersifat toksik. Selain pH, suhu juga mempengaruhi kadar amonia (NH3). Dengan meningkatnya
10
suhu maka akan meningkatkan kadar amonia dalam perairan. Amonia yang terlalu tinggi dapat mempengaruhi permeabilitas ikan terhadap air dan menurunkan konsentrasi ion dalam tubuhnya sehingga akan mempengaruhi tekanan osmotik tubuh, dengan demikian konsumsi oksigen pada jaringan insang meningkat sehingga mengurangi kemampuan darah dalam mengedarkan oksigen. Kadar amonia (NH3) yang dapat ditoleransi oleh ikan adalah 0,098 ppm (Boyd 1990).
2.4.6 Hidrogen Sulfida (H2
Hidrogen sulfida (H
S)
2S) merupakan gas hasil uraian bahan organik yang
diuraikan oleh bakteri dalam kondisi anaerob. Perubahan pH mendistribusikan asam sulfida menjadi bentuk-bentuk yang lain (H2S, HS-, dan S2-). Sulfida
dihasilkan oleh beberapa bakteri heterotrofik, misalnya Desulfovibrio yang memanfaatkan sulfat dan senyawa sulfur lainnya sebagai akseptor akhir elektron dalam proses metabolisme dan menghasilkan gas belerang. Hidrogen sulfida yang tidak terionisasi sangat berbahaya bagi organisme perairan (Boyd 1989). Sifat yang ditimbulkan H2S yaitu mudah larut, toksik dan menimbulkan bau telur
busuk. Konsentrasi maksimum H2S di perairan adalah sebesar 0,02 mg/L.
2.5 Histopatologi dan Gambaran Darah Ikan 2.5.1 Histopatologi ikan
Histopatologi adalah metode yang sensitif dan secara biologis bernilai untuk mengukur efek stres hewan terhadap lingkungan. Perubahan histopatologi sebagai indikator penting faktor stres dimana perubahannya dapat terjadi secara biokimia dan fisiologis. Perubahan ini biasa digunakan untuk meramal efek yang mungkin terjadi pada organisme seperti respon pertumbuhan, reproduksi, menghindarkan diri dari predator, dan stabilisasi populasi yang terjadi pada tingkat yang lebih tinggi (Mackim 1985; Meyer dan Hendricks 1985, diacu dalam Hinton dan Laurtn 1990).
Untuk melihat perubahan yang ditimbulkan akibat masuknya bahan pencemar pada tubuh ikan terutama pada organ pernafasan (insang), dan ginjal maka dilakukan pengamatan secara histopatologi. Histologi adalah cabang ilmu biologi yang mempelajari tentang jaringan. Patologi adalah kajian tentang
11
penyakit atau kajian tentang adaptasi yang tidak cukup terhadap perubahan-perubahan lingkungan eksternal dan internal.
Insang adalah organ yang berhubungan dengan pernapasan utama dari ikan. Epithelium insang dari ikan adalah lokasi pertukaran gas yang utama, keseimbangan asam basa, dan regulasi ion. Fungsi organ pernafasan ini adalah hal yang penting bagi kehidupan ikan, dan untuk seluruh keberadaan ikan. Oleh karena itu, jika ikan diekspos ke lingkungan yang tercemar, akan membahayakan fungsi utama dari organ pernafasan ikan tersebut. Toksisitas logam-logam berat yang melukai insang dan struktur jaringan luar lainnya, dapat menimbulkan kematian terhadap ikan yang disebabkan oleh proses anoxemia, yaitu terhambatnya fungsi pernapasan yakni sirkulasi dan eksresi dari insang. Unsur-unsur logam berat yang mempunyai pengaruh terhadap insang adalah timah, seng, besi, tembaga, kadmium dan merkuri (Widodo 1980).
Ginjal berfungsi untuk filtrasi dan mengekskresikan bahan yang tidak dibutuhkan oleh tubuh, termasuk polutan seperti logam berat yang toksik. Hal tersebut menyebabkan ginjal sering mengalami kerusakan oleh daya toksik logam. Ginjal berperan utama dalam ekskresi metabolisme, pencernaan dan tempat penyimpanan berbagai unsur, termasuk bahan racun. Histopatologi ginjal adalah suatu kunci indikator dari toksisitas bahan kimia.
2.5.2 Gambaran darah ikan
Sel darah tersusun atas sel darah merah (eritrosit) dan sel darah putih (leukosit), dan kedua tipe sel ini terbentuk pada jaringan hematopoetik ginjal. Volume darah pada ikan lebih sedikit dibandingkan dengan vertebrata lainnya, yaitu sekitar 3% dari berat tubuhnya. Darah mempunyai fungsi vital diantaranya adalah mengedarkan nutrien ke seluruh sel-sel tubuh, membawa oksigen ke seluruh jaringan tubuh serta membawa hormon dan enzim ke organ yang memerlukannya (Wedemeyer 1996). Darah mengalir dengan membawa oksigen dari insang ke jaringan, karbondioksida ke kulit dan insang, serta produk pencernaan dari hati ke jaringan dan ion seperti Na+ dan Cl- yang berperan dalam osmoregulasi. Sedangkan bahan-bahan asing atau yang tidak dibutuhkan oleh tubuh diangkut ke ginjal dan dikeluarkan melalui urin atau dipagositasi.
12
Parameter darah merupakan suatu indikator adanya perubahan kondisi kesehatan ikan, baik karena faktor infeksi (mikroorganisme) maupun karena faktor non infeksi oleh lingkungan, genetik, dan nutrisi. Menurut Amlacher (1970), darah mengalami perubahan-perubahan yang serius khususnya bila terkena infeksi oleh bakteri, dalam hal ini Bacterial Haemorragic Septicemia. Selain itu, kelebihan dan kekurangan makanan juga mempengaruhi komposisi darah (perubahan pada level total protein, hemoglobin, dan total eritrosit).
Eritrosit pada ikan merupakan sel yang terbanyak yang berfungsi sebagai transpor oksigen. Pada ikan air tawar berjumlah sekitar 1-2 juta sel/mm3 (Bowser 1993, diacu dalam Wedemeyer 1996). Sedangkan menurut Roberts (1978), pada ikan normal (yang tidak terkena penyakit atau gangguan-gangguan lainnya) jumlah sel darah merah berkisar 1,05-3,00 x 106 sel/mm3
Leukosit berjumlah lebih sedikit dibandingkan dengan eritrosit, pada ikan Chanel catfish total leukosit berjumlah 64,75 x 10
. Rendahnya jumlah eritrosit menandakan ikan mengalami anemia dan kerusakan organ ginjal. Sedangkan tingginya jumlah eritrosit menandakan ikan dalam keadaan stres dan terserang patogen (Wedemeyer dan Yasutake 1977; Nabib dan Pasaribu 1989). Faktor-faktor yang mempengaruhi jumlah sel darah merah adalah spesies, perbedaan induk (genetik), kondisi nutrisi, aktifitas fisik, dan umur (Dellman dan Brown 1989).
3
sel/mm3 (Wedemeyer 1996). Menurut Rastogi (1977), jumlah sel darah putih pada ikan air tawar berkisar antara 20.000-150.000 sel/mm3
Trombosit berfungsi utama dalam pembekuan darah apabila terjadi luka pada tubuh ikan serta mengaktifkan protrombin menjadi trombin dengan bantuan kalsium. Trombosit merupakan nukleat dan berukuran lebih kecil daripada limposit tetapi sering tidak ditemukan pada darah ikan yang tidak mengalami stres (Wedemeyer 1996). Monosit beredar melalui peredaran darah dan mampu
darah. Jumlah leukosit yang menyimpang dari keadaan normal mempunyai arti klinis penting untuk evaluasi proses penyakit (Dellman dan Brown 1989). Leukosit berdiferensiasi di ginjal menjadi beberapa tipe khusus seperti limposit, netrofil, dan trombosit. Jumlah limposit pada ikan salmon adalah 90-98%, netrofil 1-9%, dan trombosit 1-6% sedangkan monosit sekitar 0,1% dari total leukosit.
13
menembus dinding kapiler, masuk ke dalam jaringan penyambung dan berdiferensiasi menjadi sel-sel fagositik (Rastogi 1977). Netrofil berfungsi melawan penyakit bersama-sama dengan eosinofil yang disebabkan oleh organisme mikroseluler seperti bakteri dan virus. Sifat melawan penyakit ini disebut sifat fagositik yaitu memakan dan menghancurkan sel penyebab penyakit (Lagler et al. 1977).
Hematokrit merupakan perbandingan antara sel darah merah dan plasma darah, serta berpengaruh terhadap pengaturan sel darah merah (Hesser 1960). Peningkatan kadar hematokrit ini dipengaruhi oleh dua faktor yaitu perubahan parameter lingkungan terutama suhu perairan serta keadaan fisiologi ikan terkait dengan energi yang dibutuhkan (Jawad et al. 2004). Menurut Snieszko (1960) ikan rainbow trout yang normal, nilai hematokrit berkisar antara 23-33%. Apabila ikan terserang penyakit atau kehilangan nafsu makan karena sebab-sebab yang tidak jelas, maka nilai hematokrit menjadi lebih rendah (Snieszko 1960). Hal ini sesuai dengan Angka et al. (1985) yang menyatakan bahwa apabila ikan terkena penyakit atau nafsu makannya menurun, maka nilai hematokrit akan menjadi rendah. Menurut Angka et al. (1985) hematokrit ikan bervariasi tergantung pada faktor nutrisi dan umur ikan. Anak ikan dengan nutrisi baik mempunyai kadar hematokrit lebih tinggi daripada ikan dewasa atau anak ikan dengan nutrisi rendah. Nabib dan Pasaribu (1989) menyatakan bahwa nilai hematokrit di bawah 30% menunjukkan defisiensi eritrosit. Sedangkan Gallaugher et al. (1995) menyatakan bahwa nilai hematokrit yang lebih kecil dari 22% menunjukkan ikan mengalami anemia.
Hemoglobin adalah protein dalam eritrosit yang tersusun atas protein globin tidak berwarna dan pigmen heme yang dihasilkan dalam eritrosit. Kemampuan darah untuk mengangkut oksigen bergantung pada kadar Hb dalam darah (Lagler et al. 1977). Disebutkan juga oleh Siakpere et al. (2005) bahwa secara fisiologis, hemoglobin menentukan tingkat ketahanan tubuh ikan dikarenakan hubungannya yang sangat erat dengan daya ikat oksigen oleh darah. Wells et al. (2005) menyatakan bahwa 1 gram hemoglobin dapat mengikat kira-kira 1,34 mL oksigen. Hemoglobin dalam darah ikan teleostei berkisar antara 37-70% (Lagler et al. 1977). Berdasarkan penelitian yang dilakukan oleh Ogbulie dan
14
Okpokwasili (1999) diperoleh bahwa Clarias garipienus yang sehat memiliki nilai hemoglobin yang lebih tinggi dibandingkan dengan ikan yang sakit. Molekul hemoglobin adalah suatu protein dalam eritrosit yang terdiri dari protoporfirin, globin dan besi (Fe) bervalensi. Hemoglobin darah merupakan alat transportasi oksigen dan karbondioksida. Di dalam kapiler-kapiler insang, hemoglobin bergabung dengan oksigen membentuk oksihemoglobin. Menurut Angka et al. (1985) kadar hemoglobin dalam darah ikan mas dewasa normal adalah 8,61±0,43 - 10,86±0,48 g/100mL, sedangkan menurut Blaxhall (1972) bahwa kadar hemoglobin dibawah kisaran kadar hemoglobin ikan normal mengindikasikan ikan mengalami anemia. Meningkatnya kadar hemoglobin menunjukkan ikan berada dalam keadaan stres (Anderson dan Swicki 1993).
2.6 Toksisitas Cu Terhadap Konsumsi Oksigen dan Respon Hematologi
Laju konsumsi oksigen dalam tubuh biota air dipengaruhi oleh banyak faktor, yaitu faktor-faktor lingkungan (eksternal) dan faktor-faktor dalam biota itu sendiri (internal). Perbedaan kebutuhan oksigen dalam suatu lingkungan bagi ikan dari spesies tertentu disebabkan oleh adanya perbedaan struktur molekul sel darah ikan, yang mempengaruhi hubungan antara tekanan parsial oksigen dalam air dan derajat kejenuhan oksigen dalam sel darah.
Insang sebagai alat pernapasan ikan, juga digunakan sebagai alat pengatur tekanan antara air (lingkungan) dengan dalam tubuh ikan (osmoregulasi). Oleh sebab itu, insang merupakan organ yang penting pada ikan, yang juga sangat peka terhadap pengaruh toksisitas logam. Sel epitel insang merupakan tempat beberapa macam logam klas B terikat. Keberadaan logam berat yang berlebihan di perairan akan mempengaruhi sistem respirasi organisme akuatik.
III. METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini telah dilaksanakan selama bulan Oktober – Desember 2009. Untuk pemeliharaan dan analisis Cu pada air dan hati ikan uji dilakukan di Laboratorium Lingkungan Akuakultur, sedangkan untuk analisis darah dan histopatologi dilakukan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah akuarium, selang, pH-meter, termopH-meter, mikroskop, DO-pH-meter, blower, stoples, dan timbangan elektrik. Bahan-bahan yang diperlukan adalah ikan nila gift ukuran 10-12 gram, agen tembaga (CuSO4.5H2O), NaOH, CH3COOH, air ketapang, kapur pertanian
dan pakan ikan.
3.3 Prosedur Penelitian
Penelitian ini terdiri dari 2 bagian, yaitu bagian pertama berupa penelitian pendahuluan dengan 2 tahapan yaitu uji toksisitas Cu dan uji nilai pH; dan bagian kedua berupa penelitian inti yaitu uji pengaruh toksisitas Cu pada berbagai pH, analisis darah, pengukuran tingkat konsumsi oksigen dan uji histopatologi.
3.3.1 Penelitian Pendahuluan 3.3.1.1 Uji Toksisitas Cu
Uji toksisitas Cu bertujuan untuk menentukan konsentrasi CuSO4.5H2O
sebagai bahan uji yang akan digunakan untuk mencemari media pemeliharaan dengan Cu sebagai bahan aktif sebanyak 0,1 mg/L; 0,3 mg/L; 0,5 mg/L, 0,7 mg/L dan 0,9 mg/L. Nilai konsentrasi yang dipakai berdasarkan nilai LC50 Cu pada
ikan air tawar. Apabila pada uji ini tidak diperoleh hasil yang diharapkan pada batas ambang bawah dan batas ambang atas dari konsentrasi Cu yang digunakan, maka nilai konsentrasi Cu yang dipakai akan diturunkan atau ditingkatkan. Langkah yang dilakukan adalah membagi sebanyak 150 ekor hewan uji menjadi 5
16
perlakuan dengan 3 ulangan (masing-masing terdiri dari 10 ekor). Perlakuan diberi Cu dengan konsentrasi yang telah ditetapkan berdasarkan LC50 ikan-ikan
air tawar yang biasanya berkisar antara 0,02 – 1,0 mg/liter (Moore 1991). Konsentrasi Cu yang akan digunakan adalah 0,1 mg/L, 0,3 mg/L, 0,5 mg/L, 0,7 mg/L dan 0,9 mg/L, yang diuji selama 96 jam. Kemudian akan digunakan satu konsentrasi Cu yang telah memberikan pengaruh terhadap ikan uji. Indikator pengaruh yang digunakan adalah respon aktif ikan terhadap pakan yang diberikan, kelangsungan hidup dan tidak terjadi perubahan warna kulit ikan dari warna yang cerah menjadi lebih gelap (hitam).
3.3.1.2 Uji Nilai pH
Uji nilai pH bertujuan untuk mengetahui konsentrasi asam asetat yang digunakan untuk menurunkan pH menjadi 5 dan 6 serta konsentrasi NaOH untuk menaikkan pH menjadi 7 dan 8. Tahapan ini juga digunakan untuk mengetahui pengaruh perubahan pH terhadap ketahanan tubuh ikan uji. Tahap uji ini menggunakan ikan sebanyak 120 ekor dengan 4 perlakuan dan 3 ulangan, ikan ditempatkan sebanyak 10 ekor per akuarium yang masing-masing memiliki nilai pH 5±0,5; 6±0,5; 7±0,5; dan 8±0,5 selama 96 jam. Untuk mengatur nilai pH agar sesuai dengan yang diinginkan digunakan CH3COOH dan NaOH, namun terlebih
dahulu air yang akan digunakan dilakukan penstabilan kesadahannya sehingga lebih mudah dalam pengaturan nilai pH. Peningkatan alkalinitas air dilakukan dengan menggunakan rebusan air ketapang sebanyak 10 ml/L air, yang ditambahkan ke dalam media pemeliharaan. Untuk meningkatkan kesadahan dilakukan dengan merendam kapur dalam air yang akan digunakan sebagai media pemeliharaan. Air yang telah diberi perlakuan (air keran + air ketapang + asam asetat, dan air keran + air kapur + NaOH) didiamkan selama 2 hari sebelum dimasukkan ikan. Ikan yang akan diberi perlakuan terlebih dahulu diadaptasikan pada pH 6 selama 2 hari sebelum dimasukkan pada wadah perlakuan yang memiliki nilai pH 5, sedangkan perlakuan pH 8 terlebih dahulu diadaptasikan pada pH 7. Apabila selama waktu perlakuan berlangsung terjadi fluktuasi pH maka akan ditambahkan NaOH untuk meningkatkan pH dan CH3COOH untuk
17
pH digunakan CH3COOH 1% dan untuk meningkatkan nilai pH digunakan NaOH
1%. CH3COOH 1% sebanyak ±1ml dapat menurunkan nilai pH sebesar ±0,1,
sedangkan NaOH 1% sebanyak ±2 ml dapat meningkatkan pH sebesar ±0,1.
3.3.2 Penelitian Inti 3.3.2.1 Uji Pengaruh
Uji pengaruh dilakukan tanpa pergantian air. Penelitian ini bertujuan untuk mengetahui toksisitas tembaga pada berbagai pH terhadap tingkat konsumsi oksigen dan respon hematologi ikan nila gift. Pada penelitian ini digunakan empat nilai pH dengan konsentrasi tembaga dari hasil uji toksisitas yang menyebabkan letalitas terendah dan laju pertumbuhan harian tertinggi pada ikan nila gift. Pemberian tembaga pada perlakuan hanya dilakukan sekali yaitu pada awal penelitian. Pada awal dan akhir penelitian juga akan dilakukan analisis air media pemeliharaan dengan metode AAS untuk mengukur kandungan Cu yang terdapat pada air media pemeliharaan dan hati ikan uji. Pengukuran pH air dilakukan setiap hari, untuk menjaga agar nilai pH yang digunakan tetap sesuai dengan perlakuan. Variabel yang diukur meliputi : tingkat konsumsi oksigen, dan respon hematologi (jumlah sel darah merah, jumlah sel darah putih, kadar hemoglobin, dan kadar hematokrit serta diferensiasi leukosit), kerusakan jaringan, dan kelangsungan hidup. Pada uji pengaruh ini, digunakan ikan sebanyak 240 ekor dengan masing-masing perlakuan sebanyak 10 ekor dengan volume air 25 L pada 4 perlakuan, 4 kontrol dan 3 kali ulangan sehingga terbentuk 24 unit percobaan.
3.3.2.2 Tingkat Konsumsi Oksigen
Tingkat konsumsi oksigen diukur pada akhir penelitian dengan menghitung rasio oksigen terlarut pada awal dan akhir pengamatan. Botol respirasi diisi air sampai penuh, selanjutnya diaerasi dengan kuat (bubling) sehingga kandungan oksigennya bertambah. Setelah diaerasi air media dibiarkan selama setengah jam, kemudian dilakukan pengukuran oksigen terlarut sebagai DO awal. Ikan ditimbang kemudian dimasukkan kedalam botol respirasi dan ditutup selama 1 jam untuk dihitung DO akhir, maka akan didapatkan tingkat konsumsi oksigen dengan menggunakan rumus Liao dan Huang (1975).
18
TKO = {(DOawal – Doakhir)/W x t} x V
Keterangan :
TKO = tingkat konsumsi oksigen (mg O2
DOawal = oksigen terlarut pada awal pengamatan (mg/L) / gr tubuh /jam)
DOakhir = oksigen terlarut pada akhir pengamatan (mg/L) W = berat ikan uji (gr)
t = periode pengamatan (jam)
V = volume air dalam respirometer (L)
3.3.2.3 Prosedur Pengukuran Kualitas Air
Pengukuran kualitas air terdiri dari CO2, DO, NH3, H2S, pH dan suhu air.
Pengukuran pH dan suhu dilakukan setiap hari, dan pengaturan pH untuk mencapai nilai pH perlakuan dilakukan setiap 8 jam. Pengukuran CO2 dan DO
dilakukan pada awal penelitian (sebelum ikan dimasukkan), setelah ikan dimasukkan, dan pada akhir penelitian (saat diperoleh kematian 50% pada salah satu perlakuan). Konsentrasi H2S dan NH3 dalam media pemeliharaan diukur
pada akhir penelitian.
3.3.2.4 Tahap Analisis Darah
1) Penghitungan jumlah sel darah merah (SDM)
Prosedur pengamatan dan penghitungan jumlah SDM pada penelitian ini berdasarkan Blaxhall dan Daisley (1973). Darah diambil dari ikan dengan menggunakan injeksi yang berisi cairan antikoagulan untuk mencegah terjadinya penggumpalan darah. Darah yang tersedot dimasukkan kedalam ependorf, kemudian darah dihisap menggunakan pipet pencampur sampai dengan skala 0,5 dan ditambahkan larutan Hayems yang dihisap dengan pipet yang sama hingga mencapai skala 101. Setelah itu, pipet digoyang membentuk angka delapan selama 3-5 menit. Tetesan pertama dibuang dan tetesan berikutnya diteteskan kedalam hemositometer (haemocytometer) dan ditutup dengan kaca penutup. Penghitungan dilakukan pada 5 kotak kecil yaitu pada sudut kiri atas, sudut kanan atas, sudut kiri bawah, sudut kanan bawah dan pada bagian tengah. Jumlah sel darah merah yang terhitung dikonversikan dengan rumus :
19
Jumlah sel darah merah = ∑ sel darah merah terhitung x 104
sel/mm3.
2) Penghitungan jumlah sel darah putih (SDP)
Prosedur pengamatan dan penghitungan jumlah SDP dilakukan berdasarkan Blaxhall dan Daisley (1973). Metode pengambilan darahnya sama dengan metode pengambilan darah merah. Darah dihisap dengan pipet pencampur sampai dengan skala 11. Jumlah sel darah putih yang terhitung dikonversikan dengan rumus :
Jumlah sel darah putih = ∑ sel darah putih terhitung x 50 sel/mm3 3) Pengukuran kadar hematokrit
Prosedur pengamatan dan penghitungan kadar hematokrit dilakukan menurut Anderson dan Swicki (1993). Menggunakan Microhematocrit method, darah dimasukkan kedalam tabung mikrohematokrit sampai 4/5 bagian. Kemudian salah satu ujung tabung disumbat dengan crestaseal. Darah disentrifuge selama 5 menit. Setelah itu akan terbentuk lapisan-lapisan yang terdiri dari lapisan plasma yang jernih di bagian atas, kemudian lapisan putih abu-abu (buffy coat) yang merupakan trombosit dan leukosit dan lapisan eritrosit yang berwarna merah. Nilai hematokrit ditentukan dengan mengukur persentase volume eritrosit dari darah dengan menggunakan alat ukur panjang (mistar) dan dinyatakan dalam persentase (% Ht).
4) Kadar Hemoglobin (Hb)
Pengukuran kadar haemoglobin pada prinsipnya adalah mengkonversikan haemoglobin dalam darah ke dalam bentuk asam hematin oleh asam klorida. Mula-mula darah diisap menggunakan pipet sahli hingga skala 20 mm3. Kemudian dipindahkan ke dalam tabung Hb yang berisi HCl 0,1 N sampai skala 10 (garis kuning). Didiamkan selama 3–5 menit agar Hb bereaksi dengan HCl membentuk asam hematin, kemudian diaduk dan ditambahkan aquadestila (sedikit demi sedikit) hingga warnanya sama dengan standar. Pembacaan skala dilakukan dengan melihat tinggi permukaan larutan yang
20
dikocok dengan skala lajur g% yang menunjukkan banyaknya Hb dalam gram setiap 100 ml darah dan dinyatakan dalam persentase (% Hb).
5) Diferensiasi Leukosit
Satu tetes darah diteteskan di atas gelas objek yang bersih. Dengan menggunakan gelas objek yang lain darah disinggungkan sehingga antara kedua objek gelas tersebut membentuk sudut ± 30°. Setelah itu darah didorong ke arah depan dengan tidak mengubah sudut kedua objek gelas tersebut. Sediaan darah yang tipis setelah dikeringanginkan difiksasi selama ± 5 menit. Sediaan yang telah difiksasi kemudian diwarnai dengan zat warna Giemsa selama ± 30 menit. Sediaan diangkat dan kelebihan zat warna dibilas dengan air kran. Kemudian dikeringanginkan dan siap untuk diamati.
3.3.2.5 Uji Histopatologi
Pengamatan biota ikan yang terkena dampak limbah, dilakukan pengamatan dengan menggunakan metode mikroteknik, yaitu dengan cara membuat preparat histologis. Preparat histologis yang dibuat adalah insang, kulit dan ginjal ikan. Prosedur dalam pembuatan preparat histologis adalah: ikan dibedah dan diambil bagian insang, kulit dan ginjalnya, kemudian diawetkan dengan formalin 4 % selama 24 jam dan difiksasi dengan alkohol 70 % selama 24 jam. Setelah itu dimasukkan ke dalam alkohol 80%, 90%, 95 %, absolut i dan ii, larutan alkohol : xylol (1:1), xylol I dan II masing-masing selama 1 jam. Infiltrasi parafin dalam oven 60ºC, xylol:parafin (1:1), Parafin I dan II masing-masing selama 1 jam. Kemudian sampel ditanam dalam cetakan dan dibiarkan mengeras membentuk blok yang kemudian ditempel pada blok kayu (holder), lalu sampel dipotong dengan microtome dengan ketebalan 6-10 mikron. Potongan ditempel pada gelas objek yang sebelumnya telah diolesi dengan glycerin albumin. Sampel dikeringkan pada inkubator 40ºC selama 24 jam lalu diwarnai dengan HE.
Proses pewarnaan dengan menggunakan hemotoxylin dan eosin dengan langkah sebagai berikut : deparafinasi dengan xylol I dan II masing-masing 2 menit, lalu dimasukkan ke dalam alkohol absolut, 96 % dan 90 % masing-masing selama 2 menit. Kemudian dimasukkan ke dalam alkohol 80 % dan 70%
masing-21
masing selama 20 detik. Dicuci dengan air mengalir lebih kurang 2 menit dan dimasukkan ke dalam haemotoxylin selama 4 menit lalu dicuci lagi dengan air mengalir sampai jernih. Dimasukkan ke dalam eosin selama 1,5 menit dan dicuci kembali dengan air mengalir sampai jernih. Direndam dengan alkohol 70 %, 89%, 90%, absolute, xylol i dan ii masing-masing 2 menit. Setelah sampel siap, ditutup dengan cover glass yang sudah ditetesi dengan entelan neu dan dikeringkan dalam oven pada suhu 40ºC selama 24 jam, kemudian diamati di bawah mikroskop.
3.4 Rancangan Percobaan
Perlakuan yang diterapkan adalah perbedaan nilai pH terhadap toksisitas tembaga pada media percobaan untuk mengetahui tingkat konsumsi oksigen (TKO) dan respon hematologi ikan nila gift. Percobaan dirancang mengikuti Rancangan Acak Lengkap, dengan model percobaan sebagai berikut (Steel and Torrie 1982) :
Yij = μ + τi + έij
Yij = Ulangan ke-j dari perlakuan ke-i μ = Nilai tengah
τi = Pengaruh perlakuan ke-i έij = galat
Sebanyak 240 individu ikan nila gift berukuran 10-12 gram dibagi dalam 4 perlakuan, 4 kontrol, dan masing-masing terdiri dari 3 ulangan sehingga terbentuk 24 unit percobaan, yaitu :
K1
K
= kontrol 1 dengan kisaran nilai pH 5±0,5 tanpa Cu
2
K
= kontrol 2 dengan kisaran nilai pH 6±0,5 tanpa Cu
3
K
= kontrol 3 dengan kisaran nilai pH 7±0,5 tanpa Cu
4
P
= kontrol 4 dengan kisaran nilai pH 8±0,5 tanpa Cu
1
P
= perlakuan 1 dengan kisaran nilai pH 5±0,5 + Cu 0,3 mg/L
2
P
= perlakuan 2 dengan kisaran nilai pH 6±0,5 + Cu 0,3 mg/L
3
P
= perlakuan 3 dengan kisaran nilai pH 7±0,5 + Cu 0,3 mg/L
22
3.5 Analisis Data
Parameter utama dalam penelitian ini adalah konsumsi oksigen dan respon hematologi, sedangkan parameter pendukungnya adalah kelangsungan hidup, histopatologi jaringan dan kualitas air berupa pH, suhu, CO2, DO, H2
Untuk mengetahui pengaruh Cu pada berbagai pH terhadap konsumsi oksigen, kadar hematokrit, kadar hemoglobin, jumlah eritrosit, jumlah leukosit, dan diferensiasi leukosit pada ikan nila gift, maka data yang diperoleh dianalisis dengan menggunakan analisis ragam (anova). Apabila terdapat pengaruh yang nyata maka dilanjutkan dengan uji BNT (Steel dan Torrie 1982) dengan tingkat kepercayaan 95%. Uji beda dilakukan dengan menggunakan program Microsoft Exel 2007 dan SPSS 15.0. Parameter pendukung dianalisis dengan statistik deskriptif menggunakan tabel, grafik, dan gambar.
S dan TAN.
IV. HASIL DAN PEMBAHASAN
4.1 Uji Pendahuluan 4.1.1 Toksisitas Cu
Dari uji yang dilakukan pada lima konsentrasi Cu yang berbeda yaitu 0,1; 0,3; 0,5; 0,7; dan 0,9 mg/L, diperoleh bahwa pada konsentrasi Cu 0,3 mg/L menghasilkan tingkat kelulusan hidup tertinggi (Tabel 1) dengan pengaruh terkecil pada ikan yaitu nafsu makan ikan tetap baik, yang ditandai dengan jumlah pakan yang tersisa hanya sedikit dan respon yang baik ketika pakan diberikan, serta tingkat stres rendah yang dapat dilihat dari perubahan warna kulit ikan nila. Dalam kondisi stres ikan nila akan menunjukkan perubahan warna kulit dari warna yang cerah menjadi lebih gelap. Konsentrasi Cu 0,3 mg/L ini digunakan pada penelitian selanjutnya (uji pengaruh).
Tabel 1 Kelangsungan hidup (%) ikan nila pada uji toksisitas Cu dengan konsentrasi yang berbeda
Konsentrasi (mg/L)
Jumlah ikan (ekor)
Kelangsungan hidup (%/jam)
0 24 48 72 96 0,1 10 100 100 100 100 100 0,3 10 100 100 100 100 90 0,5 10 100 100 100 90 80 0,7 10 100 100 100 90 70 0,9 10 100 100 90 80 50 4.1.2 Nilai pH
Nilai pH cenderung kembali ke nilai pH air normal dalam jangka waktu ± 8 jam. Untuk menurunkan pH 0,1 dibutuhkan CH3COOH sebanyak 1 mL,
sedangkan untuk menaikkan pH 0,1 membutuhkan NaOH sebanyak 2 mL. Dari uji nilai pH yang dilakukan selama 96 jam, diperoleh tingkat kelangsungan hidup pada keempat nilai pH (5,6,7 dan 8) adalah 100%, hal ini berarti bahwa keempat nilai pH ini aman bagi hidup ikan, sehingga keempat nilai pH ini digunakan dalam penelitian lanjutan.
24
4.2 Pengaruh Toksisitas Cu pada Berbagai pH 4.2.1 Kualitas Air dan Kandungan Cu dalam Air
Data kualitas air yang diambil dalam penelitian ini adalah CO2, DO, H2S,
TAN, suhu, dan pH. Suhu air selama penelitian berlangsung berkisar antara 26ºC-27ºC, sedangkan pH diatur setiap 8 jam untuk mencapai nilai pH perlakuan. Tabel 2 menunjukkan data pengukuran kualitas air pada media pemeliharaan selama penelitian.
Tabel 2 Rata-rata nilai kualitas air pada media pemeliharaan selama penelitian.
Perlakuan CO2 (mg/L) DO (mg/L) H2S TAN NH3
awal tengah akhir awal tengah akhir (mg/L) (mg/L) (mg/L)
P P 1 P 2 P 3 3,99 4 4,59 1,86 1,59 4,66 4,19 3,99 3,59 11,14 8,99 7,39 6,79 6,44 5,53 5,68 5,83 6,06 5,32 5,58 5,72 2,15 2,35 2,67 3,34 0,009 0,006 0,001 0,001 1,705 2,316 3,213 3,711 - - 0,019 0,215 K K 1 K 2 K 3 3,19 4 2,99 1,59 0,59 5,39 4,09 3,79 3,19 8,39 7,06 5,99 5,06 5,58 6,00 5,87 5,88 5,21 5,57 5,58 5,37 2,23 3,17 4,07 4,10 0,007 0,004 0,001 0,001 1,609 1,801 2,707 3,121 - - 0,016 0,181 Konsentrasi CO2 Konsentrasi H
menunjukkan kecenderungan menurun dengan meningkatnya nilai pH. Selama pemeliharaan tidak dilakukan pergantian air, sehingga menyebabkan penurunan kualitas air yang diindikasikan adanya penurunan konsentrasi DO yang sangat drastis pada akhir penelitian.
2S menunjukkan kecenderungan menurun dengan
meningkatnya nilai pH, sedangkan konsentrasi NH3 meningkat dengan
meningkatnya nilai pH. Hal ini sesuai dengan pernyataan Boyd (1990) bahwa peningkatan nilai pH menyebabkan penurunan konsentrasi H2S dalam air dan
peningkatan NH3. Pada perlakuan P4 konsentrasi NH3
Untuk mengurangi kekeruhan air pada media pemeliharaan, dilakukan penyiponan setiap 3 hari. Air hasil penyiponan, dimasukkan kembali kedalam media pemeliharaan dengan cara disaring dengan menggunakan kapas zeolit yang bertujuan untuk meminimalisir terjadinya pengurangan kandungan Cu dalam media pemeliharaan.
berada diluar batas aman untuk budidaya ikan, seperti yang disarankan Boyd (1990), yaitu kurang dari atau sama dengan 0,098 mg/L.
25
Pemberian Cu dilakukan hanya 1 kali yaitu pada awal perlakuan sebelum ikan dimasukkan. Pengukuran kadar Cu dalam air dilakukan pada awal dan akhir penelitian dengan menggunakan metode AAS (Atomic Absorption Spectrophotometry), untuk mengetahui akumulasi logam berat Cu dalam air. Hasil pengukuran Cu dalam air pada awal dan akhir penelitian, dapat dilihat dalam Tabel 3.
Tabel 3 Rata-rata kandungan Cu dalam air media pemeliharaan
Perlakuan Cu dalam air (ppm)
awal akhir Cu terpakai P P 1 P 2 P 3 0,3 4 0,3 0,3 0,3 0,061 0,089 0,107 0,135 0,239 0,211 0,193 0,165 K K 1 K 2 K 3 Nihil 4 Nihil Nihil Nihil - - - - - - - -
Dari data diperoleh bahwa jumlah Cu yang terpakai meningkat dengan menurunnya nilai pH. Hal ini sesuai dengan Boyd (1982) yang menyatakan bahwa perubahan nilai pH dapat mempengaruhi toksisitas suatu senyawa kimia dan juga tembaga (Cu) dalam air. Pada saat nilai pH asam, terjadi peningkatan jumlah H2S
dalam air sehingga terjadi kecenderungan ion Cu2+ akan berikatan dengan ion S 2-membentuk senyawa CuS (tembaga sulfida). Senyawa CuS ini akan mengalami pelepasan kembali karena ion S yang dihasilkan dalam bentuk gas yang mudah menguap sehingga Cu akan kembali terakumulasi dalam perairan. Hal inilah yang menyebabkan toksisitas Cu meningkat pada nilai pH asam. Pada saat nilai pH normal ke arah basa, terjadi peningkatan jumlah NH3 dalam perairan yang
dihasilkan oleh proses metabolisme dan sisa pakan. Ketika NH3 masuk ke dalam
air, maka ion hidrogen dari senyawa H2O akan segera bereaksi membentuk
senyawa NH4 yang tidak bersifat toksik dan ion OH- (Wedemeyer 1996). Ion OH
-akan berikatan dengan ion Cu2+ akan membentuk senyawa CuOH+ yang mengendap di dasar perairan sehingga pada pH basa Cu tidak bersifat toksik.
26
4.2.2 Kandungan Cu dalam Hati Ikan
Pengukuran Cu dalam hati ikan dilakukan pada semua perlakuan dan kontrol diakhir pemaparan dengan menggunakan metode AAS (Atomic Absorption Spectrophotometry). Hasil pengukuran Cu dalam hati dapat dilihat dalam Tabel 4. Kontrol tidak dicemari dengan Cu, namun dari hasil analisis diperoleh adanya Cu pada hati ikan kontrol. Ini mengindikasikan bahwa sebelum diberikan perlakuan ikan telah tercemar oleh Cu, hal ini diperkuat dengan ditemukannya mineralisasi pada insang, dan ginjal ikan kontrol, hal ini sesuai dengan pernyataan Hinton dan Laurtn (1990) bahwa, kerusakan ginjal sebagai indikator terjadinya polusi lingkungan. Akumulasi Cu yang terjadi didalam hati ikan nila meningkat dengan menurunnya nilai pH.
Tabel 4 Kandungan Cu dalam hati ikan
Perlakuan Hasil AAS Akumulasi Cu Cu dalam hati (mg/L) dalam hati (mg/L) P1 P 0,189 0,110 2 P 0,110 0,028 3 P 0,097 0,020 4 K 0,081 0,014 1 K 0,079 - 2 K 0,082 - 3 K 0,077 - 4 0,067 - 4.2.3 Analisis Histopatologi Ikan Nila
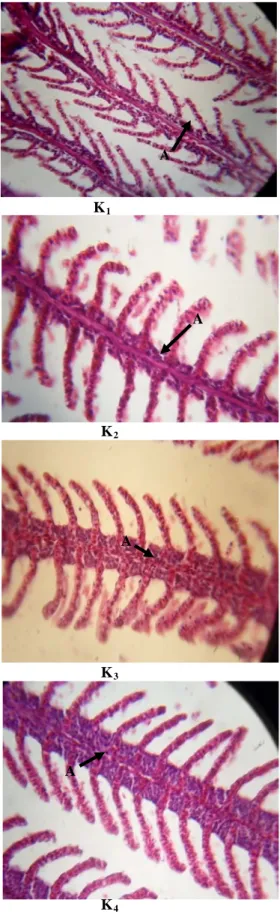
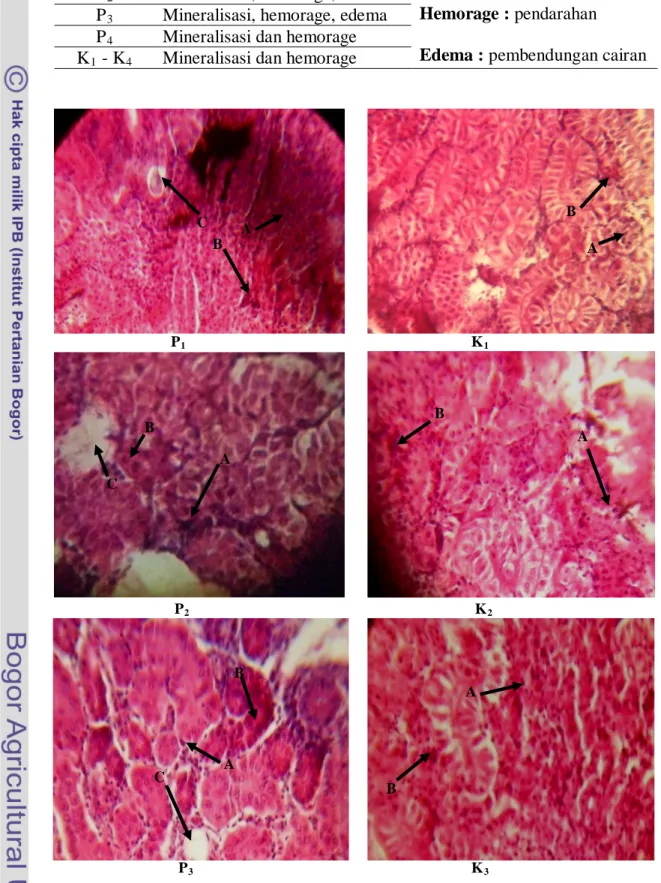
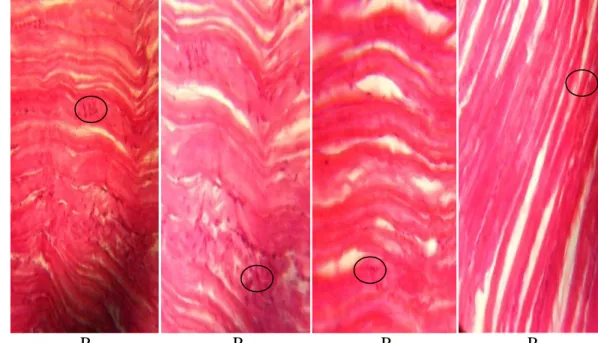
Pengukuran tingkat kerusakan jaringan pada organ insang, ginjal dan kulit dilakukan pada awal dan akhir penelitian. Hasil pengamatan mikroskop terhadap kerusakan insang pada setiap perlakuan ditampilkan pada Gambar 1 dan gambaran jaringan insang normal disajikan dalam Gambar 2. Kerusakan ginjal ditampilkan pada Gambar 3 dan gambaran ginjal normal disajikan dalam Gambar 4. Sedangkan kerusakan pada kulit ditampilkan pada Gambar 5 dan Gambar 6 merupakan gambaran kulit ikan normal.
Jaringan insang pada semua perlakuan mengalami kerusakan dengan tingkat kerusakan yang berbeda yaitu kerusakan terparah terjadi pada perlakuan P1,
27
perubahan histologi insang pada ikan nila diperlihatkan pada Tabel 5. Bintik hitam atau coklat (mineralisasi) yang terjadi pada insang dan ginjal mengindikasikan adanya Cu. Adanya Cu menyebabkan tergantinya posisi Zn yang terdapat di dalam enzim karbonik anhidrase sehingga akan menghambat kerja dari enzim tersebut untuk mendehidrasi HCO3- menjadi CO2. Tingkat kerusakan
insang yang terjadi pada perlakuan P1, P2, dan P3 disebabkan karena adanya
akumulasi logam berat Cu sedangkan pada perlakuan P4 disebabkan karena
adanya penurunan kualitas air berupa konsentrasi NH3 yang telah melampaui
ambang batas. Kerusakan ini disebabkan karena insang merupakan organ pertama tempat penyaringan air yang masuk ke dalam tubuh ikan, sehingga jika air di suatu perairan mengandung logam berat maka akan memberikan dampak pada jaringan organ insang tersebut. Terakumulasinya bahan pencemar (Cu) pada insang ikan, akan memberikan gangguan pada fungsi normal metaloenzim. Di dalam metaloenzim terdapat unsur mangan (Mg) sehingga jika metaloenzim disubsitusi oleh logam yang bukan semestinya, maka protein akan mengalami deformasi sehingga mengakibatkan terjadinya penurunan katalitik enzim tersebut.
Tabel 5 Perubahan histologi insang ikan nila
Perlakuan Insang Keterangan
P1 Mineralisasi, hiperplasia, edema, fusi dan hemorage
Mineralisasi : penumpukan mineral/
logam berat lainnya
Hiperplasia: pembesaran akibat
suatu penyakit/pertumbuhan yang berlebihan pada suatu bagian tubuh
Edema : pembendungan cairan Fusi : pertumbuhan sel yang tidak
terkontrol
Telangiektasis : pembendungan
cairan pada ujung lamela sekunder membentuk bola
Hemorage : pendarahan
P2 Mineralisasi, edema, fusi dan telangiektasis
P3 Mineralisasi, fusi, telangiektasis P4 Mineralisasi, hiperplasia,
edema dan hemorage
28
P1 K1 P2 K2 P3 K3 P4 K4
Gambar 1 Gambaran jaringan insang pada akhir penelitian
(A) Mineralisasi, (B) Hiperplasia, (C) Edema, (D) Fusi, (E) Telangiektasis, (F) Hemorage
D A E C A B D F A A C E D A A C F A B A