PEMBUATAN SENSOR KIMIA UNTUK ANALISIS Ni2+ DALAM PRODUK JAMU KEMASAN MENGGUNAKAN REAGEN
4-(2-PYRIDYLAZO)RESORSINOL (PAR) DENGAN TEKNIK SPOT TEST
SKRIPSI
MELLA VITRIA LESTARI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PEMBUATAN SENSOR KIMIA UNTUK ANALISIS Ni2+ DALAM PRODUK JAMU KEMASAN MENGGUNAKAN REAGEN
4-(2-PYRIDYLAZO)RESORSINOL (PAR) DENGAN TEKNIK SPOT TEST
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada Fakultas Sains dan
Teknologi Universitas Airlangga
Disetujui Oleh :
Pembimbing I,
Dr. rer. nat. Ganden Supriyanto, M.Sc. NIP. 19681228 199303 1 001
Pembimbing II,
LEMBAR PENGESAHAN SKRIPSI
Judul : Pembuatan Sensor Kimia Untuk Analisis Ni2+ Dalam Produk Jamu Kemasan Menggunakan Reagen 4-(2-pyridylazo)resorcinol (PAR) dengan Teknik Spot Test Penyusun : Mella Vitria Lestari
NIM : 080810528
Pembimbing I : Dr. rer.nat. Ganden Supriyanto, M.Sc Pembimbing II : Harsasi Setyawati S.Si., M.Si
Tanggal seminar : 18 Juli 2012
Disetujui Oleh : Pembimbing I,
Dr. rer. nat. Ganden Supriyanto, M.Sc. NIP. 19681228 199303 1 001
Pembimbing II,
Harsasi Setyawati S.Si., M.Si NIK. 139080769
Mengetahui, Ketua Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
KATA PENGANTAR
Puji syukur ke hadirat Allah S.W.T yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul “Pembuatan Sensor Kimia untuk Analisis Ni2+ dalam Produk Jamu Kemasan Menggunakan Reagen 4-(2-pyridylazo)resorcinol (PAR) dengan Teknik Spot Test”.
Skripsi ini dibuat untuk memenuhi persyaratan akademis pendidikan sarjana sains dalam bidang kimia Fakultas Sains dan Teknologi Universitas Airlangga.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. rer. nat. Ganden Supriyanto, M.Sc selaku dosen pembimbing I atas bimbingan dan nasehatnya selama penyusunan dan penyelesaian skripsi ini, 2. Ibu Harsasi Setyawati S.Si., M.Si selaku dosen pembimbing II atas bantuan
dan kesabaran dalam memberikan bimbingan kepada penulis,
3. Bapak Drs Yusuf Syah, M.S selalu penguji I yang telah membimbing dan memberi saran demi sempurnanya naskah skripsi ini,
4. Ibu Tjitjik Sri Tjahjandarie, Ph.D selaku penguji II yang telah membimbing dan memberi nasehat serta saran demi sempurnanya naskah skripsi ini,
6. Bapak dan ibu dosen Departemen Kimia Universitas Airlangga atas ilmu dan nasehat yang telah diberikan,
7. Bapak dan Ibu saya tercinta atas segala kasih sayang, dukungan, dan doanya, 8. Teman-teman kimia angkatan 2008 atas kebersamaannya selama mengemban
ilmu di Universitas Airlangga dan Dyah Respati, Novi, Putri, Evril, Adel serta Julie atas bantuan dan dukungan yang kalian berikan,
9. Teman-teman kost Dwi, Sabrina, Nadia, Yuar, Lilis dan mbk indah yang telah memberi dukungan dan bantuan selama pengerjaan skripsi ini,
10. Kakak angkatan 2007 mbak Dhica dan mbk Syarifa atas bantuan yang diberikan
11. Karyawan dan karyawati FSAINTEK UNAIR dan petugas laboratorium yang telah banyak memebantu,
12. Semua pihak yang telah banyak membantu yang tidak bisa disebutkan satu persatu.
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan skripsi ini, oleh karena itu kritik dan saran yang besifat membangun untuk kesempurnaan penulisan skripsi ini sangat diperlukan. Semoga skripsi ini dapat bermanfaat bagi semua pihak.
Surabaya, Juli 2012 Penulis,
Lestari, M.V, 2012, Pembuatan Sensor Kimia Untuk Analisis Ni2+ Dalam Produk Jamu Kemasan Menggunakan Reagen 4-(2-piridilazo)resorsinol (PAR) dengan Teknik Spot Test. Skripsi ini di bawah bimbingan Dr.rer.nat. Ganden Supriyanto, M.Sc., dan Harsasi setyawati, S.Si, M.Si., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Pada penelitian ini telah dilakukan pembuatan sensor kimia dengan teknik spot test menggunakan reagen 4-(2-piridilazo)resorsinol (PAR) untuk analisis Ni2+. Penelitian ini bertujuan mengetahui kemampuan reagen PAR yang digunakan sebagai sensor kimia ion Ni2+. Sensor dioptimasi dengan variasi pH dan konsentrasi reagen PAR. Sensor memiliki hasil optimum pada pH 8 dengan konsentrasi PAR 0,02%. Panjang gelombang maksimum sensor kimia 495 nm. Dilakukan uji selektifitas sensor dengan penambahan ion Fe3+, Pb2+, Cr3+, Zn2+ dan Cu2+ dengan perbandingan konsentrasi 1:1, 1:10, 1:20, dan 1:100. Hasil penelitian menunjukkan ion Fe3+, Pb2+, Cr3+, Zn2+ dan Cu2+memberikan interferensi terhadap sensor. Sensor memiliki nilai linieritas sebesar 0,997 pada rentang konsentrasi Ni2+ antara 0,0-2,0 ppm. Limit deteksi sensor sebesar 0,2 ppm dengan akurasi rata-rata 98,92% dan koefisien variasi (presisi) rata-rata 0,2652% dengan sensitivitas sebesar 1,216 L/mg.
Lestari, M.V, 2012, Production Of Chemical Sensor For Ni2+ In Packaging Herbal Using Reagent 4-(2-pyridylazo)resorcinol By Spot Test Technique. This script is supervised by Dr.rer.nat. Ganden Supriyanto, M.Sc., and Harsasi Setyawati, S.Si, M.Si., Department of Chemistry, Faculty of Science and Technology, Airlangga University, Surabaya.
ABSTRACT
DAFTAR ISI
HALAMAN JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
3.5.2.1 Pembuatan larutan natrium dihidrogen fosfat 1M ... 16
3.5.2.2 Pembuatan larutan natrium hidroksida 1M ... 16
3.5.2.3 Pembuatan larutan bufer fosfat ... 16
3.5.2.4 Pembuatan larutan asam asetat 1M ... 17
3.5.2.5 Pembuatan larutan natrium asetat trihidrat 1M ... 17
3.5.2.6 Pembuatan larutan buffer asetat ... 17
3.5.3 Pembuatan larutan Induk Ni2+ 1000 ppm, larutan standar Ni2+
100 ppm dan 1 ppm ... ...18
3.5.4 Pembuatan larutan Induk Fe3+ 1000 ppm, larutan standar Fe3+ 100 ppm dan 1 ppm ... 19
3.5.5 Pembuatan larutan Induk Cr3+ 1000 ppm, larutan standar Cr3+ 100 ppm dan 1 ppm... ... 19
3.5.6 Pembuatan larutan Induk Pb2+ 1000 ppm, larutan standar Pb2+ 100 ppm dan 1 ppm ... 20
3.5.7 Pembuatan larutan Induk Zn2+ 1000 ppm, larutan standar Zn2+ 100 ppm dan 1 ppm ... 20
3.5.8 Pembuatan larutan Induk Cu2+ 1000 ppm, larutan standar Cu2+ 100 ppm dan 1 ppm ... 21
3.6 Optimasi Parameter Analitik ... 21
3.6.1 Penentuan panjang gelombang maksimum reagen PAR ... 21
3.6.2 Penentuan panjang gelombang maksimum dan penentuan pH optimum dalam pembentukan senyawa kompleks Ni(II)-PAR 22 3.6.3 Penentuan konsentrasi optimum senyawa PAR ... 23
3.7 Pembuatan deret intensitas warna PAR terhadap konsentrasi Ni2+. 23 3.8 Uji Selektifitas Senyawa PAR ... 23
3.9 KonfirmasiAnalisis Ni2+ dengan Metode Spektrofotometri dan Penentuan Parameter Validasi ... 25
3.9.1 Pembuatan kurva standar ... 25
BAB IV HASIL DAN PEMBAHASAN 4.1 Optimasi Parameter Analitik ... 31
4.1.1 Penentuan panjang gelombang maksimum reagen PAR ... 31
4.1.2 Penentuan panjang gelombang maksimum dan penentuan pH optimum dalam pembentukan senyawa kompleks Ni(II)-PAR 32 4.1.3 Penentuan konsentrasi optimum reagen PAR ... 35
4.2 Pembuatan Deret Intensitas Warna ... 38
4.3 Uji Selektivitas Senyawa PAR ... 39
4.4 Konfirmasi Analisis Ni2+ dengan Metode Spektrofotometri dan Penentuan Parameter Validasi ... 44
4.4.1 Pembuatan kurva standar ... 44
4.4.3 Penentuan sensitivitas ... 45
4.4.4 Penetuan limit deteksi ... 45
4.4.5 Penentuan akurasi ... 46
4.4.6 Penetuan koefisien variasi (presisi) ... 47
4.5 Perlakuan Sampel ... 47
4.5.1 Sampel jamu serbuk ... 47
4.5.2 Sampel jamu cair ... 50
4.6 Analisis Komprehensif Antar Variabel ... 53
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan... 55
5.2 Saran ... 55
DAFTAR TABEL
Nomor 3.1 3.2 3.3 4.1 4.2 4.3
Judul Tabel
Pembuatan larutan buffet fosfat... Pembuatan larutan buffer asetat... Pembuatan larutan buffer bikarbonat... Hasil absorbansi rata-rata Ni(II)-PAR... Penentuan akurasi %recovery... Penentuan koefisien variasi...
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
DAFTAR LAMPIRAN
Nomor Judul
1 Penentuan Panjang Gelombang Maksimum dan pH Optimum dalam Pembentukan Senyawa Kompleks Ni(II)-PAR
2 Penentuan Konsentrasi Optimum Reagen PAR 3 Penentuan Selektivitas Sensor Kimia
4 Konfirmasi dengan Metode Spektrofotometri 5 Penentuan Limit deteksi
6 Penentuan Akurasi
BAB I PENDAHULUAN 1.1Latar Belakang
Jamu merupakan ramuan tradisional yang telah dikenal luas dan dimanfaatkan oleh masyarakat untuk mengobati penyakit ringan, mencegah datangnya penyakit, menjaga ketahanan dan kesehatan tubuh, serta untuk tujuan kecantikan. Pada anak-anak, jamu yang diberikan umumnya untuk pengobatan, sedangkan bagi orang dewasa jamu digunakan untuk pencegahan penyakit atau menjaga stamina. Masyarakat Indonesia lebih memilih mengkonsumsi jamu karena telah dipercaya secara turun-temurun dari nenek moyang, harganya murah, mudah didapatkan dan dapat dibuat sendiri. Selain itu masyarakat yang menganut paham kembali ke alam (back to nature) justru berusaha mengurangi atau menghindari efek samping yang dapat timbul karena bahan-bahan kimia yang biasanya terdapat pada obat-obatan modern (Limananti dan Triratnawati, 2003).
Seiring dengan perkembangan jaman, pengolahan produk jamu juga mengalami perkembangan, sebagai contoh peralatan merebus jamu dahulu menggunakan kuali yang terbuat dari tanah liat sekarang menggunakan panci stainless steel, peralatan menumbuk jamu dahulu menggunakan alu yang terbuat dari kayu ataupun batu sekarang sudah menggunakan mesin penggilingan dari stainless steel. Logam-logam penyusun stainless steel merupakan logam tahan
karat perpaduan dari nikel, krom dan besi.
terkandung dalam peralatan tersebut. Pelepasan dan korosi nikel dari peralatan stainless steel merupakan penyumbang terbesar masuknya nikel ke dalam produk
jamu kemasan. Ketika jamu kemasan tersebut dikonsumsi manusia hampir secara rutin, nikel masuk ke dalam tubuh mencapai 1 mg/hari (Cempel and Nikel, 2006). Selain dari peralatan stainless steel, kontaminasi oleh logam berat seperti nikel (Ni), seng (Zn), plumbum (Pb), dan kuprum (Cu) juga menjadi perhatian serius karena dapat menjadi potensi polusi pada permukaan tanah maupun air tanah yang dapat diserap oleh tumbuhan termasuk tanaman obat (Chaney et al., 1998a; Knox et al., 2000). Hal tersebut mengakibatkan tanaman obat yang digunakan untuk membuat jamu kemasan bisa terkontaminasi jika ditanam pada tanah dan air yang tercemar logam nikel (Ni), seng (Zn), plumbum (Pb) dan kuprum (Cu) secara alami (Zareba et al., 2004).
Melihat bahaya nikel (Ni) di atas yang memiliki pengaruh langsung pada kesehatan, maka perlu adanya pengendalian kadar nikel (Ni) pada produk jamu kemasan. Menurut Keputusan Menteri Kesehatan Republik Indonesia nomor 907/MENKES/SK/VII/2002 tanggal 29 Juli 2002 kadar maksimum nikel (Ni) yang diperbolehkan dalam produk air minum yaitu 0,02 ppm. Selama ini, metode yang biasa digunakan untuk menganalisis kadar nikel (Ni) adalah metode spektroskopi serapan atom (SSA), ICP-OES dan metode gravimetri. Namun, metode ini mempunyai kelemahan yaitu membutuhkan biaya analisis yang tinggi, hanya dapat dikerjakan oleh orang terlatih di laboratorium dan tidak praktis (Sari, 2008; Silva et al., 2009).
(Silva et al., 2009; Marczenko and Balcerzak, 2000). Dengan menggunakan reagen PAR, sampel yang mengandung Ni2+ dapat ditentukan kadarnya secara kualitatif dan semikuantitatif dengan hanya meneteskan reagen ke dalam sampel sehingga kadar nikel dapat diketahui dengan cara membandingkan intensitas perubahan deret warna yang dibuat dari reaksi antara larutan standar Ni2+ dengan berbagai konsentrasi dengan reagen PAR.
1.2Rumusan Masalah
Berdasarkan latar belakang masalah tersebut di atas, maka dapat dirumuskan masalah sebagai berikut;
1. apakah reagen 4-(2-pyridylazo)resorcinol (PAR) dapat digunakan sebagai sensor kimia dengan teknik spot test dalam analisa kadar Ni2+ dalam produk jamu kemasan?
2. berapakah konsentrasi optimum reagen 4-(2-pyridylazo)resorcinol (PAR) dan pH optimum pada analisa kadar Ni2+ dalam produk jamu kemasan? 3. bagaimanakah validitas sensor kimia meliputi liniearitas, selektivitas,
sensitivitas, limit deteksi, akurasi dan presisi pada analisa kadar Ni2+ dalam produk jamu kemasan menggunakan 4-(2-pyridylazo)resorcinol (PAR)?
1.3Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut;
2. menentukan konsentrasi reagen 4-(2-pyridylazo)resorcinol (PAR) dan pH optimum pada analisa kadar Ni2+ dalam produk jamu kemasan
3. menentukan validitas sensor kimia meliputi: liniearitas, selektivitas, sensitivitas, limit deteksi, akurasi dan presisi pada analisa kadar Ni2+ dalam produk jamu kemasan menggunakan 4-(2-pyridylazo)resorcinol (PAR)
1.4Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2. 1. Nikel
Nikel (Ni) adalah logam dengan nomor atom 28 dan berwarna putih keperakan yang keras, bersifat liat, dapat ditempa dan sangat kukuh. Logam ini melebur pada suhu 1445°C dan bersifat sedikit magnetis (Vogel, 1994). Nikel (Ni) banyak digunakan untuk industri metalurgi, industri kimia dan pelapisan logam pada peralatan rumah tangga maupun industri (Satmoko, 2006).
2. 2. 4-(2-pyridylazo)resorcinol (PAR)
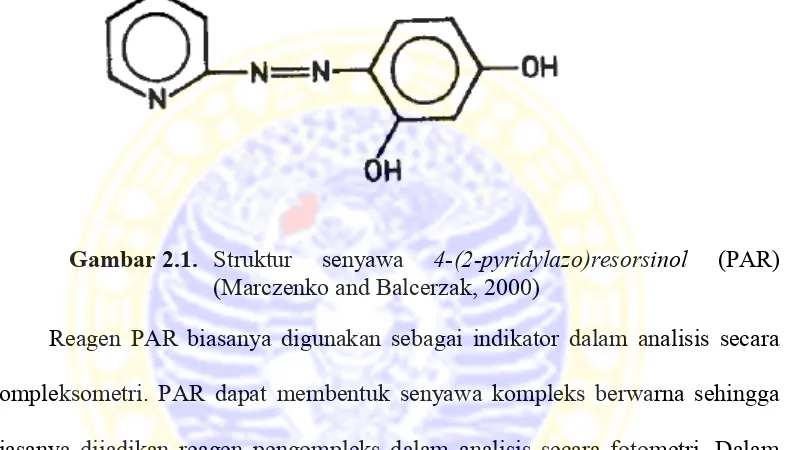
PAR atau 4-(2-pyridylazo)resorsinol merupakan reagen organik dengan rumus molukul C11H9N3O2 yang mempunyai berat molekul 215,21 g/mol. PAR berbentuk butiran-butiran halus berwarna kuning kecokelatan yang larut dalam air (Fries dan Getrost, 1977; Marczenko and Balcerzak, 2000).
Gambar 2.1. Struktur senyawa 4-(2-pyridylazo)resorsinol (PAR) (Marczenko and Balcerzak, 2000)
U(VI), Zn(II), Fe(II), Fe(III), Sn(II), dan V(V) dalam analisis Ni2+, dapat dihindari dengan optimasi pH dan uji selektivitas terlebih dahulu. Interferensi dari ion pengganggu ini dapat dicegah dengan penambahan suatu reagen tertentu yang disebut zat penopeng (masking agent), yang akan membentuk kompleks stabil dengan ion-ion pengganggu tersebut (Vogel, 1994).
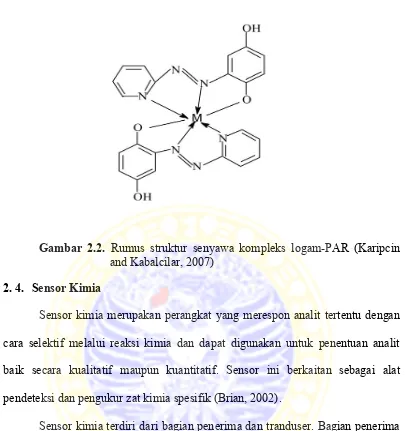
2. 3. Senyawa Kompleks
Gambar 2.2. Rumus struktur senyawa kompleks logam-PAR (Karipcin and Kabalcilar, 2007)
2. 4. Sensor Kimia
Sensor kimia merupakan perangkat yang merespon analit tertentu dengan cara selektif melalui reaksi kimia dan dapat digunakan untuk penentuan analit baik secara kualitatif maupun kuantitatif. Sensor ini berkaitan sebagai alat pendeteksi dan pengukur zat kimia spesifik (Brian, 2002).
Sensor kimia terdiri dari bagian penerima dan tranduser. Bagian penerima berfungsi sebagai penyeleksi dan pengubah sifat kimia yang dideteksinya menjadi energi yang bisa diukur oleh bagian tranducer. Sedangkan bagian transducer berfungsi mengubah energi yang membawa sifat-sifat kimia tersebut menjadi sinyal elektrik (Gunawan, 2010). Sensor dalam industri kimia digunakan untuk proses dan kontrol kualitas selama produksi. Sensor kimia juga dapat digunakan untuk monitoring lingkungan.
dideteksinya. Kemampuan mendeteksi zat tersebut meliputi beberapa hal sebagai berikut;
1. sensitivitas, yaitu ukuran seberapa sensitif sensor mengenali zat yang dideteksinya. Sensor yang baik akan mampu mendeteksi zat meskipun jumlah zat tersebut sangat sedikit,
2. selektivitas, yaitu sejauh mana sensor memiliki kemampuan menyeleksi gas atau cairan yang ingin dideteksinya,
3. waktu respon, yaitu waktu yang dibutuhkan sensor untuk mengenali zat yang dideteksinya. Semakin cepat waktu respon maka semakin baik sensor tersebut, 4. stabilitas dan daya tahan, yaitu sejauh mana sensor dapat secara konsisten
memberikan besar sensitifitas yang sama untuk suatu zat, serta seberapa lama sensor tersebut dapat terus digunakan.
Selain ke empat sifat di atas, terdapat dua sifat lain yang juga tidak kalah pentingnya terutama bagi sensor komersial yaitu konsumsi energi yang dibutuhkan untuk menjalankan sensor tersebut. Sifat lain yang tidak kalah penting juga adalah berapa harga yang dibutuhkan untuk memproduksi sensor tersebut. Tentunya tingkat konsumsi energi yang rendah serta harga yang murah menjadi harapan bagi industri sensor disamping sifat-sifat sensor yang baik (Hooker, 2002).
2.5 Spektrofotometri UV-Vis
spektrofotometer (Thomas and Burgess, 2007). Daerah pengukuran spektrofotometri UV-Vis adalah pada panjang gelombang 180-380 nm untuk daerah ultra violet (UV) dan 380-780 nm untuk visibel (tampak).
Gambar 2.3. Spektrum elektromagnetik (Thomas and Burgess, 2007) Spektofotometri UV–Vis melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV–Vis lebih banyak dipakai untuk analisis kuantitatif dibandingkan kualitatif. Analisis kuantitatif dengan metode spektrofotometri UV–Vis dapat digolongkan tiga macam pelaksanaan pekerjaan yaitu analisis kuantitatif zat tunggal, campuran dua macam zat, dan campuran tiga macam zat atau lebih. Sedangkan analisis secara kualitatif dipakai untuk data sekunder atau data pendukung dengan melakukan pemeriksaan kemurnian spektrum UV–Vis dan penentuan panjang gelombang maksimum
(λmaks). Hampir semua molekul organik dan anorganik dapat dianalisis (Mulja,
1995; Thomas and Burgess, 2007).
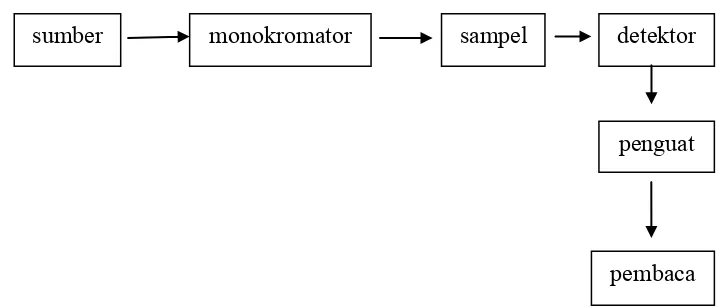
Gambar 2.4. Diagram blok komponen spektrofotometer (Underwood dan Day, 1998)
Spektrum yang dihasilkan dari energi yang diserap oleh molekul di daerah UV-Vis berupa pita (bukan garis), hal ini disebabkan oleh struktur elektron pada gugus kromofor yang kompleks sehingga menghasilkan transisi elektronik yang lebih dari satu macam. Panjang gelombang yang menghasilkan transisi elektronik yang memberikan absorbansi maksimum disebut panjang gelombang maksimum (λ maks). Sebagian zat mempunyai struktur elektron tertentu, sehingga dapat memberikan panjang gelombang maksimum yang tertentu pula. Prinsip dasar analisis kuantitatif metode spektrofotometri UV-Vis yaitu menggunakan persamaan Lambert-Beer, yang menyatakan bahwa besarnya sinar yang diserap sebanding dengan konsentrasi analit (Mulja, 1995; Underwood dan Day, 1998). 2. 5. Jamu
Jamu merupakan ramuan tradisional yang telah dikenal luas dan dimanfaatkan oleh masyarakat dengan tujuan mengobati penyakit ringan, mencegah datangnya penyakit, menjaga ketahanan dan kesehatan tubuh, serta untuk tujuan kecantikan (Limananti dan Triratnawati, 2003). Jamu merupakan unsur penting budaya jawa yang menyebar sampai ke pulau Bali pada zaman
sumber monokromator sampel detektor
penguat
Majapahit. Sebagian besar jamu dibuat menurut resep tradisional yang diturunkan dari beberapa generasi. Bentuk jamu dapat berupa campuran bahan-bahan yang dikeringkan, terus digiling halus lalu diolah menjadi serbuk, pil, minuman, dan balsam atau obat gosok (Liong, 2009).
Jamu menjadi lebih populer saat ini seiring dengan munculnya paham back to nature (kembali ke alam). Penggunaan jamu untuk mengobati penyakit semakin berkembang dan mengalami kemajuan pesat. Hal ini karena ada penyakit-penyakit tertentu yang tidak dapat sembuh secara medis, tetapi dapat disembuhkan dengan jamu atau ramuan tradisional. Kecenderungan masyarakat memilih jamu atau ramuan tradisional didasarkan pada alasan-alasan sebagai berikut :
1. harganya relatif lebih murah dibanding obat-obat modern sehingga terjangkau oleh masyarakat luas,
2. bahan-bahannya mudah diperoleh di lingkungan sekitar tempat tinggal, 3. proses pembuatan dan peralatan yang digunakan lebih sederhana,
BAB III
METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Februari 2012 sampai dengan Juni 2012 di Laboratorium Penelitian Kimia Analitik Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya.
3.2 Bahan Penelitian
Bahan kimia yang digunakan dalam penelitian ini berderajat pro-analisis. Bahan penelitian tersebut yaitu NiSO4.7H2O, 4-(2-pyridylazo)resorcinol (PAR), HNO3 pekat, akuadem, NaH2PO4, NaOH, CH3COOH, CH3COONa.3H2O, NaHCO3, Pb(NO3)2, Cr(NO3)3.9H2O, FeCl3.6H2O, ZnSO4.7H2O, CuSO4.5H2O dan sampel jamu kemasan.
3.3 Alat Penelitian
3.4 Diagram Alir Penelitian
Persiapan bahan dan alat penelitian
Pembuatan larutan induk, kerja, dan standar Ni2+, Fe3+, Cr3+, Pb2+, Zn2+, Penentuan pH optimum pembentukan
kompleks Ni(II)-PAR Sensor kimia dalam bentuk Test
Kit (Teknik spot test)
Pembuatan larutan induk, kerja, dan standar Ni2+, Fe3+, Cr3+, Pb2+, Zn2+, Penentuan pH optimum pembentukan
kompleks Ni(II)-PAR Sensor kimia dalam bentuk Test
3.5 Pembuatan Larutan
3.5.1 Pembuatan larutan induk PAR 1% dan larutan PAR 0,04%; 0,03%; 0,02%; 0,01%; dan 0,005%
Larutan induk 4-(2-pyridylazo)resorcinol (PAR) 1% dibuat dengan melarutkan 1 gram padatan PAR dengan akuadem pada labu ukur 100 mL.
Larutan 4-(2-pyridylazo)resorcinol (PAR) 0,04%; 0,03%; 0,02%; 0,01%; dan 0,005% dibuat dengan mengambil 4,0; 3,0; 2,0; 1,0; dan 0,5 mL larutan induk PAR 1% menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 100 mL.
3.5.2 Pembuatan larutan buffer
3.5.2.1 Pembuatan larutan natrium dihidrogen fosfat 1 M
Ditimbang 11,9 gram natrium dihidrogen fosfat, kemudian dilarutkan dengan akuadem dalam gelas beker. Larutan tersebut dipindahkan ke dalam labu ukur 100 mL dan diencerkan dengan akuadem sampai tanda batas.
3.5.2.2 Pembuatan larutan natrium hidroksida 1 M
Sebanyak 4,0 gram natrium hidroksida ditimbang, lalu dimasukkan gelas beker dan dilarutkan dengan akuadem. Larutan dipindahkan ke dalam labu ukur 100 mL dan diencerkan dengan akuadem sampai tanda batas.
3.5.2.3 Pembuatan larutan buffer fosfat
Tabel 3.1 Pembuatan larutan buffer posfat (Thomas, 1980)
3.5.2.4 Pembuatan larutan asam asetat 1 M
Larutan asam asetat 1 M dibuat dengan mengencerkan 15,88 mL larutan asam asetat glasial dengan akuadem dalam labu ukur 250 mL, kemudian larutan tersebut diencerkan sampai tanda batas dan dihomogenkan.
3.5.2.5 Pembuatan larutan natrium asetat trihidrat 1 M
Ditimbang 6,8 gram natrium asetat trihidrat dilarutkan dengan akuadem dalam gelas beker. Kemudian larutan tersebut dipindahkan secara kuantitatif ke dalam labu ukur 50 mL lalu diencerkan dengan akuadem sampai tanda batas dan dihomogenkan.
3.5.2.6 Pembuatan larutan buffer asetat
Larutan asam asetat dan natrium asetat dicampurkan dalam gelas beker dan diencerkan dengan akuadem sampai volumenya 100 mL. Selanjutnya pH larutan diukur dengan pH meter. Apabila pH terlalu asam maka ditambahkan ke dalamnya larutan CH3COONa.3H2O 1 M tetes demi tetes hinggan pH yang diinginkan tercapai. Apanila pH terlalu basa maka ditambahkan tetes demi tetes larutan CH3COOH 1 M sampai diperoleh pH yang didinginkan.
3.5.2.7 Pembuatan larutan buffer bikarbonat
Sebanyak 8,4 gram NaHCO3 ditimbang, kemudian dilarutkan dengan 10 mL akuadem dalam gelas beker 100 mL dimasukkan ke dalam labu ukur 100 mL lalu ditambahkan akuadem sampai tanda batas. Kemudian 50 mL larutan NaHCO3 1M dicampurkan dengan NaOH 1M (x) mLl dan akuadem sampai tanda batas.
Tabel 3.3 Pembuatan larutan buffer bikarbonat (Thomas, 1980) NaHCO3 1 M (mL) NaOH 1M (mL) pH teoritis
50 5,0 9,0
3.5.3 Pembuatan larutan induk Ni2+ 1000 ppm, larutan standar Ni2+ 100 ppm dan larutan standar Ni2+ 1 ppm
Untuk membuat larutan induk Ni2+ 1000 ppm dilakukan dengan cara menimbang 0,4783 gram NiSO4.7H2O dalam gelas beker. Kemudian dilarutkan dengan akuadem dan dipindahkan secara kuantitatif ke dalam labu ukur 100 mL.
Pembuatan larutan standar Ni2+ 1 ppm dilakukan dengan cara mengambil 1 mL larutan induk Ni2+ 100 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 100 mL sampai tanda batas.
3.5.4 Pembuatan larutan induk Fe3+ 1000 ppm, larutan standar Fe3+100 ppm dan larutan standar Fe3+ 1 ppm
Untuk membuat larutan induk Fe3+ 1000 ppm dilakukan dengan menimbang 0,4804 gram FeCl3.6H2O dalam gelas beker. Kemudian ditambahkan akuadem lalu dimasukkan dalam labu takar 100 mL dan diencerkan dengan akuadem sampai tanda batas.
Pembuatan larutan standar Fe3+ 100 ppm dilakukan dengan cara mengambil 5 mL larutan induk Fe3+ 1000 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 50 mL sampai tanda batas.
Pembuatan larutan standar Fe3+ 1 ppm dilakukan dengan cara mengambil 1 mL larutan induk Fe3+ 100 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 100 mL sampai tanda batas.
3.5.5 Pembuatan larutan induk Cr3+ 1000 ppm, larutan standar Cr3+100 ppm dan larutan standar Cr3+ 1 ppm
Untuk membuat larutan induk Cr3+ 1000 ppm dilakukan dengan menimbang 0,7692 gram Cr(NO3)3.9H2O dalam gelas beker. Kemudian dilarutkan dengan akuadem dalam gelas beker dan dipindahkan secara kuantitatif kedalam labu ukur 100 mL dan diencerkan dengan akuadem sampai tanda batas.
Pembuatan larutan standar Cr3+ 1 ppm dilakukan dengan cara mengambil 1 mL larutan induk Cr3+ 100 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 100 mL sampai tanda batas.
3.5.6 Pembuatan larutan induk Pb2+ 1000 ppm, larutan standar Pb2+100 ppm dan larutan standar Pb2+ 1 ppm
Untuk membuat larutan induk Pb2+ 1000 ppm dilakukan dengan menimbang 0,1599 gram Pb(NO3)2 dalam gelas beker dan ditambahkan dengan HNO3 dan akuadem. Larutan dipindahkan secara kuantitatif kedalam labu ukur 100 mL dan diencerkan dengan akuadem sampai tanda batas.
Pembuatan larutan standar Pb2+ 100 ppm dilakukan dengan cara mengambil 5 mL larutan induk Pb2+ 1000 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 50 mL sampai tanda batas.
Pembuatan larutan standar Pb2+ 1 ppm dilakukan dengan cara mengambil 1 mL larutan induk Pb2+ 100 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 100 mL sampai tanda batas.
3.5.7 Pembuatan larutan induk Zn2+ 1000 ppm, larutan standar Zn2+100 ppm dan larutan standar Zn2+ 1 ppm
Untuk membuat larutan induk Zn2+ 1000 ppm dilakukan dengan menimbang 0,4415 gram ZnSO4.7H2O kemudian dilarutkan dengan akuadem dalam gelas beker 100 mL. Larutan dipindahkan secara kuantitatif kedalam labu ukur 100 mL dan diencerkan dengan akuadem sampai tanda batas.
Pembuatan larutan standar Zn2+ 1 ppm dilakukan dengan cara mengambil 1 mL larutan induk Zn2+ 100 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 100 mL sampai tanda batas.
3.5.8 Pembuatan larutan induk Cu2+ 1000 ppm dan Pembuatan larutan standar Cu2+ 1 ppm
Untuk membuat larutan induk Cu2+ 1000 ppm dilakukan dengan menimbang 0,3862 gram CuSO4.5H2O dalam gelas beker. Kemudian dilarutkan dengan akuadem dalam gelas beker 100 mL. Larutan dipindahkan secara kuantitatif kedalam labu ukur 100 mL dan diencerkan dengan akuadem sampai tanda batas.
Pembuatan larutan standar Cu2+ 100 ppm dilakukan dengan cara mengambil 5 mL larutan induk Cu2+ 1000 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 50 mL sampai tanda batas.
Pembuatan larutan standar Cu2+ 1 ppm dilakukan dengan cara mengambil 1 mL larutan induk Cu2+ 100 ppm dengan menggunakan buret dan diencerkan dengan akuadem dalam labu ukur 100 mL sampai tanda batas.
3.6 Optimasi Parameter Analitik
3.6.1 Penentuan panjang gelombang maksimum reagen PAR
3.6.2 Penentuan panjang gelombang maksimum dan Penentuan pH optimum dalam pembentukan senyawa kompleks Ni(II)-PAR
Penentuan panjang gelombang maksimum dan pH optimum dalam pembentukan senyawa kompeks Ni(II)-PAR dilakukan bersama dengan mengukur absorbansi senyawa kompleks Ni(II)-PAR pada rentang pH 3, 4, 5, 6, 7, 8 dan 9. Pengukuran menggunakan spektrofotometer UV-Vis Shimadzu-1800 pada panjang gelombang 380-780 nm.
3.6.3 Penentuan konsentrasi optimum senyawa PAR
Disiapkan labu ukur 10 mL sebanyak 5 buah yang berisi PAR 0,005%; 0,01%; 0,02%; 0,03% dan 0,04%. Ke dalam masing-masing labu ukur tersebut ditambahkan 2 mL larutan buffer dengan pH optimum (prosedur 3.6.2) dan larutan Ni2+ 10 ppm sebanyak 1 mL, selanjutnya ditambahkan akuadem sampai tanda batas. Selanjutnya dilihat intensitas warna yang terjadi. Larutan dengan konsentrasi tertentu, yang memiliki nilai absorbansi tertinggi jika diukur dengan spektrofotometer UV-Vis pada panjang gelombang maksimum (prosedur 3.6.2) merupakan larutan yang memberikan hasil paling optimum. Blanko yang digunakan adalah 2 mL larutan buffer dengan pH optimum (prosedur 3.6.2) dan ditambahkan aquadem sampai tanda batas pada labu ukur 10 ml.
3.7 Pembuatan deret intensitas warna PAR terhadap konsentrasi Ni2+ Sebanyak 1 ml larutan PAR dengan konsentrasi optimum (prosedur 3.6.3) ditambahkan ke dalam larutan kerja Ni2+ 2 ppm pada pH optimum (prosedur 3.6.2) dalam labu ukur 10 ml, sehingga diperoleh larutan dengan konsentrasi Ni2+ 0,2 ppm. Langkah ini diulang sebanyak 3 kali. Prosedur yang sama dilakukan pada larutan standar Ni2+ dengan konsentrasi 0,4; 0,6; 0,8; 1,0 dan 2,0 ppm yang dibuat dari larutan kerja Ni2+ 10,0 ppm (untuk larutan 4,0; 6,0 dan 8,0 ppm) dan Ni2+ 100 ppm (untuk larutan 20,0 ppm). Dibuat urutan intensitas warna kompleks Ni(II)-PAR berdasarkan urutan konsentrasi larutan standar Ni2+.
3.8 Uji Selektivitas Senyawa PAR
dari zat-zat lain yang mungkin berada bersama analit. Larutan standar Ni2+ 10 ppm 1 ml ditambahkan larutan Fe3+ 100 ppm 1 mL dalam labu ukur 10 mL sehingga perbandingan konsentrasi Ni2+/Fe3+ sebesar 1:10. Sebanyak 1 mL reagen PAR dengan konsentrasi optimum (prosedur 3.6.3) dimasukkan ke dalam campuran tersebut pada pH optimum (prosedur 3.6.2), dan warna yang terbentuk dibandingkan dengan warna larutan yang mengandung Ni2+ 10 ppm yang telah ditambahkan reagen PAR dengan konsentrasi optimum (prosedur 3.6.3) pula. Prosedur yang sama dilakukan pada perbandingan konsentrasi Ni2+/Fe3+ sebesar 1:1; 1:10; 1;20 dan 1:100. Hal yang sama juga dilakukan untuk Ni2+/Cr3+ sebesar 1:1; 1:10; 1:10; 1;20 dan 1:100, Ni2+/Pb2+ sebesar 1:1; 1:10; 1:20 dan 1:100, Ni2+/Zn2+ sebesar 1:1; 1:10; 1:20 dan 1:100, Ni2+/Cu2+ sebesar 1:1; 1:10, 1:20 dan 1:100 . Logam Cr3+, dan Fe3+ dipilih dalam uji selektivitas dikarenakan logam-logam tersebut berada pada peralatan logam-logam stainless steel bersama logam-logam Ni2+ tersebut (Harold, 2010). Sedangkan logam seng (Zn), plumbum (Pb) dan kuprum (Cu) juga menjadi perhatian serius karena dapat menjadi potensi polusi pada permukaan tanah maupun air tanah yang dapat diserap oleh tumbuhan (Chaney et al., 1998a; Knox et al., 2000). Hal tersebut memperkuat dugaan bahwa tanaman
3.9Konfirmasi Analisis Ni2+ dengan Metode Spektrofotometri dan Penentuan Parameter Validasi
3.9.1 Pembuatan kurva standar
Larutan PAR 1 ml dengan konsentrasi optimum (prosedur 3.6.3) ditambahkan ke dalam larutan kerja Ni2+ 10 ppm pada pH optimum (prosedur 3.6.2) dalam labu ukur 10 ml, sehingga diperoleh larutan dengan konsentrasi Ni2+ 1 ppm. Langkah ini diulang sebanyak 3 kali. Prosedur yang sama dilakukan pada larutan standar Ni2+ dengan konsentrasi 0,2; 0,4; 0,6; 0,8 dan 2,0 ppm yang dibuat dari larutan kerja Ni2+ 10 ppm (untuk larutan 2,0; 4,0; 6,0 dan 8,0 ppm) dan Ni2+ 100 ppm (untuk larutan 20 ppm). Larutan diukur serapannya menggunakan spektrofotometer UV-Vis pada pada panjang gelombang maksimum (prosedur 3.6.2). Nilai absorbansi yang diperoleh digunakan untuk membuat kurva standar dan untuk menentukan parameter validasi.
3.9.2 Penentuan liniearitas
3.9.3 Penentuan selektivitas
Selektivitas adalah kemampuan untuk membedakan analit dari interferensi logam lain yang ada di dalam sampel (Mitra dan Brukh, 2003). Penentuan selektivitas ini ditentukan dari uji selektivitas senyawa PAR pada optimasi parameter analitik (prosedur 3.8). Perbandingan konsentrasi Ni2+/Fe3+ sebesar 1:1; 1:10; 1;20 dan 1:100, Ni2+/Cr3+ sebesar 1:1; 1:10; 1:10; 1;20 dan 1:100, Ni2+/Pb2+ sebesar 1:1; 1:10; 1:20 dan 1:100, Ni2+/Zn2+ sebesar 1:1; 1:10; 1:20 dan 1:100, Ni2+/Cu2+ sebesar 1:1; 1:10, 1:20 dan 1:100, dibandingkan dengan warna larutan yang mengandung Ni2+ 10 ppm yang telah ditambahkan reagen PAR dengan konsentrasi optimum. Jika absorbansi campuran Ni2+ dengan Fe3+, Cr3+, Pb2+, Zn2+, dan Cu2+ lebih besar dari absorbansi Ni2+ 10 ppm dan panjang gelombangnya mendekati Ni2+, maka ion-ion logam tersebut mengganggu analisis Ni2+ dengan PAR.
3.9.4 Penentuan sensitivitas
3.9.5 Penentuan limit deteksi
Limit deteksi menyatakan besarnya nilai kadar analit terkecil dalam sampel yang masih dapat diukur atau dideteksi dengan baik oleh suatu metode. Nilai limit deteksi dihitung berdasarkan persamaan regresi yang diperoleh pada pembuatan kurva standar perbandingan dengan metode spektrofotometri (prosedur 3.9). Batas deteksi ditentukan dengan persamaan berikut :
y = yb + 3 Sb (3)
Keterangan :
yb = a pada persamaan regresi (intersep)
𝑆𝑏
=
𝑆
𝑦/𝑥=
(𝑦𝑖−𝑦 ) 2𝑛−2 (4)
Keterangan :
Sy/x = standar deviasi pada pengukuran y
= y yang didapat dari hasil subtitusi nilai x ke dalam persamaan regresi linier
yi = hasil pengukuran y ke-i, y yang dapat dimasukkan ke dalam persamaan regresi linier,sehingga:
𝑥
=
𝑦−𝑎𝑏 (5)
3.9.6 Penentuan akurasi
Akurasi diperoleh dengan menghitung persen recovery konsentrasi Ni(II) yang sudah diketahui kadarnya. Disiapkan sampel Ni(II) yang telah diketahui kadarnya. Sampel Ni(II) diukur absorbansinya dengan replikasi tiga kali pada kondisi optimum sensor. Dari hasil pengukuran tersebut keakuratan metode dapat diketahui. sebagai berikut Persamaan untuk persen recovery adalah :
%𝑟𝑒𝑐𝑜𝑣𝑒𝑟𝑦
=
kadar Ni II yang teramatikadar Ni II sebenarnya
x 100%
(6) 3.9.7 Penentuan koefisien variasi (presisi)
Presisi atau ketelitian menyatakan derajat keterulangan (reproducibility) yaitu besarnya kesesuaian atau penyimpangan dari setiap hasil pengukuran yang telah dilakukan berulang-ulang pada sampel yang sama.
Presisi dapat ditentukan dengan menghitung nilai simpangan baku (standar deviasi = SD) dan koefisien variasi (KV) dari data hasil pengukuran berulang sebanyak tiga kali yang diperoleh dari data perbandingan dengan metode spektrofotometri (prosedur 3.9) dengan mengambil rentang konsentrasi 0,02 ppm; 0,12 ppm dan 0,2 ppm. Harga SD dan KV dapat ditentukan dari persamaan berikut (Miller dan Miller, 1988) :
𝑆𝐷
=
(𝑥𝑖−𝑥 )3.10 Perlakuan Sampel
3.10.1 Destruksi basah sampel jamu serbuk
Ditimbang dengan teliti 0,5000 gram sampel jamu kemasan dalam Erlenmeyer 100 mL, kemudian ditmbahkan air panas 10 mL, ditambahkan H2SO4 10 mL dan dimasukkan dalam labu kjeldahl, dipanaskan diatas hot plate dengan ditutup corong sampai larutanya jernih dan dilakukan di lemari asam. Larutan tersebut kemudian didinginkan dan setelah dingin di-add-kan dalam labu ukur 100 mL dan disaring.
3.10.2 Destruksi basah sampel jamu cair
Diambil 10,0 ml sampel jamu cair kemasan, kemudian ditambah air panas 10 mL dan HNO3 pekat 0,5 mL. Kemudian dipanaskan dengan ditutup kaca arloji. Pemanasan dilakukan di lemari asam. Setelah larutan jernih dan tinggal 1/3 bagian diangkat dan didinginkan. Larutan yang dingin addkan dinetralkan dan di-addkan dalam labu ukur 100 mL. Larutan tersebut kemudian disaring dan siap dianalisis menggunakan sensor kimia.
3.11 Analisis Sampel
tersebut diaduk sampai homogen. Warna larutan yang terbentuk dibandingkan dengan deret warna larutan standar Ni2+.
Akurasi analisis sampel jamu padat maupun cair dengan sensor kimia dinyatakan dengan menunjukkan kedekatan hasil analisis dengan kadar analit yang sebenarnya dengan menunjukkan %Recovery. Pada penelitian ini akurasi ditentukan menggunakan metode adisi standar. Dalam metode adisi standar, sampel dianalisis lalu sejumlah tertentu analit yang diperiksa ditambahkan ke dalam sampel dicampur dan dianalisis lagi. Penambahan analit dilakukan pada konsentrasi rendah, tengah dan atas (Harmita, 2004). Penambahan analit yang telah diketahui kadarnya ini dilakukan bersamaan dengan destruksi sampel. Sampel jamu serbuk maupun cair ditambah dengan Ni2+ 0,2; 0,8 dan 2,0 ppm. Lalu dilihat hasil %recovery-nya, sesuai atau tidak dengan hasil perhitungan.
%𝑟𝑒𝑐𝑜𝑣𝑒𝑟𝑦= konsentrasi adisi standar−konsentrasi sampel sebenarnya
konsentrasi analit yang ditambahkan x 100%
BAB IV
HASIL DAN PEMBAHASAN 4.1 Optimasi Parameter Analitik
4.1.1 Penentuan panjang gelombang maksimum reagen PAR
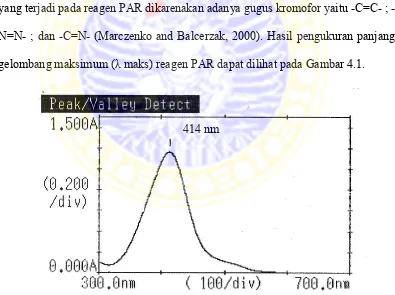
Panjang gelombang maksimum reagen PAR diukur dengan menggunakan larutan PAR 0,01%, larutan buffer posfat pH 8 dan akuadem dalam labu ukur 10 ml menggunakan spektrofotometer UV-Vis Simadzu 1800. Blanko yang digunakan dalam pengukuran ini adalah akuadem. Reagen PAR berwarna kuning kecoklatan sehingga pengukuran dilakukan pada rentang 380-700 nm. Warna yang terjadi pada reagen PAR dikarenakan adanya gugus kromofor yaitu C=C ; -N=N- ; dan -C=N- (Marczenko and Balcerzak, 2000). Hasil pengukuran panjang
gelombang maksimum (λ maks) reagen PAR dapat dilihat pada Gambar 4.1.
Gambar 4.1 Panjang gelombang maksimum senyawa PAR 0,001%
Berdasarkan gambar di atas dapat diketahui bahwa panjang gelombang maksimum reagen PAR (4-(2-piridilazo)resorsinol adalah 414 nm. Dalam media
netral dan basa, panjang gelombang maksimum reagen PAR adalah 413 (Thomas, and Burgess, 2007). Perbedaan panjang gelombang sebesar 1,0 nm masih dalam batas toleransi yang diperkenankan yaitu lebih kurang 3 nm (Farmakope Indonesia, 2009).
4.1.2 Penentuan panjang gelombang maksimum dan pH optimum dalam pembentukan senyawa kompleks Ni(II)-PAR
elektron bebas berikatan dengan H menjadikan orbital Ni2+ tidak terisi penuh sehingga senyawa kompleks yang terbentuk tidak memberikan serapan yang optimum.
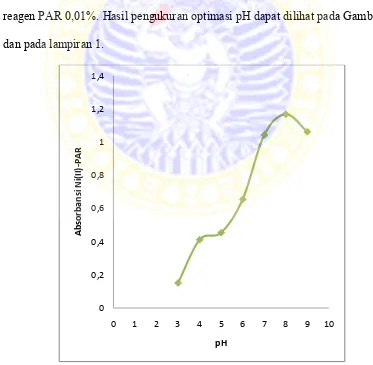
Dipilih pH 7, 8 dan 9 karena dalam medium netral dan basa PAR membentuk senyawa kompleks dengan Ni2+ (Marczenko and Balcerzak, 2000). Larutan yang diukur tersebut di dalamnya mengandung Ni2+ 10 ppm, buffer dengan variasi pH antara 3-9, dan reagen PAR 0,01%. Larutan tersebut dimasukkan dalam labu ukur 10 mL dan ditambah akuadem sampai tanda batas. Blanko yang digunakan adalah larutan dengan campuran antara akuadem dan reagen PAR 0,01%. Hasil pengukuran optimasi pH dapat dilihat pada Gambar 4.2 dan pada lampiran 1.
Berdasarkan gambar diatas dapat diketahui bahwa pH optimum senyawa kompleks Ni(II)-PAR adalah 8. Pada pH tersebut senyawa kompleks Ni(II)-PAR yang terbentuk memberikan warna yang stabil sehingga warnanya bisa bertahan hingga beberapa jam. Pada pH 9, nilai absorbansi senyawa kompleks Ni(II)-PAR turun. Hal tersebut terjadi karena konsentrasi ion Ni2+ pada suasana basa turun membentuk hidroksidanya menjadi Ni(OH)2. Nilai absorbansi senyawa kompleks Ni(II)-PAR paling tinggi terjadi pada pH 8 dengan panjang gelombang maksimum 495 nm. Hasil pengukuran panjang gelombang senyawa kompleks Ni(II)-PAR dapat dilihat pada Gambar 4.3 dan data selengkapnya dapat dilihat pada lampiran 1.
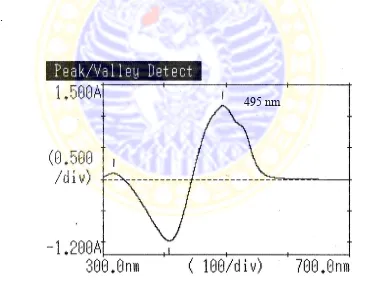
Gambar 4.3 Panjang gelombang maksimum senyawa kompleks Ni(II)-PAR
Pada gambar tersebut nampak dua puncak gelombang, dipilih puncak pada panjang gelombang 495 nm karena senyawa kompleks Ni(II)-PAR merupakan
senyawa yang berwarna sehingga terletak pada panjang gelombang visibel yaitu antara 380-700 nm. Sedangkan puncak yang lain berada pada panjang gelombang dibawah 380 nm sehingga dapat dipastikan puncak tersebut bukan puncak senyawa kompleks Ni(II)-PAR. Hasil ini sesuai dengan literatur bahwa PAR merupakan salah satu senyawa azo yang digunakan untuk reagen spektrofotometri Ni2+ yang memberikan nilai panjang gelombang maksimum 495 nm dalam media netral dan basa (Marczenko and Balcerzak, 2000).
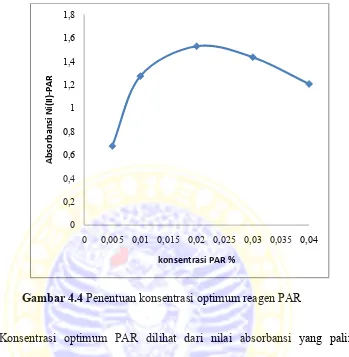
4.1.3 Penentuan konsentrasi optimum reagen PAR
Gambar 4.4 Penentuan konsentrasi optimum reagen PAR
Konsentrasi optimum PAR dilihat dari nilai absorbansi yang paling optimum, dari Gambar 4.4 menunjukkan bahwa absorbansi yang paling optimum terletak pada konsentrasi reagen PAR 0,02%. Senyawa pyridilazo bertindak sebagai ligan tridentat yang mempunyai perbandingan stoikiometri logam : ligan adalah 1: 2 (Silva et al., 2009). Persamaan reaksi dan pembentukan kompleks yang diusulkan dapat dilihat pada Gambar 4.5
0
0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04
Ni2+ + 2
Gambar 4.5 Persamaan reaksi dan pembentukan kompleks senyawa Ni(II)-PAR
Jika konsentrasi dinaikkan menjadi 0,03% dan 0,04% maka absorbansi reagen PAR menurun karena reaksi Ni2+ dengan reagen PAR telah jenuh. Jika konsentrasi PAR melebihi perbandingan tersebut orbital kosong logam Ni2+ telah
N N
OH
OH
N O
HO
N N
Ni
N O
OH N
terisi penuh, sehingga sisa PAR berlebih tidak bisa bereaksi dengan Ni2+ dan menyebabkan absorbansinya menjadi turun.
4.2 Pembuatan Deret Intensitas Warna
Pada penelitian ini dilakukan penentuan deret intensitas warna sensor kimia dengan variasi konsentrasi Ni2+ yaitu 0,0; 0,2; 0,4; 0,6; 0,8; 1,0 dan 2,0 ppm dengan pH 8. Pembuatan deret intensitas warna ini digunakan sebagai acuan dalam menganalisis Ni2+ baik secara kualitatif maupun semikuantitatif. Hasil dari intensitas warna sensor kimia pada penelitian ini disajikan Gambar 4.6.
Gambar 4.6 Deretan warna sensor kimia Deret Warna (ppm)
Berdasarkan Gambar 4.6 intensitas warna semakin terlihat kuat seiring dengan semakin meningkatnya konsentrasi Ni2+ yang diberikan. Hal tersebut menunjukkan bahwa meningkatnya konsentrasi Ni2+ berarti jumlah ion Ni2+ yang bereaksi dengan PAR semakin banyak pula, sehingga kemungkinan terbentuknya kompleks Ni(II)-PAR juga makin besar dan mengakibatkan meningkatnya intensitas warna kompleks. Namun jika konsentrasi Ni2+ terus ditingkatkan melebihi 2,0 ppm maka tidak akan terjadi perubahan warna yang signifikan dan absorbansinya konstan.
4.3 Uji Selektivitas Senyawa PAR
Uji selektivitas ini bertujuan untuk mengetahui sejauh mana sensor kimia yang dibuat, memiliki kemampuan dalam menyeleksi analit yang akan dideteksi dari zat-zat lain yang mungkin berada bersama analit. Pengukuran selektifitas dari reagen PAR ini terhadap ion-ion lain dilakukan dengan cara menentukan ion-ion logam lainnya yang terkandung juga dalam sampel jamu dan cukup mengganggu dalam menentukan ion logam Ni2+. Data selengkapnya dapat dilihat pada lampiran 3.
Ni2+ 0 ppm Ni2+ 1 ppm
Perbandingan konsentrasi Ni2+ dan Fe3+
1:1 1:10 1:20 1:100
Dari gambar di atas dapat dilihat secara visual warna senyawa kompleks Ni2+ dengan Ni2+ yang ditambah dengan Fe3+. Hasil analisis menggunakan spektrofotometer UV-Vis (lampiran 3) menunjukkan terjadi pergeseran nilai absorbansi antara Ni2+ dan Ni2+ yang ditambah dengan Fe3+. Pergeseran absorbansi tersebut disebabkan oleh pergeseran panjang gelombang maksimum. nilai absorbansi Ni2+ dan Ni2+ : Fe3+ dengan perbandingan mulai 1:1 memiliki nilai perbedaanya lebih dari 3%. Begitu pula dengan perbandingan 1:10, 1:20 dan 1:100. Sehingga dapat ditarik kesimpulan bahwa ion Fe3+ mengganggu analisis. Data selengkapnya dapat dilihat pada lampiran 3.
Gambar 4.8. Selektivitas Ni2+ dengan Pb2+
Dari gambar di atas dapat dilihat secara visual warna senyawa kompleks Ni2+ dengan Ni2+ yang ditambah dengan Pb2+. Hasil dari pengukuran menggunakan spektrofotometer Uv-Vis (lampiran 3) menunjukkan bahwa nilai absorbansi Ni2+ dengan Ni2+ yang ditambah dengan Pb2+ mengalami pergeseran nilai absorbansi yang disebabkan oleh adanya pergeseran panjang gelombang. Nilai absorbansi Ni2+ dan Ni2+ : Pb2+ dengan perbandingan mulai 1:1 memiliki Ni2+ 0 ppm Ni2+ 1 ppm
Perbandingan konsentrasi Ni2+ dan Pb2+
nilai perbedaan absorbansi lebih dari 3%. Begitu pula dengan perbandingan 1:10, 1:20 dan 1:100. Sehingga dapat ditarik kesimpulan bahwa ion Pb2+ mengganggu analisis sensor terhadap Ni2+.
Gambar 4.9. Selektivitas Ni2+ dengan Cr3+
Dari gambar di atas dapat dilihat secara visual warna senyawa kompleks Ni2+ dengan Ni2+ yang ditambah dengan Cr3+. Hasil dari pengukuran menggunakan spektrofotometer UV-Vis (lampiran 3) menunjukkan bahwa nilai absorbansi Ni2+ dengan Ni2+ yang ditambah dengan Cr3+ mengalami pergeseran nilai absorbansi yang disebabkan oleh adanya pergeseran panjang gelombang. Nilai absorbansi Ni2+ dan Ni2+ : Cr3+ dengan perbandingan mulai 1:1 memiliki nilai perbedaanya lebih dari 3%. Begitu pula dengan perbandingan 1:10, 1:20 dan 1:100. Sehingga dapat ditarik kesimpulan bahwa ion Cr3+ mengganggu analisis. Ni2+ 0 ppm Ni2+ 1 ppm
Perbandingan konsentrasi Ni2+ dan Cr3+
Gambar 4.10. Selektivitas Ni2+ dengan Zn2+
Dari gambar di atas dapat dilihat secara visual warna senyawa kompleks Ni2+ dengan Ni2+ yang ditambah dengan Zn2+. Hasil dari pengukuran menggunakan spektrofotometer UV-Vis (lampiran 3) menunjukkan bahwa nilai absorbansi Ni2+ dengan Ni2+ yang ditambah dengan Zn2+ mengalami pergeseran nilai absorbansi yang disebabkan oleh adanya pergeseran panjang gelombang. Dari hasil pengukuran menggunakan spektrofotometer UV-Vis nilai absorbansi Ni2+ dan Ni2+ : Zn2+ dengan perbandingan mulai 1:1 memiliki nilai perbedaanya lebih dari 3%. Begitu pula dengan perbandingan 1:10, 1:20 dan 1:100. Sehingga dapat ditarik kesimpulan bahwa ion Zn2+ mengganggu analisis.
Ni2+ 0 ppm Ni2+ 1 ppm
Perbandingan konsentrasi Ni2+ dan Zn2+
Gambar 4.11. Selektivitas Ni2+ dengan Cu2+
Dari gambar di atas dapat dilihat secara visual warna senyawa kompleks Ni2+ dengan Ni2+ yang ditambah dengan Cu2+. Hasil dari pengukuran menggunakan spektrofotometer UV-Vis (lampiran 3) menunjukkan bahwa nilai absorbansi Ni2+ dengan Ni2+ yang ditambah dengan Cu2+ mengalami pergeseran nilai absorbansi yang disebabkan oleh adanya pergeseran panjang gelombang. Nilai absorbansi Ni2+ dan Ni2+ : Cu2+ dengan perbandingan mulai 1:1 memiliki nilai perbedaanya lebih dari 3%. Begitu pula dengan perbandingan 1:10, 1:20 dan 1:100. Sehingga dapat ditarik kesimpulan bahwa ion Cu2+ mengganggu analisis.
Adanya interferensi dari ion-ion seperti Fe3+, Pb2+, Cr3+, Zn2+ dan Cu2+ yang juga bereaksi dengan PAR membentuk kompleks yang berwarna mengakibatkan analisis terhadap ion Ni2+ tidak maksimal (Marczenko and Balcerzak, 2000).
Ni2+ 0 ppm Ni2+ 1 ppm
Perbandingan konsentrasi Ni2+ dan Cu2+
4.4 Konfirmasi Analisis Ni2+ dengan Metode Spektrofotometri dan Penentuan Parameter Validasi
4.4.1 Pembuatan Kurva Standar
Perbandingan dengan metode spektrofotometri ini dilakukan dengan membuat kurva standar dan menentukan nilai-nilai dari parameter validasi. Pada penelitian ini larutan yang diukur untuk membuat kurva standar dibuat dari larutan Ni2+ dengan variasi konsentrasi yang terdiri atas 0,2; 0,4; 0,6; 0,8; 1,0; dan 2,0 ppm yang ditambah larutan PAR 0,02% pada pH 8. Replikasi dilakukan sebanyak 3 kali. Dari hasil pengukuran menggunakan spektrofotometer UV-Vis
pada λ=495 nm diperoleh data absorbansi rata-rata dan dibuat kurva standar
sebagai berikut. Data secara lengkap dapat dilihat secara lengkap pada lampiran 4. Tabel 4.1 Hasil absorbansi rata-rata Ni(II)-PAR
Konsentrasi Ni2+ (ppm) Absorbansi rata-rata
0,0 0,008
Gambar 4.12 Kurva standar Ni(II)-PAR
4.4.2 Penentuan linieritas
Penentuan linieritas diperoleh dari data hasil konfirmasi menggunakan metode spektrofotometri. Dari data yang tertera pada tabel 4.1, dibuat kurva absorbansi terhadap konsentrasi Ni2+.
Dari kurva standar di atas diperoleh persamaan regresi linier y=1,216x+0,026 dengan koefisien korelasi (linieriras) R2=0,997. Nilai koefisien korelasi tersebut menunjukkan kurva mendekati linier dan korelasi antara absorbansi dan konsentrasi Ni2+ yang berbanding lurus, dikarenakan nilai koefisien korelasinya yang mendekati 1 (Miller dan Miller, 1988).
4.4.3 Penentuan sensitivitas
Sensitivitas marupakan kemampuan membedakan analit dengan unsur maupun senyawa lain dalam sampel hingga konsentrasi terkecil. Sensitivitas ditunjukkan oleh nilai slope dari persamaan regresi kurva standar, semakin besar nilainya semakin sensitif pula sensor tersebut (Mitra dan Brukh, 2003). Kurva standar pada Gambar 4.12 menunjukkan nilai sensitivitas sebesar 1,216 L/mg. Hal tersebut menunjukkan bahwa dengan perubahan konsentrasi sebesar 1,216 L/mg akan menghasilkan perbedaan intensitas yang besar.
4.4.4 Penentuan limit deteksi
Nilai limit deteksi dihitung berdasarkan persamaan regresi yang diperoleh pada pembuatan kurva standar. Hasil perhitungan menunjukkan limit deteksi dari spektrofotometer pada penelitian ini sebesar 0,1095 ppm. Sedangkan limit deteksi dari sensor kimia dengan menggunakan reagen PAR untuk analisis Ni2+ adalah 0,2 ppm. Data selengkapnya dapat dilihat pada lampiran 5.
4.4.5 Penentuan akurasi
Akurasi ditentukan berdasar perhitungan %recovery yang menyatakan memasukkan nilai absorbansi hasil pengukuran ke dalam persamaan tersebut (variable y) diperoleh nilai %recovery yang ditunjukkan tabel 4.2.
Tabel 4.2 Penentuan akurasi (%recovery)
Konsentrasi sebenarnya (ppm) Konsentrasi terukur (ppm) %Recovery
0,2 0,166 83,06
0.4 0,435 108,75
0,6 0,583 97,17
0,8 0,803 100,37
1,0 1,055 105,5
2,0 1,973 98,65
Rata-rata 98,92
4.4.6 Hasil penentuan koefisien variasi (presisi)
Presisi atau ketelitian ditentukan dengan menghitung nilai simpangan baku (SD) dan koefisien variasi (KV) dari data hasil pengukuran berulang. Hasil perhitungan menunjukkan data simpangan baku dan koefisien variasi yang ditunjukkan pada tabel 4.3. Data selengkapnya dapat dilihat pada lampiran 7.
Tabel 4.3 Penentuan koefisien variasi
Konsentrasi (ppm) Simpangan baku (SD) Koefisien variasi (KV) (%)
0,2 0,0020 0,877
Rata-rata 0,0120 0,2562
Dari hasil perhitungan, nilai simpangan bakunya adalah 0,0120% dan koefisien variasi adalah 0,2562%. Hal tersebut menunjukkan pengukuran pada penelitian ini memiliki ketelitian yang baik, hal tersebut didasarkan pada nilai simpangan baku dan koefisien variasinya. Suatu pengukuran dikatakan teliti jika simpangan bakunya kecil dan nilai koefisien variasinya memiliki nilai kurang dari 3% (Miller dan Miller, 1988).
4.5.Perlakuan Sampel 4.5.1 Sampel jamu serbuk
analisis. Larutan sampel yang netral tersebut diambil dan ditetesi reagen PAR kemudian dicocokan dengan deret warna yang telah dibuat dan dilihat berapa kadarnya sesuai dengan warna yang dibentuk oleh senyawa kompleks Ni(II)-PAR. Sampel jamu tersebut memberikan warna diantara 0,0 ppm dan 0, 2 ppm, bisa dilihat pada gambar 4.13.
Gambar 4.13 Sampel jamu serbuk yang dicocokkan dengan deret warna
Untuk mengecek kesesuaiannya digunakan spektrofotometer UV-Vis simadzu 1800. Dari hasil pengecekan menggunakan spektrofotometer sampel
jamu padat yang dianalisis memiliki kadar Ni2+ 0,0209 ppm.
Analit yang dianalisis terlalu kecil dan tidak berada pada rentang deret warna sehingga perlu dilakukan adisi standar untuk menganalisisnya. Dalam metode adisi standar, sampel dianalisis lalu sejumlah tertentu analit yang
Deret Warna (ppm)
diperiksa ditambahkan ke dalam sampel dicampur dan dianalisis lagi (Harmita, 2004). Gambar sampel jamu yang diadisi standar sebagai berikut :
Gambar 4.14 Sampel jamu serbuk yang dicocokkan dengan deret warna (sudah diadisi)
Penambahan analit yang telah diketahui kadarnya ini dilakukan bersamaan dengan destruksi sampel. Sampel jamu serbuk ditambah dengan Ni2+ 0,2; 0,8 dan 2,0 ppm. Penambahan tersebut sengaja dilakukan pada konsentrasi rendah, tengah dan atas dengan tujuan bisa mewakili data secara keseluruhan. Lalu dilihat hasil %recovery-nya, sesuai atau tidak dengan hasil perhitungan. Hal ini bertujuan
untuk mengetahui apakah matriks didalam sampel berpengaruh terhadap analit yang akan dianalisis. Hasil %recovery sampel berturut-turut adalah 69,45%,
Deret Warnan (ppm)
129,25% dan 97,30%. Rentang %recovery pada penambahan analit tersebut memiliki rata-rata 98,67% untuk konsentrasi antara 0,2-2,0 ppm. Nilai tersebut masih diijinkan karena penambahan analit pada matriks antara 100 ppb – 1ppm rata-rata yang diperoleh adalah 80-110 % (Harmita, 2004). Analisis perhitungan dapat dilihat pada lampiran 8.
4.6.2. Sampel jamu cair
Deret Warna (ppm)
0,0 0,2 0,4 0,6 0,8 1,0 2,0
Gambar 4.16 Sampel jamu serbuk yang dicocokkan dengan deret warna (sudah diadisi)
Untuk memastikan larutan tersebut diukur menggunakan spektrofotometer UV-Vis. Dengan menggunakan spektofotometer konsentrasi Ni2+ dalam sampel jamu cair adalah 0,0516 ppm.
Penambahan analit yang telah diketahui kadarnya ini dilakukan bersamaan dengan destruksi sampel. Sampel jamu cair ditambah dengan Ni2+ 0,2; 0,8 dan 2,0 ppm diambil konsentrasi rendah, tengah dan tinggi supaya dapat mewakili seluruh pengukuran. Hal ini bertujuan untuk mengetahui apakah matriks didalam sampel berpengaruh terhadap analit yang akan dianalisis. Lalu dilihat hasil %recovery-nya, sesuai atau tidak dengan hasil perhitungan. Hasil %recovery-nya secara berturut-turut adalah 77,95%, 105,97% dan 89,02%. Sehingga rata-rata
Deret Warna (ppm)
%recovery konsentrasi 0,2-2,0 ppm adalah 90,98%. Rentang %recovery tersebut
masih diijinkan karena penambahan analit pada matriks antara 100 ppb – 1ppm rata-rata yang diperoleh adalah 80-110 % (Harmita, 2004). Analisis perhitungan dapat dilihat pada lampiran 8.
4.6 Analisis Komprehensif Antar Variabel
Sensor kimia menggunakan reagen PAR dengan teknik spot test dibuat dengan beberapa optimasi parameter analitik. Optimasi tersebut meliputi penentuan panjang gelombang maksimum reagen PAR yaitu 414 nm dan panjang gelombang maksimum senyawa kompleks Ni(II)-PAR yaitu 495 nm. Panjang gelombang maksimum senyawa kompleks ini kemudian digunakan untuk optimasi berikutnya. Optimasi berikutnya adalah penentuan pH optimum pembentukan senyawa kompleks Ni(II)-PAR. Dalam pembuatan sensor ini pH optimum senyawa kompleks yang didapat adalah pH 8 dan konsentrasi optimum reagen PAR adalah 0,02%. Optimasi yang dilakukan tersebut bertujuan agar sensor yang dibuat bisa digunakan secara maksimal.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan dapat ditarik kesimpulan sebagai berikut:
1. reagen 4-(2-piridilazo)resorsinol (PAR) dapat digunakan sebagai sensor kimia dengan teknik spot test dalam analisis kadar Ni2+,
2. konsentrasi reagen PAR yang digunakan dalam pembuatan sensor kimia dengan teknik spot test untuk analisis Ni2+ dengan rentang konsentrasi 0,2-2,0 ppm adalah 0,02% dengan pH optimum 8,
3. Linieritas dari sensor kimia sebesar 0,997, selektivitas yang diganggu oleh ion Fe3+, Pb2+, Cr3+, Zn2+ dan Cu2+, sensitivitas sebesar 1,216 L/mg, limit deteksi spektrofometer UV-Vis 0,1095 ppm, limit deteksi sensor kimia 0,2 ppm, akurasi rata-rata 98,92%, dan presisisi (koefisien variasi) rata-rata 0,2562%, dengan.
5.2 Saran
Sensor kimia ini memiliki limit deteksi 0,2 ppm sedangkan ambang batas kadar Ni2+ pada produk air minum adalah 0,02 ppm. Sehingga diperlukan metode adisi standar untuk menganalisis sampel jamu.
DAFTAR PUSTAKA
Anyadike, Nnamdi. 2002. Nickel : An Industry on the Brink of Expansion. Cambridge-England : Victoire Press Ltd
Brian R. Eggins. 2002. Chemical Sensor And Biosensor Analytical Techniques In The Sciences. John Wiley and Sons, Ltd. University of Ulster at Jordanstown Northern Ireland, UK
Cempel, M.,Nikel, G., Nickel: A Review of Its Sources and Environmental Toxicology, Polish J. of Environ. Stud. Vol. 15, No. 3 (2006), 375-382 Chaney RL, Brown SL, Angle JS., 1998a, Soil-root interface: Food chain
contamination and ecosystem health, Di dalam: Huang M, et al (ed). Madison WI: Soil Sci Soc Am 3:9-11.
Farmakope Indonesia, 2009, Edisi keempat, Jakarta : Depkes RI.
Fries, J. and Getrost, H., 1977, Organic Reagents For Trace Analysis, E. Merck Darmstad, New York
Geoffrey A, Lawrance. 2010. Introduction to Coordination Chemistry. John Wiley and sons, Ltd. University of Newcastle, Callaghan, NSW, Australia A John
Gunawan, Budi 2010. Teknologi Sensor Kimia. Teknik Elektro Sunan Muria Kudus : Mawas
Hapsari I. P., Oktiawan W.,Junaidi. 2010. Penurunan Nikel (Ni) Dan Seng (Zn) Dalam Pengolahan Limbah Cair Industri Elektronik Menggunakan Metode Presipitasi Dengan Senyawa Alkali NaOH Dan Na
2CO3. Studi Kasus PT.
Hartono Istana Teknologi
Harris, Daniel C., 2007, Quantitative Chemical Analysis, Seventh Edition, W. H. Freeman and Company, New York
Harmita, 2004. Petunjuk Pelaksanaan Validasi metode dan Cara Perhitungnnya. Departemen Farmasi FMIPA-UI. Majalah Ilmu Kefarmasian, Vol. I, No. 3, Desember 2004,117-135
Harold M. Cobb., 2010, The history of stainless steel. ASM international: printed united states of americi
Karipcin, Fatma and Karbalcilar, Eser., 2007. Spectroscopic and Thermal studies on Solid Complexes of 4-(2-pyridylazo)resorcinol with Some Transition Metals. Acta Chim. Slov. 54, 242–247
Keputusan Menteri Kesehatan Republik Indonesia Nomor 907/MENKES/SK/VII/2002 tanggal 29 Juli 2002 tentang syarat-syarat dan pengawasan kualitas air minum
Knox A.S., Seaman J, Andriano DC, Pierzynski G., 2000, Chemostabilization of metals in contaminated soils. Di dalam: Wise DL, Trantolo DJ, Cichon EJ, Inyang HI, Stottmeister U (ed), Bioremediation of Cotaminated Soils, New York: Marcek Dekker Inc. hlm 811-836.
Komandoko, Gamal. 2010. Ensiklopedia Pelajar dan Umum. Jogjakarta : Pustaka Widyatama
Limananti, A. I., Triratnawati A, Jurusan Antropologi, Universitas Gadjah Mada. Ramuan Jamu Cekok Sebagai Penyembuhan Kurang Nafsu Makan Pada Anak: Suatu Kajian Etnomedisin. Makara, Kesehatan, Vol. 7, No. 1, Juni 2003
Liong, Theresa C. Y. 2009. The Martha Tilaar Way Sukses Meraih Bisnis. Jakarta : Koma
Marczenko, Z. and Balcerzak, M. 2000. Separation Preconsentration and Spectrometry in Inorganic Analysis.Amsterdam, The Netherlands:Elsevier Science B.V.
Miller, J.C and Miller, J.N., 1988, Statistics For Analytical Chemistry Second Edition, Ellis Horwood Limitwd, England
Mitra, S and Brukh, R., 2003, Sample Preparation Techniques in Analytical Chemistry, New Jersey Institute of Technology, New Jersey
Mulja, M dan Suharman., 1995, Analisis Instrumental, Airlangga University Press, Surabaya
Sari, R. S., 2008, Analisis Nikel Menggunakan Metoda Uji Noda dengan Pengkhelat Dimetil Glioksim, In : Seminar Tugas Akhir S1 Jurusan Kimia FMIPA Undip. Jurusan Kimia Undip
Satmoko, Yudo. 2006. Kondisi Pencemaran Logam Berat di Perairan Sungai DKI Jakarta JAI Vol 2, no 1. Jakarta : Pusat Teknologi Lingkungan-BPPT
Setyawati H. dan Murwani I.K., 2010, Sintesis Dan Karakterisasi Senyawa Kompleks Besi(III)-EDTA, Prosiding Seminar Nasional Sains 2010
Silva, E.L., Roldan, P.D.S., Gine, M.F., 2009, Simultaneus Preconcentration of Cooper, Cadmium, and Nickel in Water Samples by Cloud Point Extration Using 4-(2-pyridylazo)-resolcinol and Their Determination by Inductively Coupled Plasma Optic Emision Spectrometry, Journal of Hazardous Materials 171
Thomas, L.C dan Chamberlain, G.J., 1980, Colorimetric Chemical Analytical Methods, 9thed., The Tintometer. Ltd., Salisbury, England
Thomas, O. and Burgess, C., 2007, Uv-Visible Spectrophotometry Of Water And Wastewater, Amsterdam, The Netherlands: Elsevier B.V
Underwood, A.L., and Day, R.A., 1998, Analisis Kimia Kuantitatif, Edisi ke-6, Penerbit Erlangga Press, Jakarta
Vogel, 1994, Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro, Edisi kelima, Bagian 1, Penerjemah : Ir. L. Setiono, dkk, Penerbit PT. Kalman Media Pusaka, Jakarta
Von Burg, R. 1997. Nickel and Some Nickel Compounds. J. Appl. Toxicol Widowati, Wahyu, dkk. 2008. Efek Toksis Logam. Yogyakarta : Andi Yogyakata
LAMPIRAN 1
Penentuan Panjang Gelombang Maksimum dan pH Optimum dalam Pembentukan Senyawa Kompleks Ni(II)-PAR
1. Data hasil pengukuran panjang gelombang dan absorbansi senyawa kompleks Ni(II)-PAR dengan variasi pH 3-9
pH Ni(II)-PAR Panjang gelombang maksimum (nm) Absorbansi
3 533,00 0,151
4 522,20 0,412
5 519,60 0, 454
6 498,40 0,655
7 496,00 1,044
8 495,00 1,169
9 495,00 1,063
2. Gambar spektrum panjang gelombang senyawa kompleks Ni(II)-PAR dengan variasi pH 3-9
b. pH 4
d. pH 6
f. pH 8
LAMPIRAN 2
Penentuan Konsentrasi Optimum Reagen PAR
1. Data hasil pengukuran absorbansi senyawa kompleks Ni(II)-PAR dengan variasi konsentrasi PAR 0,005%-0,04%
Konsentrasi PAR (%) Absorbansi
0,005 0,675
1. Data hasil pengukuran absorbansi sensor kimia dengan penambahan ion-ion pengganggu pada perbandingan konsentrasi tertentu
a. Penambahan larutan Ni2+ terhadap larutan Fe3+
Larutan Ni
perbandingan konsentrasi Ni2+: Fe3+
b. Penambahan larutan Ni2+ terhadap larutan Pb2+
c. Penambahan larutan Ni2+ terhadap larutan Cr3+
Larutan Ni
perbandingan konsentrasi Ni2+: Pb2+
selektivitas Ni
2+dan Pb
2+0,5
d. Penambahan larutan Ni2+ terhadap larutan Zn2+
e. Penambahan larutan Ni2+ terhadap larutan Cu2+
Larutan Ni
perbandingan konsentrasi Ni2+: Zn2+
LAMPIRAN 4
Perbandingan dengan Metode Spektrofotometri
1. Data hasil pengukuran absorbansi senyawa kompleks Ni(II)-PAR
Konsentrasi Pb2+ (ppm)
Absorbansi pada replikasi ke- Absorbansi rata-rata
perbandingan konsentrasi Ni2+: Cu2+
y = 1,216. (0) + 0,026 y = 0,026
2. Kadar Ni2+ 0,2 ppm
y = 1,216 x + 0,026 y = 1,216. (0,2) + 0,026 y = 0,2692
3. Kadar Ni2+ 0,4 ppm
y = 1,216 x + 0,026 y = 1,216. (0,4) + 0,026 y = 0,5124
4. Kadar Ni2+ 0,6 ppm y = 1,216 x + 0,026 y = 1,216. (0,6) + 0,026 y = 0,7556
5. Kadar Ni2+ 0,8 ppm y = 1,216 x + 0,026 y = 1,216. (0,8) + 0,026 y = 0,9988
yLOD = 1,216 x + 0,026 0,1592= 1,216 x + 0,026 0,1332= 1,216 x
x = 0,1095 LOD = 0,1095
Jadi limit deteksi spektrofotometer UV-Vis sebesar 0,1095ppm. LAMPIRAN 6
Penentuan Akurasi
Persamaan regresi : y = 1,216x + 0,026 1. Konsentrasi Ni2+ 0,2 ppm
0,228 = 1,216x + 0,026 x = 0,166 ppm
%𝑟𝑒𝑐𝑜𝑣𝑒𝑟𝑦= 0,166
0,2 x 100%
%recovery = 83,06% 2. Konsentrasi Ni2+ 0,4 ppm
0,555 = 1,216x + 0,026 x = 0,435 ppm
%𝑟𝑒𝑐𝑜𝑣𝑒𝑟𝑦= 0,435
0,4 x 100%
%recovery = 108,75% 3. Konsentrasi Ni2+ 0,6 ppm