HALAMAN PERSEMBAHAN
“Mereka masih ada. Mungkin akan tetap begitu. Tapi aku terbiasa abaikan mereka. Dan mereka akan menyerah. Bukankah begitu juga dengan mimpi -mimpi buruk kita?”
/’Tapi mereka menghantuimu.’/ “Mereka masa laluku. Semua orang dihantui masa lalu.” Pembicaraan John Nash
(penderita schizophrenia pertama peraih nobel tahun 1994) dengan Hansen (rekan John Nash di Princeton University) dalam
film Beautifull Mind.
“Segala perkara dapat kutanggung di dalam Dia yang memberi kekuatan kepadaku”, Filipi 4:13
“Jika yang lebih baik bagimu - masih mungkin, mengapakah engkau berhenti pada yang cukup?” Disampaikan oleh
Mario Teguh dalam MT
Golden Point:
MENUNTUT = MEMINTA+ KESUNGGUHAN
“Rasa malas itu seharusnya
digunakan untuk membangun pribadi manusia yang lebih baik bukan semestinya untuk
menjatuhkan pribadi manusia, misal: malas membuang waktu yang menjauhkan kita dari tujuan
awal kita hidup,” D. L. Edhi Sambada (28 September 2010)
Skripsi ini aku persembahkan kepada:
Ibu, Bapak, keluarga besarku (Sastro Tinoyo dan Hadi Sumarto)
sebagai ungkapan rasa hormat dan baktiku,
perempuan yang membuat aku yakin analogi semesta ini tak terbatas,
KATA PENGANTAR
Puji dan syukur kepada Tuhan karena berkat rahmat dan anugerah-Nya penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Antioksidan Menggunakan Radikal 1,1-difenil-2-pikrilhidrazil (DPPH) dan Penetapan Kandungan Fenolik Total Fraksi Air Ekstrak Etanolik Daun Selasih (Ocimum Sanctum L.)” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam penelitian dan penyusunan skripsi ini penulis telah mendapat banyak bantuan dan dukungan dari berbagai pihak sehingga skripsi ini dapat terselesaikan dengan baik. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. C.J. Soegihardjo, Apt. sebagai Dosen Pembimbing yang telah membimbing penulis baik dalam penelitian maupun dalam penyusunan skripsi ini.
2. Yohanes Dwiatmaka, M.Si. sebagai Dosen Penguji atas pengarahan dan
kesediaannya menguji skripsi ini.
3. Lucia Wiwid Wijayanti, M.Si. sebagai Dosen Penguji atas pengarahan dan
kesediaannya menguji skripsi ini.
4. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma
5. Teman-teman dan sahabatku, Andy Kurniawan dan Yosafat Rubbyanto
Widodo, kelas B angkatan 2007, dan kelas FST A angkatan 2007, terima kasih atas bantuan dan kerjasamanya beserta segala suka duka yang telah dilewati bersama dalam penelitian ini.
6. Koleta Stefani Sarinastiti yang selalu mendoakan dan mendorong agar
skripsi ini cepat untuk diselesaikan.
7. Tim tenis Prambanan (Somatso), pemuda Karangnongko (SKS), dan Paroki
Kalasan, yang telah memberi dorongan agar skripsi ini cepat diselesaikan serta membantu penulis di saat ingin meluapkan emosi di lapangan tenis. 8. Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat
disebutkan satu-persatu.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna baik dalam hal isi, maupun bahasa. Oleh karena itu, saran dan kritik yang membangun sangat penulis harapkan untuk menyempurnakan skripsi ini. Akhir kata, penulis berharap semoga skripsi ini dapat bermanfaat dan menjadi sumbangan dalam perkembangan ilmu pengetahuan.
Yogyakarta, Januari 2011
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
KATA PENGANTAR ... vi
PERNYATAAN KEASLIAN KARYA ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xviii
INTISARI ... xix
ABSTRACT ... xx
BAB I PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah ... 4
C. Keaslian Penelitian ... 5
D. Manfaat Penelitian ... 6
BAB II PENELAAHAN PUSTAKA... 8
A. Selasih ... 8
1. Keterangan botani selasih (Ocimum sanctum Linn.) ... 8
2. Deskripsi ... 9
3. Kandungan kimia dan kegunaan selasih ... 9
B. Senyawa Fenolik ... 11
C. Antioksidan ... 16
1. Radikal bebas ... 16
2. Definisi antioksidan ... 17
3. Mekanisme antioksidan ... 18
4. Penggolongan antioksidan ... 19
5. Manfaat antioksidan ... 21
6. Metode pengujian aktivitas antioksidan ... 21
D. Metode DPPH ... 24
E. Ekstraksi ... 25
F. Kesahihan Metode Analisis... 30
G. Kesalahan dalam Metode Analisis ... 32
1. Kesalahan sistemik ... 33
2. Kesalahan tidak sistemik ... 34
H. Landasan Teori ... 34
BAB III METODOLOGI PENELITIAN... 37
A. Jenis dan Rancangan Penelitian ... 37
B. Variabel ... 37
1. Variabel bebas ... 37
2. Variabel tergantung ... 37
3. Variabel pengacau ... 37
C. Definisi Operasional ... 37
1. Ekstrak etanolik daun selasih ... 37
2. Fraksi air ... 37
3. Persen inhibitionconcentration (%IC) ... 37
4. Persen inhibition concentration 50 (IC50) ... 38
D. Bahan dan Alat Penelitian ... 38
1. Bahan penelitian ... 38
2. Alat penelitian ... 38
E. Tatacara Penelitian ... 39
1. Determinasi tumbuhan ... 39
2. Pengumpulan bahan ... 39
3. Preparasi sampel ... 39
4. Pembuatan larutan pembanding dan uji ... 40
5. Uji pendahuluan ... 40
7. Uji aktivitas antioksidan ... 42
8. Penetapan kandungan fenolik total ... 44
F. Analisis Hasil ... 46
BAB IV HASIL DAN PEMBAHASAN ... 48
A. Hasil Determinasi Tumbuhan ... 48
B. Hasil Pengumpulan Bahan ... 48
C. Hasil Preparasi Sampel ... 50
D. Hasil Uji Pendahuluan ... 56
1. Uji fenolik ... 56
2. Uji pendahuluan aktivitas antioksidan ... 57
E. Hasil Optimasi Metode Uji Antioksidan ... 58
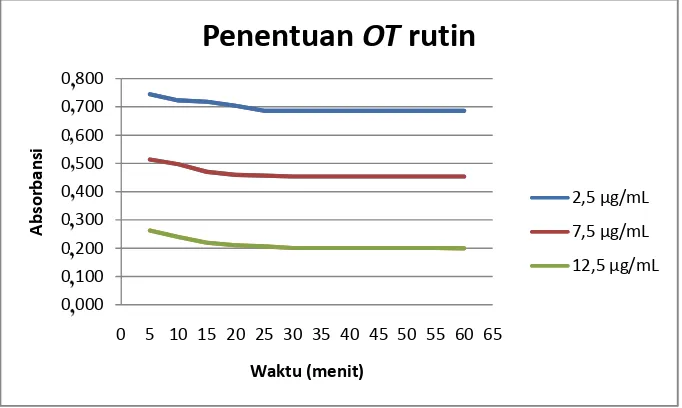
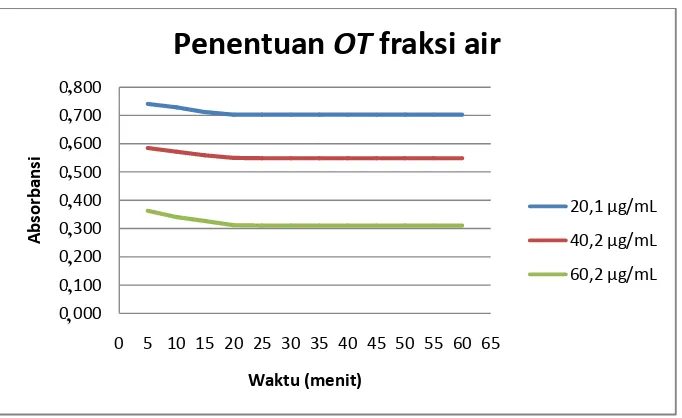
1. Penentuan OT metode uji aktivitas antioksidan ... 59
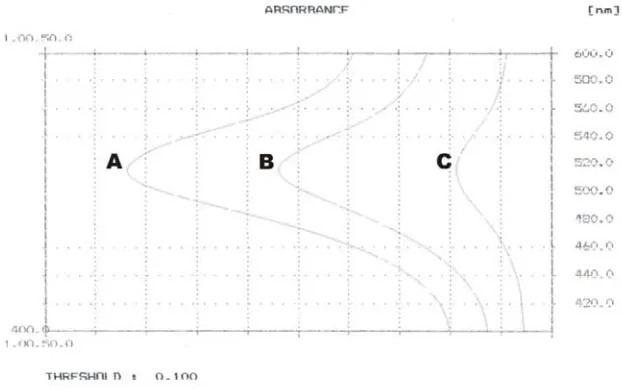
2. Penentuan λ maksimum metode uji aktivitas antioksidan ... 60
F. Hasil Validasi Metode Uji Aktivitas Antioksidan ... 62
1. Akurasi metode uji aktivitas antioksidan ... 64
2. Presisi metode uji aktivitas antioksidan ... 66
3. Linearitas metode uji aktivitas antioksidan ... 66
4. Spesifisitas metode uji aktivitas antioksidan ... 67
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH ... 67
H. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total ... 73
1. Penentuan OT penetapan kandungan fenolik total ... 73
I. Hasil Validasi Metode Penetapan Kandungan Fenolik Total ... 74
1. Akurasi penetapan kandungan fenolik total ... 75
2. Presisi penetapan kandungan fenolik total ... 76
3. Linearitas penetapan kandungan fenolik total... 77
4. Spesifisitas penetapan kandungan fenolik total ... 77
J. Hasil Estimasi Kandungan Fenolik Total ... 77
BAB V KESIMPULAN DAN SARAN ... 81
A. Kesimpulan ... 81
B. Saran ... 81
DAFTAR PUSTAKA ... 82
LAMPIRAN ... 89
DAFTAR TABEL
Halaman Tabel I. Mayoritas golongan senyawa fenolik pada tumbuhan (Mann,
et al., 1994) ... 12
Tabel II. Beberapa macam Reactive Oxygen Species (ROS) dan antioksidan yang menetralkannya (Percival, M., 1998) ... 17
Tabel III. Tingkat kekuatan antioksidan dengan metode DPPH ... 25
Tabel IV. Rentang akurasi yang masih dapat diterima... 31
Tabel V. Rentang KV yang masih dapat diterima ... 32
Tabel VI. Hasil %Recovery dan %CV uji aktivitas antioksidan rutin ... 65
Tabel VII. Hasil %Recovery dan %CV uji aktivitas antioksidan fraksi air ... 65
Tabel VIII. Hasil %IC rutin menggunakan radikal DPPH ... 69
Tabel IX. Hasil %IC fraksi air ekstrak etanolik daun selasih menggunakan radikal DPPH ... 69
Tabel X. Hasil nilai IC50 fraksi air ekstrak etanolik daun selasih dan rutin ... 70
Tabel XI. Penggolongan tingkat kekuatan antioksidan rutin dan fraksi air ekstrak etanolik daun selasih ... 72
DAFTAR GAMBAR
Halaman Gambar 1. Reaksi pembentukan dan penggabungan radikal fenoksil (a,
b, c, dan d adalah radikal fenoksil) (Bruneton, 1999) ... 13
Gambar 2. Oksidasi rutin (dos Santos, Mazo, dan Cavalheiro, 2008) ... 15
Gambar 3. Perubahan warna larutan pada reaksi radikal DPPH dengan antioksidan (Witt , Lalk, Hager, dan Voigt, 2010) ... 25
Gambar 4. Skema jalannya penelitian ... 47
Gambar 5. Hasil uji fenolik (A = kontrol negatif [blanko], B = kontrol positif [asam galat], dan C = larutan uji [fraksi air ekstrak etanolik daun selasih]) ... 57
Gambar 6. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol negatif, B = kontrol positif [rutin], dan C = larutan uji [fraksi air ekstrak etanolik daun selasih]) ... 57
Gambar 7. Grafik penentuan OT rutin ... 59
Gambar 8. Grafik penentuan OT fraksi air ... 60
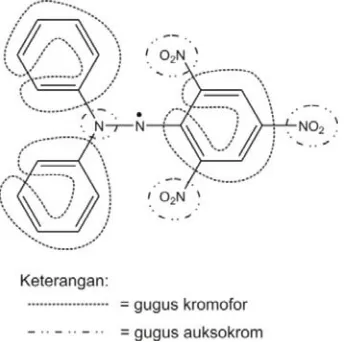
Gambar 9. Gugus kromofor dan auksokrom DPPH ... 61
Gambar 10. Spektra panjang gelombang maksimum DPPH pada tiga seri konsentrasi (keterangan: konsentrasi A = 0,080 mM; B = 0,048 mM; C = 0,016 mM)... 62
Gambar 12. Kurva persamaan regresi linear aktivitas antioksidan fraksi
air ekstrak etanolik daun selasih ... 64 Gambar 13. Struktur rutin (dos Santos, et al., 2008) ... 68 Gambar 14. Donasi proton senyawa antioksidan ke radikal DPPH
(Prakash, et al., 2010) ... 70 Gambar 15. Grafik penentuan OT penetapan kandungan fenolik total ... 73 Gambar 16. Spektra panjang gelombang maksimum senyawa berwarna
biru pada tiga seri konsentrasi asam galat (keterangan: konsentrasi asam galat A = 50 µg/mL; B = 100 µg/mL; C =
150 µg/mL) ... 74 Gambar 17. Kurva persamaan regresi linear antara konsentrasi asam
galat dengan absorbansi ... 75 Gambar 18. Struktur asam galat (Eslami, Pasanphan, Wagner, dan
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman selasih ... 89
Lampiran 2. Gambar tanaman selasih dari daerah goa Selarong (Yogyakarta) ... 90
Lampiran 3. Perhitungan rendemen ... 90
Lampiran 4. Data penimbangan bahan ... 91
Lampiran 5. Data perhitungan konsentrasi DPPH, larutan pembanding, dan larutan uji ... 92
Lampiran 6. Scanning pengkoreksi ... 94
Lampiran 7. Optimasi metode uji aktivitas antioksidan ... 99
Lampiran 8. Uji aktivitas antioksidan menggunakan radikal DPPH ... 101
Lampiran 9. Perhitungan nilai IC50 fraksi air ekstrak etanolik daun selasih dan rutin ... 102
Lampiran 10. Uji statistik aktivitas antioksidan dengan PASW Statistics 18 ... 103
Lampiran 11. Penimbangan untuk uji kandungan fenolik total ... 104
Lampiran 12. Optimasi penentuan kandungan fenolik total ... 104
INTISARI
Antioksidan merupakan senyawa yang menghambat reaksi oksidasi dengan mengikat radikal bebas. Akibatnya, kerusakan sel oleh radikal bebas dapat dihambat. Selasih diketahui memiliki senyawa fenolik. Senyawa tersebut beraktivitas antioksidan. Penelitian ini dilakukan untuk menentukan aktivitas antioksi dan serta kandungan fenolik total fraksi air ekstrak etanolik daun selasih. Pengujian aktivitas antioksidan menggunakan radikal 1,1-difenil-2-pikrilhidrazil (DPPH) dan dinyatakan dengan nilai Inhibition Concentration 50 (IC50).
Keberadaan senyawa beraktivitas antioksidan akan mengubah warna larutan DPPH dari ungu menjadi kuning. DPPH memiliki λ maksimum di 515,5 nm. Ketika elektronnya berpasangan oleh keberadaan senyawa antioksidan, maka absorbansinya menurun secara stokiometri sesuai jumlah elektron yang diambil. Kandungan fenolik total ditentukan dengan metode Folin-Ciocalteu dan dinyatakan dengan nilai massa ekuivalen asam galat (mg ekivalen asam galat per g fraksi air). Senyawa fenolik akan dioksidasi oleh pereaksi fenol Folin-Ciocalteu dalam suasana basa sehingga terbentuk larutan dengan warna biru. Larutan tersebut memiliki λ maksimum di 750 nm. Hasil penelitian menunjukkan bahwa fraksi air ekstrak etanolik daun selasih mempunyai aktivitas antioksidan kuat dengan nilai IC50 sebesar 50,93±0,76 µg/mL. Kandungan fenolik total sebesar
5,04±0,03 mg ekivalen asam galat per g fraksi air.
ABSTRACT
Antioxidants are compounds that inhibit oxidation reactions by binding free radicals. Consequently, cell damage by free radicals can be inhibited. Holy basil is known to have phenolic compounds. This research was conducted to determine the activity and content of phenolic antioxidants and total the water fraction from ethanolic extract of holy basil leaves. Tests for antioxidant activity using the radical DPPH, expressed as Inhibition Concentration 50 (IC50). The presence of antioxidant compound, will change colour of DPPH from purple to yellow. DPPH has a λ maximum at 515,5 nm. When the electron pairs by the presence of antioxidant compounds, the absorbance decreases as stochiometric. Total phenolics content determined by the Folin-Ciocalteu method, expressed as mg equivalent gallic acid per g of water fraction. Phenolics compound will oxidated by Folin-Ciocalteu reagent in alkaline conditions, formed blue solution. The solution has a maximum λ at 750 nm. The results showed that the water fraction from ethanolic extract of holy basil leaves have strong antioxidant activity with IC50 value of 50,93±0,76 µg/mL. Total phenolic content of 5,04±0,03
mg equivalent gallic acid per g water fraction.
Keywords: water fraction from ethanolic extract of Ocimum sanctum L. leaves, antioxidant, DPPH, total phenolic content
BAB I PENGANTAR
A. Latar Belakang
Tanpa disadari, dalam tubuh manusia terbentuk radikal bebas secara terus menerus, baik melalui proses metabolisme sel normal maupun akibat respon terhadap pengaruh dari luar tubuh, seperti paparan polusi lingkungan, ultraviolet, dan asap rokok. Radikal bebas adalah atom atau molekul yang memiliki elektron tidak berpasangan (unpaired electron). Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara menyerang dan mengikat elektron molekul sekitarnya misalnya protein, asam lemak tak jenuh, dan lipoprotein, serta unsur DNA termasuk karbohidrat. Dari molekul-molekul target tersebut, yang paling rentan terhadap serangan radikal bebas adalah asam lemak tak jenuh. Senyawa radikal bebas di dalam tubuh dapat merusak asam lemak tak jenuh ganda pada membran sel sehingga dinding sel menjadi rapuh, merusak basa DNA sehingga mengacaukan sistem genetika, dan berlanjut pada pembentukan sel kanker (Salganik, 2001; Winarsi, 2007). Selain itu radikal bebas dalam tubuh dapat memicu munculnya berbagai penyakit degeneratif, seperti kardiovaskuler, penuaan dini (Palmer dan Kitchin, 2010), dan osteoporosis akibat dari perusakan sel secara oksidatif (Winarsi, 2007).
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Dengan kata lain, antioksidan merupakan senyawa yang dapat
Akibatnya, kerusakan sel oleh radikal bebas dapat dihambat (Winarsi, 2007). Penambahan antioksidan ke dalam formulasi makanan juga efektif mengurangi oksidasi lemak yang menyebabkan ketengikan, toksisitas, dan destruksi biomolekul makanan (Decker, 1998).
Sumber antioksidan dapat berasal dari alam maupun hasil sintesis. Antioksidan alam seperti vitamin C, vitamin E, dan flavonoid terbukti aman dikonsumsi oleh manusia (Winarsi, 2007), sedangkan antioksidan sintesis seperti
butyl hydroxy anisol (BHA), propil galat (PG), tert-butyl hydroquinone (tBHQ) mempunyai efektivitas yang tinggi tetapi dapat menyebabkan kanker melalui mutasi pada DNA (Malkinson, 1999; Gharavi, Haggarty, dan El-Kadi, 2007). Hal inilah yang menyebabkan adanya penelitian eksplorasi sumber antioksidan alam yang berasal dari tumbuhan.
Kandungan senyawa fenolik selasih berupa eugenol, cirsilineol,
isothymusin, isothymonin, asam rosmarinat, orientin, dan vicenin. Akan tetapi tetap terdapat perbedaan komposisi maupun jumlah senyawa bioaktif dalam selasih sebagai akibat pembibitan pada daerah yang berbeda (Wangcharoen dan Morasuk, 2007 a). Dalam suatu penentuan aktivitas antioksidan telah diketahui bahwa senyawa yang menyebabkan aktivitas antioksidan berupa senyawa fenolik. Kesimpulan ini diperoleh karena terdapat hubungan yang langsung antara aktivitas antioksidan suatu tumbuhan dengan kandungan total fenoliknya (Aqil, Ahmad, dan Mehmood, 2006). Oleh karena adanya kandungan senyawa fenolik pada selasih, maka penelitian ini bertujuan untuk mengetahui aktivitas antioksidan dan kandungan total senyawa fenolik dari selasih.
fraksi etil asetat daun selasih yang kepolarannya lebih rendah daripada air sehingga peneliti ingin memperoleh informasi aktivitas antioksidan daun selasih dari fraksi yang lebih polar daripada etil asetat.
Metode yang digunakan untuk menentukan aktivitas antioksidan dalam penelitian ini adalah metode DPPH. Tujuan metode ini adalah untuk meneliti parameter konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan (IC50). Metode DPPH merupakan metode yang mudah, cepat, dan sensitif untuk
pengujian aktivitas antioksidan senyawa tertentu atau ekstrak tanaman (Koleva, van Beek, Linssen, de Groot, dan Evstatieva, 2002; Prakash, Rigelhof, dan Miller, 2010). Pada penentuan kandungan total fenolik digunakan metode Folin-Ciocalteau. Metode ini umum digunakan sebagai standar penentuan kandungan fenolik total setara massa ekivalen asam galat pada uji aktivitas aktivitas antioksidan sumber tumbuhan (Aqil, et al., 2006).
B. Perumusan Masalah
1. Berapakah nilai aktivitas antioksidan fraksi air ekstrak etanolik daun selasih
dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50?
C. Keaslian Penelitian
Sejauh pengamatan penulis, penelitian tentang uji aktivitas antioksidan menggunakan radikal DPPH dan penetapan kandungan fenolik total daun selasih (Ocimum sanctum L.) pernah dilakukan oleh:
1. Aqil, et al., 2006, dengan judul “Antioxidant and Free Radical Scavenging Properties of Twelve Traditionally Used Indian Medicinal.” Penelitian ini menggunakan daun selasih dalam bentuk serbuk kering untuk diekstrak dengan metanol 98%. Ekstrak metanolik inilah yang kemudian dijadikan bahan uji.
2. Wangcharoen dan Morasuk, 2007 a, dengan judul “Antioxidant Capacity
and Phenolic Content of Holy Basil.” Penelitian ini menggunakan daun selasih dari pasar di Chiangmai (Thailand) dan diolah menjadi ekstrak etanolik (60%) dari daun selasih sebagai bahan ujinya.
3. Wangcharoen dan Morasuk, 2007 b, dengan judul “Antioxidant Capacity
and Phenolic Content of Some Thai Culinary Plants.” Penelitian ini menggunakan ekstrak etanolik (18%, 36%, 57%, 76%, dan 95%) daun selasih sebagai bahan ujinya.
4. Veeru, Kishor, dan Meenakshi, 2009, “Screening of Medicinal Plant
5. Widodo, 2011, dengan judul “Uji Aktivitas Antioksidan Menggunakan
Radikal 1,1-Difenil-2-Pikrilhidrazil (DPPH) dan Penetapan Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Etanolik Daun Selasih (Ocimum sanctum L.).” Penelitian ini menguji fraksi etil asetat ekstrak etanolik daun selasih.
Perbedaan antara penelitian ini dengan penelitian sebelumnya adalah bahwa pada penelitian ini daun selasih dipanen dari daerah Goa Selarong, Yogyakarta (RT 1/RW 3 Pedukuhan Kentolan Lor, Kelurahan Gowasari, Kecamatan Pajangan, Kabupaten Bantul) dan dalam keadaan segar diolah untuk didapatkan fraksi air ekstrak etanolik (76%) daun selasih kemudian diuji aktivitas antioksidan menggunakan radikal DPPH dan ditetapkan kandungan fenolik totalnya.
D. Manfaat Penelitian 1. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan sumbangan pada perkembangan ilmu pengetahuan dalam bidang farmasi, khususnya tentang aktivitas antioksidan fraksi air ekstrak etanolik daun selasih dengan menggunakan radikal DPPH dan kandungan fenolik total fraksi air ekstrak etanolik daun selasih. 2. Manfaat praktis
E. Tujuan Penelitian 1. Tujuan umum
Tujuan umum penelitian ini adalah menguji aktivitas antioksidan menggunakan radikal bebas DPPH dan menetapkan kandungan fenolik total fraksi air ekstrak etanolik daun selasih.
2. Tujuan khusus
a. Mengetahui nilai aktivitas antioksidan fraksi air ekstrak etanolik daun
selasih dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50.
BAB II
PENELAAHAN PUSTAKA
A.Selasih
1. Keterangan botani selasih (Ocimum sanctum Linn.)
Tumbuhan selasih termasuk dalam familia Lamiaceae (Kartesz, 2010). Sinonim: O. tenuiflorum L., Geniosporum tenuiflorum (L.) Merr.
Moschosma tenuiflorum (L.) Heynhold, Ocimum album Blanco, O. anisodorum
Muell., O. brachiatum sensu Hasskarl (non Blume), O. flexuosum sensu Blanco,
O. frutescens sensu Burm. f. (non L.), O. gratissimum sensu Lour (non L.), O. hirsutum Benth., O. inodorum. Burm. f., O. monachorum L., O. nelsonii, Zipp ex Span., O. sanctum L. var. hirsute (Benth.) Hook.f., O. villosum Roxb., O. virgatum Blanco , O. virgatum, O. tomentosum Lam., Lumnitzera tenuiflora (L.) Spreng., Plectranthus monachorum (L.) Spreng., P. striatus sensu Meschler et Hosseus. (non Benth.) (Anton, et al., 2009).
Nama daerah: Sumatera: selaseh. Jawa: telasih, solasih, atau selasih. Sulawesi: kukuru atau amping (Wijayakusuma, 2005).
Common name: Inggris: holy basil, sacred basil, monks basil, Perancis:
basilic sacré, basilica thailandais, Jerman: heiliges basilikum, königsbasilikum,
2. Deskripsi
Selasih merupakan tanaman semusim yang tumbuh tegak, bercabang banyak dibagian atas dan berbau harum. Batang tumbuhan ini berwarna kecoklatan, bersegi empat. Daunnya tunggal, letaknya berhadapan, bertangkai yang panjangnya 0,5-2 cm. Helai daunnya berbentuk bulat telur sampai memanjang, permukaan daunnya berambut halus dengan bintil-bintil kelonjar, tulang daunnya menyirip, tepi daunnya bergerigi, panjangnya 3,5-7,5 cm dan lebar 1,5-2,5 cm, warnanya hijau tua. Bunganya berwarna putih atau lembayung, tersusun dalam tandan yang panjangnya 5-30 cm, keluar diujung percabangan. Bijinya keras, berwarna coklat tua, dan bila dimasukkan ke dalam air akan mengembang seperti selai. Tinggi tumbuhan itu mencapai 50-80 cm, tumbuh baik di tempat yang lembab dan teduh. Selasih tumbuh liar di tepi-tepi jalan, sawah kering, hutan jati, dan tepi ladang atau dapat juga ditanam di pekarangan rumah. Tumbuhan ini dapat ditemukan di daerah dataran rendah sampai ketinggian 450 meter, kadang-kadang ditanam sampai 1.100 meter diatas permukaan laut (Wijayakusuma, 2005).
3. Kandungan kimia dan kegunaan selasih
Selasih telah lama digunakan oleh masyarakat Indonesia sebagai bahan campuran minuman yang bersifat menenangkan (Solikhah, 2007).
Aktivitas antioksidan dari komponen dalam selasih merupakan alasan utama kenapa selasih mempunyai aktivitas farmakologi. Senyawa fenolik yang terdapat dalam selasih adalah fenolik berupa eugenol, cirsilineol, isothymusin,
terkandung zinc yang dapat berperan juga sebagai antioksidan yang berasal dari mineral. Bagaimanapun juga wajar bila terdapat perbedaan komposisi maupun kandungan senyawa bioaktif dalam selasih sebagai akibat pembibitan pada daerah yang berbeda (Wangcharoen dan Morasuk, 2007 a). Laporan penelitian Aqil, et al, (2006) bahwa yang bertanggung jawab atas aktivitas antioksidan ekstrak metanol daun selasih adalah senyawa fenol, glikosida, dan saponin. Ramesh dan Satakopan (2010), melaporkan bahwa dalam ekstrak 50% hidroalkoholik daun selasih mengandung alkaloid, flavonoid, saponin, glikosida, fenol, tanin, senyawa thiol, dan terpenoid.
Selasih juga memiliki kandungan asam ursolat yang memiliki peran sebagai antiinflamasi dan anti tumor (Aggarwal, Danda, dan Bokyung, 2008). Tumbuhan ini telah lama digunakan orang-orang di benua Asia dalam pengobatan tradisional, misalnya untuk mengobati penyakit maag, diare, sakit kepala, dan batuk (Wangcharoen dan Morasuk, 2007 a).
diminimalkan dengan senyawa adaptogen atau antioksidan (Kenjale, Shah, dan Sathaye, 2007).
Wangcharoen dan Morasuk (2007a) melaporkan bahwa kandungan fenolik total fraksi air ekstrak etanolik (57%) daun selasih sebesar 12,60±1,02 mg untuk selasih putih dan 19,46±1,97 mg untuk selasih merah ekivalen asam galat per g fraksi air.
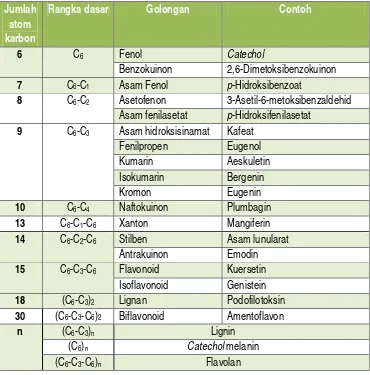
B.Senyawa Fenolik
Tabel I. Mayoritas golongan senyawa fenolik pada tumbuhan (Mann, et al.,
8 C6-C2 Asetofenon 3-Asetil-6-metoksibenzaldehid
Asam fenilasetat p-Hidroksifenilasetat
9 C6-C3 Asam hidroksisinamat Kafeat
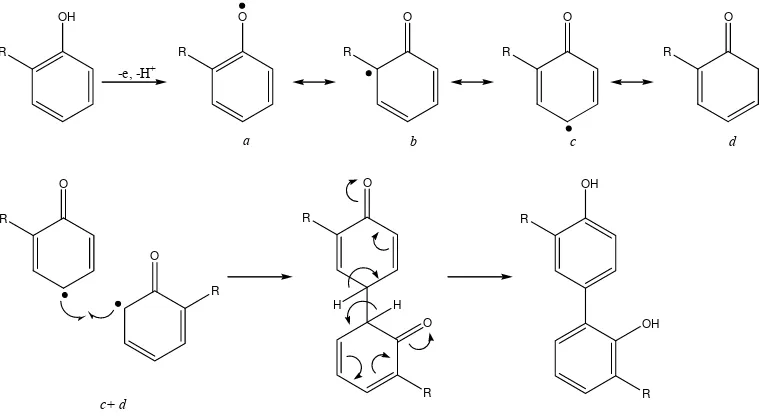
Senyawa fenolik merupakan sumber antioksidan alami yang aman digunakan sehingga menjadi senyawa bioaktif dari suatu tumbuhan. Oleh karena itu, perhatian peneliti telah tertuju pada identifikasi tumbuhan yang memiliki aktivitas antioksidan yang dapat digunakan untuk konsumsi manusia sehari-hari (Ebrahimzadeh, Pourmorad, dan Hafezi, 2007). Aktivitas antioksidan dari senyawa fenolik didapatkan dengan cara mereduksi radikal untuk tidak terjadinya reaksi samping yang merugikan. Mekanismenya melalui kemampuan gugus fenol menangkap radikal bebas dengan memberikan atom hidrogennya melalui proses transfer elektron, sehingga senyawa fenolik berubah menjadi radikal fenoksil. Radikal fenoksil ini terstabilkan oleh adanya efek resonansi (Bruneton, 1999; Marxen, Vanselow, Lippemeier, Hintze, Ruser, dan Hansen, 2007).
R
Sifat kimiawi dari senyawa fenolik alam sangat rumit. Faktanya sebagian besar senyawa tersebut berbentuk konjugat dalam tumbuhan, prinsip konjugasinya dengan residu gula yang terhubung dengan satu atau lebih senyawa fenolik. Mayoritas senyawa fenolik dapat diekstraksi dengan metanol atau kloroform (Mann, et al., 1994). Golongan yang terbanyak dari senyawa fenolik adalah flavonoid. Karena mempunyai sejumlah gugus hidroksil yang tak tersulih, atau suatu gula, flavonoid merupakan senyawa polar. Pada umumnya flavonoid larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, air, dan lain-lain. Adanya gula yang terikat pada flavonoid (bentuk umum yang ditemukan) cenderung menyebabkan flavonoid lebih mudah larut dalam air dan dengan demikian campuran pelarut di atas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavon, dan flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
Contoh senyawa fenolik yang sering diteliti adalah rutin dan asam galat. Rutin sering digunakan sebagai pembanding aktivitas antioksidan bahan tumbuhan karena telah banyak diteliti tentang aktivitas antioksidannya (Armala, 2009; Sunardi, 2007).
Gambar 2. Oksidasi rutin (dos Santos, Mazo, dan Cavalheiro, 2008)
Sedangkan asam galat sering digunakan dalam berbagai jurnal ilmiah pengujian kandungan fenolik total sebagai ekivalen terhadap kandungan fenolik total bahan tumbuhan yang diuji (Javanmardi, Stushnoff, Locke, dan Vivanco, 2003; Wangcharoen dan Morasuk, 2007 a&b; Dehpour, et al., 2009; Inglett, Rose, Chen, Stevenson, dan Biswas, 2009; Veeru, et al., 2009).
Rutin (3’,4’,5,7-tetrahidroksiflavon-3β–D-rutinosida) atau vitamin P merupakan senyawa fenolik yang tergolong dalam flavonoid. Gugus O-dihidroksi pada cincin B, diasosiasikan dengan aktivitas antioksidan rutin (Lopez, Martinez, Del-Valle, Ferrit, dan Luque, 2003). Rutin diaplikasikan untuk mengobati tekanan
darah tinggi dan penyakit yang berkaitan dengan vaskuler (dos Santos, et al., 2008). Nilai IC50 rutin dari penelitian aktivitas antioksidan yang dilakukan oleh
Armala (2009) sebesar 7,909 µg/mL, sedangkan oleh Sunardi (2007) sebesar 7,000 µg/mL. Semakin kecil nilai IC50 suatu bahan uji maka semakin efektif
bahan uji tersebut berperan sebagai antioksidan. Penelitian aktivitas antioksidan yang dilakukan Wangcharoen dan Morasuk (2007a) dengan bahan uji berupa ekstrak etanolik (60%) dari daun selasih, IC50 sebesar 554±17 µg/mL untuk
selasih putih dan 333±13 µg/mL untuk selasih merah.
Asam galat (asam 3,4,5-trihidroksibenzoat) merupakan senyawa fenolik yang bukan tergolong dalam flavonoid, secara luas tersebar dan terdapat dalam berbagai macam tumbuhan. Asam galat termasuk antioksidan alami yang sering digunakan sebagai pengawet makanan. Gugus fungsi dalam struktur asam galat yang bertanggungjawab memberikan aktivitas antioksidan adalah 3 gugus hidroksil (Lopez, et al., 2003).
C.Antioksidan 1. Radikal bebas
Senyawa radikal bebas di dalam tubuh dapat merusak asam lemak tak jenuh ganda pada membran sel sehingga dinding sel menjadi rapuh, merusak basa DNA sehingga mengacaukan sistem genetika, dan berlanjut pada pembentukan sel kanker (Winarsi, 2007).
Tabel II. Beberapa macam Reactive Oxygen Species (ROS) dan antioksidan yang menetralkannya (Percival, 1998)
ROS Neutralizing Antioxidants
Radikal Hidroksil Vitamin C, glutation, flavonoid, asam lipoat
Radikal Superoksida Vitamin C, glutation, flavonoid, superoksida dismutase
Peroksida Hidrogen Vitamin C, glutation, flavonoid, beta karoten, vitamin E, asam lipoat
Peroksida Lipid Vitamin E, beta karoten, ubikuinon, flavonoid, glutation peroksidase
Kemiripan sifat antara radikal bebas dan oksidan terletak pada agresivitas untuk menarik elektron di sekelilingnya. Berdasarkan sifat ini, radikal bebas dianggap sama dengan oksidan. Tetapi perlu diketahui, bahwa tidak setiap oksidan merupakan radikal bebas. Radikal bebas lebih berbahaya dibandingkan dengan senyawa oksidan non-radikal (Winarsi, 2007).
2. Definisi antioksidan
Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas. Akibatnya kerusakan sel dapat dihambat (Winarsi, 2007).
Kebanyakan senyawa ini (misalnya tokoferol) digunakan sebagai pengawet dalam berbagai produk (misalnya dalam lemak, minyak dan produk makanan untuk menunda ketengikan dan perubahan-perubahan yang tidak diinginkan, dalam karet untuk menunda oksidasi). Pengertian antioksidan yang lebih relevan secara biologis ialah senyawa alami atau sintetik yang ditambahkan ke dalam produk untuk mencegah atau menunda kerusakan yang disebabkan oleh udara (Huang, Ou, dan Prior, 2005).
3. Mekanisme antioksidan
Secara garis besar, mekanisme penangkapan radikal bebas dapat dibedakan menjadi dua macam, yaitu secara enzimatik dan non-enzimatik. Enzim yang dapat berperan sebagai antioksidan adalah superoksida dismutase, katalase, glutation peroksidase, dan glutation reduktase (Winarsi, 2007).
Secara non-enzimatik, senyawa antioksidan bekerja melalui empat cara, yaitu sebagai berikut:
a. penangkap radikal bebas, misalnya vitamin C dan vitamin E, b. pengkelat logam transisi, misalnya EDTA,
c. inhibitor enzim oksidatif, misalnya aspirin dan ibuprofen, dan
d. kofaktor enzim antioksidan, misalnya selenium sebagai kofaktor glutation
Aktivitas senyawa polifenol sebagai antioksidan meliputi tiga mekanisme sebagai berikut.
(a) Aktivitas penangkapan radikal seperti reactive oxygen species (ROS)
ataupun radikal yang dihasilkan dari peroksidasi lipid seperti R’, RO’ dan ROO’ dengan proses transfer elektron melalui atom hidrogen,
(b) mencegah spesies senyawa reaktif produksi katalisis transisi metal seperti
reaksi melalui khelasi metal, dan
(c) interaksi dengan antioksidan lainnya, seperti lokalisasi dan penggabungan
dengan antioksidan lainnya (Niki dan Noguchi, 2000; Winarsi, 2007; Pereira, Valentão, Pereira, dan Andrade, 2009).
4. Penggolongan antioksidan
Menurut sumbernya, antioksidan dapat digolongkan menjadi dua macam, yaitu antioksidan sintetik dan alami (Gulcin, Uguz, Oktay, Beydemir, dan Kufrevioglu, 2004).
a. Antioksidan sintetik
Haggarty, dan El-Kadi, 2007). Peters, Rivera, Jones, Monks, dan Lau pada tahun 1996 melaporkan bahwa antioksidan sintetik, yaitu tBHQ dan 3-tert-butyl-4-hydroxyanisole dapat mempromosi karsinogenesis renal dan kandung kemih pada tikus. Walaupun dalam penelitian tersebut tidak diketahui secara pasti mekanisme karsinogenesisnya. Begitu pula dengan BHA dan BHT, dalam konsentrasi tinggi dan penggunaan yang lama, BHA dapat menginduksi tumor pada perut hewan uji sedangkan BHT dapat menginduksi tumor pada liver hewan uji. Semua publikasi juga setuju dengan fakta tersebut. Lain halnya vitamin E yang merupakan antioksidan alami tidak memiliki sifat karsinogenik (Parke dan Lewis, 1992; Kahl dan Kappus, 1993). BHT yang diadministrasikan secara kronis terhadap mencit menyebabkan menurunnya konsentrasi alpha isozyme of protein kinase C (PKCa) dalam paru-paru sehingga dapat menginisiasi terjadinya tumor (Kahl, 1984; dan Malkinson, 1999).
b. Antioksidan alami
Antioksidan alami merupakan antioksidan yang diproduksi langsung oleh tanaman maupun tubuh, contohnya: senyawa polifenol flavonoid, tanin, katalase dan glutation peroksidase bekerja dengan cara mengubah H2O2 menjadi H2O dan
O2, sedangkan superoksid dismutase bekerja dengan cara mengkatalisis reaksi
5. Manfaat antioksidan
Antioksidan bermanfaat dalam mencegah kerusakan oksidatif yang disebabkan radikal bebas dan ROS sehingga mencegah terjadinya berbagai macam penyakit seperti penyakit kardiovaskuler, jantung koroner (Ames, 1983; Mbata, 2010), kanker (Salganik, 2001) serta penuaan dini (Palmer dan Kitchin, 2010). Penambahan antioksidan ke dalam formulasi makanan, juga efektif mengurangi oksidasi lemak yang menyebabkan ketengikan, toksisitas, dan destruksi biomolekul yang ada dalam makanan (Decker, 1998).
6. Metode pengujian aktivitas antioksidan
Terdapat beberapa metode pengujian aktivitas antioksidan baik secara kualitatif maupun secara kuantitatif. Uji kualitatif untuk mengetahui apakah suatu senyawa memiliki aktivitas antioksidan dapat dilakukan dengan metode kromatografi baik kromatografi lapis tipis atau kromatografi kertas. Metode ini dapat untuk memisahkan campuran antioksidan yang kompleks sekalipun. Pereaksi semprot yang digunakan untuk deteksi dapat dibedakan menjadi empat kelompok, yaitu sebagai berikut.
(a) Senyawa-senyawa yang dapat membentuk warna ketika tereduksi (kalium permanganat, ferri-sianida, ferri-dipiridil, dan asam fosfomolibdat);
(c) radikal bebas stabil yang menerima radikal hidrogen dari antioksidan
(1,1-difenil-2-pikrilhidrazil); dan
(d) senyawa-senyawa yang membentuk senyawa adisi yang berwarna
(palladium klorida dan pentadium klorida) (Davidek, 1997).
Pada tahun 2005, Shivaprasad, Mohan, Kharya, Shiradkar, dan Lakshman melaporkan bahwa uji aktivitas antioksidan dapat dilakukan secara spektrofotometri. Uji tersebut dilakukan secara in-vitro.
i. Metode conjugated diene
Metode ini mengukur absorbansi konjugasi dari diena sebagai hasil dari oksidasi asam lemak tak jenuh pada panjang gelombang UV 234 nm. Prinsip metode ini adalah selama oksidasi asam linoleat, ikatan rangkap terkonversi ke bentuk ikatan rangkap terkonjugasi, yang dikarakterisasi dengan absorpsi kuat pada panjang gelombang UV 234 nm. Aktivitasnya diekspresikan dengan istilah
inhibitory concentration (IC50).
ii. Metode penangkapan radikal hidroksil
Kapasitas penangkapan radikal hidroksil dari suatu ekstrak berhubungan langsung dengan aktivitas antioksidannya. Metode ini memerlukan generation in-vitro dari radikal hidroksil menggunakan Fe3+/ascorbate/EDTA/H2O2
kuning dengan reagen Nash (2M ammonium asetat dengan 0,05M asam asetat dan 0,02M asetil aseton dalam air destilasi). Intensitas warna kuning diukur secara spektrofotometri pada panjang gelombang 412 nm. Aktivitas antioksidan diekspresikan dengan %penangkapan radikal hidroksil.
iii. Metode Ferric Reducing Ability of Plasma (FRAP)
Aktivitas antioksidan diestimasi dengan mengukur peningkatan absorbansi dari pembentukan ion-ion fero dari reagen FRAP yang mengandung 2,4,6- tri(2-piridil)-s-triazin (TPTZ) dan FeCl3.6H2O. Absorbansi diukur secara
spektrofotometri pada 595nm.
iv. Metode Trapping Antioxidant Parameter (TRAP)
Metode ini didefinisikan sebagai pengukuran parameter total radikal yang terjebak antioksidan. Fluororesen dari R-phycoerythrin yang dipadamkan oleh 2,2’-azo-bis (2-amidino-propan) hidroklorida (ABAP) sebagai generator radikal. Reaksi pemadaman ini diukur sebagai adanya aktivitas antioksidan (Shivaprasad,
et al., 2005).
D.Metode DPPH
Metode yang paling sering digunakan untuk menguji aktivitas antioksidan tanaman obat adalah metode uji dengan menggunakan radikal bebas DPPH (Shivaprasad, et al., 2005). Tujuan metode ini adalah mengetahui parameter konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan (IC50).
Hal ini dapat dicapai dengan cara menginterpretasikan data eksperimental dari metode tersebut (Molyneux, 2004). DPPH merupakan radikal bebas yang dapat bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen, dapat berguna untuk pengujian aktivitas antioksidan komponen tertentu dalam suatu ekstrak (Dinis, Maderia, dan Almeida, 1994).
Karena adanya elektron yang tidak berpasangan, DPPH memberikan serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh keberadaan penangkap radikal bebas, maka absorbansinya menurun secara stokiometri sesuai jumlah elektron yang diambil. Keberadaan senyawa antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009). Perubahan absorbansi akibat reaksi ini telah digunakan secara luas untuk menguji kemampuan beberapa molekul sebagai penangkap radikal bebas (Dinis, et al., 1994).
Gambar 3. Perubahan warna larutan pada reaksi radikal DPPH dengan antioksidan (Witt, Lalk, Hager, dan Voigt, 2010)
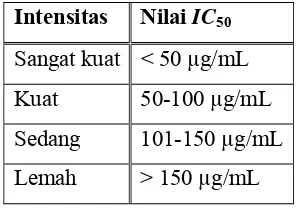
Menurut Ariyanto cit. Armala (2009), tingkat kekuatan antioksidan senyawa uji menggunakan metode DPPH dapat digolongkan menurut nilai IC50
(Tabel III).
Tabel III. Tingkat kekuatan antioksidan dengan metode DPPH Intensitas Nilai IC50
Sangat kuat < 50 µg/mL
Kuat 50-100 µg/mL
E.Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan cara mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, selanjutnya pelarut diuapkan sampai semua atau hampir semua pelarut menguap (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995).
Penyarian atau ekstraksi merupakan suatu peristiwa perpindahan massa zat aktif yang semula berada di dalam sel kemudian ditarik oleh cairan penyari sehingga zat aktif larut dalam cairan penyari. Pada umumnya penyarian akan bertambah baik jika permukaan simplisia yang bersentuhan dengan penyari semakin luas (Harborne, 1987).
Dalam memilih cairan penyari, seseorang harus mempertimbangkan banyak faktor. Cairan penyari yang baik harus memenuhi kriteria berikut ini.
(1) Murah dan mudah diperoleh, (2) stabil secara fisika dan kimia, (3) bereaksi netral,
(4) tidak mudah menguap dan tidak mudah terbakar, (5) selektif,
(6) tidak mempengaruhi zat berkhasiat, dan
(7) diperbolehkan oleh peraturan yang berlaku (Anonim, 1986).
mungkin masih tetap dapat memberikan hasil yang memuaskan. Tetapi, dalam bahan tumbuhan yang sudah lama, ada kecenderungan glikosida diubah menjadi aglikon karena pengaruh fungi, dan aglikon yang peka menjadi teroksidasi. Bila menggunakan bahan tumbuhan segar, setelah cuplikan dipilih sebagai tanda bukti, disarankan untuk mengeringkan sisanya cepat-cepat (untuk mencegah kerja enzim). Seringkali merupakan tindakan yang bijaksana bila kita mengekstraksi cuplikan bahan tumbuhan yang belum dikeringkan untuk kemudian dipakai pada pemeriksaan secara kromatografi untuk melihat apakah proses pengeringan mengubah susunan flavonoid atau tidak (Markham, 1988).
Metode penyarian yang digunakan tergantung dari wujud dan kandungan zat dari bahan yang akan disari. Cara penyarian dapat dibedakan menjadi: infundasi, maserasi, perkolasi, dan penyarian berkesinambungan (Anonim, 1986).
Infundasi merupakan proses penyarian yang umumnya digunakan untuk menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati. Sari yang dihasilkan tidak stabil dan mudah tercemari oleh kapang dan kuman. Oleh karena itu, sari yang diperoleh dengan cara ini tidak boleh disimpan lebih dari 24 jam. Infundasi dibuat dengan cara menyari simplisia dengan air pada suhu 900C selama 15 menit (Anonim, 1986).
sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Dapat dilakukan modifikasi terhadap teknik maserasi, misalnya teknik remaserasi. Pada teknik ini, cairan dibagi menjadi dua kemudian seluruh serbuk simplisia dimaserasi dengan cairan penyari pertama, sesudah dienaptuangkan dan diperas, ampas dimaserasi lagi dengan cairan penyari kedua (Anonim, 1986).
Perkolasi merupakan cara penyarian yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia yang telah terbasahi. Cairan penyari akan mengalir dari atas ke bawah melalui serbuk kemudian cairan akan melarutkan zat aktif di dalam sel yang dilalui sampai mencapai keadaan jenuh. Serbuk simplisia yang akan diperkolasi dibasahi terlebih dahulu dengan cairan penyari kemudian dimasukkan sedikit demi sedikit ke dalam alat perkolasi (perkolator) sambil tiap kali ditekan. Serbuk kemudian ditutup dengan kertas saring dan cairan penyari dialirkan hingga di atas permukaan serbuk masih terdapat lapisan penyari. Setelah 24 jam, kran dibuka dan diatur hingga kecepatan tetesannya adalah 1 mL permenit. Akhir proses perkolasi ditentukan dengan pemeriksaan zat secara kualitatif pada perkolat terakhir (Anonim, 1986).
waktu yang lama dan penggunaannya dibatasi untuk zat-zat yang tahan terhadap pemanasan (Voigt, 1995).
Ekstraksi cair-cair merupakan suatu teknik dimana suatu larutan (biasanya air) dibuat bersentuhan dengan suatu pelarut kedua (biasanya pelarut organik), sehingga menimbulkan perpindahan satu atau lebih zat terlarut ke dalam pelarut yang kedua. Pada prinsipnya, kedua pelarut yang digunakan tidak saling tercampurkan. Metode ektrasksi cairan-cairan yang sering digunakan adalah menggunakan alat corong pisah, dimana kedua pelarut yang tidak saling campur dimasukkan ke dalam corong pisah dan dilakukan penggojogan selama beberapa menit (Bassett, Denney, Jeffery, dan Mendham, 1991).
Keefektifan dari proses ekstraksi ini dinyatakan dalam suatu tetapan yang dikenal dengan nama koefisien distribusi (KD). Menurut Nernst, KD dapat dinyatakan sebagai rasio antara konsentrasi zat terlarut dalam pelarut pertama dan konsentrasi zat terlarut dalam pelarut kedua, dengan syarat bahwa keadaan molekulnya sama dalam kedua cairan dan temperaturnya adalah konstan (Bassett,
et al., 1991).
Hal ini sesuai dengan rumus:
dimana D adalah koefisien distribusi antara dua pelarut, adalah bobot zat yang
tertinggal pada pelarut 1, adalah bobot zat yang terlarut pada pelarut 1, V adalah volume pelarut 1, dan v adalah volume pelarut 2, serta n adalah banyaknya ekstraksi yang dilakukan (n kali). Dari rumus tersebut, apabila jumlah ekstraksi semakin banyak (nilai n semakin besar) maka nilai akan semakin kecil. Dengan kata lain, bobot zat yang tertinggal pada pelarut 1 semakin kecil dan zat lebih banyak yang tersari ke pelarut 2, yang artinya proses ekstraksi lebih efektif bila dibandingkan dengan satu ekstraksi tunggal (Bassett, et al., 1991).
F. Kesahihan Metode Analisis
Akurasi metode analisis adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kriteria kecermatan sangat bergantung kepada konsentrasi analit dalam matriks sampel dan pada keseksamaan metode (RSD) (Harmita, 2004). Untuk penelitian bioanalisis %recovery yang baik berkisar 80-120% (Mulja dan Hanwar, 2003).
Tabel IV. Rentang akurasi yang masih dapat diterima Analit pada matrik
Presisi adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2004).
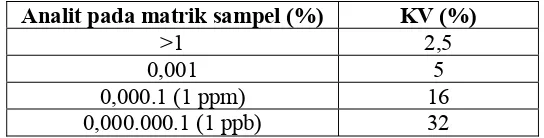
dari seri-seri pengukuran. Ripitabilitas merupakan presisi di bawah kondisi operasional dalam periode waktu yang singkat (International Conference On Harmonisation Expert Working Group, 2005).
Tabel V. Rentang KV yang masih dapat diterima Analit pada matrik sampel (%) KV (%)
>1 2,5 0,001 5
0,000.1 (1 ppm) 16
0,000.000.1 (1 ppb) 32
(Harmita, 2004).
Linearitas dari suatu prosedur analisis merupakan kemampuannya (pada rentang tertentu) untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel. Persyaratan data linearitas yang bisa diterima jika memenuhi nilai koefisien korelasi (r) > 0,999 (Mulja dan Suharman, 1995). Spesifisitas merupakan kemampuan suatu metode untuk mengukur dengan akurat respon analit diantara seluruh komponen sampel potensial yang mungkin ada dalam matriks sampel (Mulja dan Hanwar, 2003).
G. Kesalahan dalam Metode Analisis
1. Kesalahan sistemik
Kesalahan sistemik adalah hasil analisis yang menyimpang secara tetap dari harga kadar yang sebenarnya karena proses pelaksanaan prosedur analisis, sehingga kesalahan ini disebut juga kesalahan prosedur (Mulja dan Suharman, 1995).
Kesalahan sistematik dapat disebabkan oleh beberapa faktor, yaitu sebagai berikut.
(a) Kesalahan personil dan operasi. Kesalahan ini disebabkan oleh cara
pelaksanaan analisis, bukan karena metode. Kesalahan operasi umumnya bersifat fisis (bukan khemis), misalnya kesalahan pengamatan visual pada titik akhir titrasi, kekeliruan cara pencucian endapan, dan sebagainya. Jadi kesalahan ini bersifat individual dan sangat dipengaruhi oleh ketrampilan analis dalam melakukan pekerjaan analisis.
(b) Kesalahan alat dan pereaksi. Kesalahan ini disebabkan oleh pereaksi yang
kurang murni, alat yang kurang valid atau pemakaian alat yang kurang tepat walaupun alatnya sendiri baik, contohnya pengambilan volume tepat dengan pipet ukur atau gelas ukur, penggunaan buret 50 mL (buret makro) untuk analisis mikro, dan sebagainya.
(c) Kesalahan metode analisis. Kesalahan ini dapat disebabkan oleh kesalahan
Kesalahan sistematik dapat dihindari atau diperkecil dengan cara sebagai berikut.
(a) Mengkalibrasi instrument dan melakukan koreksi secara berkala (biasanya
tiap bulan atau disesuaikan dengan frekuensi pemakaian alat), (b) memilih metode dan prosedur standar dari badan resmi, (c) memakai bahan kimia dengan derajat untuk analisis, (d) meningkatkan pengetahuan dan ketrampilan para analis,
(e) melakukan penetapan blangko atau kontrol dengan zat baku, dan
(f) melakukan penetapan paralel (in duplo atau in triplo) (Mulja dan Suharman, 1995).
2. Kesalahan tidak sistemik
Kesalahan tidak sistematik adalah penyimpangan yang tidak tetap dari hasil penentuan kadar dengan instrumen yang disebabkan fluktuasi dari instrumen yang dipakai. Penyebab kesalahan ini tidak dapat ditentukan dan tidak dapat dikontrol maka kesalahan ini disebut juga kesalahan acak (Mulja dan Suharman, 1995).
H.Landasan Teori
Oleh karena itu diperlukan senyawa antioksidan untuk menghambat reaksi oksidasi radikal bebas. Sumber antioksidan dapat berasal dari hasil sintesis maupun alam. Antioksidan sintesis seperti tBHQ, BHA, BHT, dan PG mempunyai efektivitas yang tinggi tetapi dapat menyebabkan kanker melalui mutasi pada DNA. Hal inilah yang menyebabkan adanya penelitian eksplorasi sumber antioksidan alami yang berasal dari tumbuhan.
Selasih telah lama digunakan oleh masyarakat Indonesia sebagai tanaman obat, bahan campuran minuman yang bersifat menenangkan (sedatif), dan kosmetika. Senyawa fenolik yang terdapat dalam selasih adalah fenolik berupa eugenol, cirsilineol, isothymusin, isothymonin, asam rosmarinat, orientin, dan
vicenin. Senyawa fenolik adalah substansi organik dimana terdiri dari senyawa aromatik dengan substituen hidroksil. Aktivitas antioksidan dari senyawa fenolik didapatkan dengan cara mereduksi radikal bebas untuk tidak terjadinya reaksi samping yang merugikan.
Kandungan total fenolik ditentukan dengan metode Folin-Ciocalteu. Adanya senyawa fenolik dalam sampel uji akan mereduksi asam fosfomolibdat-fosfotungstat menjadi senyawa yang berwarna biru. Intensitas warna biru yang dihasilkan bersifat sebanding dengan kandungan fenolik dalam sampel uji.
I. Hipotesis
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental karena subjek uji diberi perlakuan.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi air ekstrak etanolik daun selasih. 2. Variabel tergantung berupa aktivitas antioksidan dan kandungan fenolik total
fraksi air ekstrak etanolik daun selasih.
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu
pemanenan,umur tanaman, dan cara panen.
4. Variabel pengacau tidak terkendali berupa cahaya matahari dan cuaca.
C. Definisi Operasional
1. Ekstrak etanolik daun selasih adalah sari hasil proses maserasi daun selasih dengan penyari etanol.
2. Fraksi air adalah hasil fraksinasi ekstrak etanol daun selasih dengan
menggunakan air.
3. Persen inhibition concentration (%IC) adalah persen yang menyatakan
4. Persen inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi air
ekstrak etanolik daun selasih yang menghasilkan penangkapan 50% radikal DPPH.
D. Bahan dan Alat Penelitian
1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah: daun selasih (Ocimum sanctum L.) yang diambil dari daerah Goa Selarong (Yogyakarta); akuades (Laboratorium Kimia Analisis Instrumental Fakultas Farmasi Universitas Sanata Dharma); bahan kualitas p.a. E. Merck, yaitu: metanol, bahan kualitas p.a. Sigma Chem. Co., USA, yaitu: DPPH, reagen Folin-Ciocalteu, asam galat, dan rutin; bahan kualitas teknis Brataco Chemica, yaitu: wasbensin dan etil asetat; bahan kualitas teknis CV. General Labora, yaitu: metanol; dan aluminium foil.
2. Alat penelitian
Alat yang digunakan dalam penelitian ini adalah: neraca analitik (Scaltec SBC 22, BP 160P), vacuum rotary evaporator (Junke & Kunkel), waterbath
E. Tatacara Penelitian
1. Determinasi tumbuhan
Determinasi tanaman selasih dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma dengan acuan van Steenis (1981).
2. Pengumpulan bahan
Tanaman selasih diperoleh dari daerah Goa Selarong (Yogyakarta). Pengumpulan pada musim kemarau bulan September tahun 2010. Pemanenan dilakukan pada tanaman yang menjelang berbunga saat pagi hari.
3. Preparasi sampel
Ekstrak etanol daun selasih ditambah 300 mL air hangat dan diekstraksi
cair-cair menggunakan wasbensin dengan perbandingan larutan ekstrak : wasbensin (1:1 v/v), kemudian didiamkan sampai terpisah sempurna.
Fase air akan berada pada bagian bawah, sedangkan fase wasbensin berada pada bagian atas.
Dari hasil partisi diperoleh dua fraksi, yaitu fraksi wasbensin dan fraksi air. Selanjutnya fraksi air diekstraksi cair-cair lagi menggunakan etil asetat dengan perbandingan larutan fraksi air : etil asetat (1:1 v/v) sehingga didapatkan fraksi air dan etil asetat. Setelah dipisahkan fraksi air diuapkan pelarutnya dengan vacuum rotary evaporator. Hasil fraksi tersebut kemudian ditutup dengan plastik serta
aluminium foil lalu disimpan dalam eksikator. Lalu hasil fraksi tersebut digunakan untuk dianalisis lebih lanjut.
4. Pembuatan larutan pembanding dan uji a. Pembuatan larutan DPPH
Sejumlah DPPH dilarutkan ke dalam metanol p.a sehingga diperoleh larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan pembanding
c. Pembuatan larutan uji
i. Larutan uji untuk uji aktivitas antioksidan
Sebanyak 25,0 mg hasil fraksi air pada preparasi sampel ditimbang, lalu ditambahkan metanol p.a sampai 25,0 mL. Diambil sebanyak 1,0; 2,0; 3,0; 4,0; dan 5,0 mL larutan tersebut, kemudian ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan uji sebesar 100,0; 150,0; 200,0; 250,0 dan 300,0 µg/mL.
ii.Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 7,5 mg hasil fraksi air pada preparasi sampel ditimbang, lalu ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan uji sebesar 750,0 µg/mL.
d. Pembuatan larutan asam galat
5. Uji pendahuluan a. Uji fenolik
Sebanyak 0,5 mL metanol p.a, larutan pembanding asam galat 150,0 µg/mL, dan larutan uji 750,0 µg/mL dimasukkan ke dalam tiga tabung reaksi. Lalu ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10; v/v). Larutan tersebut selanjutnya ditambahkan dengan 4,0 mL Na2CO3 1M. Setelah 10 menit, amati warna pada larutan tersebut.
b. Uji pendahuluan aktivitas antioksidan
Sebanyak 1 mL larutan DPPH dimasukkan ke dalam masing-masing tiga tabung reaksi. Ditambahkan masing-masing dengan 1 mL metanol p.a, larutan pembanding rutin 37,5 µg/mL, dan larutan uji 200,0 µg/mL. Selanjutnya larutan tersebut ditambahkan dengan 3 mL metanol p.a. Larutan tersebut kemudian divortek selama 30 detik. Setelah 30 menit, amati warna pada larutan tersebut.
6. Optimasi metode uji aktivitas antioksidan
a. Penentuan operating time (OT) metode uji aktivitas antioksidan
b. Penentuan panjang gelombang serapan maksimum (λ maksimum) metode uji aktivitas antioksidan
Pada tiga labu ukur 5 mL, dimasukkan masing-masing 0,2; 0,6; dan 1,0 mL larutan DPPH. Ditambahkan larutan tersebut dengan metanol p.a hingga tanda batas sehingga konsentrasi DPPH menjadi 0,016; 0,048; dan 0,080 mM. Larutan tersebut kemudian divortek selama 30 detik. Diamkan selama OT. Lalu dilakukan
scanning λ maksimum dengan spektrofotometer visibel pada panjang gelombang 400-600 nm.
7. Uji aktivitas antioksidan
Uji aktivitas antioksidan ditentukan dengan menggunakan metode spektrofotometri sesuai dengan penelitian Armala (2009).
a. Pengukuran absorbansi larutan kontrol
Pada labu ukur 5 mL, dimasukkan sebanyak 1 mL larutan DPPH. Ditambahkan larutan tersebut dengan metanol p.a hingga tanda batas. Kemudian larutan tersebut dibaca absorbansinya pada saat OT dan λ maksimum. Pengerjaan dilakukan sebanyak 3 kali. Larutan ini digunakan sebagai kontrol untuk menguji larutan pembanding dan uji.
b. Pengukuran absorbansi larutan pembanding dan uji
selama OT. Larutan dibaca absorbansinya dengan spektrofotometer visibel pada λ maksimum. Pengerjaan dilakukan sebanyak 3 kali.
c. Validasi metode uji aktivitas antioksidan
Hasil dari prosedur 7 a dan b, divalidasi akurasi (%recovery), presisi (%CV), spesifisitas (spektra kontrol), dan linearitasnya (nilai r).
%Recovery = 100%
%CV = 100%
d. Estimasi aktivitas antioksidan
Hasil dari prosedur 7 a dan b, dihitung nilai %IC dan IC50 untuk rutin
dan fraksi air ekstrak etanolik daun selasih.
8. Penetapan kandungan fenolik total
Kandungan fenolik total ditentukan dengan menggunakan metode spektrofotometri sesuai dengan penelitian Veeru, et al., (2009).
a. Optimasi metode penetapan kandungan fenolik total i. Penentuan OT
ii. Penentuan λ maksimum
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 µg/mL ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10; v/v). Larutan selanjutnya ditambah dengan 4,0 mL natrium karbonat 1M. Diamkan selama OT. Lalu dilakukan scanningλ maksimum dengan spektrofotometer visibel pada panjang gelombang 600-800 nm.
b. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 50; 75; 100; 125; dan 150 µg/mL ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10; v/v). Larutan selanjutnya ditambah dengan 4,0 mL natrium karbonat 1M. Setelah OT, absorbansinya dibaca pada λ maksimum terhadap blanko yang terdiri atas akuades : metanol p.a. (1:1), reagen Folin-Ciocalteu, dan larutan natrium karbonat 1M. Pengerjaan dilakukan sebanyak 3 kali.
c. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 8 b, divalidasi akurasi (%recovery), presisi (%CV), spesifisitas (spektra kontrol), dan linearitasnya (nilai r).
d. Estimasi kandungan fenolik total larutan uji
F. Analisis Hasil
Uji aktivitas antioksidan menghasilkan aktivitas penangkapan radikal DPPH yang dilaporkan sebagai %IC dihitung dengan rumus:
/ 100%
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 menggunakan persamaan
regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun pembanding sedangkan sumbu y adalah %IC. Lalu dianalis secara statistik untuk menentukan ada atau tidak adanya perbedaan bermakna antara nilai IC50 larutan pembanding
dengan uji.
Penetapan kandungan fenolik total menghasilkan nilai mg ekivalen asam galat per g fraksi air. Nilai tersebut didapatkan dari analisis regresi linear dengan data kurva baku secara intrapolasi.
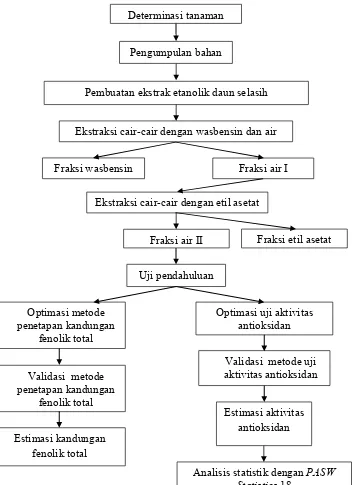
Gambar 4. Skema jalannya penelitian
Determinasi tanaman
Pengumpulan bahan
Pembuatan ekstrak etanolik daun selasih
Ekstraksi cair-cair dengan wasbensin dan air
Fraksi wasbensin Fraksi air I
Ekstraksi cair-cair dengan etil asetat
Fraksi etil asetat
Analisis statistik dengan PASW Statistics 18
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tumbuhan
Langkah awal yang dilakukan pada penelitian ini adalah determinasi tanaman selasih. Tujuan determinasi tanaman tersebut adalah untuk mengetahui kebenaran identitas tanaman yang digunakan dalam penelitian. Kebenaran identitas tanaman tersebut digunakan untuk menghindari adanya kemungkinan kesalahan dalam pengambilan sampel pada analisis fitokimia (Harborne, 1987). Determinasi tanaman selasih dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma pada tanggal 24 September 2010 dengan acuan van Steenis (1981). Hasil determinasi tanaman selasih dapat dilihat di lampiran 1 yang menyatakan kebenaran tanaman, yaitu Ocimum sanctum L. atau selasih.
B. Hasil Pengumpulan Bahan
Daun selasih dipanen dari tempat budidaya tanaman selasih pada
tanggal 22 September 2010 di daerah Goa Selarong, Yogyakarta (RT 1/RW 3 Pedukuhan Kentolan Lor, Kelurahan Gowasari, Kecamatan
Pajangan, Kabupaten Bantul).
kriteria-kriteria tersebut, jumlah metabolit sekunder dalam daun selasih maksimal. Pemanenan pada musim kemarau (kelembaban rendah) dikarenakan menghindari dan mencegah efek dari penguraian yang dipromosi oleh pertumbuhan mikroorganisme yang pertumbuhannya meningkat seiring dengan naiknya tingkat kelembaban. Alasan lainnya karena biosintesis senyawa fenolik akan lebih banyak saat mendapatkan sinar matahari daripada tidak mendapatkan sinar matahari terutama saat musim penghujan. Pemanenan menjelang tanaman berbunga dimaksudkan agar metabolit sekunder dalam daun tanaman sebagai subjek uji penelitian memiliki kandungan yang maksimal, sedangkan pada saat tanaman berbunga kemungkinan besar, banyak metabolit sekunder yang ditransport menuju bunga untuk kemudian menjadi buah sebagai cadangan makanan tanaman. Pemanenan saat pagi hari dilakukan dengan tujuan agar metabolit sekunder yang terdapat dalam tanaman belum diolah melalui fotosintesis menjadi metabolit sekunder lainnya dan agar mempertahankan kesegaran tanaman saat transport menuju laboratorium. Usaha pemanenan dengan kriteria-kriteria tanaman di atas bertujuan untuk memaksimalkan kandungan metabolit sekunder tanaman yang dapat diekstraksi oleh peneliti (World Health Organization, 2003).
sewaktu pemanenan, maka enzim tersebut dengan adanya oksigen akan mengubah senyawa fenolik menjadi bentuk radikal dan akhirnya terjadi reaksi oksidasi
multistep yang membuat senyawa tersebut menjadi bentuk polimer (Evans dan Hedger, 2001). Bentuk polimer tersebut berfungsi untuk menutup luka pada jaringan tanaman. Adanya peristiwa tersebut, senyawa fenolik dioksidasi menjadi senyawa yang kurang atau bahkan tidak memiliki aktivitas antioksidan.
C. Hasil Preparasi Sampel
Tujuan dari preparasi sampel adalah untuk mendapatkan fraksi air ekstrak etanolik daun selasih yang diduga dalam fraksi tersebut mengandung senyawa fenolik. Sampel yang digunakan dalam preparasi sampel berupa daun selasih yang masih segar. Menurut Markham (1988), alasan digunakan daun yang masih segar sebagai sampel adalah untuk menjaga kestabilan senyawa flavonoid (termasuk dalam golongan senyawa fenolik) dalam sampel karena bahan tumbuhan yang telah dikeringkan mempunyai kecenderungan adanya perubahan susunan senyawa flavonoid. Perubahan tersebut dapat berupa glikosida menjadi aglikonnya karena potensi adanya pengaruh fungi. Bentuk aglikon tersebut dapat berubah menjadi bentuk teroksidasinya dan terjadi reaksi oksidasi multistep yang akhirnya terbentuk polimer. Dalam hal ini, peneliti mengekstraksi daun selasih segar dengan etanol dengan tujuan agar fungi tidak tumbuh dalam ekstrak daun selasih.
atau blackening cenderung lebih besar. Laporan dari Markham (1988) dan Galati, et al., (2005) tersebutlah yang membuat peneliti berupaya untuk mengantisipasi agar stabilitas senyawa fenolik dalam daun selasih terjaga.
Daun selasih yang diperoleh dicuci dengan air mengalir untuk membersihkannya dari pengotor-pengotor yang menempel. Setelah itu, daun selasih diangin-anginkan untuk menghilangkan air yang menempel dari proses pencucian daun selasih. Lalu daun selasih diblender sebelum dimaserasi, tujuannya adalah untuk memperkecil ukuran permukaan daun selasih sehingga penyarian akan bertambah baik jika permukaan simplisia yang kontak dengan penyari semakin luas (Harborne, 1987).
Lalu dilakukan proses maserasi dengan penyari etanol 76% dan dibantu dengan alat shaker. Penyarian dilakukan dengan cara maserasi karena peneliti menghindari cara preparasi sampel yang banyak membutuhkan perlakuan pemanasan terhadap sampel. Hal ini dilakukan untuk menjaga stabilitas dari senyawa fenolik yang diekstraksi (Bruneton, 1999).
cara maserasi daripada perkolasi. Hal ini disebabkan karena dalam kondisi segar yang diperkecil ukuran sampel dengan blender, akan didapatkan ukuran sampel yang diperkecil dengan sifat polidispers. Ukuran yang demikian dapat menyumbat aliran cairan perkolat dalam perkolator sehingga aliran cairan perkolat tidak menetes. Lain halnya jika menggunakan serbuk yang telah diayak dengan derajat kehalusan tertentu, cairan perkolat dapat mengalir akibat adanya pori-pori dalam susunan serbuk sampel. Efek farmakologis yang diharapkan bersifat umum, yaitu antioksidan sehingga pemilihan maserasi daripada perkolasi akan lebih menguntungkan. Cara maserasi yang dilakukan oleh peneliti menggunakan alat bantu berupa shaker yang digunakan untuk membantu proses maserasi agar penyari lebih dapat kontak langsung dengan sel-sel dalam daun selasih daripada hanya didiamkan saja. Hal ini membuat proses maserasi dapat secara efektif mengekstraksi metabolit sekunder dalam daun selasih. Pada proses maserasi, dilakukan pula remaserasi dengan tujuan untuk memaksimalkan proses penyarian agar mendapatkan lebih banyak senyawa fenolik dibandingkan hanya digunakan maserasi saja.
Pelarut metanol tidak digunakan karena memiliki efek toksik yang lebih tinggi daripada etanol (Armala, 2009). Pelarut n-butanol tidak digunakan karena n-butanol lebih non polar serta struktur dari n-butanol lebih besar sehingga n-butanol kurang begitu bisa masuk ke dalam sel-sel daun selasih daripada etanol. Alasan digunakan campuran etanol dan air daripada hanya air adalah karena campuran tersebut dapat melarutkan dengan optimal senyawa fenolik, agar ekstrak yang dihasilkan tidak ditumbuhi mikroorganisme yang dapat merubah susunan fisika-kimia senyawa dalam ekstrak, dan agar enzim dalam ekstrak yang ikut tersari tidak aktif karena etanol mempunyai kecenderungan dapat mendenaturasi enzim dengan cara menarik kandungan air dari enzim.
Pemilihan konsentrasi etanol sebesar 76% sebagai penyari merupakan hasil dari penelitian Wangcharoen dan Morasuk (2007 b) yang melaporkan bahwa pada ekstrak etanolik 76% daun selasih, secara lebih efektif dan efisien menghasilkan aktivitas antioksidan dibandingkan dengan konsentrasi etanol 18%, 36%, 57%, dan 95%. Oleh karena itu, peneliti memilih etanol dengan konsentrasi 76% untuk mengekstraksi daun selasih.
Tujuan pemilihan penyaringan filtrat menggunakan corong Buchner yang diintegrasikan dengan pompa vacuum daripada dengan penyaringan biasa adalah untuk mempercepat proses penyaringan dan memperbanyak hasil penyaringan. Setelah itu, untuk menguapkan pelarut hasil penyaringan filtrat, digunakan alat
2001). Hal ini dikarenakan alat tersebut memakai prinsip penurunan tekanan udara dalam sistem vacuum sehingga titik didih larutan dapat diturunkan (Dave, 2010).
Setelah didapatkan ekstrak kental etanolik daun selasih, kemudian ekstrak tersebut dilarutkan dengan air hangat. Digunakan air hangat agar dapat lebih melarutkan ekstrak etanolik daun selasih. Fraksi air berada di bagian bawah, sedangkan fraksi wasbensin berada di bagian atas. Hal ini dikarenakan berat jenis (b.j.) air lebih besar daripada wasbensin. Air memiliki b.j. sebesar 0,996 sedangkan b.j. wasbensin sebesar 0,730 (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995; Robin Laboratoire, 2009).
Dalam fraksi air pertama dari hasil pemisahan ekstrak etanolik daun selasih dengan wasbensin, akan didapatkan senyawa fenolik yang lebih murni karena air dan senyawa fenolik bersifat polar maka air dapat melarutkan senyawa fenolik. Dalam fraksi wasbensin akan didapatkan zat-zat kimia yang tidak diinginkan, yaitu senyawa-senyawa non polar seperti lipid dan klorofil sehingga fraksi ini dapat dibuang.
![Gambar 5. Hasil uji fenolik (A = kontrol negatif [blanko], B = kontrol positif [asam galat], dan C = larutan uji [fraksi air ekstrak etanolik daun selasih])](https://thumb-ap.123doks.com/thumbv2/123dok/1708134.2080975/78.612.224.419.504.620/gambar-fenolik-kontrol-negatif-larutan-ekstrak-etanolik-selasih.webp)