Laboratorium Fisiologi – Biologi - UNESA 1 KATA PENGATAR
Alhamdulilah, segala puji dan rasa syukur senantiasa kami berikan kepada Allah SWT, yang telah memberikan kemampuan, kekuatan, dan kemudahan bagi penulis untuk melaksanakan tugas sekaligus membuat Laporan Kerja Praktikum yang telah kami lakukan.
Sebagai prasyarat untuk memenuhi tugas mata kuliah Fisiologi Tumbuhan, maka penulis melakukan praktikum dengan judul ‘Pengaruh Kadar Enzim Terhadap Kecepatan Reaksi Pengubahan Amilum Menjadi Glukosa’. Kegiatan ini dilakukan pada tanggal 18 Maret 2014, sebagai waktu yang ditentukan oleh dosen mata kuliah terkait yaitu Ibu Yuni Sri Rahayu dan Bu Yuliani.
Penulis menyadari bahwa masih banyak kesalahan yang sengaja maupun tak disengaja kami lakukan, baik dari segi tinjauan teori maupun prakteknya sehingga kritik dan saran pembaca selalu kami tunggu demi perbaikan Laporan Kerja Praktikum ini.
Terakhir, semoga laporan ini bermanfaat bagi pembaca dan terutama bagi kami sebagai penulis. Kurang lebih kami mohon maaf yang sebesar-besarnya.
Surabaya, 25 Maret 2014
Laboratorium Fisiologi – Biologi - UNESA 2 DAFTAR ISI
KATA PENGANTAR ... 1
DAFTAR ISI ... 2
BAB I PENDAHULUAN ... 3
A. Latar Belakang ... 3
B. Rumusan Masalah ... 3
C. Tujuan ... 3
D. Hipotesis ... 3
BAB II KAJIAN TEORI ... 4
BAB III METODE PENELITIAN ... 9
A. Jenis Penelitian ... 9
B. Variabel Penelitian ... 9
C. Alat dan bahan ... 9
D. Langkah Kerja ... 10
E. Alur Kerja ... 10
BAB IV ANALISIS DAN PEMBAHASAN ... 13
A. Hasil ... 13
B. Analisis ... 14
C. Pembahasan ... 16
D. Diskusi ... 18
BAB V PENUTUP ... 19
A. Kesimpulan ... 19
B. Saran ... 19
DAFTAR PUSTAKA ... 20
Laboratorium Fisiologi – Biologi - UNESA 3 BAB I
PENDAHULUAN
A. Latar Belakang
Salah satu proses penting yang terjadi di dalam tubuh tumbuhan yaitu metabolisme. Proses tersebut berupa pemecahan molekul menjadi molekul yang lebih kecil (katabolisme) dan penyusunan molekul dari molekul-molekul yang lebih kecil (anabolisme). Dalam tubuh tumbuhan terjadi banyak reaksi kimia yang kompleks dengan banyak tipe yang berbeda. Namun tidak pernah terjadi kekacauan, hal ini disebabkan karena adanya suatu protein khusus yang mengontrol metabolisme yang disebut enzim (Widarmayanti, P Ratih. 2012).
Enzim merupakan biokatalisator yang sangat efektif yang akan meningkatkan kecepatan reaksi kimia spesifik secara nyata, dimana reaksi ini tanpa enzim akan berlangsung lambat (Lehninger, 1995). Kebanyakan enzim-enzim yang terdapat di tubuh organisme tidak bekerja secara sendiri-sendiri tetapi saling bekerja sambung-menyambung satu dengan yang lain membentuk sistem enzim (Isnawati, 2009). Pemanfaatan enzim amilase dari kecambah biji di bidang industri masih belum banyak dilakukan. Bila hal ini dilakukan tentunya merupakan salah satu cara yang dapat meningkatkan nilai ekonomis dari jagung tersebut (Bahri, Syaiful dkk. 2012).
Berdasarkan uraian diatas maka kami melakukan suatu percobaan dengan judul “Pengaruh Kadar Enzim Terhadap Kecepatan Rekasi Pengubahan Amilum”.
B. Rumusan Masalah
Bagaimana pengaruh kadar enzim terhadap kecepatan reaksi pengubahan amilum menjasi glukosa?
C. Tujuan
Untuk mengamati pengaruh kadar enzim terhadap kecepatan reaksi pengubahan amilum menjadi glukosa.
D. Hipotesis
Laboratorium Fisiologi – Biologi - UNESA 4 BAB II
KAJIAN TEORI
Enzim
Enzim merupakan katalisator biologi, sehingga dapat mengkatalis reaksi kimia pada kondisi yang tidak ekstrim (suhu tubuh dan pH netral). Sebagian besar enzim-enzim tubuh organisme tersusun atas protein yang mempunyai struktur tersier (konformasi tiga dimesi). Protein penyusun enzim adalah makromolekul yang sangat besar. Dengan demikian ukuran enzim jauh lebih besar dibandingkan substratnya. Enzim fungsional disebut holoenzim (Isnawati, 2009).
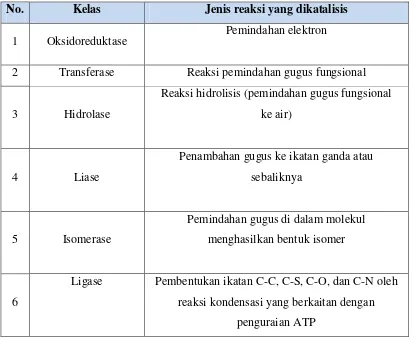
Penggolongan enzim secara internasional telah dilakukan secara sistematis. Sistem ini menempatkan semua enzim ke dalam enam kelas utama, masing-masing dengan sub kelas, berdasarkan atas jenis reaksi yang dikatalisa (Tabel 2).
Tabel 2. Klasifikasi enzim secara internasional, berdasarkan reaksi yang dikatalisis.
No. Kelas Jenis reaksi yang dikatalisis
1 Oksidoreduktase Pemindahan elektron
2 Transferase Reaksi pemindahan gugus fungsional
3 Hidrolase
Reaksi hidrolisis (pemindahan gugus fungsional ke air)
4 Liase
Penambahan gugus ke ikatan ganda atau sebaliknya
5 Isomerase
Pemindahan gugus di dalam molekul menghasilkan bentuk isomer
6
Ligase Pembentukan ikatan C-C, C-S, C-O, dan C-N oleh reaksi kondensasi yang berkaitan dengan
penguraian ATP
Laboratorium Fisiologi – Biologi - UNESA 5 Enzim mempercepat suatu reaksi kimia dengan cara menurunkan energi aktivasi. Energi aktivasi adalah energi yang diperlukan supaya molekul-molekul substrat berada pada puncak transisi/ puncak ketidakstabilan. Pada grafik dibawah ini dapat dilihat bahwa dengan adanya enzim energi aktivasi akan semakin kecil (Isnawati, 2009).
Struktur enzim
Suatu enzim (holoenzim) tersusun atas bagian protein dan bukan protein. Bagian protein disebut apoenzim, dan bagian non protein disebut kofaktor. Kofaktor dapat berupa ion logam (Cu, Mg, K, Fe, Na), atau koenzim yang berupa bahan organik, misalkan vitamin B (B1, B2) (biologimediacentre.com, 2012).
Sifat-sifat enzim
Sebagai suatu bahan yang penting dalam metabolisme, enzim memiliki sifat-sebagai berikut (biologimediacentre.com, 2012):
kerja enzim bersifat spesifik/khusus, artinya bahwa satu enzim hanya
dapat bekerja pada satu substrat enzim bekerja pada suhu tertentu
enzim berkerja pada derajat keasaman (pH) tertentu
kerja enzim dapat bolak-balik, artinya selain dapat memecah substrat juga
dapat membentuk substrat dari penyusunnya
Hal-hal yang dapat mempengaruhi kerja enzim di antaranya adalah:
suhu
derajat keasaman (pH) konsentrasi enzim jenis substrat
Laboratorium Fisiologi – Biologi - UNESA 6 Suatu enzim hanya dapat bekerja spesifik pada suatu substrat untuk suatu perubahan tertentu. Misalnya, sukrase akan menguraikan rafinosa menjadi melibiosa dan fruktosa, sedangkan oleh emulsin, rafinosa tersebut akan terurai menjadi sukrosa dan galaktosa (Salisbury, 1995).
Apabila suhu terlalu tinggi, struktur tiga dimensi enzim akan rusak, sehingga substrat tidak lagi dapat terikat dengannya. Dengan demikian enzim tersebut tidak akan dapat menjalankan fungsinya lagi sebagai biokatalisator. Pada umumnya denaturasi ini bersifat tidak terbalikan atau permanen (Salisbury, 1995).
Enzim dihambat oleh molekul-molekul tertentu pada proses katalisisnya. Adapun beberapa hambatan kerja enzim secara skematis seperti bagan dibawah ini (Isnawati, 2009):
a. Hambatan dapat balik kompetitif terjadi pada enzim yang molekul penghambatnya secara struktural mirip dengan struktur molekul substrat. Molekul penghambat menempel pada sis aktif enzim, dengan demikian substrat tidak bisa melekat pada sisi aktif enzim dan tidak bisa diubah menjadi produk.
b. Hambatan dapat balik non kompetitif terjadi dengan cara molekul penghambat pada enzim tetapi tidak pada sisi aktif. Pelekatan molekul penghambat pada enzim menyebabkan perubahan konformasi tiga dimensi pada sisi aktif enzim, dengan demikian substrat tidak dapat melekat pada sisi aktif enzim.
c. Hambatan tidak dapat balik pada kerja enzim akan gugus fungsional enzim secara permanen dan mengakibatkan kerusakan pada enzim itu, sehingga enzim tidak dapat bekerja lagi.
hambatan kerja enzim
Dapat balik/ reversible
Kompetitif
Non kompetitif Tidak dapat
Laboratorium Fisiologi – Biologi - UNESA 7 Amilase
Salah satu enzim yang diperlukan untuk pertumbuhan adalah amilase. Amilase dapat diartikan sebagai segolongan enzim yang merombak pati, glikogen dan polisakarida yang lain. Tumbuhan mengandung α dan β amilase, hewan memiliki hanya α amilase, dijumpai dalam cairan pankreas dan juga (pada manusia dan beberapa spesies lain) dalam ludah. Amilase memotong rantai polisakarida yang panjang, menghasilkan campuran glukosa dan maltosa. Amilosa merupakan polisakarida yang terdiri dari 100-1000 molekul glukosa yang saling berikatan membentuk rantai lurus. Dalam air, amilosa bereaksi dengan iodin memberikan warna biru yang khas (Fox, 1991).
Amilase merupakan enzim yang penting dalam bidang pangan dan bioteknologi. Amilase merupakan enzim yang mengkatalisis reaksi hidrolisis pati menjadi gula sederhana. Amilase mengubah karbohidrat yang merupakan polisakarida menjadi maltosa (alfa dan beta) ataupun glukosa (gluko amilase).
Pertumbuhan tanaman yang berasal dari biji diawali dari proses perkecambahan. Dalam pertumbuhannya memerlukan energi, dan energi tersebut berasal dari perombakan bahan-bahan organik seperti karbohidrat, lemak, dan protein. Enzim yang digunakan untuk merombak protein adalah enzim protease, perombakan lemak adalah enzim lipase dan pati memerlukan enzim amilase. Enzim-enzim tersebut secara bersamaan dihasilkan tumbuhan selama proses perkecambahan (Bahri, Syaiful dkk., 2012).
Larutan Buffer
Laboratorium Fisiologi – Biologi - UNESA 9 BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian ini adalah eksperimental, karena dilakukan percobaan untuk menjawab rumusan masalah, dan terdapat variabel-variabel dalam penelitian yang dilakukan.
B. Variabel Penelitian
1. Variabel manipulasi : kadar enzim
2. Variabel kontrol : waktu, jenis kecambah, kadar amilum, volume amilum, dan volume KI-I2
3. Variabel respon : kecepatan perubahan warna (sebagai indikator pengubahan amilum mejadi glukosa)
C. Bahan dan Alat
Alat
1. Mortar dan penumbuk porselin 1 buah
2. Tabung reaksi 4 buah
3. Rak tabung reaksi 1 buah
4. Timbangan 1 buah
5. Tabung centrifuge 4 buah
6. Gelas ukur 10 mL 1 buah
7. Centrifuge
8. Cawan tetes/kaca arloji 1 / 12 buah
9. Pipet tetes 5 buah
10.Lampu spirtus 1 buah
11.Penjepit tabung reaksi 1 buah
Bahan
1. Kecambah kacang hijau berumur dua hari 30 gr
2. Larutan amilum 4% 2 ml
3. Aquades
4. Larutan KI-I2 1 tetes
Laboratorium Fisiologi – Biologi - UNESA 10 D. Langkah Kerja
1. Menyiapkan bahan dan alat yang diperlukan. 2. Membuang kulit biji kecambah.
3. Tambahkan 30 ml larutan buffer fosfat sitrat pada kecambah hijau, kemudian gerus 30 gram kecambah kacang hijau sampai semua kecambah hancur.
4. Memasukkan ke dalam tabung reaksi centrifuge dan memusingnya selama 5 menit dengan kecepatan 250 rpm.
5. Mengambil cairan bagian atas (supernatan) dengan bantuan pipet tetes dan memasukkkannya ke dalam tabung reaksi. Cairan ini dianggap sebagai larutan enzim amilase 100%.
6. Membuat enzim dengan kadar 0% ,25% ,50% ,dari enzim yang berkadar 100% dengan cara sebagai berikut: kadar enzim 50% diperoleh cara mengambil 5 ml enzim 100% dan ditambahkan aquades sampai volemenya menjadi 10 ml, kadar enzim 25% diperoleh dengan cara mengambil 5 ml enzim 50% dan ditambahkan aquades sampai volumenya menjadi 10 ml, kadar enzim 0% diperoleh dengan cara memanaskan 5 ml enzim 100% sampai mendidih.
7. Menyediakan tabung reaksi dan isilah dengan 5 ml larutan enzim 100%, tambahkan 2 ml larutan amilum 1%. Mencatat waktunya.kemudian mengocok perlahan sampai larutan tercampur benar. Saat mencampur larutan amilum + enzim ditetapkan sebagai saat nol.
8. Mengambil 1 tetes campuran setiap 2 menit lalu mengujinya dengan 1 tetes larutan KI-I2 pada lempeng penguji (cawan tetes).
9. Mencatat waktu tiap perubahan warna yang terjadi pada lempeng penguji.
10.Mengulangi langkah ke 6 sampai 8, masing-masing untuk kadar enzim 50% , 25%, dan 0%.
E. Alur Kerja
Membuang kulit biji kecambah
Laboratorium Fisiologi – Biologi - UNESA 11 Tambahkan 30 mL larutan buffer
fosfat sitrat dan gerus 30 gram kecambah kacang hijau
Masukkan mL gerusan kecambah kacang hijau ke dalam 3 tabung reaksi, masing-masing 10 mL.
Masukkan tabung reaksi ke dalam tabung reaksi.
cair volumenya 10mL, sbg larutan enzim 50%
Untuk Larutan enzim 25%, ambil 5mL dr enzim 50% dan tambahkan aquades sampai volume nya 10mL
Tambahkan 2mL larutan amilum 4%. Saat mencampur ailum+enzim ditetapkan sbg saat 0.
25% 2mL Amilum 4%
50%
Laboratorium Fisiologi – Biologi - UNESA 12 Setiap 2 menit diambil 1 tetes
dari setiap larutan campuran, dan diuji dengan 1 tetes KI-I2
pada cawan tetes. 25% 50%
100% 0%
Satu tetes KI-I2 setiap dua
menit
Laboratorium Fisiologi – Biologi - UNESA 13
Perubahan Warna Pada Konsentrasi Enzim
Laboratorium Fisiologi – Biologi - UNESA 14 Dua
menit ke-
Perubahan Warna Pada Konsentrasi Enzim
0% 25% 50% 100%
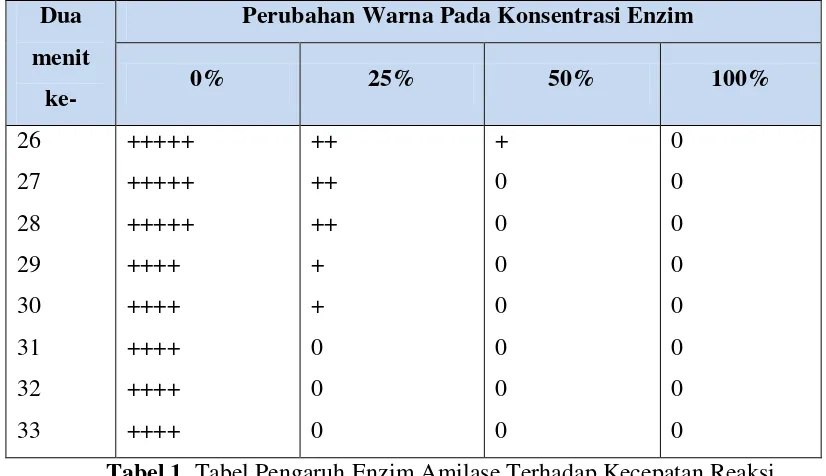
Tabel 1. Tabel Pengaruh Enzim Amilase Terhadap Kecepatan Reaksi Pengubahan Amilum Menjadi Glukosa
Keterangan:
Berdasarkan hasil praktikum maka dapat diketahui pada konsentrasi larutan enzim 0% tidak terjadi perubahan warna yang menonjol sampai pada 2 menit ke-29. Pada konsentrasi larutan enzim 0%, semula berwarna biru tua-kehitaman pekat, ketika diuji dengan KI-I2 satu tetes pada dua menit ke-29 terjadi perubahan warna dari biru tua kehitaman yang pekat menjadi biru tua dengan kepekatan berkurang satu tingkat. hal ini dapat terjadi karena konsentrasi enzim sama dengan nol%.
Laboratorium Fisiologi – Biologi - UNESA 15 lebih terang dan kepekatan turun satu tingkat. sehingga pada dua menit ke 31 warna larutan merubah menjadi kuning.
Kemudian pada konsentrasi enzim 50% perubahan warna pertama terjadi pada dua menit ke-5, lebih cepat dibandingkan dengan kedua konsentrasi enzim sebelumnya. Pada dua menit ke-29 larutan konsentrasi enzim 50% sudah mengalami perubahan warna menjadi kuning sampai pada dua menit ke-33.
Pada konsentrasi larutan enzim 100% perubahan warna terjadi lebih cepat dibandingkan ketiga larutan sebelumnya, yaitu perubahan warna pertama pada dua menit ke-3 yang semula berwarna biru tua pekat menjadi biru keunguan dengan kepekatan warna dari +++++ menjadi ++++. Semua uji pada larutan enzim dengan KI-I2 dihentikan pada dua menit ke-33 hal tersebut dikarenakan semua larutan sudah berubah warna menjadi kuning kecuali pada konsentrasi enzim 0%.
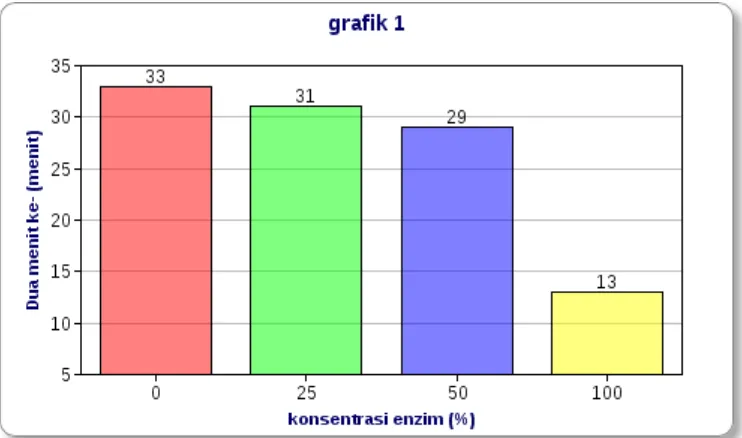
Dari analisis hasil data di atas dapat dibuat grafik pengaruh kadar enzim terhadap kecepatan reaksi pengubahan amilum menjadi glukosa.
Laboratorium Fisiologi – Biologi - UNESA 16 C. Pembahasan
Pertumbuhan tanaman yang berasal dari biji diawali dari proses perkecambahan. Dalam pertumbuhannya memerlukan energi, dan energi tersebut berasal dari perombakan bahan-bahan organik. Enzim yang digunakan untuk merombak protein adalah enzim protease, perombakan lemak adalah enzim lipase dan pati memerlukan enzim amilase. Enzim-enzim tersebut secara bersamaan dihasilkan tumbuhan selama proses perkecambahan (Bahri, Syaiful dkk., 2012). Sehingga pada praktikum ini kecambah kacang hijau yang masih berumur 2 hari mempunyai banyak sekali enzim yang diproduksi oleh tumbuhan untuk membentuk energi dalam perkecambahan.
Dari analisis hasil data di atas pada konsentrasi enzim 0% yang didapatkan dari 10 mL konsentrasi enzim 100% yang telah dipanaskan sampai mendidih. Pada saat dipanaskan suhu larutan enzim semakin meningkat mengakibatkan enzim di dalam mengalami denaturasi.
Apabila suhu terlalu tinggi, struktur tiga dimensi enzim akan rusak, sehingga substrat tidak lagi dapat terikat dengannya. Dengan demikian enzim tersebut tidak akan dapat menjalankan fungsinya lagi sebagai biokatalisator. Pada umumnya denaturasi ini bersifat tidak terbalikan atau permanen (Salisbury, 1995). Sehingga pada konsentrasi enzim 0% enzim sudah mengalami denaturasi sehingga tidak dapat berikatan dengan substrat menyebabkan tidak adanya enzim yang dapat mengubah amilum menjadi glukosa. Dengan demikian pada konsentrasi enzim 0% tidak terjadi perubahan warna sampai pada dua menit ke -33. Menurut beberapa teori enzim akan mengalami denaturasi pada suhu ≥50C.
Laboratorium Fisiologi – Biologi - UNESA 17 iodine dan amilum. Amilopektin, yaitu bagian amilum yang bercabang, membentuk heliks yang lebih pendek sehingga molekul iodine tidak dapat mengikatnya. Akibatnya, apabila dilakukan uji iodine, warna yang terbentuk adalah oranye atau kuning. Pada konsentrasi enzim 25% perubahan warna menjadi kuning terjadi pasa dua menit ke-31. Begitupula pada konsentrasi enzim 50% terjadi perubahan warna yang pertama lebih cepat yaitu pada dua menit ke-5 dari +++++ menjadi ++++. Dan pada dua menit ke-27 terjadi perubahan warna menjadi 0 yaitu warna kuning. Hal ini menunjukkan adanya reaksi enzim amilase yang membentuk glukosa.
Pada konsentrasi enzim 100% menunjukkan perubahan warna yang pertama sangat cepat, yaitu pada dua menit ke-3 dan berubah menjadi warna kuning pada dua menit ke-13. Dalam hal ini, dapat disimpulkan bahwa semakin tinggi kadar enzim yang ditambahkan pada larutan amilum maka semakin cepat reaksi enzim amilase dalam mengubah amilum menjadi glukosa. Hal ini sesuai dengan fungsi enzim sebagai katalisator biologi yaitu dapat mempercepat suatu reaksi kimia dengan cara menurunkan energi aktivasi. Energi aktivasi adalah energi yang diperlukan supaya molekul-molekul substrat berada pada puncak transisi/ puncak ketidakstabilan (Isnawati, 2009).
Penambahan larutan buffer yaitu larutan yang tahan terhadap perubahan pH dengan penambahan asam atau basa. Larutan seperti itu digunakan dalam berbagai percobaan biokimia dimana dibutuhkan pH yang terkontrol dan tepat ( Fardiaz, 1992 ). Kemudian penambahan KI-I2 satu tetes sebagai uji iodine untuk menunjukkan ada/tidaknya amilum pada suatu larutan dan untuk menunjukkan perubahan warna menjadi kuning sebagai indikator adanya reaksi kimia antara enzim amilase dengan amilum dalam membentuk glukosa.
D. Diskusi
Laboratorium Fisiologi – Biologi - UNESA 18 bantuan enzim amilase, dan penguraian maltosa menjadi glukosa dibantu oleh enzim maltase.
2. Fosfat sitrat buffer berfungsi mempertahankan harga pH dari larutan enzim. Sehingga ketika ada penambahan zat KI-I2 ataupun saat terjadi pengenceran, nilai pH larutan enzim tidak berubah (tetap). Hal ini penting karena enzim dapat mengalami perubahan konformasi bila nilai ph berubah-ubah.
3. Hal-hal yang dapat mempengaruhi kerja enzim di antaranya adalah (Isnawati, 2009):
suhu
derajat keasaman (pH) konsentrasi enzim jenis substrat
Laboratorium Fisiologi – Biologi - UNESA 19 BAB V
PENUTUP
A. Kesimpulan
5. Kadar enzim berpengaruh terhadap kecepatan reaksi pengubahan amilum menjadi glukosa.
6. Semakin tinggi kadar/konsentrasi enzim, maka semakin cepat kecepatan reaksi dalam mengubah amilum menjadiglukosa. Sebaliknya, pada reaksi dengan konsentrasi sedikit atau tanpa adanya enzim, maka kecepatan reaksi pengubahan amilum menjadi glukosa membutuhkan waktu yang lebih lama.
B. Saran
1. Pastikan bahwa dalam membuat larutan konsentrasi enzim tidak tercampur dengan konsentrasi lain.
Laboratorium Fisiologi – Biologi - UNESA 20 DAFTAR PUSTAKA
Rahayu, Sri Rahayu., dan Yuliani, dkk. 2014. Petunjuk Praktikum Mata kuliah Fisiologi Tumbuhan. Surabaya : Laboratorium Fisiologi Tumbuhan-Biologi-UNESA
Salisbury, Frank B., dan Ross, C.W. 1995. Fisiologi Tumbuhan Jilid 2 Edisi Keempat alih bahasa Lukman dan Sumaryono. Bandung: ITB.
Isnawati. 2009. Biokimia. Surabaya: UNESA University Press.
Anam, Khairul. 2010. Sekolah Pascasarjana Institute Pertanian Bogor: Produksi
Enzim Amilase (online),
(http://khairulanam.files.wordpress.com/2010/08/enzim-amilase.pdf, diakses pada 22 Maret 2014).
Bahri, Syaiful., Moh, Mirzan., dan Moh, Hasan. 2012. Karakterisasi Enzim Amilase Dari Kecambah Biji Jagung Ketan (Zea mays ceratina L.). Journal Natural Sciencies, 1:132-143.
BMC. 2012. Enzim. (http://biologimediacentre.com/enzim/, diakses pada tanggal 22 Maret 2014).
Miladi, D Sahri. 2010. Fungsi Larutan Penyangga. ( http://sahri.ohlog.com/fungsi-larutan-penyangga.oh81641.html, diakses pada tanggal 22 Maret 2014).
Laboratorium Fisiologi – Biologi - UNESA 21 LAMPIRAN
Pengupasan kulit Kecambah Kacang Hijau Penimbangan Kacang Hijau dengan Neraca Ohauss
Penghancuran Kecambah Kacang Hijau Setelah Pemberian Larutan Buffer
Supernatan Larutan Enzim 100% setelah dicentrifuge
Laboratorium Fisiologi – Biologi - UNESA 22 Supernatan Larutan Enzim 25% setelah
dicentrifuge
Supernatan Larutan Enzim 50% setelah dicentrifuge
Pembakaran larutan Enzim Konsentrasi 0%
Uji Iodine Pertama pada larutan enzim 0% dan 25%