BAB I PENDAHULUAN
1.1 Judul Praktikum : Analisa Oksidimetri/Reduktometri 1.2 Tanggal Praktikum : 12 Oktober 2015
1.3 Pelaksana praktikum : Kelompok 2 1. Amrizal 2. Fathan Zakian 3. Chairun nisa 4. Junidar A Saragih 5. Nurul Azmi
1.4 Tujuan Praktikum : Penentuan suatu zat kimia itu terjadi reaksi oksidasi dan reduksi
reaksi dalam mana elektron diikat disebut reduksi. Himpunan bilangan bulat kaecil yang disebut bilangan oksidasi atau keadaan oksidasi, yang ada hubungan dengan angka banding-senyawa (dari) unsur-unsur, membantu untuk mengingat-ingat rumus untuk senyawa.
Dalam senyawa ion, bilangan oksidasi suatu ion sama dengan muatan ion itu. Dalam senyawa Litium Oksida dan Aluminium Florida bilangan oksidasi litium, oksigen, aluminium dan fluor masing-masing adalah +1, -2, +3 dan -1. Bila bilangan oksidasi dicantum dengan rumus senyawa, maka bilangan ini ditulis diatas bilangan lambangnya, dengan tanda plus (+) atau minus (-) didepan angka.
Bila terdapat lebih dari satu atom dalam rumus itu, bilangan oksidasi ditaruh dalam tanda kurung dan banyaknya atom ditulis sebagai subsrib kana (dari) tanda kurung itu.
Contoh: NaCl, H2O, AlF3, Ba3N2 (Keenan, 1992).
Oksidasi ialah peristiwa pelepasan elektron, mengalami oksidasi berarti melepaskan elektron, pengertian reduksi ialah peristiwa penangkapan elektron mengalami reduksi berarti menangkap elektron, semua reduksi pelepasan elektron disebut reduksi oksidasi dan semua reaksi penangkapan elektron disebut reduksi. Contoh reaksi-reaksi Oksidasi:
K K+ +e...(2.1) Z Zn2+ + 2e...(2.2)
Fe2+ Fe3+ + e...(2.3)
Contoh reaksi-reaksi Reduksi:
Cu2+ + 2e Cu...(2.4)
Sn4+ + 2e Sn2+...(2.5)
Cl2 + 2e 2Cl...(2.6)
3
Persitiwa pelepasan elektron leh suatu atom selalu disertai dengan peristiwa penangkapan elektron eleh atom lain, jadi peristiwa oksidasi selalu disertai oleh peristiwa reduksi.
Contoh Reaksi Redoks :
Zn Zn2+ + 2e (reduksi)...(2.7)
Cu2+ + 2e Cu (reduksi)...(2.8)
Zn + Cu2+ Zn2+ Cu (reduksi)...(2.9)
2.2 Reagensia yang Lazim pada Penerapan Titrasi Oksidasi-Reduksi 2.2.1 Zat Pengoksidasi
1. Natrium dan Hidrogen
Hidrogen peroksida merupakan zat pengoksida dengan potensialstandar positif yang besar.
H2O2 + 2H+ + 2 2H2O + 1,77V...(2.10)
2. Kalium dan Ammonium Peroksida Sulfat
Ion perosida sulfat merupakan zat pengoksida yang ampuh dalam larutan asam:
S2O62- +2e2SO42- ...(2.11)
3. Natrium Bismulat
Senyawa ini merupakan zat pengoksida yang ampuh, yang mengoksidasikan Mn (II), MnO4-, Cr (III), Cr
2O72-, Ce (III) , Ce (IV) (R.A Day Al
Underwood, 1986)
Transformasi yang mengubah atom netral menjadi ion-ion positif berlangsung dengan melepaskan elektron dan karena itu, proses itu merupakan suatu proses oksidasi, perhatikan contoh:
Fe Fe2+ + 2e-...(2.12)
pertambahan elektron dan oleh karena reaksi tersebut itu termasuk proses reduksi, contohnya:
Cl2 + 2e- 2Cl-...(2.13)
Oksidasi dan reduksi selalu berlangsung secara serentak dan jumlah yang dilepaskan pada oksidasi harus sama dengan jumlah elektron yang dilepaskan pada reduksi.
2.2.2 Zat Pereduksi
Larutan standar zat-zat pereduksi tidaklah begitu meluas pemakaiannya seperti larutan standard zat pengoksida karena kebanyakan zat pereduksi dioksidasi perlahan-lahan oleh oksigen dan udara. Natrium Tiosulfat adalah senyawaan satu-satunya pereduksi biasa yang dapat disimpan dalam waktu lama tanpa mengalami oksidasi dan tidak terganggu oleh udara, reagensia ini digunakan secara ekslusif untuk titrasi ion-ion. Zat-zat pereduksi yang kadang-kadang digunakan di laboratorium:
1. Besi
Larutan ion besi (III) dalam asam sulfat 0.5 – 1N dioksidasi oleh udara lambat-lambat saja dapat digunakan sebagai larutan standard. Akan tetapi normalitasnya harus dicek setidaknya tiap hari, larutan pemangat serium (IV) ataupun dikromat cocok untuk mentitrasi larutan besi (II).
2. Kromium (II)
Kromium (II) merupakan zat pereduksi yang ampuh dengan potensial reaksi, reaksinya adalah :
Cr3+ + e Cr2+
5
2.3 Keadaan Oksidasi
Keadaan oksidasi adalah suatu konsep yang sangat berguna untuk dapat mendiagnosa dengan cepat keadaan oksidasi atau reduksi suatu atom, dlam suatu senyawa seperti MnO2, H2ASO3, dan HASO42- keadaan oksidasi sutu atom dalam
suatu gabungan kimia adalah muatan listrik atom itu, yang di hitung menurut suatu kaidah tertentu, istilah lain yang biasa di gunakan untuk menyatakan keadan oksidasi ialah bilangan oksidasi atau keadaan valensi.Dua kaidah dasar untuk menentukan keadaan oksidasi:
1. Dalam senyawa ion biner, keadaan oksidasi ialah muatan per atom.
2. Dalam senyawa kovalen atau non-ion, elektron yang terlibat dalam pembentukan ikatan tidak sepenuhnya di alihkan dari unsur yang satu ke unsur yang lain tetapi di miliki bersama oleh atom – atom yang saling berikatan.
Kaidah (1) dan (2) mempunyai beberapa konsekuensi:
a. Keadaan oksidasi unsur bebas dan yang tidak bergabung ialah nol.
b. Keadaan oksidasi hidrogen dalam senyawa biasanya +1, kecuali dalam hal hibrida logam, di manan nilainya ialah -1.
c. Keadaan oksidasi oksigen dalam senyawa biasanya –Hm, kecualidalam peroksida, di mana nilainya adalah -1, atau di dalam senyawa fluor, dimana nilai itu bisa positif.
d. Hasil penjumlahan aljabar keadaan oksidasi yang positif dalam seluruh atom dalam setiap molekul netral ialah nol.
e. Hasil penjumlahan aljabar keadaan oksidasi yang positif yang negatif dalam seluruh atom yang setiap ion sama dengan muatan ion itu.
2.4 Menyeimbangkan Persamaan Oksidasi – Reduksi
a. Jika suatu logam yang mempunyai valensi positif atau di oksidasi, keadaan oksidasi hasilnya sudah jelas.
b. Jika hologen bebas di reduksi, hasil reduksinya adalah ion hologenida (muatan = -1).
c. Reduksi asam nitrat pekat menghasilkan NO2, sedangkan reduksi
asamnitrat encer mungkin menghasilkan NO, N2, NH4+, dan bergantung
pada zat pereduksi dan tingkat keenceran asam itu.
d. Ion pemanggonat, MnO4- direduksi menjadi Mn2+ dalam yang nyata – nyat
asam, sebagaimana juga MnO2, hasil reduksi permanganat di dalam larutan
netral atau alkali mungkin MnO(OH), MnO2.
e. Jika peroksida di reduksi, hasil reduksi harus mengandung oksigen dalam keadaan oksidasi, -11, seperti dalam H2O atau OH-, jika peroksida di
oksidasi, akan terbentuk olsigen molekul.
f. Dikromat, Cr2O72-, direduksi dalam larutan-larutan menjadi Cr3+.
( Rosemberg, 1980). Reduktometri adalah teknik titrasi yang menggunakan titran sebagai suatu reduktor,salah satu teknik ini adalah iodometri di bedakan menjadi iodometri langsung dan tidak langsung.pada iodometri langsung di gunakan sebagai titran,iodometri tidak langsung adalah metode titrasi berdasarkan reduksi zat analat oleh ion iodium sehingga timbul l2.Kemudian di titrasi dengan natrium
tiosulfat dan di tentukan jumlahnya, ion tiosulfat yang bereaksi dengan iodium membentuk ion titiationat (S4082-),keunggulan tiosulfat yang di pakai adalah tidak
mudah teroksidasi dengan udara,baik iodometri langsung maupun iodometri tidak langsung menggunakan amilum sebagai indicator perubahan waran(Keenan,1992) Syarat-syarat suatu larutan dapat menjadi titran yaitu :
1. Larutan harus benar-benar dalam keadaan murni dengan kadar pengotor < 0,02%
2. Larutan harus stabil secara kimiawi, mudah dikeringkan dan tidak bersifat higroskopis
BAB III
METODELOGI PRAKTIKUM
3.1 Alat dan Bahan 3.1.1 Alat - Alat 1. Neraca digital 2. Labu ukur 3. Pipet tetes 4. Pipet volume 5. Erlenmayer 6. Hot Plate
7. Buret dan corong 8. Spatula
9. Bola penghisap 10. Kaca arloji 11. Termometer 12. Spatula
3.1.2 Bahan - Bahan 1. FeCl2
2. HCl
3. Natrium thiosulfat 0,1 N 4. KI 20%
5. NaHCO3
6. Amilum
3.2 Prosedur Kerja
Adapun prosedur kerja yang harus dilakukan adalah:
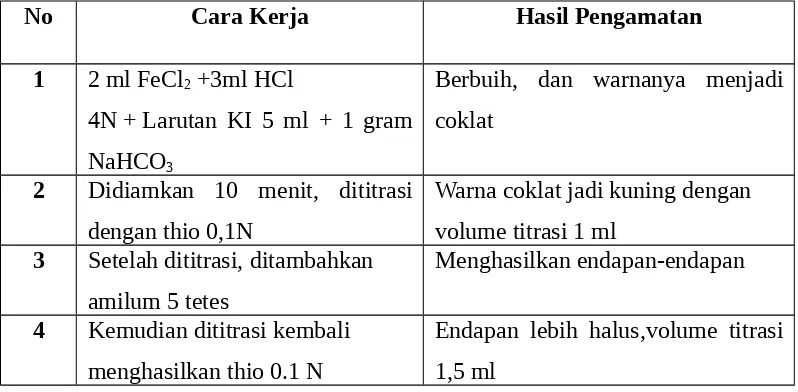
1. Dimasukkan 2 ml larutan FeCl2 dan 3 ml larutan HCl 4N kedalam
erlenmeyar, kemudian ditambah KI 5 ml dan 1 gram NaHCO3 , kemudian
ditutup.
2. Didiamkan diselama 10 menit,kemudian dititrasi dengan thio 0,1 N .
3. Setelah dititrasi ditambahkan amilum sebanyak 5 tetes sampai terdapat endapan.
4. Kemudian ditrasi kembali menggunakan thio 0,1 N 5. Hitung kadar FeCl2 dan Fe.
%FeCl2 = 1002 × V × N × BeCl2Berat sampel ×100 ×100%
%Fe = BM Fe
BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil
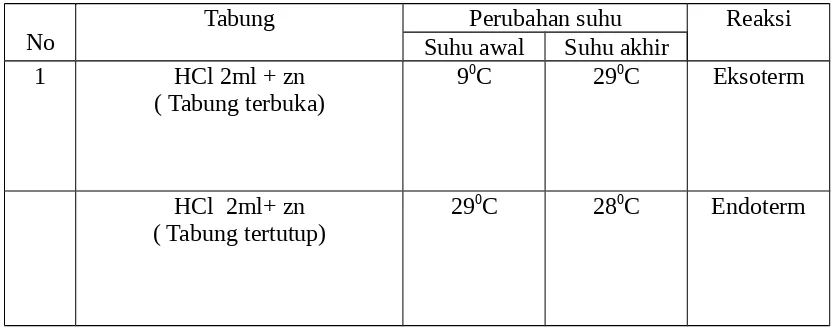
Tabel 4.1 Hasil Pengamatan Analisa Oksidimetri/Reduktometri
No Cara Kerja Hasil Pengamatan
Endapan lebih halus,volume titrasi 1,5 ml
4.2 Pembahasan
Ketika 2 ml larutan FeCl2 di tambahkan 3 ml HCl 4N, 5 ml KI 20% dan 1
gram NaHCO3menghasilkan larutan yang berbuih dan berwarna coklat. Buih-buih
dan gelembung yang tredapat dalam larutan tersebut adalah gas CO2 terperangkap
di dalam Erlenmeyer tertutup berguna untuk membentuk CO2 dalam larutan.
Tujuan dari menambahkan larutan HCl sebagai larutan untuk menstandarisasi atau sebagai menentu suasana asam,sebab larutan yang terdiri dari kalium iodide dalam kondisi netral atau memiliki keasaman rendah. Reaksinya adalah sebagai berikut:
IO3-+ 5I- + 6H+→ 3I2 + 3H2O
Selain itu HCl adalah pelaru tterbaik untuk besi sehingga membantu proses kelarutan. FeCl2 adalah larutan yang bersifat oksidator dan dapat mengoksida
kalium iodide yang di tambahkan membentuk iodium. Iodium yang terbentuk dapat di tentukan dengan menggunakan larutan baku natrium thiosulfat jadi dengan kata lain tujuan dari kalium iodium adalah sebagai standarisasi dalam proses pembakuan natrium thiosulfat. Tujuan dari penambahan NaHCO3 untuk
menurunkan keasaman larutan dan untuk mengusir oksigen dari wadah karena
CO2 lebih berat dan mencegah kontak O2 dengan larutan dan menjadi alasan
ditutupnya erlenmeyer adalah untuk mencegah kontak langsung O2 juga.
Pada percobaan kedua larutan di titrasi dengan thio 0,1N menghasilkan perubahan warna coklat menjadi kuning dan di capai volume titrasi sebesar 1 ml.Sedangkan tujuan penambahan 5 tetes amilum ke larutan yang telah di titrasi adalah karena larutan tersebut memiliki potensial reduksi rendah jadi untuk mereaksiakannya secara sempurna di perlukan suasana asam.Untuk itu di perlukan indicator, indicator tersebut adalah larutan amilum yang dapat membentuk senyawa absorpsi dengan thio. Pada percobaan ini menghasilkan endapan-endapan. Endapan-endapan itu adalah endapan yang berasal dari FeCl2
yang telah larut dengan HCl + KI + NaHCl3. Dan terpisah dengan indikator
amilum,setelah itu larutan di titrasi kembali menggunakan thio 0,1N menghasilkan endapan yang lebih halus dan mencapai volume titrasi kedua sebesar 1,5 ml.Penambahan amilum yang dilakukan saat mendekati titik akhir titrasi dimasudkan agar amilum tidak membungkus kalium iodium karena akan menyebabkan amilum sukar dititrasi untuk kembali ke senyawa semula. Proses titrasi harus dilakukan segera mungkin, hal ini disebabkan sifat I2 yang mudah
BAB V PENUTUP
5.1 Kesimpulan
Berdasarkan hasil dan pembahasan yang telah di uraikan, maka dapat di simpulkan bahwa :
1. Terjadi perubahan warna karena telah terjadinya reaksi kimia,yaitu dengan terbentuk endapan.
2. Volume titrasi pertama sebanyak ml dengan hasil warna coklat menjadi kekuning-kuningan.
3. Volume titrasi yang kedua adalah 1,5 ml dengan perubahan bentuk endapan yaitu endapan yang terbentuk menjadi lebih halus di banding volume titrasi yang pertama.
4. Saat titrasi dengan amilum terbentuk endapan. 5. Kadar FeCl2 dalam sampel yaitu 11,105 %
6. Kadar Fe dalam sampel yaitu 2,25 %
5.2 Saran
Dari praktikum yang telah dilakukan terdapat saran yang perlu disampaikan yang diantaranya adalah:
1. Ketelitian pada saat melakukan penitrasian mencapai end point
2. Keakuratan data pada saat perhitungan kadar % FeCl2 dan % Fe yang
terkandung dalam sampel yang digunakan.
3. Fokus dalam mengamati percobaan tahap demi tahap.
BAB I PENDAHULUAN
1.1 Judul Praktikum : Analisa Konsentrasi
A. Analisa Konsentrasi CO2 dalam Air
Sampel
B. Analisa Konsentrasi NaOH dalam Air Sampel
C. Analisa Kadar NaCl dalam Air Laut D. Analisa % HCl
1.2 Tanggal Pratikum : 5 Oktober 2015 9 November 2015 1.3 Pelaksana Praktikum :1. Amrizal
2. Chairun Nisa 3. Fathan Zakian 4. Junidar A Saragih 5. Nurul Azmi
1.4 Tujuan Praktikum :1. Menentukan kadar CO2 dalam air sampel
2. Untuk menghitung kadar NaOH dalam air sampel
3. Untuk menghitung kadar NaCl dalam Air Laut
4. Untuk menghitung % HCl
Campuran zat-zat yang homogen disebut larutan, yang memiliki komposisi merata atau serba sama di seluruh bagian volumenya. Suatu larutan mengandung satu zat terlarut atau lebih dari satu pelarut. Zat terlarut merupakan satu komponen yang jumlahnya sedikit, sedangkan pelarut adalah komponen yang terdapat dalam jumlah yang lebih banyak. Suatu larutan dengan jumlah maksimum zat terlarut pada temperatur tertentu disebut larutan jenuh, Sebelum mencapai keadaan jenuh, larutan tidak jenuh.Kadang-kadang dijumpai suatu keadaan dengan zat terlarut dalam larutan lebih banyak daripada zat terlarut yang seharusnya dapat melarut pada temperatur tersebut. Larutan yang demikian disebut larutan lewat jenuh.
Banyaknya zat terlarut yang dapat menghasilkan larutan jenuh, dalam jumlah tertentu pelarut pada temperatur konstan disebut kelarutan. Kelarutan suatu zat bergantung pada sifat zat itu, molekul pelarut, temperatur, dan tekanan. Meskipun larutan dapat mengandung banyak komponen, tetapi pada kesempatan tertentu larutan dapat mengandung dua komponen yaitu larutan biner. Lomponen dari larutan biner yaitu zat terlarut dan pelarut (Hiskia, 1996).
Berdasarkan daya hantar larutan dapat dibedakan menjadi 2 macam antara lain larutan elektrolit dan larutan non elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Sedangkan larutan non elektrolit yang dapat menghantarkan arus listrik (Team Jurusan Teknik Kimia, 2012).
Fasa larutan dapat berupa fasa padat yang bergantung pada sifat-sifat kedua komponen pembentuk larutan dan fasa zat-zat pembentuknya sama. Jenis-jenis larutan yaitu gas, cair, dan padat antara lain:
1. Larutan gas, penyusunnya campuran antara gas antar uap (dalam semua perbandingan), contoh: udara dengan N2 sebagai pelarut.
15
2. Larutan cair, zat padat, zat cair atau gas melarut ke dalam pelarut cair atau gas melarut ke dalam zat padat dan pelarut cair. Contoh: asam asetat dalam air.
3. Larutan padat, gas terlarut dalam zat padat (gas H2 dalam logam
palladium), zat cair terlarut dalam zat padat (raksa dalam logam emas), zat padat terlarut dalam zat padat (seng dalam tembaga, karbon dalam besi). 4. Larutan baku/larutan standar adalah larutan yang konsentrasinya telah .
Larutan baku biasanya berfungsi sebagai titran sehingga ditempatkan buret, yang sekaligus berfungsi sebagai alat ukur volume larutan baku. Larutan yang akan ditentukan konsentrasinya atau kadarnya, diukur volumenya dengan menggunakan pipet volumetri dan ditempatkan di erlenmeyer.
a. Larutan baku primer
Larutan yang mengandung zat padat murni yang konsentrasi larutan diketahui secara tepat melalui metode gravimetri (perhitungan massa), dapat digunakan untuk menetapkan konsentrasi larutan lain yang belum diketahui. Nilai konsentrasi dihitung melalui perumusan sederhana, setelah dilakukan penimbangan teliti dari zat pereaksi tersebut dan dilarutkan dalam volume tertentu. Contohnya K2CrO7, AS2O3, NaCl, asam oksalat, asam benzoat (Beni,
1997).
b. Larutan suatu zat yang konsentrasinya tidak dapat diketahui dengan tepat karena berasal dari zat yang tidak pernah murni. Konsentrasi larutan ini ditentukan dengan pembakuan menggunakan larutan baku primer, biasanya melalui metode titrimetri. Contohnya AgNO3, KmnO4, Fe(SO4)2 (Basset J, 1994).
2.2 Reaksi dalam Larutan
Banyak reaksi baik di dalam laboratorium mapupun di alam lingkungan kita, satu atau lebih pereaksi berada dalam larutan. Pereaksi tersebut larut dalam bermacam-macam cairan, misalnya air. Dalam tubuh kita misalnya, makanan larut dalam darah dan dibawa ke dalam sel, di mana terjadi reaksi rantai yang kompleks dan disebut metabolisme.
sesuatu terjadi. Tetapi jika kedua senyawa ini masing-masing kita larutkan terlebih dahulu dalam air dan kemudian dicampur, suatu reaksi, yang cepat akan terjadi. Tetapi jika kedua senyawa ini masing-masing kita larutkan terlebih dahulu dalam air dan kemudian dicampur, suatu reaksi yang cepat akan terjadi, seperti prinsip pereaksi larut.
Alasan terjadinya perbedaan dalam keadaan yang padat dan keadaan cair tidak begitu sukar untuk dipahami. Jika kristal dicampur, hanya permukaan luarnya saja yang dapat kontak, yang berarti hnaya sebagian kecil pereaksi yang mungkin dapat bereaksi. Jika senyawa ini dilarutkan dalam air, masing-masing partikel pereaksi dalam keadaan bebas dan dapat dengan mudah bercampur dengan molekul air. Jika keduan senyawa ini bercampur dan menyebabkan terjadinya reaksi diantara dua senyawa tersebut lebih cepat. Persamaan reaksi yang terjadi NaCl(aq) + AgNO3(aq)→AgCl(s) + NaNO3(aq) di mana kita menggunakan
kata (aq) untuk memperlihatkan NaCl, AgNO3, dan NaNO3 berada dalam keadaan
larut dalam air (aqous solution) dan (s) unturk memperlihatkan AgCl dalam keadaan padat (solut). Cairan yang berbentuk susu kental dari hasil reaksi campuran disebabkan oleh munculnya zat padat putih (AgCl). Zat padat yang terbentuk dalam larutan sebagai hasil suatu reaksi kimia seperti ini disebut endapan (presipitat).
Suatu reaksi kimia dalam reaksi tidak selalu dilihat dengan terbentuknya suatu endapan. Dalam beberapa reaksi terbentuk gas, seperti misalnya reaksi antara asam klorida dan natrium karbohidrat. Kadang-kadang yang terjadi hanya perubahan warna dan ada pula yang kelihatannnya tidak terjadi perubahan sama sekali, karena semua pereaksi dan hasil reaksi larut dalam air dan tidak berwarna. 2.3 Terminologi yang Digunakan untuk Larutan
17
cair adalah pelarut (solven) dan garam yang padat dan larut dalam air disebut solute (zat yang terlarut).
Di dalam definisi larutan yang berupa suatu campuran homogen yang komposisinya berbeda, misalnya sejumlah garam larut dalam sejumlah air yang diketahui, dapat berbeda dari satu larutan ke larutan lainnya. Jika kita ingin mengubah menjadi jumlah relatif solut dan solven dalam suatu larutan yang mengandung sejumlah besar solute dalam suatu solven yang diketahui jumlahnya disebut itu mengandung solute yang pekat. Jika membandingkan secara kuantitatif konsentrasi relatif dari larutan itu, kita menggunakan istilah pekat dan encer. Suatu larutan pekat adalah solut (zat terlarut) yang relative konsentrasinya tinggi dan larutan encer adalah solute yang konsentrasinya kecil. Suatu hal yang perlu diingat adalah larutan pekat yang lain adalah larutan encer. Larutan encer adalah istilah yang relatif. Larutan yang menbgandung 0.01 g NaCl perliter adalah larutan encer yang jika dibandingkan dengan larutan pekat yang mengandung 0,1 g NaCl perliter, tetapi larutan 0,1 g NaCl adalah larutan encer jika dibandingkan dengan larutan 10 g NaCl per liter.
2.4 Proses Pelarutan 2.4.1 Solvasi dan hidrasi
Senyawa polar pada umumnya melarut dalam pelarut polar. Air adalah pelrut senyawa polar yang baik karena memiliki momen dipole besar yaitu 1,84 D. Pelarut lain yang mempunyai dipole besar seperti HCN (2,9 D), HF cair (1,9 D), namun jarang digunakan karena sangat sukar bekerja dengan zat-zat ini. Pelarut suatu senyawa dalam suatu pelarut dapat dianggap sebagai reaksi anatara zat terlarut dan pelarut. Jika pelarutnya S da zat terlarutnya adalah senyawa ion maka ion reaksi yang terjadi:
MX(s)+yS(l)→(MSa)+ + (XSb)-+ =1484 (y-a-b)S(l) ...(2.1)
Peristiwa ini disebut solvasi. Jika pelarutnya adalah air,
MX(s) + yH2O(l) → (M(H2O)s)+ + (x(H2O)b)- + (y-a-b) H2O(l)...(2.2)
(X(H2O)b)- ditulis X-(aq) (James E Brady, 1995).
2.5 Energi Pelarutan
Peristiwa pelarutan suatu senyawa ion MX(s) dapat ditulis sebagai berikut,
MX(s) → M+(aq) + X-(aq) ...(2.3)
E1 = ∆H
∆H = kalor pelarutan
Kalor pelarutan suatu senyawa ion dalam proses pelarutan terdiri atas tiga faktor yaitu:
1. Energi yang diperlukan untuk memecahkan struktur kisi padat menjadi ion gas (kebalikan energy kisi).
MX(s) → M+(g) + X(g) ...(2.4) E2 = EK
Ek adalah energy kisi
2. Energi solvasi (untuk pelarutan air disebut energy hidrasi)
M+(g) + X-(g) → M+(aq) + X-(aq) ...(2.5) E3 = Eh
Eh adalah energi hidrasi (Hiskia, 1996). 2.6 Sifat Larutan
Jenis zat terlarut dan jenis prlarut akan mempengarughi sifat larutan yang terbentuk. Air merupakan pelarut yang tidak asing lagi dalam pelarut air, dan sifat larutannya. Sifat-sifat air seperti mudah diperoleh, mudah digunakan, memiliki berbagai trayek cair yang panjang dan kemampuannya untuk melarutkan berbagai zat adalah sifat-sifat yang tidak dimiliki oleh pelarut lainnya. Sifat ini menempatkan air menjadi pelarut yang universal. Kenyataan inilah yang mendorong banyaknya usaha pengkajian perilaku, perubahan sifat dan analisis kimia zat seing dilakukan dalam medium air.
2.7 Proses Melarut
1. Melarut (to dissolve) dapat diartikan sebagai
Terdispersinya molekul-molekum zat terlarut di dalam molekul-molekul air: misalnya gula dalam air, minyak dalam air atau dalam hal lain CCl4
dalam benzene.
19
3. Berinteraksimya zat terlarut dengan pelarut (air). 2.8 Konsentrasi Larutan
Konsentrasi didefinisikan sebagai jumlah zat terlarut dalam setiap satuan larutan atau pelarut. Pada umumnya konsentrasi dinyatakan dalam satuan fisik, misalnya satuan berat atau satuan volume atau satuan kimia, misalnya mol, massa rumus dan equivalen. Cara menyatakan konsentrasi dalam satuan fisik yaitu, persen berat, % w/w, persen volume: % vn, persen berat-volume: % w/v, gram zat terlarut dalam satuan millimeter larutan, parts per million, parts per billion.
Cara menyatakan konsentrasi dalam satuan kimia yaitu, kemolaran (M), kemolalan (m), kenormalan (N), keformalan (F), fraksi mol. Di bidang kedokteran dan ilmu-ilmu biologi biasanya digunakan satuan konsentrasi dalam persen berat-volume (%w/v), persen milligram, ekivalen (Ea), mili ekivalen (mEa), dan keosmopolaran (Mulyono, 2006).
2.8.1 Persen Konsentrasi
Dalam bidang kimia sering digunakan persen untuk menyatakan konsentrasi larutan. Persen konsentrasi dapat dimyatakan dalam persen berat (% w/w), persen volume (% v/v), dan persen berat/volume (% w/v).
1. Persen berat (% w/w)
Persen berat (% w/w) = gram zat terlarutgram zat terlarut + gram pelarut ×100 ..(2.8) Persen berat (% w/w) = gram zat terlarut
gram larutan × 100 ...(2.9) 2. Persen volume (% v/v)
Persen volume ¿ml zat terlarut
ml larutan ×100 ...(2.10) 3. Persen Berat/Volume (% w/v)
Persen Berat/Volume (% w/v) = gram zat terlarut
ml larutan × 100 ...(2.11) 2.8.2 Parts per Milion dan Parts per billion
Jika larutan sangat encer digunakan satuan konsentrasi parts per million (ppm), dan parts per billion (ppb). Satu ppm ekivalen dengan 1 mg zat terlarut dalam 1 L larutan.
1 ppm = 1 mg zat terlarut1 L larutan ...(2.12)
1 ppb = 1 α zat terlarut1 L larutan ...(2.13)
Parts per million dan parts per billion adalah satuan yang mirip persen berat. Jika persen berat, gram zat terlarut per 100 gram larutan, ppm gram zat terlarut persejuta gram larutan.
ppm = berat zat terlarutberat larutan ×106 ...(2.14)
ppb = berat zat terlarut
berat larutan × 109 ...(2.15) 2.8.3 Fraksi Mol (X)
Fraksi mol A = XA = Jumlah mol AJumlah mol semua komponen ...(2.16)
Fraksi mol zat terlarut =
Jumlah mol zat terlarutJumlah mol senyawa komponen...(2.17)
Fraksi mol pelarut = Jumlah mol pelarut
Jumlah mol zat terlarut + jumlah mol pelarut ...(2.18) Jumlah kedua fraksi mol (fraksi mol terlarut + jumlah mol pelarut) sama dengan satu.
2.8.4 Keformalan (F)
Keformalan = Jumlah massa rumus terlarut
Liter larutan ...(2.19) 2.8.5 Kemolaran (M)
Kemolaran atau konsentrasi molar, M, suatu larutan menyatakan jumlah mol spesi zat terlarut dalam 1 liter larutan atau jumlah milimol dalam 1 ml larutan.
Kemolaran (M) = Mol zat terlarut
21
Jika mM adalah massa molar (g mol-1)
2.8.7 Kenormalan (N)
Kenormalan = Ekivalen zat terlarutLiter Larutan ...(2.21) 2.9 Kadar Karbondioksida
Kadar karbondioksida (CO2) yang baik bagi organisme perairan yang
kurang lebih 15 ppm. Jika lebih dari sangar membahayakan karena menghambat pengikatan oksigen (O2). Lebih lanjut dikatakan kadar karbondioksida yang
berlebih dapat diatasi dengan melakukan air secara rutin agar tidak mengurangi pertumbuhan organism misalnya ganggang (Mujiman, 1989).
Tinggi dan rendahnya suatu karbondioksida dalam perairan tidak lepas dari pengaruh parameter seperti oksigen, alkanitas, kesadahan, suhu, cahaya dan sebagainya. Di mana semakin tinggi karbondioksida maka oksigen yang diperlukan bertambah. Konsentrasi karbondioksida sangat erat hubungannya dengan konsentrasi tidak terdapat dalam bentuk gas. Hal ini karena adanya pembentukan adanya pembentukan kalsium dan magnesium karbonat yang memiliki sifat rendah sehingga mengalami presipitasi (Zonneveld, 1991).
2.10 Titrasi
Titrasi merupakan metode analisa secara kuantitatif yang biasa digunakan dalam laboratorim untuk menentukan kadar atau konsentrasi dari reaktan. Karena pengukuran volume titrasi memainkan peranan penting dalam titrasi, maka teknik ini juga dikenal dengan analisa volumetrik. Analisa titrimetri merupakan satu dari bagian utama dari kimia analitik dan perhitungannya berdasarkan hubungan titrimetri.
BAB III
METODELOGI PRAKTIKUM 3.1. Alat dan Bahan
3.1.1 Peralatan yang digunakan
3.1.1.1 Analisa Konsentrasi CO2 dalam Air
1. Buret
3.1.1.2 Analisa Konsentrasi NaOH dalam Braine 1. Buret
3.1.1.3 Analisa Konsentrasi NaCl dalam Air Laut 1. Buret
3.1.2.1 Analisa Konsentrasi CO2 dalam Air
1. Natrium Hidroksida (NaOH) 2N 2. Indikator fenolfthalein (PP) 1% 3 tetes 3. Air keran 5 ml
4. Air mineral 5 ml
3.1.2.2 Analisa Konsentrasi NaOH dalam Braine 1. Thio 1N
2. Asam Klorida (HCl) 0,1N 3. Indikator metil orange 3 tetes
4. Indikator fenolfthalein (PP) 3 tetes 1% 5. Air kolam 10 ml
6. Air garam 10 ml
3.1.2.3 Analisa Konsentrasi NaCl dalam Air Laut 1. AgNO3 0,1 N
Adapan prosedur kerja yang dilakukan sebagai berikut
1. Air keran dan air mineral diambil menggunakan pipet volume masing-masing 5 ml, lalu dimasukkan ke dalam erlenmeyer
2. Kemudian ditambahkan indikator fenolfthalein 3 tetes
3. Lalu dititrasi dengan larutan NaOH 2N yang telah diketahui normalitasnya 4. Dihitung kadar CO2
3.2.2 Analisa Konsentrasi NaOH dalam Sampel
1. Air kolam dan air garam diambil menggunakan pipet volume masing-maisng 10 ml, lalu dimasukkan ke dalam erlenmeyer
2. Lalu ditambahkan 1 ml thio
3. Kemudia ditambahkan 2 tetes indikator fenolfthalein (PP)
4. Lalu dititrasi dengan HCl sampai berubaha keruh dan catat volumenya 5. Lalu ditambahkan 3 tetes indikator meti; orange larutan menjadi merah
muda, titrasi dilanjutkan sampai mencapai titik akhir titrasi (berwarna merah muda) dan dicatat volumenya
6. Kemudian dihitung kadar NaOH
3.2.3 Analisa Konsentrasi NaCl dalam Air Laut
1. Sampel dipipet sebanyak 10 ml dan dimasukkan ke dalam labu ukur 50 ml
25
3. Sampel yang telah diencerkan kemudian diambil sebanyak 10 ml dimasukkan ke dalam erlenmeyer
4. Ditambahkan indikator K2CrO4 sebanyak 3 tetes
5. Dititrasi dengan AgNO3 0,1 N sampai end point (terbentuk endapan)
6. Dihitung kadar NaCl 3.2.3 Analisa % HCl
1. Ditimbang 10 gram sampel dan dimasukkan ke dalam erlenmeyer
2. Diambil 2 ml aquadest, dimasukkan ke dalam erlenmeyer yang berisi sampel
3. Ditambahkan 3 tetes indikator PP
No
4.1.2 Analisa Konsentrasi NaOH dalam sampel
Tabel 4.2 Hasil Percobaan Analisa Konsentrasi NaOH dalam sampel No
27
Tabel 4.3 Hasil Percobaan Analisa Konsentrasi dalam Air Laut
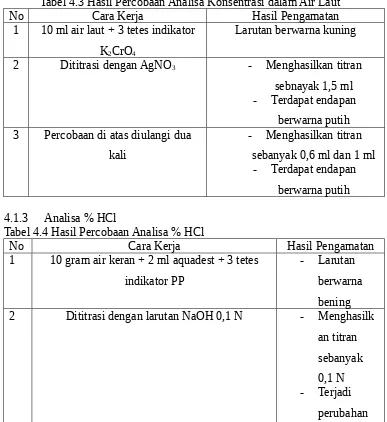
No Cara Kerja Hasil Pengamatan
1 10 ml air laut + 3 tetes indikator K2CrO4
Larutan berwarna kuning 2 Dititrasi dengan AgNO3 - Menghasilkan titran
sebnayak 1,5 ml - Terdapat endapan
berwarna putih 3 Percobaan di atas diulangi dua
kali
- Menghasilkan titran sebanyak 0,6 ml dan 1 ml
- Terdapat endapan berwarna putih 4.1.3 Analisa % HCl
Tabel 4.4 Hasil Percobaan Analisa % HCl
No Cara Kerja Hasil Pengamatan 2 Dititrasi dengan larutan NaOH 0,1 N - Menghasilk
an titran
3 Air keran 10 gram + 2 ml aquadest + indikator PP sebanyak 3 tetes
Larutan berwarna bening 4 Dititrasi dengan larutan NaOH 0,1 N Menghasilkan
titran sebanyak 0,25 ml
perubahan warna menjadi merah
muda 4.2
Pembahasan
Ketika 5 ml air keran dan 3 tetes indikator PP 1% dimasukkan ke dalam erlenmeyer diamati larutan berwarna bening. Hasil yang sama juga diperoleh saat 5 ml air mineral ditambah 3 tetes indikator PP 1%. Larutan kemudian dititrasi dengan menggunakan larutan NaOH 2N. Titrasi adalah metode analisis kimia secara kuantitatif untuk menentukan konsentrasi reaktan. Pada 5 ml air keran yang pertama volume titrasinya 0,3 ml dan yang kedua 0,4 ml. Sedangkan sampel air mineral volume titrasinya untuk kedua-duanya ialah 0,1 ml. Pada percobaan analisa konsentrasi CO2 setelah itu digunakan indikator untuk mengetahui
penambahan titran berhenti. Indikator bertanggap pada adanya titran berlebih dengan berubah warna. Sehingga pada percobaan analisa konsentrasi CO2 setelah
dititrasi dengan NaOH larutan yang telah bercampur dengan indikator PP 1% berubah warna menjadi merah muda. Pada saat belum ada penambahan NaOH ke dalam larutan titrat, larutan titrat masih berada dalam suasana netral, sehingga di dalam larutan masih banyak terdapat ion H+. Hal ini menyebabkan molekul
indikator PP 1% di dalam larutan lebih banyak dari ionnya, sehingga warna larutan dipengaruhi oleh warna indikator PP 1%, yaitu tidak berwarna. Sedangkan pada saat titrasi dimulai, yang menyebabkan larutan yang berwarna merah muda pda pH larutan terus meningkat dengan adanya NaOH. Peningkatan pH larutan menyebabkan larutan menjadi semakin basa. Karena larutan menjadi semakin basa, jumlah ion H+ menjadi tidak ada dan jumlah ion OH- dalam larutan akan
semakin banyak. Ion-ion akan meningkat dan mengikat ion H+, sehingga
konsentrasi ion H+ akan berkurang dan keseimbangan adak bergeser ke kanan.
29
atau melewatinya. Setelah didapat volume titrasi dan hasil pengamatan dapatlah dihitung kadar CO2 yang terdapat di dalam air keran dan air mineral. Pada sampel
air keran volume titrasi yang pertama dan kedua 5280 ppm dan yang kedua 7040 ppm. Sedangkan air mineral yang pertama dan kedua volume titrasinya 1760 ppm. Hasil yang berbeda-beda disebabkan karena perbedaan volume titrasi pula. Volume titrasi yang berbeda-beda disebabkan karena metode yang digunakan yaitu dengan metode visual (titik akhir pada saat berubah warna). Perubahan warna ini dapat atau tidak terjadi tepat pada saat titik akhir titrasi. Dalam percobaan ini satuan yang digunakan adalah ppm. Sebab ppm merupakan penyataan konsentrasi untuk larutan yang sangat encer.
Kadar CO2 yang diperoleh dalam percobaan ini dapat menajdi cara kita
untuk mengetahui sampel mana yang baik dikonsumsi, sebab kadar CO2 yang
tinggi menamdakan bahwa air itu kurang baik untuk dikonsumsi. Sehingga dalam percobaan ini air mineral lebih layak konsumsi daripada air keran. Jumlah CO2
yang terdapat dalam air yang ideal adalah 103 mg/liter (ppm).
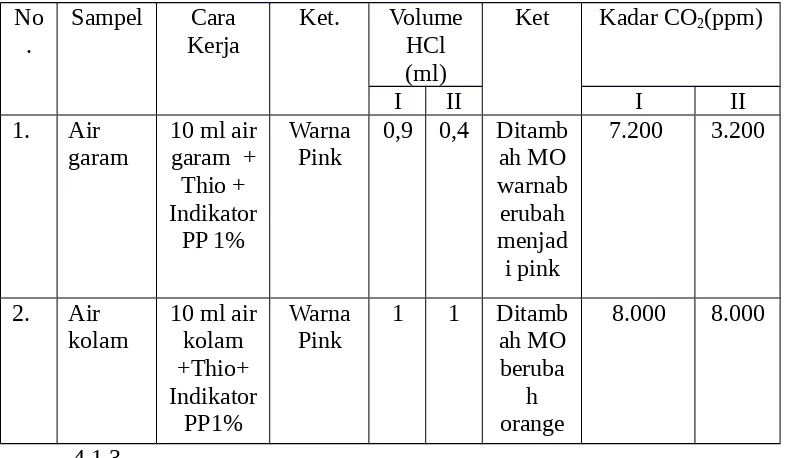
Sedangkan untu k analisa konsentrasi NaOH dalam braine ketika 10 ml air garam ditambahkan indikator PP 1% dicampurkan larutan berwarna bening disebbakan oleh banyak terdapat ion H+ sehingga warna larutan dipengaruhi oleh
warna indikator PP 1% yaitu tidak berwarna. Hal sama juga dihasilkan sampel air keran kemudian kedua sampel larutan dititrasi dengan thio 0,1N dan menghasilkan perubahan wrana menajdi keruh. Perubahan warna menjadi tanda titik akhir titrasi. Titrasi sampel air garam pertama memiliki volume 0,9 ml dan yang kedua 0,4 ml. Sedangkan volume titrasi air kolam yang sama untuk percobaan pertama dan kedua yaitu sebesar 1 ml. Titrasi ini merupakan titrasi asam kuat (HCl). Indikator PP 1% memiliki trayek 8,0 – 9,6. Pada percobaan ini indikator PP 1% mengalami disosiasi menjadi ion-ionnya. Pada larutan masih banyak mengandung ion H+, sehingga warna arutan dipengaruhi warna
Setelah didapat volume titrasi diketahui kadar NaOH yang tekandung dalam sampel. Di dalam sampel air garam pada percobaan pertama terdapat 7200 ppm dan yang kedua 3200 ppm. Untuk air kolma kadarnya 8000 ppm untuk kedua percobaanya. Volume titrasi yang berbeda-beda disebabkan karena metode visual (melihat titik akhit berdasarkan perubahan warna larutan). Peubahan warna dapat atau tidak terjadi tepat saat titrasi. Sama halnya dengan analisa konsentrasi CO2 dalam air, satuan yang dipakai adalah ppm menyatakan konsentrasi larutan
yang sangat encer.
Pada percobaan ini sampel yang digunakan adalah air laut. Ketika air laut ditambahkan dengan indikator K2Cr2O4, larutan berwarna kuning,
perubahan menjadi kuning pada larutan ini disebabkan oleh penambahan senyawa K2Cr2O4 yang apabila ditambahkan dengan senyawa apapun akan
merubah sebuah senyawa atau larutan menjadi kuning. Hal ini dikarenakan sifat dari unsur yang terdapat dalam senyawa K2Cr2O4 berawarna kuning.
Kemudian larutan dititrasi dengan AgNO3 dan menghabiskan volume
31
Pada percobaan ini sampel yang diganakan adalah air keran. Pada saat air keran ditambahkan aquadest dan juga ditambahkan 3 tetes indikator PP menghasilkan larutan bening. Hal tersebut terjadi karena larutan bersifat netral sehingga tidak merubah warna dasar dan sifat larutan yang terdiri atas air keran, aquadest dan indikator yang tidak berwarna atau bening. Setelah larutan dititrasi dengan NaOH 1 N dan menghasilkan warna larutan berubah menjadi merah muda. Perubahan warna larutan terjadi karena larutan telah berubah menjadi asam dengan pH dibawah 7. Kemudian melalui titrasi tersebut diperoleh volume titrasi sebanyak 0,2 ml. perubahan warna larutan juga menandakan bahwa titik akhir titrasi telah terjadi.
Kemudian percobaan analisa % HCl pengulangan sebanyak 2 kali dengan prosedur kerja yang sama. Pada pengulangan keduan dihasilkan volume titrasi 0,25 ml dan pada pengulangan ketiga didapat volume titrasi sebanyak 0,2 ml. sama halnya pada percobaan pertama, larutan berubah warna dari larutan bening menjadi merah muda. Sebab titrasi adalah metode analisa kimia untuk menentukan konsentrasi suatu reaktan. Untuk mengetahui penambahan titran telah berhenti, digunakan indikator yang bertanggap terhadap titran berlebih terhadap perubahan warna. Titik titrasi pada saat indikator berubah warna disebut titik akhir, oleh karena itu pada percobaan analisa % HCl ini larutan berubah warna menjadi merah muda.
1. Volume titrasi untuk menentukan kadar CO2 dalam air keran adalah 0,3 ml
dan 0,4 ml. Sedangkan untuk menentukan kadar CO2 dalam air mineral 0,1
ml
2. Saat dititrasi dengan dengan NaOH air keran dan air mineral berubah warna menjadi merah muda
3. Jika kadar CO2 tinggi dalam air, maka air tersebut tidak baik untuk dikonsumsi
4. Perubahan warna setelah dititrasi oleh indikator PP 1 % adalah bening 5. Kadar CO2 dalam air keran 5280 ppm dan 7040 ppm. Sedangkan dalam
air mineral 1760 ppm.
6. Volume titrasi air garam untuk menentukan konsentrasi NaOH 0,9 ml dan 0,4 ml. Sedangkan volume titrasi air kolam 1 ml
7. Kadar NaOH yang terdapat dalam air garam 7200 ppm dan 3200 ppm. Sedangkan dalam air kolam 8000 ppm
8. Penambahan indikator PP 1 % akan mengubah warna sampel dan akan mempermudah titik akhir titrasi
9. Terbentuknya endapan pada percobaan analisa konsentrasi NaCl dalam air laut menunjukkan bahwa titik akhir titrasi telah dicapai.
10. Terjadinya perubahan warna larutan pada percobaan analisa % HCl menandakan bahwa titik akhir titrasi telah tercapai.
11. Dalam percobaan ini digunakan indikator K2CrO4 dan indikator PP yang
berguna untuk mempercepat terjadinya reaksi pada larutan.
12. Semakin besar volume titrasi yang dihabiskan, maka semakin tinggi pula konsentrasinya, sebaliknya semakin sedikit volume titrasi yang dihabiskan, maka semakin rendah pula konsentrasinya.
4.2 Saran
Dalam percobaan analisa konsentrasi selain menggunakan metode analisis titrimetri. Dikenal juga metode analisa gravimetri. Gravimetri pada tahap pengukuran dalam metodenya adalah penimbangan. Analitnya secar fisik dipisahkan dari semua komponen lain dari sampel itu maupun dari pelarutnya.
33
1.1 Judul Praktikum : Analisa Dengan Peralatan Instrument 1.2 Tanggal Praktikum : 2 November 2015
1.3 Pelaksana Praktikum : Kelompok 2 1. Amrizal 2. Chairun Nisa 3. Fathan Zakian 4. Junidar A Saragih 5. Nurul Azmi 1.4 Tujuan Praktikum :
1.4.1 pH Meter
a. Merangkai instalasi pH meter, mengkalibrasi dan mempergunakan pH meter
b. Menghitung derajat keasaman / basa dalam pernyataan konsentrasi ion hidrogen dalam larutan sampel.
1.4.2 Analisa Fe Secara Spektrofotometri
Untuk mengetahui kadar Fe dalam air sampel
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Spektrofotometer
Spektrofotometri adalah suatu metode analisis yang berdasarkan pada pengukuran serapan sinar monokromatis oleh suatu lajur larutan berwarna pada panjang gelombang yang spesifik dengan menggunakan monokromator prisma atau kisi difraksi dan detector vacuum phototube atau tabung foton hampa. Alat yang digunakan adalah spektrofotometer, yaitu sutu alat yang digunakan untuk menentukan suatu senyawa baik secara kuantitatif maupun kualitatif dengan mengukur transmitan ataupun absorban dari suatu cuplikan sebagai fungsi dari konsentrasi. Pada titrasi spektrofotometri, sinar yang digunakan merupakan satu berkas yang panjangnya tidak berbeda banyak antara satu dengan yang lainnya, sedangkan dalam kalorimetri perbedaan panjang gelombang dapat lebih besar. Dalam hubungan ini dapat disebut juga spektrofotometri adsorpsi atomic (Harjadi, 1990).
Spektrometer menghasilkan sinar dari spectrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau diabsorbsi. Kelebihan spectrometer dibandingkan fotometer adalah panjang gelombang dari sinar putih dapat lebih terseleksi dan ini diperoleh dengan alat pengurai seperti prisma, grating, atau celah optis. Pada fotometer filter dari berbagai warna yang mempunyai spesifikasi melewatkan trayek panjang gelombang tertentu. Pada fotometer filter tidak mungkin diperoleh panjang gelombang yang benar-benar monokromatis, melainkan suatu trayek panjang gelombang 30-40 nm. Sedangkan pada spektrofotometer, panjang gelombang yang benar-benar terseleksi dapatdiperoleh dengan bantuan alat pengurai cahaya seperti prisma. Suatu spektrofotometer tersusun dari sumber spektrum tampak yang kontiniu, monokromator, sel pengabsorbsi untuk larutan sampel atau blanko dan suatu alat untuk mengukur perbedaan absorbsi antara sampel dan blanko ataupun pembanding (Khopkar, 2002).
Sinar yang melewati suatu larutan akan terserap oleh senyawa-senyawa dalam larutan tersebut. Intensitas sinar yang diserap tergantung pada jenis senyawa yang ada, konsentrasi dan tebal atau panjang larutan tersebut. Makin tinggi konsentrasi suatu senyawa dalam larutan, makin banyak sinar yang diserap.
Spektrometer menghasilkan sinar dari spectrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau diabsorbsi. Kelebihan spectrometer dibandingkan fotometer adalah panjang gelombang dari sinar putih dapat lebih terseleksi dan ini ndiperoleh dengan alat pengurai seperti prisma, grating, atau celah optis. Pada fotometer filter berbagai filter dari berbagai warna yang mempunyai spesifikasi melewatkan trayek panjang gelombang tertentu.
Pada fotometer filter tidak mungkin diperoleh panjang gelombang yang benar-benar monokromatis, melainkan suatu trayek panjang gelombang 30-40 nm. Sedangkan pada spektrofotometer, pnjang gelombang yang benar-benar terseleksi dapatdiperoleh dengan bantuan alat pengurai cahaya seperti prisma. Suatu spektrofotometer tersusun dari sumber spektrum tampak yang kontinyu, monokromator, sel pengabsorbsi untuk larutan sampel atau blanko dan suatu alat untuk mengukur perbedaan absorbsi antara sampel dan blanko ataupun pembanding. Pengertian spektrofotometri lebih spesifik atau pengertiannya lebih sempit karena ditunjukan pada interaksi antara materi dengan cahaya (baik yang dilihat maupun tidak terlihat), sedangkan pengertian spektroskopi lebih luas misalnya cahaya maupun medan magnet termasuk gelombang elektromagnetik (Eka, 2007 ).
Pengertian spektroskopi dan spektrofotometri pada dasarnya sama yaitu di dasarkan pada interaksi antara materi dengan radiasi elektromagnetik. Namun pengertian spektrofotometri lebih spesifik atau pengertiannya lebih sempit karena ditunjukan pada interaksi antara materi dengan cahaya (baik yang dilihat maupun tidak terlihat). Sedangkan pengertian spektroskopi lebih luas misalnya cahaya maupun medan magnet termasuk gelombang elektromagnetik.
37
1) Sebagai gelombang
2) Sebagai partikel-partikel energi yang disebut foton.
Karena sifat tersebut maka beberapa parameter perlu diketahui misalnya panjang gelombang, frekuensi dan energi tiap foton. Hubungan dari ketiga parameter di atas dirumuskan oleh Planck yang dikenal dengan persamaan Planck. Hubungan antara panjang gelombang frekuensi dirumuskan sebagai.
c= λ . v atau λ = c/v atau v = c/λ
Persamaan Planck: hubungan antara energi tiap foton dengan frekuensi E= h . v
Dari rumus di atas dapat diketahui bahwa energi dan frekuensi suatu foton akan berbanding terbalik dengan panjang gelombang tetapi energi yang dimiliki suatu foton akan berbanding lurus dengan frekuensinya. Misalnya, energi yang dihasilkan cahaya UV lebih besar dari pada energi yang dihasilkan sinar tampak. Hal ini disebabkan UV memiliki panjang gelombang (λ) yang lebih pendek (100– 400 nm) dibanding panjang gelombang yang dimiliki sinar tampak (400–800 nm).
Interaksi antara materi dengan cahaya disini adalah terjadi penyerapan cahaya, baik cahaya Uv, Vis maupun Ir oleh materi sehingga spektrofotometri disebut juga sebagai spektroskopi absorbsi. Dari 4 jenis spektrofotometri ini (UV, Vis, UV-Vis dan Ir) memiliki prinsip kerja yang sama yaitu “adanya interaksi antara materi dengan cahaya yang memiliki panjang gelombang tertentu”. Perbedaannya terletak pada panjang gelombang yang digunakan.
Secara sederhana Instrumen spektrofotometri yang disebut spektrofotometer terdiri dari :
2.2 Keuntungan dari Spektrofotometer a. Dapat digunakan secara luas
b. Memiliki kepekaan yang tinggi c. Keseletifannya cukup baik d. Tingkat ketelitian tinggi
Syarat larutan yang dapat digunakan untuk analisis campuran dua komponen adalah
1) Komponen-komponen dalam larutan tidak boleh saling bereaksi 2) Penyerapan komponen-komponen tersebut tiak sama
3) Komponen harus menyerap pada panjang gelombang tertentu (Underwood, 1988).
2.3 Bagian-Bagian dalam Spektrofotometri
1. Sumber sinar polikromatis berfungsi sebagai sumber sinar polikromatis dengan berbagai macam rentang panjang gelombang. misalnya untuk spektrofotometer:
1) UV menggunakan lampu deuterium atau disebut juga heavy hidrogen 2) VIS menggunakan lampu tungsten yang sering disebut lampu wolfram 3) UV-VIS menggunan photodiode yang telah dilengkapi monokromator. 4) Infra merah, lampu pada panjang gelombang IR.
39
Sedangkan filter optik berupa lensa berwarna sehingga cahaya yang diteruskan sesuai dengan warnya lensa yang dikenai cahaya. Ada banyak lensa warna dalam satu alat yang digunakan sesuai dengan jenis pemeriksaan.
3. Sel sampel berfungsi sebagai tempat meletakan sampel
a. UV, VIS dan UV-VIS menggunakan kuvet sebagai tempat sampel. Kuvet biasanya terbuat dari kuarsa atau gelas, namun kuvet dari kuarsa yang terbuat dari silika memiliki kualitas yang lebih baik. Hal ini disebabkan yang terbuat dari kaca dan plastik dapat menyerap UV sehingga penggunaannya hanya pada spektrofotometer sinar tampak (VIS). Kuvet biasanya berbentuk persegi panjang dengan lebar 1 cm.
b. IR, untuk sampel cair dan padat (dalam bentuk pasta) biasanya dioleskan pada dua lempeng natrium klorida. Untuk sampel dalam bentuk larutan dimasukan ke dalam sel natrium klorida. Sel ini akan dipecahkan untuk mengambil kembali larutan yang dianalisis, jika sampel yang dimiliki sangat sedikit dan harganya mahal.
4. Detektor berfungsi menangkap cahaya yang diteruskan dari sampel dan mengubahnya menjadi arus listrik. Syarat-syarat sebuah detektor :
a. Kepekaan yang tinggi
b. Perbandingan isyarat atau signal dengan bising tinggi c. Respon konstan pada berbagai panjang gelombang. d. Waktu respon cepat dan signal minimum tanpa radiasi.
e. Signal listrik yang dihasilkan harus sebanding dengan tenaga radiasi. Macam-macam detektor :
2) Photocell, misalnya CdS. 3) Phototube
4) Hantaran foto 5) Dioda foto 6) Detektor panas
5. Read out merupakan suatu sistem baca yang menangkap besarnya isyarat listrik yang berasal dari detektor (Underwood, 1988).
2.4 Proses Absorbsi Cahaya pada Spektrofotometri
Ketika cahaya dengan panjang berbagai panjang gelombang (cahaya polikromatis) mengenai suatu zat, maka cahaya dengan panjang gelombang tertentu saja yang akan diserap. Di dalam suatu molekul yang memegang peranan penting adalah elektron valensi dari setiap atom yang ada hingga terbentuk suatu materi. Elektron-elektron yang dimiliki oleh suatu molekul dapat berpindah (eksitasi), berputar (rotasi) dan bergetar (vibrasi) jika dikenai suatu energi.
Jika zat menyerap cahaya tampak dan UV maka akan terjadi perpindahan elektron dari keadaan dasar menuju ke keadaan tereksitasi. Perpindahan elektron ini disebut transisi elektronik. Apabila cahaya yang diserap adalah cahaya inframerah maka elektron yang ada dalam atom atau elektron ikatan pada suatu molekul dapat hanya akan bergetar (vibrasi). Sedangkan gerakan berputar elektron terjadi pada energi yang lebih rendah lagi misalnya pada gelombang radio.
Atas dasar inilah spektrofotometri dirancang untuk mengukur konsentrasi suatu suatu yang ada dalam suatu sampel. Dimana zat yang ada dalam sel sampel disinari dengan cahaya yang memiliki panjang gelombang tertentu. Ketika cahaya mengenai sampel sebagian akan diserap, sebagian akan dihamburkan dan sebagian lagi akan diteruskan.
Pada spektrofotometri, cahaya datang atau cahaya masuk atau cahaya yang mengenai permukaan zat dan cahaya setelah melewati zat tidak dapat diukur, yang dapat diukur adalah It/I atau I/It (perbandingan cahaya datang dengan cahaya
41
2.5 Hukum Lambert - Beer
Berdasarkan hukum Lambert-Beer, rumus yang digunakan untuk menghitung banyaknya cahaya yang hamburkan:
T = It
Io atau %T = It
Io × 100%
Dan absorbansi dinyatakan dengan rumus:
A = - Log T = -log ItIo Di mana:
I = merupakan intensitas cahaya datang
It atau I1 = intensitas cahaya setelah melewati sampel.
Rumus yang diturunkan dari Hukum Beer dapat ditulis sebagai: A= a . b . c atau A = ε . b . c
Dimana: A = absorbansi
c = konsentrasi larutan yang diukur
ε = tetapan absorptivitas molar (jika konsentrasi larutan yang diukur dalam molar) a = tetapan absorptivitas (jika konsentrasi larutan yang diukur dalam ppm).
Secara eksperimen hukum Lambert-beer akan terpenuhi apabila peralatan yang digunakan memenuhi kriteria-kriteria berikut:
1. Sinar yang masuk atau sinar yang mengenai sel sampel berupa sinar dengan dengan panjang gelombang tunggal (monokromatis).
2. Penyerapan sinar oleh suatu molekul yang ada di dalam larutan tidak dipengaruhi oleh molekul yang lain yang ada bersama dalam satu larutan. 3. Penyerapan terjadi di dalam volume larutan yang luas penampang (tebal
4. Penyerapan tidak menghasilkan pemancaran sinar pendafluor. Artinya larutan yang diukur harus benar-benar jernih agar tidak terjadi hamburan cahaya oleh partikel-partikel koloid atau suspensi yang ada di dalam larutan. 5. Konsentrasi analit rendah. Karena apabila konsentrasi tinggi akan menggangu
kelinearan grafik absorbansi versus konsentrasi (Harjadi, 1990). 2.6 Faktor-faktor Penyebab Kesalahan Spektrofotometer
1. Adanya serapan oleh pelarut. Hal ini dapat diatasi dengan penggunaan blangko, yaitu larutan yang berisi selain komponen yang akan dianalisis termasuk zat pembentuk warna.
2. Serapan oleh kuvet. Kuvet yang ada biasanya dari bahan gelas atau kuarsa, namun kuvet dari kuarsa memiliki kualitas yang lebih baik.
3. Kesalahan fotometrik normal pada pengukuran dengan absorbansi sangat rendah atau sangat tinggi, hal ini dapat diatur dengan pengaturan konsentrasi, sesuai dengan kisaran sensitivitas dari alat yang digunakan (melalui pengenceran atau pemekatan) (Harjadi, 1990).
2.7 Menentukan konsentrasi sampel dengan cara kurva kalibrasi
Konsentrasi sampel dalam suatu larutan dapat ditentukan dengan rumus yang diturunkan dari hukum lambert beer (A= a . b . c atau A = ε . b . c). Namun ada cara lain yang dapat digunakan untuk menentukan konsentrasi suatu spesi yang ada dalam suatu larutan yakni dengan cara kurva kalibarasi. Cara ini sebenarnya masih tetap bertumpu pada hukum Lambert-Beer yakni absorbansi berbanding lurus dengan konsentrasi.
Langkah-langkah yang perlu dilakukan dalam penentuan konsentrasi zat dengan kurva kalibarasi:
43
melakukan analisis Maching kuvet harus dilakukan agar kesalahannya makin kecil.
2. Membuat larutan standar pada berbagai konsentrasi. Larutan standar yaitu larutan yang konsentrasinya telah diketahui secara pasti. Konsentrasi larutan standar dibuat dari yang lebih kecil sampai lebih besar dari konsentrasi analit yang diperkirakan.
3. Ambilah salah satu larutan standar, kemudian ukur pada berbagai panjang gelombang. Hal ini dilakukan untuk mengetahui pada panjang gelombang berapa, absorbansi yang dihasilkan paling besar. Panjang gelombang yang menghasilkan absorbansi paling besar atau paling tinggi disebut panjang gelombang maksimum (lmaks).
4. Ukurlah absorbansi semua larutan standar yang telah dibuat pada panjang gelombang maksimum.
5. Catat absorbansi yang dihasilkan dari semua larutan standar, kemudian alurkan pada grafik absorbansi vs konsentrasi sehingga diperoleh suatu kurva yang disebut kurva kalibarasi. Dari hukum Lambart-Beer jika absorbansi yang dihasilkan berkisar antara 0,2-0,8 maka grafik akan berbentuk garis lurus, namun hal ini tidak dapat dipastikan.
6. Ukurlah absorbansi larutan yang belum diketahui konsentrasinya. Setelah diperoleh absorbansinya, masukan nilai tersebut pada grafik yang diperoleh pada langkah 5. Misalkan absorbansi yang diperoleh 0,6. Maka jika ditarik garis lurus konsentrasi sampel akan sama dengan konsentrasi larutan standar 10 ppm.
Selain dengan cara tersebut, konsentrasi sampel dapat dihitung dengan persamaan regresi linear:
y = bx + a
sehingga diperoleh nila x. Nilai x yang diperoleh merupakan konsentrasi sampel yang dianalisis (Eka, 2007 ).
2.8 Cara Kerja Spektrofotometer
Cara kerja spektrofotometer secara singkat adalah sebagai berikut. Tempatkan larutan pembanding, misalnya blanko dalam sel pertama sedangkan larutan yang akan dianalisis pada sel kedua. Kemudian pilih fotosel yang cocok 200-650 nm ( 650-1100 nm ) agar daerah λ yang diperlukan dapat terliputi.
BAB III
METODELOGI PRAKTIKUM
3.1. Alat dan Bahan
3.1.1 Peralatan yang digunakan pada pH Meter 1. pH Meter 1 buah
2. Gelas kimia
3.1.2 Peralatan yang digunakan pada Analisa Fe Secara Spektrofotometer 1. Labu ukur
3.2.1 Bahan yang digunakan pada pH Meter 1. Air bawang
2. Air nanas 3. Air jeruk 4. Air sabun 5. Air gula
3.2.2 Bahan yang digunakan pada Analisa Fe Secara Spektrofotometer 1. FeCl2 200 ppm
Adapun prosedur kerja yang dilakukan pada pH meter adalah: 1. Peralatan pH meter dirangkai sesuai petunjuk
2. Larutan penyangga (buffer) dimasukkan pada masing-masing beaker gelas 3. pH meter dikalibrasi untuk pH 4, 7 dan 10 dengan mengunakan larutan
buffer.
4. pH masing-masing sampel dihitung dan dicatat yang tertera pada pH meter.
3.3.2 Analisa Fe Secara Spektrofotometri
Adapun prosedur kerja yang dilakukan pada analisa Fe secara spektrofoto metri adalah:
1. Nol mekanis: ketika spektrofotometer dalam keadaan mati, dipastikan pada absorbansi ~ dan transmitansi 0%
2. Nol absorbansi: ketika mesin dihidupkan, dibiarkan selama 15 menit agar stabil. Sel atau kuvet yang terisi blanko yang terdiri dari air suling (aquades) dimasukkan kedalam kamar sel dan angka absorbansi dinolkan (transmitansi 100%)
3. Absorbansi maksimum (nol transmitansi): absorbansi harus disesuaikan pada angka maksimum (transmitansi pada 0 %) yaitu bila jalur sinar tertutup misalnya dengan memasukkan benda hitam kedalam kamar sel atau dengan pintu tutup otomatis
4. Peralatan spektrofotometer disiapkan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Tabel 4.1.1 Hasil Percobaan Analisa pH meter
No Sampel pH Keterangan
1 Air nanas 5,61 Asam
2 Air Bawang 6,6 Asam
3 Air Gula 7,4 Basa
4 Air Jeruk 6,2 Asam
5 Air Sabun 11,2 Basa
Tabel 4.1.2 Hasil Percobaan Analisa Fe Secara Spektrofotometri
No. Sampel Absorbansi (A) Transmitasi (%) λ (nm)
1 FeCl2 1000 ppm 0,204 62,6 562
2 FeCl2 800 ppm 0,164 68,6 562
3 FeCl2 600 ppm 0,157 69,6 562
4 FeCl2 400 ppm 0,139 72,5 562
5 FeCl2 200 ppm 0,127 74,7 562
4.2 Pembahasan
Analisa secara spektrofotometri dilakukan pada sampel dengan konsentrasi 1000 ppm, 800 ppm, 600 ppm, 400 ppm, 200 ppm. Pada hasil pengamatan larutan 1000 ppm, dapat menyerap cahaya sebesar 0,204 A dan pada sampel 800 ppm, dapat menyerap cahaya sebesar 0,164 A, pada sampel 600 ppm, dapat menyerap cahaya sebesar 0,157 A, pada sampel 400 ppm, dapat menyerap cahaya sebesar 0,139 A, serta pada sampel 200 ppm, dapat menyerap cahaya 0,127 A. Dari data tersebut maka semakin besar konsentrasi larutan, maka semakin maka semakin
besar cahaya yang di serap dan cahaya yang dilewatkan sedikit, dan semakin kecil konsentrasi larutan, maka semakin sedikit cahaya yang di serap dan cahaya yang dilewatkan semakin banyak.
200 ppm0 400 ppm 600 ppm 800 ppm 1000 ppm 0.05
0.1 0.15 0.2 0.25
Konsentrasi (ppm)
A
bs
or
ba
ns
i (
A
)
Gambar Grafik Hubungan Antara Absorbansi Dengan Konsentrasi
Dari grafik tersebut terlihat bahwa konsentrasi suatu larutan berbanding lurus dengan absorbansinya. pH meter digunakan untuk mengatur pH larutan sampel diantaranya air nanas, air bawang, air gula, air jeruk, dan air sabun. Setelah di uji dengan pH meter air nanas memiliki pH 5,61 dan bersifat asam karena di dalam air nanas terkandung asam askorbat (mengandung vitamin C), pada air bawang memiliki pH 6,6 dan bersifat asam, karna terdapat asam askorbat, dan pada air jeruk memiliki pH 6,2 dan terkandung asam sitrat, asam askorbat, serta asam folat, pada air sabun dengan pH 11,2 dan merupakan basa, karena mengandung Hidroksida (OH-) dan pada air gula dengan pH 7,4 karena
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Adapun kesimpulan dari hasil praktikum analisa dengan alat instrumen 1. Air nanas, air bawang, air jeruk, bersifat asam karena pH di bawah 7. 2. Air gula dan air sabun bersifat basa, karena pH diatas 7.
3. Semakin tinggi konsentrasi, maka absorbansi semakin besar, begitupun sebaliknya.
4. Semakin tinggi absorbansi dan konsentrasi, maka transmitasi semakin kecil, begitupun sebaliknya.
5.2 Saran
Jika ingin mengetahui nilai pH, selain dengan pH meter ada juga dengan cara lain yaitu dengan menggunakan kertas lakmus. Tetapi dengan menggunakan kertas lakmus, kita hanya dapat mengetahui jenis larutan asam atau basa tanpa mengetahui berapa tepatnya pH melalui perubahan atau tetap warna kertas lakmus tersebut.
1.2 Tanggal Praktikum : 26 Oktober 2015 1.3 Pelaksana Praktikum: 1. Amrizal
2. Chairun Nisa 3. Fathan Zakian 4. Junidar A Saragih 5. Nurul Azmi 1.4 Tujuan Praktikum
Mengamati perubahan-perubahan warna indicator pada larutan asam dan basa.
BAB II
TINJAUAN PUSTAKA
Setiap zat atau senyawa mempunyai sifat asam, basa atau netral. Kita dapat menentukan apakah zat atau senyawa itu asam, basa, atau netral dengan menggunakan indikator. Indikator ini dapat berupa indikator universal atau lakmus biru dan lakmus merah yang dibuat di laboratorium atau juga dapat menggunakan indikator asam-basa dengan bahan dari alam. Indikator asam-basa alami menggunakan bahan-bahan dari alam seperti kembang sepatu, bunga bongenvil, bunga mawar, kunyit dan beberapa jenis tumbuhan lainnya. Zat warna dari bahan-bahan tersebut memberikan warna yang berbeda dalam larutan asam, dan larutan basa. (Hardojono, 2001)
Asam merupakan zat yang memiliki sifat-sifat yang spesifik misalnya memiliki rasa asam, dapat merusak permukaan logam juga rantai monomer atau sering disebut dengan korosif. Asam juga dapat bereaksi dengan logam dan menghasilkan gas hidrogen, dapat digunakan kertas lakmus, dimana asam dapat mengubah kertas lakmus biru menjadi merah.
Basa merupakan zat yang memiliki sifat-sifat yang spesifik seperti cicin jika mengenai kulit dan terasa getir serta dapat mengubah kertas lakmus merah menjadi biru. Konsep asam-basa telah berkembang dan sampai dengan saat ini tiga konsep sangat membantu kita dalam memahami reaksi kimia dan pembentukkan molekul-molekul biru. Asam menurut Arhenius, zat dikatakan sebagai asam jika dalam bentuk larutannya dapat melepaskan ion H+ dan ion hydrogen merupakan pembawa sifat asam. Dibawah ini diberikan dua contoh asam:
HCl H+ + Cl- ...(2.1)
H2SO4 H+ + SO4 –...(2.2)
Sedangkan basa adalah zat yang dalam bentuk larutannya dapat melepaskan ion OH-, dan ion hidroksida merupakan pembawa sifat basa.
menetralisirkan sehingga air merupakan senyawa yang bersifat netral.
H2O H++ OH- ...(2.6)
Persamaan diatas menunjukan adanya ion hydrogen [H+] yang bernuatan positif, selanjutnya reaksi-reaksi yang melibatkan kedua ion tersebut dikenal dengan reaksi netralisasi.Menurut Lowry dan Bronsted, zat dikatakan asam karena memiliki kemampuan untuk mendonorkan protonnya, sedangkan basa adalah zat yang menerima proton, sehingga dalam sebuah reaksi dapat melibatkan asam dan basa. Contohnya reaksi pelarutan amoniak dalam air.
Reaksi ke kanan NH3 berperan sebagai aseptor proton (basa) dan H2O
sebagai protonnya, sehingga berperan sebagai asam, sering disebut dengan asam konjungsi.Untuk ion hidroksida [OH-] dapat menerima proton dan berperan
sebagai basa dan disebut dengan basa konjugasi.
Reaksi di atas menghasilkan pasangan asam-basa konjugasi, yaitu asam, dengan basa konjugasinya dan basa dengan asam konjugasinya. Untuk lebih jelasnya contoh lain, dua molekul NH3 lain bertindak sebagai donor proton dan
yang lain sebagai penerima proton. (James E Brady, 1999).
2.1 Prinsip Titrasi Asam dan Basa
Titrasi asam basa melibatkan reaksi antara asam dengan basa, sehingga akan terjadi perubahan pH larutan yang dititrasi, secara percobaan, perubahan pH dapat diikuti dengan mengukur pH larutan yang dititrasi dengan elektode pada pH meter. Reaksi antara asam dan basa, dapat berupa asam kuat atau lemah dengan basa kuat atau lemah (Kleinfelter, 1984).
2.2 Indikator Asam Basa
Indikator asam basa merupakan asam organik lemah dan basa organik lemah mempunyai dua warna dalam pH larutan yang berbeda. Pada titrasi asam
dengan basa, maka indikator berada pada tingkat kecil. Pada titrasi asam dengan basa, maka indikator berada pada tingkat kecil.
Indikator asam basa yaitu zat yang memberikan warna berbeda dalam lingkungan asam dan lingkungan basa (zat yang warnanya dapat berubah saat berinteraksi atai bereaksi dengan senyawa asam maupun senyawa basa). Teori asam menurut Arhenius asam adalah senyawa yang dalamnya larutan dapat menghasilkan ion H+. Basa ialah senyawa yang dalam larutannya menghasilkan
ion OH-, menurut Bronsted-Lowry asam ialah proton donor, sedangkan basa
adalah proton aseptor. Contoh :
HAC (aq) + H2O (l) H3O (aq) + AC- (aq)...(2.7)
Asam 1 basa 2 asam 2 basa 1
HAC dengan AC- merupakan pasangan asam basa konjungsi H3O+ dengan H2O
merupakan pasangan asam-basa konjugasi.
Pada contoh diatas terlihat, bahwa air dapat bersifat asam (proton donor) dan sebagai basa (proton akseptor). Zat atau ion atau spesi seperti itu bersifat ampiprotik (amfoter). Indikator alami hanya bias menunjukkan, apakah zat tersebut bersifat asam atau basa, tetapi tidak dapat menunjukkan nilai pHnya contohnya ekstrak bung kamboja putih dan bunga pacar, air merah, ekstrak kunyit, dan lain-lain. (Hiskia, 1982).
2.3 Kekuatan Asam dan Basa
Pada dasarnya skala/tingkat keasaman suatu larutan bergantung pada konsentrasi ion H+ dalam larutan. Makin besar konsentrasi ion H+ makin asam
larutan tersebut. Umumnya konsentrasi ion H+ sangat kecil, sehingga untuk
menyederhanakan penulisan. Seorang kimiawan dari Denmark bernama Sorrensen mengusulkan konsep pH untuk menyatakan konsentrasi ion H+. Nilai pH sama
dengan negatif logaritma konsentrasi ion H+ dan secara matematika diungkapkan
dengan persamaan: a. Derajat keasaman (pH)
Air murni pada temperatur 250C:
[H+] =[OH-] = 10-7 mol/L
Sehingga pH air murni =7 Jika pH = 7 bersifat netral Jika pH < 7 bersifat asam Jika pH > 7 bersifat basa
b. Asam kuat
Disebut asam kuat karena zat terlarut dalam larutan ini mengion seluruhnya ( = 1).
c. Asam lemah
Disebut asam lemah karena zat terlarut dalam larutan ini tidak mengion seluruhnya, ≠ 1, (0<<1).
d. Basa kuat
Disebut basa kuat karena zat terlarut dalam larutan ini mengion seluruhnya (=1).
Tabel 2.1 Beberapa indikator asam basa
Indikator Perubahan warna dengan meningkatkannya pH
Rentang pH
Metal merah Merah ke kuning 4,2-6,2
Metal orange Merah ke kuning 3,1-4,4
Metal kuning Merah ke kuning 2,0-4,0
Timol biru Merah ke kuning 1,2-2,8
Fenol merah Kuning ke biru 6,8-8,4
Brom kresol ungu Kuning ke ungu 5,2-6,8 Brom finol biru Kuning ke biru 6,0-7,6 Fenol ftalein Tidak berwarna kemerahan 8,0-9,6 Timol ftalein Tidak berwarna kebiruan 9,3-10,6 Allzarin kuning Kuning ke violet 10,1-12,0
Netal merah Merah ke kuning 6,8-8,0
2.4 Teori Asam-Basa
Pada tahun 1884 Svante Arrhenius mengemukakan teori tentang asam dan basa yaitu teori asam basa arrhenius. Menurutnya, asam adalah suatu zat yang apabila dilarutkan dalam air akan menghasilkan ion H+ dimana ion tersebut
merupakan satu-satunya ion yang ada dalam larutan. Basa merupakan zat yang apabila dilarutkan dalam air akan terionisasi menghasilkan ion OH-, dan ion
55
Pada tahun 1923 ahli kima Denmark bernama J.N Bronsted dan ahli kimia inggris bernama T.N Lowry mengemukakan teori yang bernama teori asam basa broansted-lowry, yang berbunyi suatu zat pemberi proton (proton donor) disebut asam dan suatu zat penerima proton (proton aseptor) disebut basa. Dari definisi tersebut maka suatu asam setelah melepas proton akan membentuk basa konjugasi dari asam tersebut. Demikian pula dengan basa, setelah menerima proton akan membentuk asam konjugasi dari basa tersebut.
Pada tahun 1932 G.N Lewis menyatakan teori yang berbunyi basa adalah zat yang memiliki satu atau lebih pasangan elektron bebas yang dapat di berikan kepada zat lain sehingga terbentuk ikatan kovalen koordinasi, sedangkan asam adalah zat yang dapat menerima pasangan elektron tersebut (Harrizul, 1995).
Berbagai teori telah dikemukakan dalam menerangkan sifat asam dan basa.Teori pertama kali di ajukan adalah teori Arrhenius.
Arrhenius mendefinisikan asam sebagai suatu senyawa yang apabila dilarutkan dalam air akan membebaskan ion hidrogen (H+) sedangkan basa adalah
senyawa yang apabila dilarutkan dalam air akan melepaskan ion hidroksida (OH-).
Reaksi netaliasi yang merupakan reaksi antara asam dan basa membentuk garam dan air secara sederhana dapat ditulis.
H+ + OH- → H
2O ...(2.8)
Tetapi kelemahan teori Arrhenius adalah teori ini hanya terbatas pada larutan dengan pelarut air, walaupun asam dan basa juga terdapat. Pada larutan dengan pelarut bukan air sebagai contoh misalkan reaksi yang berlangsung pada larutan dengan ammonia cair sebagai berikut :
CH4Cl + NaNH2 → NaCl + NH3...(2.9)
Reaksi ionnya
NH4+ + NH2-→ 2 NH3 ...(2.10)
BAB III
METODOLOGI PRAKTIKUM 3.1 Alat dan Bahan
3.1.1 Peralatan yang digunakan 1. Pipet Tetes 1 buah
2. Rak tabung reaksi 1 buah 3. Bola penghisap 1 buah 4. Tabung Reaksi 4 buah 5. Gelas Kimia 1 buah
6. Kertas Lakmus secukupnya 7. Pipet Volume 1 buah 3.1.2 Bahan
1. Larutan HCl 0,1 M
2. Air
3. Larutan NaOH 0,1 M 4. Larutan CH3COOH 0,1 M
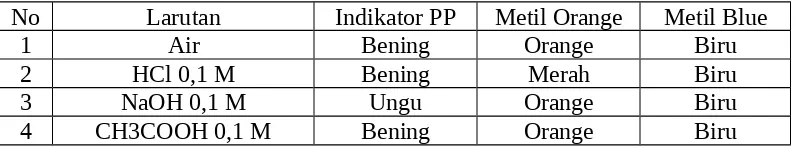
5. Indikator PP 2 %, metyl red, metyl blue, metyl orange 3.2. Prosedur Kerja
Adapun prosedur kerja yang dilakukan sebagai berikut: 1. 4 buah tabung reaksi masing-masing diisi 2 ml larutan :
a. Air
b. HCl 0.1 M c. NaOH 0.1 M d. CH3COOH 0.1 M
Ke dalam masing-masing tabung dicelupkan kertas lakmus merah dan biru, perubahan warna kertas lakmus kemudian dicatat.
2. Larutan pada cara kerja no.1 jangan dibuang, tetapi masing-masing tabung diteteskan dengan 2 tetes indikator PP, metil orange, dan metil blue