LAPORAN PRAKTIKUM
KIMIA DASAR II
OLEH:
NAMA: I PUTU AGUS DINA ASTAWA KELAS: 11c
NPM:08.8.03.51.30.1.5.1190
JURUSAN PENDIDIKAN MIFA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN UNIVERSITAS MAHASARASWATI DENPASAR
KATA PENGANTAR
Puji syukur kami panjatkan kehadirat Tuhan Yang Maha Esa karena atas berkat dan rahmat-Nyalah, penyusunan laporan tetap praktikum kimia dasar II ini dapat terselesaikan dengan baik dan tepat waktu.
Adapun penyusunan laporan ini adalah sebagai tugas akhir dari mata kuliah kimia dasar II yang bertujuan untuk memenuhi tugas dan memperoleh nilai tambahan. Selain itu, saya juga ingin mengetahui lebih dalam mengenai materi kimia dasar II lebih dalam.
Saya sadar, apa yang kami perbuat jauh dari sempurna. Oleh sebab itu kami mohon maaf apabila ada kekurangan yang tentunya tidak saya sengaja. Saya mengucapkan terima kasih banyak kepada seluruh pihak yang telah membantu saya dalam penysunan laporan ini.
Akhirnya saya mengucapkan terimakasih dan semoga apa yang telah saya perbuat dapat berguna bagi pembaca.
Denpasar, 8 juni 2009
DAFTAR ISI
KATA PENGANTAR DAFTAR ISI
Percobaan 1 REAKSI DAPAT BALIK
Percobaan 2 KESETIMBANGAN KIMIA
Percobaan 3 PENURUNAN TITIK BEKU
Percobaan 5 INDIKATOR DAN PENENTUAN PH
Percobaan 6 LARUTAN BUFFER
Percobaan 7 HIDROLISA
Percobaan 8 LARUTAN ELEKTROLIT
Percobaan 9 ELEKTROLISA
Percobaan 10 UNSUR GOLONGAN ALKALI
Percobaan 1 REAKSI DAPAT BALIK
A. Tujuan
Adapun tujuan yang ingin dicapai dalam melakukan percobaan ini adalah untuk mengetahui apakah suatu reaksi dapat balik. B. Alat dan Bahan
Suatu zat yang bila direaksikan tidak dpat kembali ke zat semula maka reaksi tersebut dikenal dengan reaksi searah / reaksi yang tidak dapat balik (irreversible) sedanglkan reaksi dapat balik (reversible) adalah reaksi yang dapat balik keadaan semula. Reaksi dpat balik biasanya dapat diketahui dalam proses-proses industri. Selain itu reaksi yang dapat balik ini berlangsung secara tidak tuntas di dalam suatu sistem tertutup dan akan berakhir dengan terjadinya suatu kesetimbanagn. Kesetimbangan tersebut akan tercapai apabila laju reaksi maju sama dengan laju reaksi baliknya.
D. Cara Kerja
1. Perubahan PbSO4 menjadi PbI2 dan kembali menjadi PbSO4
Isi tabung reaksi dengan 5 ml larutan Pb(NO3)2 0,1 M dan
tambahkan 10 tetes larutan H2SO4 2 M. Perhatikan warna
endapan yang terbentuk. Buang larutannya, dan cuci endapan dengan 5 ml air. Tambah pada endapan sedikit demi sedikit 5 ml larutan KI 0,5 M. Sambil menggoyangkan tabung reaksi perhatikan warna endapan. Buang larutannya, dan cuci
endapan dengan 5 ml air. Tambah pada endapan sedikit demi sedikit 1 ml larutan 1 ml larutan Na2SO4 1 M sambil
menggoyang tabung reaksi. Perhatikan perubahan warna endapan.
2. Perubahan CuSO4 menjadi Cu(OH)2 dan kembali menjadi
CuSO4
isi tabung reaksi dengan 3 ml larutan CuSO4 0,1 M tambahkan
Selanjutnya, tuangkan dalam tabung reaksi tersebut 3 ml larutan H2SO4 0,1 M. Amati lagi perubahan yang terjadi. Catat
semua perubahan yang terjadi.
E. Hasil Pengamatan
1.Perubahan PbsO4 menjadi PbI2 dan kembali menjadi PbSO4
5 cm larutan Pb(NO3)2 0,1 mol di tambah dengan 10 tetes
larutan H2SO4 2 M warna larutan menjadi keruh, Setelah
beberapa menit larutan tersebut membentuk endapan yang berwarna putih.
Pb(NO3)2 + H2SO4 PbSO4 + 2NO3
Endapan berwarna putih
Setelah membuang larutan yang tidak mengendap dan endapan yang berwarna putih tersebut dicuci dengan 5 ml air dan ditambahkan sedikit demi sedikit 5 ml larutan KI 0,5 . setelah beberapa menit terbentuk endapan yang berwarna kuning.
PbSO4 + KI PbI2 + K2SO4
Endapan berwarna kuning
Endapan kuning tersebut dicuci lagi dan kembali dilarutkan dengan 1 ml larutan NaSO4 1 M. Sehingga membentuk
endapan berwarna putih kembali. PbI2 + Na2SO4 PbSO4 + 2NaI
2.Perubahan CuSO4 menjadi Cu(OH)2 dan kembali menjadi CuSO4
3 cm larutan CuSO4 0,1 mol di tambah dengan 5ml larutan
NO2H 0,1 M terjadi perubahan dan membentuk endapan
berwarna biru. Larutan tersebut di tambah 3 ml larutan H2SO4 0,1 M dan membentuk endapan berwarna biru da
kembali membentuk CuSO4
F. Pembahasan
G. Kesimpulan
Dari hasil pengamatan, dapat ditarik kesimpulan: Pb(NO3)2 + H2SO4 PbSO4 + 2NO3
Cuci, endapan berwarna putih. PbSO4 + KI PbI2 + K2SO4
Cuci, endapan berwarna putih.
Adapun tujuan yang ingin dicapai dalam melakukan percobaan ini adalah untuk mengetahui kesetimbangan kimia yang terjadi dalam suatu larutan setelah ditambah larutan tertentu.
B. Alat dan Bahan
Reaksi kesetimbangan yaitu reaksi yang hasil reaksinyadapat kembali membentuk zat pereaksi. Reaksi ini disebut juga reaksi ini disebut juga reaksi 2 arah atau reaksi bolak-balik(reversible).
Kesetimbangan kimia bersifat dinamis yaitu secara makroskopis tidak terjadi perubahan konsentrasi dan warna, sedangkan secara mikroskopis selalu terjadi perubahan terus-menerus.
Kesetimbangan kimia dibedakan menjadi kesetimbangan homogen dan heterogen.
D. Cara Kerja
1. Pengaruh penambahan ion asetat pada reaksi setimbang Asam Asetat
Isi sebuah tabung reaksi dengan 3 ml larutan CH3COOH 0,1 M
kemudian pertetes CH3COONan0,1 M. Sambil dikocok, sampai
warna larutan berubah.
2. Menggeser letaknya kesetimbangan Feri tiosianat
Isi sebuah tabung reaksi 3 ml FeCl3 0,1 M. Tambah 3 ml larutan
KCNS 0,1 M. Pindahkan campuran ini kedalam gelas kimia dan encerkan dengan air, sehingga warna larutan berubah menjadi meerah muda.
Sediakan 4 tabung reaksi dan masing-masing tabung dengan 3 ml larutan tersebut.
Pada tabung reaksi ke-2 tambah 3 ml larutan FeCl3 0,1 M
Pada tabung reaksi ke-3 tambah 3 ml larutan KCNS 0,1 M Pada tabung reaksi ke-4 tambah 3 ml larutan HCl 0,1 M Bandingkan warna laruatan-larutan diatas dengan warna larutan yang terdapat dalam tabung reaksi pertama. Amati dan catat semua perubahan yang terjadi. E. Hasil Pengamatan
1. Pengaruh penambahan ion asetat pada reaksi setimbang asam asetat
CH3COOH + MO warna larutan menjadi orange
2. Menggeser letaknya kesetimbangan Feri Tiosianat
FeCl3 + KCNS Fe(CNS)3 + KCl + H2O (warna larutan merah
muda)
o Tabung reaksi ke-2 + 3 ml FeCl3 0,1 M ( warna menjadi
lebih muda dari warna pada tabung 1)
o Tabung reaksi ke-3 + 3 ml KCNS ( warna larutan menjadi lebih tua dari warna pada tabung 1)
o Tabung reaksi ke-4 + 3 ml KCl 0,1 M (warna larutan menjadi lebih muda dari warna tabung 1)
F. Pembahasan
1. Pengaruh penambahan ion asetat pada reaksi setimbang Asam Asetat
Pada penambahan larutan CH3COONa 0,1 M warna larutan tidak
berubah yang artinya kesetimbangan kimia bersifat dinamis. 2. Menggeser letaknya kesetimbangan Feri Tiosianat
o Pada tabung kedua warna lebih muda yang berarti kesetimbangan bersgeser kekiri.
o Pada tabung ketiga warna larutan lebih tua yang berarti
kesetimbangan bergeser kekanan.
o Pada tabung keempat warna larutan lebih muda yang berarti kesetimbangan bergeser kekiri.
G. Kesimpulan
Dari hasil percobaan yang dilakukan dapat disimpulkan bahwa: 1. Pengaruh penambahan ion asetat pada reaksi setimbang asam
2. Menggeser letaknya kesetimbangan Feri Tiosianat bersifat dinamis secara mikroskopis karena pada larutan terjadi perubahan secara terus-menerus.
Percobaan 3
PENURUNAN TITIK BEKU
A. Tujuan
Adapun tujuan yang ingin dicapai dalam melakukan
percobaan ini adalah untuk mengetahui seberapa besar penurunan titik beku yang terjadi pada air yang ditambah suatu larutan.
B. Alat dan Bahan Alat-alat:
- Tabung reaksi besar - Pengaduk
- Gelas ukur - Thermometer - Gelas kimia - Sendok
Bahan-bahan - Urea
- Garam dapur - Es
Penurunan titik beku merupaka salah satu sifat koligatif larutan nonelektrolit yang dapat dirumuskan sebagai berikut.
ΔTf = Kf . m atau ΔTf = (T1- (-T2)) ̊ C kimiadengan potongan-potongan es yang telah dicampur dengan garam dapur. Aduk larutan terjadi proses terjadi pembekuan temperatur tidak berubah). Teruskan pengamatan temperatur ini selama 1 menit lagi.
Amati dan catat semua perubahan yang terjadi.
E. Hasil Pengamatan
ZAT SUHU AWAL SUHU AKHIR
o Suhu awal air 29,2 ̊C dan suhu akhir 0 ̊C maka penurunan titik beku
ΔTf = 29,2 ̊C – (-0 ̊C)
= 29,2 ̊C H. Kesimpulan
Penurunan titik beku dapat di cari dengan rumus : ΔTf = ( T1 – ( - T2)) ̊C
Apabila suatu zat cair ditambahkan suatu zat alin maka akan mempengaruhi kesetimbangan.
Penurunana titik beku urea adalah 22,7 ̊C
Percobaan 5
INDIKATOR DAN PENENTUAN PH
A. Tujuan
Adapun tujuan yang ingin dicapai dalam melakukan percobaan ini adalah untuk mengetahui PH suatu zat dengan menggunakan berbagi indikator
Alat-alat:
Dalam menentukan PH selalu identik dengan sifat asam, netral dan basa. Dimana larutan bersifat asam apabila nilai Phnya kurang dari 7, larutan bersifat netral apabila nilai Phnya 7 dan larutan bersifat basa bila nilai Phnya lebih dari 7.
D. Cara Kerja
1. Penetuan PH Air
Teteskan 1 tetes air suling pada sepotong kertas indikator universal. Setelah kering bandingkan warnanya dengan warna standar. Cata harga PH nya.
Ulangi percobaan diatas dengan menggunakan: - Air PDAM -Air kapur -Air liur - Air sumur - Air jeruk -Air hujan
Catat harga Phnya untuk masing-masing percobaan 3. Penetuan PH contoh tanah
Isi sebuah tabung reaksi dengan 1 sendok tanah. Tambahkan 10 ml air suling. Kocok beberapa menit dan saring. Sediakan 2 tabung reaksi dan masin-masing tabung masukkan 1 ml air suling tersebut.
Pada tabung reaksi ke-1 tambah 2 tetes BTB. Perhatikan warna larutan. Berdasarkan hasil pengamatan, tentukanlah, apakah tanah yang diperiksa bersifat asam, netral atau basa. Bila tanah yang diperiksa bersifat asam, tambahkan 2 tetes indikator MO kedalamtabung reaksi ke-2.
Bila tanah yang diperisa itu bersifat basa, tambahkan 2 tetes indicator Ppkedalam tabung reaksi ke-2. Amati dan catat semua perubahan yang terjadi.
E. Hasil Pengamatan 1. Penentuan PH air
- Air suling nilai Phnya 7 - Air jeruk nilai Phnya 4 - Air PDAM nilai Phnya 9 - Air liur nilai Phnya 7 - Air sumur nilai Phnya 8 - Air hujsn nilai Phnya 7 - Air kapur nilai Phnya 10
Tanah yang disaring ditambahkan dengan BTB bersifat asam karena harga Phnya sebesar 5
Tanah yang disaring ditambahkan dengan MO bersifat asam karena harga Phnya sebesar 6
F. Pembahasan
1. Penentuan PH air
- Air suling bersifat netral - Air jeruk bersifat asam - Air PDAM bersifat basa - Air liur bersifat netral - Air sumur bersifat basa - Air hujan bersifat netral - Air kapur bersifat basa
2. Penentuan PH contoh tanah Tanah bersifat asam
H. Kesimpulan
Dari hasil percobaan dapat disimpulkan bahwa larutan yang bersifat:
- Asam adalah air jeruk dan tanah.
Percobaan 6 LARUTAN BUFFER
A. Tujuan
Adapun tujuan yang ingin dicapai dalam melakukan percobaan ini adalah untuk mengetahui apakah suatu larutan dapat
mempertahankan harga Phny atau tidak.
B. Alat dan Bahan
Larutan penyangga atau larutan bufer adalh larutan yang mampu mempertahankan harga Phnya terhadap penambahan sedikit asam dan basa.larutan penyangga dapat dibedakan menjadi dua yaitu:
a) Larutan penyangga asam mengandung asam lemah(HA b) Larutan penyangga basamengandung suatu basa lemah(B) D. Cara Kerja
1. Pembuatan larutan bufer
a) Isi sebuah tabung reaksi dengan 5 ml larutan CH3COOH 1
M. Tambah kedalam tabung ini 5 ml larutn CH3COONa 1
M. Aduk larutan tersebut. Teteskan 1 tetes larutan diatas kertas indikator universal. Keringkan dan tentukan PH larutan tersebut dengan membandingkan kertas ini dengan warna standar. Cata pHnya.
b) Isi sebuah tabung reaksi dengan 5 ml larutan NH4OH 1 M.
Tambahkan kedalam tabung ini 5 ml larutan NH4Cl 1 M.
Aduk dan periksa larutan ini dengan kertas indikator universal. Catat pHnya.
2. pengenceran larutan Bufer
Masukkan 5 ml larutan bufer 1 A kedalam tabung reaksi ini encerkan dengan 5 ml air. Kocok dan periksa pHnya larutan tersebut dengan kertas indikator universal. Dengan cara yang sama encerkan 5 ml larutan bufer 1 B dengan 5 ml air dan periksa pHnya. Amati dan cata semua perubahan yang terjadi. 3. Penambahan sedikit asam/basa pada latutan bufer
Kocok masing-masing larutan, dan periksa pHnya dengan kertas indikator universal. Ulangi percobaan ini dengan menggunakan larutan bufer 1B. Amati dan catat semua perubahan yang
terjadi.
E. Hasil Pengamatan
Tabel:
Larutan p
H Penambahan Air HCl NaOH
CH3COOH +
CH3COONa
6 6 5 6
NH4OH + NH4Cl 5 5 5 6
F. Pembahasan
- Larutan CH3COOH + CH3COONa harga phnya 6 sehingga
bersifat asam dan harga phnya tidak berubah walaupun ditambah sedikit asam/basa.
- Larutan NH4OH + NH4Cl harga phnya 5 sehingga bersifat
asamdan harga phnya tidak berubah walaupun ditamgah sdikit asam/basa.
G. Kesimpulan
Percobaan 7 HIDROLISA
A. Tujuan
Adapun tujuan yang ingin dicapai dalam melakukan
percobaan ini adalah untuk mengetahui perubahan warna yang terjadi setelah berbagai jenis larutan dicampur dengan BTB dan PP serta mengetahui harga phlarutan NH4Cl dan CH3COONa.
B. Alat dan Bahan
- Na-karbonat padat - Amonium sulfat padat - Na-klorida padat - Natrium asetat padat
- Larutan NH4Cl pemeriksaan - Indikator BTB
- Amonium Klorida padat - Indikator PP
- Kalium nitrat padat - Indiktor universal universal - Larutan CH3COONa pemeriksaan
B. Landasan Teori
Dimana garam diuraikan oleh air membentuk asam lemak. Basa lemah disebabkan oleh ion-ion garam yang terlarut dalam air kemudian bereaksi dengan air.
D. Cara Kerja
a) Isi 2 tabung reaksi dengan sedikit reaksi kristal Na2CO3.
Tambah kedalam masing-masing tabung 5 ml air. Kocok sampai semua kristalnya melarut. Masukkan kedalam tabung reakdi ke-1 dengan 2 tetes indikator BTB dan amati perubahan warna indikator. Ulangi percobaan tersebut diatas dengan
menggunakan:
- Sedikit kristal NaCl - Sedikit kristal CH3COONa
- Sedikit NH4Cl - Sedikit kristal (NH4)2SO4
- Sedikit kristal KNO3
b) Ambil dengan sebuah pepet tetes larutan NH4Cl pemeriksaan
indikator universal 1 tetes larutan ini. Keringkan dan bandingkanwarnanya dengan warna standar. Catat harga pHnya. Ulangi percobaan tersebut dengan memakai larutan CH3COONa pemeriksaan.catat harga pHnya. Amati dan catat
semua perubahan yang terjadi.
E. Hasil Pengamatan a) Tabel:
LARUTAN BTB PP
Na2CO3 Biru tua Ungu
NaCl Orange Putih
NH4Cl Orange Putih
KNO3 Orange Putih
CH3COONa Biru tua Merah muda
(NH4)2SO4 Orange putih
b) Larutan NH4Cl menghasilkan harga ph sebesar 6.
Larutan CH3COONa menghasilkan ph sebesar 9.
F. Pembahasan
Garam yang terhidrolisis dalam air akan bersifat asam atau basa. Adapun garam yang berasal dari asam kuat dan basa kuat
tidakmengalami hidrolisis dan bersifat netral. Sifat garam larutan bergantung pda kekuatan relatif asam basa penyusunnya, yaitu:
- Garam dari basa kuat dan basa kuat bersifat netral - Garam dari asam kuat dan basa lemah bersifat asam - Garam dari asam lemah dan basa kuat bersifat basa
- Garam dari asam lemah dan basa lemah tergantung pada tetapan ionisasi asam dan basanya (ka dan kb)
Ka > kb : bersifat asam Ka > kb : bersifat basa Ka = Kb : bersifat netral
G. Kesimpulan
A. Dari hasil percobaan dapat disimpulkan bahwa garam-garam yangditambahkan dengan air misal
a) Na2CO3 bersifat basa
b) NaCl bersifat netral c) NH4Cl bersifat asam
d) KNO3 bersifat netral
e) CH3COONa bersifat basa
f) (NH4)2SO4 bersifat asam
B. Larutan NH4Cl bersifat asam
Percobaan 8
LARUTAN ELEKTROLIT
A. Tujuan
Adpun tujuan yang ingin dicapai dalam melakukan percobaan ini adalah untuk mengethui suatu larutan termasuk larutan elektrolit atau tidak.
B. Alat dan Bahan Alat-alat:
- ampermeter - elektroda -
- Gelas kimia - kabel - Baterai/arus listrik
Bahan-bahan:
- Larutan gula - Air suling
- Larutan asam klorida 1M - Larutan asam asetat 1M - Larutan asam sulfat 1M - Larutan Na-hidroksida 1M - Larutan aNa-klorida 1M - Laruts=an alkohol 10% C. Landasan Teori
Larutan elektolit merupakan larutan yang dapat menghantarkan arus listrik. Larutan elektrolit terbagi atas elektrolit kuat dan
elektrolit lemah. Perbedaan sifat keduanya diuraikan dalam tabel berikut:
Sifat-sifat elektrolit kuat Sifat-sifat elektrolit lemah Dalam air terionisasi Dalam air terionisasi
sebagian
α = 1 0 < α < 1
Daya hantar listrik kuat Daya hantar listrik lemah
D. Cara Kerja
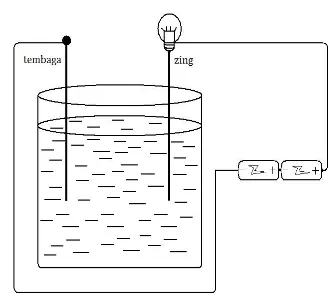
Kedalam gelas kimia masukkan
Selanjutnya kefalam larutan ini masukkan dua batang elektroda dan hubungkan dengan kabel dan ampere meter kesumber arus. Seperti pada gambar. Perhatikan dan catat semua perubahan yang terjadi.
Gambar susunan alat.
Kerjakanseperti percobaan diatas. Tetapi gantilah larutan gula dengan:
- Air suling
- .Larutan asam klorida 1M - Larutan asam asetat 1M - Larutan asam sulfat 1M - Larutan NaOH 1M
- Larutan NaCl 1M
- Larutan alkohol 10 % Amati dan catat semua perrubahan yang terjadi.
E. Hasil Pengamatan
Larutan ELEKTROLIT KUAT ELEKTROLIT LEMAH ELEKTROLITNON KET
Gula gelembungTidak ada
HCl gelembungBanyak
H2SO4 gelembungBanyak
Air
suling gelembungTidak ada
CH3COO
H gelembungSedikit
gelembung
Alkohol gelembungTidak ada
NaCl gelembungBanyak
F. Pembahasan
a) Gula, air suling dan alkohol merupakan larutan nonelektrolit karena tidak terdapat gelembung udara pada larutan dan lampu tidak menyala.
b) CH3COOH merupakan larutan elektrolit lemah karena hanya
terdapat sedikit gelembung udara pada larutan dan nyala lampu redup.
c) HCl, H2SO4,NaOH dan NaCl merupakan larutan elektrolit
kuat karena banyak terdapat gelembung pada larutan dan nyal lampu sangat terang.
G. Kesimpulan
Dari hasil percobaan dapat disimpulkan bahwa :
- Larutan elektrolit kuat adalah HCl, H2SO4,NaOH dan NaCl.
- Larutan elektrolit lemah dalah CH3COOH.
- Larutan nonelektrolit adalah gula,air suling dan alkohol.
Percobaan 9 ELEKTROLISA
A. Tujuan
Adapun tujuan yang ingin dicapi dalam melakukan percobaan ini adalah untuk mengetahui hidrolisa suatu larutan.
B. Alat dan Bahan Alat-alat:
- Pipet tetes - Elektroda karbon -
- Gelas kimia - Kabel
- Gelas ukur Bahan-bahan:
- Larutan NaCl 0,5 M - Larutan CUSO4
- Kertas lakmus merah dan biru - Indikator PP C. Landasan Teori
Baterai (sel golvani) menghasilkan arus apabila reaksi oksidasi-reduksi berlangsung spontan. Sel elektrolit menggunakan energi untuk menghasilkan perubahan kimia. Proses elektrolisis meliputi pendorongan arus melalui sel untuk menghasilkan perubahan kimia dalam mana potensial sel adalah negatif.
D. Cara Kerja kimia. Sambungkan kedua kutub
elektroda ini dengan baterai dan tentukan anoda dan katoda. Biarkan selama + 5 menit. Setelah ini keluarkan kedua elektroda kedalam larutan. Masukkan lakmus merah dengan biru. Catat semua perubahan yang terjadi. Setelah itu masukkan pula 2 tetes larutan PP dan amati perubahan yang terjadi.
2. Elektrolisa Larutan CUSO4
Isi gelas kimia dengan 25 ml larutanCUSO4 0,5 M dan masukkan
elektroda dengan baterai dan tentukan anoda dan katodannya. Biarkan selama 5 menit.
Keluarkan kedua elektroda dan amati keadaan kedua elektroda tersebut. Amati dan catat semua perubahan yang terjadi.
E. Hasil Pengamatan
1. Elektrolisa larutan NaCl
- Elektroda karbon dimasukkan kedalam gelas kimia yang telah berisi lrutan NaCl 0,5 M dan didiamkan selama +5 menit dimana warna NaCl sebelumnya berwarna bening berubah menjadi hijau kekuning-kuningan.
- Kertas lakmus biru tetap biru
- Diteteskan larutan PP, larutan berubah menjadi warna merah
2. Elektrolisa Larutan CUSO4
Elektroda dengan baterai dimana elektroda tersebut sudah ditentukan anoda dan katodanya kemudian elektroda dimasukkan kedalam larutan CUSO4 an dibiarkan selama +5 menit. Setelah
dikeluarkan elektrodanya ternyata warna anoda berubah menjadi hitam dan katoda menjadi cokelat (karatan).
F. Pembahasan
1. Elektrolisa larutan NaCl
- Larutan NaCl berubah menjadi hijau kekuning-kuningan, membuat lakmus merah menjadi biru dan lakmus biru tetap yang artinya bersifat basa.
- Larutan PP membuat warna NaCl menjadi merah yang berarti bersifat asam.
2. Elektrolisa Larutan CUSO4
Anoda menjadi warna hitam dan katoda menjadi cokelat
G. Kesimpulan
Dari hasil pecobaan dapat disimpulkan bahwa:
- Larutan NaCl bersifat asam kuat dan basa kuat - Larutan CUSO4 katoda berwarn acokelat dan anoda
Percobaan 10
UNSUR GOLONGAN ALKALI
A. Tujuan
Adapun tujuan yang ingin dicapi dalam melakukan percobaan ini adalah untuk mengetahui unsur-unsur logam alkali dalam suatu logam dan sifat-sifatnya.
B. Alat dan Bahan Alat-alat:
- Tabung reaksi dan tempatnya - Pinset - Gelas kimia - Pisau
Bahan-bahan:
- Logam natrium - Kertas saring
- Air suling
- Kertas lakmus merah dan biru - Lrutan PP
C. Landasan Teori
Logfam alkali atau golongan 1A: - Jari-jari atom sangat besar
- Penganter panas dan listrik yang baik
- Reduktor hebat,dengan air, hidrogen, oksigen dan halogen. Contoh: pembuatan logam Na diperoleh denga
caraelektrolisis NaCl cair pada temperatur 600 dengan elektroda besi. Logam ini banyak digunakan sebagai agen pereduksibahan pembuatan TEL, cairan pendingin
padareaktor atom an penerang jalan raya.
E. Cara Kerja
Isi air suling
kedalam gelas kimia, kemudian masukkan pula sehelai kertas saring sehingga
Ambil sepotong logam Na dengan pinset, kemudian isilah dengan pisaumsebesar butir beras. Perhatikan warna logam Na pada pemukaan yang baru diiris.
Gambar susunan alat.
Masukkan sekeping kecil laogam Na yang tadi kedalam air dala gelas kimia yang telah disiapkan dan hendaknya segera
menghindar dari tempat tersebut u tuk menghindari percikan natrium. Perhatikan perubahan yangterjadi.
Sebelum dan sesudah percobaan ambillah air yang ada didalam gelas kimia tadi dan tuangkan sedikit ke 2tabung reaksi. Kemudian periksa
a) Dengan kertas lakmus b) Dengan 2 tetes larutan PP
Amati dan catat semua perubahan yang terjadi.
E. Hasil Pengamatan
- Pada saat logam Na dimasukkan kedalam air langsung terdapat perciakan api dan berangsur-angsur habis.
- Pada saat percobaan menggunakan kertas lakmus, sebelum dicampur dengan air didalam gelas kimia warna kelas tidak berubah warna dan setelah dicampur dengna air didalam gelas kimia warna kertas berubah yaitu lakmus merah menjadi biru dan lakmus biru tetap.
- Sebelum ditetesi dengan PP warna air keruh dan setelah ditetesi denga n laarutan Ppberubah menjadi merah.
F. Pembahasan
- Sesuai denga sifat logam alkali Na dapat bereaksi hebat denga air , oksigen dan ha;ogen.
G. Kesimpulan
Percobaan 11
UNSUR-UNSUR GOLONGAN ALKALI TANAH
A. Tujuan
Adapun tujuan yang ingin dicapi dalam melakukan percobaan ini adalah untuk mengetahuiunsur-unsur logam alkalidalam suatu logam dan sifat-sifatnya.
B. Alat dan Bahan Alat-alat:
- Kawat mikrom - Lampu spiritus Bahan-bahan:
- Larutan asam klorida 4M - Larutan Ca-klorida 0,1 M - Larutan Ba-klorida 0,1 M - Larutan (NH4)2C2O4 0,1 M
C. Landasan Teori
Sifat-sifat Logam alkali tanah atau golongan IIA: - Titik cair dan kekerasan melebihi logam alkali
- Jari atom lebih kecil dibandingkan logam alkali seperiode
- Garam logam alkali tanah menghasilkan nyala dengan warna tertentu
D. Cara Kerja
1. Tes nyala terhadap ion-ion Ca+, Sr+, dan Ba+
Bersihkan kawat nikrom dengan cara mencelupkan kedalam larutan HCl, kemudian masukkan kawat ini kedalam nyala lampu spiritus, sehingga warna nyala lampu tidak berubah(biru).
Celupkan kawat nikrom kedalam CaCl2, dan masukka kawat ini
kedalam nyala lampu spiritus. Amati warna nyala api.
Bersihkan kembali kawat nikrom dan ulangi percobaan tersebut dengan menggunakan berturut-turut larutan SrCl2 dan BaCLl2.
Amati warna nyala api.
2. Reaksi pengenalan senyawa maagnesium
Isi 3 tabung reaksi masing-masing denga 3 ml larutan MgSO4 0,5
M kedalam tabung 1 tambahkan 3 ml larutanNaOH 0,1 Mkedalam tabung 2 tambahkan 3 ml larutan (NH4)2CO3 0,1
M.kedalam tabung 3tambahkan 2 ml larutan naHPO4 0,1 M dan
2 ml larutan NH4Cl 0,1 m.
E. Hasil Pengamatan
1. Tes nyala terhadap ion-ion Ca+, Sr+, dan Ba+
2. Reaksi pengenalan senyawa maagnesium
TABUNG REAKSI WARNA
I MgSO4 0,5M+NaOH
0,1M Keruh dan terdapatendapan
II MgSO4 0,5M+
1) Tes ntla pada api pada larutan HCl tetap biru, CaCl2 dan SrCl2
api berwarna merah dan BaCl2 berwarna kuning
2) - Reaksi yang terjadi pada tabung I perubahan warna larutan dari bening menjadi putih keruh.
- Reaksi yang terjadi pada tabung II tidak terjadi perubahan warna yaitu tetap bening.
- Reaksi yang terjadi pada tabung I perubahan warna larutan dari bening menjadi putih keruh.