Laporan LIPID
Laporan Praktikum Hari/ tanggal : Kamis, 10 November 2011 Biokimia umum Waktu : 11.00 – 13.30 PJP : Waras Nurcholis, M.Si Asisten : Dhaniar Astri
Riska Ayu P Lusianawati
Resti Siti M. S.Si.
LIPID Kelompok 5 Yulita Mardiani B04100001 Susan Fasella B04100032 Puti Puspitasari B04100043
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMUPENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
2011
Pendahuluan
Lipid adalah sekumpulan senyawa di dalam tubuh yang memiliki ciri-ciri yang serupa dengan malam, gemuk (grease), atau minyak. Karena bersifat hidrofobik, golongan senyawa ini dapat dipakai tubuh sebagai sarana yang bermanfaat untuk berbagai keperluan. Misalnya jenis lipid yang dikenal sebagai trigliserida berfungsi sebagai bahan bakar yang penting. Senyawa ini sangat efisien untuk dipakai sebagai simpanan bahan penghasil energi karena terkumpul dalam butir-butir kecil yang hampir-hampir bebas air, membuatnya jauh lebih ringan daripada timbunan karbohidrat setara yang sarat air. Jenis lipid yang lain lagi merupakan bahan structural yang penting. Kemampuan lipid jenis ini untuk saling bergabung menyingkirkan air dan senyawa polar lain menyebabkannya dapat membentuk membran sehingga memungkinkan adanya berbagai organisme yang kompleks. Membran tersebut memisahkan satu sel dengan sel yang lain di dalam jaringan, serta memisahkan berbagai organel di dalam sel menjadi ruangan-ruangan yang memiliki ciri kimia tertentu sehingga dapat ditata dan diatur sendiri (Gilvery & Goldstein 1996).
Senyawa-senyawa yang termasuk lipid dapat dibagi dalam beberapa golongan.. Ada beberapa cara penggolongan yang dikenal. Bloor membagi lipid dalam tiga golongan besar, yaitu: (1) lipid
sederhana, yaitu ester asam lemak dengan berbagai alkohol, contohnya lemak atau gliserida dan lilin (waxes); (2) lipid gabungan yaitu ester asam lemak yang mempunyai gugus tambahan, contohnya fosfolipid, cerebrosida; (3) derivate lipid, yaitu senyawa yang dihasilkan oleh proses hidrolisis lipid, contohnya asam lemak, gliserol dan sterol. Di samping itu berdasarkan sifat kimianya yang penting, lipid dapat dibagi dalam dua golongan besar, yaitu lipid yang dapat disabunkan, yakni yang dapat dihidrolisis dengan basa, contohnya lemak, dan lipid yang tidak dapat disabunkan, contohnya steroid. Lipid dibagi dalam beberapa golongan berdasarkan kemiripan struktur kimianya, yaitu: asam lemak, lemak, lilin, fosfolipid, sfingolipid, terpen, steroid, lipid kompleks (Riawan, 1990).
Suatu asam lemak merupakan suatu rantai hodrokarbon dengan suatu gugusan karboksil terminal, telah diidentifikasi lebih dari 70 asam lemak yang tersedia di alam. Walaupun asam lemak berantai pendek, contohnya, asam lemak berantai empat-atau enam- adalah lazim ditemukan, namun triasilgliserolutama ditemukan pada tumbuh-tumbuhan memiliki asam lemak dengan jumlah atom karbon genap, dengan panjang 14 hingga 22 karbon. Asam lemak jenuh tidak mengandung ikatan ganda C=C dalam strukturnya, sementara asam lemak tidak jenuh memiliki satu atau lebih ikatan ganda, yang kadang-kadang berada dalam konfigurasi geometris cis. Asam lemak tidak jenuh paling melimpah memiliki satu atau dua ikatan ganda (masing-masing, asam lemak monoenoat dan dienoat); namun, asam lemak olefinik dengan tiga (trienoat) dan empat (tetraenoat) ikatan ganda juga ditemukan secara alamiah (Armstrong 1995).
Percobaan lipid kali ini bertujuan untuk mengetahui sifat dan struktur lipid melalui uji-uji kualitatif. Selain itu, bertujuan untuk mempelajari sifat-sifat lipid melalui beberapa reaksi uji kualitatif lipid. Metode Praktikum
Praktikum mengenai bifisik dilaksanakan di Labolatorium Biokimia pada hari Kamis, tanggal 10 November 2011 pukul 11.00-13.30 WIB.
Alat-alat yang digunakan dalam praktikum lipid antara lain tabung reaksi, rak tabung reaksi, gelas piala, pipet tetes, pipet Mohr, bulb, gegep tabung reaksi, kertas floroglusinol, sudip, erlenmeyer, tutup erlenmeyer, ruang asam, bunsen, dan penangas air.
Bahan-bahan yang digunakan antara lain air, eter, kloroform, alkohol panas, alkohol dingin, alkali, asam encer, kristal KHSO4, minyak kelapa, minyak kelapa tengik, lemak hewan, mentega, margarin, gliserol, asam stearat, pati, asam oleat, kloroform anhidrat, dan florogusinol.
Uji kelarutan. Sebanyak 2 ml pelarut dimasukkan ke dalam tabung reaksi bersih. Bahan percobaan ditambahkan sedikit ke dalam tabung. Tabung lalu dikocok kuat-kuat, kemudian diamati kelarutannya. Uji dilakukan pada minyak kelapa, lemak hewan, mentega, margarin, gliserol, asam oleat, dan asam stearat. Sedangkan pelarut yang digunakan adalah air, eter, kloroform, alkohol panas, alkohol dingin alkali, dan asam encer.
Uji akrolein. Sedikit kristal KHSO4 dimasukkan ke dalam tabung reaksi. Lalu bahan percobaan dimasukkan dengan kadar sama pada percobaan pertama. Larutan dipanaskan langsung di atas api yang mula-mula dibuat kecil. Akrolein yang terkandung pada bahan percobaan dapat diidentifikasi dengan penciuman bau asap putih yang timbul. Uji ini dilakukan terhadap minyak kelapa, lemak hewan, gliserol, asam palmitat, dan asam stearat, dan pati.
Uji ketidakjenuhan. Bahan percobaan sebanyak 1 ml dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan kloroform dengan volume yang sama. Larutan lalu ditetesi pereaksi Iod Hubl tetes demi tetes sambil dikocok dan diamati perubahan warnanya. Uji ini dilakukan terhadap minyak kelapa, minyak kelapa yang tengik, lemak hewan, mentega, margarin, asam palmitat, dan asam oleat.
Uji ketengikan. Bahan percobaan sebanyak 5 ml dimasukkan ke dalam erlenmeyer 100 ml. Lalu ditambahkan HCL pekat sebanyak 5 ml dan dicampurkan dengan hati-hati.Siapkan kertas saring yang telah dicelupkan dalam floroglusinol. Kemudian larutan ditambahkan serbuk CaCO3 dan segera ditutup dengan sumbat karet yang dijepitkan kertas floroglusinol sehingga kertasnya tergantung. Keadaan ini dibiarkan selama 10-20 menit hingga terjadi perubahan warna pada kertas. Uji ini dilakukan terhadap minyak kelapa, minyak kelapa tengik, lemak hewan, dan mentega dengan takaran 2,5 ml untuk bahan cairan dan seujung sudip untuk bahan padatan.
Uji salkowski dan uji Lieberman Buchard. Uji kedua ini merupakan uji untuk kolesterol, prinsipnya sama yaitu tambahkan 2 sendok kolesterol ke dalam tabung reaksi, dan 3 ml kloroform
anhidrat.setelah tercampur tambahkan 3 ml asam sulfat pekat, amati perubahan warna yang terjadi. Untuk uji Lieberman Buchard tambahkan 10 tetes asam asetat anhidrat dan 2 tete asam sulfat pekat, kocok dan amati warna yang terjadi.
Hasil
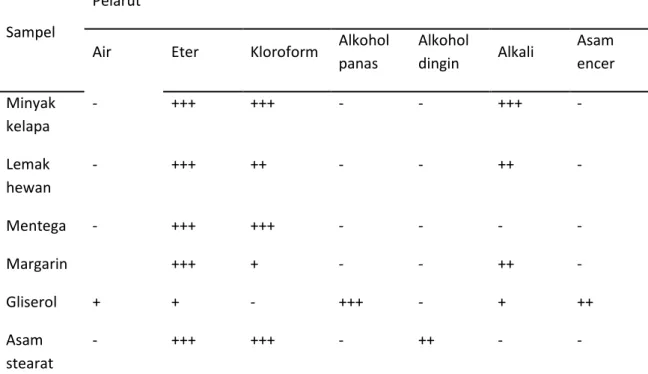
Tabel 1 Hasil uji kelarutan
Sampel
Pelarut
Air Eter Kloroform Alkohol panas Alkohol dingin Alkali Asam encer Minyak kelapa - +++ +++ - - +++ - Lemak hewan - +++ ++ - - ++ - Mentega - +++ +++ - - - - Margarin +++ + - - ++ - Gliserol + + - +++ - + ++ Asam stearat - +++ +++ - ++ - - Keterangan :
+ = bahan percobaan larut
- = bahan percobaan tidak larut
(a)
(a) (b) (c)
(d) (e) (f)
Gambar 1 Hasil uji kelarutan : (a)air, (b)eter,(c)kloroform, (d)alkohol panas, (e)alkali, dan (f)asam encer (minyak kelapa, minyak kelapa tengik, lemak hewan, mentega, margarin, dan asam olereat [kiri-kanan])
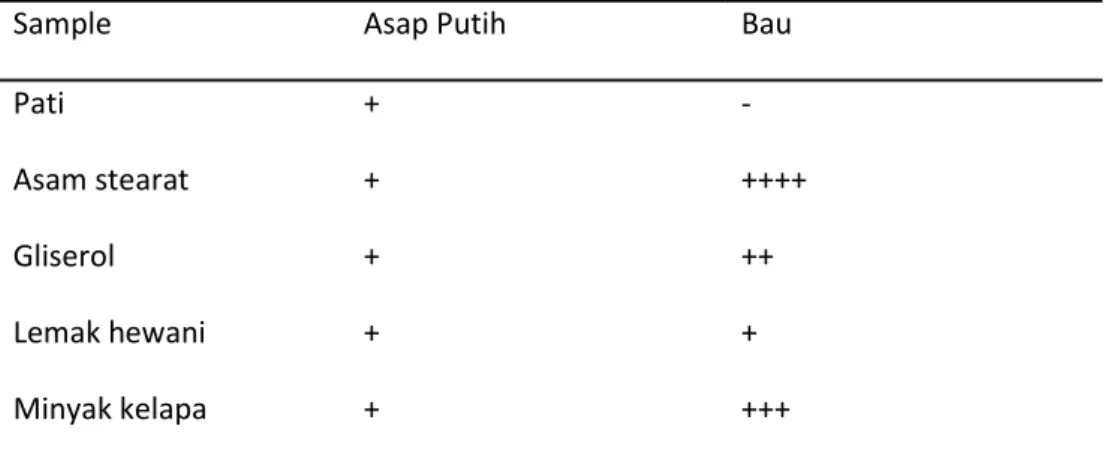
Tabel 2 Hasil Uji Akrolein
Sample Asap Putih Bau
Pati + - Asam stearat + ++++ Gliserol + ++ Lemak hewani + + Minyak kelapa + +++ Keterangan :
+ : ada asap putih dan bau -: tidak ada asap putih dan bau Tabel 3 Hasil uji ketidakjenuhan
Sample Kloroform Iod Hubl
Minyak kelapa Bening Pink ( jenuh)
Minyak kelapa tengik Bening Putih
Lemak hewan Bening Putih
Mentega Bening Putih
Margarin Bening Pink (jenuh)
Asam oleat Bening Putih
1 : Minyak Kelapa 2 : Minyak Kelapa tengik 3 : Lemak Hewan 4 : Mentega 5 : Margarin 6 : Asam oleat
Keterangan
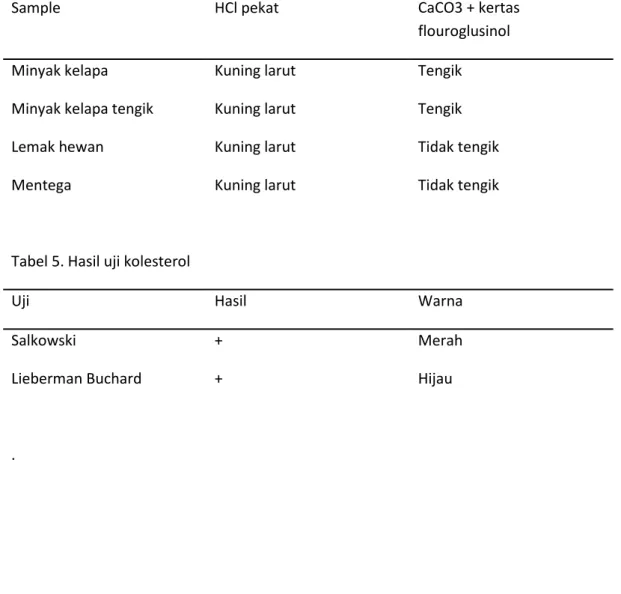
1 2 3 4 5 6 Gambar 2 Hasil uji ketidakjenuhan Tabel 4. Hasil uji ketengikan
Sample HCl pekat CaCO3 + kertas
flouroglusinol
Minyak kelapa Kuning larut Tengik
Minyak kelapa tengik Kuning larut Tengik
Lemak hewan Kuning larut Tidak tengik
Mentega Kuning larut Tidak tengik
Tabel 5. Hasil uji kolesterol
Uji Hasil Warna
Salkowski + Merah
Lieberman Buchard + Hijau
.
Uji Salkowski Uji Lieberman-Buchard Gambar 5. Hasil uji untuk kolesterol : Salkowski dan Lieberman-Buchard Pembahasan
Asam-asam lemak jenuh ataupun tidak jenuh yang dijumpai pada trigliserida, umumnya merupakan rantai tidak bercabang dan jumlah atom karbonnya selalu genap. Ada dua macam trigliserida, yaitu
trigliserida sederhana dan trigliserida campuran. Trigliserida sederhana mengandung asam-asam lemak yang sama sebagai penyusunnya, sedangkan trigliserida campuran mengandung dua atau tiga jenis asam lemak yang berbeda. Pada umumnya, trigliserida yang mengandung asam lemak tidak jenuh bersifat cairan pada suhu kamar, disebut minyak, sedangkan trigliserida yang mengandung asam lemak jenuh bersifat padat yang sering disebut lemak. Trigliserida bersifat tidak larut dalam air, namun mudah larut dalam pelarut nonpolar seperti kloroform, benzena, atau eter. Molekul oksigen dalam udara dapat bereaksi dengan asam lemak, sehingga memutuskan ikatan gandanya menjadi ikatan tunggal. Hal ini menyebabkan minyak mengalami ketengikan.
Pada uji kelarutan derajat kelarutan lemak dapat dilihat dengan cara pengamatan secara langsung pada bahan pelarut yang digunakan atau kalau belum cukup, cairan tersebut dapat dideteksi atau disaring melalui kertas saring keatas gelas arloji, ada tidaknya residu yang tertinggal menunjukkan derajat kelarutan zat.
Trigliserida yang mengandung asam lemak yang mempunyai ikatan rangkap dapat diadisi oleh golongan halogen. Pada uji ketidakjenuhan, pereaksi iod Hubl akan mengoksidasi asam lemak yang mempunyai ikatan rangkap pada molekulnya menjadi berikatan tunggal. Warna merah muda yang hilang selama reaksi menunjukkan bahwa asam lemak tak jenuh telah mereduksi pereaksi iod Hubl (Winarno 2002).
Ketengikan pada kebanyakan lemak atau minyak menunjukkan bahwa kebanyakan golongan trigliserida tersebut telah teroksidasi oleh oksigen dalam udara bebas. Pada uji ketengikan, warna merah muda menunjukkan bahwa bahan tersebut tengik. Warna merah muda dihasilkan dari reaksi antara floroglusinol dengan molekul oksigen yang mengoksidasi lemak/minyak tersebut.
Uji Salkowski dan Lieberman-Buchard digunakan untuk mengidentifikasi adanya kolesterol. Pada uji Salkowski, terbentuk cincin coklat yang menunjukkan terjadinya reaksi antara kolesterol dengan asam sulfat pekat. Warna hijau pada uji Lieberman-Buchard menunjukkan reaksi antara kolesterol dengan asam asetat anhidrat. Kedua uji tersebut diatas dapat digunakan untuk mengukur kadar kolesterol secara kalorimetri (Poedjiadi 1994).
Penambahan pereaksi KHSO4 pada uji akrolein berfungsi untuk mengkatalisis gliserol yang ada dalam sampel, sedangkan pemanasan dengan api yang kecil untuk menghilangkan keberadaan air dalam larutan contoh. Fungsi iod dalam pengujian ketidakjenuhan adalah memutus ikatan rangkap yang terdapat dalam molekul zat, kemudian iod tersebut akan menggantikan posisi dari ikatan rangkap tersebut sehingga ikatan rangkap akan berkurang atau bahkan tidak ada sama sekali (Girindra 1988).
Gliserol lebih cepat tengik dibandingkan minyak kelapa karena minyak kelapa bila dihidrolisis akan terlebih dahulu diubah menjadi gliserol dan asam lemak bebas, lalu gliserol menjadi akrolein yang menyebabkan terjadinya bau. Sedangkan gliserol apabila terhidrasi akan langsung diubah menjadi akrolein sehingga bau tengik lebih cepat timbul. Pereaksi KOH dibutuhkan untuk menitrasi pada sampel minyak.
Aplikasi uji ini adalah penentuan adanya kolesterol atau tidak dalam zat makanan. Metode soklet dalam mengukur kadar lemak pakan juga menggunakan prinsip uji lipid ( Despal 2007).
Daftar Pustaka
Despal, dkk. 2007. Pengantar Ilmu Nutrisi. Bogor: Departemen Ilmu dan Teknologi Pakan Fakultas Peternakan IPB.
Frank B. 1995. Buku Ajar Biokimia Edisi ketiga. EGC: Jakarta
Gilvery, Goldstein. 1996. Biokimia Suatu Pendekatan Fungsional Edisi 3. Airlangga University Press: Surabaya
Girindra A, dkk. 1988. Penuntun Praktikum Biokimia. Bogor: IPB Press Riawan, S. 1990. Kimia Organik. Edisi 1. Binarupa Aksara: Jakarta Winarno FG. 2002. Kimia Pangan dan Gizi. Jakarta: Gramedia.
aporan Praktikum Lemak
BAB 1
MATERI DAN METODE Materi
Alat yang digunakan dalam Praktikum Lemak adalah pipet tetes berfungsi untuk mengambil larutan dan meneteskannya dalam tabung reaksi dan tabung reaksi berfungsi untuk tempat mereaksikan larutan.. Bahan yang digunakan dalam praktikum ini yaitu minyak kelapa, mentega, margarine, air, alcohol, eter, kloroform, air sabun, Na2CO3 dan lemak ( gajih ).
Metode
Sifat Fisik, Kekentalan, dan Bau
Langkah kerja pada percobaan ini dilakukan dengan cara menyediakanminyak kelapa dan lemak (gajih) pada tabung reaksi secara terpisah.Mengamati sifat kekentalan, bau, dan sifat fisik dari minyak kelapa dan lemak (gajih). Mencatat hasil pengamatan pada buku praktikum.
Uji Kelarutan Lipid
Langkah kerja pada percobaan ini dilakukan dengan cara menyediakan lima tabung reaksi yang masing-masing telah diiskan air, Na2CO3, alkohol, eter dan kloroform sebanyak 10 tetes secara urut. MenambahkanMinyak Kelapa sebanyak 10 tetes pada tiap tabung. Kemudian menggojognya
sampai tercampur dan biarkan beberapa menit kemudian mengamati apa yang terjadi. Mengulangi percobaan tersebut dengan menggunakan Mentega danMargarin.
dan mengamati hasilnya. Mengulangi percobaan dengan mentega dan margarine. Pembentukan Emulsi
Langkah kerja pada percobaan ini dilakukan dengan caramenyediakan tiga tabung reaksi. Tabung I berisi 2 ml air dan 1 tetes minyak kelapa. Tabung II berisi 2 ml air, 1 tetes minyak dan 1 tetes Na2CO3. Tabung III berisi 2 ml air, 1 tetes minyak kelapa dan 1 tetes air sabun. Menggojog sampai tercampur dan mengamati hasilnya. Mengulangi percobaan dengan mentega dan margarine.
BAB 2
HASIL DAN PEMBAHASAN
Uji Sifat Fisik, Kekentalan dan Bau Lemak
Berdasarkan hasil praktikum yang telah dilakukan, diperoleh sebagai berikut : Tabel 1. Hasil Pengamatan Uji Sifat Fisik, Kekentalan dan Bau Lemak
Sampel Kekentalan Bau Sifat fisik
Minyak kelapa Encer Tengik Kekuningan, cair
Lemak (gajeh) Kental Amis Bergelambir, padat
Sumber : Data Primer Praktikum Kimia Dasar, 2012
Percobaan dengan Uji Sifat Fisik, Kekentalan dan Bau Lemak memiliki tujuan untuk mengetahui sifat fisik lemak, tingkat kekentalan, dan bau dari lemak. Hasil praktikum pada kedua sampel
menunjukkan hasil yang berbeda baik itu dari segi fisik, kekentalan maupun baunya, tetapi sebenarnya zatnya sama. Hal ini sesuai pendapat Hawab (2004) bahwa lemak dan minyak hanya berbeda wujud, tetapi zatnya sama. Pada suhu tinggi lipid menjadi cair, sedangkan pada suhu rendah lipid menjadi padat. Lemak (gajih) memiliki tingkat kekentalan tinggi dan berbau amis , sedangkan minyak kelapa memiliki tingkat kekentalan rendah dan berbau tengik. Hal ini sesuai dengan pendapat Sastrohamidjoyo (2000) pada lemak memiliki sifat kental, padat,
sedangkan minyak kelapa mempunyai sifat kental namun sedang, berbau dan cair. 3.2. Uji Kelarutan Lipid pada Minyak Kelapa
Berdasarkan hasil praktikum yang telah dilakukan, diperoleh hasilsebagai berikut : Tabel 2. Hasil Pengamatan Uji Kelarutan Lipid
Pelarut Minyak Margarin Mentega
H2O Na2CO3 Alkohol Eter Kloroform Tidak larut Tidak larut Tidak larut Larut Larut Tidak larut Tidak larut Tidak larut Larut Larut Tidak larut Tidak larut Tidak larut Larut Larut Sumber: Data Primer Praktikum Dasar, 2012
Pada Uji Kelarutan ini, minyak kelapa, margarin dan mentega digunakan sebagai bahan terlarut. Bahan pelarut digunakan Air, Na2CO3,Alkohol, Eter, dan Kloroform. Uji kelarutan diperoleh hasil bahwa ketiga sampel tidak larut dalam air, Na2CO3 dan alkohol. Namun semua sampel larit pada pelarut organik polar yaitu eter dan kloroform. Hal ini sesuai dengan pendapat Hart et al (2003)
bahwa lipid tidak larut dalam air tetapi larut dalam pelarut organik polar. Hawab (2004) juga menambahkan bahwa ciri khusus dari zat atau senyawa lipid ialah tidak larut dalam air, tetapi larut dalam pelarut-pelarut lemak, yaitu cairan pelarut nonpolar, seperti khloroform, eter, aseton, dan sebagainya. Pelarut seperti eter dan klorofom yang digunakan disebut juga sebagai pelarut lemak. Sesuai pendapat Poedjiadi (1994) bahwa pelarut organik misalnya eter, aseton, kloroform, benzena yang sering disebut “pelarut lemak”.
3.2 Uji Emulsi
Berdasarkan hasil praktikum yang telah dilakukan diperoleh hasil sebagai berikut : Tabel 1.3 Pengamatan Uji Emulsi
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan hasil pengamatan uji emulsi bahwa mentega, margarine dan minyak kelapa dapat membentuk emulsi oleh Na2CO3 dan air sabun yang dicampur dengan air, sedangkan untuk air tidak mengemulsi. Hal ini sesuai pendapat Poedjiadi (1994) bahwa sabun digunakan sebagai bahan pembersih kotoran, terutama kotoran yang bersifat lemak atau minyak karena sabun dapat
mengemulsikan lemak atau minyak. Serta margarin merupakan minyak kelapa sawit yang mengalami proses hidrogenasi, yaitu proses perubahan asam lemak cair menjadi asam lemak padat.
Hart et al (2003) menambahkan bahwa lemak mempunyai sifat tidak larut dan teremulsi dalam air. Percobaan emulsi saat pelarutnya berupa Na2CO3 dan air sabun yang dicampur dengan air juga menunjukkan adanya sedikit endapan. Hal ini sesuai pendapat Hart et al(2003) bahwa apabila pada suatu bahan yang diujikan terdapat lemak maka akan mengalami emulsi dengan sempurna yang ditunjukkan dengan adanya endapan.
KESIMPULAN
Percobaan mengenai lemak dapat diambil kesimpulan bahwa lemak tidak larut dan tidak mengemulsi dalam air, tetapi larut dalam pelarut-pelarut lemak yaitu cairan pelarut non polar seperti chloroform, eter, aseton dan sebagainya. Lemak mengemulsi saat dilarutkan dengan Na2CO3 dan air sabun yang telah dicampur dengan air. Wujud atau fisik antara lemak dan minyak berbeda pada saat uji fisik, kekentalan dan bau. Sebenarnya zat antara lemak dan minyak sama.
DAFTAR PUSTAKA
Hart, H,. L.E Craine dan D.J Hart. 2003. Kimia Organik. Erlangga, Jakarta.
Hawab, H.M. 2004. Pengantar Biokimia Edisi Revisi. Bayumedia Publishing, Jakarta. Poedjiadi, A. 1994. Dasar-dasar Biokimia. Ut-Press, Jakarta.
Sastrohamidjojo, H. 2000.Kimia Dasar. Gadjah Mada University Press, Yogyakarta.
Laporan Praktikum Biokimia Lipid
Posted by: vheenhie on: November 11, 2011 In: Uncategorized
1 Komentar
JUDUL : Lipida
Hari/Tanggal : Jumat, 21 Oktober 2011
TUJUAN :
2.1 Menguji kelarutan lemak dan minyak pada berbagai jenis pelarut. 2.2 Menguji sistem emulsi lemak/minyak dalam air dan larutan Na2CO3. 2.3 Menentukan bilangan penyabunan suatu lemak/minyak.
III. TINJAUAN PUSTAKA
Suatu Lipid didefinisikan sebgai senyawa organic yang terdapat dalam alam serta tak larut dalam air, tetapi larut dalam pelarut organic non polar sperti suatu hidrokarbon atau dietil eter ( Fessenden & Fessenden,1982)
Lipid adalah senyawa yang merupakan ester dari asam lemak dengan gliserol yang kadang-kadang mengandung gugus lain. Lipid tidak larut dalam air, tetapi larut dalam pelarut organic se[erti eter, aseton, kloroform, dan benzene (Salirawati et al,2007)
Lipid tidak memiliki rumus molekul yang sama, akan tetapi terdiri dari beberapa golongan yang berbeda. Berdasarkan kemiripan struktur kimia yang dimiliki, lipid dibagi menjadi beberapa golongan, yaitu Asam lemak, Lemak dan fosfolipid ( Salirawati et al,2007)
R1,R2,dan R3 adalah rntai hidrokarbin dengan jumlah atom karbon dari 3 sampai 23, tetapi yang paling umum dijumpai yaitu 15 dan 17 (Salirawati et al,2007).
Lemak dan minyak adalah trigliserida atau triasilgliserol,kedua istilah ini berarti “triester (dari) gliserol”. Perbedaan antara suatu lemak dan minyak bersifat sebarang: pada temperatur kamar lemak berbentuk padat dan minyak bersifat cair. Sebagian besar gliserida pada hewan adalah berupa lemak, sedangkan gliserida dalam tumbuhan cenderung berupa minyak (fessenden & fessenden, 1982)
Lemak digolongkan berdasarkan kejenuhan ikatan pada asam lemaknya. Adapun penggolongannya adalah asam lemak jenuh dan tak jenuh (Salirawati et al,2007).
Lemak yang mengandung asam-asam lemak jenuh, yaitu asam lemak yang tidak memiliki ikatan rangkap. Dalam lemak hewani misalnya lemak babi dan lemak sapi, kandungan asam lemak jenuhnya lebih dominan (Salirawati et al,2007).
Asam lemak tak jenuh adalah asam lemak yang mempunyai ikatan rangkap. Jenis asam lemak ini dapat di identifikasi dengan reaksi adisi, dimana ikatan rangkap akan terputus sehingga terbentuk asam lemak jenuh (Salirawati et al,2007).
Dengan reagen HubI’s Iod yang berupa larutan iod dalam alkohol dan mengandung sedikit HgCl2, maka kemungkinan hilangnya warna iod akan berbeda untuk penambahan jenis minyak yang berbeda, karena kandungan ikatan rangkap setiap jenis minyak memang berbeda. Semakin banyak ikatan rangkap semakin cepat warna iod hilang, karena berarti seluruh I2 telah digunakan untuk memutuskan ikatan rangkap ( Salirawatiet al,2007).
Derajat ketiakjenuhan dinyatakan dengan bilangan iodin, yaitu jumah garam yang dapat diserap oleh 100 gram lemak untuk reaksi penjenuhan. Semakin besar bilangan Iodin semakin tinggi
ketidakjenuhannya ( Salirawati et al,2007).
Dengan proses hidrolisis lemak akan terurai menjadi asam lemak dan gliserol. Proses ini dapat berjalan dengan menggunakan asam, basa, atau enzim tertentu. Contohnya hidrolisis gliseril tristearat akan menghasilkan gliserol dan asam stearat (salirawati et al,2007)
Gambar 3.1 Contoh hidrolisis Margarin
Proses hidrolisis yang menggunakan basa akan menghasilkan gliserol dan sabun. Oleh karena itu sering disebut reaksi penyabunan (Saponifikasi). Apabila rantai karbon pendek, maka jumlah mol asam lemak besar, sedangkan jika rantai karbon panjang, jumlah mol asam lemak kecil. Jumlah miligram KOH yang diperlukan untuk menyabunkan 1 gram lemak disebut bilangan penyabunan (Salirawati et al,2007)
Besar kecilnya bilangan penyabunan tergantung pada panjang pendeknya rantai karbon. Semakin pendek rantai karbon, semakin kecil bilangan penyabunannya (salirawati et al,2007)
Gambar3.2 Reaksi penyabunan gliseril stearat
Jika digunakan NaOH maka akan dihasilka sabun yang bersifat lebih keras atau biasa disebut “sabun cuci”, sedangkan jika digunakan KOH maka dihasilkan sabun yang lebih lunak atau biasa disebut “sabun mandi”. (Salirawati et al,2007)
Diantara sekian banyak jenis Minyak, manyak kelapalah yang paling sering digunakan. Minyak kelapa diperoleh dari ekstraksi terhadap. Minyak kelapa kasar mengandung komponen bukan minayk seperti fosfatida, gum, sterol (0,06%-0,8%), tokoferol (0,003%) dan asam lemak nenas kurang dari 5% .
Menurut ketaren(1986), warna pada minyak disebabkan oleh adanya pigmen-pigmen warna alam karoten yang merupakan hidrokarbon tidak jenuh. Sedangkan menurut Kisshenbuar (1960), warna pada minyak selain disebabkan oleh zat warna karoten juga disebabkan oleh kotoran lain karena asam-asam lemak dan gliserida murni tidak berwarna.
Karoten merupakan hidrokarbon sangat tidak jenuh dan tiak stabil pada suhu tinggi. Karoten tidak dapat dihilangkan dengan proses oksidasi, walaupun minyak sampai menjadi tengik, tetapi dapat diserap oleh beberapa absorben, sehingga minyak tidak berwarna lagi (Ketaren, 1986).
Minyak kelapa berdasarkan kandungan asam lemaknya digolongkan dalam minyak asam laurat, karena kandungan asam lauratnya paling besar, yaitu 44-52% dalam minyak. Berdasarkan tingkat ketidakjenuhannya yang dinyatakan dengan bilangan iod, maka minyak kelapa dapat dimasukkan kedlam golongan non drying oil, karena bilangan iod minyak berkisar antara 7,5-10,5. (Ketaren, 1986).
Asam lemak jenuh minyak kelapa kurang lebih 90%. Minyak kelapa mengandung 84% trigliserida dengan tiga molekul asam lemak jenuh, 12% trigliserida dengan dua asam lemak jenuh dan 4% trigliserida denganasam lemak jenuh (ketaren,1986).
Sifat fisik Minyak kelapa yang terpenting adalah tidak mencair tahap demi tahap seperti lemak yang lain akan tetapi langsung berubah menjadi cair, hal ini disebabkan karena titik cair asam lemak penyusunnya bedekatan, asam lemak laurat 44○C,asam lemak miristat 54○C, asam lemak palmitat 63○C. Dengan demikian plastisitasa trigliserida juga terbatas (Murdijati gardjito,1980)
Metode Percobaan 4.1 Alat - Tabung reaksi - Kertas lakmus - Gelas kimia - Pipet tetes
4.2 Bahan - Mentega - Margarin
- Minyak kayu cendana - Alkohol panas - Asam encer - Aquades - Alkali - Larutan Na2CO3. 1,0 % 4.3 Prosedur Kerja Uji Kelarutan
Derajat kelarutan lemak/minyak dapat dilihat atau ditentukan dengan pengamatan secara langsung pada bahan pelarut yang dipakai.
Cara kerja :
3 mL pereaksi dimasukkan ke dalam tabung reaksi yang bersih. Sedikit bahan percobaan dibubuhkan ke dalam tabung yang sudah berisi pelarut. Isi tabung dikocok kuat-kuat dan diamati kelarutannya.
Emulsi
Minyak/lemak tidak dapat larut dalam air tetapi dapat membentuk emulsi yang stabil bila ada bahan lain yang dapat berfungsi sebagai emulgator.
Cara Kerja:
Kira-kira 5 mL air dimasukkan ke tabung reaksi yang bersih. 3 tetes bahan percobaan dimasukkan pada tabung reaksi berisi air. Dikocok kuat-kuat selama 1-2 menit. Diamati dan dicatat hasilnya.
5 mL air dimasukkan ke dalam tabung reaksi yang bersih. 2-3 tetes larutan Na2CO3 dibubuhkan kedalam tabung yang berisi air. Dikocok dan diperiksa larutan dengan indicator hingga laritan bersifat basa. Kemudian, 3 tetes bahan percobaan dibubuhkan ke dalamnya dan dikocok kuat-kuat selama 1-2 menit. Diamati dan dicatat hasilnya.
Penentuan bilangan penyabunan
2,5 g bahan percobaan (lemak/minyak) dan 25 ml KOH 0,1 M dimasukkan kedalam Erlenmeyer 250 ml. dibuat juga blankonya(pengerjaannya sama, tetapi tanpa menggunakan bahan percobaan). Baik bahan percobaan maupun blako dibuat duplo (2 kali ulangan)
Direfluks diatas api kecil sampai penyabunan sempurna (kira-kira 30 menit). Untk mengetahui apakah proses penyabunan telah selesai/sempurna, hasil refluks diteteskan dalam tabung yang berisi air. Bila bening berarti proses penyabunan telah selesai.
Setelah didinginkan, hasil refluks ditambah 2 tetes indicator fenolftalein dan dititrai denganlarutan HCl 0,5 M.
Di hitung bilangan penyabunan
Keterangan :
V1 = Volume Hcl yang dibutuhkn untuk bahan percobaan (mL) V2 = Volume HCl yang dibutuhkan untuk blako (mL)
M = Molaritas Hcl yang digunakan 56,1 = massa molekul KOH
Penentuan Bilangan peroksida
Minyak sebanyak 5 g ditimbang dalam Erlenmeyer 250 mL dan ditambahkan30 ml campuran pelarut yang terdiri dari 60% CH3COOH dan 40% CHCl3, lalu dikocok
Selanjutnya, larutan tersebut ditanbahkan 0,5 mL larutan KI jenuh sambil dikocok dan dibiarkan dalam ruangan gelap selama 2 menit.
Larutan ditambahkan 30 mL aquades dan 3 tetes indicator kanji lalu dititrasi dengan Na2S2O3 0,01 M. Proses yang sama dilakukan juga terhadap blanko.
Penentuan bilangan asam
Minyak sebanyak 20 g ditimbang dalam Erlenmeyer dan ditambahkan 50 mL etanol 95% Campuran kemudian dipanaskan selama 10 menit dalam pemanas air sambil diaduk, kemudian dtambahkan 3 tetes indicator pp dan dititrasi dengan KOH 0,1 M.
V. Hasil Percobaan
Hidrolisis pati oleh amilase air liur
Bahan Percobaan Kloroform Alcohol Panas Asam Encer Alkali
Minyak kelapa + - - -
Mentega + - - -
Margarin + + - -
Keterangan: (+) = larut (-) = tidak larut
Bahan Percobaan Emulsi A Emulsi B
Minyak kelapa - +
Mentega - +
Margarin - +
Keterangan : (+) = membentuk emulsi (-) = tidak membentuk emulsi
Blanko Bahan Percobaan
Ulangan I Ulangan II Ulangan I Ulangan II
Meniskus akhir 14,5 6,5 22 9,5
Meniskus awal 10 1 6 2
Volume HCl 4,5 5,5 16 7,5
Rataan Vb= 5 Rataan Vi= 11,75
Diketahui : berat bahan percobaan : 2,5 gram Konsentrasi HCl : 0,5 M
Volume HCl untuk blanko (V1) : 5 ml Volume HCl untuk bahan percobaan : 11,75 ml Massa molekul KOH : 56 g/mol
= 75,735
Penentuan bilangan Peroksida Konsentrasi Na2S2O3 = 0.01 M Volume Na2S2O3 = 10 ml Berat sampel = 5 gram
= 20
Penentuan bilangan asam Konsentrasi KOH = 0,1 M Volume KOH = 17,5 ml Berat sampel = 20 gr
Titrasi Meniskus awal = 0 Meniskus akhir = 17,5 = 4,90875 VI. PEMBAHASAN
Pada percobaan pertama yaitu uji kelarutan, minyak kelapa, mentega dan margarine ketiganya larut dalam kloroform, tetapi pada alcohol panas hanya margarine yang larut sedangkan pada alkali ketiganya tidak larut. Menurut Lehninger (1982), lipid merupakan sekumpulan senyawa biomolekul yang dapat larut dalam pelarut-pelarut organik nonpolar seperti kloroform, eter, benzene, aseton, dan petroleum eter. Jadi, hasil percobaan ini membuktikan bahwa lipid larut dalam kloroform karena kloroform merupakan pelarut non polar sedangkan alcohol tidak karena alcohol merupakan pelarut polar begitu pula dengan alkali (salirawati et al,2007).
Pada percobaan kedua, pembentukan emulsi terlihat bahwa untuk percobaan bagian A Minyak, mentega dan margari hanya dilarukan dengan menggunkan air. Tidak terjadi pembentukkan emulsi karena minyak, mentega dan margarine tidak dapat larut didalam air Karena air merupakan pelarut polar (salirawati et al,2007).
Tetapi pada percobaan bagian B, dengan adanya larutan Na2CO3 Minyak kelapa membentuk emulsi ketika dilarutkan kedalam larutan campuran air dan Na2CO3. Karena Na2CO3 merupakan zat emulgator sehingga pada penambahan lipid kedalam larutan air dan Na2CO3 terjadi emulsi karena larutan Na2CO3 membantu menurunkan tegangan permukaan air. (Fessenden & Fesenden, 1982) Pada percobaan ketiga yakni penentuan bilangan penyabunan minyak direaksikan dengan KOH. Sabun yang dihasilkan dari reaksi ini berupa sabun yang mempunyai sifat yang lebih keras (Salirawati et al,2007).
Dalam penentuan bilangan penyabunan, besar kecilnya bilangan penyabunan ditentukan oleh panjang pendeknya rantai karbon. Hasil dari bilangan penyabunan dari minyak adalah 75,735 hal ini menunjukan bahwa minyak memiliki rental yang panjang karena bilangan penyabunannya besar (Salirawati et al,2007).
Pada percobaan keempat yakni penentuan bilangan peroksida, minyak dilarukn dalam pelarut yang merupakan campuran kloroform dan asam asetat. Dan ditambhkan larutan kanji kemudian dititrasi. Hasil akhir dari titrasi larutan membentuk dua fase. Bilangan peroksida dari minyak yang didapat sesuai hasil percobaan adalah 20. Penentuan bilangan peroksida ini bertujuan untk melihat kualitas minyak. Karena seringkali minyak mudah mengalami kerusakan yang disebabkan oleh autooksidasi
radikal asam lemak tidak jenuh dalam lemak. Untk menghambatnya biasanya ditambahkan antioksidan. Antioksidn bersifat sebagai akseptor radikal bebas dan mampu menghentikan reaksi oksidasi minyak (stuckey,1968).
Reaksi autooksidasi dimulai ketika radikal bebas hasil tahap inisiasi bereaksi dengan oksigen membentuk radikal peroksida. Reaksi ini berntai dan sangat cepat dengan energy hamper nol, sehingga konsentrasi radikal peroksida yang terbentuk lebih besar dalam siste makanan dimana oksigen tersebut berada. Radikal peroksida tersebut akan mengekstrak ion hydrogen dari lipid membentuk hidroperoksida dan molekul radikal lipida baru (Trilaksani,2003)
Dan untuk percoban selanjutnya yakni penentuan bilangan asam. Sesuai hasil percobaan diperoleh 4,98075. Asam yang berasal dari antioksidan bertindak sebagai donor proton (hydrogen) terhadap radikal bebas yang terbentuk sehingga tahap propagasi dapat terhambat dan jumlah radikal bebasa yang dapat menstimulasi terjadinya kankerpun dapat dikurangi jumlahnya. Semakin banyak
antioksidan yang ditambahkan pada minyak, kerusakan minyak karena oksidasipun dapat dikurang (Salirawati et al,2007). VII. Kesimpulan
Dari hasil percobaan di atas dapat disimpulakan bahwa :
Lemak dan minyak tidak larut di dalam asam, alkohol dan alkali(pelarut Polar), tetapi dalam pelarut organik seperti: eter, kloroform, dll.
Lemak dan minyak tidak membentuk emulsi di dalam air, tetapi di dalam larutan garam seperti Na2CO3 membentuk emulsi
Bilangan penyabunan adalah Jumlah miligram KOH yang diperlukan untuk menyabunkan 1 gram lemak. Besar kecilnya bilangan penyabunan tergantung pada panjang pendeknya rantai karbon. Semakin pendek rantai karbon, semakin kecil bilangan penyabunannya.
DAFTAR PUSTAKA
Budha,K.1981. Kelapa dan hasil pengolahannya. Denpasar: Fakultas teknologi dan pertanian Universitas Udayana
Fessenden dan Fessenden.1982.Kimia Organik II,edisi ketiga.Jakarta: Erlangga
Garjito,M.1980.Minyak:Sumber,penanganan, pengelolahan, dan pemurnian. Yogyakarta: Fakultas Teknologi pertanian UGM
Salirawati et al.2007.belajar kimia menarik. Jakarta: Grasindo
Trilaksani,W.2003.Antioksidan Jenis, Sumber, Mekanisme Kerja, dan peran terhadap kesehatan. Laporan penelitian.Bogor:IPB
SUNDAY, APRIL 22, 2012
Analisis Kualitatif dan Kuantitatif Lipid Posted by Valdis Rein on 2:01 PM
Lipid adalah senyawa organik berminyak atau berlemak yang tidak larut dalam air, dapat diekstrak dari sel dan jaringan oleh pelarut nonpolar, seperti kloroform dan eter. Asam lemak adalah komponen unit pembangun pada hampir semua lipid. Asam lemak adalah asam organik berantai panjang yang mempunyai atom karbon dari 4 sampai 24. Asam lemak memiliki gugus karboksil tunggal dan ekor hidrokarbon nonpolar yang panjang. Hal ini membuat kebanyakan lipid bersifat tidak larut dalam air dan tampak berminyak atau berlemak (Lehninger 1982).
Lipid secara umum dapat dibagi ke dalam dua kelas besar, yaitu lipid sederhana dan lipid kompleks. Yang termasuk lipid sederhana antara lain adalah: 1) trigliserida dari lemak atau minyak seperti ester asam lemak dan gliserol, contohnya adalah lemak babi, minyak jagung, minyak biji kapas, dan butter, 2) lilin yang merupakan ester asam lemak dari rantai panjang alkohol, contohnya adalah beeswax, spermaceti, dan carnauba wax, dan 3) sterol yang didapat dari hidrogenasi parsial atau menyeluruh fenantrena, contohnya adalah kolesterol dan ergosterol (Scy Tech Encyclopedia 2008).
Lipid yang paling sederhana dan paling banyak mengandung asam lemak sebagai unit penyusunnya adalah triasilgliserol, juga sering disebut lemak, lemak netral, atau trigliserida. Jenis lipid ini
merupakan contoh lipid yang paling sering dijumpai baik pada manusia, hewan, dan tumbuhan. Triasilgliserol adalah komponen utama dari lemak penyimpan atau depot lemak pada sel tumbuhan dan hewan, tetapi umumnya tidak dijumpai pada membran. Triasilgliserol adalah molekul hidrofobik nonpolar, karena molekul ini tidak mengandung muatan listrik atau gugus fungsional dengan
polaritas tinggi (Lehninger 1982).
Triasilgliserol terakumulasi di dalam beberapa area, seperti jaringan adiposa, dalam tubuh manusia dan biji tanaman, dan triasilgliserol ini mewakili bentuk penyimpanan energi. Lipid yang lebih kompleks berada dekat dan berhubungan dengan protein dalam membran sel dan partikel subselular. Jaringan yang lebih aktif mengandung lipid kompleks yang lebih banyak, contohnya adalah dalam otak, ginjal, paru-paru, dan darah yang mengandung konsentrasi fosfatida dalam
jumlah tinggi pada mamalia (Scy Tech Encyclopedia 2008).
Terdapat berbagai macam uji yang berkaitan dengan lipid yang meliputi analisis kualitatif maupun kuantitatif.
A. Uji kualitatif Lipid 1. Uji Kelarutan Lipid
Uji ini terdiri atas analisis kelarutan lipid maupun derivat lipid terdahap berbagai macam pelarut. Dalam uji ini, kelarutan lipid ditentukan oleh sifat kepolaran pelarut. Apabila lipid dilarutkan ke dalam pelarut polar maka hasilnya lipid tersbut tidak akan larut. Hal tersebut karena lipid memiliki sifat nonpolar sehingga hanya akan larut pada pelarut yang sama-sama nonpolar (Scy Tech
Encyclopedia 2008). 2. Uji Akrolein
Uji kualitatif lipid lainnya adalah uji akrolein. Dalam uji ini terjadi dehidrasi gliserol dalam bentuk bebas atau dalam lemak/minyak menghasilkan aldehid akrilat atau akrolein. Menurut Scy Tech Encyclopedia (2008), uji akrolein digunakan untuk menguji keberadaan gliserin atau lemak. Ketika lemak dipanaskan setelah ditambahkan agen pendehidrasi (KHSO4) yang akan menarik air, maka bagian gliserol akan terdehidrasi ke dalam bentuk aldehid tidak jenuh atau dikenal sebagai akrolein (CH2=CHCHO) yang memiliki bau seperti lemak terbakar dan ditandai dengan asap putih (Scy Tech Encyclopedia 2008).
3. Uji Ketidakjenuhan Lipid
Uji ketidakjenuhan digunakan untuk mengetahui asam lemak yang diuji apakah termasuk asam lemak jenuh atau tidak jenuh dengan menggunakan pereaksi Iod Hubl. Iod Hubl ini digunakan sebagai indikator perubahan. Asam lemak yang diuji ditambah kloroform sama banyaknya. Tabung dikocok sampai bahan larut. Setelah itu, tetes demi tetes pereaksi Iod Hubl dimasukkan ke dalam tabung sambil dikocok dan perubahan warna yang terjadi terhadap campuran diamati. Asam lemak jenuh dapat dibedakan dari asam lemak tidak jenuh dengan cara melihat strukturnya. Asam lemak tidak jenuh memiliki ikatan ganda pada gugus hidrokarbonnya. Reaksi positif ketidakjenuhan asam lemak ditandai dengan timbulnya warna merah ketika iod Hubl diteteskan ke asam lemak, lalu warna kembali lagi ke warna awal kuning bening. Warna merah yang kembali pudar menandakan bahwa terdapat banyak ikatan rangkap pada rantai hidrokarbon asam lemak (Scy Tech Encyclopedia 2008).
4. Uji Ketengikan
Uji kualitatif lipid lainnya adalah uji ketengikan. Dalam uji ini, diidentifikasi lipid mana yang sudah tengik dengan yang belum tengik yang disebabkan oleh oksidasi lipid. Minyak yang akan diuji dicampurkan dengan HCl. Selanjutnya, sebuah kertas saring dicelupkan ke larutan floroglusinol. Floroglusinol ini berfungsi sebagai penampak bercak. Setelah itu, kertas digantungkan di dalam erlenmeyer yang berisi minyak yang diuji. Serbuk CaCO3 dimasukkan ke dalam erlenmeyer dan segera ditutup. HCl yang ditambahkan akan menyumbangkan ion-ion hidrogennya yang dapat memecah unsur lemak sehingga terbentuk lemak radikal bebas dan hidrogen radikal bebas. Kedua bentuk radikal ini bersifat sangat reaktif dan pada tahap akhir oksidasi akan dihasilkan peroksida (Syamsu, 2007).
5. Uji Salkowski untuk kolesterol
Uji Salkowski merupakan uji kualitatif yang dilakukan untuk mengidentifikasi keberadaan kolesterol. Kolesterol dilarutkan dengan kloroform anhidrat lalu dengan volume yang sama ditambahkan asam sulfat. Asam sulfat berfungsi sebagai pemutus ikatan ester lipid. Apabila dalam sampel tersebut terdapat kolesterol, maka lapisan kolesterol di bagian atas menjadi berwarna merah dan asam sulfat terlihat berubah menjadi kuning dengan warna fluoresens hijau (Pramarsh, 2008).
6. Uji Lieberman Buchard
Uji Lieberman Buchard merupakan uji kuantitatif untuk kolesterol. Prinsip uji ini adalah
mengidentifikasi adanya kolesterol dengan penambahan asam sulfat ke dalam campuran. Sebanyak 10 tetes asam asetat dilarutkan ke dalam larutan kolesterol dan kloroform (dari percobaan
Salkowski). Setelah itu, asam sulfat pekat ditambahkan. Tabung dikocok perlahan dan dibiarkan beberapa menit. Mekanisme yang terjadi dalam uji ini adalah ketika asam sulfat ditambahkan ke dalam campuran yang berisi kolesterol, maka molekul air berpindah dari gugus C3 kolesterol,
kolesterol kemudian teroksidasi membentuk 3,5-kolestadiena. Produk ini dikonversi menjadi polimer yang mengandung kromofor yang menghasilkan warna hijau. Warna hijau ini menandakan hasil yang positif. Reaksi positif uji ini ditandai dengan adanya perubahan warna dari terbentuknya warna pink kemudian menjadi biru-ungu dan akhirnya menjadi hijau tua (WikiAnswers, 2008).
B. Uji Kuantitatif Lipid
Firestone dalam Schmidl dan Labuza (2000) dalam Fachri (2008) menyebutkan bahwa untuk
menganalisa kandungan lemak dalam makanan dapat dilakukan dengan cara volumetris, gravimetris, dan kromatografi. Kromatografi yang dapat dipakai seperti kromatografi gas (CG), kromatografi lapisan tipis (TLC), kromatografi ekslusi (SEC), kromatografi cairan (LC) dan kromatografi yang memiliki unjuk kerja baik seperti HP-SEC dan HPLC.
Kromatografi gas digunakan untuk melarutkan dan menghitung lipida seperti triasilgliserol dan turunan-turunan FAME. TLC sangat sesuai untuk memisahkan ester kolestrol, mono, di, triacylglycerols, asam lemak bebas, kolestrol, dan fospolipid. SEC dan HP-SEC digunakan untuk memisahkan produk hidrolitik, oksidasi dan pemanasan lemak. Sedangkan HPLC digunakan untuk memisahkan lipida non-volatil yang memiliki berat molekul tinggi.
Untuk menentukan kadar lemak total dalam makanan, the Nutrition and Labeling Education membutuhkan tahapan sebagai berikut, yaitu (1) hidrolisis dengan asam atau basa; (2) ekstraksi dengan eter ; dan (3) konversi asam lemak ke metil ester asam lemak (FAME) kemudian menghitung kadar FAME dengan kromatografi gas. Artiss dkk (1988) menentukan kandungan lipida dengan menggunakan TLC dan metode enzimatis. Enzim yang digunakan adalah enzim hidrolase, oxidase dan peroxidase dalam precursor chromogen. Metode ini sesuai untuk menentukan fospolipida hewan, jaringan tissue manusia dan fluida (Fachri 2008).
REFERENSI
Fachri AB. 2008. Lemak dan
minyak.http://boyarieffacgri.blogspot.com/the_nature_has_talked/Lemak_dan _minyak.htm. [Diakses 20 Mei 2010].
Lehninger AL. 1982. Dasar-Dasar Biokimia Jilid I. Maggy Thenawijaya, penerjemah. Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry.
Pramarsh. 2008. Test for cholesterol. [terhubung
berkala].http://www.planetayurveda.com/cholesterol_remedies. html. [Diakses 20 Mei 2010].. Scy Tech Encyclopedia. 2008. Acrolein test.http://www.answers.com/topic/acrolein_test. html. [Diakses 20 Mei 2010].
Scy Tech Encyclopedia. 2008. Lipid. [terhubung
berkala].http://www.answers.com/library/Sci%252DTech%20Encyclopedia-cid-47286. html.[Diakses 20 Mei 2010].
Syamsu JA. 2007. Penyimpanan pakan ternak: tinjauan proses kimiawi dari
mikrobiologi. http://jasmal.blogspot.com/2007_12_01_archive. html. [Diakses 20 Mei 2010]. WikiAnswers. 2008. What are the reaction involved in Lieberman Buchard
test.http://wiki.answers.com/Q/What_are_the_reaction involved_in_Lieberman_Buchard_test. html. [Diakses 20 Mei 2010].
Laporan Praktikum Ke-9 Hari/Tanggal : Kamis, 3 Mei 2012 Integrasi Proses Nutrisi Tempat Praktikum : Laboratorium Biokimia dan Mikrobiologi Nutrisi
Nama Asisten : Febynia Mutiara Z.
LEMAK DAN SPEKTROFOTOMETRI Yusuf Jafar Rizali
D14100064
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2012
PENDAHULUAN
Latar Belakang
Minyak dan lemak adalah senyawa kimia yang banyak terdapat di alam. Minyak umumnya berwujud cair pada suhu ruang sedangkan lemak cenderung berwujud padat pada suhu ruang. Asam-asam lemak merupakan komponen penyusun minyak dan lemak, dan asam lemak ini
merupakan senyawa rantai karbon. Dalam rantai karbon asam lemak tersebut, terdapat ikatan antar karbon yang berjenis tunggal maupun rangkap. Ikatan jenis tunggal pada rantai karbon memiliki kestabilan oksidatif yang lebih baik dibandingkan ikatan rangkap. Sebaliknya, ikatan rangkap memberikan sifat minyak yang cair pada suhu ruang. Jenis ikatan yang ada dalam asam lemak akan berpengaruh terhadap jenis aplikasi yang cocok digunakan terhadapnya. Secara keseluruhan, susunan trigliserida minyak dan lemak mempunyai kesamaan pada gliserol, maka perbedaan sifat-sifat minyak dan lemak dilihat pada komponen asam lemaknya.
Lemak merupakan sumber energi yang utama untuk proses metabolisme tubuh. Lemak yang
beredar di dalam tubuh diperoleh dari dua sumber yaitu dari makanan dan hasil produksi organ hati, yang bisa disimpan di dalam sel-sel lemak sebagai cadangan energi. Fungsi lemak adalah sebagai sumber energi, pelindung organ tubuh, pembentukan sel, sumber asam lemak esensial, alat angkut vitamin larut lemak, menghemat protein, memberi rasa kenyang dan kelezatan, sebagai pelumas, dan memelihara suhu tubuh. Sehubungan dengan hal tersebut maka sangat penting didalam menguji derajat kelarutan lemak sehingga dalam penggunaannya, lemak dapat berfungsi secara optimal.
Tujuan
Praktikum lemak bertujuan untuk mempelajari derajat kelarutan lemak nabati dan hewani di dalam berbagai jenis pelarut organik, sedangkan praktikum spektrofotometer bertujuan untuk menentukan kadar protein berdasarkan reaksi ninhidrin.
TINJAUAN PUSTAKA
Minyak dan Lemak
Lemak dan minyak adalah salah satu kelompok yang termasuk pada golongan lipid , yaitu senyawa organik yang terdapat di alam serta tidak larut dalam air, tetapi larut dalam pelarut organik non-polar, misalnya dietil eter (C2H5OC2H5), Kloroform (CHCl3), benzena dan hidrokarbon lainnya,
lemak dan minyak dapat larut dalam pelarut yang disebutkan di atas karena lemak dan minyak mempunyai polaritas yang sama dengan pelaut tersebut (Hart, 1983).
Kirshman dan Pomeroy (1949) in Klein (1971) mengatakan bahwa minyak sebagai komponen cair yang relative non-volatil. Minyak dapat diperoleh dari bahan yang mengandung minyak dengan cara pengepresan, dengan cara ekstraksi mengunakan berbagai zat pelarut yang mudah menguap (Ketaren, 1986).
Johnson dan Davenport (1971) mendefinisikan lemak sebagai suatu kelompok bahan yang secara umum larut dalam ether, chloroform atau pelarut yang lainnya. Minyak dan lemak mempunyai sifat tidak larut dalam air, hidrophobik dan terdapat pada tumbuhan hewan darat dan laut dan biasa disebut trigliserides (Marley, 1968 in Sonntag, 1979).
Protein Susu
Kandungan protein dalam susu sekitar 3,4%. Protein susu terbagi menjadi dua kelompok utama, yaitu casein yang dapat diendapkan oleh asam dan enzim rennin dan protein whey yang dapat mengalami denaturasi oleh panas. Casein merupakan protein utama susu yang jumlahnya mencapai 80% total protein susu. Pengasaman susu dapat mengendapkan casein. Bila terdapat cukup asam akan terjadi pengendapan disertai dengan melarutnya garam-garam kalsium dan fosfor yang semula terikat pada protein (Buckle et al., 1987).
Spektrofotometri
Alat yang digunakan untuk mengukur panjang gelombang absorpsi suatu larutan atau suatu molekul dalam larutan yaitu spektrofotometer. Absorbsi cahaya suatu molekul merupakan suatu bentuk interaksi antara gelombang cahaya (foton) dan molekul. Energi cahaya diserap oleh molekul dan digunaka oleh elektron di dalam molekul tersebut untuk bertransisi ke tingka eneri elektroik (E) yang lebih tiggi (Sentra Biosains Dinamika, 2001). Macam-macam spektrofotometer diantaranya spektrofotometer ultraungu (UV), sinar tampak, dan inframerah yang dibuat atas dasar yang sama. Sebuah sumber cahaya menghasilkan cahaya dari bagian spektrum elektromagnetik dar
spektrofotometer dengan panjang gelombang tertentu, tergantung pada strukturnya.
Gambar 1. Proses absorbsi cahaya dari spektrofotometer menembus cairan sampel
Pada spektrofotometer sinar tampak, molekul senyawa yang dianalisis tidak akan mengabsorbsi cahaya. Oleh karena itu, senyawa tersebut harus diikat untk suatu senyawa kimia sehingga menghasilkan warna senyawa berwarna tersebut akan mengabsorbsi cahaya pada rantai panjang
gelombang yang terbatas (Wilson dan Warker 2000). Metode pengukuran ini disebut sebagai dasar dari kolorimeri. Pelarut spektrofotometri yang dapat digunakan adalah semua cairan tertentu yang dapat diperoleh dalam bentuk mrni dalam daerah ukur 220 nm-800 nm serta yang tidak atau hanya sedikit meμnunjkkan absorbsi sendiri dan dapat melarutkan degan mudah senyawa yag hendak dianalisis. Letak maksimum absorbsi tergantung pada pelarut yang digunakan dan akan bergeser ke arah panjang gelombang yang lebih panjang dengan bertambahnya polaritas pelarut.
Minyak Sawit
Minyak kelapa sawit seperti umumnya minyak nabati lainnya adalah merupakan senyawa yang tidak larut dalam air, sedangkan komponen penyusunnya yang utama adalah trigliserida dan nontrigliserida (Nurhida Pasaribu, 2004). Minyak sawit adalah fraksi cair berwarna kuning
kemerahan yang diperoleh dengan cara fraksinasi minyak kelapa sawit kasar (Crude Palm Oil) dan telah mengalami proses pemurnian (Ketaren, 1986). Muchtadi (1996) menyatakan bahwa munyak sawit sebagai salah satu jenis minyak nabati tidak mengandung kolesterol, pada saat proses
pemurnian CPO menjadi minyak sawit kolesterol yang dimiliki CPO mengalami degradasi. Sterol yang dimiliki minyak sawit adalah fitosterol yang sebenarnya akan dapat menurunkan LDL (Low Density Lipoprotein) dan meningkatkan HDL (High Density Lipoprotein).
Minyak sawit merupakan sumber minyak nabati yang penting disamping minyak kelapa, kacang-kacangan, jagung dan sebagainya (Tim Perkembangan Ilmu Pengetahuan dan Teknologi, 1996). Minyak kelapa sawit memiliki kadar air 0,25% (Hardja, 2001).
Minyak Kedelai
Kandungan minyak dan komposisi asam lemak dalam kedelai dipengaruhi oleh varietas dan keadaan iklim tempat tumbuh. Lemak kasar terdiri dari trigliserida sebesar 90-95 persen, sedangkan sisanya adalah fosfatida, asam lemak bebas, sterol dan tokoferol. Minyak kedelai mempunyai kadar asam lemak jenuh sekitar 15% sehingga sangat baik sebagai pengganti lemak dan minyak yang memiliki kadar asam lemak jenuh yang tinggi seperti mentega dan lemak babi. Hal ini berarti minyak kedelai sama seperti minyak nabati lainnya yang bebas kolestrol (Admin, 2011). Titik cair yang dimiliki minyak kedelai sangat tinggi, yaitu sekitar -16oC dan biasanya berbentuk padat (solid) pada ruang yang mempunyai suhu tinggi. Hal ini berarti minyak kedelai dapat digunakan untuk biodiesel dan bahan bakar pada musim panas (summer fuel) ( Al Arif, 2011).
Hampir 90 persen dari produksi minyak kedelai digunakan di bidang pangan dan dalam bentuk telah dihidrogenasi, karena minyak kedelaimengandung lebih kurang 85 persen asam lemak tidak jenuh ( Al Arif, 2011).
Minyak kelapa adalah minyak yang dihasilkan dari daging kelapa segar yang berasal dari kelapa matang, yang diproses secara mekanis senatural mungkin sehinga tidak membuat minyak yang dihasilkan berubah. Menurut Codex Stan 19-1981 (rev. 2-1999), VCO mempunyai kadar air 0,1-0,5%, bilangan asam maksimal 13 mg KOH/g contoh, kadar asam lemak bebas maksimal 0,5% asam laurat, berwarna jernih kristal air, serta bebas dari bau dan rasa asing (tengik). VCO dapat
merangsang metabolisme. Komponen minyak kelapa ini terdiri dari asam lemak jenuh (90%) dan asam lemak tak jenuh (10%). Asam lemak jenuh berantai pendek pada VCO berperan positif dalam proses pembakaran nutrisi makanan menjadi energi (Fife, 2004).
Minyak yang mengandung asam lemak tak jenuh cenderung untuk mengalami oksidasi sedangkan yang mengandung lebih banyak asam lemak jenuh mudah terhidrolisis. Pembentukkan peroksida dipercepat oleh adanya cahaya, suasana asam, kelembapan udara, dan katalis (Widiyanti, 1995).
Lemak Ayam
Lemak hewan dicirikan dengan relatif tingginya kandungan kolesterol dan mengandung sedikit asam lemak tidak jenuh, lemak hewan merupakan salah satu potensi yaitu menyebabkan timbulnya penyakit. Tingginya konsumsi daging dan produk olahan daging dapat meningkatkan resiko terjadinya penyakit pada sistem sirkulasi darah. Lemak tubuh pada ayam broiler biasanya ditimbun dalam tiga bagian yaitu rongga abdomen terutama sekeliling tembolok yaitu beratnya sekitar 2%-2,5% dari bobot karkas bahkan dapat mencapai 5-6%, kedua pada kulit terutama pada pangkal bulu dan bagian belakang dekat pangkal ekor sehingga berat lemaknya dapat mencapai 12-20% dari berat karkas dan ketiga, pada organ tubuh lain (Natawihardja, 1981). Prosentase lemak abdomen pada ayam jantan berkisar antara 1,4-2,6% dari berat hidup, sedangkan untuk ayam betina antara 3,2-4,8% (Leeson dan Summer, 1980).
Lemak Sapi
Letak perlemakan pada ruminansia berbeda dengan lemak pada unggas. Ternak ruminansia yang masihmuda mempunyai kemampuan untuk mengkonversi gula menjadi asam-asam lemak, namun ketika rumen mulai berfungsi, kemampuan itu hilang dan asetat menjadi sumber karbon utama yang digunakan untuk mensintesis asam-asam lemak. Asetat akan berdifusi masuk ke dalam darah dari rumen dan dikonversi di jaringan menjadi asetil Co-A, dengan energi berasal dari hidrolisis ATP menjadi AMP. Jalur ini terjadi di tempat penyimpanan lemak tubuh yaitu jaringan adiposa (di bawah kulit, jantung dan ginjal). Hal tersebut juga yang terjadi di monogastrik (Despal et al., 2007).
Butir jagung mempunyai kadar minyak rata rata 3 %, tetapi jika diambil lembaganya saja, maka kadar minyak dalam lembaga itu rata rata antara 22 – 28%. Minyak jagung adalah ester dari glyserol dengan asam lemak, dimana semua radikal (OH) dari glyserol sudah di esterifikasi, karenanya disebut : Tri Glyserida Ester. Minyak jagung merupakan minyak yang kaya akan poly unsaturated fat, yaitu lemak tak jenuh yang justru aktif menurunkan kadar cholesterol dalam darah. Cholesterol adalah sterol yang terdapat dalam fat, dan bersifat dapat membuat kerak dalam
pembuluh darah, sehingga akan terjadi penyempitan dalam pembuluh darah tersebut akibatnya orang yang terkena akan menderita penyakit tekanan darah tinggi. Rumus molekul Cholesterol : C27 H46 O yang umumnya banyak terdapat dalam lemak hewan (Tedy, 2011).
Alkohol
Alkohol dapat mengeliminasi bakteri dengan mengkoagulasi protein. Alkohol mempunyai sifat mudah menguap. Alkohol menghilangkan lapisan lemak dan sebum kulit yang merupakan pelindung alami kulit terhadap infeksi bakteri (Lay dan Hastowo, 1992).
NaOH
NaOH disebut juga kaustik soda dengan sifat dapat membirukan lakmus merah. Larutannya dalam air menghasilkan ion yang bermuatan positif dan ion hidroksil yang bermuatan negatif. NaOH biasa digunakan sebagai pelarut. NaOH berguna untuk menetralkan asam, bahan baku pembuatan sabun, detergen, serat rayon, serta pemisah belerang dari minyak bumi. NaOH dari elektrolisis larutan NaCl merupakan basa kuat. NaOH sangat reaktif dalam bereaksi dengan larutan asam. (Fauzan, 2001).
Larutan Deterjen Cair
Detergen termasuk salah satu kebutuhan yang dapat diusahakan sendiri dalam
pembuatannya. Detergen cair mempunyai mutu atau kualitas yang dapat bersaing dengan detergen yang sudah ada saat ini, yaitu detergen bubuk. Metode pembuatan deterjen cair adalah mencampur 10 % SLS – DG, 20 % soda abu, CMC lokal 5 %, pewarna secukupnya dan air 64.5% ke dalam reactor, memanaskan campuran bahan diatas kemudian diaduk, setelah tercampur homogen api dimatikan, lalu didinginkan, setelah dingin ditambah parfum sebanyak 1 %, mengalirkan larutan ke bak filter, mengalirkan larutan ke bak penampung. Dari pembuatan deterjen cair yang telah dilakukan dapat diambil kesimpulan yaitu proses pembuatan deterjen cair itu mudah, Harganya murah dan lebih hemat dibandingkan dengan deterjen bubuk. Karakteristik deterjen cair adalah sebagai berikut yaitu Larutan agak kental, Jika belum digunakan tidak berbusa, jika digunakan busanya sedikit. Warnanya bening putih keruh jika tidak ditambahkan pewarna (Danang setiawan, M. Sidik, Farihah Isnayanti, M. Risal Al amin, Afif Ependi, 2008).
Asam Asetat
Asam asetat dikenal dengan sebutan asam cuka. Asam asetat berbentuk larutan yang berwarna putih bening. Konsentrasi asam asetat murni adalah 96% (Kurniawan, 1991). Asam asetat termasuk asam organik lemah berupa cairan tak berwarna dan berbau sangit. Ikatan hidrogen dalam asam asetat mampu mencegah ikatan H20 (Cuningham,1976). Asam asetat adalah zat pengatur keasaman pada produk pangan (BSN, 1995). Penambahan asam asetat memiliki tujuan untuk meningkatkan konsistensi, nilai gizi, cita rasa, mengendalikan keasaman, kebasaan, serta memantapkan bentuk dan rupa dari produk pangan (Winarno, 1982).
MATERI DAN METODE
Materi
Alat yang digunakan pada praktikum ini adalah tabung reaksi beserta rak, spektrofotometer, dan spoit. Sedangkan bahan yang digunakan adalah VCO, minyak canola, lemak rusa , minyak kedelai, lemak ayam, minyak sawit, lemak daging, minyak ikan, minyak zaitun, asam asetat,
kloroform, alkohol, campuran alkohol, NaOH, aquadest, larutan SDS, deterjen, sabun colek, larutan standar casein 10 mg/ml, susu skim, dan susu dancow.
Prosedur Uji Lemak
Disediakan 11 jenis pelarut, kemudian 11 pelarut tersebut dimasukkan ke dalam 11 tabung reaksi yang telah disediakan masing-masing sebanyak 1 ml. Lalu dimasukkan sebanyak 1 ml sampel (minyak atau lemak) ke dalam tabung reaksi yang telah berisi pelarut. Tabung yang telah berisi campuran dikocok 10x. Setelah itu, diamati kelarutan 11 jenis lemak tersebut.
Penggunaan Spektrofotometer dalam penentuan kadar protein Pembuatan larutan standar
Deret standar dibuat dengan cara memipet larutan standar casein sebanyak 0 ml, 2 ml, 4 ml, 6 ml, 8 ml, dan 10 ml ke dalam 6 buah tabung reaksi, kemudian dengan menggunakan aquadest volumenya dijadikan 10 ml. Masing- masing tabung dikocok sampai homogen. Sebanyak 5 ml dari masing-masing tabung dipipet ke dalam tabung reaksi yang lain. Masing-masing-masing ditambahkan sebanyak 4 ml larutan biuret 0,1%, Tabung reaksi didiamkan pada suhu ruang selama 30 menit. Serapan dibaca pada lamda 540 nm.
Pengujian sampel kuantitatif
Sebanyak 2,5 ml sampel susu murni dipipet ke dalam tabu takar 100 ml dan ditambahkan aquadest sampai tanda tera, selanjutnya dikocok hingga homogen. Larutan sampel dipipet sebanayk 10 ml ke dalam tabung reaksi lalu ditambahkan 4 ml larutan biuret, didiamkan pada suhu ruang selama 30
menit, dan serapannya dibaca pada ( 540 nm. Kadar protein sampel ditentukan dengan cara menggunakan hukum Lambert beer.
Pengujian sampel secara kuantitatif (Prosedur 1)
Sebanyak 1 ml larutan sampel protein (susu skim, susu murni, sari kedelai) dimasukan ke dalam tabung reaksi. Kemudian ditambahkan 2 ml larutan NaOH 2N. Selanjutnya 2 tetes larutan CuSO4 1 % ditambahkan melalui dinding tabung, dan dicampur hingga homogen. Semua prosedur ini dilakukan pada setiap sampel protein, selanjutnya warna cincin diamati, apakah berwarna merah jambu atau violet.
Pengujian sampel secara kualitatif (Prosedur 2)
Sedikit contoh dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 1 ml larutan NaOH 5 % dan 3 ml larutan alkohl 95 %. Air yang mendidih disiapkan untuk memanaskan larutan tersebut selama 1,5 menit. Selanjutnya larutan yang terbentuk dipisahkan menggunakan kertas saring, dan dimasukkan ke dalam tabung reaksi lainnya. Setelah itu didinginkan pada suhu ruangan, dan setelah cukup dingin ditambahkan 1 ml larutan NaOH 40 % dan 2 tetes larutan CuSO4 melalui dinding tabung reaksi. Warna violet yang terbentuk pada lapisan alkohol diamati, dan jika belum terbentuk lapisan ditambahlan larutan NaOH lagi.
HASIL DAN PEMBAHASAN
Hasil
Berdasarkan percobaan yang dilakukan, telah diperoleh hasil sebagai berikut. Tabel 1 Kelarutan Lemak dengan beberapa perlakuan
Jenis Lemak Pelarut Alkoho l Deterge n Sabu n Colek Asam Aseta t Aquade s SD S NaO H Hexa n Alkoho l 1 :NaOH Lemak Sapi +++ ++ ++ +++ +++ ++ +++ ++ +++ Lemak Ayam - + ++ _ _ _ _ +++ + Minya k Kelapa ++ ++ ++ _ _ ++ _ +++ + Minya k Kedela i + ++ ++ _ _ ++ _ +++ + Minya k Sawit + +++ +++ _ _ ++ + + +++ ++ Minya k Dedak Padi + +++ +++ _ _ ++ + + +++ ++ Minya k Jagung + ++ +++ _ _ ++ + _ +++ +++ Keterangan : (-) : tidak larut (+) : sedikit larut (++) : larut (+++) : sangat larut
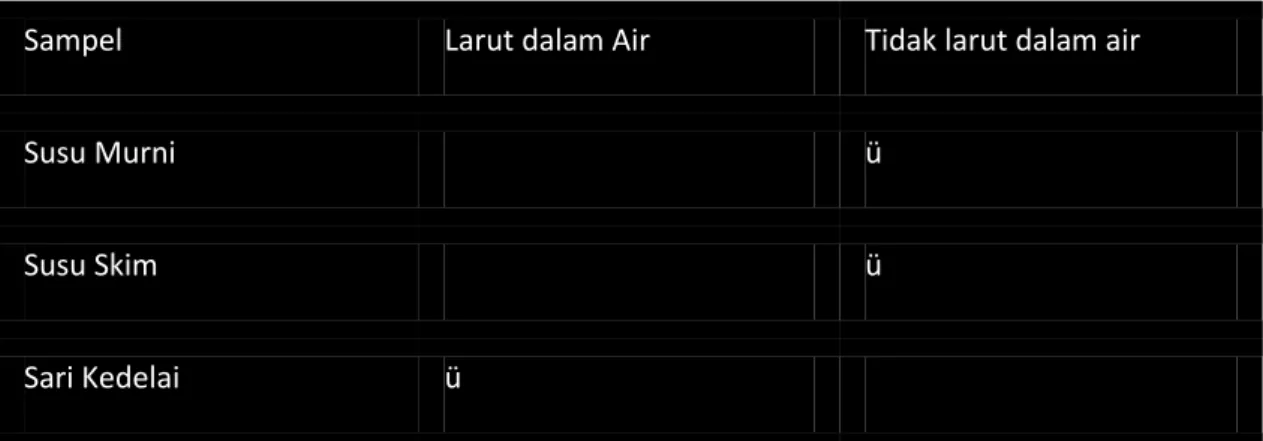
Tabel 2 Uji Sampel Kualitatif
Sampel Larut dalam Air Tidak larut dalam air
Susu Murni ü
Susu Skim ü
Sari Kedelai ü
Uji Sampel Kualitatif ( Prosedur 1) Susu Skim : +
Susu Murni : + Sari Kedelai : + Air : - Keterangan :
(-) : tidak ada protein (+) : ada protein
Uji protein menggunakan spektrofotometer 0 ml (blanko) : 0,1345 2 ml : 0,020 4 ml : 0,002 6 ml : 0,022 8 ml : 0,048 10 ml : 0,071 Susu skim : 0,429 Pembahasan
Lemak dan minyak adalah salah satu kelompok yang termasuk pada golongan lipid , yaitu senyawa organik yang terdapat di alam serta tidak larut dalam air, tetapi larut dalam pelarut organik non-polar, misalnya dietil eter (C2H5OC2H5), Kloroform (CHCl3), benzena dan hidrokarbon lainnya, lemak dan minyak dapat larut dalam pelarut yang disebutkan di atas karena lemak dan minyak mempunyai polaritas yang sama dengan pelaut tersebut (Hart, 1983).
Kirshman dan Pomeroy (1949) in Klein (1971) mengatakan bahwa minyak sebagai komponen cair yang relative non-volatil. Minyak dapat diperoleh dari bahan yang mengandung minyak dengan cara pengepresan, dengan cara ekstraksi mengunakan berbagai zat pelarut yang mudah menguap (Ketaren, 1986).
Johnson dan Davenport (1971) mendefinisikan lemak sebagai suatu kelompok bahan yang secara umum larut dalam ether, chloroform atau pelarut yang lainnya. Minyak dan lemak mempunyai sifat tidak larut dalam air, hidrophobik dan terdapat pada tumbuhan hewan darat dan laut dan biasa disebut trigliserides (Marley, 1968 in Sonntag, 1979).
Berdasarkan hasil yang diperoleh, dapat diketahui bahwa setiap pelarut mempunyai daya melarutkan yang berbeda-beda terhadap lemak-lemak yang diuji. Pelarut yang paling sulit
melarutkan lemak adalah asam asetat, aquadest, dan NaOH, sedangkan pelarut yang paling banyak dan paling mudah melarutkan lemak adalah hexan. Pada uji kualitatif juga terlihat bahwa lemak susu yang berasal dari hewan tidak mudah larut dalam air, sedangkan lemak susu yang berasal dari tumbuhan (kedelai) dapat larut dalam air. Hal tersebut menunjukkan bahwa lemak atau minyak tidak mudah untuk dilarutkan sehingga di dalam tubuh pun digunakan zat khusus untuk melarutkan lemak yang akan digunakan sebagai energi.
KESIMPULAN
Berdasarkan hasil yang diperoleh, dapat disimpulkan bahwa pelarut yang paling baik atau dapat melarutkan lemak dengan baik adalah Hexan. Cara kerja spektrofotometer adalah mengukur
konsentrasi suatu zat pada larutan dengan sistem pembacaan absorbansi larutan terhadap cahaya. Spektrofotometer dapat digunakan untuk menentukan kadar protein dalam susu.
DAFTAR PUSTAKA
Admin. 2011. Minyak kelapa dari dapur menuju industry. [terhubung
berkala]http://www.komplemen.com/minyak-kelapa-dari-dapur-menuju-industri-123.html (6 Mei 2012).
Al Arif. 2011. Manfaat Minyak Kelapa Murni (VCO, Virgin Coconut Oil). [terhubung berkala] .http://www.minyak-kelapa.com/artikel/pengertian.php (6 Mei 2012).
Buckle, 1987. Ilmu Pangan. UI Press, Jakarta
Despal et al. 2007. Pengantar Ilmu Nutrisi, Modul Kuliah NTP-231. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan-Institut Pertanian Bogor, Bogor.
Hardja, B. S. 2001. Studi pembuatan mentega coklat tiruan dan minyak sawit dengan proses interestifikasi enzimatik. Laporan Penelitian, Hibah Bersaing. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor.
Hart, Harold. 1983. Organic Chemistry, a Short Course, Sixth Edition, Michigan State University, Houghton Mifflin Co.
Ketaren, S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. 1st Edition. Universitas Indonesia. Jakarta.
Muchtadi, T. 1996. Peranan teknologi pangan dalam peningkatan nilai tambah produk minyak sawit Indonesia. Orasi Ilmiah. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor.
Pasaribu, Nurhida. 2004. Minyak Buah Kelapa Sawit. Makalah. Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Setiawan, Danang. M. Sidik, Farihah Isnayanti, M. Risal Al amin, Afif Ependi. 2008. Indusrti kecil sabun cair. Jurusan D III Teknik Kimia, Institut Teknologi 10 Nopember, Surabaya.
Tedy. 2011. Industri minyak jagung. [terhubung berkala] .
http://www.chem-is- try.org/materi_kimia/kimia-industri/teknologi-proses/pembuatan-biodiesel-dengan-katalis-biologis/ (6 Mei 2012).
LEMBAR PENGESAHAN
Satuan cara I (Uji Lemak/ minyak) pada praktikum mata kuliah biokimia dilakukan pada hari : Rabu
tanggal : 20 Mei 2009
waktu : 15.30 WIB s.d 18.00 WIB
tempat : Laboratorium Pragram Studi Ilmu Kelautan kampus FPIK Universitas Diponegoro Jl. Prof. Sudarto, SH. Tembalang Semarang.
BAB I
PENDAHULUAN Latar Belakang
Perkembangan ilmu pengetahua dan teknologi yang telah menjerat kepada seluruh komponen sisi keberlangsungan hidup manusia tidak bisa masuk begitu saja. Dibutuhkan komitmen bersama baik pemereintah sebagai wadah penggerak utama maupun komponen masarakat yang secara langsung berhadapan untuk dapat menguasai dan memanfaatkannya. Sehingga didapat hasil yang berkesinambungan antara perkembangan ilmu pengetahuan, penemuan teknologi baru dengan daya guna yangbisa dipakai oleh masyarakat.
Atas dasar komitmen tersebut maka tidak bisa dipungkiri keberadaaan seoarang mahasiswa khususnya mahasiswa Ilmu kelautan dituntut harus memiliki dayan guna baik dalam
menciptakan keilmuan dan teknologi terbaru maupun memanfaakan keilmuan dan teknologi yang sudah ada yang bisa diterapkan di lingkungan masarakat dalam cakupan kecilnya dan bangsa dalam cakupan besarnya.
Untuk mencapai komitmen tersebut di atas, maka langkah awal yang bisa dilakukan oleh seorang mahasiswa ilmu Kelautan adalah dengan mempelajari konsep keilmuan yang berkaitan erat dengan Progran Strudi Ilmu kelautan salah satunya adalah dengan melakukan satuan acara praktikum pada mata kuliah Biokimia dengan sub bahasan yang diparktikumkan adalah “ Uji Lemak / Minyak, dan Ektrasi Alginat Pada Rumpu Laut”.
Maksud dan Tujuan
Setelah melakukan praktikum Biokimia serta dengan menyusun laporan hasil praktikum diharapkan mahasiswa Ilmu Kelautan mampu :
menentukan bilangan penyabunan. menentukan asam lemak.
BAB II
TINJAUAN PUSTAKA
2.1. Pengertian Lemak/ Minyak
Lipid (dari kata yunani Lipos. Lemak) merupakan penyusun tumbuhan atau hewan yang dicerikan oleh sifat kelarutannya. Terutama lipid tidak bisa larut dalam air, tetapi larut dalam larutan non polar seperti eter.
(Hart, 2003)
Lemak atau minyak ialah triester dari gliserol dan disebut trigliserida. Bila minyak atau lemak dididihkan dengan alkali, kemudian mengasamkan larutan yang dihasilakan, maka akan didapatkan gliserol dan campuran asam lemak. Reaksi ini disebut penyabunan.
(Hart, 2003)
Lemak/minyak merupakan asam karboksilat/asam alkanoat jenuh alifatis (tidak terdapat ikatan rangkap C=C dalam rantai alkilnya, rantai lurus, panjang tak bercabang) dengan gugus utama – COOH dalam bentuk ester/gliserida yaitu sesuatu jenis asam lemak atau beberapa jenis asam lemak dengan gliserol suku tinggi.
(smk3ae.wordpress.com /23/05/09)
Lemak/ minyak ialah trigliserida, yaitu trimester dari dliserol. Asam lemak ialah asam yang diperoleh dari proses penyabunan lemak/ minyak.
(Hart, 2003)
Minyak / lemak merupakan lipida yang banyak terdapat di alam. Minyak merupakan senyawa turunan ester dari gliserol dan asam lemak. Struktur umumnya adalah :
CH2-O-C-R1 CH-O–C–R2 CH2–O–C–R3
R1,R2, R3 adalah gugus alkil mungkin saja sama atau juga beda. Gugus alkil tersebut
dibedakan sebagai gugus alkil jenuh (tidak terdapat ikanatanrangkap) dan tidak jenuh (terdapat ikan rangkap).
(Hart, 2003)
Lemak adalah suatu gliserida dan merupakan suatu ester. Apabila ester ini bereaksi dengan basa maka akan terjadi saponifikasi yaitu proses terbentuknya sabun dengan residu gliserol. Sabun dalam air akan bersifat basa. Sabun ( R COONa atau R COOK ) mempunyai bagian yang bersifat hidrofil (- COO -) dan bagian yang bersifat hidrofob (R – atau alkil). Bagian karboksil menuju air dan menghasilkan buih (kecuali pada air sadah), sedangkan alkil (R -) menjauhi air
dan membelah molekul atau kotoran (flok) menjadi partikel yang lebih kecil sehingga air mudah membentuk emulsi atau suatu lapisan film dengan kotoran. Air adalah senyawa polar sedangkan minyak adalah senyawa non polar, jadi keduanya sukar bercampur oleh karena itu emulsinya mudah pecah. Untuk memantapkan suatu emulsi perlu ditambahkan suatu zat emulgator atau zat pemantap, antara lain ;
1. Ca Butirat, Ethanol.
2. Senyawa pembentuk sel liofil,protein, gum, dan gelatin.
3. Garam Fe, BaOH, SO4, Fe(OH)SO4, PbSO4, Fe2O3, Tanah liat, CaCO3, dll. (smk3ae.wordpress.com /23/05/09)
Asam lemak tidak lain adalah asam alkanoat atau asam karboksilat berderajat tinggi (rantai C lebih dari 6). Karena berguna dalam mengenal ciri-cirinya, asam lemak dibedakan menjadi asam lemak jenuh dan asam lemak tak jenuh. Asam lemak jenuh hanya memiliki ikatan tunggal di antara atom-atom karbon penyusunnya, sementara asam lemak tak jenuh memiliki paling sedikit satu ikatan ganda di antara atom-atom karbon penyusunnya.
(Wikipedia Indonesia /23/05/09)
Asam lemak, bersama-sama dengan gliserol, merupakan penyusun utama minyak nabati atau lemak dan merupakan bahan baku untuk semua lipida pada makhluk hidup. Asam ini mudah dijumpai dalam minyak masak (goreng), margarin, atau lemak hewan dan menentukan nilai gizinya. Secara alami, asam lemak bisa berbentuk bebas (karena lemak yang terhidrolisis) maupun terikat sebagai gliserida.
(Wikipedia Indonesia /23/05/09) 2.2. Sifat Lemak/ Minyak
Asam lemak merupakan asam lemah, dan dalam air terdisosiasi sebagian. Umumnya berfase cair atau padat pada suhu ruang (27° Celsius). Semakin panjang rantai C penyusunnya, semakin mudah membeku dan juga semakin sukar larut.
Asam lemak jenuh bersifat lebih stabil (tidak mudah bereaksi) daripada asam lemak tak jenuh. Ikatan ganda pada asam lemak tak jenuh mudah bereaksi dengan oksigen (mudah teroksidasi). Karena itu, dikenal istilah bilangan oksidasi bagi asam lemak.
Keberadaan ikatan ganda pada asam lemak tak jenuh menjadikannya memiliki dua bentuk: cis dan trans. Semua asam lemak nabati alami hanya memiliki bentuk cis (dilambangkan dengan "Z", singkatan dari bahasa Jerman zusammen). Asam lemak bentuk trans (trans fatty acid, dilambangkan dengan "E", singkatan dari bahasa Jerman entgegen) hanya diproduksi oleh sisa metabolisme hewan atau dibuat secara sintetis. Akibat polarisasi atom H, asam lemak cis memiliki rantai yang melengkung. Asam lemak trans karena atom H-nya berseberangan tidak mengalami efek polarisasi yang kuat dan rantainya tetap relatif lurus.
Ketengikan (Ingg. rancidity) terjadi karena asam lemak pada suhu ruang dirombak akibat
hidrolisis atau oksidasi menjadi hidrokarbon, alkanal, atau keton, serta sedikit epoksi dan alkohol (alkanol). Bau yang kurang sedap muncul akibat campuran dari berbagai produk ini.
(Wikipedia Indonesia /23/05/09) 2.3 . Penamaan Asam Lemak