2. TINJAUAN PUSTAKA
3.1. Keadaan Umum Lokasi Penelitian
Secara umum, musim penghujan di Kepulauan Seribu mulai terjadi pada bulan November hingga April dengan 10-20 hari hujan per bulan. Bulan Januari merupakan bulan dengan curah hujan terbesar. Musim kemarau terjadi pada bulan Mei hingga Oktober dengan 4-10 hari hujan per bulan dan bulan Agustus merupakan bulan terkering. Musim pancaroba terjadi antara bulan April-Mei dan bulan Oktober-November (Dinas Hidro-Oseanografi 1986 in Pratama 2005).
Pada Kepulauan Seribu berhembus dua jenis musim, yaitu musim angin barat dan musim angin timur. Pada bulan Desember hingga Maret angin barat berhembus dengan arah berkisar antara Barat Daya hingga Barat Laut. Kecepatan angin berhembus rata-rata 7-20 knot, dimana pada bulan Desember hingga Februari kecepatan angin dapat melebihi 20 knot. Pada musim timur, berhembus angin timur mulai bulan Juni hingga September dengan kecepatan 7-15 knot. Angin berhembus dengan arah berkisar antara Timur Laut dan Tenggara. Untuk musim pancaroba mulai terjadi antara bulan April sampai bulan Mei dan bulan Oktober sampai November (Dinas Hidro-Oseanografi 1986 in Pratama 2005).
3.2. Makrozoobentos
Organisme bentos merupakan organisme yang melekat atau menetap pada dasar atau hidup di dasar endapan. Bentos meliputi organisme nabati (fitobentos) dan organisme hewani (zoobentos). Organisme bentos dapat dibagi berdasarkan cara makannya menjadi suspension feeder dan deposit feeder (Odum 1993).
Bentos laut ditandai oleh jumlah sessile yang sangat banyak, atau organisme yang secara relatif tidak aktif yang memperagakan ciri zonasi di kawasan pantai. Dalam keadaaan ekstrim pada atau di atas garis pasang naik, organisme pasti sanggup menahan kekeringan dan perubahan temperatur, karena hanya sebentar saja tertutup atau tersiram air. Sebaliknya pada kawasan bawah pasang surut (subtidal), oganisme selalu tertutup air (Odum 1993).
Berdasarkan tempat hidupnya, bentos dapat dibagi menjadi dua, yaitu epifauna, jenis bentos yang hidup di permukaan dasar laut, baik yang hidup melekat,
merangkak ataupun merayap di permukaan dasar laut. Jenis bentos lainnya adalah infauna, yaitu bentos yang membenamkan diri dalam dasar laut atau menggali lubang dalam dasar laut (Nybakken 1988).
Menurut McIntyre (1978) in McLusky dan McIntyre (1988), mengklasifikasikan bentos berdasarkan ukuran saringan yang terangkum pada Tabel 1.
Tabel 1. Klasifikasi bentos berdasarkan ukuran saringan (sieve size) (McIntyre 1978 in McLusky dan McIntyre 1988).
Kategori Ukuran
Mikrobentos Melewati ukuran saringan terkecil
Meiobentos Melewati ukuran saringan 0,5 sampai 1,0 mm Makrobentos Tersaring pada ukuran saringan 0,5 sampai 1,0 mm
Menurut Nybakken (1988) kelompok organisme dominan yang menyusun makrofauna di dasar lunak sublitoral terbagi dalam empat kelompok taksonomi; filum Annelida, filum Arthropoda, filum Ekinodermata, dan filum Moluska. Cacing polychaeta (filum Annelida) banyak terdapat sebagai spesies pembentuk tabung dan penggali. Krustasea yang dominan adalah ostrakoda, ampipoda, isopoda, dan dekapoda (Hemminga dan Duarte 2000). Umumnya mereka menghuni permukaan pasir dan lumpur. Moluska biasanya terdiri dari berbagai spesies bivalvia penggali dengan beberapa gastropoda di permukaan. Ekinodermata biasanya sebagai bentos subtidal, terutama terdiri dari bintang laut dan ekinoid (bulu babi dan dollar pasir).
Menurut Mac Arthur (1960) in Nybakken (1988) dikenal dua pola daur hidup organisme yang agak berbeda pada habitat manapun juga. Tipe yang pertama disebut Oportunistik, dimana spesies ini memiliki ciri masa hidup yang pendek, perkembangan yang cepat untuk bereproduksi sehingga terdapat banyak periode reproduksi per tahun, larva terdapat hampir atau sepanjang tahun di perairan, dan angka kematiannya yang tinggi. Biasanya mereka merupakan hewan kecil dan sering menetap atau sessile. Tipe yang kedua yaitu Ekuilibrium dengan ciri daur hidup yang panjang, perkembangan mencapai dewasa yang relatif lama, terdapat satu atau lebih periode reproduksi per tahun dan angka kematiannya rendah. Biasanya ukuran spesies ini lebih besar dari spesies Oportunistik dan sering aktif bergerak.
Zoobentos membantu mempercepat proses dekomposisi materi organik. Hewan bentos terutama yang bersifat herbivor dan detritivor dapat menghancurkan makrofita akuatik yang hidup maupun yang mati dan serasah yang masuk ke dalam perairan menjadi potongan-potongan yang lebih kecil, sehingga mempermudah mikroba untuk menguraikannya menjadi nutrien bagi produsen perairan (Nybakken 1988).
3.3. Komunitas Makrozoobentos
Komunitas adalah kumpulan populasi yang hidup pada suatu lingkungan tertentu atau habitat fisik tertentu yang saling berinteraksi dan secara bersama-sama membentuk trofik (Odum 1993). Struktur komunitas memiliki lima tipologi atau karakteristik yang dapat diukur atau dipelajari yaitu keanekaragaman spesies, dominansi, bentuk dan struktur pertumbuhan, kelimpahan relatif, serta struktur trofik (Krebs 1989 in Odum 1993).
Organisme bentos memiliki beberapa peranan di dalam komunitas perairan meliputi kemampuannya mendaur ulang bahan organik yang masuk dari luar, membantu proses mineralisasi, dan kedudukannya penting dalam berbagai posisi penting dalam rantai makanan (Lind 1979 in Fahliza 2007). Menurut APHA (1976), respon komunitas makrozoobentos secara umum disebabkan oleh masukan bahan organik, bahan kimia beracun dan perubahan substrat dasar. Hubungan antara perubahan lingkungan dengan kestabilan suatu komunitas makrozoobentos dapat dianalisa secara kuantitatif maupun kualitatif. Analisa kuantitatif dilakukan dengan melihat keanekaragaman jenis organisme yang hidup di lingkungan tersebut dan hubungannya dengan kelimpahan tiap jenisnya. Analisa kualitatif adalah dengan melihat jenis-jenis organisme yang mampu beradaptasi pada lingkungan tertentu.
3.4. Lamun
Lamun (seagrasses) adalah tumbuhan berbunga (Angiospermae) yang tumbuh mencolok dan sering merupakan komponen utama yang dominan di lingkungan pesisir (Kuo dan McComb 1989 in Tomascik et al. 1997).
Tumbuhan ini mempunyai beberapa sifat yang memungkinkannya hidup di lingkungan laut, yaitu (1) mampu hidup di media air asin, (2) mampu berfungsi
normal dalam keadaan terbenam, (3) mempunyai sistem perakaran jangkar yang berkembang baik, (4) mampu melaksanakan penyerbukan dan daur generatif dalam keadaan terbenam (Den Hartog 1970 in Irawan 2003). Selain itu, lamun juga memiliki sistem internal untuk transportasi gas dan nutrien (Fortes 1990).
Lamun di Indonesia terdiri dari 7 marga (genera) lamun. Tiga diantaranya (Enhalus, Thalassia, dan Halophila) termasuk suku Hydrocaritaceae, sedangkan empat marga lainnya (Halodule, Cymodoceae, Syringodium, dan Thalassodendron) termasuk suku Pomatogetonaceae (Nontji 1987). Zonasi sebaran dan karakteristik lamun di perairan pesisir Indonesia dapat dikelompokkan menurut (1) genangan air dan kedalaman; (2) kualitas air; (3) komposisi jenis; (4) tipe substrat; (5) asosiasi dengan sistem lain (seperti terumbu karang, mangrove, dan estuaria) (Dahuri 2003).
Dari 20 jenis lamun yang dijumpai di perairan Asia tenggara, hanya 13 jenis lamun yang umum dijumpai di perairan Indonesia, yaitu Cymodocea serrulata, C. rotundata, Enhalus acoroides, Halodule uninervis, H. pinifolia, Halophila minor, H. ovalis, H. decipiens, H. spinulosa, H. beccari, Thalassia hemprichii, Syringodium isoetifolium, dan Thalassodendron ciliatum (Den Hartog 1970 in Irawan 2003; Kiswara 2009). Penyebaran lamun di Indonesia mencakup perairan Jawa, Sumatera, Bali, Kalimantan, Sulawesi, Maluku, Nusa Tenggara, Papua.
Komunitas lamun yang dijumpai di alam sering berasosiasi dengan flora dan fauna akuatik lainnya, seperti algae, meiofauna, moluska, ekinodermata, krustasea, dan berbagai jenis ikan. Asosiasi tersebut membentuk suatu ekosistem yang kompleks yaitu ekosistem lamun.
Ekosistem lamun berfungsi sebagai penyuplai energi baik pada zona bentik maupun pada zona pelagis dalam bentuk rantai makanan. Detritus daun lamun yang tua didekomposisi oleh sekumpulan jasad bentik (seperti teripang, kerang, kepiting, dan bakteri), sehingga dihasilkan bahan organik baik yang tersuspensi maupun yang terlarut dalam bentuk nutrien. Nutrien tersebut tidak hanya bermanfaat bagi tumbuhan lamun, tetapi juga bermanfaat untuk pertumbuhan fitoplankton dan selanjutnya zooplankton, dan juvenile ikan/udang, dapat dilihat pada Gambar 2.
Dalam suatu komunitas lamun, 1 are (1.000 m2) lamun dapat menghasilkan lebih dari 10 ton daunnya per tahun. Biomassa ini dapat menyediakan makanan, tempat hidup, dan daerah pemijahan untuk puluhan ribu vertebrata maupun invertebrate, baik juvenile maupun dewasa (Mukhida 2007 in Kiswara 2009).
Gambar 2. Rantai makanan di ekosistem lamun (Fortes 1990)
Secara ekologis padang lamun mempunyai beberapa fungsi penting bagi wilayah pesisir dan laut, yaitu:
1. Lamun berperan sebagai produsen primer.
Lamun memfiksasi sejumlah karbon organik dan sebagian besar memasuki rantai makanan, baik melalui pemangsaan langsung oleh herbivora maupun melalui dekomposisi sebagai serasah. Lamun juga memberikan sumbangan terhadap produktivitas terumbu karang. Serasah yang diproduksi oleh lamun dapat membantu meningkatkan kelimpahan fitoplankton dan zooplankton di perairan terumbu karang sehingga energi yang diambil lamun akan dialihkan ke ekosistem terumbu karang (Azkab 2006).
2. Lamun sebagai penangkap sedimen.
Lamun dapat mengikat sedimen dan menstabilkan substrat lunak dengan sistem perakaran yang padat dan saling menyilang. Daun lamun yang lebat akan memperlambat aliran air yang disebabkan oleh arus dan ombak, sehingga perairan di sekitarnya menjadi tenang. Disamping itu, rizhome dan akar lamun dapat menahan serta mengikat sedimen, sehingga dapat menguatkan dan menstabilkan dasar perairan (Bengen 2001).
3. Lamun sebagai habitat biota.
Lamun berperan sebagai tempat berlindung, mencari makan, tumbuh besar, dan memijah bagi beberapa jenis biota laut. Beberapa organisme hanya menghabiskan sebagian dari siklus hidupnya di padang lamun dan beberapa dari mereka adalah ikan dan udang yang mempunyai nilai ekonomis penting. Lamun dapat dimakan langsung oleh organisme avertebrata seperti bulu babi serta berbagai jenis ikan dari famili Scaridae dan Acanthuridae. Selain itu lamun juga dapat dimakan oleh penyu dan duyung (Azkab 2006).
4. Lamun berperan sebagai tudung pelindung yang melindungi penghuni padang lamun dari sengatan matahari (Azkab 2000).
5. Lamun memegang peranan yang berarti dalam daur berbagai zat hara dan elemen-elemen langka di lingkungan bahari (Azkab 2000).
6. Lamun sebagai makanan dan kebutuhan lain.
Selain peranan-peranan lamun yang telah dibahas di atas juga masih ada beberapa hal yang tidak kalah penting khususnya lamun sebagai makanan, baik makanan hewan maupun manusia, serta kegunaan lain seperti sebagai bahan baku dalam pembuatan kertas (Azkab 2000).
7. Lamun dapat menjadi objek wisata bahari dan wisata pendidikan.
3.5. Parameter Fisika dan Kimia Air
Kondisi perairan dapat diketahui, salah satunya melalui pengukuran parameter fisika dan kimia air, antara lain djelaskan sebagai berikut:
3.5.1. Suhu
Cahaya matahari yang masuk ke dalam perairan akan mengalami penyerapan dan perubahan menjadi energi panas. Proses penyerapan cahaya ini berlangsung secara lebih intensif pada lapisan atas sehingga lapisan atas perairan memiliki suhu yang lebih tinggi (lebih panas) dan densitas yang lebih kecil daripada lapisan bawah (Effendi 2003).
Suhu perairan merupakan salah satu faktor yang sangat penting dalam mengatur proses kehidupan dan penyebaran organisme dalam suatu perairan. Pada umumnya peningkatan suhu air sampai skala tertentu akan mempercepat
perkembangbiakan organisme perairan. Perubahan suhu dapat menjadi isyarat bagi organisme untuk memulai atau mengakhiri berbagai aktifitas, misalnya reproduksi (Nybakken 1988).
Peningkatan suhu mengakibatkan peningkatan viskositas, reaksi kimia, evaporasi, dan volatilisasi. Selain itu, peningkatan suhu juga menyebabkan peningkatan kecepatan metabolisme dan respirasi organisme air, dan selanjutnya mengakibatkan peningkatan konsumsi oksigen. Peningkatan suhu perairan sebesar 100 C menyebabkan terjadinya peningkatan konsumsi oksigen oleh organisme akuatik sekitar 2-3 kali lipat. Namun, peningkatan suhu ini disertai dengan penurunan kadar oksigen terlarut sehingga keberadaan oksigen seringkali tidak memenuhi kebutuhan oksigen bagi organisme akuatik untuk melakukan proses metabolisme dan respirasi (Effendi 2003).
3.5.2. Arus
Arus merupakan gerakan mengalir suatu masa air yang dapat disebabkan oleh tiupan angin, perbedaan densitas air laut atau dapat pula disebabkan oleh gerakan periodik jangka panjang. Arus yang disebabkan oleh gerakan periodik jangka panjang ini antara lain arus yang disebabkan oleh pasang surut (pasut) (Nontji 1987).
Arus merupakan faktor fisika perairan yang paling mempengaruhi zona intertidal. Keberadaan arus memperluas zona intertidal, mempengaruhi sebaran dan jenis organisme yang dapat ditemukan (Webber dan Thurman 1991).Kecepatan arus perairan berpengaruh pada produktivitas padang lamun. Turtle grass dapat menghasilkan hasil tetap (standing crop) maksimal pada kecepatan arus 0,5 m/det (Dahuri et al.1996).
2.5.3. Kecerahan
Kecerahan perairan menunjukkan kemampuan cahaya untuk menembus lapisan air pada kedalaman tertentu. Pada perairan alami, kecerahan sangat penting karena erat kaitannya dengan proses fotosintesis. Semakin tinggi nilai kecerahan, maka semakin tinggi pula tingkat penetrasi cahaya ke kolom perairan. Penetrasi cahaya matahari atau kecerahan sangat penting sekali bagi tumbuhan lamun. Hal ini
terlihat dari sebaran lamun yang terbatas pada daerah yang masih menerima cahaya matahari (Supriharyono 2009).
2.5.4. Salinitas
Salinitas adalah konsentrasi total ion yang terdapat di perairan (Boyd 1988 in Effendi 2003). Salinitas menggambarkan padatan total di dalam air, setelah semua karbonat dikonversi menjadi oksida, semua bromide dan iodide digantikan oleh klorida, dan semua bahan organik telah dioksidasi (Effendi 2003).
Menurut Nybakken (1988), salinitas mempunyai peranan yang penting dalam kehidupan organisme, misalnya dalam ditribusi biota akuatik. Salinitas merupakan salah satu besaran yang berperan dalam lingkungan ekologi laut.
2.5.5. Derajat Keasaman (pH)
Sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai nilai ph sekitar 7-8,5. Nilai pH sangat mempengaruhi proses biokimiawi perairan, misalnya proses nitrifikasi akan berakhir jika pH rendah (Effendi 2003).
Sedangkan menurut Nybakken (1988) lingkungan perairan laut memiliki pH yang bersifat relatif stabil dan berada dalam kisaran yang sempit, biasanya berkisar antara 7,5-8,4.
2.5.6. Oksigen Terlarut (Dissolved Oxygen)
Kadar oksigen terlarut di perairan dipengaruhi oleh suhu, salinitas, dan turbulensi air. Kadar oksigen terlarut berkurang dengan semakin meningkatnya suhu, ketinggian (altitude) dan berkurangnya tekanan atmosfer (Effendi 2003).
Kelarutan oksigen penting artinya dalam mempengaruhi keseimbangan komunitas dan kehidupan organisme perairan. Selain itu kandungan oksigen terlarut mempengaruhi keanekaragaman organisme suatu ekosistem perairan. Menurut Effendi (2003) perairan yang diperuntukkan bagi kepentingan perikanan sebaiknya memiliki kadar oksigen tidak kurang dari 5 mg/l. Kadar oksigen terlarut kurang dari 4 mg/l mengakibatkan efek yang kurang menguntungkan bagi semua organisme akuatik.
atmosfer sekitar 35% dan aktivitas fotosintesis oleh tumbuhan air dan fitoplankton (Novonty dan Olem 1994 in Effendi 2003).
2.5.7. Nutrien (Nitrat dan Ortofosfat)
Nutrien atau senyawa inorganik esensial terlarut berperan dalam fungsi metabolik biota laut, terutama untuk kehidupan dan pertumbuhan produktivitas primer (Sanusi 2006). Beberapa nutrien yang penting dalam perairan laut adalah nitrogen dan fosfor.
Nitrogen dalam perairan laut berasal dari beberapa sumber, antara lain : hasil difusi dari atmosfir melalui permukaan perairan, hasil fiksasi, hasil degradasi bahan organik, dan buangan limbah organik dari aktivitas manusia. Distribusi nitrogen dalam laut dipengaruh oleh : proses fotosintesis, gerakan massa air (adveksi-difusi), dan gerakan gravitasi residu organisme air (Sanusi 2006).
Nitrat dan amonium adalah sumber utama nitrogen di perairan. Namun, amonium lebih disukai oleh tumbuhan. Kadar nitrat di perairan yang tidak tercemar biasanya lebih tinggi daripada kadar amonium. Kadar nitrat-nitrogen pada perairan alami hampir tidak pernah lebih dari 0.1 mg/liter (Effendi 2003).
Di perairan, unsur fosfor tidak ditemukan dalam bentuk bebas sebagai elemen, melainkan dalam bentuk senyawa anorganik yang terlarut (ortofosfat dan polifosfat) dan senyawa organik yang berupa partikulat. Ortofosfat merupakan bentuk fosfor yang dapat dimanfaatkan secara langsung oleh tumbuhan akuatik, sedangkan polifosfat harus mengalami hidrolisis membentuk ortofosfat terlebih dahulu, sebelum dapat dimanfaatkan sebagai sumber fosfor (Effendi 2003).
Sumber utama fosfat terutama berasal dari daratan, yaitu melalui pelapukan batuan (aloton) yang masuk ke laut terutama melalui transportasi sungai. Selain itu, buangan limbah organik seperti deterjen yang masuk ke laut atau perairan estuari akan memberikan sumbangan fosfat dalam bentuk polifosfat (Sanusi 2006).
Dalam perairan laut yang normal, rasio N/P adalah sebesar 15:1. Rasio N/P yang meningkat (~ 17:1) potensial menimbulkan blooming atau eutrofikasi perairan, dimana terjadi pertumbuhan fitoplankton yang tidak terkendali (Sanusi 2006).
2.6. Sedimen
Sedimen terutama terdiri dari partikel-partikel yang berasal dari hasil pembongkaran batu-batuan dan potongan-potongan kulit (shell) serta sisa-sisa rangka dari organisme laut. Sebagian besar dasar laut yang dalam ditutupi oleh jenis partikel yang berukuran kecil yang terdiri dari sedimen halus, sedangkan hampir semua pantai ditutupi oleh partikel yang berukuran besar yang terdiri dari sedimen kasar (Hutabarat dan Evans 1984). Jenis-jenis partikel tersebut sangat menentukan jenis hewan bentos yang mendiami sedimen tersebut sebagai habitatnya, seperti untuk jenis sedimen pebbles (kerikil)dan granules (butiran)setidaknya akan ditemui hewan-hewan gastropoda. Sedangkan untuk jenis sedimen sand (pasir) akan ditemui hewan kerang-kerangan (bivalvia) dan untuk jenis sedimen silt (lumpur) biasanya dapat ditemukan cacing. Hal tersebut masih sebagai kemungkinan, sedang kenyataannya masih dipengaruhi oleh faktor lain, misalnya tingkat kesuburan, ada tidaknya pencemaran sekunder yang dialami oleh sedimen, kecepatan arus dan sebagainya (Wibisono 2005).
Bentos yang dominan hidup di substrat berlumpur tergolong dalam suspension feeders (penyaring suspensi sebagai sumber makanan). Diantara yang umum ditemukan adalah kelompok polychaeta, bivalvia, krustasea, ekinodermata, dan bakteri. Disamping itu juga ditemukan gastropoda dengan indeks keanekaragaman yang rendah serta lamun yang berperan meningkatkan kehadiran bentos (Nybakken 1988).
Adapun substrat berpasir umumnya miskin akan organisme, tidak dihuni oleh kehidupan makroskopik, selain itu kebanyakan bentos pada pantai berpasir mengubur diri dalam substrat. Produksi primer pantai berpasir rendah, meskipun kadang-kadang dijumpai populasi diatom yang hidup di pasir intertidal. Pantai berpasir tidak menyediakan substrat yang tetap untuk melekat bagi organisme, karena aksi gelombang secara terus-menerus menggerakkan partikel substrat (Nybakken 1988).
Pada jenis sedimen berpasir, kandungan oksigen relatif lebih besar dibandingkan pada sedimen yang halus karena pada sedimen berpasir terdapat pori udara yang memungkinkan terjadinya pencampuran yang lebih intensif dengan air di atasnya, tetapi pada sedimen ini tidak banyak nutrien, sedangkan pada substrat yang
lebih halus walaupun oksigen terbatas namun nutrien tersedia dalam jumlah yang berlimpah (Wood 1987).
Bahan organik berasal dari hewan atau tumbuhan yang membusuk lalu tenggelam ke dasar perairan dan bercampur dengan lumpur. Bahan organik yang mengendap di dasar perairan merupakan sumber bahan makanan bagi organisme makrozoobentos. Jumlah dan laju penambahan bahan organik dalam sedimen mempunyai pengaruh yang besar terhadap populasi organisme dasar. Sedimen yang kaya akan bahan organik sering didukung oleh melimpahnya organisme bentik tersebut (Wood 1987). Dengan demikian, rendahnya kandungan bahan organik (C-organik) dalam sedimen juga akan mempengaruhi komposisi dan kepadatan makrozoobentos.
Wood (1987) mengemukakan bahwa terdapat hubungan antara kandungan bahan organik dengan ukuran partikel sedimen. Pada sedimen halus, persentase bahan organik lebih tinggi daripada sedimen yang kasar. Hal ini berkaitan dengan kondisi lingkungan yang memungkinkan terjadinya pengendapan sedimen lumpur yang diikuti oleh akumulasi bahan-bahan organik dasar perairan.
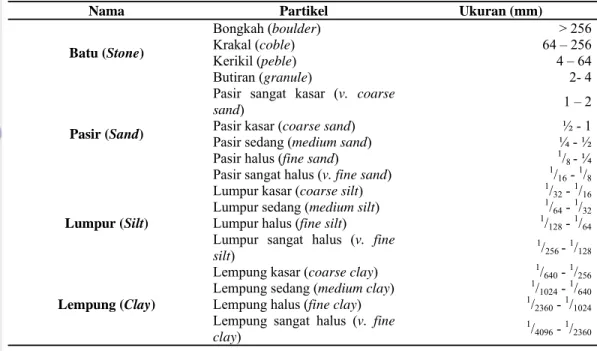
Berdasarkan ukuran dan besar butir, maka sedimen dapat diklasifikasikan seperti yang ditunjukkan oleh Tabel 2.
Tabel 2 . Ukuran besar butir untuk sedimen menurut skala Wentworth (Wentworth 1922 in Mckenzie dan Yoshida 2009)
Nama Partikel Ukuran (mm)
Batu (Stone) Bongkah (boulder) > 256 Krakal (coble) 64 – 256 Kerikil (peble) 4 – 64 Butiran (granule) 2- 4 Pasir (Sand)
Pasir sangat kasar (v. coarse
sand) 1 – 2
Pasir kasar (coarse sand) ½ - 1
Pasir sedang (medium sand) ¼ - ½
Pasir halus (fine sand) 1/8 - ¼
Pasir sangat halus (v. fine sand) 1/16 - 1/8 Lumpur (Silt)
Lumpur kasar (coarse silt) 1/32 - 1/16
Lumpur sedang (medium silt) 1/64 - 1/32
Lumpur halus (fine silt) 1/128 - 1/64
Lumpur sangat halus (v. fine silt)
1/ 256 - 1/128
Lempung (Clay)
Lempung kasar (coarse clay) 1/640 - 1/256
Lempung sedang (medium clay) 1/1024 - 1/640
Lempung halus (fine clay) 1/2360 - 1/1024
Lempung sangat halus (v. fine clay)
1/