AKTIVITAS ANTIBAKTERI SENYAWA HASIL
BIOTRANSFORMASI KURKUMIN OLEH
MIKROB ENDOFIT ASAL KUNYIT
MIFTAKH NUR RAHMAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
MIFTAKH
NUR
RAHMAN.
Aktivitas
Antibakteri
Senyawa
Hasil
Biotransformasi Kurkumin oleh Mikrob Endofit Asal Kunyit. Dibimbing oleh
MEGA SAFITHRI dan TITIK K PRANA.
Kunyit mengandung kurkumin yang telah diketahui memiliki aktivitas
antibakteri. Selain itu kunyit pun memiliki mikrob endofit yang hidup di dalam
jaringannya. Mikrob endofit berpotensi sebagai agen biotransformasi senyawa
aktif yang terdapat pada inangnya. Penelitian ini bertujuan memperoleh ekstrak
murni senyawa hasil biotransformasi kurkumin oleh mikrob endofit asal kunyit
dan mengetahui aktivitas antibakterinya. Senyawa hasil biotransformasi kurkumin
diekstrak dari kultur mikrob endofit dengan etil asetat teknis. Ekstrak tersebut
kemudian difraksinasi menggunakan kromatografi kolom dengan pelarut
n-heksana, n-heksana-etil asetat (20:1), n-heksana-etil asetat (5:1), n-heksana-etil
asetat (2:1), kloroform-metanol (10:1), dan kloroform-metanol (5:1). Setelah itu
dimurnikan menggunakan kromatografi lapis tipis preparatif dengan eluen
kloroform-metanol (10:1). Semua ekstrak diujikan aktivitas antibakterinya
terhadap Escherichia coli, Staphylococcus aureus, Bacillus subtilis, Salmonella
typhi, dan Ralstonia solanacearum menggunakan metode difusi dengan
konsentrasi 50 mg/mL. Rendemen ekstrak murni adalah 2.66% dengan Rf 0.701.
Ekstrak murni senyawa hasil biotransformasi memiliki aktivitas antibakteri yang
paling tinggi dibandingkan dengan ekstrak kasar dan ekstrak setelah fraksinasi
serta memiliki aktivitas antibakteri dua kali lebih tinggi dibandingkan dengan
kurkumin. Semua bakteri uji dapat dihambat pertumbuhannya oleh ekstrak
senyawa hasil biotransformasi. Salmonella typhi adalah bakteri yang paling
sensitif terhadap ekstrak murni senyawa hasil biotransformasi dengan diameter
zona hambat 9.0 mm.
ABSTRACT
MIFTAKH NUR RAHMAN. Antibacterial Activity of Curcumin Biotransformed
Compound by Endophyitic Microbe from Turmeric. Under the direction of
MEGA SAFITHRI and TITIK K PRANA.
Turmeric is contains curcumin that known has antibacterial activity. On
the other hand turmeric has endophytic microbe that live in their tissues.
Endophytic microbe potentially as biotransformation agent of active compound of
their hosts. The aim of this research was to obtain pure extract of curcumin
biotransformed compound by endophytic microbe from turmeric and to know
antibacterial activity of that compound. Curcumin biotransformed compound was
extracted from endophytic microbe culture with technical ethyl acetate. That
extract then separated using column chromatography with solvents hexane,
n-hexane-ethyl acetate (20:1), n-n-hexane-ethyl acetate (5:1), n-n-hexane-ethyl acetate
(2:1), chloroform-methanol(10:1), and chloroform-methanol (5:1). And then
purified using preparative layer chromatography with eluent chloroform-methanol
(10:1). All of extracts were tested their antibacterial activity with diffusion
method against Escherichia coli, Staphylococcus aureus, Bacillus subtilis,
Salmonella typhi, and Ralstonia solanacearum with 50 mg/mL concentration.
Pure extract rendemen was 2.66% with Rf 0.701. Pure curcumin biotransformed
compound extract had higher antibacterial activity than crude extract and
semi-pure extract and had doubled antibacterial activity than curcumin. Curcumin
biotransformed compound inhibited all of test bacterias and the most sensitive
bacteria was Salmonella typhi with 9.0 mm inhibitory zone diameter.
AKTIVITAS ANTIBAKTERI SENYAWA HASIL
BIOTRANSFORMASI KURKUMIN OLEH
MIKROB ENDOFIT ASAL KUNYIT
MIFTAKH NUR RAHMAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul : Aktivitas Antibakteri Senyawa Hasil Biotransformasi Kurkumin oleh
Mikrob Endofit Asal Kunyit
Nama : Miftakh Nur Rahman
NIM : G84051106
Disetujui
Komisi Pembimbing
Mega Safithri, S.Si, M.Si.
Dr. Ir. Titik K. Prana
Ketua
Anggota
Diketahui
Dr. drh. Hasim, DEA.
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Alhamdulillah, segala puji bagi Allah yang telah berkehendak atas segala
sesuatu yang terjadi di alam semesta sehingga karya ilmiah yang berjudul
Aktivitas Antibakteri Senyawa Hasil Biotransformasi Kurkumin oleh Mikrob
Endofit Asal Kunyit dapat terselesaikan. Karya ilmiah ini ditulis berdasarkan
penelitian yang dilaksanakan di laboratorium Mikrobiologi-Biopolimer Pusat
Penelitian Bioteknologi LIPI sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Mega
Safithri, S.Si, M.Si dan Dr. Ir. Titik K Prana, yang telah membimbing penulis
selama penelitian dan penyusunan skripsi. Penulis juga mengucapkan terima kasih
kepada keluarga di rumah yang selalu mendukung dan mendoakan. Tak lupa
penulis juga mengucapkan terima kasih kepada Dr. Partomuan Simanjuntak,
APU, Bustanussalam, S.Si, Dwi Wulandari, S.Si, Akhmad Darmawan, M.Si, Erik
Firdian, dan teman-teman di Departemen Biokimia.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 22 Januari 1987 dari ayah Nur
Samsudin dan ibu Aan Hasanah. Penulis merupakan putra pertama dari 3
bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 1 Bogor dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis
memilih Mayor Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah
Biologi pada tahun ajaran 2006/2007 dan 2007/2008 serta mata kuliah Pengantar
Penelitian Biokimia pada tahun ajaran 2008/2009. Penulis juga aktif dalam
himpunan profesi Community of Research and Education in Biochemistry
(CREBs) sebagai staf subbidang Biokimia Medis pada tahun 2006/2007 dan ketua
bidang Bioanalisis pada tahun 2007/2008.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Kunyit (Curcuma longa Linn) ... 1
Mikrob Endofit ... 2
Biotransformasi ... 2
Kromatografi ... 3
Antibakteri ... 4
BAHAN DAN METODE
Alat dan Bahan ... 4
Metode Percobaan ... 4
HASIL DAN PEMBAHASAN
Analisis Pembentukan Senyawa Hasil Biotransformasi ... 6
Pemurnian Senyawa Hasil Biotransformasi ... 7
Aktivitas Antibakteri Senyawa Hasil Biotransformasi ... 8
SIMPULAN DAN SARAN
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR GAMBAR
Halaman
1 Rimpang kunyit ... 1
2 Struktur kurkumin ... 2
3 Kurva pertumbuhan kapang endofit kunyit ... 2
4 Pertumbuhan isolat kapang ... 6
5 Pola KLT produksi senyawa hasil biotransformasi ... 6
6 Fraksi hasil pemisahan dengan kromatografi kolom ... 7
7 Pola KLT pemurnian senyawa hasil biotransformasi ... 8
8 Perkiraan struktur molekul senyawa hasil biotransformasi ... 8
9 Aktivitas antibakteri senyawa hasil biotransformasi ... 9
DAFTAR LAMPIRAN
Halaman
1 Tahapan produksi senyawa hasil biotransformasi ... 13
2 Tahapan pemurnian senyawa hasil biotransformasi ... 14
3 Nilai rendemen pemurnian senyawa hasil biotransformasi ... 14
4 Tahapan pengujian aktivitas antibakteri senyawa hasil biotransformasi ... 15
5 Diameter zona hambat senyawa hasil biotransformasi ... 15
6 Diameter zona hambat amoksisilin dengan konsentrasi 1 mg/mL ... 16
7 Diameter zona hambat kurkumin dengan konsentrasi 50 mg/mL ... 16
8 Zona hambat ekstrak kasar senyawa hasil biotransformasi ... 16
9 Zona hambat ekstrak senyawa hasil biotransformasi setelah fraksinasi ... 17
10 Zona hambat ekstrak senyawa hasil biotransformasi setelah isolasi ... 17
11 Pengujian metanol dan etil asetat terhadap pertumbuhan bakteri ... 18
12 Spektrum proton NMR senyawa hasil biotransformasi ... 18
1
PENDAHULUAN
Indonesia terletak di daerah khatulistiwa dengan iklim tropis yang memungkinkan matahari bersinar sepanjang tahun. Keuntungan letak geografis tersebut menjadikan Indonesia sebagai sumber berbagai jenis kekayaan hayati. Masyarakat Indonesia telah mengenal beragam obat tradisional yang berasal dari kekayaan hayati terutama tumbuhan. Sampai saat ini diketahui bahwa seperempat obat yang ada di dunia diperoleh dari tumbuhan yang salah satu diantaranya adalah kunyit (Oomah 2000).
Kunyit telah digunakan oleh manusia sebagai salah satu obat tradisional. Khasiat obat pada kunyit berasal dari senyawa kurkuminoid yang mayoritas terdiri atas kurkumin. Senyawa kurkuminoid tersebut juga dapat dimanfaatkan sebagai pewarna makanan alami yang aman dikonsumsi. Selain mengandung senyawa kurkuminoid, kunyit memiliki mikrob endofit yang hidup bersimbiosis mutualisme (Oomah 2000).
Mikrob endofit adalah mikrob yang hidup di dalam jaringan tumbuhan dengan membentuk koloni selama periode tertentu dari siklus hidupnya tanpa membahayakan inangnya. Kelompok mikrob endofit tersebut dapat menghasilkan metabolit sekunder atau melakukan biotransformasi metabolit inangnya secara enzimatik menjadi senyawa turunannya. Simanjuntak et al. (2002) membuktikan bahwa mikrob endofit yang diisolasi dari tumbuhan kina dapat melakukan biotransformasi senyawa kinkona menjadi kinkona N-oksida yang lebih aktif dalam mengobati malaria. Oleh karena itu perlu dilakukan penelitian terhadap aktivitas senyawa hasil biotransformasi kurkumin oleh mikrob endofit yang berasal dari kunyit untuk memperoleh senyawa turunan yang diharapkan lebih aktif dari kurkumin.
Salah satu pengujian aktivitas senyawa hasil biotransformasi adalah dengan melihat potensi antibakterinya. Kurkumin telah diketahui memiliki aktivitas antibakteri oleh karena itu senyawa hasil biotransformasinya diharapkan memiliki aktivitas antibakteri yang lebih tinggi. Pengujian dilakukan terhadap 5 jenis bakteri, yaitu
Staphylococcus aureus, Bacillus subtilis, Escherichia coli, Salmonella typhi, dan Ralstonia solanacearum Untuk mendapatkan hasil pengujian yang baik maka ekstrak kasar senyawa hasil
biotransformasi tersebut perlu dimurnikan dengan metode kromatografi kolom kromatografi lapis tipis preparatif.
Tujuan penelitian ini adalah memperoleh ekstrak murni senyawa hasil biotransformasi kurkumin oleh mikrob endofit asal kunyit dan menguji aktivitasnya sebagai antibakteri. Hipotesis yang diajukan adalah ekstrak murni senyawa hasil biotransformasi kurkumin memiliki aktivitas antibakteri yang lebih tinggi dibandingkan senyawa asalnya dan dapat menghambat pertumbuhan 5 jenis bakteri uji. Hasil penelitian ini diharapkan dapat memberikan informasi mengenai manfaat mikrob endofit kunyit untuk melakukan biotransformasi kurkumin menjadi senyawa turunannya yang memiliki aktivitas antibakteri yang lebih tinggi.
TINJAUAN PUSTAKA
Kunyit (Curcuma longa Linn.)Kunyit merupakan salah satu tanaman rempah dan obat. Habitat asli tanaman tersebut meliputi wilayah Asia khususnya Asia Tenggara. Bagian kunyit yang dapat digunakan sebagai obat adalah rimpangnya. Khasiat terbaik dari rimpang kunyit yang digunakan sebagai obat terdapat pada rimpang induk yang warna bagian dalamnya kemerahan dan masih segar (Gambar 1). Tanaman kunyit dapat hidup dengan baik pada suhu yang berkisar antara 20–30 °C dengan curah hujan 1500-2000 mm/tahun. Kunyit biasanya memiliki batang setinggi 1 meter dan memiliki sistem perakaran yang disebut rizoma (Kloppenburgh 2006).
Rimpang kunyit mengandung senyawa aktif yang berkhasiat sebagai obat yaitu kurkuminoid, salah satunya adalah kurkumin yang strukturnya ditunjukkan pada Gambar 2. Rumus kimia kurkumin adalah C21H20O6. Kurkumin dikenal sebagai warna kuning alami dan termasuk ke dalam kelompok senyawa polifenol yang dapat mengubah
permeabilitas membran sehingga
menyebabkan kebocoran nutrisi pada sel bakteri.(Oomah 2000).
Gambar 1 Rimpang kunyit (Babu et al. 2007).
Kurkumin bermanfaat sebagai antioksidan dan berfungsi sebagai penghilang rasa sakit karena kurkumin dapat menghambat aktivitas enzim siklooksigenase-2 (cox-2) (e.c. 1.14.99.1) Enzim cox-2 mengubah asam arakhidonat menjadi prostaglandin yang menyebabkan timbulnya rasa sakit. Kurkumin juga dapat digunakan sebagai kosmetik seperti yang telah digunakan oleh penduduk India d Bangladesh. Kurkumin pun
aktivitas antibakteri berspektrum luas yaitu antibakteri yang aktif terhadap berbagai jenis bakteri Gram positif dan Gram negatif, antivirus, dan penginduksi apoptosis sel (antitumor) (Bermawie 2006).
Aktivitas antibakteri kurkumin telah diketahui dapat menghambat pertumbuhan
Mycobacterium tuberculosis
Mycobacterium bovis yang dapat menyebabkan penyakit TBC (Cikrici 2008). Selain itu kurkumin juga dapat menghambat pertumbuhan Staphylococcus
epidermidis penyebab ruam pada kulit, Escherichia coli penyebab diare akut
(Tajbakhsh et al. 2008).
Gambar 2 Struktur kurkumin (Joe et al. 2004).
Mikrob Endofit
Mikrob endofit adalah sekelompok mikrob yang hidup di dalam jaringan pembuluh tanaman, daun, akar, buah, dan batang. Mikrob tersebut hidup
simbiosis yang saling menguntungkan, dalam hal ini mikrob mendapatkan nutrisi dari hasil metabolisme tanaman inangnya dan memproteksi tanaman inang tersebut terhadap herbivora, serangga, atau jaringan yang patogen (Radji 2005).
lingkungan tempat tumbuhnya inang dapat mempengaruhi populasi endofit, misalnya pada daerah tropis diversitas populasi endofit lebih beraneka ragam.
merupakan salah satu komponen penting dalam biodiversitas mikrob. Umumnya dari satu spesies tanaman dapat diisolasi ratusan jenis endofit (Tan & Zou 2001).
yang dilakukan untuk mengisolasi endofit adalah merendam jaringan tanaman dengan alkohol 75% dan natrium hipoklorit lalu jaringan tersebut diletakkan diatas
Kurkumin bermanfaat sebagai
antioksidan dan berfungsi sebagai penghilang rasa sakit karena kurkumin aktivitas enzim (e.c. 1.14.99.1). 2 mengubah asam arakhidonat menjadi prostaglandin yang menyebabkan timbulnya rasa sakit. Kurkumin juga dapat digunakan sebagai kosmetik seperti yang telah digunakan oleh penduduk India dan pun memiliki berspektrum luas yaitu yang aktif terhadap berbagai Gram positif dan Gram negatif, antivirus, dan penginduksi apoptosis sel teri kurkumin telah diketahui dapat menghambat pertumbuhan dan yang dapat menyebabkan penyakit TBC (Cikrici et al 2008). Selain itu kurkumin juga dapat
Staphylococcus
b ruam pada kulit, dan penyebab diare akut
kurkumin
Mikrob endofit adalah sekelompok mikrob yang hidup di dalam jaringan pembuluh tanaman, daun, akar, buah, dan batang. Mikrob tersebut hidup dengan saling menguntungkan, dalam hal ini mikrob mendapatkan nutrisi inangnya dan memproteksi tanaman inang tersebut terhadap herbivora, serangga, atau jaringan Kondisi lingkungan tempat tumbuhnya inang dapat mempengaruhi populasi endofit, misalnya pada daerah tropis diversitas populasi Endofit merupakan salah satu komponen penting dalam biodiversitas mikrob. Umumnya dari satu spesies tanaman dapat diisolasi ratusan . Tahapan yang dilakukan untuk mengisolasi mikrob jaringan tanaman dengan alkohol 75% dan natrium hipoklorit lalu jaringan tersebut diletakkan diatas
media CMM (Corn Milk Malt). Setelah masa inkubasi selama 3 hari maka telah didapat mikrob endofit yang tumbuh di sekitar jaringan tersebut. (Tanaka et al 1999).
Salah satu kelompok mikrob endofit yang telah berhasil diisolasi adalah kapang dari rimpang kunyit. Pertumbuhan kapang endofit dari rimpang kunyit tersebut diawali dengan terbentuknya hifa yang berwarna putih kemudian tumbuh spora yang menimbulkan variasi warna yang berbeda untuk setiap jenis kapang. Seperti halnya mikrob yang lain, kapang pun memiliki fase fase pertumbuhan, yaitu fase lag, fase eksponensial, fase stasioner, dan fase kematian. Pertumbuhan kapang biasanya lebih lambat daripada pertumbuhan bakteri dan khamir (Pelczar & Chan 2005). Fase fase pertumbuhan kapang endofit yang telah diisolasi dari rimpang kunyit tersebut dapat terlihat melalui kurva pertumbuhannya (Gambar 3).
Setelah diisolasi dan dimurnikan, mikrob endofit dapat dimanfaatkan untuk menghasilkan berbagai senyawa alam yang berpotensi sebagai antibakteri, antikanker, dan antioksidan (Strobel & Daisy 2003). Selain itu, endofit juga dapat dimanfaatkan sebagai agen biotransformasi senyawa aktif yang terkandung dalam tanaman inangnya seperti biotransformasi kinkona menjadi kinkona-N oksida oleh mikrob endofit dari tanaman kina (Simanjuntak et al 2002), dan biotransformasi tetrahidrofuran lignan oleh mikrob endofit dari Viguiera arenaria sebagai obat penyakit Chagas (Verza et al 2009)
Gambar 3 Kurva pertumbuhan kapang endofit kunyit (Riyadh 2008).
Biotransformasi
Biotransformasi adalah pengubahan suatu senyawa menjadi senyawa turunannya yang strukturnya berbeda dari senyawa asalnya akibat aktivitas metabolisme suatu mikrob (Lu et al. 1995). Proses ini sangat berkaitan dengan penggunaan enzim untuk
0.000 0.010 0.020 0.030 0.040 0.050 1 5 9 13 17 B o b o t B io m a ss a K er in g ( g ra m )
Waktu Inkubasi (Hari)
2
). Setelah masa inkubasi selama 3 hari maka telah didapat mikrob endofit yang tumbuh di
et al.
endofit adalah kapang dari rimpang kunyit. Pertumbuhan kapang diawali dengan terbentuknya hifa yang berwarna putih kemudian tumbuh spora yang menimbulkan variasi warna yang berbeda untuk setiap jenis kapang. Seperti halnya mikrob yang lain, kapang pun memiliki fase-fase pertumbuhan, yaitu fase-fase lag, fase-fase
fase stasioner, dan fase kematian. Pertumbuhan kapang biasanya pertumbuhan bakteri Fase-fase pertumbuhan kapang endofit yang telah diisolasi dari rimpang kunyit tersebut dapat pertumbuhannya Setelah diisolasi dan dimurnikan, mikrob endofit dapat dimanfaatkan untuk menghasilkan berbagai senyawa alam yang berpotensi sebagai antibakteri, antikanker, dan antioksidan (Strobel & Daisy 2003). t dimanfaatkan sebagai agen biotransformasi senyawa aktif yang terkandung dalam tanaman inangnya seperti biotransformasi kinkona menjadi N oksida oleh mikrob endofit dari 2002), dan ignan oleh
Viguiera arenaria et al.
Gambar 3 Kurva pertumbuhan kapang endofit kunyit (Riyadh 2008).
Biotransformasi adalah pengubahan suatu senyawa menjadi senyawa turunannya yang strukturnya berbeda dari senyawa asalnya akibat aktivitas metabolisme suatu Proses ini sangat untuk
3
mengubah suatu substrat ke dalam suatu produk melalui langkah-langkah yang kompleks. Jenis reaksi pada suatu senyawa yang mengalami biotransformasi yaitu oksidasi, reduksi, hidrolisis, konjugasi, asetilasi, dan metilasi. Penetapan dari suatu proses biotransformasi memerlukan pengembangan optimal biokatalisator, bioreaktor, dan media reaksi (Rosazza 2000).
Aplikasi biotransformasi dalam bioindustri adalah penggunaan mikrob untuk mengubah metabolit tumbuhan inang menjadi senyawa yang lebih berkhasiat. Biokatalisator yang berasal dari mikrob tersebut pun dapat dimanfaatkan dalam industri kimia yang melibatkan proses yang rumit seperti isomerasi, sintesis campuran kiral, reaksi hidrolisis terbalik, dan sintesis kompleks seperti hidroksilasi aromatik (Carbal 2002).
Kromatografi
Kromatografi adalah metode pemisahan yang umum dilakukan untuk suatu campuran senyawa alam secara fisik yaitu dengan
mendistribusikan komponen yang
dipisahkan diantara dua fase, yaitu fase gerak dan fase diam. Transfer massa antara kedua fase tersebut terjadi ketika komponen dalam campuran terjerap pada permukaan partikel atau terbagi kedalam sejumlah cairan yang melewatinya. Pemisahan secara kromatografi dapat dikelompokkan berdasarkan sifat fisika dan kimia dari kedua fasenya. Kelompok tersebut adalah kromatografi cair, kromatografi cair-padat, kromatografi gas-cair, dan kromatografi gas-padat (Khopkar 2003).
Salah satu jenis dari kromatografi cair- padat adalah kromatografi lapis tipis (KLT). Prinsip kerja dari KLT adalah perbedaan tingkat kelarutan suatu senyawa diantara dua fase. Metode ini sering digunakan karena murah dan mudah. Fase gerak yang digunakan pada KLT adalah pelarut organik dengan perbandingan tertentu yang tujuannya untuk mengubah kepolaran. Fase diam yang digunakan adalah senyawa yang dapat menahan pergerakan sampel yang dibawa oleh fase gerak karena memiliki kepolaran yang sesuai dengan komponen yang dipisahkan.
Pemisahan pada KLT terjadi karena persaingan antara fase diam dan fase gerak untuk mengikat komponen yang terdapat pada campuran yang akan dipisahkan.
Persaingan tersebut disebabkan oleh polaritas yang dimiliki oleh fase diam dan komponen campuran. Komponen yang berpolaritas sama dengan fase diam akan berinteraksi lebih kuat dan akibatnya komponen tersebut terjerap oleh fase diam (Stoddard et al. 2007). Analisis dengan KLT diinterpretasikan melalui nilai retardation
factor (Rf). Nilai Rf adalah perbandingan
jarak yang ditempuh pelarut dengan jarak yang ditempuh komponen sampel. Nilai Rf menujukkan perbedaan sifat senyawa dan dapat digunakan untuk mengidentifikasi senyawa tersebut (Heftamann 2004). Informasi nilai Rf dari KLT dapat digunakan sebagai dasar untuk fraksinasi dengan kromatografi kolom.
Jenis lain dari kromatografi cair-padat adalah kromatografi kolom. Prinsip kerja dari kromatografi ini sama dengan KLT namun fase gerak dialirkan secara kontinyu agar komponen terbawa sesuai dengan kepolarannya. Aliran fase gerak melalui sampel yang berada pada fase diam disebut sebagai elusi. Metode elusi pada kromatografi kolom terbagi menjadi dua yaitu metode elusi isokratik dan elusi gradien. Elusi gradien sangat tepat untuk memisahkan campuran yang kompleks. Dengan metode tersebut, polaritas eluen dapat diatur sedemikian rupa sehingga pemisahan komponen dalam ekstrak dapat lebih baik karena perubahan polaritas yang bertahap. Gradien elusi diawali dari pelarut yang non polar ke campuran pelarut yang relatif polar. Penambahan eluen non polar didahulukan karena senyawa-senyawa non polar yang terdapat pada campuran memiliki Rf yang tinggi sehingga memiliki waktu retensi yang lebih singkat daripada senyawa yang lebih polar (Sandur 2007).
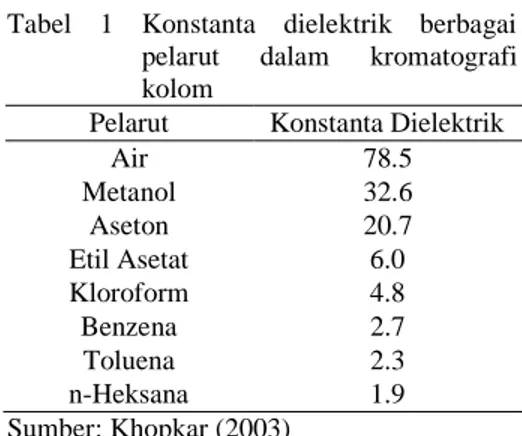
Pemilihan eluen digunakan untuk memisahkan komponen senyawa alam harus ditentukan dengan teliti agar kualitas pemisahan dapat mencapai hasil yang baik. Pemilihan eluen tersebut didasari oleh polaritas atau nilai konstanta dielektrik dari masing-masing pelarut. Tabel 1 menunjukan konstanta dielektrik dari berbagai pelarut yang umum digunakan dalam kromatografi kolom. Pergerakan senyawa yang dipisahkan pada kromatografi kolom sangat dipengaruhi oleh tingkat kepolaran eluen yang digunakan. Apabila eluen terlalu polar maka tidak akan terjadi pemisahan karena senyawa dalam campuran akan bergerak sangat cepat saat keluar dari kolom (Sandur 2007).
4
Tabel 1 Konstanta dielektrik berbagai pelarut dalam kromatografi kolom
Pelarut Konstanta Dielektrik
Air 78.5 Metanol 32.6 Aseton 20.7 Etil Asetat 6.0 Kloroform 4.8 Benzena 2.7 Toluena 2.3 n-Heksana 1.9 Sumber: Khopkar (2003) Antibakteri
Mikroorganisme bersifat sangat merugikan karena dapat menginfeksi dan menimbulkan penyakit serta merusak bahan pangan. Mikroorganisme yang merugikan dapat ditangani secara fisik maupun kimia dengan suatu zat antibakteri. Zat antibakteri adalah zat yang dapat mengganggu pertumbuhan atau bahkan mematikan bakteri dengan cara mengganggu metabolisme mikrob tersebut. Antibakteri ini hanya digunakan jika mempunyai sifat toksik selektif, artinya dapat membunuh bakteri yang menyebabkan penyakit tetapi tidak beracun bagi penderitanya. Berdasarkan aktivitasnya zat antibakteri dibedakan menjadi dua jenis, yaitu yang memiliki aktivitas menghambat pertumbuhan bakteri (bakteriostatik) dan yang memiliki aktivitas membunuh bakteri (bakteriosida). Beberapa zat antibakteri bersifat bakteriostatik pada konsentrasi rendah dan bersifat bakterisida pada konsentrasi tinggi.
Contoh kelompok bahan antibakteri adalah fenol, alkohol, halogen, logam berat, detergen, aldehida, dan kemosterilisator gas. Dari sekian banyak contoh diatas, senyawa fenol paling sering digunakan karena senyawa tersebut tidak hanya terdapat pada antibiotika sintetik, namun pada senyawa alam yang dikenal sebagai polifenol. Apabila digunakan dalam konsentrasi yang tinggi, fenol bekerja dengan merusak membran sitoplasma secara total dengan mengendapkan protein sel. Akan tetapi, bila dalam konsentrasi rendah, fenol merusak membran sel yang menyebabkan kebocoran metabolit penting dan menginaktifkan bakteri (Madigan 2005).
Mekanisme kerja yang lain dari senyawa antibakteri adalah merusak dinding sel, menghambat kerja enzim, dan menghambat sintesis asam nukleat dan protein. Aktivitas
senyawa antibakteri dipengaruhi oleh pH, suhu, stabilitas senyawa tersebut, jumlah bakteri yang ada, lamanya inkubasi, dan aktivitas metabolisme bakteri (Madigan 2005).
BAHAN DAN METODE
Alat dan BahanAlat yang digunakan untuk pembuatan media, prekultur, inokulasi, dan penambahan kurkumin adalah Erlenmeyer 1000 mL, Erlenmeyer 100 mL, Erlenmeyer 500 mL, autoklav everlight TA-630, oven Jouan, cawan Petri, pipet mikro 5 mL, pH meter Eutech 510, pipet mikro 1 mL, dan inkubator bergoyang New Brunswick G25. Alat yang digunakan untuk pemurnian dengan kromatografi kolom adalah tabung reaksi, pipet tetes, vial, gelas piala, vortex Heidolph Reax, rotary evaporator Eyela A 1000 s, lempeng silika gel 60 F254 Merck, pipa kapiler, kolom kromatografi, lampu UV, dan hot plate Cimarec. Alat yang digunakan untuk pengujian antibakteri adalah cawan Petri, pipet mikro 100 µL, spektrofotometer, dan gel puncher.
Bahan yang digunakan untuk pembuatan media, prekultur, inokulasi, dan penambahan kurkumin adalah isolat murni kapang Cl Bel 5F, media potato dextrose broth (PDB) Difco, dan metanol pro analisis. Bahan yang digunakan untuk pemurnian adalah etil asetat, n-heksana, silika gel, pasir laut,
celite, serium sulfat (Ce(SO4)2), etanol 70%, kurkumin, kloroform, kloroform deuterium (CDCl3), dan akuades. Bahan yang digunakan untuk pengujian antibakteri adalah media nutrient agar (NA), media
sucrose peptone agar (SPA), media sucrose peptone broth (SPB), amoksisilin, dan media nutrient broth (NB).
Metode Percobaan
Prekultur dan Inokulasi ke Media Kultur (Riyadh 2008)
Sebanyak 1 ose isolat kapang endofit diinokulasikan ke dalam media PDB steril sebagai prekultur kemudian diinkubasi selama 3 hari pada inkubator bergoyang dengan suhu 28 °C. Sebanyak 0.5% (v/v) dari prekultur diinokulasikan ke dalam media PDB steril untuk kultur. Setelah itu diletakkan pada inkubator bergoyang pada suhu 28 °C selama 3 hari dengan kecepatan 120 rpm.
5
Penambahan Larutan Kurkumin ke dalam Kultur (Riyadh 2008)
Kurkumin dilarutkan dalam metanol pro analisis dengan konsentrasi 2 mg/mL. Kemudian larutan kurkumin tersebut ditambahkan pada kultur hingga konsentrasi akhir 0,01%(b/v). Setelah itu kultur yang telah ditambahkan kurkumin tersebut kembali diinkubasi pada inkubator bergoyang dengan suhu 28 °C selama 10 hari dengan kecepatan 120 rpm. Sebagai kontrol kultur tanpa penambahan kurkumin diperlakukan sama dengan kultur dengan penambahan kurkumin.
Ekstraksi Senyawa Hasil Biotransformasi (Riyadh 2008)
Ekstraksi dilakukan dengan
menambahkan etil asetat ke dalam kultur yang telah diinkubasi selama 10 hari setelah penambahan kurkumin dengan perbandingan volume 1:1. Setelah itu fase etil asetat yang berada di atas dipisahkan dari kultur secara dekantasi. Ekstrak etil asetat tersebut dipekatkan menggunakan rotary evaporator dengan suhu 37-40ºC.
Fraksinasi dengan Kromatografi Kolom (Modifikasi Riyadh 2008)
Ekstrak kasar yang telah dikeringkan kemudian ditambahkan celit. Ekstrak yang telah ditambahkan celit tersebut dimasukkan ke dalam kolom silika gel yang telah disiapkan. Fase gerak yang digunakan adalah n-heksana, n-heksana-etil asetat (20:1), heksana-etil asetat (5:1), n-heksana-etil asetat (2:1), kloroform-metanol (10:1), dan kloroform-metanol (5:1). Keran kolom dibuka penuh dan setiap tetesan sampel ditampung pada vial dengan volume 10 mL kemudian dianalisis dengan kromatografi lapis tipis. Setiap sampel dari tampungan dengan nilai Rf dan jumlah komponen yang sama digabung sebagai 1 fraksi.
Isolasi dengan KLT Preparatif
Fraksi hasil kromatografi kolom dengan pola analisis KLT yang sama seperti pola analisis KLT saat produksi dilarutkan dalam etil asetat hingga konsentrasinya 150 mg/mL. Setelah itu larutan tersebut digoreskan pada lempeng KLT dan dielusi dengan kloroform-metanol (10:1). Setelah elusi selesai, lempeng tersebut dilihat dibawah sinar UV dan kemudian spot yang terlihat ditandai. Spot yang telah ditandai tersebut dibandingkan dengan hasil analisis
KLT sebelumnya dan spot yang sama dikerik dari lempeng KLT kemudian dilarutkan kembali dengan etil asetat dan dipisahkan dari silika gel secara dekantasi. Visualisasi dilakukan dengan melihat di bawah sinar UV tanpa penambahan larutan penampak spot.
Penentuan Struktur Molekul dengan Instrumen Nuclear Magnetic Resonance (NMR)
Ekstrak murni yang telah diperoleh dari isolasi dengan KLT preparatif dikeringkan kemudian dilarutkan dalam kloroform deuterium dengan volume 1 mL. Kemudian larutan tersebut dimasukkan ke dalam tabung NMR hingga tingginya 4 cm lalu dimasukkan ke dalam instrumen NMR. Sebelum dilakukan pengukuran, instrumen NMR tersebut disesuaikan dahulu dengan sampel dan diatur frekuensinya hingga 500 MHz.
Pengujian Aktivitas Antibakteri (Bintang 1993)
Peremajaan Bakteri Uji. Peremajaan
dilakukan dengan menginokulasikan bakteri uji ke media NA dan SPA kemudian diinkubasi selama 24 jam pada suhu 37 °C. Setelah itu satu ose koloni tunggal dari biakan tersebut diinokulasikan ke dalam media NB dan SPB cair dan diinkubasi selama 18-24 jam dengan suhu 37 °C.
Uji Aktivitas Antibakteri. Biakan
bakteri uji yang telah ditumbuhkan pada media NB dan SPB diukur kerapatan optisnya (OD) pada λ 620 nm. Apabila OD > 1 maka biakan yang diinokulasikan untuk pengujian sebanyak 50 µL dan bila OD < 1 maka biakan diambil sebanyak 100 µL. Biakan tersebut diinokulasikan ke dalam media NA dan SPA yang bersuhu 40-50 ºC kemudian dihomogenkan dengan vorteks lalu dicawankan ke dalam cawan Petri steril. Setelah mengeras, media agar tersebut dilubangi sehingga terdapat sumur untuk memasukkan senyawa antibakteri. Sampel dan pembanding dimasukkan ke dalam sumur tersebut sebanyak 10 µL. Konsentrasi ekstrak senyawa hasil biotransformasi dan kurkumin yang digunakan untuk pengujian antibakteri adalah 50 mg/mL, sedangkan konsentrasi amoksisilin adalah 1 mg/mL. Pengujian diulang sebanyak 2 kali. Zona bening yang terbentuk disekitar sumur setelah inkubasi selama 18-24 jam diukur sebagai aktivitas antibakteri.
6
HASIL DAN PEMBAHASAN
Analisis Pembentukan Senyawa HasilBiotransformasi
Isolat kapang endofit kunyit Cl. Bel 5F
ditumbuhkan pada media PDB.
Pertumbuhannya terlihat dari perubahan media PDB yang semula berwarna kuning jernih menjadi keruh dan terdapat butiran berwarna putih setelah 3 hari masa inkubasi pada suhu 28 ºC dengan agitasi (Gambar 4). Media PDB telah memenuhi syarat minimum kapang untuk tumbuh karena memiliki sumber karbon dan nitrogen. Sumber karbon pada media PDB adalah dekstrosa dan pati kentang sedangkan sumber nitrogen adalah asam amino yang terkandung pada kentang (Hadioetomo 1993).
Kecukupan karbon dan nitrogen sangat menentukan pertumbuhan kapang karena keduanya merupakan faktor pembatas. Pertumbuhan tersebut digunakan sebagai informasi waktu inkubasi dalam biotransformasi. Waktu inkubasi yang dibutuhkan oleh isolat kapang dalam melakukan biotransformasi adalah 10 hari setelah penambahan larutan kurkumin karena waktu tersebut merupakan waktu optimum dari proses biotransformasi
kurkumin berdasarkan kurva
pertumbuhannya. Inkubasi dilakukan dengan agitasi yang bertujuan untuk meningkatkan aerasi dan distribusi nutrisi agar sel kapang dapat mencapai kondisi fisiologis yang optimum (White 1991)
Selain kondisi fisiologis yang optimum, faktor lain yang menentukan keberhasilan biotransformasi adalah konsentrasi kurkumin. Konsentrasi akhir kurkumin yang ditambahkan ke dalam kultur adalah 0,01 % (b/v). Kurkumin yang digunakan tersebut dilarutkan terlebih dahulu dalam metanol. Metanol dipilih sebagai pelarut karena dapat melarutkan kurkumin dengan sempurna dan menjadikannya dapat larut pula dalam kultur sehingga memudahkan interaksi dengan sel kapang. Alasan lain dari penggunaan metanol adalah sensitifitas sel kapang terhadap metanol. Sel kapang tidak rusak oleh metanol karena komponen struktural dinding selnya terdiri atas kitin atau glukan (Pelczar & Chan 2005). Kultur kapang tanpa penambahan larutan kurkumin digunakan sebagai pembanding dalam pengamatan pertumbuhan kapang selama inkubasi pembentukan senyawa hasil biotransformasi.
Gambar 4 Pertumbuhan isolat kapang.
(a): Media PDB steril; (b). Media PDB Setelah inokulasi
Senyawa hasil biotransformasi yang telah terbentuk diperoleh dengan mengekstrak kultur menggunakan etil asetat. Perbandingan volume yang digunakan dalam ekstraksi tersebut adalah 1:1. Etil asetat dipilih karena sifatnya yang semipolar dan kekuatan ekstraksinya yang lebih tinggi daripada pelarut lainnya (Khopkar 2003). Ekstrak yang telah diperoleh harus dianalisis terlebih dahulu dengan metode kromatografi lapis tipis (KLT) untuk membuktikan bahwa senyawa hasil biotransformasi telah terbentuk. Hasil analisis KLT menunjukkan adanya spot berwarna hijau yang timbul dibawah spot kurkumin dan berkurangnya spot kurkumin dari kultur. Spot berwarna hijau tersebut tidak ada pada media (M), media dengan kurkumin (M+K), standar kurkumin (K), dan kultur kapang tanpa penambahan kurkumin (-K). Dengan demikian dapat ditentukan bahwa spot
tersebut adalah senyawa hasil
biotransformasi (Gambar 5).
Gambar 5 Pola KLT produksi senyawa hasil biotransformasi.
*M: Media; M+K: Media + Kurkumin; K: Kurkumin; -K: Isolat tanpa kurkumin; A: Kultur ulangan 1; B: Kultur ulangan 2; C: Kultur ulangan 3 ; D: Kultur ulangan 4.
7
Analisis KLT tersebut menggunakan campuran kloroform-metanol sebagai fase gerak dengan perbandingan 10:1. Fase gerak tersebut dipilih karena kemampuan metanol untuk meningkatkan polaritas kloroform sehingga terbentuk suatu sistem eluen yang dapat memisahkan komponen dalam ekstrak berdasarkan nilai retardation factor (Rf) dalam ekstrak dengan baik (Khopkar 2003). Nilai Rf dari spot senyawa hasil biotransformasi adalah 0.701 sedangkan nilai Rf kurkumin adalah Rf 0.754. Nilai Rf tersebut menunjukkan bahwa senyawa hasil biotransformasi lebih polar daripada kurkumin.
Nilai Rf suatu komponen ditentukan juga oleh fase diam. Fase diam yang digunakan pada analisis KLT ini adalah silika gel F254. Silika gel adalah senyawa yang polar dan angka 254 adalah panjang gelombang sinar ultraviolet yang dapat diserapnya. Apabila nilai Rf mendekati 1 berarti campuran tidak terpisah dengan baik atau hampir tidak ada interaksi antara senyawa yang dipisahkan dengan fase diam (Khopkar 2003). Senyawa hasil biotransformasi interaksinya lebih kuat terhadap silika gel sebagai fase diam daripada campuran kloroform-metanol sebagai fase gerak. Berdasarkan hasil analisis KLT tersebut sifat dan polaritas senyawa hasil biotransformasi dapat digunakan sebagai dasar untuk pemurnian
Pemurnian Senyawa Hasil Biotransformasi
Ekstrak senyawa hasil biotransformasi yang telah dianalisis memberikan informasi berdasarkan pola spot yang dibentuknya. Ekstrak tersebut selanjutnya dihilangkan pelarutnya terlebih dahulu dengan rotary
evaporator untuk mendapatkan ekstrak
kering yang siap difraksinasi dengan kromatografi kolom. Metode elusi yang digunakan dalam fraksinasi senyawa hasil biotransformasi adalah metode elusi bergradien dengan meningkatkan polaritas.
Eluen yang pertama digunakan untuk fraksinasi senyawa hasil biotransformasi adalah n-heksana. Pelarut tersebut membawa senyawa-senyawa nonpolar seperti asam lemak. Penggunanan n-heksana dihentikan ketika warna pada fase diam sudah tidak bergerak. Hal tersebut menunjukkan bahwa senyawa non polar telah terbawa keluar dari kolom oleh n-heksana. Eluen kedua, ketiga, dan keempat yang digunakan berturut adalah n-heksana-etil asetat dengan perbandingan
(20:1), (5:1), dan (2:1). Penambahan etil asetat bertujuan untuk meningkatkan polaritas n-heksana sehingga senyawa yang lebih polar dapat terbawa keluar dari kolom. Kemudian eluen kelima dan keenam yang digunakan adalah kloroform-metanol dengan perbandingan (5:1) dan (2:1) yang bertujuan untuk membawa senyawa-senyawa polar keluar dari kolom.
Seluruh tetesan yang keluar dari kolom ditampung pada vial dan dianalisis kembali dengan KLT untuk menggabungkannya sesuai dengan kesamaan nilai Rf dan jumlah komponen yang dimilikinya. Setelah seluruh vial dianalisis dan digabungkan berdasarkan pola KLT diperoleh 11 fraksi. Dari 11 fraksi tersebut terdapat pola analisis KLT yang menunjukkan adanya spot berwarna hijau dan memiliki nilai Rf yang sama dengan spot yang berada pada ekstrak kasar yaitu 0,701. Karakteristik tersebut tidak terdapat pada fraksi lainnya sehingga senyawa hasil biotransformasi dapat ditentukan berada pada fraksi nomor 9. (Gambar 6).
Fraksi nomor 9 tersebut belum dapat dikatakan murni karena masih memiliki 4 komponen. Oleh karena itu diperlukan langkah pemurnian lanjutan. Metode yang dapat digunakan adalah KLT preparatif. KLT preparatif adalah metode yang umum digunakan untuk memisahkan komponen dari senyawa alam yang memiliki 2-5 komponen dalam suatu campuran yang berbobot 20-150 mg (Salo 2007). Fraksi nomor 9 tersebut digoreskan pada lempeng KLT dan dielusi dengan campuran kloroform-metanol (10:1).
Gambar 6 Fraksi hasil pemisahan dengan kromatografi kolom.
*-KK: ekstrak sebelum fraksinasi; 1: fraksi 1; 2: fraksi 2; 3: fraksi 3; 4:
fraksi 4; 5: fraksi 5; 6: fraksi 6; 7: fraksi 7; 8: fraksi 8; 9: fraksi 9; 10: fraksi 10; 11: fraksi 11.
Lempeng KLT yang telah dielusi tersebut akan memisahkan fraksi
menjadi empat spot. Langkah selanjutnya yang dilakukan untuk mengisolasi senyawa hasil biotransformasi adalah dengan melihat lempeng KLT di bawah sinar ultraviolet. Spot yang terlihat dan memiliki Rf yang sama dengan hasil analisis KLT kemudian ditandai. Komponen pada lempeng tersebut lalu dikerik dan dilarutkan dalam etil asetat untuk memisahkan senyawa yang diisolasi dengan silika gel yang merupakan fase diam dari lempeng KLT. Pemisahan ini dilakukan dengan cara dekantasi. Hasil isolasi senyawa biotransformasi murni terlihat dari adanya spot tunggal berwarna hijau dengan nilai 0.701. Spot tersebut sama seperti spot yang terdapat pada ekstrak kasar dan ekstrak setelah fraksinasi dengan kromatografi kolom (Gambar 7). Rendemen senyawa hasil biotransformasi murni tersebut adalah 2.66%. Penelitian Srivastava et al
tentang pemurnian ekstrak kloroform senyawa hasil biotransformasi artemisinin oleh Aspergillus flavus menunjukan rendemen yang lebih tinggi yaitu 30.5%.
Senyawa hasil biotransformasi yang telah dimurnikan tersebut ditentukan
molekulnya dengan instrumen
magnetic resonance (NMR). Hasil NMR
menunjukkan bahwa 24 atom hidrogen memiliki pergeseran yang berbeda Pergeseran proton (δH) antara 6. memberikan informasi adanya –CH= dari gugus aromatik; pergeseran δH antara 2.53~2.82 memberikan informasi adanya gugus -CH2, -CH3, dan –CH-; pergeseran δH 4.02 memberikan informasi adanya gugus OH; dan pergeseran δH pada 3,86 dan 3,85 memberikan informasi adanya gugus Analisis spektrum 13C menunjukkan 21 atom karbon yang terdiri atas 5
CH2 (49.48, 45.46, 38.49, 31.58, 28.27), 1 gugus –CH- (67.06), 6 gugus (129.57, 129.57, 115.56, 115.56, 114.57, 114.57), 6 gugus –C= (146.57,
143.89, 143.89, 132.71, 132,71), C=O (211.63) dan 2 gugus –OCH3
berdasarkan jumlah hidrogen dan karbon yang telah disebutkan diatas dapat diperkirakan bahwa senyawa turunan hasil biotransformasi kurkumin adalah tetrahidrokurkumin (Gambar 8). Enzim yang diduga mengkatalisis reaksi biotransformasi tersebut adalah reduktase. Enzim ini bekerja dengan mengkatalisis reaksi hidrogenasi ikatan rangkap pada rantai alifatik dari kurkumin (Pan et al. 1999).
Lempeng KLT yang telah dielusi akan memisahkan fraksi nomor 9 . Langkah selanjutnya kan untuk mengisolasi senyawa hasil biotransformasi adalah dengan melihat lempeng KLT di bawah sinar ultraviolet. yang terlihat dan memiliki Rf yang kemudian pada lempeng tersebut rutkan dalam etil asetat untuk memisahkan senyawa yang diisolasi dengan silika gel yang merupakan fase diam dari lempeng KLT. Pemisahan ini dilakukan . Hasil isolasi senyawa biotransformasi murni terlihat dari adanya dengan nilai Rf spot yang terdapat pada ekstrak kasar dan ekstrak setelah fraksinasi dengan kromatografi Rendemen senyawa hasil biotransformasi murni tersebut adalah
et al. (2009)
ekstrak kloroform senyawa hasil biotransformasi artemisinin menunjukan rendemen yang lebih tinggi yaitu 30.5%.
Senyawa hasil biotransformasi yang ntukan struktur dengan instrumen nuclear Hasil NMR atom hidrogen ran yang berbeda-beda.
6.73~7,02 CH= dari gugus aromatik; pergeseran δH antara memberikan informasi adanya ; pergeseran δH memberikan informasi adanya gugus -OH; dan pergeseran δH pada 3,86 dan 3,85
i adanya gugus -OCH3. menunjukkan adanya 5 gugus – .48, 45.46, 38.49, 31.58, 28.27), 1 gugus –CH= 56, 114.57, , 146.57, ), 1 gugus 3 (56.08). jumlah hidrogen dan karbon yang telah disebutkan diatas dapat senyawa turunan hasil biotransformasi kurkumin adalah ). Enzim yang biotransformasi . Enzim ini bekerja dengan mengkatalisis reaksi hidrogenasi fatik dari
Gambar 7 Pola KLT pemurnian senyawa hasil biotransformasi .
*K: Kurkumin; -KK: ekstrak kasar +KK: setelah fraksinasi; P: setelah
isolasi. O OH H3CO HO O OH H3CO HO
Gambar 8 Perkiraan struktur molekul senyawa hasil biotransformasi.
Aktivitas Antibakteri Senyawa Hasil Biotransformasi
Senyawa hasil biotransformasi diuji aktivitas antibakterinya terhadap 5 spesies bakteri yang masing-masing mewakili klasifikasi berdasarkan pewarnaan Gram. Bakteri Gram negatif yang diujikan adalah
Escherichia coli, Ralstonia solanacearum
dan Salmonella typhi. Bakteri Gram positif yang diujikan adalah Staphylococcus aureus dan Bacillus subtilis. Dari kelima bakteri tersebut, dua diantaranya adalah bakteri yang menjadi penyebab spesifik penyakit pada manusia dan tumbuhan hortikultura yaitu Salmonella typhi dan Ralstonia
solanacearum.
Pengujian dilakukan dengan
membandingkan aktivitas senyawa hasil biotransformasi dengan kurkumin dan
amoksisilin dalam menghambat
pertumbuhan bakteri. Kurkumin dan amoksisilin dipilih sebagai pembanding karena telah diketahui memiliki aktivitas antibakteri. (Chattopadhyay 2004). Selain itu keduanya adalah antibakteri berspektrum
K –KK +KK P
8
Pola KLT pemurnian senyawa
ekstrak kasar; : setelah OCH3 OH OCH3 OH molekul senyawa hasil biotransformasi.
Hasil
biotransformasi diuji aktivitas antibakterinya terhadap 5 spesies wakili Gram. ram negatif yang diujikan adalah
Ralstonia solanacearum,
ram positif
Staphylococcus aureus
elima bakteri dua diantaranya adalah bakteri yang menjadi penyebab spesifik penyakit pada manusia dan tumbuhan hortikultura
Ralstonia
Pengujian dilakukan dengan
hasil dengan kurkumin dan
isilin dalam menghambat
pertumbuhan bakteri. Kurkumin dan amoksisilin dipilih sebagai pembanding ktivitas antibakteri. (Chattopadhyay 2004). Selain itu spektrum
9
luas, yaitu antibakteri yang dapat menghambat pertumbuhan bakteri Gram negatif maupun Gram positif (Neal 2002).
Hasil pengujian menunjukkan bahwa senyawa hasil biotransformasi memiliki aktivitas yang dapat menghambat seluruh jenis bakteri uji. Dengan demikian dapat
dikatakan bahwa senyawa hasil
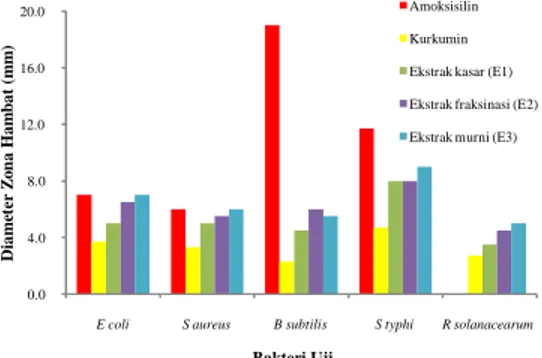
biotransformasi berpotensi sebagai antibakteri yang berspektrum luas. Aktivitas antibakteri yang dimilikinya terlihat dari zona bening yang terbentuk disekitar sumur yang berisi senyawa hasil biotransformasi pada media agar yang telah diinokulasikan bakteri uji. Sampel senyawa hasil biotransformasi yang digunakan adalah ekstrak kasar sebelum fraksinasi (E1), ektrak setelah fraksinasi (E2), dan ektrak murni setelah isolasi (E3). Ketiga sampel tersebut diujikan dengan konsentrasi yang sama yaitu 50 mg/mL. Aktivitas antibakteri tertinggi dari ketiga sampel senyawa hasil biotransformasi terhadap seluruh bakteri uji dimiliki oleh ekstrak yang paling murni (E3). Zona hambat untuk E. coli, S. aureus,
B. subtilis, S. typhi, dan R. solanacearum
berturut-turut adalah 7.0 mm, 6.0 mm, 5,5 mm, 9.0 mm, dan 5.0 mm (Gambar 9). Hasil pengujian inipun menunjukkan bahwa senyawa hasil biotransformasi lebih efektif terhadap Salmonella typhi daripada 4 bakteri uji lainnya.
Kurkumin sebagai senyawa asal pun diuji aktivitas antibakterinya sebagai pembanding dengan konsentrasi yang sama dengan senyawa hasil biotransformasinya yaitu 50 mg/mL. Diameter zona hambat yang dibentuk oleh kurkumin untuk E. coli,
S. aureus, B. subtilis, S. typhi, dan R. solanacearum berturut-turut adalah 3.7 mm,
3.3 mm, 2.3 mm, 4.7 mm, dan 2.7 mm. Hasil tersebut sesuai dengan penelitian Ross (1999) yang menyatakan bahwa kurkumin memiliki aktivitas paling tinggi untuk
Salmonella typhi (Gambar 9).
Senyawa hasil biotransformasi yang telah dimurnikan memiliki aktivitas antibakteri yang lebih tinggi daripada kurkumin untuk setiap bakteri uji. Aktivitas antibakterinya dua kali lebih tinggi daripada kurkumin dengan konsentrasi yang sama (Gambar 9). Peningkatan aktivitas antibakteri senyawa hasil biotransformasi tersebut diduga karena meningkatnya polaritas. Penelitian lain menyebutkan bahwa biotransformasi artemisinin menjadi deoksiartemisinin oleh Aspergillus flavus memiliki aktivitas antibakteri dua kali lebih
tinggi daripada senyawa asalnya karena peningkatan polaritas dari senyawa tersebut (Srivastava et al. 2009). Perkiraan struktur senyawa biotransformasi kurkumin adalah turunan kurkumin yang terhidrogenasi pada rantai alifatiknya. Menurut Somparn et al. (2007) hidrogenasi akan meningkatkan polaritas tetrahidrokurkumin. Hal tersebut diduga akan menyebabkan peningkatan afinitas dengan protein membran dan menjadikan tetrahidrokurkumin lebih stabil daripada kurkumin karena ikatan rangkapnya telah terputus (Venkatesan et al. 2002). Selain gugus fenol, kurkumin dan tetrahidrokurkumin juga memiliki dua gugus karbonil yang mempengaruhi aktivitas antibakterinya. Kurkumin akan meningkat aktivitas antibakterinya ketika salah satu gugus karbonil tersebut dihilangkan (Tajbakhsh et al. 2008).
Kurkumin dan senyawa hasil
biotransformasinya termasuk ke dalam golongan senyawa polifenol, oleh karena itu diduga memiliki mekanisme antibakteri yang sama, yaitu mendenaturasi protein membran. Denaturasi atau rusaknya protein membran akan mengubah permeabilitas membran dan menyebabkan kebocoran nutrisi pada sel bakteri sehingga sel tersebut mati (Madigan 2005). Selain itu kurkumin pun memiliki kemampuan untuk menipiskan dan mengubah fluditas membran (Hung et
al. 2008). Sehingga diduga bahwa senyawa
hasil biotransformasinya memiliki kemampuan yang sama. Aktivitas antibakteri kurkumin dan senyawa hasil biotransformasinya termasuk ke dalam golongan antibakteri sedang yaitu dengan diameter zona hambat antara 5-10 mm. Namun aktivitas antibakteri tersebut dipengaruhi oleh konsentrasi senyawa yang diujikan, suhu inkubasi, pH, dan jenis bakteri (Madigan 2005).
Gambar 9 Aktivitas antibakteri senyawa hasil biotransformasi. 0.0 4.0 8.0 12.0 16.0 20.0
E coli S aureus B subtilis S typhi R solanacearum
D ia m et er Z o n a H a m b a t (m m ) Bakteri Uji Amoksisilin Kurkumin
Ekstrak kasar (E1)
Ekstrak fraksinasi (E2)
10
SIMPULAN DAN SARAN
SimpulanSenyawa biotransformasi kurkumin dimurnikan dengan metode kromatografi kolom dan kromatografi lapis tipis preparatif (PLC). Hasil analisis pemurnian dengan kromatografi lapis tipis (KLT) menunjukkan spot tunggal dengan Rf 0.701. Rendemen ekstrak seyawa hasil biotransformasi murni adalah 2,66%.
Senyawa biotransformasi kurkumin memiliki aktivitas antibakteri pada 5 spesies bakteri uji dengan demikian senyawa tersebut bersifat sebagai antibakteri berspektrum luas. Bakteri yang paling sensitif terhadap senyawa hasil biotransformasi murni adalah Salmonella
typhi dengan diameter zona hambat 9.0 mm.
Pemurnian ekstrak senyawa hasil biotransformasi dapat meningkatkan aktivitas antibakteri. Senyawa hasil biotransformasi memiliki aktivitas antibakteri dua kali lebih tinggi daripada kurkumin dengan konsentrasi yang sama yaitu 50 mg/mL. Kurkumin dan senyawa biotransformasinya memiliki aktivitas antibakteri sedang karena diameter zona hambat yang terbentuk adalah 5-10 mm.
Saran
Perlu dilakukan penentuan konsentrasi
hambat tumbuh minimum (KHTM)
menggunakan metode dilusi maupun difusi, dan penentuan toksisitas akut untuk menentukan dosis yang aman untuk dikonsumsi oleh manusia.
DAFTAR PUSTAKA
Babu KN, Ravindran PN, Sivaraman. 2007.
Turmeric Genus Curcuma. Florida:
CRC Pr.
Bermawie N. 2006. Mengatasi demam berdarah dengan tanaman obat.
Warta Penelitian dan Pengembangan Pertanian 28: 6-8.
Carbal MS. 2002. Basic Biotechnology. Edisi ke-2. Cambridge: Cambridge University Pr.
Cikrici S, Mozioglu E, Yilmaz H. 2008. Biological activity of curcuminoids from Curcuma longa. J Nat Prod 2: 19-24.
Chattopadhyay I, Biswas K, Bandyopadhyay U, Banerjee RK. 2004. Turmeric anc curcumin: Biological actions and medicinal applications. Sci 87: 44-53.
Craig LC, Gregory JD, Hausmann W. 1950. Versatile laboratory concentration device. J Anal Chem 22: 1462. Hadioetomo RS. 1993. Mikrobiologi Dasar
dalam Praktek. Jakarta: Gramedia.
Hoftamann E. 2004. Chromatography:
Fundamental and Techniques.
Uppsala: Elsevier.
Hung WC, Chen FY, Lee CC, Sun Y, Huang HW. 2008. Membrane-thinning effect of curcumin. J Biophys 94: 4331-4338.
Joe B, Vijaykumar M, Lokesh BR. 2004. Biological properties of curcumin cellular and molecular mechanisms of action. Physiol 44: 97-111. Khopkar SM. 2003. Konsep Dasar Kimia
Analitik. Penerjemah: Saptorahardjo A. Jakarta: UI Pr. Kloppenburgh. 2006. Tanaman Berkhasiat
Indonesia. Penerjemah: Soegiri J.
Bogor: IPB Pr.
Lu H, et al. 1995. New bioactive metabolites produced by Colletrotricum sp, an endophytic fungus in Artemisia
annua. Plant Sci 151:67-73.
Madigan M. 2005. Brock Biology of
Microorganisms. London:
Prentice-Hall.
Neal MJ. 2002. Medical Pharmacology at A
Glance 4th Ed. Oxford: Blackwell Science.
Oomah BD. 2000. Herbs, Botanicals, and
Teas. Pennsylvania: Technomic.
Pan MH, Huang TM, Lin JK. 1999. Biotransformation of curcumin
through reduction and
glucoronidation in mice.
Pharmacol 27: 486-494.
Pelczar MJ, Chan ECS. 2005. Dasar-dasar
Mikrobiologi. Hadioetomo RS, Imas T, Tjitrosomo SS, angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
11
Radji M. 2005. Peranan bioteknologi dan
mikroba endofit dalam
pengembangan obat herbal. Ilmu
Kefarmasian. 3: 113-126.
Riyadh M. 2008. Uji aktivitas hepatoprotektor senyawa hasil biotransformasi kurkumin oleh kapang endofit rimpang kunyit (Curcuma longa Linn.). [skripsi]. Bogor: Sekolah Tinggi Teknologi Industri dan Farmasi.
Rosazza. 2000. Microbial Transformation of
Bioactive Compounds. Volume
ke-1. Florida: CRC Pr.
Ross I. 1999. Medicinal Plants of The
World. New Jersey: Humana Pr.
Salo P. 2007. Thin-layer chromatography with ultraviolet and mass spectrometric detections: from preparative-layer to miniaturized ultrathin-layer technique. [disertasi]. Helsinki: University of Helsinki.
Sandur KS et al. 2007. Curcumin, demethoxycurcumin,
bidesmethoxycurcumin,
tetrahydrocurcumin, and turmerous
differentially regulate
antiinflammatory and
antiproliferate responses.
Carsinogenesis 28: 1765-1773.
Simanjuntak P et al. 2002. Biotransformasi senyawa alkaloid kinkona oleh kapang Xylaria sp. menjadi alkaloid kinkona N-oksida.
Majalah Farmasi Indonesia 13:
95-100.
Somparn P, Phisalaphong C, Nakornchay S, Uncheern S, morales NP. 2007. Comparative antioxidant activity of curcumin and its demethoxy and hydrogenated derivates. Bul Biol
Pharm 30:74-78.
Srivastava S, et al. 2009. Biotransformation of artemisinin mediated through fungal strains for obtaining derivatives with novel activities.
Pharm Sci 77: 87-95
Strobel G, B. Daisy. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiol Mol
Biol Rev 67: 491-502.
Stoddard JM, et al. 2007. TLC plates as a convenient platform for solvent-free reactions. Anal Chem 2:1240 – 1241. Tajbakhsh S et al. 2008. Antibacterial
activity of indium curcumin and indium diacetylcurcumin. J Biotechnol 7: 3832-3835.
Tan RX, WX. Zou. 2001. Endophytes: a rich source of functional metabolites.
Nat Prod Rep. 18: 448-459.
Tanaka M et al. 1999. Isolation, screening, and phylogenetics identification of endophytes from plants in Hokkaido Japan and Java Indonesia. J Microbes and Environments 14: 231-241.
Venkatesan P, Unnikrishnan MK, Kumar MS, Rao MNA. 2002. Effect of curcumin analogues on oxidation of haemoglobin and lysis of erythrocytes. Biochemistry 84: 74-78.
Verza M, Arakawa NS, Lopes NP, Kato MJ, Pupo MT. 2009. Biotransformation of tetrahydrofuran lignan by the endophytic fungus Phomopsis sp. J
Chem Soc 20: 195-200.
White J. 1991. Procaryotic Physiology. London: Prentice Hall.
12
13
Lampiran 1 Tahapan produksi senyawa hasil biotransformasi
Peremajaan isolat kapang endofit kunyit Cl. Bel. 5F
Prekultur dan inkubasi selama 3 hari
Inokulasi ke media kultur dan inkubasi selama 3
hari
Penambahan larutan kurkumin
Inkubasi selama 10 hari
Ekstraksi dengan etil asetat
Pemekatan ekstrak kasar senyawa biotrannsformasi
14
Lampiran 2 Tahapan pemurnian senyawa hasil biotransformasi
Lampiran 3 Nilai rendemen pemurnian senyawa hasil biotransformasi
Bobot ekstrak kasar senyawa biotransformasi kurkumin = 1500 mg
Bobot ektrak senyawa biotransformasi setelah fraksinasi = 150 mg
Bobot ekstrak senyawa biotransformasi murni = 40 mg
I.
Rendemen fraksinasi
150
1500 × 100% = 10%
II. Rendemen KLT preparatif
40
1500 × 100% = 2.66%
Homogenisasi ekstrak dengan celit Penyiapan kolom kromatografi Fraksinasi dengan kromatografi kolom gradien eluen Analisis KLT dan penggabungan fraksiIsolasi fraksi yang mengandung senyawa hasil biotransformasi dengan KLT preparatif
15
Lampiran 4 Tahapan pengujian aktivitas antibakteri senyawa hasil
biotransformasi
Lampiran 5 Diameter zona hambat senyawa hasil biotransformasi
Bakteri Uji Diameter Zona Hambat (mm)
E1 E1 Rataan E2 E2 Rataan E3 E3 Rataan
Escherichia coli 4,0 6,0 5,0±1,41 6,0 7,0 6,5±0,71 7,0 7,0 7,0±0,00
Staphylococcus aureus 5,0 5,0 5,0±0,00 5,0 6,0 5,5±0,71 6,0 6,0 6,0±0,00
Bacillus subtilis 5,0 4,0 4,5±0,71 5,0 7,0 6,0±1,41 6,0 5,0 5,5±0,71
Salmonella typhi 8,0 8,0 8,0±0,00 8,0 8,0 8,0±0,00 9,0 9,0 9,0±0,00
Ralstonia solanacearum 3,0 4,0 3,5±0,71 4,0 5,0 4,5±0,71 4,0 6,0 5,0±1,41 Peremajaan bakteri uji
Inokulasi ke media NB dan SPB, inkubasi 18-24 jam 37ºC Inokulasi ke media NA dan SPA Pengujian sampel
Ekstrak kasar senyawa hasil biotransfomasi
kurkumin (E1)
Ekstrak senyawa hasil biotransformasi kurkumin setelah
fraksinasi (E2)
Ekstrak senyawa hasil biotransformasi kurkumin setelah
isolasi (E3)
Pengamatan zona bening setelah inkubasi
16
Lampiran 6 Diameter zona hambat amoksisilin dengan konsentrasi 1 mg/mL
Bakteri uji
Diameter Zona Hambat (mm)
A A A
Rataan
Escherichia coli
7,0
7,0
7,0
7,0±0,00Staphylococcus aureus
5,0
6,0
7,0
6,0±1,00Bacillus subtilis
20,0
19,0
18,0
19,0±1,00Salmonella typhi
12,0
12,0
11,0
11,7±0,57Ralstonia solanacearum
0,0
0,0
0,0
0,0Lampiran 7 Diameter zona hambat kurkumin dengan konsentrasi 50 mg/mL
Bakteri uji
Diameter Zona Hambat (mm)
K
K
K
Rataan
Escherichia coli
4,0
4,0
3,0
3,7±0,57
Staphylococcus aureus
4,0
3,0
3,0
3,3±0,57
Bacillus subtilis
2,0
3,0
2,0
2,3±0,57
Salmonella typhi
4,0
5,0
5,0
4,7±0,57
Ralstonia solanacearum
2,0
3,0
3,0
2,7±0,57
Lampiran 8 Zona hambat ekstrak kasar senyawa hasil biotransformasi
*A: Amoksisilin; K: Kurkumin; E1: Ekstrak kasar senyawa hasil biotransformasi.
E. coli S. aureus B. Subtilis
17
Lampiran 9 Zona hambat ekstrak senyawa hasil biotransformasi setelah fraksinasi
*A: Amoksisilin; K: Kurkumin; E2: Ekstrak senyawa hasil biotransformasi
setelah fraksinasi.
Lampiran 10 Gambar zona hambat ekstrak senyawa hasil biotransformasi setelah
isolasi
*
A: Amoksisilin; K: Kurkumin; E3: Ekstrak senyawa hasil biotransformasi setelah
isolasi.
E. coli S. Aureus B. subtilis
S. typhi R. solanacearum
E. coli S. aureus B. subtilis
18
Lampiran 11 Pengujian metanol dan etil asetat terhadap pertumbuhan bakteri
Lampiran 12 Spektrum proton NMR senyawa hasil biotransformasi
19