KONSTRUKSI DNA REKOMBINAN pCAMBIA
1303-STILBENA SINTASE PENCEGAH BUSUK AKAR KELAPA
SAWIT
EMBI LILIS
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
EMBI LILIS. Konstruksi DNA Rekombinan pCAMBIA 1303-Stilbena Sintase
Pencegah Busuk Akar Kelapa Sawit. Dibimbing oleh I MADE ARTIKA dan
TETTY CHAIDAMSARI.
Kelapa sawit merupakan komoditas perkebunan yang penting di Indonesia.
Namun usaha peningkatan produksi kelapa sawit memiliki hambatan. Salah satu
hambatan itu adalah adanya penyakit busuk akar yang disebabkan oleh
Ganoderma spp
. Pendekatan baru untuk memperoleh kelapa sawit yang tahan
terhadap serangan
Ganoderma
adalah dengan menyisipkan gen penghasil zat
yang berfungsi sebagai antijamur. Salah satu gen penghasil zat antijamur adalah
gen stilbena sintase yang berasal dari anggur (
Vitis vinifera
). Tujuan penelitian ini
adalah mengklon gen stilbena sintase pada vektor ekspresi pCAMBIA 1303
diantara promotor CaMV 35S. Gen stilbena sintase diklon terlebih dahulu ke
dalam vektor ekspresi pCAMBIA 1303, kemudian ditransformasikan ke
Eschericia coli XL-1 Blue
dan selanjutnya dimasukkan kedalam
Agrobacterium
tumefaciens
. Hasil penelitian membuktikan bahwa gen stilbena sintase telah
berhasil diklon ke dalam vektor pCAMBIA 1303. Hasil ini ditunjukkan oleh
terbentuknya dua pita pada gel elektroforesis masing-masing berukuran 12000 bp
(plasmid pCAMBIA 1303) dan 1500 bp (gen stilbena sintase) setelah dipotong
dengan enzim
Spe1
dan
Nco1
.
ABSTRACT
EMBI LILIS. The Construction of pCAMBIA 1303-Stilbene Syntase
Recombinant DNA Preventive for Rotten Root Disease of Oil Palm. Under the
direction of I MADE ARTIKA and TETTY CHAIDAMSARI.
An oil palm is one of the important estate commodities in Indonesia.
Nevertheless the effort to increase its productivity has many hindrances. One of
them is rotten root disease caused by
Ganoderma spp
. New approach to get
resistence oil palm toward
Ganoderma
attack is to insert gene produces substance
played role as an antifungi. One of genes that produces antifungi is stilbene
syntase gene derived from grapes (
Vitis vinifera
). The purpose of this research is
to cloning stilbene syntase gene on to pCAMBIA 1303 expression vector between
35S CaMV promoter. Stilbene syntase gene was cloned on to pCAMBIA 1303
expression vector then to be transformed on to
Escherichia coli
XL-1
Blue
and the
last to be inserted on to
Agrobacterium tumefaciens
. The result of this research
shows stilbene syntase gene was successful to be cloned to pCAMBIA 1303. This
result was showed by two band sized 12000 bp (pCAMBIA 1303 plasmid) and
1500 bp (stilbene syntase gene) in agarose gel after have been restricted with
SpeI
KONSTRUKSI DNA REKOMBINAN pCAMBIA
1303-STILBENA SINTASE PENCEGAH BUSUK AKAR KELAPA
SAWIT
EMBI LILIS
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul : Konstruksi DNA Rekombinan pCAMBIA 1303-Stilbena Sintase
Pencegah Busuk Akar Kelapa Sawit
Nama : Embi Lilis
NIM : G84052166
Disetujui
Dr. Ir. I Made Artika, M.App. Sc. Dr. Tetty Chaidamsari,M.Si.
Ketua Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
RIWAYAT HIDUP
Penulis dilahirkan di Cianjur pada tanggal 11 Mei 1986 dari pasangan H.
Marjuk dan Hj. Nurjanah. Penulis merupakan anak keempat dari empat
bersaudara.
Pendidikan penulis dimulai dari SDN Karang Anyar Sukaresmi Cianjur
hingga lulus tahun 1999. Kemudian penulis melanjutkan pendidikan ke SMPN 1
Sukaresmi Cianjur dan lulus tahun 2002. Tahun 2005 penulis lulus dari SMA
Negeri 1 Sukaresmi Cianjur dan melanjutkan pendikannya ke Institut Pertanian
Bogor Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif dalam kegiatan-kegiatan
organisasi kemahasiswaan diantaranya penulis aktif di Lembaga Dakwah Fakultas
MIPA (Serum G) dan CREBs. Penulis juga aktif mengikuti beberapa acara
kepanitiaan di IPB seperti
politic expose
2006/2007 dan masa pengenalan
departemen Biokimia 2007/2008. Penulis melakukan Praktik Lapangan di PT
Gizindo Primanusantara Padalarang, Bandung.
PRAKATA
Puji syukur kehadirat Allah SWT atas rahmat dan ridhaNya sehingga
penulis dapat menyelesaikan Karya Ilmiah ini. Penelitian ini dilaksanakan pada
bulan Februari sampai dengan Juli 2009 di Laboratorium Biologi Molekuler Balai
Penelitian Bioteknologi Perkebunan Indonesia. Penelitian ini berjudul Konstruksi
DNA Rekombinan pCAMBIA 1303-Stilbena Sintase Pencegah Busuk Akar
Kelapa Sawit.
Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah
membantu penyusunan Karya Ilmiah ini terutama kepada Ibu Dr. Tetty
Chaidamsari, M.Si dan Bapak Dr. Ir. I Made Artika, M.App. Sc, selaku
pembimbing, Teh Herti, dan Teh Nina serta seluruh staf Laboratorium Biologi
Molekular. Ucapan terima kasih juga penulis sampaikan kepada Tri, Nunung,
Saeli, Jimy, Wiwin, Mba Ratna, Yoanita, Dwi dan teman-teman Biokimia 42 atas
motivasinya. Tak lupa penulis sampaikan terima kasih kepada Ibu, Bapak, Aa,
Teteh, atas doa dan kasih sayang yang selalu menyertai. Semoga Karya Ilmiah ini
dapat bermanfaat.
Bogor, Oktober 2009
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN... vi
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Kelapa Sawit ... 1
Stilbena Sintase ... 2
Vektor Pengklonan pGEM-T
Easy
...
.
2
Vektor Ekspresi pCambia 1303. ... 3
Rekombinasi DNA... 3
Polimerase Chain Reaction
(PCR) ... 4
Elektroforesis Gel Agarosa untuk Analisis Fragmen... . 5
BAHAN DAN METODE
Alat dan Bahan... 5
Metode...
5
HASIL DAN PEMBAHASAN
Purifikasi dan Pengujian Produk PCR (stilbena sintase) ... 8
Kloning Gen Stilbena Sintase ke pGEM-T
Easy...
8
Urutan Nukleotida Gen Stilbena Sintase... 9
Kloning Gen Stilbena Sintase ke dalam Vektor Ekspresi
pCAMBIA 1303... 10
Transformasi pCAMBIA 1303-Stilbena Sintase ke dalam
Agrobacterium tumefaciens...
12
SIMPULAN DAN SARAN ... 13
DAFTAR PUSTAKA ... 14
DAFTAR GAMBAR
Halaman
1 Kelapa sawit (
Elaeis guineensis
Jacq) ... 1
2 Kelapa sawit yang terkena penyakit busuk akar... 2
3 Profil vektor pengklonan pGEM-T easy ... 2
2 Hasil purifikasi gen stilbena sintase sebagai produk PCR ... 8
5 Koloni biru putih hasil transformsi pGEM-T
Easy
ke
Escherichia coli
XL-1
Blue
... 9
6 Hasil PCR koloni gen stilbena sintase ... 9
7 Hasil pemotongan pGEMT-
Easy
dan STS menggunakan
enzim restriksi
Spe 1
dan
Nco1
... 10
8 Hasil pemotongan pCAMBIA 1303 dengan enzim
Nco1 dan Spe1
... 11
9 Hasil purifikasi pCAMBIA 1303... 11
10 Hasil transformasi DNA rekombinan pCAMBIA 1303-stilbena sintase
ke dalam
Escherichia coli
XL-1
Blue
... 12
11 Hasil pemotongan pCAMBIA 1303-STS dengan enzim
Spe1
dan
Nco1...
12
12 Hasil transformasi DNA rekombinan pCAMBIA 1303-STS ke
Agrobacterium tumefaciens...
13
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 16
2 Prosedur elektroforesis gel agarosa ... 17
3 Komposisi larutan sediaan... 18
4 Prosedur kerja isolasi plasmid dengan kit dari Qiagen ... 20
5 Elektroforegram hasil sekuensing... 21
6 Hasil analisis BLASTX fragmen gen stilbena sintase
...
22
PENDAHULUAN
Kelapa sawit merupakan tanaman komoditas perkebunan yang penting di Indonesia dan masih memiliki prospek pengembangan yang cukup bagus. Komoditas kelapa sawit, baik berupa bahan mentah maupun hasil olahannya, menduduki peringkat ketiga penyumbang devisa nonmigas terbesar bagi Indonesia setelah karet dan kopi (Lubis , 1992). Akan tetapi, usaha peningkatan produksi kelapa sawit memiliki hambatan yang diakibatkan oleh hama dan penyakit, antara lain disebabkan oleh cendawan patogenik Ganoderma spp. Cendawan ini menyebabkan penyakit busuk akar. Penyakit busuk akar merupakan penyakit pada kelapa sawit yang sulit ditanggulangi (Lubis 1992).
Pendekatan yang umum dilakukan dalam pengendalian penyakit tersebut adalah dengan cara mekanis, kimia dan hayati. Cara mekanis dilakukan dengan membersihkan sumber infeksi sebelum tanam dan menghindari pelukaan pada batang dan akar, namun ternyata pendekatan ini dianggap kurang ekonomis karena masih banyak generasi tanaman baru yang terkena infeksi Ganoderma spp. Pendekatan kimia menggunakan fungisida, diantaranya fungisida Tridemorph atau Triadimenol 50 ppm dan Bayfidan 10 ppm. Fungisida ini dapat membunuh miselium Ganoderma secara in vitronamun pemberian fungisida pada perkebunan kelapa sawit ternyata sulit dilakukan karena areal kelapa sawit yang luas dan menimbulkan dampak negatif terhadap lingkungan. Cara hayati dilakukan dengan menggunakan biofungisida Trichoderma dan Penicilium namun daya bunuh biofungisida relatif lebih lama dibandingkan dengan senyawa kimia yang biasa digunakan sebagai fungisida (Lubis 1992).
Solusi yang paling tepat untuk pengendalian penyakit ini adalah melalui program pemuliaan tanaman dengan menemukan gen-gen yang tahan terhadap Ganoderma baik yang berasal dari inter-spesies maupun antar-inter-spesies tetapi hingga saat ini tanaman tersebut belum pernah ada. Oleh karena itu, diperlukan pendekatan baru untuk memperoleh kelapa sawit yang tahan terhadap seranganGanoderma. Upaya yang dilakukan adalah dengan menyisipkan gen penghasil zat yang berfungsi sebagai anti jamur salah satunya adalah gen stilbena sintase (STS) yang berasal dari anggur (Vitis vinifera).
Tujuan Penelitian ini adalah mengklon gen stilbena sintase (STS) ke dalam vektor ekspresi pCAMBIA 1303 diantara promotor CAMP 35S. Hipotesis dari penelitian ini adalah gen stilbena sintase (STS) yang berasal dari anggur dapat diklon ke dalam vektor pCAMBIA 1303. Pendekatan bioteknologi melalui transfer gen stilbena sintase (STS) diharapkan mampu menghasilkan bibit transgenik kelapa sawit yang toleran terhadap Ganoderma spp.
TINJAUAN PUSTAKA
Kelapa SawitKelapa sawit (Elaeis guineensis Jacq) berasal dari Afrika. Tanaman ini dikenal di Indonesia sejak tahun 1848, namun baru ditanam secara komersial pada tahun 1911.Elaeis berasal dari kata Elaion (bahasa Yunani) yang berarti minyak, sedangkan guineensis berasal dari Guinea yaitu nama pantai barat Afrika, dan Jacq adalah nama penemu kelapa sawit yaitu Jacquis. Kelapa sawit termasuk divisi trancheophyta, kelas monocotyledoneae, ordo cocoideae, famili palmae, spesies Elaeis guineensisJacq (Gambar 1).
Upaya peningkatan produksi kelapa sawit memiliki beberapa hambatan. Salah satu hambatan untuk meningkatkan produksi kelapa sawit adalah adanya gangguan penyakit yang disebabkan olehGanoderma spp. Ganoderma adalah jamur yang menyebabkan penyakit busuk akar. Penyakit ini sampai saat ini belum dapat dikendalikan dengan baik.
Gambar 1 Kelapa sawit (Elaeis guineensis Jacq).
Gambar 2 Kelapa sawit yang terkena penyakit busuk akar.
Gejala awal penyakit ini adalah pelepah daun yang berada di pucuk berwarna pucat seperti kekurangan hara kemudian daun mengalami nekrosis yang dimulai dari daun tua ke daun yang lebih muda, pelepah daun akan patah dan menggantung. Selain itu, pelepah daun muda tidak membuka dan terkumpul lebih banyak dari biasanya. (Gambar 2). Umumnya 6-12 bulan setelah gejala terakhir tanaman akan mati. Infeksi terjadi karena kontak akar yang sakit (Lubis 1992).
Stilbena Sintase
Stilbena sintase merupakan gen yang berperan sebagai pengendali resveratrol. Resveratrol merupakan pitoaleksin yang paling lama dan intensif diteliti dalam hubungannya dengan mekanisme ketahanan suatu tanaman terhadap serangan jamur patogen. Resveratrol (trans 3,4,5-trihidroksistilbena) merupakan pitoaleksin dengan berat molekul rendah dan bersifat nonprotein yang terbentuk bila tanaman terinduksi oleh patogen. Pitoaleksin merupakan metabolit sekunder yang bersifat antimikrobial (Ingham 1973).
Beberapa varietas tanaman diketahui memiliki kandungan resveratrol tinggi secara alami, seperti anggur, kacang tanah dan pinus. Kandungan resveratrol di daun anggur sebesar 400 µg g-1 per berat segar. Konsentrasi sebesar ini menyebabkan tanaman anggur resisten terhadap serangan jamur (Sbaghiet al. 1995).
Biosintesis stilbena (resveratrol) dapat berlangsung bila tersedia enzim
stilbena sintase yang mengatalisis pembentukan stilbena hidroksi yang berasal dari malonil CoA dan p-Coumaroyl CoA. Tanaman tembakau, tomat, alfafa dan varietas anggur rentan yang disisipi gen tersebut terbukti resisten terhadap berbagai patogen jamur (Hainet al. 1993).
Vektor Pengklonan pGEM-TEasy Plasmid pGEM-TEasy(Gambar3) merupakan plasmid sirkular terbuka, memiliki dua buahorigin of replication dan gen ketahanan terhadap ampisilin (Amp). Plasmid ini mengandungmulty cloning site. Karena memiliki kelebihan timin yang menggantung di ujung terbuka plasmid ( T overhang), plasmid ini sering dipakai sebagai vektor untuk produk PCR yang selalu memiliki kelebihan adenin pada ujungnya tanpa memerlukan tahapan pemotongan terlebih dahulu. Plasmid pGEM-TEasy juga termasuk plasmid high copy number yang cocok untuk menyimpan gen insert dalam suatu inang (Kendrew & Lawrence 1994). Selain itu, pGEM-TEasy merupakan vektor yang berukuran kecil yaitu 3015 bp. Ukuran tersebut relatif kecil sehingga vektor dapat membawa DNA target cukup banyak dan memudahkan preparasi DNA sisipan dalam jumlah besar. Vektor berukuran kecil lebih mudah dimasukkan ke dalam sel inang dan lebih mudah dimurnikan karena cenderung tidak rapuh dibandingkan dengan vektor berukuran besar ( Sambrooket al. 1991).
Gambar 3 Profil vektor pengklonan pGEM-TEasy.
Vektor Ekspresi pCAMBIA 1303 DNA vektor adalah molekul DNA yang dapat bereplikasi secara mandiri dan dapat digunakan sebagai pembawa molekul DNA lain yang tidak memiliki kemampuan bereplikasi sendiri di dalam sel. DNA yang sering digunakan adalah plasmid bakteri. Plasmid adalah bahan genetik ekstrakromosom yang diwariskan secara tetap. Ciri-ciri plasmid antara lain berukuran kecil dan hanya mengandung beberapa gen, membawa informasi genetik, terlepas dari DNA kromosom atau kadang-kadang dapat berintegrasi dengan DNA kromosom, dan dapat diisolasi dengan mudah dari sel bakteri. Ciri lain plasmid adalah mempunyai situs untuk memulai replikasi yang disebut ORI (origin of replication) (Nicholl 1994)
Plasmid pCAMBIA 1303 merupakan plasmid yang dikonstruksi sebagai vektor DNA dalam metode transformasi langsung dan menggunakan Agrobacterium tumefaciens. Plasmid pCAMBIA 1303 mengandung promotor CaMV 35S (cauliflower mosaic virus). Promotor ini berhubungan dengan urutan yang terpoliadenilasi pada T-DNA plasmid. Hal ini memungkinkan pembuatan klon langsung ke dalam T-DNA plasmid. Tersedianya promotor aktif yang kuat sangat diperlukan untuk ekspresi suatu gen pada tanaman baik monokotil maupun dikotil. Beberapa hasil penelitian menyatakan bahwa CaMV35S adalah promotor konstitutif yang aktif pada sel tanaman monokotil akan tetapi kekuatannya sedikit menurun pada sel tumbuhan dikotil dan tidak aktif pada beberapa tipe sel seperti pollen (Tzfira & Citovsky 2002). Selain itu, pCAMBIA 1303 mempunyai gengusA. Gen gusA ( -glucuronidase) dalam plasmid pCAMBIA 1303 berfungsi sebagai gen reporter untuk memonitor proses transformasi dan introduksi gen yang direkayasa (Tzfira & Citovsky 2002).
Rekombinasi DNA
Rekombinasi DNA adalah pembentukan kombinasi baru dari materi pembawa informasi genetik. Rekombinasi dilakukan dengan melakukan penyisipan molekul asam nukleat yang dikerjakan di luar sel ke suatu vektor dan dibawa masuk ke dalam sel inang. Rekombinasi DNA memerlukan adanya vektor dan enzim-enzim. Enzim yang umum digunakan adalah enzim nuklease, ligase, polimerase dan enzim modifikasi (Brown 1991).
Enzim nuklease adalah enzim yang mendegradasi DNA dengan memecah ikatan fosfodiester yang menghubungkan satu nukleotida dengan nukleotida lainnya pada urutan DNA. Enzim nuklease terdiri atas endonuklease dan eksonuklease. Eksonuklease memecah nukleotida satu per satu dari ujung rantai DNA sementara endonuklease memecah ikatan fosfodiester di tengah-tengah pada rantai DNA. Salah satu contoh endonuklease adalah endonuklease restriksi. Endonuklease restriksi merupakan enzim bakteri yang memotong DNA utas ganda hanya pada tempat pengenalan spesifik. Aktivitas enzim restriksi dipengaruhi oleh kemurnian DNA, buffer, dan temperatur. Enzim restriksi membutuhkan NaCl, Mg2+, dan terkadang ditriotreitol (DDT) sebagai pereduksi. Sifat hasil pemotongan DNA oleh enzim nuklease ini ada dua yaitu (1) ujung tumpul (blunt end) terjadi karena enzim membuat potongan utas ganda yang sederhana pada pertengahan urutan pengenal dan (2) ujung lengket (sticky end) terjadi karena enzim restriksi menghasilkan potongan berbentuk zig zag atau dengan belok tajam melalui dua atau empat nukleoitida. Salah satu contoh endonuklease restriksi adalahSpe1danNco1 (Brown 1991). Situs pemotongan enzim Spe1 adalah di antara basa AC pada urutan basa ACTAGT sedangkan situs pemotongan enzim Nco1 adalah di antara basa CC pada urutan CCATGG. Sifat hasil pemotongan dari kedua ujung ini adalah ujung lengket.
Enzim kedua dari kelompok enzim manipulasi DNA adalah enzim ligase. Enzim ligase berfungsi menyambungkan utas DNA. Penyambungan DNA terjadi jika nukleotida yang satu mempunyai gugus 5’ fosfat dan nukleotida yang lain terdiri atas gugus 3’ hidroksil. Ujung lengket yang komplementer jauh lebih efisien dibandingkan dengan ujung tumpul pada proses ligasi karena ujung-ujung lengket yang cocok dapat saling berpasangan dengan ikatan hidrogen (Brown 1991).
Enzim yang ketiga adalah enzim polimerase. Menurut Brown (1991) enzim polimerase adalah enzim yang dapat mensintesis DNA baru. Enzim polimerase ini dibagi menjadi tiga jenis, yaitu polimerase DNA 1, polimerase klenow, dan polimerase transkriptase reversi. Polimerase DNA 1 melekat pada untaian DNA tunggal yang pendek dan mensintesis DNA baru sekaligus mendegradasi DNA yang ada. Enzim polimerase klenow dapat mensisntesis DNA komplementer hanya pada cetakan DNA tunggal. Jenis enzim
yang ketiga yaitu polimerase transkriptase reversi dapat membentuk untaian DNA dengan menggunakan RNA sebagai cetakan. Enzim yang keempat adalah enzim modifikasi. Enzim modifikasi adalah enzim yang dapat menambahkan dan menghilangkan gugus kimia. Salah satu contoh enzim ini adalah calf intestinal alkaline phosphatase (CIAP). Enzim ini mengatalisis pemindahan gugus 5’ fosfat dari DNA . Pemindahan gugus 5’ fosfat bertujuan mencegah terjadinya penyambungan intramolekul (Kendrew & Lawrence 1994).
Tahap-Tahap Rekombinasi DNA
Secara umum rekombinasi DNA dilakukan sebanyak 6 tahap. Tahap pertama merupakan tahap isolasi fragmen DNA dan DNA vektor, masing-masing DNA dapat diisolasi dari bakteri. Setelah diisolasi, fragmen DNA dan DNA vektor dipotong dengan enzim restriksi yang sama. Tahap selanjutnya adalah penggabungan fragmen DNA dengan DNA vektor. Tahap ini biasanya disebut tahap ligasi. Penggabungan DNA ini biasanya dibantu oleh enzim ligase. Hasil tahap ligasi adalah terbentuknya DNA rekombinan (fragmen DNA dengan DNA vektor).
Tahap ketiga dari rekombinasi DNA adalah transformasi DNA rekombinan ke bakteri. Transformasi adalah proses memasukkan DNA asing ke dalam sel inang. Tahap keempat adalah seleksi sel inang yang telah mengalami transformasi dan telah mengandung DNA rekombinan. Inang yang telah mengalami transformasi dan telah mengandung DNA rekombinan dapat diseleksi berdasarkan gen penanda (selectable marker) yang dibawa oleh plasmid. Gen penanda yang biasa digunakan adalah gen yang tahan terhadap antibiotik tertentu.
Tahap selanjutnya adalah transformasi ke sel target. Tahap terakhir dari rekombinasi DNA adalah meneliti gen yang diklon. Kegiatan ini ditekankan pada cara mendapatkan informasi mengenai lokasi gen, struktur gen, cara gen ditranskripsi, dan produk translasi yang dikode oleh gen (Brown 1991).
Polymerase Chain Reaction (PCR)
Teknik PCR merupakan salah satu komponen utama teknologi DNA rekombinan dan pertama kali ditemukan oleh Kary B. Mulis pada tahun 1983. Teknik ini merupakan amplifikasiin vitrosejumlah
sekuens DNA dengan menggunakan 2 oligonukleotida sebagai primer yang berhibridisasi secara berlawanan pada sisi daerah target utas DNA yang diinginkan (Old & Primrose 1994). PCR mampu mengamplifikasi secara selektif sekuens DNA spesifik dengan faktor 106, hal inilah yang membuat penggunaan teknik PCR semakin meluas disamping kesederhanaan metodenya (Saiki 1989).
Reaksi PCR adalah tiruan dari proses replikasi DNA, yaitu dengan adanya pembukaan rantai DNA utas ganda, penempatan primer, dan perpanjanagan rantai DNA baru oleh DNA polimerase dari arah 5’ ke 3’, hanya saja pada teknik PCR tidak menggunakan enzim ligase dan primer RNA. Secara ringkas, teknik PCR dilakukan dengan cara mencampurkan sampel DNA dengan primer oligonukleotida, deoksiribonukleotida trifosfat, enzim termostabil Taq DNA polimerase dalam larutan yang sesuai, kemudian menaikkan dan menurunkan suhu campuran secara berulang selama beberapa jam sampai diperoleh jumlah sekuen DNA yang diinginkan.
Satu siklus pada teknik PCR terdiri atas tiga tahap, yaitu denaturasi, annealing dan ekstensi. Denaturasi dilakukan pada suhu 90-95 oC, sehingga terjadi pemisahan utas ganda DNA menjadi dua utas tunggal DNA yang menjadi cetakan (template) tempat penempelan primer dan tempat kerja DNA polimerase. Selanjutnya suhu diturunkan untuk penempelan primer oligonukleotida pada sekuen yang komplementer pada molekul DNA cetakan. Tahap ini disebut annealing. Suhu annealing tiap sekuen DNA sifatnya spesifik dan merupakan penentu utama keberhasilan suatu reaksi PCR. Tahap terakhir adalah tahap ekstensi yang dilakukan pada suhu 72
o
C. Suhu ini merupakan suhu optimum untuk kerja enzim Taq DNA polimerase. Sintesis DNA komplemen dengan DNA cetakan terjadi pada rahap ekstensi. Ketiga tahap tersebut disusun berulang kali dalam mesin PCR, umumnya antara 25-40 siklus, bergantung pada jumlah DNA yang diinginkan
Primer oligonukleotida yang digunakan dalam teknik PCR harus memenuhi beberapa syarat, antara lain memiliki susunan basa yang acak, sehingga tidak terjadi polipurin atau polipirimidin, memiliki jumlah purin dan pirimidin yang seimbang, memiliki titik leleh saling mendekati satu sama lain, dan sedikit mungkin memiliki basa yang komplementer.
Panjang primer yang umum digunakan berkisa
r
20-30 basa (Saiki 1989).Elektroforesis Gel Agarosa untuk Analisis Fragmen
Elektroforesis merupakan pergerakan zat bermuatan listrik akibat adanya pengaruh medan listrik. Molekul DNA termasuk senyawa bermuatan negatif. Sifat ini menjadikan molekul DNA yang ditempatkan pada medan listrik akan bermigrasi menuju kutub positif. Kecepatan migrasi molekul DNA tergantung pada konsentrasi gel yang digunakan, ukuran molekul yang dianalisis, serta tegangan listrik yang diberikan. Salah satu gel yang dapat digunakan pada elektroforesis adalah gel agarosa. Agarosa digunakan untuk memisahkan, mengidentifikasi, dan memurnikan fragmen-fragmen DNA (Sambrooket al.1989).
Mobilitas fragmen DNA pada gel elektroforesis sangat dipengaruhi oleh komposisi dan kelarutan ion buffer elektroforesis. Jika konsentrasi ion-ion sangat sedikit maka konduktifitas listrik sangat kecil dan migrasi DNA menjadi lambat. Konsentrasi ion yang berlebih akan mengakibatkan gel mencair dan DNA terdenaturasi. Selain buffer elektroforesis, teknik elektroforesis DNA juga memerlukan loading buffer. Buffer ini berfungsi meningkatkan densitas sampel sehingga fragmen tersebut berada di dasar well dan tidak menyebar. Fungsi lainnya adalah memberi warna pada fragmen DNA sehingga mempermudah pengamatan proses elektroforesis. Buffer ini dapat juga membantu pergerakan sampel ke anoda. Ukuran fragmen DNA hasil pemotongan dengan endonuklease restriksi dapat ditentukan dengan memakai penanda DNA (marker). Penanda DNA adalah fragmen DNA yang telah diketahui ukurannya (Sambrooket al.1989).
BAHAN DAN METODE
Alat dan BahanAlat-alat yang digunakan pada penelitian ini adalah tabung mikro 500 µL, pipet mikro, alumunium foil, parafilm, sarung tangan, cawan petri, Erlenmeyer, gelas piala, sudip, peralatan elektroforesis, gel doc, sentrifus, ose, stirer, laminar air flow cabinet, inkubator bergoyang, autoklaf, penangas air, mesin PCR, penangas air bergoyang, dan lemari es.
Bahan-bahan yang digunakan adalah E. coli galur XL1-Blue, gen stilbena sintase, plasmid pGEM-TEasy, pCAMBIA 1303, Agrobacterium tumefacians galur AGL-0, enzim restriksi Nco1 dan Spe1, kit elusi dari Invitrogen, kit ligasi dari promega, kit isolasi plasmid dari Roche, kit elusi dari Qiagen, es batu, TBE 0.5x, EtBr, loading dye,marker 1 Kb plus, media luria bertani (LB) yang terdiri atas tripton,ekstrak kamir dan NaCl, media luria bertani agar (LA) yang terdiri atas tripton,ekstrak kamir, NaCl dan agar , KOH 10 N, HCl 5M, bufer ligasi, T4 ligase, glukosa, Ampisilin 100 mg/L, IPTG 0.1 mM, X-Gal 40 mg/L, kanamisin 100000 mg/L, rifampisin 25000 mg/L, EDTA, dNTP, primer M13 F, primer M13 R, Taq polimerase, MW, Mg2+ dan buffer.
Metode Penelitian
Purifikasi Produk PCR (Stilbena Sintase) Penelitian ini dimulai dari purifikasi terhadap produk PCR yang didapatkan. Purifikasi ini menggunakanhigh pure plasmid isolation kit dari Invitrogen. Fragmen dipotong dari gel menggunakan pisau skalpel, kemudian ditimbang dan dilarutkan dengan buffer GS1. Penimbangan dilakukan untuk menentukan banyaknya buffer GS1 yang harus ditambahkan. Perbandingan antara sampel dan buffer GS1 adalah 1:3. Selanjutnya, campuran diinkubasi pada suhu 50oC selama 15 menit, setiap 3 menit larutan dikocok dengan membolak-balikan tabung secara perlahan dan setelah larut campuran dikocok setiap 5 menit. Larutan kemudian ditransfer ke dalam kolom, lalu disentrifugasi dengan kecepatan 12000 rpm selama 2 menit pada suhu 25oC.
Tahap selanjutnya adalah sebanyak 500 µL buffer GS1 ditambahkan ke dalam kolom dan diinkubasi selama 1 menit, kemudian disentrifugasi dengan kecepatan 12000 rpm selama 2 menit. Sampel yang berada di dalam kolom kemudian ditambah dengan 700 µL W9 dan diinkubasi selama 5 menit, sampel selanjutnya disentrifugasi kembali dengan kecepatan 12000 rpm selama 2 menit untuk menghilangkan sisa etanol. Setelah itu, 30 µL buffer TE yang sudah dipanaskan (65-70oC) dimasukkan ke dalam sampel, kemudian diinkubasi selama 1 menit dan disentrifugasi dengan kecepatan 12000 rpm selama 3 menit. Hasil purifikasi kemudian diuji dengan elektroforesis gel agarosa 1% sebanyak 2 µL.
Kloning Gen Stilbena Sintase (STS) ke dalam Plasmid pGEM-TEasy
Kloning gen diawali dengan ligasi gen STS dengan pGEM-T Easy. Ligasi dilakukan dengan menggunakan kit dari Promega. Sebanyak 5 µL buffer ligase dicampurkan dengan 0.5 µL plasmid pGEM-TEasy , 1 µL T4 Ligase dan 3.5 µL gen stilbena sintase. Kemudian campuran diinkubasi pada suhu 25 oC selama 1 jam atau pada suhu 4 oC selama satu malam. Hasil ligasi selanjutnya ditransformasikan ke E.coli XL1-Blue
Transformasi gen hasil ligasi ke bakteri E.coli XL1-Blue menggunakan metode heat shock. Sebanyak 10 µL hasil ligasi dimasukkan ke dalam 200 µL sel kompeten dan dikocok perlahan sampai campuran merata. Selanjutnya, campuran diinkubasi di dalam es selama 30 menit, kemudian diinkubasi pada suhu 42 oC selama 50 detik. Tabung yang telah diinkubasi pada suhu 42 oC kemudian diinkubasi di dalam es selama 10 menit. Larutan kemudian ditambah dengan 800 µL LB glukosa dan dikocok menggunakan inkubator bergoyang dengan kecepatan 150 rpm pada suhu 37 oC selama 90 menit.
Selanjutnya, larutan diambil dan disebar ke media luria bertani agar (LA) ditambah ampisilin 100 ppm, isopropil tiogalaktosida (IPTG) 0.1 mM dan X-Gal 40 mg/L. Selanjutnya dilakukan seleksi putih biru untuk membedakan sel yang mengandung plasmid rekombinan dengan sel yang tidak mengandung plasmid rekombinan.
Konfirmasi Koloni Transforman yang Membawa Fragmen Sisipan
Konfirmasi koloni transforman dilakukan dengan teknik PCR koloni. PCR koloni dilakukan menggunakan mesin PCR (Biometra T-Personal). Proses ini diawali oleh pemecahan sel dengan pemanasan 96
o
C selama 5 menit, kemudian suhu turun menjadi 50 oC dan berlangsung selama 90 detik, suhu naik kembali menjadi 96 oC selama 90 detik, lalu 90 detik selanjutnya pada suhu 45oC, 1 menit pada suhu 96oC dan 40 oC selama 1 menit. Setelah pemanasan pada proses lisis, campuran PCR (buffer, MW, dNTPs, primer universal M13 F, M13 R dan Taq polimerase) ditambahkan pada setiap sampel. Proses PCR dilanjutkan kembali dengan suhu 94oC selama 30 detik, 55oC selama 1 menit, dan 2 menit pada 72
o
C selama 30 siklus dan selanjutnya 72 oC selama 5 menit. Hasil PCR koloni diverifikasi pada gel agarosa. Koloni terpilih
kemudian dikultur dalam medium LB cair yang mengandung ampisilin dan diinkubasi pada inkubator bergoyang suhu 37 oC dengan kecepatan 150 rpm. Selanjutnya dilakukan isolasi plasmid menggunakan High Pure Plasmid Isolation Kit (Roche) dari kultur bakteri yang tumbuh. Hasil isolasi plasmid selanjutnya diverifikasi kembali pada gel agarosa dan dilakukan sekuensing.
Sekuensing Fragmen Terklon
Pengurutan basa (sekuensing) fragmen gen terklon dilakukan di Lembaga Molekuler Eijkman Jakarta menggunakan primer universal M13 F dan M13 R. Hasil sekuen fragen selanjutnya dianalisis dengan program bioinformatika.
Isolasi DNA Plasmid
Prosedur yang digunakan mengikuti prosedur High Pure Plasmid Isolation Kit dari Roche. Isolasi DNA plasmid dilakukan terhadap koloni yang berdasarkan hasil PCR koloni diketahui mengandung plasmid terinsersi fragmen yang diinginkan. Koloni tersebut dikulturkan dalam media luria bertani (LB) yang mengandung ampisilin kemudian diinkubasi selama 16 jam pada suhu 37 oC dengan pengocokan 150 rpm . DNA plasmid yang diperoleh dielektroforesis dengan gel agarosa 1% untuk melihat kemurniannya.
Sebanyak 3-4 mL kultur sel Escherichia colidiransfer ke dalam tabung mikro dan disentrifugasi dengan kecepatan 8000 rpm pada suhu 25oC selama 2 menit. Pellet yang dihasilkan kemudian diresuspensikan dengan suspension buffer 250 µL dan ditambahkan lysis buffer selanjutnya diaduk 6-8 kali. Campuran kemudian diinkubasi selama 5 menit pada suhu ruang dan ditambah dengan 350 µL binding buffer dan diaduk 3-4 kali, campuran diinkubasi kembali didalam es selam 5 menit. Selanjutnya, campuran disentrifugasi dengan kecepatan 13000 rpm selama 10 menit pada suhu 25 oC, supernatan kemudian ditransfer ke kolom dan disentrifugasi kembali dengan kecepatan 13000 rpm selama 1 menit pada suhu 25oC. Cairan di bawah kolom dibuang dan ditambah dengan 500 µL wash buffer 1. Selanjutnya, larutan disentrifugasi dengan kecepatan 13000 rpm selama 1 menit pada suhu 25oC, cairan di bawah kolom dibuang dan ditambah denganwash buffer2. Larutan kemudian disentrifugasi dengan kecepatan
13000 rpm selama 1 menit pada suhu 25oC, cairan di bawah kolom dibuang selanjutnya disentrifugasi kembali. Sebanyak 30 µL elution buffer selanjutnya ditambahkan ke dalam kolom dan disentrifugasi dengan kecepatan 13000 rpm selama 1 menit pada suhu 25oC, hasil purifikasi kemudian diuji dengan elektroforesis gel agarosa 1%.
Pemotongan pGEM-T Easy dan Pemurnian Gen Stilbena Sintase
Plasmid pGEM-T Easy yang mengandung gen stilbena sintase dipotong menggunakan enzim restriksi Spe1 dan Nco1. Sebanyak 49 µL DNA plasmid rekombinan dicampur dengan 7 µL dH2O, 7
µL buffer 2SpeI, 7 µL enzimSpeI dan 7 µL enzimNcoI . Campuran diinkubasi selama 1 jam pada suhu 37 oC dan kemudian dielektroforesis menggunakan gel agarosa 0.6%. Setelah elektroforesis selesai, gel diletakkan pada gel doc. Selanjutnya fragmen yang berukuran 1500 bp dipotong menggunakan skalpel untuk dipurifikasi.
Kloning Gen Stilbena Sintase dengan Vektor Ekspresi pCAMBIA 1303
Sebelum diligasi dengan gen stilbena sintase, plasmid pCAMBIA 1303 dipotong terlebih dahulu dengan enzim restriksi Spe1 dan Nco1. Pemotongan ini dilakukan pada suhu 37 oC selama 1 jam. Ligasi dilakukan menggunakan T4 ligase dan buffer ligase dari Promega. Sebanyak 5 µL gen stilbena sintase yang telah dipurifikasi dicampur dengan buffer ligase sebanyak 10 µL, 3 µL plasmid pCAMBIA 1303 dan 2 µL T4 ligase di dalam tabung mikro 500 µL . Selanjutnya, tabung ditutup dengan parafilm, diaduk menggunakan alat spin kira-kira 1 menit, kemudian diinkubasi pada suhu 4oC selama 16 jam.
Transformasi gen stilbena sintase ke dalam bakteri E.coli XL1-Blue menggunakan metodeheat shock. Sebanyak 10 µL hasil ligasi dimasukkan ke dalam 200 µL sel kompeten dan dikocok perlahan sampai campuran merata. Selanjutnya, campuran diinkubasi di dalam es selama 30 menit, kemudian diinkubasi pada suhu 42oC selama 50 detik. Campuran kemudian diinkubasi di dalam es selama 10 menit, ditambah dengan 800 µL LB glukosa dan dikocok menggunakan inkubator bergoyang dengan kecepatan 150 rpm pada suhu 37oC selama 90 menit. Selanjutnya, campuran disebar ke media LA dengan penambahan
kanamisin 25 mg/L kemudian diinkubasi selama 1 malam.
Seleksi DNA Rekombinan
Setelah diinkubasi semalam, koloni yang terbentuk diambil dengan tusuk gigi dan diberi nomor kemudian dimasukkan ke dalam media LA untuk dibuat duplikatnya dan juga koloni tersebut dikulturkan dalam media LB yang mengandung kanamisin 25 mg/L. Selanjutnya dikocok pada kecepatan 150 rpm selama 1 malam. Hasil kultur selanjutnya diisolasi menggunakan kit dari Qiagen dan ditransformasikan ke dalam Agrobacterium setelah dilakukan analisis restriksi menggunakan enzim Spe1 dan Nco1.
Transformasi pCAMBIA 1303-Stilbena Sintase ke dalam Agrobacterium tumefaciens
Transformasi pCAMBIA 1303-stilbena sintase ke dalam Agrobacterium tumefaciens menggunakan metode heat shock. Sebanyak 10 µL DNA plasmid ditambahkan ke dalam 500 µL sel kompeten Agrobacterium strain AGL-0. Kemudian diinkubasi didalam es selama 15 menit. Selanjutnya, campuran diinkubasi selama 5 menit di nitrogen cair lalu 5 menit pada suhu 37 oC. Campuran kemudian ditambah dengan 1 mL YEP dan diinkubasi selama 3 jam pada suhu 28 oC. Selanjutnya, campuran disentrifugasi 3 menit dengan kecepatan 6000 rpm pada suhu 25 oC. Supernatan dibuang dan 200 µL dicampur dengan pellet. Campuran kemudian disebar ke media LA yang mengandung rifampisin 50 mg/L dan kanamisin 25 mg/L lalu diinkubasi pada suhu 28oC selama 2 malam dalam keadaan gelap sambil dikocok dengan kecepatan 150 rpm.
Seleksi DNA Rekombinan
Setelah DNA rekombinan pCAMBIA 1303-stilbena sintase ditransformasikan ke Agrobacterium tumefaciens diinkubasi 2 malam, koloni yang terbentuk diambil dengan tusuk gigi. Kemudian koloni tersebut diberi nomor. Selanjutnya, koloni dimasukkan ke dalam media LA untuk dibuat duplikatnya dan juga koloni tersebut dikulturkan dalam media LB yang mengandung kanamisin 25 mg/L dan rifampisin 50 mg/L. Selanjutnya koloni dalam media LB diinkubasi pada suhu 28oC sambil dikocok pada kecepatan 150 rpm selama 2 malam kemudian dilakukan isolasi plasmid.
HASIL DAN PEMBAHASAN
Purifikasi dan Pengujian Produk PCR(Stilbena Sintase)
Purifikasi ini menggunakan high pure plasmid isolation kit dari Invitrogen. Percobaan dilakukan sesuai dengan prosedur yang terdapat dalam metode. Purifikasi bertujuan memurnikan produk PCR yang diperoleh dari pengotor yang mungkin ada pada produk PCR. Hasil purifikasi kemudian diuji dengan elektroforesis gel agarosa.
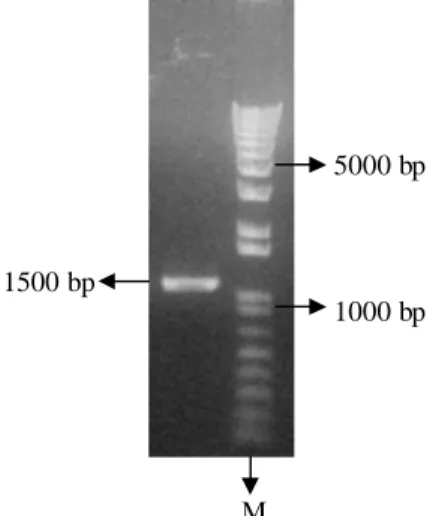
Hasil elektroforesis menunjukkan adanya satu fragmen hasil purifikasi. Fragmen tersebut berukuran sekitar 1500 bp dan fragmen ini diperkirakan merupakan gen stilbena sintase yang diinginkan (Gambar 4). Pengujian dengan elektroforesis gel agarosa dilakukan untuk mengetahui kualitas dan kuantitas gen stilbena sintase yang akan diligasi dengan vektor pGEM-TEasy.Hasil purifikasi ini selanjutnya dimasukkan ke dalam vektor pengklonan pGEM-TEasy
M
Gambar 4 Hasil purifikasi gen stilbena sintase,M= marker, fragmen berukuran 1500 bp = Gen stilbena sintase.
Kloning Gen Stilbena Sintase ke dalam Vektor pGEM-TEasy
Tahapan kloning terdiri atas ligasi, transformasi dan seleksi. Ligasi dilakukan dengan menggabungkan fregmen gen stilbena sintase, plasmid pGEM-T Easy sebagai vektor, buffer dan T4 DNA ligase. Produk ligasi kemudian ditransformasikan ke dalam Escherichia coli XL-1 Blue kompeten. Produk ligasi pada tahap ini adalah stilbena sintase yang sudah disisipkan pada vektor pGEM-TEasy.
Transformasi ke Escherichia coli dilakukan untuk memperbanyak DNA
plasmid rekombinan. Transformasi dilakukan menggunakan metodeheat shock yaitu dengan pemberian kejut panas pada suhu 42 oC selama 50 detik. Prinsip dari
proses tersebut adalah terjadi lonjakan suhu dari 0oC ke 42 oC terhadap sel yang telah diberi perlakuan CaCl2. Perlakuan CaCl2ini
dilakukan dalam pembuatan sel kompeten. Garam CaCl2 akan mempengaruhi porositas
membran sel sehingga pada saat terjadi lonjakan suhu membran menjadi tidak selektif terhadap molekul asing dan produk ligasi dapat masuk ke dalam sel. Sel kemudian dikultur dalam media tumbuh LB dengan penambahan glukosa selama 1.5 jam untuk memperbanyak jumlah sel dan memberi kesempatan kepada sel untuk mengekspresikan marka seleksi dari plasmid yang dibawanya. Setelah itu sel disebar pada media seleksi LA, IPTG, dan X-Gal kemudian diinkubasi selama 16 jam pada suhu 37 oC. Penambahan IPTG dalam media seleksi berfungsi sebagai penginduksi ekspresi gen sedangkan X-Gal berfungsi sebagai substrat.
Hasil transformasi ke Escherichia colimenunjukkan terbentuknya koloni putih dan biru (Gambar 5). Koloni putih merupakan koloni yang diperkirakan mengandung fragmen gen sisipan (gen stilbena sintase) sedangkan koloni biru diperkirakan merupakan koloni yang tidak mengandung fragmen gen sisipan. Terbentuknya koloni putih biru ini disebabkan adanya marka seleksi pada vektor pGEM-T Easy. Marka seleksi biasanya berupa gen yang membawa sifat resistensi terhadap antibiotik tertentu. Vektor pGEM-T Easy memiliki marka seleksi berupa gen resistensi ampisilin dan marka seleksi tambahan berupa gen Lac Z. Gen pembawa sifat resistensi terhadap ampisilin ini menyandi enzim -Laktamase. Enzim -Laktamase akan mendegradasi ampisilin sehingga ketika sel pembawa plasmid rekombinan ditumbuhkan dalam media yang mengandung ampisilin, maka sel tersebut akan tumbuh sementara sel yang tidak membawa plasmid rekombinan akan mati. Gen Lac Z menyandi enzim -Galaktosidase. Enzim ini akan menghidrolisis X-Gal yang ditambahkan pada media seleksi menjadi galaktosida dan senyawa turunannya yaitu 5-bromo-4-kloro indoksil yang berwarna biru. Ketika terdapat fragmen gen sisipan pada plasmid maka sintesis -peptida yang berperan sebagai aktivator terhadap kerja enzim -Galaktosidase akan terhambat sehingga warna biru tidak terbentuk.
1500 bp
1000 bp 5000 bp
1 2
Gambar 5 Koloni biru putih hasiltransformasi pGEM-TEasy ke Escherichia coli. Nomor 1 adalah koloni putih dan nomor 2 adalah koloni biru.
.
Seleksi transforman melalui pengamatan warna koloni yang terbentuk tidak selalu sesuai dengan teori. Artinya bahwa tidak semua koloni berwarna putih pasti membawa fragmen gen sisipan dan sebaliknya belum tentu semua koloni berwarna biru merupakan koloni yang tidak membawa fragmen gen sisipan. Hal tersebut dapat disebabkan oleh karakteristik dari fragmen gen hasil PCR yang diklon ke dalam pGEM-T Easy. Sebagai contoh, koloni biru dapat dihasilkan dari produk PCR yang diklon pada frame yang sama dengan gen LacZ. Produk PCR tersebut biasanya memiliki tiga basa sama yang berulang pada beberapa bagian fragmen, termasuk memiliki basa adenin yang berulang pada bagian ujungnya (Promega 1999). Produk PCR yang demikian tidak memiliki kodon stop pada bagian fragmennya sehingga akan ditranslasi bersamaan dengan gen LacZ dan menghasilkan koloni berwarna biru
Koloni sel yang terbentuk pada media seleksi selanjutnya diambil 6 koloni untuk diamplifikasi dengan teknik PCR koloni dan dikonfirmasi dengan elektroforesis gel agarosa 1% dengan voltase 100 volt. Tujuan utama dari PCR koloni adalah untuk mengkonfirmasi koloni transforman yang membawa fragmen gen sisipan dan menghindari kesalahan dari pengamatan warna koloni.
PCR koloni diawali dengan pemilihan koloni terpisah yang tumbuh pada media seleksi. Koloni-koloni tersebut diberi nomor
terlebih dahulu kemudian dengan tusuk gigi steril, koloni tersebut diduplikat pada media seleksi yang telah dibagi menjadi beberapa wilayah dan digunakan sebagai cetakan pada proses PCR.
Elektroforegram (Gambar 6) menunjukkan terdapat dua klon transforman yang berhasil diinsersi yaitu koloni nomor 5 dan nomor 6. Keberhasilan dalam proses PCR koloni dapat diamati dari ukuran klon transforman. Gambar 6 Menunjukkan bahwa fragmen mengalami penambahan ukuran sekitar 200 bp sehingga ukurannya menjadi 1700 bp. Penambahan ukuran ini mungkin terjadi karena terdapat sekuen promotor dari vektor yang menempel pada gen target.
Koloni positif selanjutnya dikultur pada media LB yang ditambah ampisilin. Selanjutnya, dilakukan isolasi plasmid dari setiap kultur menggunakan high pure plasmid isolation kit dariRoche.
1 2 3 4 5 6 M
Gambar 6 Hasil PCR koloni gen STS. Nomor 1-6 nomor koloni yang digunakan sebagai cetakan, M= Marker.
Urutan Nukleotida Gen Stilbena Sintase Fragmen DNA plasmid hasil klon tersebut kemudian dimurnikan dan dikirim ke lembaga Eijkman Jakarta untuk ditentukan urutan nukleotidanya. Data hasil sekuensing yang berupa urutan basa selanjutnya diproses menggunakan program bioedit. Melalui program bioedit, urutan basa yang diperoleh disejajarkan baik forward maupun revers dan selanjutnya
1700 bp
5000 bp
dianalisis dengan program BLASTX pada
web. www.ncbi.nlm.nih.gov untuk
membandingkan sekuen nukleotida yang ditranslasikan pada seluruh open reding frame (ORF) dengan sekuen protein dalam database ( Claverie dan Notredam 2003).
Hasil analisis dengan program BLASTX dinyatakan dengan besarnya nilai scorebits dan E value. Nilai E value dan scorebits menunjukkan tingkat homologi gen yang dianalisis dengan protein yang bersesuaian padadatabase. Homologi yang tinggi ditunjukkan dengan nilai score bits yang semakin besar (>150) danE value yang kecil (<10-4). Nilai score bits ditunjukkan oleh warna hasil analisis BLASTX yaitu warna hitam, biru, hijau, merah muda dan merah. Warna hitam menunjukkan nilai score bits kurang dari 40, warna biru menunjukkan nilai score bits antara 40 sampai dengan 50, warna hijau menunjukkan nilai score bits 50 sampai dengan 80, warna merah muda menunjukkan nilaiscore bits 80 sampai dengan 200, dan warna merah menunjukkan nilai score bits lebih besar sama dengan 200. Semakin besar nilaiscore bits maka semakin tinggi tingkat homologi gen yang diperoleh dengan protein lain yang bersesuaian pada database. Hasil analisis fragmen gen stilbena sintase dengan program BLASTX menunjukkan terbentuknya warna merah (Lampiran 6) dengan nilai score bits lebih besar dari 150 dan E value lebih kecil dari 10-4(Tabel 1). Hasil ini menunjukkan bahwa fragmen gen stilbena sintase yang dianalisis memiliki tingkat homologi yang tinggi dengan protein lain yang bersesuaian pada database. Hasil ini memberikan keyakinan bahwa fragmen yang terbentuk dari hasil PCR adalah gen stilbena sintase.
Tabel 1 Hasil analisis BLASTX fragmen gen stilbena sintase
Protein yang bersesuaian Score (Bits) E Value hypothetical protein 286 3e-76 [Vitis vinifera]
Stilbene synthase 286 3e-76 [Vitis riparia]
resveratrol synthase 286 3e-76 [Vitis vinifera]
Stilbene synthase 286 3e-76 [Vitis vinifera]
*hanya ditampilkan sebagian,secara lebih lengkap dapat dilihat pada lampiran 6.
Kloning Gen Stilbena Sintase ke dalam Vektor Ekspresi pCAMBIA 1303
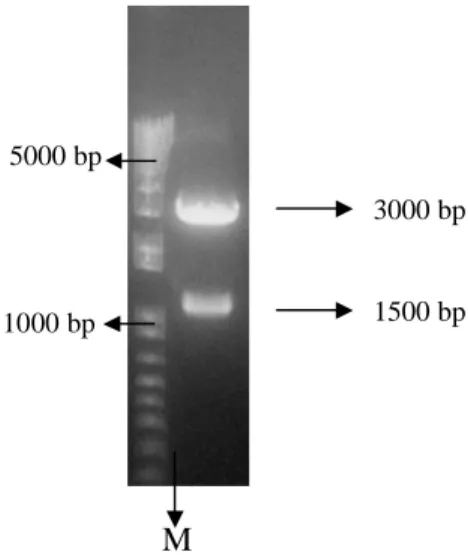
Sebelum gen stilbena sintase (STS) diligasi dengan vektor ekspresi pCAMBIA 1303, gen stilbena sintase yang terdapat didalam pGEM-T Easy dipotong terlebih dahulu dengan enzim restriksi Spe1 dan Nco1. Pemotongan ini dilakukan pada suhu 37oC selama 4 jam. Tujuan pemotongan ini adalah memisahkan fragmen gen stilbena sintase (STS) dengan vektor pengklonan pGEM-T Easy sehingga STS bisa diligasi dengan vektor ekspresi pCAMBIA 1303. Hasil pemotongan pGEM-T Easydan STS ditunjukkan pada gambar 7.
Gambar 7 menunjukkan bahwa hasil pemotongani pGEM-T Easy dan stilbena sintase dengan enzim restriksiSpe1 dan Nco1 menghasilkan 2 fragmen dengan ukuran sekitar 3000 bp dan 1500 bp. Fragmen berukuran 3000 bp diperkirakan merupakan fragmen pGEM-T Easy sementara fragmen berukuran 1500 bp merupakan fragmen gen stilbena sintase (STS). Hasil ini menunjukkan bahwa fragmen gen stilbena sintase telah berhasil dipisahkan dengan vektor pengklonan pGEM-TEasy. Fragmen berukuran 1500 bp selanjutnya dipotong dari gel menggunakan pisau skalpel dan dipurifikasi. Selanjutnya, fragmen gen stilbena sintase diligasi dengan vektor ekspressi pCAMBIA 1303.
M
Gambar 7 Hasil pemotongan pGEM-TEasy dan gen stilbena sintase (STS) dengan enzim restriksiSpe 1 dan Nco1, M= Marker, fragmen berukuran 3000 bp = Plasmid pGEM-TEasy, fragmen berukuran 1500 bp= Gen stilbena sintase.
3000 bp
1500 bp 1000 bp
Genstilbena sintase disisipkan pada vektor ekspresi pCAMBIA 1303 pada tempat pemotongan enzim restriksiNcoIdan Spe1 sehingga untuk mencapai tujuan tersebut vektor pCAMBIA 1303 dipotong terlebih dahulu dengan enzim restriksi NcoI dan Spe1. Hasil pemotongan vektor pCAMBIA 1303 menunjukkan terbentuknya fragmen berukuran sekitar 12000 bp (Gambar 8). Fragmen tersebut kemudian diisolasi dari gel dan dipurifikasi, sehingga didapatkan plasmid pCAMBIA 1303 yang siap diligasi dengan gen STS. Pemotongan dengan enzim restriksi ini dilakukan pada suhu 37 °C selama 1 jam. Seluruh volume reaksi kemudian dielektroforesis pada gel agarosa 1%.
Setelah itu, dilakukan Ligasi antara pCAMBIA 1303 dan stilbena sintase. Ligasi dilakukan dengan mencampur plasmid pCAMBIA 1303, DNA sisipan (stilbena sintase), buffer dan T4 DNA ligase. Ligasi dilakukan menggunakan T4 ligase dan buffer ligase dari Promega. Penggunaan enzim T4 DNA ligase pada proses ini untuk mengatalisis pembentukan ikatan fosfodiester antara ujung 5’ fosfat dan 3’ hidroksil dari nukleotida yang berdekatan. Penambahan enzim T4 DNA ligase ini mampu membentuk kompleks enzim AMP yang selanjutnya terikat pada nick (daerah putus).
M
Gambar 8 Hasil pemotongan pCAMBIA 1303, M=Marker, fragmen berukuran 12000= Plasmid pCAMBIA 1303.
Hasil ligasi stilbena sintase dan pCAMBIA 1303 selanjutnya ditransformasikan ke bakteri Escherichia coli XL1-Blue untuk memperbanyak DNA plasmid rekombinan. Transformasi dilakukan menggunakan metodeHeat shock yaitu dengan pemberian kejut panas pada suhu 42 oC selama 50 detik. Prinsip dari metode ini adalah adanya lonjakan suhu dari 0oC ke 42oC terhadap sel yang telah diberi perlakuan CaCl2. Garam CaCl2 akan
mempengaruhi porositas dari membran sel sehingga pada saat terjadi lonjakan suhu membran menjadi tidak selektif terhadap molekul asing dan produk ligasi dapat masuk ke dalam sel.
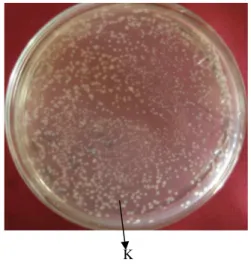
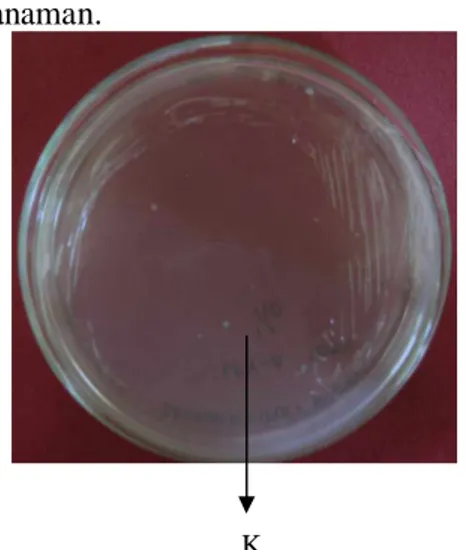
Hasil transformasi selanjutnya diseleksi dalam media Luria bertani agar yang mengandung kanamisin 25 mg/L. Hasil seleksi menunjukkan Terbentuknya beberapa koloni putih (Gambar 9). Koloni tersebut diperkirakan merupakan koloni Escherichia coliyang mengandung plasmid rekombinan. Escherichia coli yang tidak mengandung plasmid rekombinan tidak akan tumbuh dalam media seleksi karena tidak membawa gen yang mampu mendegradasi kanamisin.
Koloni tersebut kemudian ditumbuhkan dalam media LB yang mengandung kanamisin dengan konsentrasi 25 mg/L. Plasmid rekombinan dalamE. coli yang telah dikultur selanjutnya diisolasi. Isolasi DNA plasmid ini menggunakan kit dari Qiagen.
K
Gambar 9 Hasil transformasi pCAMBIA 1303-stilbena sintase ke Escherichia coli XL-1 Blue, K= Koloni yang mengandung plasid rekombinan.
12000 bp
Hasil isolasi plasmid dianalisis dengan menggunakan elektroforesis gel agarosa. Hasil elektroforesis menunjukkan terbentuknya plasmid berukuran sekitar 13500 (Gambar 10). Plasmid ini diperkirakan merupakan plasmid pCAMBIA 1303 yang telah mengandung fragmen gen stilbena sintase.
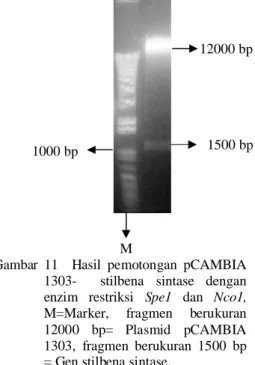
Plasmid yang telah diisolasi selanjutnya dipotong dengan enzim restriksi spe1 dan Nco1. Pemotongan ini dilakukan untuk memastikan bahwa sel yang tumbuh pada media seleksi adalah sel E. coli XL1-Blue yang membawa plasmid yang telah tersisipi gen stilbena sintase. Hasil pemotongan plasmid rekombinan pCAMBIA 1303-stilbena sintase dengan enzim restriksi Spe1 dan Nco1 menunjukkan terbentuknya dua fragmen masing-masing berukuran sekitar 12000 bp dan 1500 bp (Gambar 11). Fragmen berukuran 12000 bp diperkirakan merupakan plasmid pCAMBIA 1303 sedangkan fragmen berukuran 1500 bp diperkirakan merupakan fragmen gen stilbena sintase . Adanya dua pita dengan ukuran 12000 bp dan 1500 bp ini menunjukkan bahwa gen stilbena sintase telah berhasil dikonstruksi dengan vektor ekspresi pCAMBIA 1303.
M
Gambar 10 Gen stilbena sintase yang sudah terklon dalam pCAMBIA 1303, M=Marker, fragmen ukuran 13500= Gen stilbena sintase yang terklon dalam pCAMBIA 1303.
M
Gambar 11 Hasil pemotongan pCAMBIA 1303- stilbena sintase dengan enzim restriksi Spe1 dan Nco1, M=Marker, fragmen berukuran 12000 bp= Plasmid pCAMBIA 1303, fragmen berukuran 1500 bp = Gen stilbena sintase.
Transformasi pCAMBIA 1303-Stilbena Sintase ke dalamAgrobacterium
tumefaciens.
Transformasi pCAMBIA 1303-stilbena sintase ke dalam Agrobacterium tumefaciens menggunakan metode heat shock. Prinsip metode ini adalah terjadi lonjakan suhu dari 0 oC ke suhu -20 oC terhadap sel yang telah diberi perlakuan CaCl2. Garam CaCl2 akan mempengaruhi
struktur dan muatan dari membran sel sehingga pada saat terjadi lonjakan suhu membran menjadi tidak selektif terhadap molekul asing dan produk ligasi dapat masuk ke dalam sel .
Setelah sel kompeten AGL-0 dicampur dengan plasmid pCAMBIA 1303-STS, campuran selanjutnya disebar ke media seleksi LA yang dicampur kanamisin dan rifamfisin kemudian diinkubasi dalam keadaan gelap. Inkubasi dalam keadaan gelap dilakukan karena Agrobacterium tumefaciens sensitif terhadap cahaya. Selain itu, inkubasi dalam keadaan gelap dilakukan untuk mengkondisikan Agrobacterium seperti pada habitat aslinya yaitu tanah yang gelap.
Hasil seleksi DNA rekombinan pada media sleksi menunjukkan terbentuknya koloni berwarna putih (Gambar 12). Koloni yang terbentuk merupakan koloni yang mengandung plasmid rekombinan yaitu koloni yang mengandung DNA rekombinan pCAMBIA 1303-stilbena sintase. Jumlah koloni yang tumbuh di media seleksi saat transformasi ke 13500 bp
12000 bp
12000 bp
Agrobacterium tumefaciens lebih sedikit dibandingkan dengan jumlah koloni saat transformasi ke Escherichia coli. Hal ini terjadi karena Agrobacterium tumefaciens memiliki jumlah salinanyang lebih sedikit dibandingkan dengan Escherichia coli. Agrobacterium tumefaciens yang digunakan pada penelitian ini adalah Agrobacterium galur AGL-0. Agrobacterium galur AGL-0 digunakan karena memiliki virulensi yang lebih tinggi dibandingkan galur Agrobacterium lainnya.
Agrobacterium tumefaciens merupakan bakteri tanah yang secara genetik dapat mentransfer gen ke tanaman. Bakteri ini secara alami mampu menginfeksi tanaman dan menyebabkan timbulnya tumor akibat dari transfer fragmen DNA (T-DNA) dari plasmid Ti (tumor-inducing) bakteri ke sel tanaman. Sifat unik ini memungkinkan plasmid Ti menjadi alat pemindah gen-gen antar spesies yang berbeda, yaitu dengan menyisipkan gen asing pada T-DNA ( Shepherd 1997).
Plasmid Ti ditemukan pada
semua strain
A. tumefaciens
virulen,
berukuran sekitar 200 kb dan stabil
dalam
Agrobacterium
pada
temperatur di bawah 30 °C. Selama
pembentukan tumor urutan tertentu
plasmid Ti T-DNA ditransfer ke sel
tanaman dan berintegrasi ke genom
inti sel tanaman (Tzfira & Citovsky
2002). Plasmid Ti membawa banyak
gen yang terlibat dalam proses
infeksi, sebagian dari sekuennya
berintegrasi ke DNA kromosom
tanaman.
K
Gambar 12 Hasil transformasi pCAMBIA 1303-STS ke Agrobacterium, K= Koloni yang tumbuh.
Agrobacterium tumefaciens memiliki tiga komponen genetik yang digunakan untuk menginfeksi tanaman. Komponen yang pertama adalah komponen T-DNA, yaitu fragmen yang ditransfer ke sel tanaman. T-DNA terletak di plasmid Ti pada Agrobacterium. Komponen kedua adalah virulance (vir) region . Gen vir dibagi menjadi tujuh macam, yaituvir A,vir B,vir C, vir D, vir E, vir F, dan vir G (Brown 1997). Gen-gen vir mensintesis protein virulance (vir). Peranan protein vir adalah menginduksi terjadinya transfer T-DNA dan mengintegrasikan T-DNA ke tanaman. Gen vir akan berekspresi jika terdapat inducer, antara lain monosiklik fenolik seperti asetosiringon dan monosakarida seperti glukosa dan galaktosa. Selain inducer, kondisi pH juga mempengaruhi genvir, pH yang digunakan adalah 5-5.8. Senyawa fenolik dan monosakarida terbentuk saat tanaman dikotil mengalami luka dengan mengeluarkan getah dan proses ini jarang terjadi pada tanaman monokotil sehingga untuk transformasi tanaman monokotil perlu penyesuaian kondisi infeksi. Penyesuaian kondisi dapat dilakukan dengan menambahkan fenolik, menambahkan monosakarida, dan pengaturan pH (Sheng & Citovsky 1996). Komponen yang ketiga adalah gencromosomal virulance (chv). Gen chv terletak di kromosom Agrobacterium. Gen ini berfungsi dalam pelekatan bakteri ke dalam sel tanaman dengan membentuk senyawa protein -1,2-glukan (Sheng & Citovsky 1996).
Penggunaan Agrobacterium tumefaciens dalam transformasi tanaman lebih menguntungkan dibandingkan dengan metode lain. Beberapa keuntungannya antara lain Agrobacterium tumefaciens bersifat lebih stabil dan tanaman transgenik bersifat fertil (Arencibiaet a. 1998).
SIMPULAN DAN SARAN
Hasil penelitian menunjukkan bahwa gen stilbena sintase sudah berhasil terklon ke dalam vektor ekspresi pCAMBIA 1303. Hal ini dibuktikan dengan restriksi menggunakan enzim Spe1 dan Nco1 menghasilkan dua fragmen berukuran 12000 bp dan 1500 bp. Fragmen berukuran 12000 merupakan pCAMBIA 1303 sedangkan fragmen berukuran 1500 bp merupakan fragmen gen stilbena sintase. DNA rekombinan pCAMBIA 1303-stilbena sintase telah berhasil ditransformasi ke Agrobacterium tumefaciens strainAGL-0.DNA rekombinan pCAMBIA 1303–stilbena sintase yang telah berhasil ditransformasikan ke dalam Agrobacterium tumefaciens strain AGL-0 sebaiknya dilanjutkan dengan transformasi ke dalam tanaman.
DAFTAR PUSTAKA
Arencibia AD et al. 1998. Transformationmediated by Agrobacterium tumefaciens. Transgenic Res 7: 213-222.
Claverie JM, Notredame C. 2003.Bioinformatics for Dummies. Indianapolis:Wiley.
Brown TA. 1991.Pengantar Kloning Gen. Yogyakarta : Yayasan Essentia Medica.
Hain et al. 1993. Disease resistance results from foreign phytoalexin ekspression in a novel plant.Nature 361:153-156.
Hammer REVG, et al. 1985. Production of transgenic rabbits, sheep, and pigs by microinjection. Nature 315: 680-683.
Hooykaaset al. 1979.Agrobacteriumtumor inducing plasmids: Potential vectors for the genetic engineering of plants. Di dalam: JK Setlow, A Hollaender, editor. Genetic engineering: Principles and Methods. New York: Plenum Press. hlm 156-177.
Ingham JL. 1973. Disease resistance in higher plants : The concept of pre-infectional and post-pre-infectional resistance.Phytopathol 7: 314-335 Kendrew SJ, Lawrence E. 1994. The
Encyclopedia of Molecular Biology. Cambridge: Blackwell Science
Lin W et al. 1995. Genetic Engineering of rice for resistance to sheath blight. Biotechnology 13: 686-691. Lubis AU. 1992.Kelapa Sawit di Indonesia.
Sumatra Utara : Marihat
Nicholl DST. 1994. An Introduction to Genetic Engineering. New York : Cambridge University Press. Old RW, Primrose SB. 1994. Principles of
Genetic Manipulation. Ed ke-5. Oxford: Blackwell Sciencetific. [Promega]. 1999. pGEM-T and pGEM-T
easy Vector Systems (Technical Manual No. 042) Wisconsin : Promega Corporation.
Saiki. 1989. The design and optimizationof the PCR. Di dalam: HA Erlich, edior.PCR Technology Principles and Application for DNA Amplifications. New York: M. Stockton Press. hlm 7-16.
Sain SL, Oduro, Furtek. 1994. Genetic transformation of cocoa leaf cells using Agrobacterium tumefaciens. Plant cells, Tissue and Organ Culture 37 : 243-251.
Sambrook, J. Fritsch EF, Maniatis T. 1989. Molecular cloning A Laboratory Manual. Ed ke-1. New York : Cold Spring Harbor Laboratory.
Sambbrook J, Russell DW. 2001.Molecular Cloning A Laboratory Manual. Ed ke-3. New York: Cold Spring Harbor Laboratory.
Sbaghi MP. 1995. Development of methods selection criterion to screen grapevine in vitro cultures for resistance to grey mould (Botritis cinerea).Euphyta 86: 41-47. Sheng J, Citovsky. 1996. Agrobacterium
plant cell DNA transport: have virulance protein, will trave. The Plant Cell 8: 1699-1710.
Tzfira T, Citovsky V 2002. Partners-in-infection: host proteins involved in the transformation of plant cells by Agrobacterium. Trends in Cell Biology. 12: 121–130.
Lampiran 1 Tahapan penelitian
Tahap 1
NCBI
Disain primer berdasarkan informasi yang diperoleh dari NCBI
Amplifikasi menggunakan primer spesifik.
Purifikasi produk PCR
Kloning gen
stilbene synthase
ke pGEMT-Easy
Transformasi ke
Escherichia coli
(
XL1-Blue
)
Isolasi DNA plasmid
Sekuensing
Tahap 2 Strategi Konstruksi Gen
Restriksi pGEM-T
Easy
-
stilbene synthase
dengan enzim
Spe
I dan
Nco
I
Restriksi pCAMBIA 1303 dengan enzim
Spe1
dan
Nco1
Ligasi potongan fragmen gen
stilbene synthase
dengan pCAMBIA 1303
Transformasi hasil ligasi ke
Escherichia coli
(
XL1
-
Blue
)
Konfirmasi koloni transforman dengan analisis restiksi menggunakan
Spe
I dan
Nco
I
Transformasi
pCAMBIA 1303-
stilbene synthase
ke
Agrobacterium tumefaciens
Penelitian dilakukan dari Purifikasi produk PCR (tahap1) sampai transformasi ke
Lampiran 2 Prosedur elektroforesis gel agarosa (Sambrook
et al
1989)
0.3 gram agarosa ditimbang dan dilarutkan dalam 30 mL buffer TBE 0.5X
dengan bantuan oven microvave selama satu menit 110
oC
Setelah larut, larutan dibiarkan pada suhu kamar sebentar hingga cukup
hangat dan segera ditambahkan etidium bromide sebanyak 1.5 L dan
dipindahkan ke dalam cetakan gel yang telah disusun bersama sisirnya.
Gel ditunggu hingga memadat dan sisirnya diangkat.
DNA dilarutkan dengan loading buffer dengan perbandingan 1:5 dan
dimasukkan ke dalam sumur yang terbentuk pada gel.
Gel diletakkan dalam bak elektroforesis yang telah diisi dengan buffer TBE
0.5X. Kemudian dihubungkan dengan adaptor dengan potensial listrik
sebesar 100 volt.
Setelah loading buffer berada ± 1 cm dari dasar gel, adaptor dimatikan dan
gel diangkat. Gel diletakkan di bawah sinar UV untuk melihat ada tidaknya
Lampiran 3 Komposisi larutan sediaan
1.
Bufer TBE 0.5X (500 mL)
Bufer TBE 5X dibuat dengan komposisi:
Tris-Base
27
gram
Asam
borat
13.75
gram
EDTA 0.5 M pH 8.0 10 mL
dan ditepatkan dengan ddH
2O hingga 500 mL.
Saat pemakaian dalam pembuatan gel agarosa, bufer TBE 5X ini
diencerkan menjadi 0.5X.
2.
Media padat LA
Media padat LA dibuat dengan komposisi:
LB agar Low Salt 30 gr (1 L)
Komposisi
(per
1
Liter
)
Tripton 10
Yeast exctract
5
NaCl
5
Micro
agar
10
Kemudian dilarutkan dengan ddH
2O sesuai dengan volume yang
diinginkan. Selanjutnya diaduk menggunakan
stirer
dan pH disesuaikan
hingga 7.2.
Lampiran 3 Lanjutan
3.
Media LB
(Luria bertani agar)
Media LB dibuat dengan komposisi:
Komposisi
(per
1
Liter)
Tripton 10
Yeast exctract
5
NaCl
5
Kemudian dilarutkan dengan ddH
2O sesuai dengan volume yang
diinginkan. Selanjutnya diaduk menggunakan
stirer
dan pH disesuaikan
hingga 7.2. dan disterilisasi menggunakan autoklaf.
Lampiran 4 Prosedur kerja isolasi plasmid dengan kit dari Qiagen
1. Hasil kultur ditransfer ke dalam tabung mikro 2 mL,
2. Disentrifugasi dengan kecepatan 8000 rpm selama 2 menit pada suhu 25
o
C.
3. Supernatan dibuang dan pellet ditambah dengan 250 µL P1 + RNAse, 250
µL P2 dan diaduk 6 kali,
4. Ditambah dengan 350 µL N3 dan diaduk sebanyak 6 kali.
5. Disentrifugasi dengan kecepatan 13000 rpm selam 2 menit pada suhu 25
o
C.
6. Supernatan ditransfer ke dalam kolom dan disentrifugasi dengan kecepatan
13000 rpm selam 2 menit pada suhu 25
oC.
7. Ditambah dengan 500 µL PB kemudian disentifugasi dengan kecepatan
13000 rpm selama 2 menit pada suhu 25
oC.
8. Ditambah dengan 750 µL PE kemudian disentifugasi dengan kecepatan
13000 rpm selama 2 menit pada suhu 25
oC.
9. Cairan yang terdapat di bawah kolom dibuang dan bagian yang ada pada
kolom disentifugasi dengan kecepatan 13000 rpm selama 2 menit pada
suhu 25
oC.
10. Sebanyak 30 µL
eluent buffer
ditambahkan kedalam kolom dan
disentrifugasi dengan kecepatan 13000 rpm selama 2 menit pada suhu 25
o
C.
11. Plasmid yang sudah diisolasi kemudian dielektroforesis dengan gel
agarosa sebanyak 1-2 µL.
Lampiran 6 Hasil analisis BLASTX fragmen gen
stilbene synthase
Score E
Sequences producing significant alignments: (Bits) Value
gb|AAL23576.1| stilbene synthase 3 [Vitis sp. cv. 'Norton'] 288 1e-76 emb|CAO15541.1| unnamed protein product [Vitis vinifera] 286 3e-76 sp|A5AEM3.1|THS4_VITVI RecName: Full=Stilbene synthase 4; Alt... 286 3e-76
emb|CAN74316.1| hypothetical protein [Vitis vinifera] 286 3e-76
sp|P51070.2|THS2_VITVI RecName: Full=Stilbene synthase 2; Alt... 286 3e-76 gb|ABE68894.1| resveratrol synthase [Vitis vinifera] >gb|ABE6... 286 3e-76
gb|AAF00586.1| stilbene synthase [Vitis riparia] 286 3e-76
gb|ABC84859.1| resveratrol synthase [Vitis vinifera] 286 3e-76
emb|CAA54221.1| Stilbene synthase [Vitis vinifera] 286 3e-76
pir||S16206 stilbene synthase (EC 2.3.1.-) - grape 286 3e-76
emb|CAO63088.1| unnamed protein product [Vitis vinifera] >emb... 285 6e-76
gb|ABD64685.1| stilbene synthase [Vitis vinifera] 285 8e-76
emb|CAO43584.1| unnamed protein product [Vitis vinifera] 285 1e-75 gb|ABM30194.1| stilbene synthase [Vitis quinquangularis] 285 1e-75 emb|CAO65947.1| unnamed protein product [Vitis vinifera] 284 2e-75
emb|CAN68070.1| hypothetical protein [Vitis vinifera] 284 2e-75
emb|CAN69969.1| hypothetical protein [Vitis vinifera] 284 2e-75
emb|CAO15527.1| unnamed protein product [Vitis vinifera] 283 2e-75 emb|CAO15524.1| unnamed protein product [Vitis vinifera] 283 2e-75 gb|ABF06883.1| stilbene synthase [Vitis pseudoreticulata] 283 2e-75 gb|ABF06886.1| stilbene synthase [Vitis pseudoreticulata] 283 2e-75 emb|CAO70364.1| unnamed protein product [Vitis vinifera] 283 3e-75 emb|CAO49898.1| unnamed protein product [Vitis vinifera] >emb... 283 3e-75 emb|CAO15539.1| unnamed protein product [Vitis vinifera] 283 3e-75 emb|CAO15526.1| unnamed protein product [Vitis vinifera] 283 3e-75
emb|CAN61161.1| hypothetical protein [Vitis vinifera] 283 3e-75
gb|ABM30193.1| stilbene synthase [Vitis quinquangularis] 283 3e-75 gb|ABK96920.1| stilbene synthase [Vitis rotundifolia] 283 3e-75
gb|ABJ97071.1| stilbene synthase 1 [Vitis vinifera] 283 3e-75
gb|ABF06884.1| stilbene synthase [Vitis pseudoreticulata] 283 3e-75 gb|ABF06882.1| stilbene synthase [Vitis pseudoreticulata] 283 3e-75 sp|P51071.1|THS3_VITVI RecName: Full=Stilbene synthase 3; Alt... 283 3e-75
gb|ABJ97068.1| stilbene synthase [Vitis vinifera] 283 4e-75
gb|ABF06885.1| stilbene synthase [Vitis pseudoreticulata] 282 7e-75 emb|CAO70367.1| unnamed protein product [Vitis vinifera] 281 9e-75 emb|CAO15529.1| unnamed protein product [Vitis vinifera] 281 9e-75