77
Penentuan Temperatur Optimum Terhadap Aktivitas Protease
Serin Yang Dihasilkan Oleh Stadium L3 Ascaridia galli
Ummu Balqis1 dan Yudha Fahrimal2
1, 2
Staf Pengajar Pada Fakultas Kedokteran Hewan, Universitas Syiah Kuala,
Jl. Hasan Krueng Kale no.4, Darussalam Banda Aceh
*
E-mail: u_balqis@yahoo.com
ABSTRAK
Penelitian ini bertujuan untuk menentukan temperatur optimum aktivitas protease serin yang dilepaskan oleh stadium L3 Ascaridia galli. Sebanyak 5 – 10
ekor L3 A. galli dikultur secara in vitro dalam setiap ml medium Rosswell Park
Memorial Institute (RPMI 1640), pH 6,8, tanpa merah fenol. Kultur diinkubasikan
pada temperatur 37oC dan 5% CO2 selama 3 hari. Medium kultur stadium L3 A.
galli diuji aktivitas enzimatik terhadap kasein 2% pada inhibitor/aktivator (PMSF,
EDTA, 1,10-phenanthroline, Pepstatin A, E-64), dan pada berbagai tingkatan temperatur, yaitu berturut-turut pada 27oC, 37oC, 40oC, 50oC, 60oC, 70oC dan 80oC. Temperatur optimum ditentukan berdasarkan aktivitas enzimatik tertinggi protease serin. Hasil penelitian menunjukkan bahwa temperatur optimum protease serin yang dilepaskan oleh stadium L3 A. galli adalah 70oC. Hasil tersebut
mengindikasikan bahwa temperatur berperan penting terhadap reaksi enzimatik protease serin yang dilepaskan oleh stadium L3 A. galli.
Kata kunci: Ascaridia galli, nematoda, protease serin
ABSTRACT
This research was carried out to determine the temperature optimum of
serine protease activity secreted by A. galli L3 stage. L3 were cultured in vitro (5 –
10 ml-1) in flasks containing rosswell park memorial institute (RPMI) 1640 media,
pH 6.8, without phenol red. Cultures were incubated at 370C in 5% CO2 for 3
days. Enzymatic activity of culture fluid of A. galli L3 stage was tested against casein 2% at some inhibitor/activators (PMSF, EDTA, 1,10-phenanthroline,
Pepstatin A, E-64), and at different temperature, namely 27oC, 37oC, 40oC, 50oC,
60oC, 70oC and 80oC respectively. Temperature optimum was determined based
on the highest enzymatic activity of serine protease. The result showed that
temperature optimum of the serine protease secreted by A. galli L3 stage is 70oC.
The results indicate that the temperature played an important role against
enzymatic activity of serine protease secreted by A, galli L3 satage.
78 Pendahuluan
Protease atau enzim proteolitik adalah enzim yang memiliki daya katalitik yang spesifik dan efisien terhadap ikatan peptida dari suatu molekul polipeptida atau protein. Protease dapat diisolasi dari tumbuhan (papain dan bromelin), hewan (tripsin, kimotripsin, pepsin, dan renin), mikroorganisme seperti bakteri, kapang, virus, dan cacing parasitik seperti cestoda, trematoda, dan nematoda. Protease yang diekskresi/sekresikan oleh cacing esensial untuk proses perkembangan dan kelangsungan hidup seperti penetasan telur, molting, dan exsheathment parasit. Protease yang dihasilkan cacing nematoda parasitik memainkan peranan penting pada proses penetrasi dan migrasi parasit ke jaringan inang definitif. Todorova (2000) menyatakan bahwa enzim proteolitik yang disekresikan parasit untuk invasi ke jaringan terdiri dari dua jenis protease, yaitu protease serin dan metal. Kehadiran kedua jenis protease tersebut di dalam produk yang disekresikan cacing nematoda telah dibuktikan oleh Cock et al. (1993) pada Ostertagia ostertagi, Todorova (2000) pada Trichinella spiralis, Rhoads et al. (1997 dan 2001) pada
Ascaris suum, dan Iglesias et al. (2005) pada Anisakis simplex.
Karakterisasi protease sudah luas dilakukan dari berbagai stadium secara
in vitro pada cacing nematoda, misalnya stadium infektif (L3) dan stadium dewasa
cacing Trichostrongylus colubriformis dan Haemonchus contortus (Hadas dan Stankiewicz, 1997). Karakter protease yang disekresikan cacing nematoda penting diketahui sebagai pengetahuan dasar biologi parasit. Berdasarkan active-site
region pada protease sangat memungkinkan untuk merancang inhibitor spesifik
sebagai strategi pengendalian dan tindakan terapi terhadap cacing parasitik. Aktivitas protease yang dilepaskan selama perkembangan parasit sangat dipengruhi oleh beberapa faktor, diantaranya adalah faktor temperatur.
Reaksi kimia dapat dipengaruhi oleh temperatur, maka reaksi yang menggunakan katalis enzim juga dapat dipengaruhi oleh temperatur. Pada temperatur rendah reaksi kimia berlangsung lambat, sedangkan pada temperatur yang lebih tinggi reaksi berlangsung lebih cepat. Protease yang dilepaskan oleh A.
galli adalah suatu enzim (protein), maka kenaikan temperatur dapat menyebabkan
79 protease akan terganggu dan dengan demikian konsentrasi efektif enzim menjadi berkurang dan kecepatan reaksinya pun akan menurun. Oleh karena itu, fokus penelitian ini adalah untuk menentukan aktivitas optimum protease dari produk ekskretori/sekretori stadium L3 A. galli. Tujuan penelitian ini adalah untuk
mengetahui aktivitas optimum dari protease yang dilepaskan melalui ekskretori/sekretori stadium L3 A. galli terhadap temperatur.
Bahan dan Metode Penelitian
Kultivasi Stadium L3 A. galli Secara in vitro
Larva L3 A. galli diperoleh dari isi usus ayam kampung yang disaring di
dalam gelas piala. Isi usus ditempatkan di dalam wadah saringan pada bagian atas gelas piala yang berisi air selam satu jam sehingga L3 A. galli akan turun ke dasar
gelas piala. Larva diambil dengan pipet pasteur dan dihitung jumlahnya dibawah mikroskop. Sebanyak 25 – 50 ekor L3 A.galli dikultur secara in vitro dalam cawan
petri berisi 5 ml medium RPMI-1640 pH 6,8 (tanpa phenol red). Media diberi suplemen 100 unit/ml penicillin G, 100 g/ml streptomisin, 0,25 g/ml amphotericin B, dan 5 g/ml gentamisin. Untuk mendapatkan enzim yang dilepaskan oleh stadium larva L3 A. galli, larva dikultur selama 3 hari pada
temperatur 370C dan tekanan CO2 5%. Cairan kultur dikoleksi, disentrifugasi
(12.000 g) dan disaring dengan membran filter (0,2 m), serta didialisa dengan
phosphate-buffered saline (PBS) untuk mendapatkan ekskretori/sekretori A. galli
(Rhoads et al., 1997; dan Balqis et al., 2005).
Pengaruh Berbagai Inhibitor/Aktivator
Tujuan dari karakterisasi ini adalah untuk mengetahui golongan enzim. Inhibitor yang digunakan adalah inhibitor protease phenil methanyl methane sulfonyl fluoride (PMSF) 0,5 dan 1 mM, ethylene diamine tetraacetic (EDTA) 1 dan 10 mM, 1,10-phenanthroline 1 mM, pepstatin A 1 g/ml, dan E-64 (10 g/ml dan 50 g/ml). Uji pengaruh inhibitor dilakukan dengan cara sebagai berikut: enzim, buffer Tris-HCl 10 mM, pH 8, dan inhibitor dipreinkubasi pada temperatur kamar (25°C) selama 1 jam. Larutan tersebut diuji aktivitas enzimmya. Reaksi
80 diawali dengan penambahan substrat musin. Aktivitas enzim tersebut dibandingkan dengan aktivitas enzim non inhibitor (Kong et al., 2000).
Pengukuran Aktivitas Enzim Pada Berbagai Tingkatan Temperatur
Aktivitas protease diuji terhadap casein. Campuran 500 l 0,6% casein dalam Tris mM (pH 8,0) dan 100 l enzim diinkubasi selama 2 jam pada temperatur 40oC. Reaksi dihentikan dengan penambahan 500 l asam trichloroacetic 0,4 M dan diinkubasikan pada 40oC selama 10 menit. Campuran tersebut disentrifus, 200 l supernatan dicampur dengan 1 ml sodium carbonate dan 200 l reagen Folin-Ciocalteu, dan diinkubasikan pada 27oC, 37oC, 40oC, 50oC, 60oC, 70oC dan 80oC selama 20 menit. Jumlah degradasi ditentukan dari absorbansi pada 578 nm (Kong et al., 2000; dan Balqis et al., 2006). Aktivitas 1 unit enzim ditetapkan sebagai jumlah enzim yang dibutuhkan untuk menguraikan 1g tyrosine dari casein di dalam 1 ml volume reaksi per menit. Pengukuran aktivitas enzim mengikuti metode Bergmeyer (Rukayadi dan Suhartono, 1999) seperti yang disajikan pada Tabel 1. Untuk setiap sampel yang dianalisis, harus disertai dengan blanko dan standar, dengan perincian sebagai berikut.
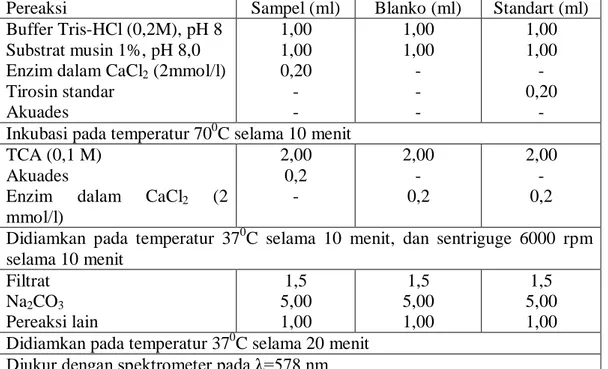
Tabel 1. Prosedur pengukuran aktivitas protease mengikuti metode Bergmeyer (Rukayadi dan Suhartono, 1999)
Pereaksi Sampel (ml) Blanko (ml) Standart (ml)
Buffer Tris-HCl (0,2M), pH 8 Substrat musin 1%, pH 8,0 Enzim dalam CaCl2 (2mmol/l)
Tirosin standar Akuades 1,00 1,00 0,20 - - 1,00 1,00 - - - 1,00 1,00 - 0,20 - Inkubasi pada temperatur 700C selama 10 menit
TCA (0,1 M) Akuades
Enzim dalam CaCl2 (2
mmol/l) 2,00 0,2 - 2,00 - 0,2 2,00 - 0,2 Didiamkan pada temperatur 370C selama 10 menit, dan sentriguge 6000 rpm selama 10 menit Filtrat Na2CO3 Pereaksi lain 1,5 5,00 1,00 1,5 5,00 1,00 1,5 5,00 1,00 Didiamkan pada temperatur 370C selama 20 menit
81 Hasil dan Pembahasan
Senyawa PMSF merupakan inhibitor spesifik bagi protease serin secara sempurna menghambat aktivitas protease. Aktivitas enzim menurun sebesar 98,2% setelah penambahan inhibitor 0,5 mM PMSF dan aktivitasnya hilang 100% setelah penambahan 1 mM PMSF. Sebaliknya, penambahan inhibitor/aktivator jenis yang lain yaitu EDTA dan phenantrolin spesifik untuk protease metal, pepstatin A spesifik untuk protease asam dan E-64 spesifik untuk protease sistein, tidak menghambat aktivitas enzim protease dari ekskretori/sekretori stadium L3 A.
galli. Berdasarkan hasil yang diperoleh, maka enzim dari ekskretori/sekretori
digolongkan sebagai enzim protease serin. Persentase aktivitas protease terhadap inhibitor/aktivator disajikan dalam Tabel 2.
Tabel 2. Pengaruh inhibitor atau aktivator terhadap aktivitas protease Inhibitor/aktivator Konsentrasi akhir
Aktivitas (%)
Kontrol 100,0
Inhibitor serin: PMSF 0,5 mM 1,8
1 mM 0
Inhibitor metal: EDTA 1 mM 107,1
10 mM 96,7
1,10-phenanthroline 1 mM 91,4
Inhibitor aspartat: Pepstatin A 1 g/ml 109,4
Inhibitor sistein: E-64 10 g/ml 93,1
50 g/ml 98,2
Inhibitor yang digunakan pada penelitian ini adalah inhibitor protease PMSF 0,5 dan 1 mM, EDTA 1 dan 10 mM, 1,10-phenanthroline 1 mM, pepstatin A 1 g/ml, dan E-64 (10 g/ml dan 50 g/ml). Hasil penelitian menunjukkan bahwa penambahan PMSF menyebabkan penurunan aktivitas enzim yang sangat besar. Seperti yang disajikan pada Tabel 2 terlihat bahwa aktivitas proteolitik sangat dihambat oleh PMSF. Semakin tinggi kadar PMSF semakin besar pula daya hambatnya. Penambahan PMSF 0,5 mM menyebabkan aktivitas yang tersisa tinggal 1,8%, sedangkan pada penambahan PMSF 1 mM tidak ada aktivitas enzim yang tersisa (0%). Penghambatan aktivitas enzim oleh PMSF menunjukkan bahwa
82 enzim yang diekskresi/sekresikan oleh stadium L3 A. galli diklasifikasikan ke
dalam jenis protease serin (Kong et al., 2000 dan Ford, 2005).
Penambahan inhibitor EDTA 1 dan 10 mM, 1,10-phenanthroline 1 mM, pepstatin A 1 g/ml, dan E-64 (10 g/ml dan 50 g/ml) tidak terlalu berpengaruh terhadap aktivitas proteolitik (Tabel 2). EDTA dan 1,10- phenanthroline adalah inhibitor spesifik terhadap enzim metalloprotease, sedangkan pepstatin A adalah inhibitor spesifik untuk enzim aspartil protease sehingga inhibitor tersebut tidak mampu menghambat aktivitas enzim proteolitik jenis serin (Cock et al., 1993).
Suhartono (1989) menyatakan bahwa senyawa inhibitor adalah senyawa yang dapat mengubah kemampuan enzim dalam mengikat substrat sehingga menyebabkan perubahan daya katalisator enzim. Perubahan ini disebabkan oleh struktur enzim yang mengalami perubahan fisik kimiawi sedemikian rupa sehingga aktivitas hayatinya menjadi berubah. Menurut Palmer (1991) protease serin memiliki sisi katalitik yang terdiri dari asam amino serin, histidin, dan aspartat. Inhibitor PMSF akan bereaksi dengan gugus –OH dari serin yang menyebabkan terjadinya efek penghambatan yang irreversible. Adanya penghambatan aktivitas enzim oleh PMSF menunjukkan bahwa enzim proteolitik ini termasuk dalam kelompok protease serin.
Lehninger (1975) menyatakan bahwa oleh karena reaksi kimia dapat dipengaruhi oleh temperatur, maka reaksi yang menggunakan katalis enzim dapat pula dipengaruhi oleh temperatur. Pada temperatur rendah reaksi kimia berlangsung lambat, sedangkan pada temperatur yang lebih tinggi reaksi berlangsung lebih cepat. Selain itu, karena enzim adalah suatu protein, maka kenaikan temperatur dapat menyebabkan terjadinya proses denaturasi. Apabila terjadi proses denaturasi, maka bagian aktif enzim akan terganggu dan dengan demikian konsentrasi efektif enzim menjadi berkurang dan kecepatan reaksinya pun akan menurun. Kenaikan temperatur sebelum terjadinya proses denaturasi dapat menaikkan kecepatan reaksi. Peningkatan temperatur dapat meningkatkan reaksi enzim yang terkatalisis dan yang tidak terkatalisis dengan cara meningkatkan energi kinetik dan frekuensi tubrukan dari besarnya molekul.
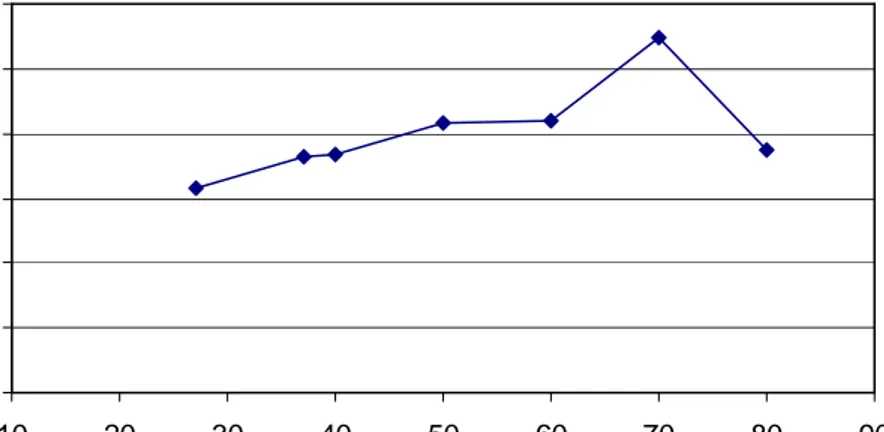
Hasil uji pengaruh temperatur terhadap aktivitas enzim protease yang diekskresi/sekresikan oleh stadium L3 A. galli disajikan pada Gambar 1.
83 Temperatur yang digunakan adalah 27oC, 37oC, 40oC, 50oC, 60oC, 70oC dan 80oC. Aktivitas enzim terlihat pada temperatur 27oC dan terjadi peningkatan bertahap sampai pada temperatur 60oC. Aktivitas enzim sangat meningkat pada suhu 70oC, dan menurun pada suhu 80oC. Berdasarkan hasil yang diperoleh diketahui bahwa temperatur optimum untuk aktivitas enzim pada crude ekskretori/sekretori stadium L3 A. galli adalah 70oC.
0 0.002 0.004 0.006 0.008 0.01 0.012 10 20 30 40 50 60 70 80 90 Temperatur (oC) A k ti v it a s e n z im ( U /m l)
Gambar 1. Pengaruh temperatur terhadap aktivitas enzim ekskretori/sekretori stadium L3 A. galli
Aktivitas protease pada penelitian ini terukur mulai dari temperatur 27oC sampai 80oC. Temperatur optimum protease ini adalah 70oC (Gambar 1), dan stabil selama 30 menit pada 50oC tetapi aktivitasnya menurun 20% pada inkubasi selama 10 menit dengan temperatur 55oC. Peranan temperatur pada reaksi enzimatik adalah untuk menjaga agar enzim dapat menjalankan aktivitas katalitik terbaiknya (Palmer, 1991).
Menurut Berasain (1997) pelepasan protease serin oleh cacing trematoda
Fasciola hepatica ditujukan untuk mendegradasi matriks ekstraselular dan
komponen membran dasar agar parasit berhasil menginvasi ke jaringan. Pelepasan protease serin oleh L3 A. galli mungkin berkaitan dengan proses invasi larva ke
jaringan untuk menjalani fase histotrofik, dimana stadium L3 A. galli
melangsungkan fase histotrofik harus menembus pertahanan selaput lendir untuk
84 histotrofik yang dibutuhkan larva A. galli adalah 3 – 54 hari pascainfeksi (Permin dan Hansen, 1998).
Kesimpulan Dari hasil penelitian dapat disimpulkan:
1. Aktivitas enzim dihambat oleh PMSF 0,5 mM sehingga digolongkan sebagai protease serin.
2. Ekskretori/sekretori yang dilepaskan L3 A. galli mengandung enzim
protease dengan temperatur optimum aktivitas enzim pada 70oC.
Ucapan Terima Kasih
Ucapan terima kasih penulis sampaikan kepada Sulaeman yang telah berperan sebagai teknisi yang menyiapkan cacing A. galli, dan Ika Malika yang telah berperan sebagai teknisi yang menyiapkan pengujian aktivitas enzim. Ucapan terima kasih juga penulis sampaikan kepada Kementrian Negara Riset dan Teknologi yang telah membiayai Riset ini melalui Riset Unggulan Terpadu 2005 s.d 2007.
Daftar Pustaka
Balqis U, Darmawi, dan Tiuria R. 2005. Purifikasi dan Karakterisasi Proteinase dari Substansi Bioaktif Stadium Transisi L3 – L4 Ascaridia galli dan
Aplikasinya Sebagai Kandidat Vaksin Terhadap Ascaridiosis pada Ayam Petelur. Laporan Riset Unggulan Terpadu. Kementrian Negara Riset dan Teknologi – RI.
Balqis U, Darmawi, dan Tiuria R. 2006. Purifikasi dan Karakterisasi Proteinase dari Substansi Bioaktif Stadium Transisi L3 – L4 Ascaridia galli dan
Aplikasinya Sebagai Kandidat Vaksin Terhadap Ascaridiosis pada Ayam Petelur. Laporan Riset Unggulan Terpadu. Kementrian Negara Riset dan Teknologi – RI.
Berasain P. 1997. Proteinases Secreted by Fasciola hepatica Degrade Extracellular Matrix and Basement Membran Components. J. Parasitol. 83(1): 1 – 5.
Cock HD, Knox DP, Claerebout E, and Graaf DCD. 1993. Partial Characterization of Proteolytic Enzymes in Different Developmental Stages of Ostertagia ostertagi. J. of Helminthol. 67: 271 – 278.
Ford L. 2005. Characterization of a Novel Filarial Serine Protease Inhibitor, Ov-SPI-1, from Onchocerca volvulus, with Potential Multifunctional Roles during Development of the Parasite. J. Biol. Chem. 280(49): 40845 – 40856. http://www.jbc.org/cgi/content/full/ (16 Mei 2006).
85 Hadas E and Stankiewicz M. 1997. Proteolytic Enzymes of Infective Larvae and Adults of Trichostrongylus colubriformis and Haemonchus contortus.
Parasitol. Res. 83: 47 – 51.
Iglesias L, Malagon D, Valero A, Benitez R, and Adroher FJ. 2005. CO2-fixing
Enzymes During Moulting from Third Larval to Fourth Larval Stage of
Anisakis simplex and Hysterothylacium aduncum (Nematoda: Anisakidae). http://parasitology.informatik.uni-wuerzburg.de/ (04 Oktober 2005)
Kong HH, Kim TH, and Chung DI. 2000. Purification and Characterization of a Secretory Serine Proteinase of Acanthamoeba healyi Isolated from Gae. J. of Parasitol. 86(1): 12 – 17.
Lehninger, A. 1975. Biochemistry, second edition. 444 Park Avenue South: New York.
Palmer T. 1991. Understanding Enzymes. 3rd ed. Ellis Horwood Chichester, West Sussex, England.
Permin A and Hansen JW. 1998. Epidemiology, Diagnosis and Control of Poultry Parasites. Food and Agriculture Organization of the United
Nations, Rome.
Rhoads ML, Fetterer RH, and Urban Jr. JF. 1997. Secretion an Aminopeptidase During Transition of Third–to Fourth–Stage Larvae of
Ascaris suum. J. of Parasitol. 83(5): 780 – 784.
Rhoads ML, Fetterer RH, and Urban Jr. JF. 2001. Release of Hyaluronidase During in vitro Development of Ascaris suum from the Third to Fourth Larval Stage. Parasitol. Res. 87(9): 693 - 697.
http://www.edpsciences.org/articles/vetres/pdf/ (12 Agustus 2006).
Rukayadi Y dan Suhartono MT. 1999. Penuntun Praktikum Biokimia (BIM.511).
Program Pascasarjana, IPB-Bogor.
Suhartono MT. 1989. Enzim dan Bioteknologi. Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi.
Todorova VK. 2000. Proteolytic Enzymes Secreted by Larval Stage of the Parasitic Nematode Trichinella spiralis. Fol. Parasitol. 47: 141 - 145.