1 BAB I
PENDAHULUAN
1.1. Latar Belakang
Tanaman bawang putih (Allium sativum Linn.) adalah tanaman holtikultura yang memiliki banyak manfaat terutama umbinya berguna sebagai bumbu dan dapat digunakan untuk mengobati beberapa penyakit seperti infeksi pernafasan dan untuk meningkatkan vitalitas tubuh (Pratimi, 1995). Wijaya et al. (2014) menyatakan bahwa produksi bawang putih di Indonesia belum mampu memenuhi permintaan kebutuhan pangan masyarakat sehingga menyebabkan selisih dan kekosongan yang cukup besar diantara konsumsi dan produksi dalam negeri. Peristiwa ini menyebabkan terjadinya defisit produksi yang mengharuskan pemerintah melakukan impor untuk memenuhi konsumsi komoditas tersebut (Wibowo, 2006).
Pada tahun 2012 produksi bawang putih Indonesia adalah 296.500 ton, sementara permintaan bawang putih nasional sebesar 400.000 ton. Untuk memenuhi kebutuhan bawang putih nasional, pemerintah Indonesia melakukan impor bawang putih tahun 2013 sebesar 320 ribu ton terutama impor bawang putih asal Cina. Peningkatan volume impor ini disebabkan oleh beberapa kendala seperti luas lahan yang sempit, biaya tinggi, kualitas bibit bawang putih yang digunakan rendah serta ketergantungan masyarakat Indonesia terhadap konsumsi bawang putih (BPS, 2012). Untuk mengatasi permasalahan tersebut diperlukan suatu usaha seperti pemuliaan tanaman yang dapat menghasilkan produksi
2
kultivar-kultivar unggul bawang putih di Indonesia ialah Lumbu putih, Lumbu hijau, Jalibarang, Banjarsari, Sanur I, Sanur II, Kediri (Bagor), Layur, dan Honya (kultivar lokal Majalengka) (Lamina, 1990 ; Wibowo, 2006).
Salah satu kultivar bawang putih yang ditanam di Bali adalah kesuna bali. Kesuna bali hanya memiliki satu siung sedangkan bawang putih biasa memiliki banyak siung. Kualitas bibit kesuna bali yang rendah dan mudah terserang penyakit menyebabkan para petani mengganti penanaman kesuna bali dengan bawang putih biasa. Keunggulan yang dimiliki oleh kesuna bali yaitu rasa yang dihasilkan lebih pedas dibandingkan dengan bawang putih biasa. Selain itu kandungan antimikroba pada senyawa kimia kesuna bali lebih besar dibandingkan bawang putih biasa sehingga sering digunakan sebagai bahan obat tradisional (Pratimi, 1995). Untuk meningkatkan produksi kesuna bali diperlukan perbaikan sifat genetik dan agronomi. Perbaikan sifat genetik kesuna bali tidak dapat dilakukan dengan persilangan karena sebagian besar genus Allium tidak memiliki bunga. Perbaikan sifat dapat diupayakan dengan cara lain diantaranya dengan induksi mutasi (Chahal dan Gosal, 2002 ; Soedjono, 2003).
Salah satu induksi mutasi yang dikenal adalah induksi polipoid (Suryo, 2007). Induksi poliploid dapat dilakukan dengan pemberian mutagen kimia seperti kolkisin pada jaringan meristem tanaman (Sofia, 2007). Senyawa ini dapat menghalangi terbentuknya benang-benang spindel pada pembelahan sel sehingga menyebabkan terbentuknya individu poliploid. Penelitian induksi poliploid dari genus Allium sebelumnya telah dilakukan oleh Ritonga dan Wulansari (2011), penggunaan konsentrasi kolkisin sebesar 0.05%, 0.1% dan 0.2 % pada tanaman
3
bawang merah (Allium ascacolinum L.). Penggunaan kolkisin ini dapat meningkatkan jumlah kromosom serta menghasilkan kromosom ujung akar yang poliploid. Pernyataan ini diperkuat oleh Suminah et al. (2002) yang menyatakan pemberian kolkisin 1% terdapat variasi bentuk, ukuran dan jumlah kromosom pada ujung akar bawang merah. Poliploidi yang terbentuk dikelompokkan menjadi tetraploid (4n), pentaploid (5n), heksaploid (6n), oktaploid (8n), dan nonaploid (9n) dengan panjang kromosom berkisar 0.3 – 1 μm dan sebagian besar berbentuk metasentris.
Penelitian lainnya pada melon dikemukakan oleh Yuniasih (2011) yang menyatakan bahwa pemberian kolkisin pada konsentrasi 0.01% dengan lama perendaman 6 jam dapat menginduksi kecambah melon tetraploid. Dalam penelitian tersebut lama perendaman kolkisin berpengaruh nyata terhadap terbentuknya kromosom tetraploid pada tanaman melon. Pada umumnya kolkisin bekerja secara efektif pada konsentrasi 0.01-1% untuk jangka waktu 6-72 jam, namun dalam hal ini setiap jenis tanaman memiliki respon yang berbeda-beda (Suminah et al., 2002).
Menurut Hindarti (2002) secara morfologi konsentrasi kolkisin 0.01% menyebabkan peningkatan tinggi tanaman, diameter batang, volume umbi dan bobot siung pada tanaman bawang putih, tetapi tidak berpengaruh nyata terhadap jumlah siung yang dihasilkan. Kolkisin juga dapat menambah variasi genetik pada tanaman bawang putih lokal seperti kesuna bali. Variasi genetik yang terjadi akibat pemberian mutagen kolkisin dapat dideteksi dengan pengamatan karakter morfologi, anatomi, fisiologi dan penanda molekuler. Menurut Volk et al. (2003)
4
pengamatan karakter morfologi diperlukan untuk mengevaluasi variasi genetik pada tanaman bawang putih melalui diameter umbi, jumlah daun serta tinggi tanaman. Selain karakter morfologi, variasi genetik tanaman juga dapat dilihat dari penambahan jumlah kromosom. Menurut Suminah et al. (2002) perendaman ujung akar bawang merah (Allium ascolinum L.) dengan konsentrasi kolkisin 1% selama 6 jam dapat menambah jumlah kromosom menjadi tetraploid (4n), pentaploid (5n), heksaploid (6n), septaploid (7n), oktaploid (8n) dan nonaploid (9n). Variasi genetik pada tingkat ploidi juga dapat dilihat dari indeks stomata tanaman. Penelitian Lu dan Bridgen (1997) melaporkan bahwa tanaman Alstroemaria sp diploid mempunyai 39 stomata per mm2 dan tanaman yang tetraploid mempunyai kerapatan stomata lebih rendah, yaitu 22 stomata per mm2.
Pengamatan karakter morfologi dinilai kurang akurat dalam menentukan variasi genetik pada tingkat ploidi. Dalam hal ini, sebagian besar karakter yang nampak merupakan interaksi genetik dan kondisi lingkungan (Zainudin, 2006). Oleh karena itu, diperlukan upaya analisis dengan penanda molekuler. Penanda molekuler telah berhasil dalam mengevaluasi keragaman, evolusi pada tingkat genetik serta mengindentifikasi peta genetik dari suatu kultivar tanaman (Hoon-Lim et al., 1999). Salah satu penanda molekuler yang umum digunakan adalah RAPD (Random Amplified Polymorphic DNA). RAPD dapat menyediakan penanda polimorfisme pola pita DNA dalam jumlah banyak. Pada penelitian yang dilakukan oleh Al-Zahim et al. (1997) dari 35 primer RAPD yang digunakan untuk pengklasifikasian tanaman bawang putih diperoleh 26 primer yang membentuk pola pita polimorfik.
5
RAPD mampu menentukan adanya keanekaragaman (polimorfisme) genetik tanaman yang dihasilkan dengan pemberian mutagen kolkisin (Hardiyanto et al., 2008). Hasil penelitian Zainudin (2006) menunjukkan bahwa dengan penetesan kolkisin 0%-0.9% pada Protocorm-like Bodies (PLB) anggrek Onicidium didapatkan perbedaan pada pola pita-pita DNA genomik dengan menggunakan 6 primer melalui proses RAPD.
1.2. Rumusan Masalah
1. Bagaimana pengaruh pemberian konsentrasi kolkisin (Biotech Agro) terhadap fenotipe dan jumlah kromosom dari tanaman kesuna bali (Allium sativum Linn.)?
2. Bagaimana variasi genetik tanaman kesuna bali yang dihasilkan dari pemberian kolkisin (Biotech Agro) berdasarkan marka molekuler RAPD?
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Menganalisis pengaruh perlakuan kolkisin (Biotech Agro) terhadap fenotipe dan jumlah kromosom dari tanaman kesuna bali (Allium sativum Linn.).
2. Mendeteksi variasi genetik melalui ada tidaknya perubahan DNA dengan penanda RAPD.
6 1.4. Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat diperoleh tanaman kesuna bali yang bersifat poliploid dengan fenotipe umbi yang besar dan tanaman yang kokoh. Manfaat lainnya adalah dapat diperoleh tanaman kesuna bali yang bervariasi secara genetik akibat pemberian kolkisin yang berguna sebagai bahan dalam perakitan varietas unggul.
7 BAB II
KAJIAN PUSTAKA
2.1 Bawang Putih (Allium sativum Linn.)
2.1.1 Deskripsi Bawang Putih (Allium sativum Linn.)
Tanaman bawang putih (Allium sativum Linn.) merupakan tanaman monokotil dan berumpun. Bawang putih memiliki sistem perakaran serabut dan dangkal serta berada di permukaan tanah, sehingga tanaman ini sangat rentan terhadap cekaman kekeringan. Fungsi dari sistem perakaran serabut pada tanaman ini adalah untuk menyerap atau mengisi air dan nutrisi yang ada disekitarnya. Bagian yang berfungsi sebagai batang pada tanaman bawang putih adalah cakram. Cakram berbentuk lingkaran pipih terdapat di dasar umbi dan memiliki struktur kasar dan padat. Fungsi dari cakram pada tanaman bawang sebagai batang pokok yang tidak sempurna dan terletak di dalam tanah. Pada permukaan bawah cakram tumbuh akar serabut dari tanaman bawang. Tanaman bawang putih juga memiliki batang semu yaitu kumpulan dari kelopak daun yang saling membungkus kelopak daun dibawahnya sehingga terlihat seperti batang. Satu bongkahan bawang putih terdiri dari beberapa siung yang mengelompok dan berkumpul dalam satu cakram yang ditunjukkan pada Gambar 2.1 (Thomson, 2007).
8 Gambar 2.1
Bawang Putih Tunggal (kesuna bali) (Allium sativum Linn.)
Daun dari tanaman bawang putih ini memiliki ciri helai daun menyerupai pita, tipis dan bagian pangkalnya membentuk sudut. Daun berwarna hijau, bagian atas daun terlihat lebih gelap dan sisi bawah daun berwarna lebih cerah (Gambar 2.2). Kelopak daun menutupi siung umbi bawang putih hingga pangkal daun. Kelopak ini membalut bagian kelopak daun yang lebih muda sehingga membentuk suatu batang semu yang posisinya tepat berada pada umbi bawang. Tanaman bawang putih tidak memiliki bunga, karena itu tanaman ini tidak dapat dibiakkan dengan persilangan. Ukuran siung dari tanaman bawang putih bervariasi tergantung pada varietasnya, siung memiliki bentuk lonjong. Untuk varietas lokal rata-rata menghasilkan 15-20 siung setiap umbinya (Suriana, 2011).
Daun
Umbi Cakram
9 Gambar 2.2
Kesuna Bali (Allium sativum Linn.)
Pada pemotongan bagian punggung dari bawang putih secara vertikal, akan terlihat pertumbuhan bibit vegetatif. Oleh karena itu, siung bawang putih dapat dijadikan sebagai calon benih untuk pertanaman selanjutnya. Sebagai calon benih, siung bawang putih melewati masa dormansi sekitar 6-8 bulan (Suriana, 2011).
2.1.2 Syarat Tumbuh Bawang Putih (Allium sativum Linn.)
Tanaman bawang putih dapat tumbuh pada berbagai ketinggian tergantung pada varietas yang digunakan. Daerah pertanaman bawang putih terbaik berada pada ketinggian 600 m dpl (di atas permukaan laut) (Marpaung, 2010). Menurut Sarwadana dan Gunadi (2007) selain di dataran tinggi tanaman bawang putih juga dapat dikembangkan di dataran rendah. Hal ini dibuktikan dengan bawang putih varietas Lokal Sanur yang telah berhasil beradaptasi sangat baik di dataran rendah sehingga sangat berpotensi untuk dikembangkan sebagai varietas dataran rendah.
10
Jenis tanah yang cocok untuk pertumbuhan tanaman bawang putih adalah grumusol (ultisol). Kondisi tanah yang porous menstimulir perkembangan akar dan bulu-bulu akar sehingga serapan unsur hara akan berjalan dengan baik. Pada musim penghujan kurang baik digunakan untuk penanaman bawang putih karena suhu rendah dan kondisi tanah terlalu basah sehingga mempersulit pembentukan siung (Thomsom, 2007).
2.1.3 Kandungan Kimia Bawang Putih (Allium sativum Linn.)
Tanaman bawang putih (Allium sativum Linn.) memiliki aroma yang menusuk tajam dan rasa yang persisten. Tanaman bawang putih memiliki aroma yang khas berasal dari zat aktif utama yaitu allicin. Aroma yang dihasilkan ketika senyawa allicin bereaksi dengan enzim alinase. Minyak atsiri yang dihasilkan dari umbi bawang putih berkisar antara 0,1-0,3 % dengan kandungan allil propil dan dialil disulfida. Bawang putih memiliki kandungan enzim-enzim antara lain allinase, peroxides, dan myrosinase (Kemper, 2000).
2.1.4 Kesuna Bali (Allium sativum Linn.)
Dalam sejarah Bali umbi (mula) banyak dimanfaatkan sebagai bahan ramuan obat. Dalam kitab Ayurveda dijelaskan bahwa ada banyak umbi yang dapat digunakan untuk menyembuhkan berbagai macam penyakit serta tanamannya mudah diperoleh di Indonesia. Salah satu tanaman yang umbinya sering digunakan sebagai bahan ramuan obat adalah kesuna bali (Nala, 2004). Dalam sejarahnya kesuna bali (rasona=sansekerta) merupakan tanaman yang
11
memiliki umbi atau mula berwarna putih mengkilat, diibaratkan seperti tetesan air suci yang jatuh ke bumi. Oleh karena itu umbi dari kesuna bali banyak dimanfaatkan sebagai ramuan obat oleh masyarakat di Bali terutama para balian (dukun). Manfaat dari umbi kesuna bali ini dapat meningkatkan nafsu makan, aprodisiaka, menurunkan panas badan, penghilang perut kembung, untuk obat patah tulang, diare, dan sakit tenggorokan (Nala, 2004).
Kesuna bali merupakan salah satu kultivar bawang putih lokal yang hanya menghasilkan satu siung saja. Faktor lingkungan pertanaman yang tidak mendukung pertumbuhan, mengakibatkan hanya berkembang satu tunas utama. Tunas utama ini akan tumbuh dominan terhadap pertumbuhan tanaman serta menekan tunas lain yang merupakan bakal dari pertumbuhan siung-siung berikutnya, sehingga hanya terbentuk siung tunggal yang utuh (Barnes, 2007).
Menurut Barnes (2007) tanaman bawang putih tunggal bukan merupakan varietas melainkan suatu kultivar karena hanya bersifat sementara. Apabila tanaman ini ditanam di dataran yang kondisinya sesuai maka akan menghasilkan jumlah siung yang banyak. Hal ini menunjukkan bahwa bawang putih memiliki sifat yang sensitif terhadap perubahan lingkungan sekitar.
2.2 Mutasi
Mutasi adalah suatu perubahan genetik pada sejumlah gen atau susunan kromosom maupun gen tunggal. Pada peristiwa mutasi terjadi perubahan terhadap urutan (sequences) nukleotida DNA sehingga menyebabkan perubahan pada protein yang dihasilkan (Nasir, 2002).
12
Mutasi lebih sering terjadi pada bagian sel yang sedang aktif membelah, misalnya pada tunas dan biji. Berdasarkan proses terjadinya, mutasi dibagi menjadi dua yaitu mutasi alami dan mutasi induksi. Dalam pemuliaan tanaman inkonvensional mutasi induksi lebih sering digunakan karena dapat menambah keanekaragaman genetik dari tanaman (Sofia, 2007).
Senyawa mutagen dapat dikelompokkan menjadi dua yaitu mutagen fisik dan mutagen kimia. Mutagen fisik yang sering digunakan untuk bahan penelitian contohnya seperti sinar X, sinar α, sinar β sinar γ dan sinar UV sedangkan mutagen kimia contohnya seperti EMS (ethylene methane sulfonate), NMU (nitrosomethyl urea), dan NTG (nitrosoguanidine) (Purwati, 2009). Yusdar et al. (1997) menyatakan bahwa perbaikan mutu umbi bawang putih perlu dilaksanakan secara inkonvensional. Perbaikan mutu ini dilakukan dengan tujuan meningkatkan variasi genetik tanaman bawang putih. Hasil penelitian yang dilakukan Permadi et al. (1991) menunjukkan bahwa mutagen kimia seperti kolkisin sangat efektif digunakan dalam menghasilkan tanaman poliploid. Dengan lama perendaman selama 3 jam serta konsentrasi kolkisin 0.1% dan 0.15% yang digunakan dapat menghasilkan bibit tanaman bawang merah yang poliploid.
Penggunaan mutagen fisik seperti iradiasi sinar gamma hanya dapat dimanfaatkan untuk menghasilkan biji-biji dari tanaman padi dan palawija agar berumur pendek, tahan serangan hama dan cepat panen. Sedangkan penggunaan mutagen kimia seperti kolkisin banyak menghasilkan keuntungan diantaranya dapat menyebabkan tanaman memiliki ukuran buah yang lebih besar serta tidak berbiji (Soedjono, 2003).
13 2.3 Mutagen Kolkisin
Senyawa kolkisin adalah suatu alkaloid yang berasal dari umbi dan biji tanaman krokus (Colchicum autumnale Linn.) famili Liliaceae. Rumus kimia kolkisin adalah C22H25O6N dan struktur kimia kolkisin adalah :
Gambar 2.3
Struktur Molekul Kolkisin Murni (Eigsti dan Dustin, 1995)
Senyawa kolkisin merupakan reagen penting dalam peristiwa mutasi yang dapat menyebabkan terjadinya tanaman poliploid. Sifat umum yang ditampilkan oleh tanaman poliploid adalah tanaman menjadi lebih kekar, bagian-bagian tanaman seperti akar, batang, daun, bunga dan buah menjadi lebih besar. Efektifitas kerja larutan kolkisin dalam menginduksi mutasi tanaman bawang putih berkisar antara 0.01%-1.00%, sedangkan lama waktu perendaman dalam kolkisin berkisar antara 3-24 jam (Hindarti, 2002).
Konsentrasi larutan kolkisin dan lama waktu perendaman yang belum tepat tidak akan menghasilkan tanaman dengan sifat poliploid (Sofia, 2007). Demikian pula sebaliknya apabila konsentrasi larutan kolkisin terlalu tinggi dengan perendaman yang terlalu lama maka senyawa kolkisin akan memperlihatkan efek negatif yaitu penampilan tanaman menjadi tidak bagus, sel-sel pada tanaman rusak hingga dapat menyebabkan kematian pada tanaman (Asif et al., 2000). Permadi et al. (1991) menemukan bahwa konsentrasi kolkisin 0.04%
14
dengan lama perendaman selama 3 jam dapat menyebabkan terjadinya depresi pertumbuhan dan vigor pada tanaman bawang merah Sumenep. Selain depresi pertumbuhan konsentrasi kolkisin yang tinggi juga menyebabkan penyusutan jumlah daun, stomata yang lebih sedikit dan berat kering yang lebih rendah dari tanaman kontrol pada bawang merah Sumenep. Pemberian senyawa kolkisin tidak berpengaruh terhadap pertambahan jumlah siung pada tanaman bawang putih (Hindarti, 2002).
2.4 Deteksi Mutan
2.4.1 Deteksi Mutan Secara Morfologi
Deteksi mutan secara morfologi dan fisiologi dapat ditunjukkan dengan karakter-karakter pertumbuhan seperti tinggi tanaman, jumlah daun, panjang daun dan indeks stomata. Pernyataan ini diperkuat oleh hasil penelitian Ritonga dan Wulansari (2011) yang menemukan bahwa pemberian kolkisin pada konsentrasi 0.05% dapat menambah ukuran akar pada tanaman bawang merah (Allium ascalonicum L.). Penelitian Permadi et al. (1991) pada tanaman bawang merah Sumenep diperoleh bentuk daun yang pendek, daun lebih tebal, jumlah daun sedikit, dan lingkar daun semakin besar. Dosis yang efektif dalam menginduksi mutasi pada bawang merah ini adalah pada konsentrasi 0.04% dengan lama perendaman selama 3 jam.
Kolkisin sering digunakan untuk menghasilkan sel-sel poliploid buatan. Aplikasi kolkisin pada tanaman dilakukan dengan meneteskan atau merendam bagian tanaman dalam larutan kolkisin selama satu hari (Permatasari, 2007). Pada
15
tanaman kapri, penggunaan kolkisin dengan konsentrasi 0.0005 % dan 0.001% dengan lama perendaman selama satu jam, secara umum menghasilkan mutan poliploid memiliki bagian-bagian tanaman yang lebih besar dibandingkan tanaman normal (Murfadalina, 1997).
2.4.2 Deteksi Melalui Perhitungan Jumlah Kromosom
Mutan poliploid memiliki perubahan jumlah kromosom dari diploidnya. Kondisi kromosom yang poliploid ditunjukkan dengan adanya kelipatan dari jumlah kromosom dasarnya (Suminah et al., 2002). Tanaman bawang putih diploid (2n = 16) kemungkinan besar dapat ditingkatkan jumlah kromosomnya menjadi triploid (3n=24), tetraploid (4n=32) dan heksaploid (6n=48).
Menurut Prematilake (2005) pada umumnya tanaman normal memiliki dua pasang kromosom, namun beberapa tanaman memiliki jumlah pasang kromosom lebih dari dua contohnya kentang (tetraploid, 2n=4x= 48) dan gandum roti (heksaploid, 2n=6x=42). Tanaman kentang (Solanum tuberosum) adalah jenis tanaman kentang autotetraploid karena penggandaan jumlah kromosom terjadi secara alamiah, sedangkan tanaman serealia seperti gandum roti (Triticum aestivum) termasuk aloheksaploid karena tanaman ini merupakan hasil persilangan dari nenek moyang alotetraploid (4X) AABB dengan rumput diploid liar DD.
16 2.5 Deteksi Mutan dengan RAPD
Variasi genetik tanaman yang terjadi akibat mutasi dapat dideteksi dengan marka molekuler (DNA). Terdapat beberapa kelemahan karakter morfologi dalam analisis variasi genetik tanaman diantaranya hasil analisis yang dihasilkan tidak konsisten karena penampakan morfologi pada tanaman mungkin akan berubah saat tanaman memasuki fase pertumbuhan tertentu. Perubahan morfologi tanaman sangat dipengaruhi oleh faktor lingkungan serta mempunyai efek pleiotropi dan epistasi. Pada tanaman tahunan perubahan morfologi membutuhkan waktu yang sangat lama (Brar, 2002).
RAPD merupakan salah satu teknik marka molekuler yang banyak dijumpai dalam mendeteksi polimorfik DNA antar individu yang didasarkan pada hasil amplifikasi reaksi berantai polymerase (PCR). Primer yang digunakan berukuran 10 oligonukleotida dan primer yang umum digunakan. dalam RAPD adalah primer Operon dari Operon Technologies. Teknik RAPD memiliki kelebihan dibandingkan teknik yang lain diantaranya sampel DNA yang dibutuhkan dalam jumlah yang sedikit (10-25 ng), tidak bersifat radioaktif dan menghasilkan estimasi yang lebih tinggi untuk kesamaan interspesifik (Prana dan Hartati, 2003). Hasil penelitian yang dilakukan oleh Hardiyanto et al. (2008) pada 10 klon bawang putih lokal menggunakan 10 primer acak pada RAPD, didapatkan sekitar 79.5% fragment DNA bersifat polimorfik dan hanya 20.5% fragment DNA yang monomorfik.
17
Analisis DNA poliploid dengan marka RAPD dapat menunjukkan banyaknya pita DNA yang polimorfik. Aksi mutagenik dari senyawa kolkisin dapat menyebabkan perbedaan urutan basa nukleotida pada titik penempelan primer. Hal ini mengakibatkan primer tidak dapat menempel pada bagian tertentu sehingga tidak terjadi amplifikasi (Escand et al., 2005). Pernyataan tersebut didukung oleh Purwantoro et al. (2007) yang melaporkan bahwa konsetrasi kolkisin 0.75% dapat meningkatkan jumlah tanaman bunga kertas (Zinnia spp.) yang poliploid. Senyawa mutagenik kolkisin menyebabkan perubahan pada urutan basa nukleotida sehingga semakin tinggi konsentrasi kolkisin yang diberikan semakin besar jumlah mutasi yang dihasilkan.
Senyawa mutagenik kolkisin dapat pula menyebabkan perbedaan pada ukuran pita DNA tanaman. Zainudin (2006) melaporkan bahwa dengan penetesan larutan kolkisin 0.01%, 0.03%, 0.05%, 0.07% dan 0.09% didapatkan perbedaan pola pita DNA pada Protocorm like-bodies (PLB) anggrek dari ukuran pita 500-1000bp, 1000-1500bp dan 1500-2642bp.
18 BAB III
KERANGKA BERPIKIR DAN KONSEP PENELITIAN
3.1 Kerangka Berpikir
Komoditas sayuran yang banyak mendatangkan keuntungan terutama dari segi ekonomi adalah bawang putih (Allium sativum Linn.). Kebutuhan bawang putih di Indonesia terus-menerus meningkat sejalan dengan membaiknya perekonomian nasional yang diikuti dengan meningkatnya pengetahuan masyarakat akan pentingnya gizi dari komoditas tersebut. Meningkatnya jumlah konsumsi tidak sebanding dengan produktivitas hasil yang masih rendah, oleh karena itu pemerintah lebih banyak melakukan impor terhadap komoditas bawang putih (Yusdar et al., 1997).
Bawang putih lokal yang perlu dilakukan perbaikan genetik adalah kesuna bali. Kesuna bali merupakan salah satu kultivar bawang putih lokal yang ditanam di Bali dan hanya berkembang dengan satu siung saja. Keunggulan dari kultivar ini adalah umbinya banyak dijadikan untuk bahan obat serta memiliki aroma dan rasa yang lebih nikmat dibandingkan dengan bawang putih biasa. Untuk itu perlu dilakukan usaha untuk meningkatkan kualitas dari kultivar ini dengan cara induksi poliploid menggunakan senyawa kimia kolkisin (Hardiyanto et al., 2008 : Syamsiah dan Tajudin, 2005).
Pemberian konsentrasi kolkisin dan lama perendaman sangat berpengaruh dalam menghasilkan tanaman poliploid. (Chahal dan Gosal, 2002). Beberapa cara untuk mengamati perubahan ploidi akibat pemberian kolkisin
19
adalah melalui morfologi, sitologi dan molekuler. Secara morfologi, tanaman polipoid umumnya memiliki ukuran yang lebih besar (Sofia, 2007), sedangkan berdasarkan perhitungan kromosom akan terdapat penggandaan kromosom yang dapat berupa tertrapoid (4n), heksapoid (6n), septaploid (7n), oktaploid (8n) dan nanoploid (9n) (Suminah et al., 2002).
Variasi genetik yang dihasilkan akibat pemberian kolkisin dapat diamati dengan marka molekuler RAPD. Penelitian Purwantoro et al. (2007) menunjukkan tingkat poliploidi pada tanaman bunga kertas yang diberi kolkisin lebih banyak dibandingkan tanaman kontrol. Hal ini membuktikan bahwa semakin tinggi tingkat kolkisin yang diberikan maka semakin besar jumlah mutasi yang dihasilkan pada tanaman (Escand et al., 2005).
20 3.2 Konsep Penelitian
Kebutuhan Bawang Putih (Allium sativum Linn.) di Indonesia terus meningkat
Keanekaragaman yang Rendah dapat diatasi dengan Pemuliaan Mutasi
Pemuliaan Mutasi dengan Senyawa Kimia Kolkisin (C22H25O6N)
Konsentrasi 0, 5%, 10% dan 20% Kolkisin (C22H25O6N)
Mutan Bawang Putih Bali (Allium sativum Linn.)
Analisa morfologi : - Panjang dan jumlah
daun.
- Tinggi tanaman - Berat kering umbi
setelah panen Analisa Sitologi : - Indeks stomata - Perhitungan jumlah kromosom Analisa Molekuler dengan Marka RAPD
21 3.3 Hipotesis Penelitian
Hipotesis dari penelitian ini adalah sebagai berikut:
a) H0: Konsentrasi kolkisin tidak berpengaruh terhadap perubahan morfologi, anatomi dan sitologi pada tanaman kesuna bali.
b) H1: Konsentrasi kolkisin berpengaruh terhadap perubahan morfologi, anatomi dan sitologi pada tanaman kesuna bali.
22 BAB IV
METODELOGI PENELITIAN
4.1 Rancangan Penelitian
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak kelompok (RAK) dengan perlakuan konsentrasi kolkisin yang berbeda yaitu kontrol, konsentrasi kolkisin 5%, konsentrasi kolkisin 10% dan konsentrasi kolkisin 20%. Areal percobaan dibagi ke dalam enam kelompok (ulangan), masing-masing kelompok terdiri dari empat petak percobaan terdiri dari enam tanaman percobaan, kemudian akan dipilih empat tanaman secara acak untuk diamati. Keenam tanaman percobaan ditentukan secara acak letaknya pada masing-masing kelompok, seperti terlihat pada Gambar 4.1.
4.2 Lokasi dan Waktu Penelitian
Sampel tanaman kesuna bali diambil dari tanah pertanian di Desa Pakisan, Kecamatan Sawan, Kabupaten Buleleng Bali. Penanaman dilakukan di Pertanian Kreatif Matahari Terbit Sanur, Kecamatan Denpasar Timur. Pembuatan preparat kromosom, stomata dan ektraksi DNA dilakukan di Laboratorium Bioteknologi Jurusan Agroekoteknologi Fakultas Pertanian Universitas Udayana. Analisis PCR-RAPD dilaksanakan di Laboratorium Biomedik dan Biologi Molekuler Hewan Fakultas Kedokteran Hewan Universitas Udayana. Penelitian ini dilakukan dari bulan September 2013 – Agustus 2014.
23
Kelompok 1 Kelompok 2
Kelompok 3
Kelompok 5
Gambar 4.1 Denah Petak Percobaan
Keterangan a. P0 = Kontrol; b. P1 = Kolkisin 5% ; c. P2 = Kolkisin 10% dan d. P3 = Kolkisin 20% dan U: Nomor Polybag Tanaman (1-6)
P3 U5 P3 U6 P3 U4 P3 U2 P3 U3 P3 U1 P0 U6 P0 U2 P0 U1 P0 U5 P0 U3 P0 U4 P2 U2 P2 U5 P2 U4 P2 U6 P2 U1 P2 U3 P1 U3 P1 U4 P1 U5 P1 U1 P1 U2 P1 U6 P1 U2 P2 U5 P2 U6 P1 U1 P2 U4 P2 U2 P2 U3 P2 U4 P0 U6 P0 U1 P0 U5 P0 U4 P0 U2 P0 U3 P1 U3 P3 U5 P3 U3 P3 U4 P1 U4 P1 U5 P1 U6 P3 U6 P3 U2 P3 U1 P2 U6 P2 U5 P2 U4 P2 U3 P2 U2 P2 U1 P1 U6 P1 U2 P1 U1 P1 U5 P1 U2 P1 U1 P0 U6 P0 U1 P0 U2 P0 U5 P0 U4 P0 U3 P3 U5 P3 U3 P3 U4 P3 U1 P3 U2 P3 U6 P0 U4 P0 U3 P0 U2 P0 U6 P0 U1 P0 U5 P3 U3 P3 U5 P3 U2 P3 U6 P3 U4 P3 U1 P1 U6 P1 U1 P1 U3 P1 U5 P1 U4 P1 U2 P2 U3 P2 U6 P2 U2 P2 U4 P2 U1 P2 U5 P1 U1 Kelompok 4 P2 U1 P2 U6 P2 U5 P2 U4 P2 U2 P2 U3 P3 U6 P3 U1 P3 U5 P3 U4 P3 U3 P3 U2 P0 U6 P0 U1 P0 U2 P0 U5 P0 U4 P0 U3 P1 U5 P1 U3 P1 U1 P1 U2 P1 U6 P1 U4 P0 U2 P0 U5 P0 U3 P0 U1 P0 U6 P0 U4 P1 U3 P1 U2 P1 U5 P1 U4 P1 U1 P1 U6 P3 U1 P3 U6 P3 U5 P3 U4 P3 U3 P2 U2 P2 U5 P2 U4 4 P2 U3 P2 U6 P2 U1 P3 U2 Kelompok 6
24 4.3 Ruang Lingkup Penelitian
Adapun ruang lingkup penelitian pada tesis ini adalah induksi kolkisin terhadap tanaman kesuna bali untuk mendapatkan tanaman yang poliploid. Analisis morfologi, fisiologi, sitologi dan molekuler tanaman kesuna bali (Allium sativum Linn.) untuk mengamati pengaruh kolkisin terhadap tingkat ploidi.
4.4 Penentuan Sumber Data
Penelitian ini menggunakan umbi kesuna bali yang diambil dari dari tanah pertanian Desa Pakisan, Kecamatan Sawan, Kabupaten Buleleng Bali.
4.5 Variabel Penelitian
Adapun variabel dalam penelitian ini adalah :
a. Variabel bebas adalah variabel yang diduga sebagai sebab munculnya variabel lain. Variabel bebas dalam penelitian ini adalah konsentrasi senyawa kolkisin yaitu : 5%, 10% dan 20%.
b. Variabel terikat adalah variabel respon atau output, variabel ini muncul sebagai akibat dari manipulasi variabel lain. Variabel terikat dalam penelitian ini adalah respon dari tanaman kesuna bali, yaitu: karakter morfologi, anatomi tanaman dan analisis DNA tanaman kesuna bali.
25
Variabel-variabel yang diamati dalam penelitian ini adalah :
1. Morfologi tanaman kesuna bali setelah diberi perlakuan kolkisin yang berbeda meliputi: tinggi tanaman, panjang daun, jumlah daun dan berat kering umbi.
2. Anatomi tanaman kesuna bali yang meliputi: indeks stomata dan jumlah kromosom setelah diberi perlakuan kolkisin yang berbeda.
3. Analisis DNA dengan metode PCR-RAPD yang digunakan umtuk mengetahui perbedaan pola pita DNA tanaman kesuna bali yang termutasi.
4.6 Bahan Penelitian
Adapun bahan penelitian ini antara lain : 144 umbi kesuna bali, kertas label, kolkisin (Biotech Agro), polibag dan media tanam (campuran pasir, pupuk kandang dan pupuk pubotan dengan perbandingan 1:2:1), untuk analisis kromosom digunakan bahan : aquades, alkohol, asam asetat glacial, HCL, aceto-orcein. Analisis DNA menggunakan bahan: Buffer ekstraksi yang mengandung (2% CTAB (w/v), 100 mM Tris-HCl pH 8, 1,4 M NaCl, 50 mM EDTA, dan 2% β-merkaptoetanol), aquades, kloroform isoamilalkohol (KIA) 24:1, isopropanol dingin, ethanol 70%. Bahan-bahan untuk elektroforesis adalah: Agarosa, buffer TAE 50 X, loading buffer, dan ethidium bromida. Untuk PCR digunakan bahan: Aquabidest (ddH2O), 10 X PCR Buffer (PE-II) (Promega), dNTPs 8 mM (Promega), MgCl2 25 mM (Promega), primer 20 µm (Operon Technologies), PE Amplitaq 5unit/µL (Promega) dan DNA ladder 1 kb (Geneaid).
26 4.7 Instrumen Penelitian
Instrumen dari penelitian ini antara lain : sprayer, gelas ukur, pinset, Erlenmeyer, petridish, tangkai pengaduk, flakon, pisau, gelas preparat, gelas penutup, mikroskop cahaya, kamera digital, pensil, penggaris, timbangan analitik, mortar dan pestle, vortex, microcentrifuge, autoclave, water bath, pipet mikro, microtube, microwave, spatula, mesin PCR (Infinigen-Korea), UviTec Gel Doc Systems, unit elektrophoresis (GelMate 2000), dan UV-Transluminator (Biorad-Jerman).
4.8 Prosedur Penelitian
4.8.1 Persiapan Bahan
4.8.1.1 Pembuatan Larutan Kolkisin
Penelitian ini menggunakan kolkisin cair (Biotech Agro) 500 ml (50 mg/500 ml). Konsentrasi kolkisin yang dibuat adalah 5%, 10% dan 20%. Pembuatan kolkisin 5% dilakukan dengan memipet larutan kolkisin sebanyak 5 ml ditambahkan aquades sebanyak 95 ml. Larutan kolkisin 10% dibuat dengan menambahkan 10 ml kolkisin kedalam 90 ml aquades. Pembuatan larutan kolkisin 20% dilakukan dengan memipet kolkisin sebanyak 20 ml dan ditambahkan 80 ml aquades. Perlakuan kontrol (kolkisin 0 %) adalah aquades 100 ml.
4.8.1.2 Pembuatan Pewarna Aceto Orcein 2%
Pewarna ini dibuat dengan memanaskan 11,25 ml Asam Asetat Glasial sampai mendidih, kemudian ditambahkan 0,5 gram orcein sambil terus diaduk
27
sampai terlarut semuanya sekitar 10 menit pada suhu 95oC. Setelah agak dingin, ditambahkan akuades sebanyak 27,5 ml dan dibiarkan sampai suhunya mencapai 20oC kemudian disaring dengan kertas saring dan disimpan di tempat gelap (Jurčák, 1999).
4.8.1.3 Pembuatan Larutan Fiksatif Carnoy
Pengamatan kromosom dilakukan dengan fiksasi akar dengan
menggunakan larutan fiksatif carnoy. Fiksasi dilakukan dengan tujuan untuk mematikan jaringan sementara tanpa merubah struktur komponen sel. Fiksasi dilakukan dengan menggunakan larutan Carnoy (6 etanol : 3 klorofom : 1 asam asetat glacial) (Haryanto, 2010).
Menurut Jusuf (2009) larutan Carnoy adalah larutan fiksatif inti yang mempunyai daya penetrasi cepat dan dapat mengawetkan substansia Nissl dan Glikogen. Kekurangan dari larutan ini adalah memiliki efek pengerutan yang kuat serta dapat menghancurkan sebgaian besar unsur sitoplasma yang terdapat didalam sel.
4.8.2 Prosedur Kerja
4.8.2.1 Teknik Perendaman Umbi dengan Kolkisin
Perendaman umbi kesuna bali dilakukan dengan tujuan supaya senyawa kolkisin dapat terserap sempurna ke dalam umbi dan menghasilkan tanaman poliploid. Induksi mutasi senyawa kolkisin bersifat acak, sehingga tidak jarang ditemukan individu yang tetap bersifat diploid (2n) (Suminah et al., 2002).
28
Perendaman umbi dilakukan pada konsentrasi kolkisin yang bervariasi yaitu 0% (kontrol), 5%, 10% dan 20% selama 12 jam kolkisin, 12 jam air kemudian direndam kembali selama 12 jam pada larutan kolkisin sesuai intruksi perusahaan (Biotech Agro).
4.8.2.2 Teknik Penanaman Umbi
Umbi kesuna bali diperoleh dari pertanian Desa Pakisan Kecamatan Sawan Kabupaten Buleleng Bali. Umbi dipilih yang telah berumur 70 hari setelah masa panen serta memiliki berat yang seragam. Penanam umbi dilakukan di Pertanian Kreatif Sanur. Sebelum dilakukan penanaman, media tanam disiram terlebih dahulu sampai kapasitas lapang. Media tanam yang terdiri dari pasir, pupuk tanah pubotan dan campuran pupuk kandang dengan perbandingan 1:2:1 (Hardiyanto et al., 2008).
Selanjutnya ditanaman pada polibag dengan diameter 30 cm dan tinggi 15 cm lalu dibuat lubang tanam dengan kedalaman kurang lebih 5-7 cm menggunakan kayu. Kemudian bibit kesuna bali dimasukkan secara tegak ke dalam lubang tanam dan ditutup dengan mulsa jerami setebal 5 cm pada masing-masing polibag. Untuk menghindari pencabutan tanaman dalam pengambilan akar tanaman untuk pengamatan kromosom, maka digunakan teknik polibag bertingkat. Polibag yang telah ditanami umbi tersebut dilubangi disekeliling polibag lalu dimasukkan ke dalam polibag yang lebih besar.
Pemeliharaan dilakukan dengan menyemprotkan insektisida atau fungisida sebanyak 2 kali dalam satu minggu secara periodik hingga panen.
29
Pemupukan dilakukan pada umur 15 hari setelah masa tanam (MST) dengan pupuk buatan. Selanjutnya daun kesuna bali yang berumur ± 23 hari di potong dan digunakan sebagai bahan untuk isolasi DNA (Hardiyanto et al., 2008).
4.8.2.3 Pengamatan Karakter Pertumbuhan
Pengamatan karakter pertumbuhan dilakukan setiap seminggu sekali selama 90 hari masa tanam yang meliputi tinggi tanaman, panjang daun dan jumlah daun. Pengamatan juga dilakukan terhadap umbi yg meliputi berat umbi.
4.8.2.4 Perhitungan Indeks Stomata
Pengamatan indeks stomata dilakukan menggunakan daun dewasa yang dilakukan pada umur tanaman 10 MST. Pengamatan dilakukan dengan menghitung jumlah stomata per satuan bidang pandang menggunakan mikroskop binokuler dengan perbesaran 400 kali. Daun tanaman kesuna bali difiksasi dalam alkohol 75%, kemudian diganti aquadest. Untuk menghancurkan jaringan mesofil, daun direndam dalam larutan HNO3 25% selama 15 – 30 menit. Daun dicuci dengan aquadest kemudian disayat menggunakan silet. Selanjutnya sayatan epidermis abaksial direndam dalam larutan Bayclin selama 1 – 5 menit untuk menghilangkan klorofil dan mesofil yang terikat kemudian dicuci dengan aquadest. Sayatan epidermis diwarnai dengan safranin diatas gelas objek, dicuci aquadest, kemudian ditetesi gliserin 10% dan ditutup dengan gelas penutup.
30
Selanjutnya diamati dibawah mikroskop dengan perbesaran 400 kali (Palit, 2008). Indeks stomata (IS) dihitung berdasarkan rumus menurut Lestari (2006) :
Indeks stomata = Jumlah stomata
jumlah stomata + jumlah epidermis
Menurut Perwati (2009) terjadinya peningkatan derajat ploidi pada tanaman spesies Adiantum raddianum menyebabkan penambahan ukuran stomata. Derajat ploidi 2n = 6x (heksaploid) menyebabkan bertambahnya ukuran panjang stomata pada tanaman spesies Adiantum raddianum menjadi 37.21 μm. Sedangkan derajat ploidi 2n = 7x (septaploid) menyebabkan bertambahnya lebar stomata pada tanaman spesies Adiantum raddianum menjadi 31.74 μm. Kecendrungan bertambahnya derajat ploidi (2n = 7x) pada tanaman spesies Adiantum raddianum memberikan pengaruh nyata terhadap penurunan indeks stomata menjadi 13.99.
4.8.2.5 Pembuatan Preparat Kromosom
Untuk membuat preparat kromosom pada penelitian ini digunakan metode squash dengan langkah-langkah sebagai berikut: Ujung akar kesuna bali dipotong ± 2 mm kemudian ujung akar difiksasi dengan fiksatif Carnoy selama1-24 jam dalam suhu kamar. Setelah fiksasi selesai cuci ujung akar dengan akuades dan dihidrolisa dengan HCL 2N pada suhu 60oC selama 1-3 menit.
Ujung akar dicuci lagi dengan akuades kemudian diletakkan diatas gelas benda kemudian diberikan tiga tetes aceto orcein 2%. Selanjutnya dilewatkan di atas api bunsen selama 3 menit agar pewarna meresap dengan sempurna kemudian ditutup dengan gelas penutup. Ketuk dengan bagian datar pensil selama
31
tiga menit lalu diamati di bawah mikroskop dengan perbesaran 400x (Soesanti dan Setyawan, 2000).
4.8.3 Analisis DNA
4.8.3.1 Isolasi DNA
Isolasi DNA dilakukan dengan menggunakan metode CTAB yang dikembangkan oleh Doyle dan Doyle (1990). Isolasi DNA dimulai dengan menggerus 0,2 g daun umbi kesuna bali sampai halus di dalam mortar, kemudian ditambahkan 1 ml buffer ekstraksi yang telah mengandung 0,2% ß-mercaptoetanol.
Selanjutnya diinkubasi pada suhu 65ºC pada water bath selama 45-60 menit disertai dengan membolak-balik tabung setiap 10 menit. Setelah itu disentrifugasi pada kecepatan 12.000 rpm selama 10 menit. Supernatan dipindahkan ke tabung baru dan ditambahkan 1x volume kloroform: isoamilalkohol (24:1). Kemudian divortex, dan disentrifugasi pada kecepatan 12.000 rpm selama 10 menit. Lapisan atas diambil dan dimasukkan ke dalam mikrotube 1.5 ml, kemudian ditambahkan dengan isopropanol dingin kemudian dibolak-balik dengan hati-hati sampai DNA terpresipitasi. Selanjutnya disentrifugasi selama 5 menit pada kecepatan 12.000 rpm.
Larutan isopropanol dibuang, pellet DNA dicuci dengan 500 l ethanol 70% dan disentrifugasi selama 5 menit. Kemudian ethanol dibuang secara hati-hati, dan DNA dikeringkan diatas kertas tissue. Setelah kering pellet ditambah dengan 100 l aquades steril dengan tujuan untuk melarutkan pellet DNA, dan
32
ditambah RNAse (konsentrasi akhir 10 µg/ml) kemudian diinkubasi pada suhu 37oC selama 30 menit. Selanjutnya disimpan sebagai stok pada suhu -20oC.
4.8.3.2 Elektroforesis dan Penentuan Konsentrasi DNA
Jumlah DNA hasil isolasi ditentukan dengan elektroforesis pada gel agarosa 1% dalam buffer TAE. Agarosa 0,5 gram ditambahkan dengan 50 ml buffer TAE 1X kemudian dimasukkan ke dalam tabung Erlemenyer, dan dipanaskan dalam microwave ± selama 1 menit sampai gel terlihat benar-benar bening. Gel dituang ke dalam cetakan kemudian didiamkan pada suhu kamar hingga gel mengental, selanjutnya gel dimasukkan ke dalam tangki elektroforesis yang telah berisi buffer TAE. Sebanyak 3 μl DNA genomik dari hasil isolasi dicampur dengan 1 μl loading dye di atas kertas parafilm, lalu dimasukkan ke dalam parit gel agarosa. Mesin elektroforesis dialiri listrik pada tegangan 100 volt selama 60 menit. Pewarnaan dilakukan dengan cara merendam gel dalam Ethidium Bromide selama 30-45 menit. Pengamatan DNA dilakukan di bawah lampu UV dan dilakukan pemotretan.
4.8.3.3 Proses PCR (Polimerase Chain Reaction) DNA Genomik Kesuna
Bali dengan Penanda RAPD
Proses amplifikasi DNA adalah proses perbanyakan DNA secara enzimatis. Proses ini diawali dengan running sampel DNA genomik pada kondisi PCR yang berbeda yaitu: a) Pre-denaturasi: 940C (2 menit) kemudian diikuti dengan siklus yang diulang sebanyak 39 kali yaitu denaturasi: 940C (1 menit),
33
annealing: 340C (30 detik), ekstension: 720C (2 menit) dan final extension: 720C (7 menit) untuk primer OPA 01; b) Pre-denaturasi: 940C (2 menit) kemudian diikuti dengan siklus yang diulang sebanyak 45 kali yaitu denaturasi: 940C (2 menit), annealing: 360C (2 menit), ekstension: 720C (2 menit) dan final extension: 720C (10 menit) untuk primer UBC 250. Amplikon disimpan pada suhu -200C didalam freezer.
Reaksi PCR menggunakan RAPD dilakukan dalam volume reaksi 24 µl yang mengandung: 14.5 µl ddH20, 2.5 µl 10 X PCR Buffer (PE-II), 2.5 µl dNTPs (8 mM), 2.0 µl MgCl2 (25 mM), 1.25 µl Primer (20 mM) dan 0.125 µl PE Aplitaq (5 units/uL). Primer yang digunakan tercantum pada Tabel 4.1.
Tabel 4.1
Nama Primer dan Urutan Basa Primer RAPD Nama Primer Sequences 5’ 3’
OPA-01 CAGGCCCTTC OPA-02 TGCCGAGCTG OPA-04 AATCGGGGTG OPD-14 CTTCCCCAAG UBC 250 CGACAGTCCC 4.8.3.4 Elektroforesis Produk PCR
Pengamatan hasil PCR dilakukan dengan elekroforesis pada 1,5% gel agarosa dengan voltase 100 volt (Parvin et al., 2008). Sebanyak 10 µl produk PCR dielektroforesis selama 60 menit dan diwarnai dengan Ethidium Bromide dan diamati pada lampu uv dan dilakukan pemotretan gel. Untuk menentukan ukuran produk PCR digunakan DNA ladder 100 pb.
34 4.9 Analisis Data
Data morfologi dan sitologi tanaman yang diperoleh dianalisis dengan menggunakan uji F pada taraf 5% atau 0.05 dengan menggunakan ANOVA dan uji lanjut Tukey. Pita DNA yang diperoleh dianalisis dengan melihat perbedaan pola pita RAPD pada masing-masing perlakuan antara kontrol dengan variasi kolkisin yang diberikan.
Pita-pita DNA yang telah diketahui ukurannya kemudian di-scoring. Pita DNA diberi skor 1 jika ada dan skor 0 jika tidak ada. Dendogram yang menunjukkan hubungan antar perlakuan dianalisis dengan metode UPGMA menggunakan software MEGA versi 5.05.
35 BAB V
HASIL PENELITIAN
5.1 Karakteristik Morfologi Tanman kesuna bali (Allium sativum Linn.)
Hasil pengamatan dan pengukuran terhadap karakteristik morfologi dan sitologi adalah sebagai berikut ; tinggi tanaman, jumlah daun, panjang daun, berat kering umbi, indeks stomata dan jumlah kromosom tanaman kesuna bali. Pemberian konsentrasi kolkisin yang berbeda menunjukkan adanya variasi pada tinggi tiap individu tanaman kesuna bali dimasing-masing kelompok (Gambar 5.1).
Gambar 5.1
Tinggi Tanaman Kesuna Bali ; a) 2 MST; b) 6 MST; c) 10 MST ; d) 20 MST. Perlakuan; P0 = Kontrol,P1 = Kolkisin 5%, P2 = Kolkisin 10%, P3 =
36 5.1.1 Tinggi Tanaman
Rata-rata tinggi tanaman kesuna bali dianalisis menggunakan ANOVA dilanjutkan dengan Uji lanjut Tukey HSD. Hasil uji statistik menunjukkan variasi konsentrasi kolkisin yang diberikan berpengaruh nyata (P 0.05) pada umur 2MST dan 14 MST serta tidak berpengaruh nyata (P ≥ 0.05) terhadap tinggi pada umur 6 MST dan 10 MST. Pada umur 2 MST rerata tinggi tanaman pada kontrol berbeda nyata dengan kolkisin 5%, 10% dan 20%. Sedangkan pada umur 14 MST rerata tinggi tanaman kontrol berbeda nyata dengan rerata tinggi tanaman pada kolkisin 10% (Tabel 5.1).
Tabel 5.1
Rata-rata Tinggi Tanaman Kesuna Bali
Perlakuan 2 Minggu 6 Minggu 10 Minggu 14 Minggu Kontrol 3.24 ± 0.18 a 17.46 ± 1.12 a 25.70 ± 1.30 a 36.32 ± 1.45 a Kolkisin 5% 4.00 ± 0.20 b 18.39 ± 0.60 a 26.42 ± 0.82 a 37.56 ± 1.93 ab Kolkisin 10% 4.12 ± 0.18 b 18.28 ± 0.75 a 26.66 ± 0.72 a 41.98 ± 0.62 b Kolkisin 20% 3.95 ± 0.06 b 18.49 ± 0.52 a 26.85 ± 0.75 a 41.48 ± 1.16 ab Keterangan : Angka adalah rata-rata tinggi tanaman kesuna bali dari enam ulangan ±
standar error. Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berarti tidak berbeda nyata (P ≥ 0.05).
5.1.2 Panjang Daun
Secara umum pemberian konsentrasi kolkisin yang berbeda berpengaruh nyata (P 0.05) terhadap rata-rata panjang daun tanaman kesuna bali pada 2 MST dan tidak berpengaruh nyata (P ≥ 0.05) pada 6 MST, 10 MST dan 14 MST. Pada umur 2 MST rata-rata panjang daun pada kontrol berbeda nyata pada perlakuan kolkisin 5%, 10% dan 20%. Sedangkan pada umur 6 MST, 10 MST dan 14 MST
37
rata-rata panjang daun pada kontrol tidak berbeda nyata terhadap variasi konsentrasi kolkisin yang diberikan. (Tabel 5.2).
Tabel 5.2
Rata-rata Panjang Daun Kesuna Bali
Perlakuan 2 Minggu 6 Minggu 10 Minggu 14 Minggu Kontrol 1.58 ± 0.06a 12.05 ± 0.73a 21.70 ± 0.70a 30.42 ±1.73a Kolkisin 5% 1.95 ± 0.09ab 12.65 ±0.26a 22.31 ±0.53a 28.92 ±2.91a Kolkisin 10% 2.11 ± 0.16b 12.40 ± 0.49a 22.17 ±0.28a 30.77 ±1.28a Kolkisin 20% 2.21 ± 0.01b 12.32 ±0.55a 22.19 ±0.64a 29.37 ±1.63a Keterangan : Angka adalah rata-rata panjang daun kesuna bali dari enam ulangan ±
standar error. Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berarti tidak berbeda nyata (P ≥ 0.05).
5.1.3 Jumlah Daun
Pengaruh kolkisin terhadap penambahan jumlah daun tanaman kesuna bali tidak menunjukkan hasil yang signifikan dengan kontrol. Berdasarkan hasil uji lanjut Tukey HSD variasi konsentrasi kolkisin pada 10 MST berpengaruh nyata (P 0.05) terhadap peningkatan jumlah daun dan tidak berpengaruh nyata (P ≥ 0.05) pada 2 MST, 6 MST dan 14 MST (Tabel 5.3). Rata-rata jumlah daun umur 10 MST pada kontrol tidak berbeda nyata dengan perlakuan kolkisin 5% dan 10%, tetapi berbeda nyata dengan perlakuan kolksin 20%.
Peningkatan jumlah daun tanaman kesuna bali hanya berlangsung hingga umur 10 MST, sedangkan pada umur 14 MST terjadi penurunan jumlah daun (Tabel 5.3). Hal ini disebabkan karena daun pada kesuna bali umumnya akan layu dan gugur ketika mendekati masa panen (Suriana, 2011).
38 Tabel 5.3
Rata-rata Jumlah Daun Kesuna Bali
Perlakuan 2 Minggu 6 Minggu 10 Minggu 14 Minggu Kontrol 1.00 ± 0.00 a 3.88 ± 0.11a 5.03 ± 0.18 a 3.66 ± 0.17 a Kolkisin 5% 1.03± 0.02 a 4.08 ± 0.08 a 5.69 ± 0.17 ab 3.91 ±0.35 a Kolkisin 10% 1.14 ± 0.05 a 4.14 ± 0.07 a 5.72 ± 0.16 ab 4.25 ± 0.13 a Kolkisin 20% 1.14 ± 0.05 a 4.25 ± 0.13 a 5.89 ± 0.28 b 4.50 ± 0.25 a Keterangan : Angka adalah rata-rata jumlah daun kesuna bali dari enam ulangan ±
standar error. Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berarti tidak berbeda nyata (P ≥ 0.05).
5.1.4. Tanaman Abnormal
Pada penelitian ini induksi kolkisin 20% memberikan pengaruh dengan membentuk daun yang abnormal pada tanaman kesuna bali. Munculnya bentuk yang abnormal pada tanaman sering dikenal dengan istilah chimera. Chimera adalah suatu keadaan sel yang memiliki susunan gen lebih dari satu, hal ini disebabkan oleh mutasi pada gen dan kromosom (Kehr, 2001). Mutan yang terjadi pada tanaman kesuna bali ditunjukkan dengan munculnya tunas baru dan bentuk daun yang melingkar seperti spiral (Gambar 5.2). Penelitian ini didukung oleh Herman et al. (2013) menyatakan bahwa peristiwa kimera ditemukan pada daun tanaman kacang hijau (Vigna radiata L.) umur 6-9 HST pada setiap perlakuan kolkisin yang diberikan kecuali kontrol.
39 Gambar 5.2
Tanaman Kesuna Bali Abnormal pada Perlakuan Kolkisin 20%. (a) Tunas baru ; (b) Daun Melingkar seperti Spiral
5.1.5 Berat Kering Umbi
Hasil uji statistik menunjukkan rata-rata berat kering umbi kesuna bali setelah panen tidak berbeda nyata (P ≥ 0.05) antara kontrol dengan perlakuan kolksin yang diberikan (Tabel 5.4).
Tabel 5.4
Berat Kering Kesuna Bali
Berat Kering Umbi
Kontrol 1.16 ± 0.30 a Kolkisin 5% 1.31 ± 0.17 a Kolkisin 10% 1.84 ± 0.14 a Kolkisin 20% 1.14 ± 0.21 a
Keterangan : Angka adalah rata-rata berat kering umbi kesuna bali dari enam ulangan ± standar error. Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berarti tidak berbeda nyata (P ≥ 0.05).
40
Senyawa kolkisin tidak memberikan pengaruh yang signifikan terhadap bobot kering yang dihasilkan, akan tetapi berpengaruh terhadap variasi bentuk pada umbi kesuna bali. Pada perlakuan kolkisin 5% didapatkan lebih banyak umbi yang menghasilkan siung lebih dari satu, serta umbi dengan ukuran yang lebih besar. Sedangkan pada perlakuan kolkisin 10% dan 20% hanya menghasilkan satu umbi dengan jumlah siung yang banyak (Gambar 5.3).
Gambar 5.3
Variasi Bentuk Umbi Kesuna Bali setelah Panen. (a) Kontrol ; (b) Kolkisin 5% ;(c) Kolkisin 10%; (d) Kolkisin 20%. (1) Umbi dengan siung lebih dari satu ; (2)
Umbi kecil dan busuk dan (3) Ukuran umbi yang besar.
A B C D 1 1 1 2 3
41
5.2 Karakteristik Sitologi Tanaman kesuna bali (Allium sativum Linn.)
Pengamatan karakteristik sitologi tanaman bali meliputi ; indeks stomata dan jumlah kromosom. Berdasarkan hasil uji statistik pemberian konsentrasi kolkisin yang berbeda berpengaruh nyata terhadap indeks stomata serta peningkatan pada jumlah kromosom.
5.2.1 Indeks Stomata
Indeks stomata menunjukkan jumlah rata-rata yang berbeda nyata (P0.05) antara kontrol dengan kolkisin 5% dan 20% dan tidak berbeda nyata (P≥0.05) dengan kolkisin 10% (Tabel 5.5). Rata-rata indeks stomata tanaman kontrol lebih banyak dibandingkan perlakuan kolkisin lainnya. Rata-rata indeks stomata terendah dijumpai pada pemberian konsentrasi kolkisin 20% (Gambar 5.4).
Tabel 5.5
Indeks Stomata Kesuna Bali
Indeks Stomata
Kontrol (P0) 0.21 ± 0.03 a
Kolkisin 5% (P1) 0.17 ± 0.04 b Kolkisin 10% (P2) 0.20 ± 0.02 a Kolkisin 20% (P3) 0.18 ± 0.04 b
Keterangan : Angka adalah rata-rata indeks stomata kesuna bali dari enam ulangan ± standar error. Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berarti tidak berbeda nyata (P ≥ 0.05).
42 5.2.2 Jumlah Kromosom
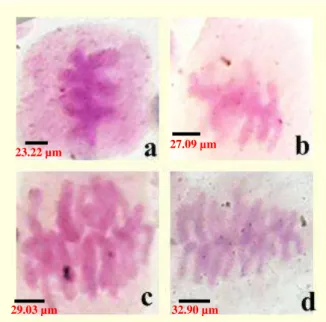
Jumlah kromosom dasar tanaman kesuna bali normal adalah delapan (x=8), sehingga 2n=16. Berdasarkan uji sitologi, induksi kolkisin mengakibatkan penambahan jumlah kromosom normal menjadi triploid (2n=3x=24). Hasil uji lanjut Tukey menunjukkan jumlah kromosom tanaman kesuna bali pada kontrol berbeda nyata (P0.05) terhadap variasi konsentrasi kolkisin yang diberikan (Tabel 5.6). Penggandaan jumlah kromosom terbanyak terjadi pada pemberian perlakuan kolksin 20 % (2n = 27) serta diikuti dengan pembesaran diameter sel (Gambar 5.5).
Tabel 5.6
Jumlah Kromosom Kesuna Bali
Jumlah Kromosom
Kontrol 14.72 ± 0. 47 a Kolkisin 5% 20.22 ± 1.55 b Kolkisin 10% 24.11 ± 1.14 bc Kolkisin 20% 27.47 ± 0.28 c
Keterangan : Angka adalah rata-rata indeks stomata kesuna bali dari enam ulangan ± standar error. Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berarti tidak berbeda nyata (P ≥ 0.05).
Selain mengakibatkan penambahan jumlah kromsom senyawa kolkisin juga berdampak terhadap kelainan yang ditimbulkan pada saat pembelahan mitosis yang sering dikenal dengan istilah C-mitosis (Colcichine mitosis) diantaranya terdapat C-profase, C-metafase, C-anafase dan C-telofase. Pada penelitian ini induksi senyawa kolkisin 20% menyebabkan kesalahan pada proses anafase (C-anafase) (Gambar 5.6).
43
Pengaruh yang diakibatkan oleh C-anafase adalah adanya penggandaan jumlah kromosom sehingga mengakibatkan tanaman kesuna bali memiliki kromosom triploid (3n).
\
Gambar 5.4
Foto Stomata kesuna bali (a) Kontrol; (b) Kolkisin 5%; (c) Kolkisin 10%; (d) Kolkisin 20%. 13.73 µm 0 µm 12.68 µm 0 µm 16.91 µm 0 µm 15.84 µm 0 µm
44 Gambar 5.5
Foto Kromosom kesuna bali (a) Kontrol; (b) Kolkisin 5% ; (c) Kolkisin 10%; (d) Kolkisin 20%.
Gambar 5.6
Foto Kromosom C-anafase Kesuna Bali Akibat Perlakuan Kolkisin 23.22 µm
32.90 µm 29.03 µm
45 5.3 Analisis PCR-RAPD
5.3.1 Isolasi DNA Kesuna Bali (Allium sativum Linn.)
Isolasi DNA kesuna bali dalam penelitian ini menggunakan metode CTAB yang dikembangkan oleh Doyle dan Doyle (1990). DNA genomik yang dihasilkan memiliki konsentrasi berkisar antara 200-400 ng/µl. Berdasarkan metode yang digunakan telah berhasil diperoleh 24 sampel DNA genomik kesuna bali (Allium sativum Linn.) namun dengan kualitas DNA yang kurang baik sehingga dilakukan pengulangan dalam isolasi (Gambar 5.7).
Gambar 5.7
DNA Genomik Hasil Isolasi Daun kesuna bali. (a) Isolasi DNA genomik pertama, parit gel agarose atas no 1-6 perlakuan kontrol (P0), no 7-12 perlakuan dengan kolkisin 5% (P1), no 13 λ DNA 200 ng, dan no14 λ DNA
400 ng. Parit gel agarose bawah no 15-20 perlakuan dengan kolkisin 10% (P2), no 21-26 perlakuan dengan kolkisin 20% (P3). (b) Isolasi DNA genomik kedua, parit gel agarose atas no 1-6 perlakuan kontrol (P0), no 7-12 perlakuan dengan kolkisin 5% (P1) , no 13 λ DNA 200 ng, dan no 14 λ DNA 400 ng. Parit gel agarose bawah no 15-20 perlakuan dengan kolkisin 10% (P2), no
21-26 perlakuan dengan kolkisin 20% (P3).
46 5.3.2 Optimalisasi PCR-RAPD
Analisis PCR tanaman kesuna bali dalam penelitian ini dilakukan dengan menggunakan lima jenis primer RAPD yaitu OPA 01, OPA 02, OPA 04, OPD 14 dan UBC 250.
Gambar 5.8
Hasil Optimalisasi PCR-RAPD DNA kesuna bali mutan. P01=Kontrol; P14 = Kolkisin 5%; P25 = Kolkisin 10% (a) Primer OPA 1; (b) Primer OPA 2; Primer
OPA 4; (d) Primer OPD 14.
c d
47
Hasil optimalisasi PCR-RAPD kesuna bali menggunakan empat primer dengan kondisi suhu pre-denaturasi (950C, 5 menit), denaturasi (950C, 1 menit), annealing (360C, 1 menit 30 detik), perpanjangan (extension) (720C, 1 menit 30 detik), perpanjangan terakhir (final extension) (720C, 10 menit) dan pasca PCR (80C) dengan siklus reaksi PCR diulang sebanyak 35 siklus tidak diperoleh pita-pita DNA genomik kesuna bali (Gambar 5.8). Optimalisasi kedua dilakukan dengan memodifikasi waktu annealing yaitu selama 2 menit. Modifikasi yang dilakukan berhasil pada primer OPA 04 akan tetapi pita-pita produk PCR yang dihasilkan tipis dan belum tampak jelas. Sedangkan tiga primer lainnya tidak menghasilkan pita produk PCR. Optimalisasi selanjutnya dilakukan dengan mengubah konsentrasi buffer PCR menjadi 2 μL, dNTP menjadi 2 μL, Taq polymerase menjadi 0.2 μL dan primer menjadi 3 μL dengan total volume reaksi menjadi 20 μL. tetap tidak menghasilkan pita-pita produk PCR.
Modifikasi dalam optimalisai PCR-RAPD yang sudah dilakukan sebelumnya tetap tidak dapat menghasilkan pita-pita produk PCR. Tahap berikutnya dilakukan modifikasi dengan cara mengubah suhu annealing berdasarkan perhitungan nilai Tm (Melting Temperature) masing-masing primer dengan menggunakan rumus [2(A+T) + 4(C+G)]. Berdasarkan perhitungan nilai Tm primer OPA 01 dan OPA 02 dikondisikan pada suhu annealing 340C, sedangkan primer OPA 04 DAN OPD 14 pada suhu annealing 320C masing-masing berjalan dalam waktu 2 menit. Hasil yang didapat menunjukkan bahwa perubahan suhu annealing belum juga bisa menghasilkan pita-pita produk PCR.
48
Optimalisasi selanjutnya dilakukan dengan merubah komponen premix PCR menggunakan kit PCR Go Taq Green© sesuai dengan jumlah sampel yang akan di PCR. Volume total premix untuk satu reaksi adalah 12.5 μL yang mengandung campuran 6.25 μL Go Taq Green© (promega), 4.25 μL ddH2O, 1 μL primer dan 1 μL DNA template. Penggunaan premix sudah pernah dilakukan pada penelitian Setiawan (2012) yang berhasil mengamplifikasi polimorfisme pita-pita DNA pada tanaman anggrek dengan menggunakan empat primer acak. Pada penelitian ini kit PCR Go Taq Green© yang digunakan belum bisa menghasilkan pita-pita produk PCR sehingga masih perlu dilakukan optimalisasi dengan metode yang berbeda. Metode yang dilakukan selanjutnya adalah dengan mengubah komponen premix dan suhu PCR.
Dari lima primer yang digunakan primer OPA 01 dan UBC 250 berhasil diamplifikasi dengan komponen premix PCR yang mengandung : 14.5 µl ddH20, 2.5 µl 10 X PCR Buffer (PE-II), 2.5 µl dNTPs (8 mM), 2.0 µl MgCl2 (25 mM), 1.25 µl Primer (20 mM), 0.125 µl PE Aplitaq (5 units/uL) dan 3 µl DNA template. Modifikasi terhadap suhu PCR berhasil dilakukan pada primer OPA 01 berdasarkan penelitian yang dilakukan oleh Ramella et al. (2005) dengan kondisi suhu PCR : Pre-denaturasi : 940C (2 menit), denaturasi : 940C (1 menit), anealing : 340C (30 detik), extension : 720C (2 menit), final extension : 720C (7 menit) sebanyak 39 siklus (Gambar 5.9).
49 1 2 3
Gambar 5.9
Hasil Optimalisasi PCR-RAPD DNA kesuna bali mutan primer OPA 01. M = Marker 100 bp (1) P33 = Kolkisin 20% tanaman ke-3; (2) P34 = Kolkisin 20%
tanaman ke-4 (3) P35 = Kolkisin 20% tanaman ke-4.
Optimalisasi suhu PCR primer UBC 250 berhasil menghasilkan pita-pita DNA berdasarkan penelitian yang dilakukan oleh Ciuca et al. (2004) dengan kondisi suhu PCR : Pre-denaturasi : 940C (2 menit), denaturasi : 940C (2 menit), anealing : 360C (2 menit), extension : 720C (2 menit), final extension : 720C (10 menit) sebanyak 45 siklus.
M
3000 bp 1500 bp 500 bp
50
5.3.3 PCR-RAPD (Polymerase Chain Reaction-Random Amplified Polymorphic DNA)
Pada penelitian ini dari lima primer yang diuji (OPA 1, OPA 2, OPA 4, OPD 14 dan UBC 250) hanya dua primer yang berhasil menghasilkan produk amplifikasi DNA yaitu primer OPA 1 dan UBC 250. Amplifikasi primer OPA 1 pada 24 sampel daun kesuna bali yang diuji pada menghasilkan ukuran fragment yang berkisar 1200bp dan 2000bp (Gambar 5.10). Polimorfisme antara kontrol dan masing-masing perlakuan kolkisin ditampilkan pada Tabel 5.7. Secara umum perlakuan kolkisin 5% dan 20% paling banyak memunculkan pita DNA hasil amplifikasi.
Gambar 5.10
Elektroforesis hasil amplifikasi dengan primer OPA 01. M = Marker 100 bp. P0= Kontrol; P1 = Kolkisin 5%; P2= Kolkisin 10%; P3= Kolkisin 20%. P33 =
Kontrol Positif dan H2O = Kontrol negatif.
3000 bp 3000 bp 1500 bp 1500 bp 500 bp 500 bp 500 bp 100 bp
51 Tabel 5.7
Ringkasan Pita DNA yang dihasilkan pada PCR dengan Primer OPA 01
Perlakuan Ukuran Fragment DNA
(bp) 1000 1200 2000 P01 0 0 0 P02 0 0 0 P03 0 0 0 P04 0 1 0 P05 0 0 0 P06 0 0 0 P11 0 1 1 P12 1 1 0 P13 0 1 1 P14 1 1 0 P15 1 1 0 P16 0 0 0 P21 0 1 0 P22 0 0 0 P23 0 1 0 P24 0 0 0 P25 0 1 0 P26 0 1 0 P31 1 1 1 P32 1 1 0 P33 0 1 0 P34 1 1 1 P35 0 1 1 P36 1 1 0
52
Amplifikasi primer UBC 250 pada 24 sampel daun kesuna bali yang diuji pada kontrol dengan perlakuan kolkisin yang diberikan terdapat perbedaan pada pola pita. Keseluruhan sampel hasil amplifikasi menghasilkan pola pita yang monomorfis dan polimorfis dengan ukuran fragment berkisar antara 600bp-1800bp (Gambar 5.11). Berdasarkan Tabel 5.8 terdapat pita DNA yang hanya muncul pada perlakuan kolkisin (1300bp), dan ada pita DNA yang hilang pada konsentrasi kolkisin yang tinggi (1400bp).
Gambar 5.11
Elektroforesis hasil amplifikasi dengan primer UBC. M = Marker 100 bp. P0 = Kontrol; P1 = Kolkisin 5%; P2 = Kolkisin 10%; P3 = Kolkisin 20%.
P11 P12 P13 P14 P15 P16 P21 P22 P23 P24 P25 P26 P31 P32 P33 P34 P35 P36 P01 P02 P03 P04 P05 P06 M 3000 bp 1500 bp 500 bp 100 bp
53 Tabel 5.8
Ringkasan Pita DNA Produk PCR dengan Primer UBC 250
Perlakuan Ukuran Fragment DNA (bp)
600 800 900 1000 1300 1400 1500 P01 1 1 0 1 0 1 0 P02 1 1 0 1 0 1 0 P03 1 1 0 1 0 1 1 P04 1 1 0 1 0 1 1 P05 1 1 0 1 0 1 1 P06 1 1 0 1 0 1 1 P11 1 1 0 1 1 1 0 P12 1 1 0 1 1 1 0 P13 1 1 0 1 1 1 0 P14 1 1 0 1 1 1 0 P15 1 1 0 1 1 1 0 P16 1 1 0 1 1 0 0 P21 1 0 0 1 1 0 1 P22 1 0 0 1 1 0 1 P23 1 0 0 1 1 0 1 P24 1 1 0 1 1 0 1 P25 1 0 1 1 1 0 1 P26 1 0 1 1 1 0 1 P31 1 1 1 1 0 0 0 P32 1 1 0 1 1 0 1 P33 1 1 0 1 1 0 1 P34 1 1 0 1 1 0 1 P35 1 1 0 1 1 0 1 P36 1 1 1 1 0 0 0
54
5.4 Pengelompokan Tanaman Kesuna Bali Akibat Perlakuan Kolkisin
Pengelompokan tanaman kesuna bali akibat perlakuan kolkisin dianalisis menggunakan program Molecular Evolutionary Genetics Analysis (MEGA 5.05). Metode pengelompokan yang digunakan adalah UPGMA (Unweight Pair Group Method With Aritmatic Average).
Berdasarkan profil pita DNA hasil amplifikasi menggunakan dua primer RAPD, ditentukan matrik kesamaan untuk mengetahui pengelompokan tanaman kesuna bali kontrol dan hasil perlakuan kolkisin. Matriks kesamaan pada Tabel 5.9 menunjukkan bahwa nilai kesamaan antar tanaman kesuna bali kontrol dengan perlakuan kolkisin berkisar 0.960 (96%) sampai dengan 0.112 (11.2%).
Dendogram pada Gambar 5.12 menunjukkan bahwa tanaman kesuna bali kontrol dengan perlakuan kolkisin menghasilkan tiga kelompok besar yaitu kelompok pertama yang terdiri dari tanaman kontrol (P0) dan tanaman hasil perlakuan kolkisin 5% (P1). Kelompok dua terdiri dari tanaman hasil perlakuan kolkisin 10% (P2) dan kolkisin 20% (P3). Kelompok ketiga hanya terdiri dari tanaman hasil perlakuan kolkisin 20% (P3).
55 Tabel 5.9
Dendogram Similaritas Dua Puluh Empat Tanaman kesuna bali Berdasarkan Karakter Molekular dengan Metode UPGMA. No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 1. Kontrol (1) 2. Kontrol (2) 0.000 3. Kontrol (3) 0.112 0.112 4. Kontrol (4) 0.258 0.258 0.112 5. Kontrol (5) 0.112 0.112 0.000 0.112 6. Kontrol (6) 0.112 0.112 0.000 0.112 0.000 7. Kolkisin 5% (1) 0.467 0.467 0.841 0.467 0.841 0.841 8. Kolkisin 5% (2) 0.467 0.467 0.841 0.467 0.841 0.841 0.258 9. Kolkisin 5% (3) 0.467 0.467 0.841 0.467 0.841 0.841 0.000 0.258 10. Kolkisin 5% (4) 0.467 0.467 0.841 0.467 0.841 0.841 0.258 0.000 0.258 11. Kolkisin 5% (5) 0.467 0.467 0.841 0.467 0.841 0.841 0.258 0.000 0.258 0.000 12. Kolkisin 5% (6) 0.258 0.258 0.467 0.841 0.467 0.467 0.467 0.467 0.467 0.467 0.467 13. Kolkisin 10% (1) 0.960 0.960 0.841 0.467 0.841 0.841 0.841 0.841 0.841 0.841 0.841 0.467 14. Kolkisin 10% (2) 0.841 0.841 0.467 0.841 0.467 0.467 0.960 0.960 0.960 0.960 0.960 0.258 0.112 15. Kolkisin 10% (3) 0.960 0.960 0.841 0.467 0.841 0.841 0.841 0.841 0.841 0.841 0.841 0.467 0.000 0.112 16. Kolkisin 10% (4) 0.467 0.467 0.258 0.467 0.258 0.258 0.841 0.841 0.841 0.841 0.841 0.112 0.258 0.112 0.258 17. Kolkisin 10% (5) 0.878 0.878 0.960 0.841 0.960 0.960 0.960 0.960 0.960 0.960 0.960 0.841 0.112 0.258 0.112 0.467 18. Kolkisin 10% (6) 0.878 0.878 0.960 0.841 0.960 0.960 0.960 0.960 0.960 0.960 0.960 0.841 0.112 0.258 0.112 0.467 0.000 19. Kolkisin 20% (1) 0.960 0.960 0.878 0.960 0.878 0.878 0.841 0.841 0.841 0.841 0.841 0.960 0.878 1.418 0.878 0.878 0.960 0.960 20. Kolkisin 20% (2) 0.960 0.960 0.841 0.467 0.841 0.841 0.841 0.258 0.841 0.258 0.258 0.467 0.258 0.467 0.258 0.258 0.467 0.467 0.841 21. Kolkisin 20% (3) 0.841 0.841 0.467 0.258 0.467 0.467 0.467 0.467 0.467 0.467 0.467 0.258 0.112 0.258 0.112 0.112 0.258 0.258 0.960 0.112 22. Kolkisin 20% (4) 0.878 0.878 0.960 0.841 0.960 0.960 0.467 0.467 0.467 0.467 0.467 0.841 0.467 0.841 0.467 0.467 0.841 0.841 0.467 0.112 0.258 23. Kolkisin 20% (5) 0.960 0.960 0.841 0.467 0.841 0.841 0.258 0.841 0.258 0.841 0.841 0.467 0.258 0.467 0.258 0.258 0.467 0.467 0.841 0.258 0.112 0.112 24. Kolkisin 20% (6) 0.841 0.841 0.960 0.841 0.960 0.960 0.960 0.467 0.960 0.467 0.467 0.841 0.960 0.878 0.960 0.960 0.841 0.841 0.112 0.467 0.841 0.841 0.960
56 P05 P06 P03 P04 P01 P02 P11 P13 P12 P14 P15 P22 P24 P16 P21 P23 P25 P26 P32 P33 P34 P35 P31 P36 0.0 0.1 0.2 0.3 0.4 Gambar 5.12
Dendogram kesuna bali mutan hasil analisis kluster dengan metode UPGMA. Keterangan a. P0 = Kontrol; b. P1 = Kolkisin 5% ; c. P2 = Kolkisin 10% dan d.
P3 = Kolkisin 20%. I II III A B A B C