KAJIAN BAKTERI PENYEBAB VIBRIOSIS PADA UDANG SECARA BIOMOLEKULER
STUDY OF THE CAUSES OF BACTERIA ON THE SHRIMP VIBRIOSIS BY BIOMOLECULAR
Lina Nasi1, Slamet Budi Prayitno2 dan Sarjito3
ABSTRAK
Penelitian ini bertujuan untuk mengkaji bakteri yang menjadi penyebab utama vibriosis pada udang dan tingkat patogennya. Udang di ambil dari pertambakkan Wakak Kendal. Uji pathogen dengan melihat tanda-tanda klinis dari agensia penyebab utama vibriosis pada udang dan tingkat kelangsungan hidup benih udang.
Metode yang diterapkan adalah Metode deskriptif. Dari hasil penelitian menunjukkan bahwa hasil dari rep-PCR membentuk 5 kelompok bakteri, maka dari kelompok tersebut di ambil isolate yang mewakili kelompok tersebut untuk di analisis sekuens 16S rDNA digunakan untuk mengkarakterisasi agensia penyebab vibriosis, oleh karena itu pada penelitian ini uji pathogen di ambil 3 isolat dengan tingkat homologi 100% yaitu JTV 19 (Vibrio sp), JTW 3 (Vibrio gallicus) dan JTW 6 (Shewanella alga). Uji pathogen menunjukkan tingkat kelangsungan hidup 80% (JTV 19) 53,33% (JTW 3) dan 76, 67% (JTW 6).
Kata Kunci : vibriosis, udang, bio molekuler
1
Mahasiswa Magister Manajemen Sumberdaya Pantai Universitas Diponegoro
2
Pembimbing Utama
3
Pembimbing Anggota
Abstract
This study aims to examine the bacteria that become the main cause vibriosis in shrimp and pathogen levels. Shrimp was taken from Kendall Wakak pond. Pathogen test by looking at clinical signs of the agents leading cause of vibriosis in shrimp and shrimp survival rates.
The method applied is descriptive method. From the results showed that the results of rep-PCR to form five groups of bacteria, then the group is taken from the isolates representing these groups for the analysis of 16S rDNA sequences used to characterize agents causes vibriosis, therefore the test pathogen in this study takes 3 isolates with 100% homology level of JTV 19 (Vibrio sp), JTW 3 (Vibrio gallicus) and JTW 6 (Shewanella algae). Pathogen test showed survival rates of 80% (JTV 19) 53.33% (JTW 3) and 76, 67% (JTW 6).
I. PENDAHULUAN
Udang merupakan salah satu komoditas perikanan unggulan dalam program revitalisasi perikanan, disamping rumput laut dan tuna. Pada awalnya jenis udang yang dibudidayakan di air payau adalah udang windu, namun setelah mewabahnya penyakit terutama WSSV, dan bakteri yang mengakibatkan menurunnya usaha udang windu, pemerintah kemudian mengintroduksi udang vannamei pada tahun 2001 untuk membangkitkan kembali usaha perudangan Indonesia dan dalam rangka diversifikasi komoditas perikanan.
Sejalan dengan program peningkatan produksi perikanan, Kementrian Kelautan dan Perikanan (KKP) menetapkan target produksi perikanan sebesar 22, 54 juta ton pada tahun 2014, dimana sebanyak 16,89 juta ton berasal dari perikanan budidaya. KKP menetapkan 10 komoditas unggulan budidaya, salah satunya adalah udang. Komoditas ini diproyeksikan mengalami peningkatan produksi tiap tahun sebesar 13% untuk udang windu dan 16% udang vannamei. Produksi udang pada tahun 2014 ditargetkan sebesar 699 ton udang windu dan 511 ribu ton udang vannamei. (Renstra Kementrian Kelautan dan Perikanan 2009-2014). Namun kendala yang dihadapi oleh banyak pembudidaya ikan dan udang adalah adanya serangan penyakit yang menyebabkan kematian.
Demikian halnya pada budidaya udang, adanya serangan bakteri yang menyebabkan kematian benih/larva udang. Bakteri Vibriosis menyerang larva udang yaitu pada saat udang dalam keadaan stress dan lemah, oleh karena itu sering dikatakan bahwa bakteri termasuk opportunistik pathogen. Dengan adanya kemunculan berbagai jenis penyakit di perairan yang disebabkan oleh bakteri Vibriosis sp. telah berdampak terhadap penurunan hasil produksi budidaya perikanan. Akibat infeksi mikroorganisme patogen tersebut, banyak organisme perairan yang dibudidayakan mengalami kematian massal sehingga menimbulkan kerugian ekonomi yang cukup tinggi (Paillard et al., 2004; Gonzales, 2005). Penyakit Vibriosis yang disebabkan oleh bakteri genus Vibriosis telah lama menjadi masalah utama bagi pelaku industri budidaya udang khususnya pada larva/benih udang. Penyakit Vibriosis tersebut telah menyebabkan kerugian besar serta kehancuran pada berbagai budidaya udang.
Metode secara biomolekuler sebagai identifikasi bakteri laut telah dilakukan oleh Sabdono, (2001), Radjasa et al(2001).
Penelitian yang dilakukan Sardjito et al (2009) melaporkan Identifikasi agensia penyebab penyakit dengan rep-PCR terbukti efektif dan efisien dalam mengelompokkan agensia penyebab utama Vibriosis pada ikan kerapu serta mampu membedakan hubungan kekerabatan spesies Vibriosis. Hal ini ditunjang pula masih terbatasnya informasi yang berkaitan dengan bakteri pathogen secara molekuler/pholyphasic. Untuk itu perlu kajian komperehensif tentang identifikasi, karakterisasi dan filogenetik molekuler penyebab utama penyakit Vibriosis dan virulensinya pada udang vannamei sangat diperlukan.
Tujuan dari penelitian ini adalah : Mengkaji bakteri apakah yang menjadi penyebab utama Vibriosis pada udang vannamei/windu, dan Mengkaji tingkat pathogenesitas bakteri agensia penyebab Vibriosis pada udang vannamei/windu.
II. METODOLOGI PENELITIAN 2.1. Metode Penelitian
Metode yang dilakukan dalam penelitian ini adalah metode deskriptif eksploratif
2.2.Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2010 – Juli 2011. Pengambilan sampel adalah di pertambakan Wakak Kendal yang merupakan tempat budidaya udang vannamei (Litopenaeus vannamei) dan udang
windu (P. Monodon) yang diduga terkena Vibriosis, isolasi dilakukan di Laboratorium Kelautan Terpadu Fakultas Perikanan dan Ilmu Kelautan Universitas Diponegoro, Semarang. Analisis biologi molekuler meliputi ekstraksi DNA, rep-PCR, 16S rDNA. Ekstraksi DNA dilakukan di Laboratorium Mikrobiologi Tanah dan Lingkungan, Fakultas Pertanian, Universitas Gajah Mada, Yogyakarta. Rep-PCR dan PCR 16S rDNA dilakukan di Laboratorium Bioteknologi PAU Magister, Universitas Gajah Mada, Yogyakarta. Sekuensing dilakukan di ”MAKROGEN” Korea. Kemudian Uji Pathogenesitas dilakukan di Laboratorium Kesehatan Ikan dan Penyakit di Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara.
2.3.Tahapan Penelitian
Pada penelitian ini dilakukan beberapa 3 tahapan yaitu:
1. Pengambilan Sampel Udang
Sampel udang vannamei dan Udang windu di ambil dari pertambakan daerah Wakak, Kendal.
2. Sterilisasi alat
digunakan dicuci dan dikeringkan. Alat-alat tersebut kemudian dibungkus dengan kertas dan disterilisasi menggunakan autoclave pada suhu 121ºC selama 20 menit dan tekanan 1atm. Kemudian dikeringkan dengan oven. Sedangkan media disterilisasi pada suhu 121ºC selama 15 menit dan tekanan 1atm.
3. Pembuatan Media TCBSA dan NA 4. Isolasi Bakteri
5. Pemurnian Bakteri
Identifikasi Isolat dengan Pendekatan Bio Molekuler
1. Ekstraksi DNA 2. Elektroforesis DNA 3.Amplifikasi DNA 4. Sekuensing DNA
5. Analisis Sequen 16S rDNA
Hasil sequen 16S rDNA selanjutnya dianalisa dan di edit dengan program GENETIX (Urakawa et al, 1999). Selanjutnya sekuen lengkap dari tiap isolat yang dipilih akan dibandingkan dengan sekuen DNA pada DNA database bank. (Marahiel et al, 1997; Radjasa et al, 2005).
Penelusuran akan dilakukan dengan sistem internet, yaitu penelusuran melalui system BLAST pada National Centre For Biotecnology Information, National of institute of Health, USA dan Ribosomal DNA Project pada University of Illionis USA, dalam rangka memperoleh presentasi homologi dan untuk mengidentifikasi isolat.
Uji Pathogenesitas 1. Hewan uji
Benih udang vannamei/windu yang diperoleh dari hatchery skala rumah tangga dengan padat penebaran mengacu pada Muliani dan Suryanti, (1998), sebanyak 10 ekor/toples/1 Liter air.
2. Uji pathogenesitas
Uji pathogenesitas dilakukan pada Isolat terpilih JTV 19, JTW 3, JTW 6dan satu kontrol dengan 3 kali ulangan, sehingga total digunakan toples sebanyak 15 buah. Dengan kepadatan bakteri 107 (Standart Mc Farland). Dilakukan dengan metode perendaman. Pengamatan terhadap gejala klinis dan kelangsungan hidup selama seminggu.
Analisa Data
Data yang diperoleh adalah data kualitatif dan kuantitatif, data kuantitatif
III. HASIL PEMBAHASAN 3.1. Hasil
Hasil Isolasi Bakteri Agensia Penyebab Vibriosis Pada Udang Vannamei (Litopenaeus
vannamei) di Pertambakan Kabupaten Kendal
No Warna Koloni Bentuk koloni
Asal isolat Karakteristik Koloni
Kode Isolat
1 Kuning Bulat Hepatopankreas Cembung JTV01
2 Kuning Pekat Bulat Hepatopankreas Cembung JTV02
3 Kuning Susu Bulat Hepatopankreas Rata JTV03
4 Kuning Pekat Bulat Lonjong
Hepatopankreas Cembung JTV04
5 Kuning Pekat Lonjong Hepatopankreas Cembung JTV05
6 Kuning Muda Bulat Hepatopankreas Cembung JTV06
7 Kuning susu Bulat Hepatopankreas Cembung JTV07
8 Kuning transparan Bulat Hepatopankreas Cembung JTV08 9 Hitam ring kuning Bulat Hepatopankreas Cembung JTV09
10 Kuning Muda Bulat Hepatopankreas Cembung JTV10
11 Kuning Bulat Hepatopankreas Cembung JTV11
12 Kuning Bening Tidak beraturan
Hepatopankreas Rata dan Halus JTV12
13 Kuning Bening Bulat Hepatopankreas Cembung JTV13 14 Putih susu Tidak
beraturan
Hepatopankreas Cembung JTV14
15 Putih Tidak
beraturan
Hepatopankreas Kasar JTV15
16 Kuning Pekat Bulat Hepatopankreas Kasar JTV16
17 Kuning muda Lonjong Hepatopankreas Cekung JTV17
18 Kuning Pekat Bulat Hepatopankreas Rata JTV18
19 Kuning muda Tidak beraturan
Hepatopankreas Kasar JTV19
Dari ke 19 isolat yang menjadi causative agent vibriosis pada udang vaname terdapat tiga bentuk koloni yaitu bulat, lonjong, dan tidak beraturan, sedangkan warna koloni terdapat 8 warna
Hasil Isolasi Bakteri Agensia Penyebab Vibriosis Pada Udang Windu (Penaeus monodon) di Pertambakan Wakak, Kabupaten Kendal
No Warna Koloni Bentuk koloni Asal isolat Karakteristik
Koloni Kode Isolat
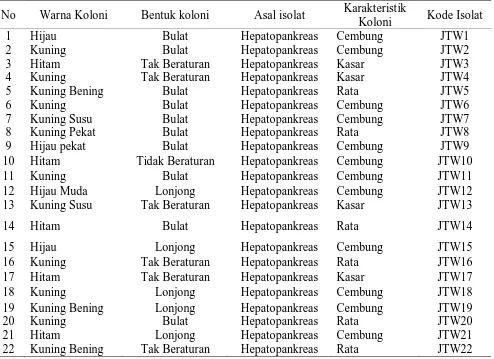
1 Hijau Bulat Hepatopankreas Cembung JTW1
2 Kuning Bulat Hepatopankreas Cembung JTW2
3 Hitam Tak Beraturan Hepatopankreas Kasar JTW3
4 Kuning Tak Beraturan Hepatopankreas Kasar JTW4
5 Kuning Bening Bulat Hepatopankreas Rata JTW5
6 Kuning Bulat Hepatopankreas Cembung JTW6
7 Kuning Susu Bulat Hepatopankreas Cembung JTW7
8 Kuning Pekat Bulat Hepatopankreas Rata JTW8
9 Hijau pekat Bulat Hepatopankreas Cembung JTW9
10 Hitam Tidak Beraturan Hepatopankreas Cembung JTW10
11 Kuning Bulat Hepatopankreas Cembung JTW11
12 Hijau Muda Lonjong Hepatopankreas Cembung JTW12
13 Kuning Susu Tak Beraturan Hepatopankreas Kasar JTW13
14 Hitam Bulat Hepatopankreas Rata JTW14
15 Hijau Lonjong Hepatopankreas Cembung JTW15
16 Kuning Tak Beraturan Hepatopankreas Rata JTW16
17 Hitam Tak Beraturan Hepatopankreas Kasar JTW17
18 Kuning Lonjong Hepatopankreas Cembung JTW18
19 Kuning Bening Lonjong Hepatopankreas Cembung JTW19
20 21 22
Kuning Hitam
Kuning Bening
Bulat Lonjong Tak Beraturan
Hepatopankreas Hepatopankreas Hepatopankreas
Rata Cembung Rata
JTW20 JTW21 JTW22
Dari ke 22 isolat agensia penyebab vibriosis pada udang windu terdapat tiga bentuk koloni yaitu bulat, tidak beraturan, dan lonjong sedangkan warna koloni terdapat 7 warna yaitu hijau, kuning, hitam, kuning bening, kuning susu, kuning pekat, dan hijau pekat.
Repetitive sequence-based Polymerase Chain Reaction (rep-PCR) Isolat Vibrio pada Udang Vannamei
[image:6.595.57.551.126.485.2]kompleks dan spesifik bagi masing-masing isolat bakteri. Pada gambar 5 menunjukkan bahwa isolat JTV 1, JTV 2, JTV 4, JTV 5, JTV 7, JTV 8, JTV 9, JTV 10, JTV 11, JTV 12, memiliki profil DNA band yang mirip, terlihat pada bp 1000, 850, 750, 700 dan 650, memiliki lima molekul DNA yang sama, sedangkan untuk isolat JTV 3 profil DNA band nya
mirip dengan profil DNA band JTV 6, terlihat pada bp 1050, 900, 850, dan 800, memiliki 4 molekul DNA yang sama.
Gambar 5. Hasil Elektroforesis rep-PCR. Keterangan : (M: DNA marker, m: JTV 13 , n: JTV 14, o: JTV 15, p: JTV 16, q: JTV 17, r: JTV 18, s: JTV 19.
Gambar 4. Hasil Elektroforesis rep-PCR. Keterangan : (M: DNA marker, a: JTV 1 , b: JTV 2, c: JTV 3, d: JTV 4, e: JTV 5, f: JTV 6, g: JTV 7, h: JTV 8, i: JTV 9, j: JTV 10, k: JTV 11, l: JTV 12.
Hasil amplifikasi DNA dengan Repetitive sequence-based Polymerase Chain Reaction (rep-PCR) isolat JTV 13 sampai dengan JTV 19 disajikan pada gambar 6. Pada gambar 6 menunjukkan bahwa isolat JTV 13, JTV 14, JTV 15, JTV 16, JTV 17, dan JTV 18, memiliki profil DNA band yang mirip, terlihat pada bp 1000, 850, 750, 700 dan 650, memiliki lima molekul DNA yang sama, sedangkan untuk isolat JTV 19 profil DNA band nya berbeda dengan isolat yang lainnya, terlihat pada bp 750 dan 600
Hasil analisis dengan Rep-PCR, kemudian dikelompokkan berdasarkan kesamaan profil fingerprint DNA. Pengelompokkan isolat bakteri berdasarkan hasil amplifikasi DNA rep-PCR menggunakan program tree view.
Repetitive sequence-based Polymerase Chain Reaction (rep-PCR) Isolat Vibrio pada udang windu
[image:7.595.341.553.163.321.2]bahwa hasil amplifikasi DNA menggunakan rep-PCR mampu menghasilkan profil fingerprint yang kompleks dan spesifik bagi masing-masing isolat bakteri. Pada gambar 2 menunjukkan bahwa isolat JTW 1, JTW 2, JTW 4, JTW 5, JTW 7, JTW 8, JTW 9, JTW 10, JTW 11, JTW 12, memiliki profil DNA band
yang mirip, terlihat pada bp 900, 800, 700, 600 dan 500, memiliki lima berat molekul DNA yang sama, sedangkan untuk isolat JTW 3 profil DNA band nya mirip dengan profil DNA band JTW 6, terlihat pada bp 1000, 750 dan 650, memiliki 3 berat
molekul DNA yang sama.
M a b c d e f g h i j k l
1000 900 800 700 600 500
200
Gambar 6. Hasil Elektroforesis rep-PCR.
Keterangan : (M: DNA marker, a: JTW 1 , b: JTW 2, c: JTW 3, d: JTW 4, e: JTW 5, f: JTW 6, g: JTW 7, h: JTW 8, i: JTW 9, j: JTW 10, k: JTW 11, l: JTW 12.
JT W20 JT W19 JT W18 JT W17 JT W16 JT W15 JT W14 JT W13 JT W12 JT W11 JT W10 JT W9 JT W8 JT W7 JT W5 JT W4 JT W1 JT W2 JT W3 JT W6
M m n o p q r s t u v
1000
900
800
700
600
Gambar 7. Hasil Elektroforesis rep-PCR.
Keterangan : (M: DNA marker, m: JTW 13 , n: JTW 14, o: JTW 15, p: JTW 16, q: JTW 17, r: JTW 18, s: JTW 19, t: JTW 20, u: JTW 21, v: JTW 22.
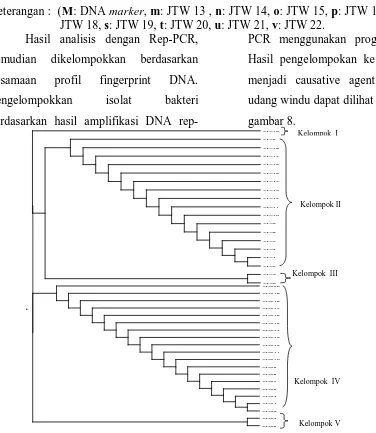
Hasil analisis dengan Rep-PCR, kemudian dikelompokkan berdasarkan kesamaan profil fingerprint DNA. Pengelompokkan isolat bakteri berdasarkan hasil amplifikasi DNA
[image:9.595.103.479.336.769.2]rep-PCR menggunakan program tree view. Hasil pengelompokan ke 22 isolat yang menjadi causative agent vibriosis pada udang windu dapat dilihat pada dendogram gambar 8.
.
JT V19
JT V5
JT V18 JT V17
JT V16 JT V15
JT V14
JT V13
JT V12 JT V11
JT V10 JT V9
JT V8
JT V7 JT V4
JT V1
JT V2
JT V3 JT V6
Kelompok I
Kelompok II
Kelompok III
Kelompok IV
Gambar 8. Dendogram hasil pengelompokkan bakteri dengan rep PCR.
Berdasarkan dendogram tersebut (gambar 8) diperoleh bakteri yang menjadi causative agent penyebab vibriosis pada udang vaname (L.vanname) terbagi menjadi 3 kelompok. Kelompok I terdiri dari isolat JTV 19, kelompok II , terdiri dari JTV 1, JTV 2, JTV 4, JTV 5, JTV 7, JTV 8, JTV 9, JTV 10, JTV 11, JTV 12, JTV 13, JTV 14, JTV 15, JTV 16, JTV 17, JTV 18, kelompok III terdiri dari isolat JTV 3 dan JTV 6. Sedangkan pada udang windu bakteri yang menjadi causative agent penyebab vibriosis pada udang windu (P. Monodon Fab.) terbagi menjadi 2 kelompok. Kelompok IV terdiri dari 20
isolat yaitu JTW 1, , JTW 14, JTW 15, JTW 16, JTW 17, JTW 18, JTW 19, JTW 20, JTW 21, JTW 22, sedangkan kelompok V terdiri dari 2 isolat yaitu JTW 3 dan JTW 6.
Proses selanjutnya dipilh 5 isolat yang mewakili masing-masing kelompok untuk dilakukan sekuensing dengan sekuen PCR 16S rDNA. Kelompok I diwakili oleh JTV 19, kelompok II diwakili oleh isolat JTV 5, kelompok III diwakili oleh isolat JTV 3, kelompok IV diwakili JTW 1, kelompok V diwakili oleh isolat JTW 3 dan JTW6.
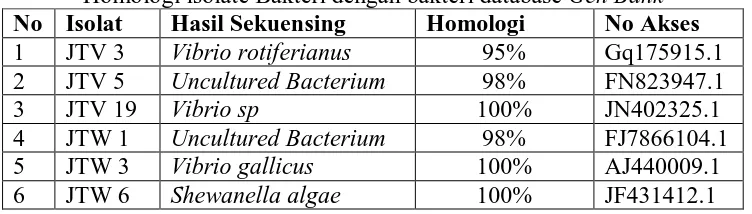
Homologi isolate Bakteri dengan bakteri database Gen Bank No Isolat Hasil Sekuensing Homologi No Akses 1 JTV 3 Vibrio rotiferianus 95% Gq175915.1 2 JTV 5 Uncultured Bacterium 98% FN823947.1
3 JTV 19 Vibrio sp 100% JN402325.1
4 JTW 1 Uncultured Bacterium 98% FJ7866104.1
5 JTW 3 Vibrio gallicus 100% AJ440009.1
Dendogram hasil rep-PCR causative agent
vibriosis dari pertambakkan Kendal Pohon Phylogenetic Agensia Penyebab Vibriosis pada Udang Vannamei dan udang windu dari pertambakkan Desa Wakak, Kabupaten Kendal.
U nc ult ure d ba c t e rium V ibrio sp
J T V 1 8 J T V 1 7 J T V 1 6 J T V 1 5 J T V 1 4 J T V 1 3 J T V 1 2 J T V 1 1 J T V 1 0 J T V 9 J T V 8 J T V 7 J T V 4 J T V 1 J T V 2
V ibrio ha rve yi
J T V 6
NR 025478.1 Vibrio xuii R 15052 DQ146983.1 Vibrio sp. V322 AB457055.1 Vibrio sp. SB G3 HQ677232.1 Vibrio sp. L-31 AJ440009.1 Vibrio gallicus LMG 21330 HWK 23
HIK 5
JF692695 Uncultured bacterium clone JOAG04C JF692678.1 Uncultured bacterium clone JOAF04C DQ357813.1 Vibrio sp.
HWK 1
FJ786104.1 Uncultured bacterium clone S0 51 HWK35
JF414773.1 Shewanella algae BPRIST022 JF342358.1 Shewanella algaeS1216 HQ876210.1 Shewanella sp. 8122 HM016087.1 Shewanella algae ATCC 51192 HM016086.1 Shewanella haliotis DW01 HQ694830 Vibrio parahaemolyticus strain BG24 HQ123986.1 Vibrio parahaemolyticus strain SB Vibrio rotiferianus strain LMG 21460 Vibrio rotiferianus strain F75121 Vibrio harveyi strain B5 Vibrio sp HDC8 Vibrio rotiferianus HIK 3 HIK 69
JN402325.1 Vibrio sp. N3
JN087491.1 Uncultured Vibrio sp. clone Liv16S L267 JN128268.1 Vibrio campbellii HNS034 JN128263.1 Vibrio azureus HNS029 HQ827779.1 Vibrio alginolyticus C100311 FN436276.1 Vibrio alginolyticus strain N26 1 FJ981876.1 Vibrio sp.
FJ906750.1 Vibrio alginolyticus strain HN08801 Salinicoccus sp. 10017 EU432557.1 FN823947.1 Uncultured bacterium clone 104N C2
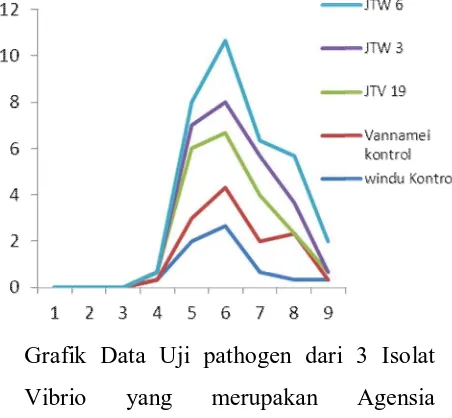
Grafik Data Uji pathogen dari 3 Isolat Vibrio yang merupakan Agensia Penyebab Utama Vibriosis pada Udang windu dan Vannamei
3.2. Pembahasan
Pada penelitian ini bakteri yang diisolasi berasal dari udang Vaname sakit dari pertambakkan Kabupaten Kendal. Udang yang terserang vibriosis menunjukkan gejala klinis sebagai berikut bagian hepatopankreas yang berwarna merah kecoklatan, tubuh terdapat bercak merah, bagian ekor geripis dan berwarna merah kecoklatan. Seperti yang dijelaskan Sunaryanto et al, (1987) udang yang terserang vibriosis mempunyai ciri badan terdapat bercak merah-merah (red discoloration) pada pleopod dan abdominal serta pada malam hari terlihat menyala.
Gejala klinis yang ditimbulkan dari vibriosis tergantung tingkat serangan yaitu
kronik atau akut. Pada tingkat kronik dan akut gejala yang ditimbulkan cukup jelas (Richards, 1980). Gejala yang terlihat seperti punggung kehitam-hitaman, bercak merah pada pangkal sirip, sisik tegak, bergerak lamban, keseimbangan terganggu, nafsu makan berkurang. Sering terjadi mata menonjol (exophotalmia), perut kembung berisi cairan, hemorhagik pada insang, mulut, tubuh, usus dan organ dalam. Apabila sampai fase ini ikan belum mati, gejala penyakit akan berkembang yaitu kulit mengelupas, koreng, nekrosis dibeberapa bagian tubuh dan dapat pula terbentuk ulser (Kamiso, 1985).
Berdasarkan rep-PCR terdapat 3 kelompok besar yang bisa mewakili ke 19 hasil isolate untuk dilakukan sekuensing. Kelompok I terdiri dari isolate JTV 19, kelompok II terdiri dari isolate JTV 1, JTV 2, JTV 4, JTV 5, JTV 7, JTV 8, JTV 9, JTV 10, JTV 11,JTV 12, JTV 13, JTV 14, JTV 15, JTV 16, Jtv 17, dan JTV 18, sedangkan kelompok III terdiri dari isolate JTV 3 dan JTV 16. Dari kelompok tersebut dipilih masing-masing kelompok untuk mewakili sekuensing yaitu kelompok I adalah isolate JTV 19, Kelompok II adalah isolat JTV 5, dan kelompok III adalah isolate JTV 3.
[image:12.595.80.306.110.319.2]yang dilakukan melalui pendekatan bio molekuler melalui PCR, khususnya rep-PCR telah berhasil mengestimasi causative agent vibriosis pada udang vannamei. Aplikasi dari rep-PCR untuk pengelompokkan bakteri secara cepat dalam rangka karakterisasi bakteri telah dilakukan oleh Rademaker dan de Bruijn (1997). Selanjutnya rep-PCR juga telah berhasil digunakan untuk pengelompokkan bakteri psikotropik dari selat Makassar (Radjasa et al, 2007).
Penelitian yang dilakukan oleh Sarjito et al (2009) diperoleh pula bahwa identofikasi agensia penyebab penyakit dengan rep-PCR terbukti efektif dan efisien dalam mengelompokkan agensia penyebab utama vibriosis pada ikan kerapu, serta mampu membedakan hubungan kekerabatan spesies vibrio. Oleh karena itu, rep-PCR banyak digunakan karena kemampuannya untuk membedakan isolate bakteri hingga ke tingkat spesies, sub spesies dan strain dengan cepat dan spesifik sehingga dapat digunakan untuk pengelompokkan bakteri (rapid grouping) (Rademeker dan de Bruijn, 1997; Radjasa et al 2007).
Berdasarkan rep-PCR terdapat 3 kelompok besar yang bisa mewakili ke 19 hasil isolate untuk dilakukan sekuensing. Kelompok I terdiri dari isolate JTV 19,
kelompok II terdiri dari isolate JTV 1, JTV 2, JTV 4, JTV 5, JTV 7, JTV 8, JTV 9, JTV 10, JTV 11,JTV 12, JTV 13, JTV 14, JTV 15, JTV 16, Jtv 17, dan JTV 18, sedangkan kelompok III terdiri dari isolate JTV 3 dan JTV 16. Dari kelompok tersebut dipilih masing-masing kelompok untuk mewakili sekuensing yaitu kelompok I adalah isolate JTV 19, Kelompok II adalah isolat JTV 5, dan kelompok III adalah isolate JTV 3.
Telah banyak dilaporkan penelitian yang berhubungan dengan vibriosis pada udang yang dilakukan melalui pendekatan bio molekuler melalui PCR, khususnya rep-PCR telah berhasil mengestimasi causative agent vibriosis pada udang vannamei. Aplikasi dari rep-PCR untuk pengelompokkan bakteri secara cepat dalam rangka karakterisasi bakteri telah dilakukan oleh Rademaker dan de Bruijn (1997). Selanjutnya rep-PCR juga telah berhasil digunakan untuk pengelompokkan bakteri psikotropik dari selat Makassar (Radjasa et al, 2007).
hubungan kekerabatan spesies vibrio. Oleh karena itu, rep-PCR banyak digunakan karena kemampuannya untuk membedakan isolate bakteri hingga ke tingkat spesies, sub spesies dan strain dengan cepat dan spesifik sehingga dapat digunakan untuk pengelompokkan bakteri (rapid grouping) (Rademeker dan de Bruijn, 1997; Radjasa et al 2007)
Melalui gejala klinis yang telah diamati, udang yang diduga terserang vibriosis dikumpulkan dan selanjutnya dilakukan pengujian secara biomolekuler. Tahap awal yang dilakukan adalah dengan mengisolasi bakteri vibrio dari tubuh udang yang diambil pada bagian hepatopancreas dan ekor. Dari bagian ekor, tidak terdapat isolat vibrio yang tumbuh. Hasil isolat yang tumbuh berasal dari bagian hepatopankreas udang windu. Diperoleh 22 isolat murni dengan karakteristik morfologi koloni yang berbeda. Selanjutnya isolat murni yang telah diperoleh diuji lanjut dengan metode PCR untuk secara langsung dapat mengidentifikasi dan membedakan jenis spesies vibrio ((Martinez et al., 1994). Dari hasil PCR pengelompokkan kemudian dilakukan menggunakan software TreeView, dan diperoleh 2 kelompok besar berdasarkan tingkat kekerabatan yang terdekat. Kelompok I
terdiri dari isolat JTW 1, JTW 2. JTW 4, JTW 5, JTW 7, JTW 8, JTW 9, JTW 10, JTW 11, JTW 12, JTW 13, JTW 14, JTW 15, JTW 16, JTW 17, JTW 18, JTW 19, JTW 20, JTW 21, JTW 22. Sedangkan kelompok II terdiri dari JTW 3 dan JTW 6.
Pada penelitian ini, karakterisasi secara molekuler dilakukan dengan membandingkan sequence 16S rDNA dari isolat-isolat bakteri-bakteri agensia penyebab vibriosis pada udang dari pertambakkan wakak Kendal dengan database DNA dunia. Database DNA dunia tersebut selalu diperbaharui secara harian dan dilakukan cross check di antara tiga database DNA dunia yaitu Gen Bank, DNA database of japan (DDJB)dan European Moleculer Biology Laboratory (EMBL), sehingga tidak akan terjadi overlapping dan status sekuense selalu terkini.
Dari tabel homologi sekuen 16S rDNA dari masing-masing isolate bakteri dengan sekuen 16S rDNA dari database Gen Bank diketahui bahwa tidak ada sekuen 16S rDNA yang identik. Hagstrom
et al. (2000) menyatakan bahwa isolat
identitas bakteri pada tingkat genus tetapi berbeda spesies. Dari pernyataan tersebut di atas dapat dikatakan bahwa isolat JTV 3 adalah genus vibrio dengan homologi sekuen 95%, JTV 5 uncultured bacterium homologi sekuen 98%, JTV 19 Vibrio Sp dengan homologi sekuen 100%, JTW 1
uncultured bacterium homologi sekuen
98%, JTW 3 Vibrio gallicus homologi 100%, dan Shewanella algae dari isolat JTW 6 dengan homologi sekuen 100%.
Homologi sebesar 95% pada penelusuran sekuen DNA isolat bakteri JTV 3, JTV 19 mempunyai nukleotida yang identik dengan bakteri Vibrio sp. Banyak penelitian yang berhubungan dengan vibrio telah melaporkan bahwa Vibrio sp terjadi secara alami dalam lingkungan air dan adalah salah satu bakteri yang paling sering terjadi dilingkungan budidaya udang (Vandenberghe, et al, 2003). Jumlah spesies Vibrio dilaporkan telah meningkat pesat dalam dekade terakhir. Thompson,
et al (2004) telah melaporkan telah
melaporkan spesies lingkungan yang terdiri dari genus vibrio 63 spesies yang terdiri dari Vibrio genus. Sepuluh dari mereka adalah keprihatinan manusia (Twedt, 1989) karena mereka telah terkait dengan infeksi kulit dan gangguan pencernaan yang parah (andrew, 2004,
Perez-Rosas dan Hazen 1998, Venkateswaran et al 1998). beberapa spesies patogen Vibrio juga telah dilaporkan sebagai agen penyebab infeksi udang (Goarant et al, 1999). Sebaliknya, spesies lain seperti Vibrio alginolyticus telah dilaporkan sebagai probiotik untuk budidaya udang (Vandenberghe, 2003, Direkbusaram, et al, 1998).
JTV 5, dan JTW 1 mempunyai nukleotida yang identik dengan bakteri
uncultured bacterium. Aman et al (1995)
menyebutkan dalam diversitas mikroba laut, hanya sebesar 1% dari total bakteri yang ada di bumi yang sudah dapat dikultur (culturablea). Sisanya terdapat ± 99% belum dapat dikultur pada media buatan manusia (unculturable). Ilmuwan terus melakukan inovasi dengan membuat media bakteri yang dapat menumbuhkan bakteri-bakteri yang baru. Uncultured
bacterium yang dahulunya belum bias
dikultur dikarenakan kompleksitas alam sehingga tidak dapat tumbuh pada media buatan manusia. Terakhir ini hanya berupa metagenom (materi genetic yang diangkat langsung dari sampel dilingkungan) yang keberadaannya diketahui melalui pendekatan kultur mandiri (culture
independent approach). Proses
diperbanyak dengan menggunakan tehnik PCR, yang selanjutnya dikloning pada suatu vector (dapat berupa plasmid, virus dll) dan selanjutnya dilakukan sekuensing DNA. Pada penelitian ini berhasil mengkultur Uncultured bacterium, dengan tingkat homologi 98% dan merujuk pada kelompok bakteri Vibrio sp, dengan melihat pohon Filogenetik pada gambar 18.
Menurut Aman et al., 1995 menyatakan Kultur mikroorganisme telah menjadi sumber hampir semua gen resistensi dengan ditandai antibiotic, oleh karena itu, kebanyakan studi sebelumnya telah mengabaikan yang berpotensi dari kolam air yang merupakan gen resistensi antibiotik pada kultur bakteri. Hal ini didukung oleh pernyataan Head et
al.,1998 bahwa keragaman dari mayoritas
uncultured sangat luas. Dan meskipun
kemajuan terbaru dalam metode kultur, isolasi kultur independent dari antibiotic gen resisten berasal dari sampel lingkungan. Dewasa ini kedua metode kultur PCR dengan ekstraksi dan cloning DNA langsung dari sampel tanah, sehingga membangun perpustakaan yang mencakup gen dari uncultured dari bakteri tanah. Seperti perpustakaan yang terdiri dari DNA lingkungan atau “perpustakaan metagenonic” telah digunakan
sebelumnya untuk mengidentifikasi klon mengekspresikan berbagai enzyme dan berbagai aktivitas antimikroba (Henne et
al.,2000).
JTW 6 mempunyai nukleotida yang identik dengan bakteri Shewanella
algae. Macdonnell et al (1985)
melaporkan pada tahun 1986, yang termasuk heterotrofik filogenetis banyak beragam bakteri fakultative anaerob yang sering diisolasi dari habitat air tawar dan laut. Saat ini, Shewanella genus (jenis spesies S.putrefaciens) terdiri dari 25 spesies, yang sebagian besar digambarkan dalam lima tahun terakhir. Spesies ini dapat beradaptasi dengan tekanan tinggi dan suhu rendah dibedakan oleh kemampuan mereka untuk mensintesis asam lemak tak jenuh ganda.
Bakteri dari genus Shewanella awalnya dimasukkan ke dalam family Vibrionaceae tetapi kemudian dipindahkan ke family Alteromonadaceae yang secara dekat lebih terkait ke filogenetis, yang juga mencakup
Gammaproteobacteria laut dari
Alteromonas genera, Marinobacterium,
Microbulbifer, Marinobacter, dan
lain-lain. Akhirnya, berdasarkan studi filogenetik terbaru, bakteri dari genus ini didapatkan untuk isolat family
fenotipik mereka sangat mirip dengan
organisme laut lainnya
Gammaproteobacteria. Sebelumnya, itu
menunjukkan bahwa komposisi lipid seluler dapat digunakan sebagai kriteria untuk diferensiasi bakteri laut milik
Alteromonas genera, Marinomonas, dan
Pseudoalteromonas. Ini merupakan
kelanjutan dari penelitian kami bertujuan untuk mengungkapkan karakteristik chemataxanomic dapat diandalkan laut Gammaproteobacteria diisolasi dari laut timur melainkan ditujukan untuk penyelidikan komparatif kuinon isoprenoid, fosfolipid, dan asam lemak dari isolat strain Shewanella dan jenis genera terkait erat Alteromonas,
Pseudoalteromonas, Marinobacter,
Marinobacterium, dan Microbulbifer.
Penelitian lebih lanjut tentang Shewanella kemudian dilaporkan oleh Venkateswaren et al 1999 yang melaporkan bahwa Shewanella genus telah dipelajari selama puluhan tahun dan selama bertahun-tahun, telah diklasifikasikan dalam taxonomy sebagai
Achromobacter, Pseudomonas,
Alteromonas, dan Shewanella. Karena
kemiripan genetik untuk Vibrionaceae, Macdonnell et al 1985 merekomendasikan bahwa Shewanella dan genus terkait
Listonella, ditempatkan dalam
keluarga/family Vibrionaceae. Spesies Shewanella adalah batang panjang, pendek, atau berserabut gram negatif yang umumnya oksidase positif, indol negatif, dan nonfermentative untuk gula paling dan biasanya menghasilkan H2S pada Kligler atau gula agar besi tiga (TSI).
Hal ini di perkuat dengan yang didapatkan dari hasil penelitian bahwa bakteri Shewanella algae dapat tumbuh pada media TCBSA, media TCBSA merupakan media spesifik untuk Vibrio, dan dalam hal ini Shewanella algae termasuk dalam family Vibrionaceae. Kemudian dilihat dari hasil pohon pylogenetic terlihat bahwa Shewanella
algae sangat berdekatan erat dengan grup
Vibrio.
Zadeh et al (2010) melaporkan bahwa Shewanella algae merupakan kandidat probiotik yang berasal dari system pencernaan dari juvenile udang windu. Probiotik merupakan makanan tambahan (suplemen) berupa sel-sel mikroba hidup, yang memiliki pengaruh menguntungkan bagi hewan inang yang
mengkonsumsinya melalui
penyeimbangan flora mikroba intestinalnya (Fuller, R. 1987). Hal ini dibuktikan dalam penelitian bahwa
Shewanella algae berasal dari isolat asal
udang windu dengan uji
pathogenesitasnya (76,67%) hal ini berarti
Shewanella algae mungkin merupakan
kandidat bakteri pathogen yang probiotik atau menguntungkan karena tingkat mortalitas terhadap udang yang diujikan di atas 50%.
Uji Pathogenesitas
Pada hasil uji pathogenisitas didapatkan tingkat kelangsungan hidup (SR) yang tertinggi berturut-turut yaitu JTV 19 sebesar (80%), JTW 6 (76,67%) JTW 3 (53,33%) dan pada perlakuan windu control sebesar 63,33% dan pada Vannamei control sebesar 60%. Kondisi fisik udang pada penelitian adalah sangat baik. Dengan memperhatikan gejala-gejala klinis yang terdapat pada benih
udang pada saat perlakuan uji pathogenitas udang berenang dalam keadaan sehat, hal ini terlihat udang bergerak laju dan aktif.
Udang yang diinfeksi dengan isolat vibrio sp (JTV 19), Vibrio gallicus (JTW 3) dan Shewanella alga (JTV 6) dari ke tiga jenis bakteri tersebut dapat dikatakan bahwa kurang pathogen pada benih udang vannamei dan udang windu. Hal ini didukung oleh kisaran kualitas air dalam keadaan baik (normal). Pada kondisi inang inang yang baik/sehat akan mempengaruhi kemampuan bakteri pada inang sehat tidak menimbulkan penyakit, akan tetapi mampu menyebabkan penyakit pada kondisi inang yang tidak normal (Sjahrurrahman, 2006).
Kualitas air yang optimal selama penelitian juga mempengaruhi rendahnya pathogenesitas agensia penyebab vibriosis. Hal ini didukung oleh beberapa penelitian yang menyatakan bahwa
Shewanella algae merupakan kandidat
daya tahan organisme terhadap serangan agensia penyebab utama vibriosis. Lingkungan yang baik akan meningkatkan daya tahan organisme yang dipelihara, sedangkan lingkungan yang kurang baik akan menyebabkan organisme yang dipelihara menjadi stress dan dapat menurunkan daya tahan terhadap serangan penyakit (Wedemeyer, 1970). Kemudian didukung oleh Wood (1974) bahwa bakteri vibrio bersifat opurtunistik, maka serangan akan timbul apabila bakteri berkembang cukup banyak dan daya tahan tubuh inang melemah.
Mortalitas karena vibriosis terjadi ketika udang tertekan oleh faktor-faktor seperti: kualitas air yang buruk, kepadatan, suhu air tinggi, pertukaran air rendah DO dan rendah (Lewis, 1973; Lightner dan Lewis, 1975; Brock dan Lightner, 1990). Mortalitas tinggi biasanya terjadi pada udang juvenil postlarvae dan muda. P monodon larva suferred mortalitas dalam waktu 48 jam dari tantangan perendaman dengan strain
V. harveyi dan V. splendidus
(Lavilla-pitogo, et al., 1990).
IV. KESIMPULAN DAN SARAN 4.1. Kesimpulan
Kesimpulan yang diperoleh dalam penelitian ini adalah:
1. Diperoleh 40 isolat yang berasosiasi dengan vibriosis pada udang vanamae dan udang windu. Hasil Rep-PCR diperoleh 5 kelompok bakteri, kelompok I terdiri dari JTV 19, kelompok II terdiri dari JTV 1, JTV 2, JTV 4, JTV 5, JTV 7, JTV 8, JTV 9, JTV 10, JTV 11, JTV 12, JTV 13, JTV 14, JTV 15, JTV 16, JTV 17, JTV 18, kelompok III terdiri dari JTV 3 dan JTV 6, Kelompok IV terdiri dari JTW I, JTW 14, JTW 15, JTW 16, JTW 17, JTW 18, JTW 19, JTW 20, JTW 21, JTW 22. Sedangkan kelompok V terdiri dari JTW 3, dan JTW 6. Hasil penelusuran berdasarkan analisis 16S rDNA menggunakan sistem BLAST diperoleh JTV 3 Vibrio rotiferianus, JTV 5 Uncultured Bacterium, JTV 19 Vibrio sp, JTW 1 Uncultured Bacterium, JTW 3 Vibrio gallicus,
JTW 6 Shewanella algae.
4.2. Saran
1. Perlu dilakukan penelitian serupa pada berbagai pertambakkan budidaya daerah pantura Jawa tengah sebagai pembanding.
2.Perlu dilakukan penelitian lanjutanuntuk isolat Shewanella alga dan Uncultured
Bacterium untuk lebih mengidentifikasi
bakteri tersebut.
UCAPAN TERIMA KASIH
Pada kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah ikut membantu dalam penyelesaian artikel ini, terlebih kepada Dosen Pembimbing Prof. Dr. Ir S.B.Prayitno, M.Sc dan Dr. Ir. Sarjito. M.App.Sc serta teman-teman MSDP 2009 untuk bantuan dan motivasinya.
DAFTAR PUSTAKA
Andrews, L.S. 2004. Strategies to Control Vibriosis in Molluscan Shellfish. Food Protection Trends 24: 70-76.
Arikunto, S. 2002. Manajemen Penelitian. Rineka Cipta. Jakarta.
Austin, B.D. and A. Austin. 1988. Bacterial Fish Pathogen: Disease and Farmed and Wild Fish. Ellis Horwood, Chichester. 364 p.
. 1989. Method for the Microbiological Examination of Fish and Shell Fish. Allice harwood Ltd. Chichester. 317 p. . 1999.
Bacterial Fish Pathogens Diseases of
Farmed and Wild Fish, 3rd (revised) Spinger Praxis. Goldfarming.
Bergey’s. 2002. Taxonomic Outline of the Procaryotes. Bergey’s Manual of Systematic Bacteriology, Second Edition, Release 2.0, New York;
Springer, 2002. DOI:
http://dx.doi.org/10.1007/bergeyoutline /main.htm.
Brock, T.D. and M.T. Madigan. 1991. Bology of Microorganisms. Prentice Hall, Englewood Cliffs. New Jersey. 368 p.
Food and Agriculture Organization (FAO). 2010. www.dkp.go.id
Irianto, A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Yogyakarta.
Kamiso, H.N. 1996. Vibriosis Pada Ikan
dan Alternatif Cara
Penanggulangannya. J. Fish Sci, 1 (1) : 78-86.
Kamiso. 2004. Status Penyakit Ikan dan Pengendaliannya di Indonesia. Seminar Nasional Penyakit Ikan dan Udang IV, Purwokerto.18-19 Mei 2004. Universitas Jendral Soedirman. Purwokerto.
Kastitonif., Widigdo. 2004. Mengenali Jenis dan Karakteristik Isolat Vibrio yang berasal dari Hepatopankreas Udang P. Monodon Secara Bakteriofage, Biokimia dan Pathogenisitasnya. PT. Centralpertiwi Bahari. Lampung.
Lavilla-Pitogo, C.R., and De La Pena, L.D. 1998. Mortalities of Pond-Cultured Juvenile Shrimp, Penaeus
monodon. Associated With Dominance
of Luminescent Vibrios In The Rearing Environment. Aquaculture 164: 337-349.
. 1988. Red Disease of Panaeid Shrimp In: Disease Diagnosis and Control in North American Aquaculture. Elsevier, Amsterdam. 100-103.
Liu, P.C., W.H. Chuang and K.K. Lee., 2003. Infectious Gastroenteristis Caused by Vibrio Harveyi (V. charcariae) in Cultured Red Drum, Scianeops ocellatus, J.Appl.lchtyl,
19:59-51.
MacDonell, M.T. and Colwell, R.R. 1985. Phylogeny of the Vibrionaceae and Recommendation for Two New Genera, Listonella and Shewanella, System. Appl. Microbiol. Vol 6, pp. 171-182 [Validation List no. 20, Int. J.
Syst. Bacteriol., 1986. Vol 36, pp.
354-356].
Mahardika, I.G.N..K. 2003. Polymerase Chain Reaction. Jurnal Veteriner Fakultas Kedokteran Hewan. Universitas Udayana vol 4 (1).
Muliani, A.Suwanto, Y. Hala. 2002. Isolasi dan Karakterisasi Asal Laut Sulawesi untuk Biokontrol Penyakit Vibriosis pada Larva Udang windu (Penaeus monodon Fab). Institut Pertanian Bogor.
Rademaker, J.L.W. and F.J. De Bruijn. 1997. Characterization and Classification of Microbes by rep-PCR Genomic Fingerprinting and Computer-Assited Pattern Analysis. In: G. Caetano-Anolles and P.M. Gresshoff (Eds) DNA Marker: Protocols, Application and Overviews. John Wiley and Sons. New York. P: 151-171.
Rademaker, J.L.W., H.J.M. Aart and P. Vinuesa. 2005. Molecular Typing of Enviromental Isolates. In: A.M. Osborn and C.J. Smith (Eds). Molecular Microbial Ecology.Taylor and Francis Group. New York. pp 97-134.
Radjasa,O.K., H Urukawa, K Kita-Tsukamoto, and K Ohwada.,2001. Characterization of Psychrotrophic
Bacteria in The Surface and Deep Sea Waters from Nortwestern Pacipic Ocean Based on 16S Ribosomal DNA Approach. Mar. Biotech.,3:454-452. Radjasa, O.K. 2009. Eco-Biotechnological
Perspectives on Bacterial Symbionts of Reefs Invertebrates. BP. Universitas Diponegoro , Semarang. 63 p.
Rand, G.M. 1980. Detection Bioassay, In (F.E. Guthrie and J.J. Perry (eds)). Introduction to Environmental Toxicology Elsevier. New York. 390-403p.
Rencana dan Strategi, Kementrian Kelautan dan Perikanan. 2010. www.dkp.go.id.
Rengpipat, S., Rukpratanporn, S., Piyatiratitivorakul, S., Menasveta, P.1998. Probiotics in Aquaculture: A case study of probiotics for larvae of black tiger shrimp (Penaeus monodon). Di dalam: Flegel TW (ed). Advances in shrimp biotechnology. Bangkok: National Center for Genetic Engineering and Biotechnology. Hlm 177-181.
Rheinheimer, G. 1992. Aquatic Microbiolgy 4th Edition. John Wiley and Sons. New York. pp 15-181.
Rubiyanto, W.H., Dian, A.S. 2007. Udang Vannamei. Penebar Swadaya. Jakarta. 74 hlm.
Phuoc, L.H., Patrick, S. and Peter, B. 2009. Standardization of Protocol For Vibrio Challenge In Specific Pathogen-Free (SPF) Shrimp (Litopenaeus vannamei). Faculty of Bioscience Engineering. Laboratory For Aquaculture and Artemia Reference Center. Ghent University. Rozier 44, B-9000, Belgium.
Sardjito, O.K. Radjasa., S. Hutabarat, dan S.B. Prayitno, 2007. Karakterisasi dan Pathogenesitas Agensia Penyebab Vibriosis pada Kerapu Macan (Epinephelus Fuscogutattus) dari Karimunjawa, Aquacukture Indonesia, 76: 762 – 766.
Sarjito, O.K. Radjasa, S.B. Prayitno, A. Sabdono dan S. Hutabarat, 2009. Phylogenetic Diversity of the Causative Agent of Vibriosis Associated With Groupers Fish from Karimunjawa Island Indonesia. Curr.Res. In Bac, 2 : 14-21.
Sardjito. 2010. Disertasi. Aplikasi Biomolekuler dalam Karakterisasi Agensia Penyebab Penyakit Vibrio dan Potensi Bakteri Sponge Sebagai Pengendali Vibriosis pada Ikan Kerapu. Universitas Diponegoro. Semarang.
Sjahrurrachman, A. 2006. Biologi Factor
Virulensi Bakteri.
http://www.tempo.co.id/medika/12200 2/pus-3.htm. Diakses 15 Juni 2006. Sunaryanto, A. and A. Mariyam. 1987.
Occuraence of Pathogenic Bacteria Causing Luminescene In Penaeid larvae In Indonesia Hatcheries. Bull. Brackhis Water Aqua. Devl. Centre, 8, 64-70.
Sung, H.H., G.H Kou. and Y.L Song. 1999. Vibriosis Resistance induced by Glucan Tretmaent in Tiger Shrimp (Penaeus Monodon). Fish Pathol. 29(1): 11-17.
Taslihan, A., M. Murdjani, C. Purbomartono, dan E.Kusnendar, 2001. Bakteri Patogen Penyebab Penyakit Mulut Merah Pada Ikan Kerapu Tikus (Cromileptes altivelis). Jurnal Perikanan II (2): 57-62.
Thompson, C.C., F.L. Thompson., K. Vandemeulebroecke., B. Hoste., P. Dawyndt and J. Swings. 2004. Use of recA as an Alternative Phylogenetic Marker In The Family Vibrionaceae. Laboratory for Microbiolgy and
BCCMTM/LMG Bacteria Collection, Ghent University, K.L. Ledeganckstraat 35, Ghent 9000, Belgium. International Journal of Systematic and Evolutionary Microbiology, 54, pp. 919-924.
Thompson, T., Fabiano, L., Iida and Swings, J. 2004. Biodevirsity of Vibrios. Microbiol. Mol. Biol. Rev., pp. 405-451.
Wedemeyer, G.A., W.T.Yasutake. 1977. Clinical Methods For Assesment Of Effect On Enviromental Stress on Fish Health. Technical Papers Of The U.S. Fish and Wildlife Service. U.S Depert. Of The Interior. Fish and Wildlife Service American 89: 1-17.
Wood, J.W. 1974. Diseases of Pasific Salmon Their Prevention and Treatment. Second ed., State of Washington, Dept. of Fish, Olympia, Washingto. 81p.