HASIL DAN PEMBAHASAN Saluran Reproduksi Rusa Timor 8etina
Rusa timor (Gervus timorensis) yang digunakan pada penelitian ini berumur tiga dan empat tahun. Pada umur terse but, rusa timor telah masuk masa aktif reproduksi, seperti yang dilaporkan Takandjandji (1997) bahwa masa aktif reproduksi rusa timor adalah 2-12 tahun.
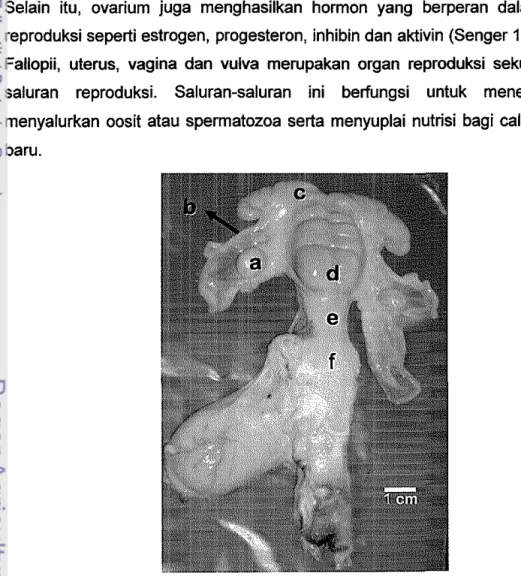
Pada penelitian ini diperoleh gambaran morfologis organ reproduksi betina rusa timor. Susunan dan bag ian-bag ian organ reproduksi betina rusa timor mirip dengan organ reproduksi pada ternak ruminansia lain (domba, sapi dan kambing), yaitu terdiri atas ovarium, tuba Fallopii (oviduct), uterus, vagina dan vulva (Gam bar 8). Ovarium merupakan organ reproduksi primer karena menghasilkan oosit yang berperan penting untuk menghasilkan individu baru. Selain itu, ovarium juga menghasilkan hormon yang berperan dalam proses reproduksi seperti estrogen, progesteron, inhibin dan aktivin (Senger 1999). Tuba Fallopii, uterus, vagina dan vulva merupakan organ reproduksi sekunder atau saluran reproduksi. Saluran-saluran ini berfungsi untuk menerima dan menyalurkan oosit atau spermatozoa serta menyuplai nutrisi bagi calon individu baru.
Gambar 8 Organ reproduksi betina rusa timor (Gervus timorensis), terdiri atas a. Ovarium, b. Tuba Fallopii, c. Cornua uteri, d. Corpus uteri, e. Cervix, f. Vagina.
Tuba Fallopii rusa timor mempunyai panjang 14.0-17.1 cm dengan diameter 0.03-0.08 cm dan berat 0.20-0.99 gram. Ukuran ini relatif sama dengan tuba Fallopii pada domba (15-19 cm) dan babi (15-30 cm) (Toelihere, 1979). Diameter tuba Fallopii rusa timor lebih kecil dibandingkan dengan yang ditemukan pada kerbau yaitu di bagian kiri sebesar 0.2 ± 0.01 cm dan bagian kanan sebesar 0.21 ± 0.01 cm (Sikar, 1983).
Uterus rusa timor bertipe bicornis, terbagi alas sepasang cornua (kanan dan kiri), corpus dan cervix uteri. Cornua uteri melengkung seperti tanduk dengan panjang 10.3-13.6 em. Ukuran ini relatif sama dengan yang dilaporkan pada rusa merah (6.5-13 em), dan lebih panjang daripada cornua wapiti (Gervus
canadiensis) yang dilaporkan mempunyai panjang 5-8 cm (Haigh dan Hudson 1993). Corpus dan cervix uteri rusa timor masing-masing memiliki panjang 1.2-1.6 em dan 4.5-5.6 cm. Pada corpus dan cornua uteri rusa timor ditemukan adanya karunkulae sebagaimana yang ditemukan pada uterus do mba, sapi dan kambing. Karunkulae merupakan daerah mukosa uterus yang berbentuk tonjolan tak berkelenjar pada uterus, yang mengandung banyak pembuluh darah. Karunkulae berperan sebagai tempat bertautnya cotyledon dengan adanya viii chorion. Viii ini akan menghubungkan komunikasi antara fetus dan induk (Toelihere 1979). Karunkulae tidak ditemukan pada uterus kuda dan babi (Toelihere 1979). Hal ini karena tipe implantasi pada kuda dan babi adalah
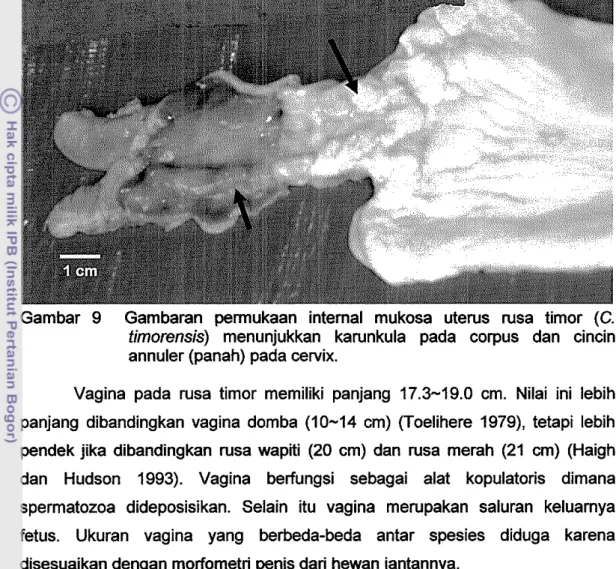
difuse, sedangkan implantasi pada ruminansia umumnya bertipe cotyledonary (T oelihere 1979). Viii chorion pada kuda dan babi tersebar di seluruh permukaan plasenta. Ukuran panjang cervix rusa timor ini lebih pendek dibanding cervix pada rusa wapiti (10-15 cm) dan rusa merah (5-7 cm) (Haigh dan Hudson 1993), serta sa pi (8-10 em) dan domba (4-10 em) (Toelihere 1979). Ukuran diameter cervix akan lebih kecil pada betina yang belum pernah bunting (Haigh dan Hudson 1993). Mukosa cervix pad a rusa timor mempunyai 4-5 cincin annuler (Gambar 9). Hal ini kurang lebih sam a dengan yang dilaporkan pad a rusa wapiti, 4-6 cincin (Haigh dan Hudson 1993). Sapi mempunyai 4 cincin (Hafez dan Hafez 2000). Cincin ini terdiri atas lapisan otot licin yang be~alan sirkuler, berfungsi untuk membantu menutup uterus dari kontaminasi mikroba (Anonim 2005). Selain itu sebagai tempat transportasi spermatozoa masuk menuju uterus dan tempat seleksi spermatozoa yang masuk. Bentuk cervix yang berlekuk dapat berfungsi sebagai penyimpan spermatozoa. Lumen yang dibentuk oleh cincin ini akan membuka selama estrus sehingga spermatozoa dapat masuk ke uterus.
23
Cervix pada babi berbentuk corong sedangkan pada kuda berupa lipatan berrnukus. Bentuk cervix ini disesuaikan dengan bentuk glans penis pada hewan jantannya (Anonim 2005).
Gambar 9 Gambaran perrnukaan internal mukosa uterus rusa timor (C. timorensis) menunjukkan karunkula pada eorpus dan einein annuler (panah) pada cervix.
Vagina pada rusa timor memiliki panjang 17.3-19.0 em. Nilai ini lebih panjang dibandingkan vagina domba (10-14 em) (Toelihere 1979), tetapi lebih pendek jika dibandingkan rusa wapiti (20 em) dan rusa merah (21 em) (Haigh dan Hudson 1993). Vagina berfungsi sebagai alat kopulatoris dimana spermatozoa dideposisikan. Selain itu vagina merupakan saluran keluarnya fetus. Ukuran vagina yang berbeda-beda antar spesies diduga karena disesuaikan dengan morfometri penis dari hewan jantannya.
Struktur Makroskopis Ovariurn
Ovarium rusa timor berbentuk ovoid (Gam bar 10) dan terletak di dekat tepi pelvis dan memiliki ukuran panjang 0.37-0.54 em, lebar 0.33-0.46 em, tebal
0.17-0.33 em serta berat 0.40-1.28 9 (Tabel 3). Ovarium yang berbentuk ovoid seperti bentuk ovarium pada domba atau kambing (Azis 1994, Kusnandar 2001).
Hafez dan Hafez (2000) menyatakan bahwa ovarium sapi dan kambing mempunyai bentuk oval seperti buah almond. Sedangkan ovarium babi seperti buah anggur dengan ukuran lebih besar dari ovarium domba. Ovarium kuda mempunyai bentuk seperti ginjal dan 2-3 kali lebih besar daripada ovarium sapi. Ovarium rusa timor memiliki panjang 0.37-0.54
0.17-0.33 em dan berat 0.40-1.28 g. Ukuran ovarium rusa timor ini lebih keeil jika dibandingkan dengan ovarium rusa wapiti saat estrus pada musim tidak kawin (1.5xO.8xO.5 em) dan dengan ovarium kambing dan domba. Toelihere (1979) mengatakan bahwa bentuk dan ukuran ovarium bisa berbeda berdasarkan spesies dan siklus berahinya. Ovarium sapi mempunyai ukuran 3.5x2.5x1.5 em (Anonim 2005). Sedangkan ukuran ovarium pada domba dan kambing relatif lebih besar dibanding ovarium rusa (Tabel 3). Menurut Arthur
et
al. (1996), ovarium domba pada saat anoestrus berukuran 1.3 x1.1 x 0.8 em.Gambar 10 Ovarium rusa timor (C. timorensis) memperlihatkan bentuk ovoid dari ovarium. Bar: 3 mm.
Pada penelitian ini ditemukan bahwa ovarium kiri rusa timor 1 relatif lebih berat dibanding berat ovarium kanan. Sedangkan pada rusa 2, ovarium kanan relatif lebih berat. Hal ini menunjukkan bahwa ovarium kanan dan ovarium kiri pada rusa timor mempunyai potensi yang sama dalam menghasilkan ovum dan berovulasi, tidak mempunyai kecenderungan sebagai ovulator kanan atau ovulator kiri. Hal ini juga terjadi pada domba, ovarium kanan (0.72±0.39 g) tidak menunjukkan perbedaan yang signifikan dengan ovarium kiri (0.70±0.35 g) (Mardhiana 2001). Aktivitas ovarium kanan dan ovarium kiri dapat berbeda pada setiap individu. Ovarium yang fungsional memiliki babot yang lebih berat dan lebih besar. Hal ini juga ditandai dengan suplai darah ke ovarium fungsional lebih aktif (Nalbandov 1990). Menurut Hafez (1993) perbedaan berat ovarium juga dapat disebabkan oleh perbedaan umur, bangsa, paritas (berapa kali melahirkan), pakan, dan siklus reproduksinya. Pada hewan betina yang sering beranak, ukuran ovariumnya dapat lebih besar dua kali lipat dari hewan betina muda. Rusa yang digunakan untuk penelitian ini dilaporkan pernah melahirkan satu kali.
25
Tabel 3 Bebera~a ukuran ovarium rusa timor dibanding ruminansia lain
Parameter Posisi Rusa 1 Rusa 2 Domba Kambing Wapiti (Haigh & (Azis 1994) Hudson 1993) Berat (g) Kanan 0.40 1.28 0.70 1.20
Kiri 0.60 0.80 0.74 1.49
Panjang (em) Kanan Kiri 0.40 0.37 1.40 1.49 1.50 0.44 0.54 1.57 1.65
Lebar (em) Kanan 0.34 0.33 1.05 0.90 0.80 Kiri 0.38 0.46 1.10 1.12
Tebal (em) Kiri Kanan 0.26 0.17 0.97 0.69 0.50 0.30 0.33 0.77 0.85
Bentuk Ovoid Ovoid Oval Oval Oval
Ukuran panjang, lebar, tebal ovarium yang diperoleh pada kedua rusa, memperlihatkan bahwa ovarium kiri cenderung lebih besar. Hal ini sarna dengan yang ditemukan pada ovarium kambing yang mempunyai ovarium kiri cenderung lebih besar walaupun ukuran ovarium kanan dan kiri tidak berbeda nyata (Azis 1994). Dari kedua rusa yang digunakan untuk penelitian ini, ukuran ovarium rusa 2 relatif lebih besar dibanding dengan ovarium rusa 1. Hal ini karena rusa 2 berada pada fase luteal. Pada fase luteal terbentuk corpus luteum yang dapat menyebabkan bertambahnya ukuran dan berat ovarium. Perbedaan ukuran ini juga diamati pada kambing (Kusnandar 2001), walaupun perbedaan ukuran ovarium pada kedua fase tersebut tidak menunjukkan perbedaan yang nyata. Perbedaan ini juga ditemukan pada ovarium sapi. Ovarium sebelah kiri (2.57x1.91x1.61 cm) lebih besar dibanding ovarium kanan (2.51x1.84x1.53 cm) (Tian dan Zhao 2000).
Struktur Mikroskopis Ovarium
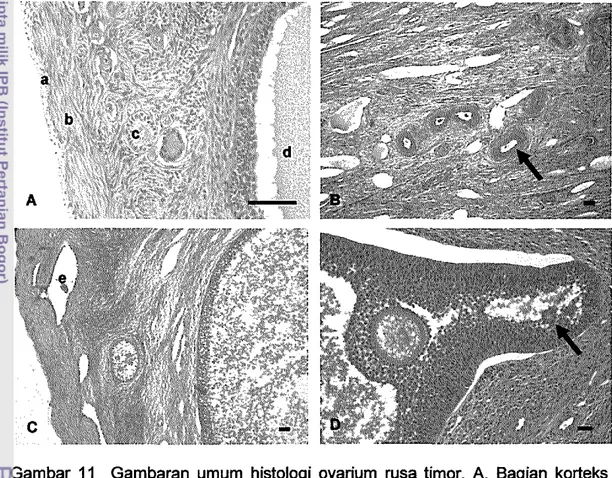
Secara mikroskopis, perrnukaan ovarium dilapisi oleh epitel selapis (epitel genminal) yang berbentuk kubus rendah. Tepat di bawah (ke arah dalam) epitel genminal ini terdapat stroma yang membentuk tunika albuginea, lapisan jaringan ikat padat tidak teratur. Ovarium dapat dibagi atas dua bag ian yaitu bag ian korteks dan bag ian medula. Berbagai tipe folikel tersebar di bag ian korteks dan berkembang ke arah medula (Gambar 11A). Pada bagian medula ditemukan adanya pembuluh darah (Gam bar 118), otot polos dan sel hilus. Pada foUkel ovarium rusa timor ditemukan adanya rete ovarii (Gam bar 11 C) dan call exner
body (Gambar 11 D).
Secara umum, gambaran histologis ovarium rusa timor mirip dengan ovarium ruminansia lain (domba, kambing dan sapi). Pada ovarium rusa timor ditemukan adanya rete ovarii. Tian dan Zhao (2000) juga menemukan rete ovarii
pada ovarium sapi. Rete ovarii diperlukan pada awal pembentukan sel folikuler. Hal ini dibuktikan pada penelitian transplantasi. Folikel pada ovarium transplantasi yang mengandung rete ovarii akan berkembang, sedangkan yang tidak mengandung rete ovarii akan gagal membentuk folikel (Byskov 1977, diacu dalam Jones 1977). Manurut Jones (1977), rete ovarii ini dapat menginisiasi awal pembelahan meiosis. Namun rete ovarii tidak berperan dalam pembentukan folikel pada kelinci dan marmut (Oeanesly 1975, diacu dalam Jones 1975). Selain rete ovarii, perkembangan folikel juga ditentukan oleh adanya sel folikuler atau sel granulosa.
Gambar 11 Gambaran umum histologi ovarium rusa timor. A. Bagian korteks dengan (a) sel germinal, (b) tunika albugenia, (c) folikel preantral, dan (d) folikel antral; B. Pada bag ian medula tampak adanya pembuluh darah (panah); (e) rete ovarii; O. call exner body (panah). Pewamaan HE. Bar 20 Ilm.
Oi dalam folikel ovarium rusa timor ditemukan adanya call exner body yang disekresi oleh sel granulosa, dan dikatakan mengandung asam hialuronat dan proteoglikan (Ross et al. 1995). Asam hialuronat merupakan mukopolisakarida asam yang terdiri atas komponen O-Glukoronat dan N-Asetil-O-Glukosamin (Lehninger 1998). Selain itu juga berperan dalam memfasilitasi migrasi sel. Proteoglikan dapat beke~a sebagai reseptor dan berpartisipasi
27
dalam pertumbuhan sel serta komunikasi antar sel (Murray et al. 1997). Call
exner body diduga sebagai prekursor liquor folikuli.
Morfologi Folikel Pada Berbagai Tahap Perkembangan
Pada ovarium rusa timor ditemukan folikel dari berbagai tahap perkembangan (folikulogenesis). Masing-masing tipe folikel mempunyai struktur dan ukuran yang berbeda-beda (Tabel 4). Berdasarkan karakteristik pada struktur morfologi dan ukurannya, folikel yang ditemukan pad a ovarium rusa timor ini dapat dibedakan menjadi 8 tipe dan dua jenis corpus yaitu corpus luteum dan corpus albikans.
Hafez dan Hafez (2000) mengatakan bahwa perkembangan dan maturasi folikel terjadi dengan adanya perubahan bentuk secara subseluler pada beberapa komponen folikel seperti differensiasi oosit, proliferasi dan differensiasi sel granulosa dan sel teka. Perubahan ini dipengaruhi oleh faktor intraovari, faktor intrafolikel ataupun faktor hormonal. Perubahan molekuler juga te~adi pada proses pperkembangan folikel, seperti pembentukan zona pelusida, reseptor FSH dan LH, pembentukan hormon (Ross et al. 1995). Faktor hormonal (antara lain androgen dan estrogen) akan menginduksi proliferasi dan diferensiasi sel-sel teka dan sel-sel granulosa serta meningkatkan kemampuan folikel dalam memproduksi estradiol dan merespon gonadotropin. Menurut pendapat lain (Anonim 2005), maturasi folikel terbagi atas beberapa tahap folikel yaitu folikel primer, sekunder, tersier (antral) dan folikel de Graaf.
Selama perkembangan dalam satu siklus estrus, ada dua tahap proses te~adinya diferensiasi ovum yaitu proses mitosis dan meiosis. Pada saat prenatal oogonium mengalami proliferasi secara mitosis (multiplikasi) dari sel germinal. Kemudian oogonia mengalami pembelahan meiosis I menjadi oosit primer sampai tahap diploten profase. Perkembangan ini terhenti sampai individu masuk masa pubertas. Setelah pubertas folikel akan berkembang lebih lanjut dan oosit primer akan berkembang menjadi oosit sekunder melalui pembelahan meiosis II (Banks 1986).
Beberapa faktor yang dipersiapkan untuk pertumbuhan oosit dan folikel antara lain adalah FSH, Epidermal Growth factor, IGF-I, dan ion kalsium. Pertumbuhan oosit dikendalikan oleh adanya OMI yang disekresi oleh sel granulosa (konsentrasi lebih tinggi pada foliel keeil dibanding folikel tersier) (Carlson 1999).
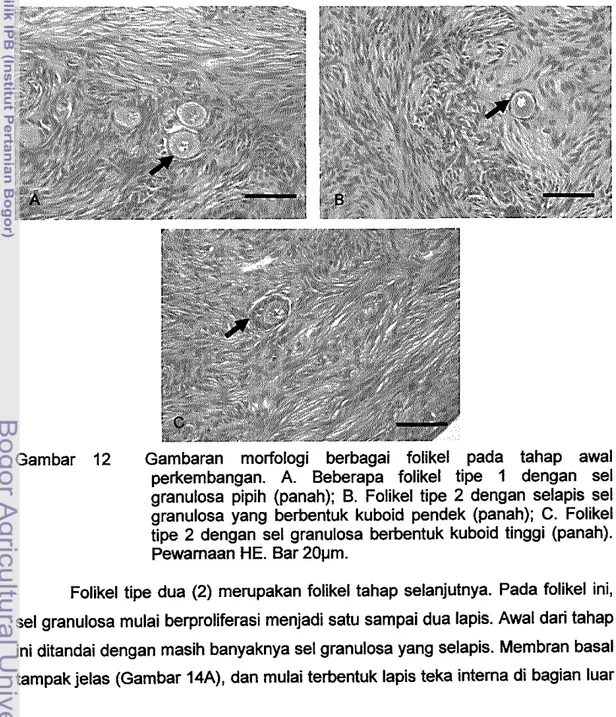
Perkembangan oosit akan diikuti dengan pembentukan zona pelusida. Diameter folikel dan diameter oositnya mengalami peningkatan. Gambaran yang ditemukan menunjukkan karakteristik folikel yang berada pada tahap awal perkembangan (Gambar 12). Menurut Rajput dan Sahrma (1996), diameter folikel primer pada domba adalah 40,.,30 11m dengan diameter oosit 25,.,35 11m sedangkan pad a kerbau diameter folikelnya adalah 35"-'48 11m dengan diameter oosit 21,.,28 11m.
Pada folikel tipe satu (1), sel granulosa berbentuk kuboid pendek (Gambar 128). Oosit besar dan berada di tengah folikel. Folikel ini merupakan fOlikel tipe dua (2). Sel granulosa selapis kemudian akan berubah menjadi kuboid tinggi. Oosit akan berkembang diikuti dengan pembentukan zona pelusida. Zona pelusida mulai terbentuk antara sel granulosa dan oosit. Membran basal tampak membatasi sel-sel granulosa dengan stroma disekitamya (Gambar 12C). Folikel tipe ini mempunyai diameter dengan kisaran antara 0.035-0.062 mm. Menurut Hyttel et al. (1996), bertambah besamya diameter berhubungan dengan differensiasi oosit. Selama perkembangan oosit, di ooplasm a terbentuk kompleks golgi, retikulum endoplasm a, lipid droplet dan membran vesikel. Aktivitas transkripsi dilakukan selama perkembangan oosit untuk sintesis protein yang digunakan untuk proses pembelahan meiosis oosit atau untuk dikeluarkan dari sel.
Secara ultrastruktur perubahan-perubahan pada folikel akan terjadi selama perkembangan folikel. Pada folikel primordial akan terbentuk coated pits dan vesikel. Pada folikel primer ditemukan beberapa mikrovili dan mitokondria.
Gap junction terbentuk pada folikel sekunder. Mikrovili menjadi kuat, jumlah
coated pits berkurang dan ditemukan adanya sekelompok cortical granule. Pada folikel tersier awal akan terbentuk atrum folikuli, jumlah cortical granule meningkat, mikrovili akan tertanam dalam zona pelusida. Kemudian jumlah lipid
droplet akan meningkat. Pad a folikel tersier akhir, jumlah lipid droplet dan vesikel
semakin meningkat dan organel-organel sel berada di daerah peripheral. Pada oosit, cortical granule akan berperan untuk menghambat polispenna, dan lipid
Tabel4 Jumlah dan diameter folikel (mm) serta diameter oosit (mm) pad a rusa timor, C. timorensis
Lapisan Jumlah folikel Diameter folikel Diameter oosit
Sel Antrum Zona
Folikel sel Posisi oosit
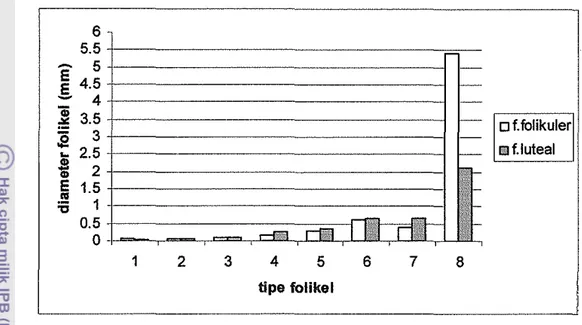
teka folikuli pelusida F. folikuler F. luteal F. folikuler F. luteal F. folikuler F. luteal granulosa Tipe 1 1 konsentrik 31 8 0.051 0.045 0.032 0.022 Tipe 2 1-2 + + konsentrik 15 8 0.076 0.071 0.044 0.035 Tipe 3 2-3 + konsentrik 3 4 0.095 0.109 0.048 0.038 Tipe 4 3-4 ++ ++ konsentrik 2 5 0.168 0.276 0.063 0.086 Tipe 5 4-5 ++ ++ +++ konsentrik 6 0.299 0.368 0.089 0.089 Tipe 6 5-6 +++ +++ +++ konsentrik 4 0.616 0.661 0.117 0.104 Tipe 7 >6 +++ +++ +++ eksentrik 1 0.402 0.560 0.114 0.101 Tipe 8 >6 +++ +++ +++ eksentrik 5.400 2.107 0.160 0.098 Keterangan : n - 20 sayatan
Braw-Tal dan Yossefi (1997) menyatakan bahwa awal perkembangan folikel dapat dibedakan menjadi dua tahap, yaitu tahap perubahan sel granulosa dari pipih menjadi kuboid pendek dan tahap kedua adalah meningkatnya jumlah sel granulosa yang diikuti dengan peningkatan ukuran oosit. Perubahan dari folikel primordial menjadi folikel yang berkembang lebih lanjut memiliki tiga ciri yaitu adanya perubahan bentuk sel granulosa dari pipih menjadi kuboid, adanya proliferasi sel granulosa dan oosit bertambah besar (Hirshfield 1991, diacu dalam Braw-Tal dan Yossefi 1997). Menurut Senger (1999), sel granulosa pada folikel primer mulai mengekspresi reseptor FSH dengan dibentuknya aktivin. Perkembangan folikel ini meliputi tiga macam maturasi (pematangan) yaitu maturasi oosit, maturasi inti dan maturasi sitoplasma.
Gambar 12 Gambaran morfologi berbagai folikel pada tahap awal perkembangan. A. Beberapa folikel tipe 1 dengan sel granulosa pipih (panah); B. Folikel tipe 2 dengan selapis sel granulosa yang berbentuk kuboid pendek (panah); C. Folikel tipe 2 dengan sel granulosa berbentuk kuboid tinggi (panah). Pewamaan HE. Bar 201Jm.
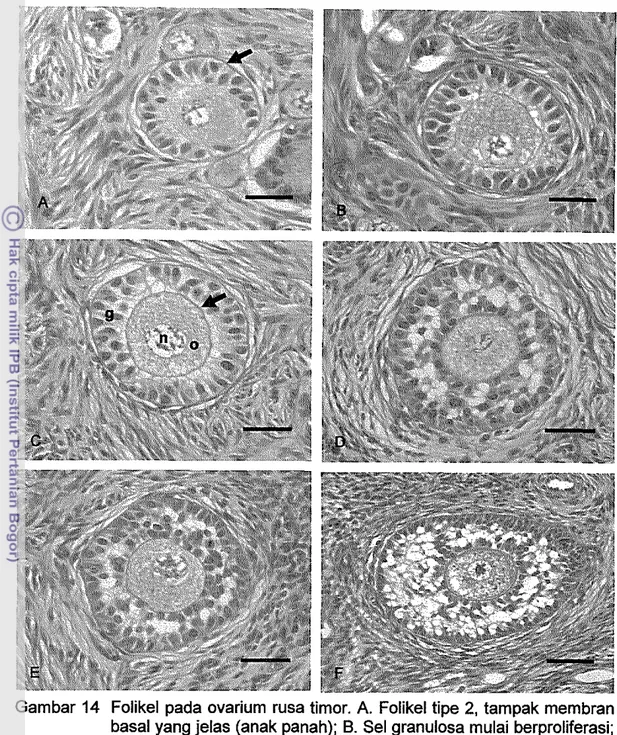
Folikel tipe dua (2) merupakan folikel tahap selanjutnya. Pada folikel ini, sel granulosa mulai berproliferasi menjadi satu sampai dua lapis. Awal dari tahap ini ditandai dengan masih banyaknya sel granulosa yang selapis. Membran basal tampak jelas (Gambar 14A), dan mulai terbentuk lapis teka intema di bagian luar
31
membran basal (Gambar 14B). oosit berada di tengah folikel dan dikelilingi oleh sel-sel granulosa. Folikel tipe ini memiliki diameter antara 0.037-0.1 mm. Zona pelusida tampak relatif sempuma mengelilingi oosit (Gambar 14C). Pada mencit dan manusia, zona pelusida terbentuk sempurna mengelilingi oosit pada tahap folikel primer (Himelstein-Braw et al. 1976; Oakberg 1979 diacu dalam Braw-Tal dan Yossefi 1997). Pada ovarium sapi terbentuknya zona pelusida secara sempurna terjadi pada folikel preantral tahap akhir (Braw-Tal dan Yossefi 1997). Zona pelusida pada rusa timor tampak terbentuk secara sempurna lebih awal dari sapi, yaitu pada folikel preantral dengan dua lapis sel granulosa. Zona pelusida adalah selubung ekstraseluler tebal yang mengelilingi oosit mamalia. Zona pelusida mengandung reseptor spermatozoa yang merupakan perantara interaksi spermatozoa-oosit, yang mengawali fertilisasi, menginduksi reaksi akrosom dan berperan dalam hambatan (zona block) terhadap polisperma (Ross et al. 1995)
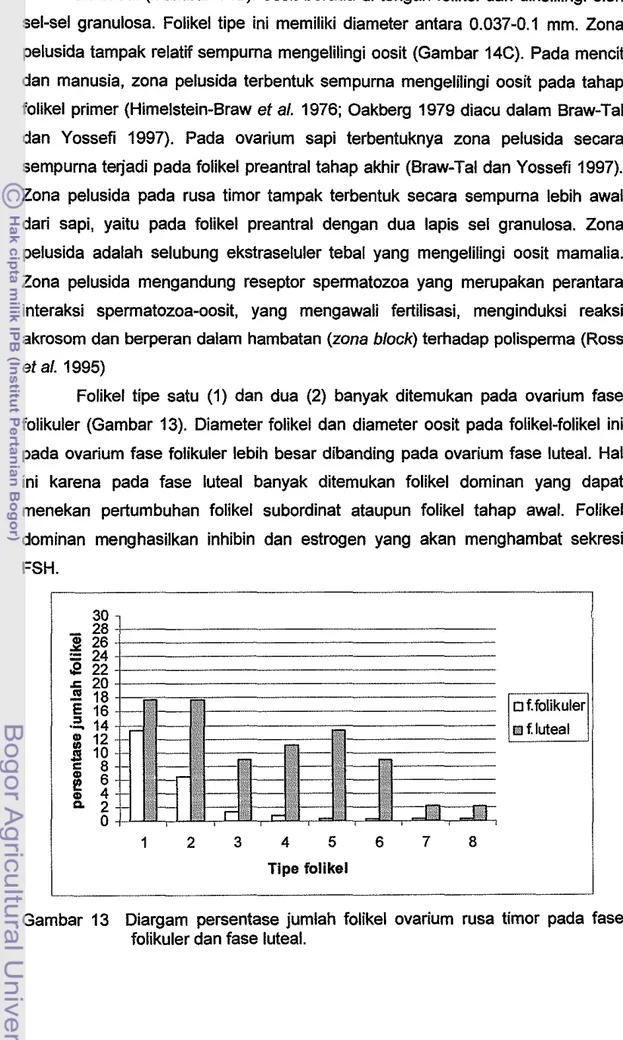
Folikel tipe satu (1) dan dua (2) banyak ditemukan pada ovarium fase folikuler (Gambar 13). Diameter folikel dan diameter oosit pada folikel-folikel ini pada ovarium fase folikuler lebih besar dibanding pada ovarium fase luteal. Hal ini karena pada fase luteal banyak ditemukan folikel dominan yang dapat menekan pertumbuhan folikel subordinat ataupun folikel tahap awal. Folikel dominan menghasilkan inhibin dan estrogen yang akan menghambat sekresi FSH. 30 28
~ ~~
.e
22 .c 20 !! 18 E 16.a
14 ., 12 .. 10~
8 i!! 6.. 4
... 2o
--=
1.
- II - I -- I---- -- - . '-~
'--2 3 -- -- - r--: - - ~r--t;::;::
.c--- t -'-r= 4 5 6 Tipe follkelJ.,
7...
~ 8 of. folikuler !II f lutealGambar 13 Diargam persentase jumlah folikel ovarium rusa timor pada fase folikuler dan fase luteal.
Pada folikel tipe tiga (3), sel-sel granulosa berproliferasi menjadi lebih banyak. Pada tahap ini, zona pelusida tampak menebal mengelilingi oosit (Gambar 14D). Sel granulosa yang terletak setelah lapisan pertama berbentuk kuboid sedangkan pada lapisan pertama sel ini berbentuk kuboid tinggi. Diameter folikel tipe ini berkisar antara 0.067-0.27 mm. Folikel tipe tiga (3) lebih banyak ditemukan pada ovarium fase luteal dibanding pada ovarium fase folikuler (Gam bar 14). Diameter folikelnyapun relatif lebih besar pada ovarium fase luteal, sedangkan diameter oositnya lebih besar pada fase folikuler.
Folikel pada tahap perkembangan selanjutnya dikategorikan sebagai folikel tipe empat (4). Pada folikel ini jumlah sel-sel teka bertambah banyak, lapis sel granulosa bertambah menjadi tiga sampai empat lapisan dan ditandai dengan penebalan zona pel us ida (Gambar 14E), oosit masih konsentrik. Perbandingan antara diameter folikel dan diameter oosit semakin besar. Sel granulosa telah banyak yang menempel pada zona pelusida, yang nantinya akan membentuk corona radiata. Di antara sel-sel granulosa tampak adanya ruangan yang berisi matriks (Gambar 14F). Sel-sel teka ekstema telah terbentuk. Folikel ini memiliki diameter antara 0.084-0.42 mm. Pembuluh darah akan terbentuk setelah terbentuknya teka ekstema pada folikel tipe (4). Darah bersirkulasi di sekitar folikel, membawa nutrisi dan gonadotropin ke folike!. Dengan pengaruh LH, sel teka intema akan memproduksi androstenidion dan testosteron. Dengan pengaruh FSH, testosteron ini akan diubah menjadi estrogen oleh membran sel granulosa. Estrogen ini akan terkumpul dalam antrum folikuli dan akan menginduksi proliferasi sel granulosa dan pertumbuhan folikel (Banks 1986).
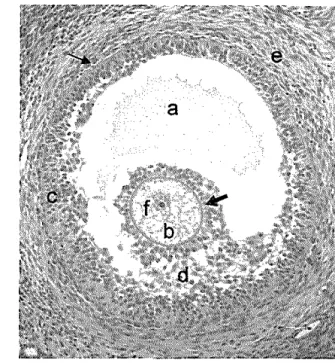
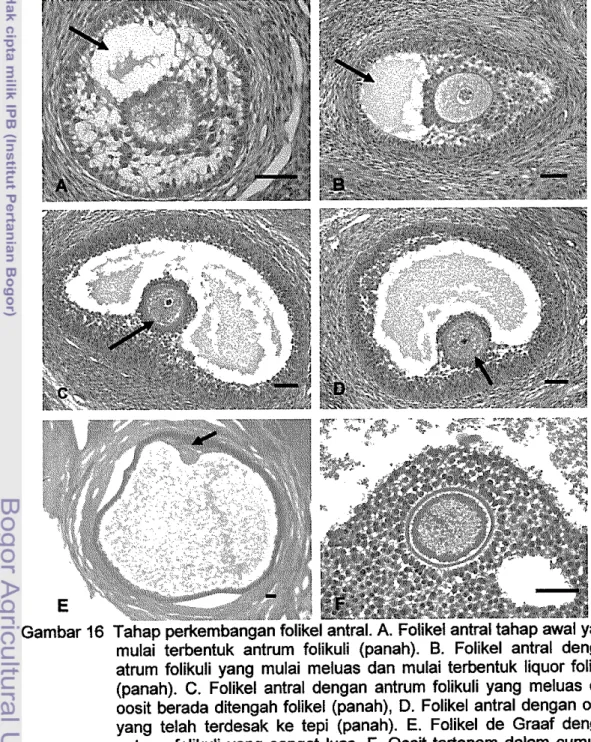
Pad a penelitian ini, folikel tipe lima (5) termasuk kategori folikel antral (Gam bar 15), karena telah tampak adanya pembentukan antrum yang berisi liquor folikuli (Gam bar 16A). Liquor folikuli ini mengandung hormon steroid dan glikosaminoglikan tertentu (Anonim 2004). Oosit masih berada di tengah folikel dan dikelilingi zona pelusida yang semakin teba!. Folikel ini memiliki empat sampai enam lapis sel granulosa dengan diameter folikel berkisar antara 0.25 sampai 0.66 mm. Pada folikel ini, oosit telah dikelilingi secara sempuma oleh corona radiata yang berupa selapis sel kolumnar. Lapisan sel ini berperanan dalam penyediaan makanan untuk oosit dan mengatur pematangan oosit. Corona radiata akan tetap
intact
sampai saat pertemuan oosit dengan spermatozoa.33
Gambar 14 Folikel pada ovarium rusa timor. A. Folikel tipe 2, tampak membran basal yang jelas (anak panah); B. Sel granulosa mulai berproliferasi; C. Folikel tipe 2 (0) oosit, (n) nukleolus, (g) sel granulosa, zona pelusida telah sempurna (anak panah); O. Folikel tipe 3; E. Folikel tipe 4; F. Folikel tipe 4 tahap akhir. Oi antara sel granulosa tampak ada ruangan yang berisi matriks (Pewarnaan HE. Bar 20 IJm).
Folikel tipe enam (6) merupakan perkembangan folikel tahap selanjutnya. Perubahan yang tampak pada folikel ini meliputi perubahan ukuran folikel, penambahan jumlah sel-sel granulosa, perkembangan lapisan teka, posisi oosit yang dikelilingi oleh sel-sel cumulus oophorus dan adanya perluasan antrum. Folikel tahap ini memiliki antrum folikuli yang mulai meluas ke arah tengah (Gam bar 16B). Oi dalam antrum terlihat adanya liquor folikuli yang semakin
banyak. Oosit masih berada ditengah dengan zona pelusida yang semakin tebal. Zona pelusida dan sel teka eksterna tampak sangat jelas. Sel-sel granulosa mengumpul ke bag ian tepi. Folikel tipe empat (4), lima (5) dan enam (6) lebih banyak ditemukan pada ovarium fase luteal dibandingkan pada ovarium fase folikuler. Diameter folikel relatif lebih besar pada ovarium fase luteal, namun diameter oositnya lebih besar pada fase folikuler.
Gambar 15 Folikel antral dan bagian-bagiannya. a. Antrum folikuli yang berisi liquor folikuli, b. Oosit, c. Sel granulosa, d. Cumulus oophorus, e. Sel-sel teka, f. Nukleus, membran basal (panah tipis), zona pelusida (panah tebal). Pewarnaan HE. Bar 20 IJm.
Pada folikel tipe tujuh (7), tampak oosit telah mulai menuju perifer karena terdesak oleh perluasan antrum (Gam bar 16C). Pada tahap lebih lanjut oosit mulai tertanam di bag ian tepi folikel dengan cumulus oophorus (Gam bar 160). Diameter dari folikel tipe ini berkisar antara 0.40 sampai 1.3 mm.
Folikel tahap selanjutnya adalah folikel tipe delapan (8) yang memiliki ciri folikel de Graaf. Setelah oosit tertanam pada cumulus oophorus, maka antrum terus membesar karena bertambahnya liquor folikuli. Liquor folikuli akan terus bertambah sampai folikel mencapai kondisi optimum untuk diovulasikan. Pada folikel de Graaf, diameter folikel dapat mencapai 5.4 mm dengan diameter oosit 0.16 mm. Antrum folikuli akan mendominasi bag ian dalam folikel. Perbandingan diameter folikel dan diameter oosit sangat besar (Gambar 16E). Folikel pada tahap ini, oositnya dikelilingi oleh corona radiata (Gam bar 16F). Pada kedua
35
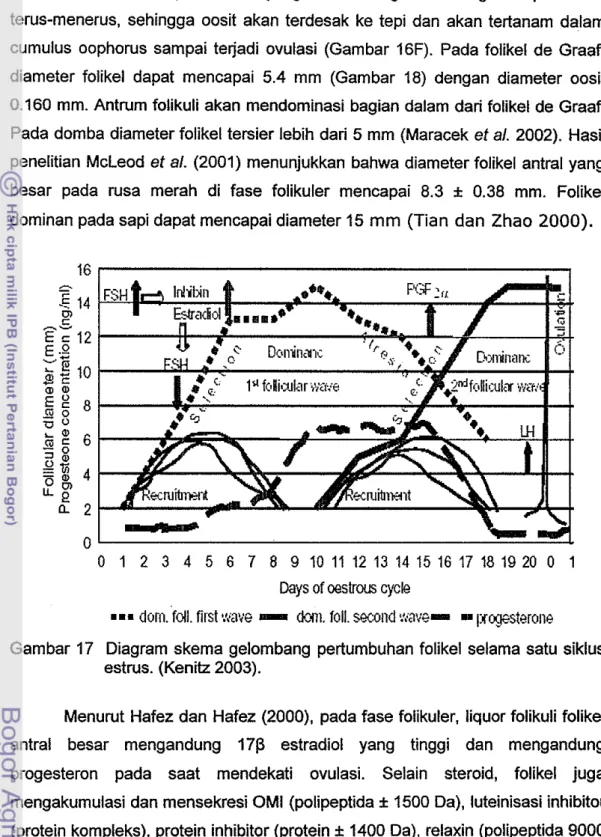
ovarium, fase folikuler maupun fase luteal, ditemukan adanya folikel tersier. Namun folikel tersier pada ovarium fase folikuler memiliki diameter folikel (5.4 mm) dan diameter oosit (0.160 mm) yang jauh lebih besar dibanding pada ovarium fase luteal (Gambar 18). Hal ini diduga rusa timor memiliki gelombang folikel dalam siklus estrusnya. Kenitz (2003) menyatakan bahwa sapi memiliki 2, 3 atau 4 gelombang folikel selama satu siklus estrus. Menurut Adam (1999), diacu dalam Kenitz (2003), 95% siklus estrus sa pi terdiri dari dua atau tiga gelombang folikel (Gam bar 17).
Gambar 16 Tahap perkembangan folikel antral. A. Folikel antral tahap awal yang mulai terbentuk antrum folikuli (panah). B. Folikel antral dengan atrum folikuli yang mulai meluas dan mulai terbentuk liquor folikuli (panah). C. Folikel antral dengan antrum folikuli yang meluas dan oosit berada ditengah folikel (panah), D. Folikel antral dengan oosit yang telah terdesak ke tepi (panah). E. Folikel de Graaf dengan antrum folikuli yang sangat luas. F. Oosit tertanam dalam cumulus oophorus (panah). Pewarnaan HE. Bar 20 jJm.
Antrum foUkuli pada folikel yang berkembang akan mengalami perluasan terus-menerus, sehingga oosit akan terdesak ke tepi dan akan tertanam dalam cumulus oophorus sampai te~adi ovulasi (Gam bar 16F). Pada foUkel de Graaf, diameter foUkel dapat mencapai 5.4 mm (Gambar 18) dengan diameter oosit 0.160 mm. Antrum folikuli akan mendominasi bag ian dalam dari folikel de Graaf. Pada domba diameter foUkel tersier lebih dari 5 mm (Maracek at a/. 2002). Hasil penelitian McLeod at al. (2001) menunjukkan bahwa diameter foUkel antral yang besar pada rusa merah di fase folikuler mencapai 8.3 ± 0.38 mm. Folikel dominan pada sapi dapat mencapai diameter 15 mm (Tian dan Zhao 2000).
16r---~
o
L
~~~·~~r'~
______
~
__________________
~~~~~
o
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 0 1Days of oestrous cycle
••• dom. foil. first wave - dem. foil. second wave- .. progesterone
Gambar 17 Diagram skema gelombang pertumbuhan foUkel selama satu siklus estrus. (Kenitz 2003).
Menurut Hafez dan Hafez (2000), pada fase folikuler, liquor folikuli folikel antral besar mengandung 1713 estradiol yang tinggi dan mengandung progesteron pada saat mendekati ovulasi. Selain steroid, foUkel juga mengakumulasi dan mensekresi OMI (polipeptida ± 1500 Da), luteinisasi inhibitor (protein kompleks), protein inhibitor (protein ± 1400 Da), relaxin (poUpeptida 9000 Da) dan inhibin (menghambat aktivitas FSH). Folikel antral ditemukan pada semua fase (fase folikuler dan fase luteal). FoUkel ini berkembang dengan adanya pengaruh FSH dan LH. Selama LH surge, sel taka intema pada foUkel dominan memproduksi progesteron yang penting untuk ovulasi. Progesteron
37
menyebabkan inisiasi sintesis enzim kolagenase oleh sel teka interna. Enzim ini akan mempermudah degradasi sel-sel pada tunika albuginea pada sisi ovulasi.
6 5.5 ~ 5
~
4.5-
4
~
3.5 :: 3~
2.5-m
2 E 1.5 IV'S
1 0.5a
0 1 2 3--
dIl
L~
4 5 6 7 tipe folikel - I - I - I-- l- I- t- I-8 of. folikuler Ii!I f.lutealGambar 18 Diagram diameter folikel ovarium rusa timor pada fase folikuler dan fase luteal.
Menurut Senger (1999), dinamika folikel antral terdiri atas tiga tahap yaitu:
1. tahap recruitmen folikel, merupakan awal pertumbuhan folikel antral dan mulai memproduksi estrogen.
2. tahap seleksi folikel, seleksi folikel yang nantinya dapat berkembang menjadi folikel dominan.
3. tahap dominasi folikel, yang merupakan perkembangan akhir dari folikel yang terseleksi untuk menjadi folikel dominan yang siap diovulasikan. Folikel-folikel lain yang tidak terseleksi akan atresi.
Pada fase luteal banyak ditemukan folikel antral karena diduga semuanya dalam tahap seleksi. Folikel dominan pada sapi dapat menekan pertumbuhan (mendominasi) folikel-folikel yang lebih kecil, namun pada domba folikel dominan tetap tumbuh selama fase luteal namun dominasinya tidak sebesar pada sapi (Ravindra et al. 1994). Hasil penelitian ini juga menunjukkan bahwa pada fase luteal sedikit ditemukan folikel tahap awal (primer-sekunder). Hal ini diduga akibat pengaruh dari inhibin pada folikel dominan atau dapat juga akibat rendahnya kadar hormon yang menstimulasi pertumbuhan folikel pada hewan yang diteliti, walaupun hal ini perlu diteliti lebih lanjut. Selain menghasilkan inhibin, folikel dominan diduga akan mereduksi suplai darah ke beberapa folikel lain dan akan menekan konsentrasi FSH dalam darah sehingga akan menyebabkan folikel lain atresi. Hal ini karena folikel antral akan menghasilkan
estrogen yang memberikan feed back negatif terhadap sekresi FSH dan feed back negatif terhadap sekresi LH. Selain itu, folikel antral juga memproduksi inhibin yang dapat menghambat sekresi FSH sehingga perkembangan folikel kecil terhambat (Hafez dan Hafez 2000). Menurut Armstrong dan Webb (1997), folikel dominan juga menghasilkan FGIF yang menghambat proliferasi sel granulosa yang menstimulasi FSH dan menghambat aktivitas aromatase. Selain itu juga menghambat vaskularisasi folikel subordinat.
Seperti pada domba dan kambing, pada rusa timor perkembangan folikel juga te~adi pada ovarium fase luteal. Pada fase tersebut ditemukan berbagai tipe folikel yang berkembang dari tipe primordial sampai folikel antral. Hal ini mencerminkan adanya dinamika folikel pada semua fase estrus. Pada fase luteal ditemukan adanya folikel tersier, namun folikel ini tidak akan terovulasi selama corpus luteum belum regresi karena tidak te~adi LH surge. Hal ini karena sekresi LH yang penting untuk pertumbuhan folikel antral akan ditekan oleh adanya progesteron (Ravindra et al. 1994). Menurut Mc Leod et al. (2001),
perkembangan folikel antral pada red deer mirip dengan ruminansia monovulatori, dan minimal terdapat satu folikel besar pada fase folikuler dan fase luteal. Pada penelitian ini ditemukan bahwa diameter oosit pada ovarium fase folikuler relatif lebih besar dibanding pada ovarium fase luteal (Gam bar 19) di berbagai tahap perkembangan (tipe 1-9). Hal ini diduga karena perkembangan oosit pada fase folikuler dipengaruhi oleh FSH, sedangkan pada fase luteal sekresi FSH dihambat oleh adanya hormon progesteron.
....
0.18 0.16 0.14'8
0.12 ~ 0.1~
0.08 E !1! 0.06 " 0.04 0.02o
fit
It
1 2--
----
- - -- - -3 4 5 tipe folikel - ~ - ----
-- -6 7 -~ :... 8 o f.folikuler Eli! f.luteal39
Pada CL, sel granulosa dan lapisan teka interna mengalami perubahan morfologi menjadi sel luteal walaupun antrum masih tampak (Gambar 20A). Diameter folikel tipe ini adalah 0.5 mm. Corpus albikans merupakan corpus luteum yang telah mengalami regresi. Pada corpus tipe ini antrum secara keseluruhan telah menjadi jaringan ikat yang berwarna keputihan (Gam bar 20B). Diamater corpus albikans berkisar antara 0.1-0.9 mm. CL hanya ditemukan pada ovarium fase luteal dengan diameter 0.5 mm, sedangkan corpus albikans ditemukan di kedua fase ovarium.
Gambar 20 Gambaran corpus luteum dan corpus albikans pada ovarium rusa timor (A). Pada bag ian tengah corpus albikans tampak adanya jaringan ikat berwarna putih (B). Pewarnaan HE. Bar: 40llm.
Setelah te~adi ovulasi, maka folikel akan membentuk CL. Pada awalnya sel granulosa dan lapisan teka interna mengalami perubahan morfologi menjadi sel luteal. Ada dua tipe sel luteal yaitu sel lutein granulosa yang berada ditengah folikel yang merupakan derivat dari sel granulosa, dan sel lutein teka yang ukurannya lebih kecil dari sel lutein granulosa yang merupakan derivat dari lapisan sel teka interna. Sel-sel lutein ini akan memproduksi progesteron. Ketika CL mengalami regresi maka terbentuklah corpus albikans yang berwarna keputihan dan terdiri atas banyak jaringan ikat. Corpus haemoraghikum tidak ditemukan pada penelitian ini. Hal ini diduga dipengaruhi oleh waktu pengambilan sampel yang tidak tepat untuk terbentuknya corpus tersebut. Karena corpus haemoraghikum akan segera berubah menjadi CL kemudian menjadi corpus albikans jika tidak te~adi kebuntingan.
Berdasarkan karakteristik pada struktur morfologi dan ukurannya, folikel yang ditemukan pada ovarium rusa timor ini dapat dibedakan menjadi 8 tipe dan dua tipe corpus (Tabel 4). Masing-masing tipe diduga memiliki dan mewakili
tahap perkembangan yang berbeda-beda, meliputi tahap perkembangan awal (preantral) maupun tahap folikel antral.
Menurut Ross et al. (1995), ada tiga macam folikel berdasarkan tahap perkembangan, yaitu folikel primordial, folikel pertumbuhan dan folikel matang atau folikel de Graaf. Menurut Senger (1999), folikulogenesis dapat dibagi menjadi dua fase, yaitu fase preantral dan fase antral. Pada fase preantral perkembangan folikel bebas dari pengaruh gonadotropin, namun dikontrol oleh faktor pertumbuhan, sedangkan pada fase antral pertumbuhan folikel distimulasi oleh gonadotropin (FSH dan LH). Fase ini ditandai dengan meningkatnya ukuran folikel secara nyata. Peningkatan ukuran ini disebabkan oleh perluasan antrum folikuli dan proliferasi sel granulosa.
Serdasarkan perubahan morfologi pada pembagian fase folikulogenesis, Erickson (2003) menemukan 8 tipe perkembangan folikel pada folikulogenesis man usia. Fase preantral (tipe 1) terbagi menjadi tiga tahap utama yaitu tahap folikel primordial, folikel primer dan folikel sekunder. Fase antral terbagi menjadi empat tahap yaitu tahap folikel antral kecil ( tipe 2, 3, 4, 5), folikel antral sedang (tipe 6), folikel antral besar (tipe 7) dan folikel de Graaf (tipe 8). Pada penelitian ini, ditemukan delapan tipe folikel pada folikulogenesis rusa timor. Pada fase preantral ada lima tipe folikel yaitu tipe 1 (folikel primer), dan folikel sekunder (tipe 2, 3, 4). Fase antral (folikel tersier) terbagi menjadi empat tahap yaitu tahap folikel antral kecil ( tipe 5), folikel antral sedang (tipe 6), folikel antral besar (tipe 7) dan folikel de Graaf preovulatori (tipe 8).
Karakteristik Histokimia Folikel Ovarium
Pada penelitian ini pewamaan Alcian Slue (AS) pH 2.5 dimaksudkan untuk menunjukkan adanya substansi karbohidrat dari golongan karbohidrat asam, sedangkan pewamaan Periodic Acid Schiff (PAS) digunakan untuk menunjukkan adanya substansi karbohidrat dari golongan karbohidrat netra!. Hasil pewarnaan menunjukkan hasil yang bervariasi pada tiap-tiap bag ian folikel (TabeI5).
Hasil pewarnaan AS-PAS menunjukkan bahwa pada folikel ovarium rusa timor, pewarnaan PAS bereaksi positif kuat pada zona pelusida, sedangkan AS bereaksi positif kuat pada liquor folikuli. AS dan PAS menunjukkan reaksi positif sangat lemah sampai lemah pada matriks di sekitar sel granulosa dan sel-sel teka. Reaksi positif terhadap AS-PAS ini juga ditemukan pada ovarium tikus
41
(Tadano dan Yamada 1978) dan ovarium antral awal pada kerbau (Parillo et al.
1998).
Tabel5 Sebaran karbohidrat asam dan karbohidrat netral pada berbagai tipe folikel ovarium rusa timor, C. Timorensis
Jenis Karbohidrat Tipe folikel Distribusi
asam netral Zona pelusida
±
+ Tipe 1 Sel granulosa±
Zona pelusida±
++ Tipe2 Sel granulosa ++±
Zona pel us ida ++ ++
Tipe 3
Sel granulosa +++
±
Zona pelusida + ++
Tipe4
Sel granulosa +++
±
Zona pel us ida + ++
Tipe 5 Sel granulosa ++ +
Liquor folikuli +++ +
Zona pelusida + +++
Tipe6 Sel granulosa + +
Liquor folikuli +++ +
Zona pelusida + +++
Tipe7 Sel granulosa + +
Liquor folikuli ++ ++
Zona pelusida + +++
Tipe8 Sel granulosa + +
Liquor folikuli
±
++Corpus luteum Sellutein ++ ++
Corpus albikans Sellutein + +
Keterangan : -
=
negatif, ±=
5angat lemah, +=
lemah, ++=
5edang, +++=
kuatHasH pengamatan menunjukkan bahwa pada tahap perkembangan awal, AS tidak menunjukkan reaksi positif pada sel-sel granulosa namun tampak positif pad a matrik diantara sel-sel granulosa. AS menunjukkan reaksi positif dengan intensitas kuat pada matriks sel-sel granulosa folikel tipe (3) dan (4), kemudian mengalami penurunan intensitas reaksi sampai folikel tipe (8) (Gam bar 21) dan sedikit meningkat kembali pada tahap corpus luteum pada sel-sel lutein. Hal ini
memberikan dugaan keterlibatan atau peran yang lebih dari karbohidrat asam dalam perkembangan foUkel tahap preantral akhir jika dibandingkan dengan karbohidrat netrai.
Pada foUkel tipe satu (1), AB menunjukkan reaksi positif sangat lemah dan PAS menunjukkan reaksi positif lemah pada zona pelusida. Reaksi positif PAS yang sangat lemah juga terUhat pada sel granulosa. AB dan PAS positif pada semua bag ian foUkel tipe dua (2). AB positif dengan intensitas sangat lemah dan PAS positif dengan intensitas sedang pada zona pelusida. SebaUknya pada bagian matriks diantara sel granulosa, AB menunjukkan reaksi positif sedang (Gambar 23A), dan PAS bereaksi positif sangat lemah. Pada foUkel tipe tiga (3), AB menunjukkan peningkatan intensitas reaksi positif pada zona pelusida dan matriks diantara sel granulosa dibanding pada folikel tipe (2). Namun PAS menunjukkan reaksi positif dengan intensitas yang relatif sama. Reaksi positif lemah dari AB dan positif sedang dari PAS terlihat pada zona pelusida folikel tipe (4) (Gambar 23B). AB positif kuat sedangkan PAS positif sang at lemah pada matriks di antara sel granulosa folikel tipe ini (Gam bar 26A).
5.---.
4 +-E
~ 3 +-ImAS I
- - - IiIIPAS
~
2 + - - - ,~
.- 1o
tipe 1 tipe 2 tipe 3 tipe 4 tipe 5 tipe 6 tipe 7 tipe 8
Tipe follkel
Gambar 21 Diagram intensitas reaksi AB-PAS pad a sel-sel granulosa.
Pada folikel tipe (5), AB dan PAS menunjukkan reaksi positif pada semua bagian foUkel (zona pelusida, matriks di antara sel-sel granulosa dan liquor folikuli). Intensitas reaksi AB dan PAS pada bagian zona pelusida relatif sama dengan yang ditemukan pada foUkel tipe (6). Penurunan intensitas reaksi AB terlihat pada matriks diantara sel granulosa namun PAS sebaliknya menunjukkan peningkatan intensitas reaksi positifnya pada bagian-bagian ini (Gam bar 26B). AB bereaksi positif kuat dan PAS bereaksi positif lemah pada liquor folikuli.
43
Pada folikel tipe (6), AB dan PAS bereaksi positif lemah pada matriks. Pada zona pelusida, AB bereaksi positif lemah (Gambar 23C) sedangkan PAS bereaksi positif kuat. Sebaliknya pada bag ian liquor folikuli, AB menunjukkan reaksi positif kuat sedangkan PAS bereaksi lemah (Gambar 26C). Pada liquor folikuli, intensitas reaksi AB dan PAS ini masih relatif sama dengan yang terdapat pada liquor folikuli folikel tipe (5). Intensitas reaksi positif AS dan PAS pada zona pelusida folikel tipe (7) relatif sama dengan pada folikel tipe (6) (Gambar 230). Begitu juga dengan reaksi positif tersebut pada sel granulosa. Pada bag ian liquor folikuli folikel tipe (7), AS dan PAS menunjukkan reaksi positif sedang (Gambar 24).
Pada folikel tipe (8), intensitas reaksi AB dan PAS pada bag ian zona pelusida dan sel granulosa masih relatif sam a (Gam bar 22) dengan yang ditemukan pada bagian-bagian tersebut di folikel tipe (7) (Gambar 23E). Namun pada liquor folikuli, intensitas reaksi AB menurun, sedangkan PAS menunjukkan reaksi positif dengan intensitas sedang (Gambar 24).
Reaksi positif dari PAS pada sel-sel granulosa dari folikel tipe satu sampai delapan (1-8) menunjukkan intensitas yang meningkat seiring tahap perkembangan folikel (Gambar 21). Hal ini memberikan dugaan keberadaan karbohidrat dari kelompok karbohidrat netral pada sel-sel granulosa serta kemungkinan keterlibatannya dalam perkembangan sel-sel granulosa folikel rusa timor. Adanya PAS positif pada corpus luteum menandakan keberadaan karbohidrat netral. Sel-sel lutein menghasilkan hormon yang mengandung karbohidrat yang dibutuhkan selama fase luteal seperti progesteron dan relaxin (Banks 1986). 5~---~
4+---ImAS I
________ -Im
PAS
o
ti~1ti~2_3_4ti~5_6ti~7_8 tlpe folikelPewamaan AB dan PAS mulai tampak positif pada zona pelusida folikel tipe (1) walaupun zona pelusida belum terbentuk sempuma, dan seterusnya AB dan PAS secara konstan bereaksi positif pada zona pelusida (Gam bar 22). Intensitas reaksi tersebut relatif meningkat seiring tahap perkembangan folikel. Zona pelusida merupakan lapisan nonseluler berbentuk pita tipis mengelilingi sitoplasma oosit dan terbentuk dari glikosaminoglikan dan glikoprotein yang disekresikan oosit (Senger 1999).
Gambar 23 Distribusi reaksi positif AB yang menunjukkan substansi karbohidrat asam (wama biru) pada folikel ovarium rusa timor. Karbohidrat asam ini terdistribusi pada lapisan sel teka, matriks sel granulosa, liquor folikuli dan zona pelusida. A. Distribusi karbohidrat asam pada folikel preantral. Distribusi karbohidrat asam pada folikel preantral sebelum terbentuk antrum folikuli (B). C. Distribusi karbohidrat asam pada folikel antral. D. Distribusi karbohidrat asam pada folikel antral dengan oosit yang mulai tertanam dalam cumulus oophorus. E Distribusi karbohidrat asam pada folikel de Graaf. Pewamaan AB. Bar: 30lJm.
45
Komponen utama zona pelusida tikus adalah tiga glikoprotein yang biasa disebut ZP1, ZP2, dan ZP3 (Aviles et al. 1997). Zona pelusida ini akan menjadi
media interaksi antara sel-sel granulosa dan oosit. Dalam fertilisasi, ZP3 merupakan molekul spesies spesifik yang berikatan dengan spermatozoa. Selain itu ZP3 berperan untuk inisiasi reaksi akrosom pada spermatozoa yang terkapasitasi (Erickson 2003). Diduga keberadaan komponen-komponen karbohidrat di atas menyebabkan AS dan PAS bereaksi positif pada zona pelusida. Zona pel us ida pada kambing menunjukkan reaksi positif terhadap pewamaan AS dan PAS. Sedangkan oosit folikel de Graaf pada domba dan kerbau tidak bereaksi positifterhadap PAS (Rajput dan Sahrma 1996).
Pada folikel antral, reaksi positif kuat AS terti hat pada liquor folikuli folikel tipe (6), dan intensitas ini menurun sampai sangat lemah pada folikel de Graaf. Pewamaan PAS bereaksi positif sedang pada liquor folikuli sampai tahap perkembangan folikel de Graaf (Gambar 24). Hal ini mencerminkan dinamika perkembangan dan perbedaan kandungan karbohidrat dari kelompok karbohidrat asam dan kelompok karbohidrat netral pada liquor folikuli sesuai dengan tahap perkembangan folikel sampai dengan tahap folikel de Graaf. Ovarium tikus juga ditemukan adanya karbohidrat netral, karbohidrat asam dan residu manosil dan glukosil pada zona pelusida, liquor folikuli dan matriks antar sel granulosa (Tadano dan Yamada 1978).
5~---. 4·~--- co E
;
3+---B
0; 2 ~--- I:ImAB I
f - - - ImPAS
J!I I: - 1~---tipe 1 tipe 2 tipe 3 tipe 4 tipe 5 tipe 6 tipe 7 tipe 8 Tipe follkel
Gambar 24 Diagram intensitas reaksi AS-PAS pada liquor folikuli.
AS dan PAS menunjukkan reaksi positif dengan intensitas sedang pada sel lutein CL, dan reaksi positif dengan intensitas lemah pada lumen folikel
(Gam bar 25A). Pada corpus albikans tampak AB dan PAS bereaksi positif dengan intensitas sedang pada bagian tengah Oaringan ikat) (Gambar 25B).
Gambar 25 Distribusi karbohidrat asam (biru panah) pada corpus luteum dan corpus albikans. Pewarnaan AB. Bar: 40J.lm.
Reaksi positif pada CL dan corpus albikans menandakan adanya karbohidrat asam dan netral pada struktur ini. Karbohidrat ini diduga berperan dalam proses perkembangan corpus pada fase luteal.
Gambar 26 Distribusi karbohidrat netral pada folikel ovarium rusa timor. Reaksi positif (merah magenta, panah) pada zona pelusida dari folikel preantral (A), awal perkembangan folikel antral (B), folikel antral dengan oosit yang telah menepi (C) dan pad a sel lutein corpus luteum.(D). Pewarnaan PAS. Bar: 20 J.lm.
47
Hasil penelitian juga menunjukkan bahwa kandungan dan distribusi karbohidrat asam dan karbohidrat netral berbeda-beda tergantung pad a tahap perkembangan folikel. Misalnya pad a folikel tipe 6, AS dan PAS sama-sama bereaksi positif kuat, namun keduanya memiliki distribusi yang berbeda. AS positif kuat pada liquor folikuli sedangkan PAS positif kuat pada z.ona pelusida.
Pewarnaan AS-PAS ini digunakan untuk mendeteksi adanya karbohidrat asam atau karbohidrat netral. Untuk mengetahui jenis karbohidrat yang lebih spesifik maka dilakukan pewarnaan histokimia lektin. Metode histokimia lektin digunakan untuk menentukan jenis karbohidrat sesuai dengan residu gulanya. Lektin dapat secara spesifik mengikat residu gula dari glikokonjugat seperti glikoprotein. Hasil pewarnaan histokimia lektin memperlihatkan distribusi ikatan lektin dari hasil reaksi lektin PHA, LCA, RCA dan ConA yang bervariasi pada bagian-bagian folikel yang berbeda (TabeI6).
Reaksi positif lektin RCA juga te~adi pada semua bag ian folikel dengan intensitas sangat lemah sampai kuat (Gam bar 27A). Lektin RCA spesifik untuk karbohidrat dengan residu gula galaktosa. Pad a penelitian ini, galaktosa ditemukan di semua bag ian folikel dengan intensitas bervariasi. Hal ini menunjukkan keberadaan dan kemungkinan peran serta keterlibatan karbohidrat dengan residu gula galaktosa pada tahap perkembangan folikel baik pada fase preantral maupun pada fase antral. Pada zona pelusida folikel fase antral, RCA bereaksi lemah (Gambar 28A) sedangkan pada folikel preantral, reaksi menunjukkan positif sedang sampai. kuat. Pada sel-sel granulosa folikel fas~ antral, intensitas RCA mengalami penurunan menjadi sedang seiring dengan perkembangan folikel, sebaliknya pada liquor folikuli intensitas RCA tampak semakin kuat pada tahap akhir perkembangan folikel. Reaksi positif pada sel granulosa dan liquor folikuli ini juga dilaporkan pada kebanyakan mamalia seperti pada men cit, tikus, hamster, kelinci, kucing, anjing dan babi (Skutelsky
et
al.1994). Lektin RCA dilaporkan negatif pada zona pelusida anjing (Skutelsky
et
al.1994). Pada penelitian ini, RCA menunjukkan reaksi positif yang sangat lemah pada zona pelusida dari folikel tahap akhir. Pada ovarium kerbau, zona pelusida folikel antral awal banyak ditemukan residu galaktosa (Parillo
et
al. 1998).Penelitian Skutelsky
et
al. (1994) menunjukkan bahwa !3-Galaktosa,O-N-asetilgalaktosamin dan N-asetilglukosamin terdapat pada zona pel us ida rodensia.
Tabel6 Pola distnbusi ikatan lektin pada bagian-bagian folikel dan ovanum rusa timor, C. timorensis
Tipe folikel Lektin Bagian folikel
preantral antral
Teka eksterna ± +
Teka interna + +
Sel granulosa ± +++
PHA
Liquor folikuli belum terbentuk +++
Zona pelusida ++ Sitoplasma oosit ++ ++ Teka eksterna ++ + Teka interna ++ + Sel granulosa ++"'+++ ++ RCA
Liquor folikuli belum terbentuk +++
Zona pelusida ++-+++ ± Sitoplasma oosit +-+++ + Teka eksterna + ++ Teka interna + ++ Sel granulosa +++ +++ LCA
Liquor folikuli belum terbentuk +++
Zona pelusida ±
Sitoplasma oosit +
Teka eksterna ±
Teka interna ±
Con A Sel granulosa
Liquor folikuli belum terbentuk ±
Zona pelusida ±
Sitoplasma oosit ±
Keterangan : -= negatif, ± = sangat iemah, + = iemah, ++ = sedang, +++ - kuat
Lektin PHA menunjukkan adanya karbohidrat dengan residu gula O-N-asetilgalaktosamin. Pada folikel ovarium rusa timor reaksi positif bervariasi pada bag ian-bag ian folikel. Lektin PHA bereaksi positif dengan intensitas sangat lemah sampai lemah pada sel-sel teka folikel fase preantral (Gambar 278) maupun fase folikel antral. Pada sel-sel granulosa terlihat adanya peningkatan intensitas, dari intensitas sangat lemah menjadi kuat pada foUkel fase antral tahap akhir.
49
Intensitas kuat juga terjadi pada bag ian liquor folikuli. Hal ini menunjukkan kemungkinan keberadaan dan keterlibatan karbohidrat yang memiliki residu gula D-N-asetilgalaktosamin pada perkembangan sel-sel granulosa dan liquor folikuli, yang merupakan sekreta sel-sel granulosa, pada folikel fase antral. Reaksi positif sedang terlihat pada bagian zona pelusida dan sitoplasma oosit (Gambar 28B). Reaksi positif lektin PHA pada bag ian-bag ian folikel ovarium rusa timor menunjukkan adanya substansi karbohidrat dengan residu gula D-N-asetilgalaktosamin. Karbohidrat dengan residu gula D-N-asetilgalaktosamin ditemukan pada bag ian sitoplasma oosit rusa timor di semua tahap perkembangan. Karbohidrat dengan residu beta-N-asetilgalaktosamin banyak ditemukan di zona pelusida pada awal perkembangan folikel antral ovarium kerbau (Parillo
et at.
1998).Gambar 27 Distribusi ikatan lektin (warna coklat) pada folikel preantral. A. Lektin RCA bereaksi positif pada semua bagian folikel kecuali pada sel granulosa. B. Lektin PHA menunjukkan reaksi positif dengan intensitas sedang pada zona pelusida dan sitoplasma oosit, dan bereaksi lemah pada matriks sel granulosa dan sel-sel teka. C. Lektin LCA bereaksi positif pada semua bag ian folikel. DAB, Bar: 20
Lektin LCA yang menunjukkan karbohidrat dengan residu gula manosa terlihat bereaksi positif dengan intensitas lemah sampai sedang pada sel-sel teka, baik sel teka interna maupun sel teka eksterna (Gambar 27C). Reaksi positif kuat terjadi pada sel-sel granulosa dan pada liquor folikuli. Sedangkan pad a oosit, bag ian zona pelusida lektin LCA menunjukkan reaksi positif yang sangat lemah, dan pada sitoplasma terlihat reaksi negatif sampai positif lemah (Gambar 28C).
Karbohidrat manosa tidak terdapat pada oosit folikel antral (zona pelusida dan sitoplasma) seperti yang dilaporkan pada folikel kucing (Skutelsky et al. 1994). Namun pada folikel preantral, karbohidrat ini terdeteksi pada semua bag ian folikel (Gambar 27C). Dari intensitas reaksi positif LCA yang diamati, pada bag ian sel granulosa dan liquor folikuli banyak ditemukan karbohidrat dengan residu gula manosa ini. Hal ini mirip dengan yang telah dilaporkan pada mamalia yang lain (Skutelsky et al.1994). Begitu juga pada folikel kerbau tahap antral awal (Parillo et al. 1998).
ConA merupakan lektin yang digunakan untuk mengenal adanya karbohidrat dengan residu manosa dan glukosa pada jaringan. Hasil penelitian ini memperlihatkan tidak adanya karbohidrat dengan residu gula manosa pada beberapa bagian folikel ovarium rusa timor seperti pada sel-sel granulosa dan zona pelusida (Gambar 28D). Ketiadaan karbohidrat dengan residu gula manosa dan glukosa dilaporkan juga pada zona pelusida kucing, anjing dan babi (Skutelsky et al. 1994).
Pada sel lutein, lektin PHA, LCA dan RCA menunjukkan reaksi positif lemah, sedangkan lektin ConA bereaksi negatif. Reaksi positif terhadap lektin LCA, RCA dan PHA ini menunjukkan bahwa sel lutein mengandung karbohidrat dengan residu gula mannosa, galaktosa dan D-N-asetilgalaktosamin. Pada penelitian ini juga diketahui bahwa sel interstisial di sekitar folikel dalam ovarium mengandung karbohidrat dengan residu gula D-N-asetilgalaktosamin, galaktosa, manosa dan sedikit glukosa. Lektin PHA juga menunjukkan reaksi positif pada Call-Exner body, menunjukkan adanya karbohidrat dengan residu gula D-N-asetilgalaktosamin pada unsur tersebut.
Secara umum dari hasil pewarnaan histokimia lektin terlihat bahwa pada sel-sel teka baik sel teka intema dan sel teka eksterna mengandung substansi karbohidrat dengan residu gula D-N-asetilgalaktosamin, galaktosa dan manosa dengan intensitas sangat lemah sampai sedang. Karbohidrat ini terlihat pada
51
semua tahap perkembangan folikel. Hal ini menunjukkan kemungkinan bahwa GaINAc, galaktosa dan manosa berperan dalam perkembangan folikel pada ovarium rusa timor. Berdasarkan hasil pewarnaan histokimia AB-PAS dan histokimia lektin ini, maka dapat diketahui bahwa karbohidrat asam yang terkandung dalam folikel rusa timor adalah D-N-asetilgalaktosamin, sedangkan karbohidrat netral yang terdeteksi adalah manosa, galaktosa dan glukosa.
Gambar 28 Distribusi ikatan lektin pada folikel antral tahap akhir. A. Lektin RCA bereaksi positif sangat lemah pada zona pelusida (panah). B. Lektin PHA bereaksi positif dengan intensitas sedang di sitoplasma oosit (panah) dan matriks pada sel-sel granulosa. C. Lektin LCA bereaksi negatif pada zona pelusida (panah). D. Lektin ConA bereaksi positif sangat lemah pad a sitoplasma oosit (anak panah). DAB, Bar: 20 jJm.
Penelitian Skutelsky et al. (1994) melaporkan bahwa zona pelusida oosit dari spesies mamalia yang berbeda menunjukkan pola ikatan lektin yang berbeda pula. Karbohidrat yang terdapat pada zona pelusida ini dapat berperan sebagai reseptor spermatozoa, residu a-galaktosil berperan pada zona pelusida tikus, sedangkan pada men cit yang berpartisipasi pada ikatan spermatozoa adalah L-fukosa, D manosa dan metil manosida. Pada hamster, marmot dan manusia yang berperan adalah L-Fucosa dan D-Galaktosa. Zona pelusida folikel
antral ovarium rusa timor bereaksi positif lemah terhadap lektin RCA. Hal ini menandakan karbohidrat dengan residu gula galaktosa terkandung dalam zona pelusida. Karbohidrat dengan residu gula galaktosa ini diduga berperan dalam fertilisasi dan merupakan spesies-spesifik dari zona pelusida oosit rusa timor.
Pada liquor folikuli rusa timor hanya sedikit terlihat reaksi lektin yang menandakan adanya karbohidrat dengan residu gula glukosa namun banyak karbohidrat dengan residu gula D-N-asetilgalaktosamin, galaktosa dan manosa. Hafez dan Hafez (2000) mengatakan bahwa komponen dan metabolit dalam liquor folikuli antara lain adalah glukosa, fruktosa, fukosa, galaktosa, manosa, glukosamin, galaktosamin, as am hialuronat, heparin dan plasminogen. Diduga komponen dalam liquor folikuli akan berbeda tergantung spesies hewan. Liquor folikuli pada folikel ovarium kerbau mengandung glikokonjugat dengan residu beta-N-acetilgalaktosamin, beta-galaktosa-(1-3)-N-asetilgalaktosamin, beta-galaktos-(1-4)-N-asetilglukosamin, N-asetilglukosamin, alfa-fukosa, alfa glukosa, alfa manosa dan asam sialik (Parillo et al. 1998).
Pada sitoplasma oosit folikel preantral terlihat pula reaksi positif beberapa lektin yang menandakan adanya karbohidrat dengan residu gula D-N-asetilgalaktosamin, galaktosa, manosa dan glukosa. Namun pada sitoplasma oosit folikel antral, karbohidrat dengan residu gula manosa tidak ditemukan lagi. Dinamika komponen tersebut mencerminkan adanya dinamika proses perkembangan dalam sitoplasma oosit.