PEMURNIAN DAN KARAKTERISASI SILIKA DARI GEL LIMBAH FASILITAS PEMURNIAN ZIRKONIUM
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta Untuk Memenuhi Sebagian
Persyaratan Guna Memperoleh Gelar Sarjana Sains Kimia
Oleh:
Hasna Irfantiningtyas Sari NIM 12307144030
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
vi
MOTTO
“Karena sesungguhnya sesudah kesulitan itu ada kemudahan. Sesungguhnya
sesudah kesulitan itu ada kemudahan”
(QS. Al-Insyirah: 5-6)
“Kepuasan terletak pada usaha, bukan pada hasil. Berusaha dengan keras adalah
kemenangan yang hakiki”
vii
HALAMAN PERSEMBAHAN
Karya ini aku persembahkan untuk:
♣ Kedua orang tuaku, ayahanda dan ibunda ku tercinta yang telah
memberikan motivasi serta dukungan yang tiada henti, mengasuh,
mendidik, selalu mendoakan serta meridhoiku.
♣ Bapak Muzakky, Bapak Prayitno, karyawan dan staff kelompok Teknologi
Pemisahan BTP dan seluruh karyawan PSTA BATAN yang telah
memberikan bimbingan, ilmu, dan pengalaman kepada penulis.
♣ Bapak I Made Sukarna dan seluruh dosen yang telah memberikan
bimbingan dan ilmu yang bermanfaat kepada penulis.
♣ Adik-adikku tersayang yang selalu memberi keceriaan, hingga membuat
viii
KATA PENGANTAR
Puji syukur senantiasa penulis panjatkan kehadirat Allah SWT atas karunia, rahmat, dan hidayahNya sehingga penulis dapat menyelesaikan tugas akhir skripsi di Pusat Sains dan Teknologi Akselerator (PSTA)-BATAN Yogyakarta, dengan judul “Pemurnian dan Karakterisasi Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium”.
Penulis menyadari bahwa dalam menyelesaikan penulisan skripsi ini tidak terlepas dari bimbingan, arahan dan bantuan serta motivasi dari berbagai pihak. Oleh karena itu, melalui kesempatan ini penulis mengucapkan terima kasih kepada:
1. Bapak Dr. Susilo Widodo, selaku Kepala Pusat Sains dan Teknologi Akselerator-BATAN Yogyakarta.
2. Ibu Dra. Elisabeth S, M. App. Sc, selaku Kepala Bidang Keselamatan Kerja dan Keteknikan Pusat Sains dan Teknologi Akselerator-BATAN Yogyakarta.
3. Bapak Dr. Hartono, selaku Dekan FMIPA Universitas Negeri Yogyakarta. 4. Bapak Jaslin Ikhsan, Ph.D. selaku Ketua Jurusan Pendidikan Kimia FMIPA
Universitas Negeri Yogyakarta.
ix
6. Bapak I Made Sukarna, M.Si sebagai Dosen Pembimbing yang telah memberikan bimbingan, saran, masukan dalam penyelesaian Tugas Akhir Skripsi.
7. Ibu Dr. Siti Sulastri, MS selaku dosen penguji utama, terima kasih atas saran dan masukannya demi sempurnanya laporan Tugas Akhir Skripsi.
8. Ibu Regina Tutik P, M.Si selaku dosen penguji pendamping, terima kasih atas saran dan masukan yang diberikan.
9. Bapak Ir. Prayitno MT, Bapak Supriyanto, Bapak Imam yang telah memberikan arahan, berbagi pengalaman dengan saya dan membantu saya dalam melakukan penelitian di laboratorium.
10. Bapak Mulyono dan semua karyawan reaktor PSTA-BATAN yang sudah berbagi pengetahuan dengan saya.
11. Teman-teman Jurusan Kimia angkatan 2012 yang telah memberikan semangat sehingga penulis dapat menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan karena keterbatasan kemampuan dan pengetahuan penulis. Oleh karena itu, penulis mengharapkan kritik dan saran demi perbaikan skripsi ini. Semoga skripsi ini dapat berguna untuk kemajuan ilmu pengetahuan. Amin.
Yogyakarta, Oktober 2016
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
PERSETUJUAN ... ii
PENGESAHAN ... iii
SURAT PERNYATAAN ... v
MOTTO ... vi
HALAMAN PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xix
DAFTAR LAMPIRAN ... xxiv
ABSTRAK ... xxvi
ABSTRACT ... xxvii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang Masalah... 1
B. Identifikasi Masalah ... 4
C. Pembatasan Masalah ... 5
D. Perumusan Masalah ... 5
E. Tujuan Penelitian ... 6
F. Manfaat Penelitian ... 6
xi
A Kajian Teori ... 7
1. Pasir Zirkon ... 7
2. Zirkonium (IV) Oksida ( ZrO2 ) ... 9
3. Silika ... 12
4. Pelindian ... 15
5. Unsur Pengotor Silika ... 16
6. Dekomposisi SiO2 ... 21
a. Bomb Digestion ... 22
b. Pelarut Asam ... 23
7. Spektrofotometer FTIR ... 25
8. Difraktometer Sinar-X ... 28
a. Sinar -X. ... 28
b. Skema dan Prinsip Kerja Difraktometer Sinar-X ... 33
9. Spektroskopi Serapan Atom (SSA) ... 35
B. Penelitian yang Relevan ... 41
C. Kerangka Berpikir Teoritis ... 42
BAB III. METODE PENELITIAN ... 44
A. Subjek dan Objek Penelitian ... 44
1 Subjek Penelitian ... 44
2. Objek Penelitian ... 44
B. Variabel Penelitian ... 44
1. Variabel Bebas ... 44
2.` Variabel Terikat ... 44
C. Alat dan Bahan ... 44
1. Alat ... 44
2. Bahan ... 45
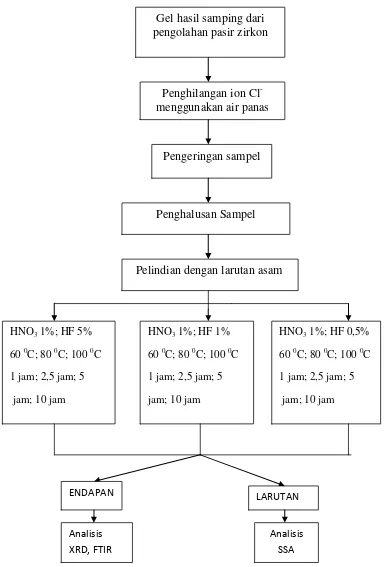
D. Prosedur Penelitian ... 45
1. Pemisahan Gel dari Air dengan Metode Filtrasi ... 47
2.` Penghilangan Ion Cl- dari Gel ... 47
xii
4. Preparasi Sampel Untuk Perlakuan dengan Variasi Waktu,
Suhu, dan Konsentrasi ... 48
5. Preparasi Analisis Hasil Desorpsi IonFe3+, Zn2+, Al3+, Cr3+ Menggunakan SSA ... 49
6. Preparasi Analisis Hasil Desorpsi Ion Al3+ Menggunakan Spektrofotometer Serapan Atom ... 50
7. Preparasi Analisis Hasil Desorpsi Ion Si2+ Menggunakan Spektrofotometer Serapan Atom ... 52
E. Teknik Analisa Data ... 53
1. Analisis Kualitatif Sampel dengan FTIR dan XRD ... 53
2. Analisis Kuantitatif Sampel dengan Spektroskopi Serapan Atom ... 53
BAB IV. HASIL DAN PEMBAHASAN ... 55
1. Pelindian Endapan Silika Menggunakan Campuran HF dan HNO3... 56
2. Analisis Hasil Desorpsi Ion Pengotor Menggunakan SSA ... 59
a. Analisis Hasil Desorpsi Ion Fe3+ Menggunakan SSA ... 59
b. Analisis Hasil Desorpsi Ion Zn2+ Menggunakan SSA ... 63
c. Analisis Hasil Desorpsi Ion Al3+ Menggunakan SSA ... 66
d. Analisis Hasil Desorpsi Ion Cr3+ Menggunakan SSA ... 69
3. Analisa Hasil Desorpsi Ion Si2+ Menggunakan SSA ... 72
4. Perbedaan Desorpsi Ion Fe3+, Zn2+, Al3+, dan Cr3+ ... 75
5. Perubahan Berat Silika Sebelum dan Setelah Perlakuan Menggunakan Campuran Asam ... 76
6. Analisis Gugus Fungsi Pada Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Secara Spektroskopi FTIR ... 78 a. Analisis Hasil Pemurnian Silika Dari Gel
xiii
Menggunakan Campuran HF 5% dan HNO3
1% Pada Suhu 60 0C ... 78 b. Analisis Hasil Pemurnian Silika Dari Gel
Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 1% dan HNO3
1% Pada Suhu 60 0C ... 80 c. Analisis Hasil Pemurnian Silika Dari Gel
Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 0,5% dan
HNO3 1% Pada Suhu 60 0C ... 82
d. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 5% dan HNO3
1% Pada Suhu 80 0C ... 85 e. Analisis Hasil Pemurnian Silika Dari Gel
Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 1% dan HNO3
1% Pada Suhu 80 0C ... 86 f. Analisis Hasil Pemurnian Silika Dari Gel
Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 0,5% dan
HNO3 1% Pada Suhu 80 0C ... 88
g. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 5% dan HNO3
1% Pada Suhu 100 0C ... 91 h. Analisis Hasil Pemurnian Silika Dari Gel
Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 1% dan HNO3
xiv
i. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 0,5% dan
HNO3 1% Pada Suhu 100 0C ... 95
7. Analisis Pola Difraksi Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium
Menggunakan Difraktometer Sinar-X ... 98 a. Analisis Hasil Pemurnian Silika Dari Gel
Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 5% dan
HNO3 1% Pada Suhu 60 0C ... 99
b. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 1% dan
HNO3 1% Pada Suhu 60 0C ... 99
c. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 0,5% dan
HNO3 1% Pada Suhu 60 0C ... 100
d. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 5% dan
HNO3 1% Pada Suhu 80 0C ... 101
e. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 1% dan
HNO3 1% Pada Suhu 80 0C ... 101
f. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 0,5% dan
xv
g. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 5% dan
HNO3 1% Pada Suhu 100 0C ... 103
h. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 1% dan HNO3 1% Pada Suhu 100 0C ... 103
i. Analisis Hasil Pemurnian Silika Dari Gel Limbah Fasilitas Pemurnian Zirkonium Menggunakan Campuran HF 0,5% dan HNO3 1% Pada Suhu 100 0C ... 104
BAB V. PENUTUP ... 106
1. Kesimpulan ... 106
2. Saran ... 107
DAFTAR PUSTAKA ... 108
xvi
DAFTAR TABEL
Halaman Tabel 1. Polimer Silika Pada Tekanan Atmosfer ... 14 Tabel 2. Rentang dan Jenis Ikatan Berdasarkan Hasil
Menggunakan Spektrofotometri Inframerah ... 27 Tabel 3. Volume Larutan yang Harus Ditambahkan Dalam
Pembuatan Larutan Standar Campuran ... 50 Tabel 4. Volume Larutan yang Harus Ditambahkan Dalam
Pembuatan Larutan Standar Al ... 51 Tabel 5. Volume Larutan yang Harus Ditambahkan Dalam
Pembuatan Larutan Standar Si ... 53 Tabel 6. Perubahan Berat Sebelum dan Setelah Diberi
Perlakuan ... 77 Tabel 7. Rangkuman Hasil Analisis Gugus Fungsi
Berdasarkan Hasil Spektra FTIR Pada Suhu 60 0C ... 84 Tabel 8. Rangkuman Hasil Analisis Gugus Fungsi
Berdasarkan Hasil Spektra FTIR Pada Suhu 80 0C ... 90 Tabel 9. Rangkuman Hasil Analisis Gugus Fungsi
Berdasarkan Hasil Spektra FTIR Pada Suhu 100 0C ... 97
Tabel 10. Statistika Penentuan Persamaan Garis Regresi Linier
Fe ... 120 Tabel 11. Statistika Penentuan Persamaan Garis Regresi Linier
Cr ... 121 Tabel 12. Statistika Penentuan Persamaan Garis Regresi Linier
Cd ... 122 Tabel 13. Statistika Penentuan Persamaan Garis Regresi Linier
Zn ... 123 Tabel 14. Statistika Penentuan Persamaan Garis Regresi Linier
xvii
Tabel 15. Statistika Penentuan Persamaan Garis Regresi Linier
Si ... 125 Tabel 16. Hasil Perhitungan Konsentrasi Fe3+ yang Terdesorpsi
dalam Larutan Hasil Destruksi ... 139 Tabel 17. Hasil Perhitungan Kadar Fe3+ yang Terdesorpsi
dalam μg/g Setelah Diberi Perlakuan dengan Variasi Campuran HNO3 1% dengan HF (5,1, dan 0,5%) dan
Waktu (1, 2.5, 5, dan 10 Jam) ... 141 Tabel 18. Hasil Perhitungan Konsentrasi Cr3+ yang terdesorpsi
dalam Larutan ... 143 Tabel 19. Hasil Perhitungan Kadar Cr3+ yang terdesorpsi dalam
μg/g Setelah Diberi Perlakuan dengan Variasi Campuran HNO3 1% dengan HF (5,1, dan 0,5%) dan
Waktu (1, 2.5, 5, dan 10 Jam) ... 145 Tabel 20. Hasil Perhitungan Konsentrasi Zn2+ yang
Terdesorpsi dalam Larutan ... 147 Tabel 21. Hasil Perhitungan Kadar Zn2+ yang Terdesorpsi
dalam μg/g Setelah Diberi Perlakuan dengan Variasi Campuran HNO3 1% dengan HF (5,1, dan 0,5%) dan
Waktu (1, 2.5, 5, dan 10 Jam) ... 149 Tabel 22. Hasil Perhitungan Konsentrasi Al3+ yang Terdesorpsi
dalam Larutan ... 151 Tabel 23. Hasil Perhitungan Kadar Al3+ yang Terdesorpsi
dalam Larutan dalam μg/g Setelah Diberi Perlakuan dengan Variasi Campuran HNO3 1% dengan HF
(5,1, dan 0,5%) dan Waktu (1, 2.5, 5, dan 10 Jam) ... 153 Tabel 24. Hasil Perhitungan Konsentrasi Si2+ yang Terdesorpsi
dalam Larutan ... 155 Tabel 25. Hasil Perhitungan Kadar Si2+ yang Terdesorpsi
xviii
Campuran HNO3 1% dengan HF (5,1, dan 0,5%) dan
xix
DAFTAR GAMBAR
Halaman
Gambar 1. Pasir Zirkon ... 7
Gambar 2 Bagan Alir Proses Pengolahan Pasir Zirkon ... 11
Gambar 3. Kadmium ... 17
Gambar 4. Kromium... 18
Gambar 5. Besi ... 19
Gambar 6. Aluminium ... 20
Gambar 7. Seng ... 21
Gambar 8. Difraktometer Sinar-X ... 28
Gambar 9. Ilustrasi Transisi Elektronik Dalam Sebuah Atom ... 29
Gambar 10. Difraksi Sinar-X Oleh Atom-Atom Pada Bidang ... 29
Gambar 11. Komponen Pada Tabung Sinar-X ... 30
Gambar 12. Jalannya Sinar-X ... 33
Gambar 13. Difraksi Sinar-X Serbuk ... 34
Gambar 14. Prosedur Penelitian ... 46
Gambar 15. Pengaruh Waktu Kontak dan Variasi Konsentrasi HF Pada Desorpsi Ion Fe3+ Pada Suhu 60 0C ... 60
Gambar 16. Pengaruh Waktu Kontak dan Variasi Konsentrasi HF Pada Desorpsi Ion Fe3+ Pada Suhu 80 0C ... 60
Gambar 17. Pengaruh Waktu Kontak dan Variasi Konsentrasi HF Pada Desorpsi Ion Fe3+ Pada Suhu 100 0C ... 61
Gambar 18. Pengaruh Waktu Kontak dan Variasi Konsentrasi HF Pada Desorpsi Ion Zn2+ Pada Suhu 60 0C ... 63
Gambar 19. Pengaruh Waktu Kontak dan Variasi Konsentrasi HF Pada Desorpsi Ion Zn2+ Pada Suhu 80 0C ... 63
Gambar 20. Pengaruh Waktu Kontak dan Variasi Konsentrasi HF Pada Desorpsi Ion Zn2+ Pada Suhu 100 0C ... 64
xx
Gambar 22. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Al3+ Pada Suhu 80 0C ... 66 Gambar 23. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Al3+ Pada Suhu 100 0C ... 67
Gambar 24. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Cr3+ Pada Suhu 60 0C ... 69 Gambar 25. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Cr3+ Pada Suhu 80 0C ... 69 Gambar 26. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Cr3+ Pada Suhu 100 0C ... 70 Gambar 27. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Si2+ Setelah Pemberian Air
Raja Pada Suhu 60 0C ... 73 Gambar 28. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Si2+ Setelah Pemberian Air
Raja Pada Suhu 80 0C ... 73 Gambar 29. Pengaruh Waktu Kontak dan Variasi Konsentrasi
HF Pada Desorpsi Ion Si2+Setelah Pemberian Air
Raja Pada Suhu 100 0C ... 74 Gambar 30. Hasil Analisis Secara Spektroskopi FTIR Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 5% dan HNO3 1% Pada Suhu
60 0C ... 78 Gambar 31. Hasil Analisis Secara Spektroskopi FTIR Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 1% dan HNO3 1% Pada Suhu
60 0C ... 80 Gambar 32. Hasil Analisis Secara Spektroskopi FTIR Sebelum
xxi
Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 0,5% dan HNO3 1% Pada Suhu
60 0C ... 82
Gambar 33. Hasil Analisis Secara Spektroskopi FTIR Sebelum Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 5% dan HNO3 1% Pada Suhu
80 0C ... 85 Gambar 34. Hasil Analisis Secara Spektroskopi FTIR Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 1% dan HNO3 1% Pada Suhu
80 0C ... 87 Gambar 35. Hasil Analisis Secara Spektroskopi FTIR Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 0,5% dan HNO3 1% Pada Suhu
80 0C ... 88 Gambar 36. Hasil Analisis Secara Spektroskopi FTIR Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 5% dan HNO3 1% Pada Suhu
100 0C ... 91 Gambar 37. Hasil Analisis Secara Spektroskopi FTIR Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 1% dan HNO3 1% Pada Suhu
100 0C ... 93 Gambar 38. Hasil Analisis Secara Spektroskopi FTIR Sebelum
xxii
Campuran HF 0,5% dan HNO3 1% Pada Suhu
100 0C ... 95 Gambar 39. Hasil Analisis Secara Difraksi Sinar-X Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 5% dan HNO3 1% Pada Suhu
60 0C ... 99 Gambar 40. Hasil Analisis Secara Difraksi Sinar-X Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 1% dan HNO3 1% Pada Suhu
60 0C ... 99 Gambar 41. Hasil Analisis Secara Difraksi Sinar-X Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 0,5% dan HNO3 1% Pada Suhu
60 0C ... 100 Gambar 42. Hasil Analisis Secara Difraksi Sinar-X Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 5% dan HNO3 1% Pada Suhu
80 0C ... 101
Gambar 43. Hasil Analisis Secara Difraksi Sinar-X Sebelum Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 1% dan HNO3 1% Pada Suhu
80 0C ... 101 Gambar 44. Hasil Analisis Secara Difraksi Sinar-X Sebelum
xxiii
Campuran HF 0,5% dan HNO3 1% Pada Suhu
80 0C ... 102 Gambar 45. Hasil Analisis Secara Difraksi Sinar-X Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 5% dan HNO3 1% Pada Suhu
100 0C ... 103 Gambar 46. Hasil Analisis Secara Difraksi Sinar-X Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 1% dan HNO3 1% Pada Suhu
100 0C ... 103 Gambar 47. Hasil Analisis Secara Difraksi Sinar-X Sebelum
Perlakuan (A), Lama Pemanasan 1 Jam (B), dan Lama Pemanasan 10 Jam (C) Menggunakan Campuran HF 0,5% dan HNO3 1% Pada Suhu
xxiv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Pembuatan Larutan HNO3 1%... 112
Lampiran 2. Pembuatan Larutan Standar Campuran ... 113 Lampiran 3. Pembuatan Larutan Standar Al ... 117 Lampiran 4. Pembuatan Larutan Standar Si ... 118 Lampiran 5. Penentuan Persamaan Garis Regresi Linier Larutan
Standar Besi ... 120 Lampiran 6. Penentuan Persamaan Garis Regresi Linier Larutan
Standar Kromium ... 121 Lampiran 7. Penentuan Persamaan Garis Regresi Linier Larutan
Standar Kadmium ... 122 Lampiran 8. Penentuan Persamaan Garis Regresi Linier Larutan
Standar Seng ... 123 Lampiran 9. Penentuan Persamaan Garis Regresi Linier Larutan
Standar Aluminium ... 124 Lampiran 10. Penentuan Persamaan Garis Regresi Linier Larutan
Standar Si... 125 Lampiran 11. Uji Signifikansi Garis Regresi Larutan Standar
Besi ... 126 Lampiran 12. Uji Signifikansi Garis Regresi Larutan Standar
Kromium... 127 Lampiran 13. Uji Signifikansi Garis Regresi Larutan Standar
Kadmium ... 128 Lampiran 14. Uji Signifikansi Garis Regresi Larutan Standar
Seng ... 129 Lampiran 15. Uji Signifikansi Garis Regresi Larutan Standar
Aluminium ... 130 Lampiran 16. Uji Signifikansi Garis Regresi Larutan Standar Si ... 131 Lampiran 17. Perhitungan Linieritas Garis Regresi Larutan
xxv
Lampiran`18. Perhitungan Linieritas Garis Regresi Larutan
Standar Kromium ... 133 Lampiran 19. Perhitungan Linieritas Garis Regresi Larutan
Standar Kadmium ... 134 Lampiran 20. Perhitungan Linieritas Garis Regresi Larutan
Standar Seng ... 135 Lampiran 21. Perhitungan Linieritas Garis Regresi Larutan
Standar Aluminium ... 136 Lampiran 22. Perhitungan Linieritas Garis Regresi Larutan
Standar Si... 137 Lampiran 23. Perhitungan Kadar Ion Fe3+ yang Terdesorpsi
dalam Cuplikan ... 138 Lampiran 24. Perhitungan Kadar Ion Cr3+ yang Terdesorpsi
dalam Cuplikan ... 142 Lampiran 25. Perhitungan Kadar Ion Zn2+ yang Terdesorpsi
dalam Cuplikan ... 143 Lampiran 26. Perhitungan Kadar Ion Al3+ yang Terdesorpsi
dalam Cuplikan ... 150 Lampiran 27. Perhitungan Kadar Ion Si2+ yang Terdesorpsi
dalam Cuplikan ... 154 Lampiran 28. Hasil Pembacaan XRD Pada Silika Sebelum Diberi
xxvi
PEMURNIAN DAN KARAKTERISASI SILIKA DARI GEL LIMBAH FASILITAS PEMURNIAN ZIRKONIUM
Oleh:
Hasna Irfantiningtyas Sari NIM 12307144030
Pembimbing utama: Muzakky, ST. M.Si Pembimbing pendamping: I Made Sukarna, M.Si
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh variasi konsentrasi HF, lama pemanasan, dan suhu pemanasan serta mencari kondisi optimum desorpsi ion Si2+ berdasarkan kadar terendah yang dihasilkan.
Metode yang digunakan dalam penelitian ini adalah metode pelindian. Metode pelindian yang dilakukan adalah melewatkan pelarut pada sampel silika. Ekstraktan yang digunakan adalah campuran HF dan HNO3 . Variasi konsentrasi
HF yang diberikan adalah 5, 1, dan 0,5 %, sedangkan konsentrasi HNO3 adalah
1%. Silika dimasukkan pada sebuah teflon kemudian diberikan campuran HF dan HNO3 sesuai variasi yang ditentukan. Setelah itu, dimasukkan ke dalam alat teflon bomb digaster dengan diatur lama pemanasan dan suhu. Setelah itu, sampel
dikeluarkan dan dilakukan pencucian menggunakan akuades. Kemudian sampel disaring menggunakan kertas saring. Residu dari hasil penyaringan dianalisis menggunakan difraktometer sinar-x dan spektrofotometer FTIR. Filtrat dari hasil penyaringan dianalisis menggunakan Spektrofotometer Serapan Atom.
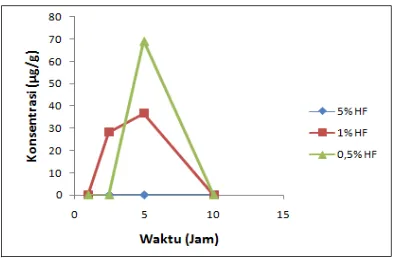
Berdasarkan hasil analisis menggunakan SSA, diperoleh hasil desorpsi ion Si2+ paling rendah menggunakan campuran HF 1% dan HNO3 1% dengan suhu
60 0C, dan lama pemanasan 5 jam. Kadar desorpsi ion Si2+ yang terendah sebesar 0 μg/g. Semakin tinggi suhu maka terjadi pergeseran gugus silanol dan siloksan yang merupakan gugus karakteristik silika ke bilangan gelombang yang lebih kecil. Semakin tinggi suhu dan konsentrasi unsur menghasilkan puncak kristalin semakin banyak. Semakin besar konsentrasi HF, semakin lama waktu pemanasan, dan semakin besar suhu pemanasan maka HF berada dalam kondisi optimum untuk mendesorpsi ion pengotor Fe3+, Zn2+, Cr3+, Al3+, dan Si2+.
xxvii
PURIFICATION AND CHARACTERIZATION OF SILICA GEL PURIFICATION WASTE FACILITIES ZIRCONIUM
By:
Hasna Irfantiningtyas Sari NIM 12307144030
Principal Supervisor: Muzakky, ST. M.Si Co principal Supervisor: I Made Sukarna, M.Si
ABSTRACT
This research aims to determine the effect of variations in the concentration of HF, prolonged heating, and the heating temperature as well as the search condition Si2+ desorption of ions generated by the lowest levels. The method used in this research is the method of leaching. Leaching method does is skip solvent on silica samples. Extractant used is a mixture of HF and HNO3. HF concentration variation given are 5, 1, and 0,5%, whereas the
concentration of HNO3 is 1%. Silica is inserted in a teflon then given a mixture of
HF and HNO3 corresponding variation determined. After that, put in a Teflon
bomb digaster tool to set heating times and temperatures. After that, the samples are removed and do the washing using distilled water. Then the samples were filtered using a filter paper. Residue from the screening results were analyzed using X-ray diffraction and FTIR spectrophotometer. The filtrate from the screening results were analyzed using Atomic Absorption Spectrophotometer.
Based on the analysis using AAS, the result desorption ion lowest Si2+ using a mixture of HF and HNO3 1% and 1% with a temperature of 60 0C, and
longer heating 5 hours. Si2+ desorption ion the lowest at 0 μg/g. The higher the
temperature, the shift of silanol and siloxane which is characteristic of silica clusters into smaller wave numbers. The higher the temperature and the concentration of the element with crystalline peaks more. The greater the concentration of HF, the longer the heating time, and the greater the heating temperature of the HF are in optimum condition for desorption impurity ions Fe
3+, Zn 2+, Cr 3+, Al 3+, and Si2+.
1 BAB I PENDAHULUAN
A. Latar Belakang Masalah
Pasir zirkon yang banyak ditemukan di alam pada umumnya berbentuk mineral-mineral zirkonium. Logam zirkonium didapat dari hasil pengolahan pasir zirkon. Berdasarkan analisis menggunakan XRF (X-ray Flouresence) hasil proses
pemisahan menggunakan meja goyang dengan bahan baku pasir zirkon yang dilakukan oleh Sajima dkk pada tahun 2012, didapat bahwa kandungan dari pasir zirkon antara lain : ZrO2, TiO2, SiO2, Fe2O3, P2O3, SnO, Al2O3, CuO, Cr2O3, dan
NbO2. Kadar dari masing-masing penyusun pasir zirkon berbeda-beda di setiap
tempat karena dipengaruhi oleh proses kejadian awalnya. Prinsip kerja meja goyang adalah berdasarkan perbedaan berat dan ukuran partikel terhadap gaya gesek akibat aliran air tipis (Sajima,dkk, 2012: 30). Pengolahan pasir zirkon menjadi kristal ZrO2 dilakukan dengan melebur pasir zirkon menggunakan NaOH
yang akan menghasilkan natrium zirkonat dan natrium silikat sebagai produk antara yang selanjutnya diproses dengan pelindian menggunakan air. Kristal ZrO2,
dihasilkan dengan cara natrium zirkonat ditambahkan HCl yang akan menghasilkan ZrOCl2 kemudian dilakukan kalsinasi yang akan menghasilkan
kristal ZrO2. Limbah yang terbentuk dari hasil proses pemurnian zirkonium
2
pemurnian zirkonium berbasis mineral zirkon masih mempunyai nilai ekonomis tinggi. Salah satu pemanfaatan gel adalah dengan mengambil silika (SiO2) yang
bernilai ekonomis tinggi. Silika diperoleh dari gel natrium silikat yang ditambahkan dengan HCl, seperti reaksi di bawah ini:
Na2SiO3 (aq) + 2 HCl (aq) → 2NaCl (aq) + SiO2 (s) + H2O (l)
(Suprianto C dan Harry Supriadi, 2015: 2-3)
Silika merupakan oksida non logam bebas yang paling banyak ditemukan di alam, memiliki sifat hidrofilik atau hidrofobik sesuai dengan struktur dan morfologinya. Silika memiliki konfigurasi stabil dalam bentuk tetrahedron. Silika diambil dari nama latin silex yang berarti batu api. SiO2 merupakan bentuk paling
stabil dan ditemukan dalam berbagai variasi kristal. Bentuk kristal murni dari silika adalah quartz. Silika merupakan kristal metalloid. Silikon memiliki nomor atom 14 dengan konfigurasi elektron [Ne] 3s23p2. Silikon mempunyai massa molar sebesar 28,0855 gram/mol. Silikon merupakan golongan karbon tetapi memiliki perilaku yang berbeda dari unsur lain dalam satu golongan karbon. Silikon mempunyai empat elektron valensi. Silikon memiliki sifat yang cenderung inert, tetapi dalam kondisi tertentu silikon dapat menjadi reaktif. Silikon memiliki titik beku sebesar 1414 0C dan titik didih sebesar 3265 0C. Di dalam industri, silikon digunakan untuk membuat gelas, chips komputer, fiber optic, keramik,
semen, zeolit, dan barang elektronik (Sumber: http://chemwiki.ucdavis.edu/Core/Inorganic_Chemistry/Descriptive_Chemistry/El
3
Di dalam industri nuklir, Si dimanfaatkan sebagai PAR (Passive Autocatalytic Recombiners) yaitu perangkat keselamatan untuk menurunkan
resiko ledakan yang terkait dengan pembebasan hidrogen. PAR dijadikan katalis untuk menggabungkan hidrogen dan oksigen secara eksoterm. Di dalam reaktor nuklir berpendingin air dengan kondisi operasi normal dan darurat mengalami radiolisis air serta reaksi uap logam dimana kedua proses itu melepaskan gas hidrogen ke udara. Dalam kondisi darurat pelepasan gas hidrogen ke udara dipercepat khususnya ketika unsur-unsur logam kontak dengan air pendingin yang secara terus-menerus meningkatkan suhu dan radiasi sehingga membebaskan gas hidrogen lebih banyak dan menimbulkan kecelakaan pada PLTN dikarenakan
overheating (E Lalik, dkk, 2015: 27).
4
Penelitian ini bertujuan untuk memurnikan silika menggunakan metode pelindianasam dengan jenis Stasionary Solid Bed dimana pelindian dilaksanakan
dengan padatan diletakkan pada posisi tidak bergerak, hanya pelarutnya saja yang mengalir melalui solid bed, sementara komponen yang mudah larut akan terlarut
oleh solvent. Penelitian ini dilakukan karena penelitian tentang pemurnian silika
menggunakan metode pelindian asam dengan jenis stasionary solid bed belum
banyak dilakukan.
Kontrol kualitas hasil pemurnian silika dilakukan melalui proses desorpsi menggunakan campuran pelarut asam pada variasi suhu, waktu kontak, dan konsentrasi asam, sedangkan untuk menentukan kadar pengotor dilakukan dengan metode SSA karena memiliki kelebihan yaitu sensitifitas tinggi dan sampel yang dibutuhkan sedikit.
B. Identifikasi Masalah
Berdasarkan latar belakang masalah di atas, maka dapat diidentifikasi beberapa masalah, yaitu:
1. Bahan utama untuk objek penelitian.
2. Jenis pelarut yang digunakan untuk desorpsi pengotor pada Si dalam objek penelitian.
3. Pengaruh suhu, lama waktu pemanasan, konsentrasi asam optimum dalam pelindian.
5
C.
Pembatasan MasalahMengingat ruang lingkup permasalahan penelitian relatif luas, maka perlu diberikan batasan masalah. Adapun masalah dibatasi pada:
1. Bahan utama yang digunakan sebagai objek penelitian adalah silika dari gel limbah fasilitas pemurnian zirkonium.
2. Jenis pelarut yang digunakan untuk desorpsi pengotor pada Si dalam objek penelitian adalah campuran HF dan HNO3 dalam variasi komposisi.
3. Pengaruh suhu, lama waktu pemanasan, konsentrasi asam optimum dalam pelindian ditentukan dari kadar ion Si2+ dan ion pengotor Fe3+, Zn2+, Al3+, dan Cr3+ yang dihasilkan.
4. Metode analisis untuk kadar ion Si2+, Fe3+, Zn2+, Al3+, Cr3+, gugus fungsi,
dan struktur kristal menggunakan alat spektrofotometer serapan atom, spektrofotometer FTIR, dan difraktometer sinar-x.
D. Perumusan Masalah
Berdasarkan latar belakang dan identifikasi masalah, maka rumusan masalah yang akan diteliti dalam penelitian ini dapat dirumuskan sebagai berikut:
1. Bagaimana pengaruh variasi konsentrasi HF, lama pemanasan, dan suhu pemanasan terhadap desorpsi ion Si2+, Fe3+, Zn2+, Al3+, Cr3+, gugus fungsi, dan struktur kristal?
2. Bagaimana kondisi yang paling optimum untuk desorpsi ion Si2+?
3. Bagaimana kondisi yang paling optimum untuk desorpsi ion pengotor Fe3+,
6 E. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk:
1. Mengetahui pengaruh variasi konsentrasi HF, lama pemanasan, dan suhu pemanasan terhadap desorpsi ion Si2+, Fe3+, Zn2+, Al3+, Cr3+, gugus fungsi,
dan struktur kristal.
2. Mengetahui kondisi yang paling optimum untuk desorpsi ion Si2+.
3. Mengetahui kondisi yang paling optimum untuk desorpsi ion pengotor Fe3+, Zn2+, Al3+, dan Cr3+.
F. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat untuk beberapa pihak, antara lain:
1. Bagi PSTA-BATAN
Memperoleh data hubungan antara variasi konsentrasi HF, lama pemanasan, dan suhu pemanasan terhadap proses pemurnian silika dari pengotor yang ada dengan metode leaching. Data ini berguna untuk merancang kinerja metode leaching dalam pemisahan silika dengan pengotornya sehingga dapat
menghasilkan silika dengan kemurnian tinggi. 2. Bagi Mahasiswa
Memperoleh ilmu yang lebih mendalam mengenai proses pemurnian silika dengan menggunakan metode pelindianasam.
3. Bagi Akademisi
7
BAB II DASAR TEORI
A. Kajian Teori 1. Pasir Zirkon
Unsur zirkonium diketahui banyak terdapat dalam pasir zirkon yang
merupakan hasil samping dari pabrik timah Bangka. Pasir zirkon adalah “heavy
minerals” disebut demikian karena densitasnya cukup besar (antara 4 - 5,5 g/mL)
dan densitas ini lebih besar dari densitas pasir kuarsa, yang merupakan penyusun utama pasir. Zirkonium yang banyak ditemukan di Kalimantan merupakan mineral ikutan pada endapan emas alluvial (plaser), walaupun di beberapa tempat
kandungan zirkon kadang-kadang lebih dominan. Pasir zirkon di Kabupaten Melawi, Kalimantan Barat di temukan di 12 lokasi, yang tersebar di 5 kecamatan, antara lain Kecamatan Nanga Pinoh, Kecamatan Nanga Ella Hilir, Kecamatan Menukung, Kecamatan Nanga Sayan dan Kecamatan Nanga Sokan. Pasir zirkon terdapat di daerah bekas penambangan emas alluvial (plaser), dengan warna
abu-abu kehitaman, butiran halus sampai sedang, dan bentuk butir menyudut tanggung (www.dim.esdm.go.id/, diakses 15 Juni 2016). Pasir zirkon ditunjukkan oleh Gambar 1.
Gambar 1. Pasir Zirkon
8
Pasir zirkon yang banyak ditemukan di alam pada umumnya berbentuk mineral-mineral zirkonium. Sedangkan logam zirkonium didapat dari hasil pengolahan pasir zirkon. Berdasarkan analisis menggunakan XRF hasil proses pemisahan menggunakan meja goyang dengan bahan baku pasir zirkon yang dilakukan oleh Sajima dkk pada tahun 2012, didapat bahwa kandungan dari pasir zirkon antara lain: ZrO2, TiO2, SiO2, Fe2O3, P2O3, SnO, Al2O3, CuO, Cr2O3, dan
NbO2. Kadar dari masing-masing penyusun pasir zirkon berbeda-beda di setiap
tempat karena dipengaruhi oleh proses kejadian awalnya.
Ada dua metode pengambilan zirkon dari mineral-mineralnya, yaitu:
a. Metode kering
Mineral zirkon diolah dengan karbon dan klorin pada temperatur tinggi, kemudian zirkon tetraklorida yang dihasilkan dipisahkan.
b Metode basah
Proses pengolahan pasir zirkon dengan metode basah pada tahap awal dilakukan dengan peleburan pasir zirkon menggunakan zat pelebur NaOH, dan terjadi reaksi di bawah ini:
ZrSiO4 (s) + 4 NaOH (aq) → Na2ZrO3 (aq) + Na2SiO3 (aq) + 2H2O (aq)
Pengambilan SiO2 dapat dilakukan dengan cara leaching menggunakan
H2O untuk memisahkan silikatnya. Kemudian leaching dengan HCl untuk
mengendapkan silikatnya. Reaksinya adalah sebagai berikut:
9 2. Zirkonium (IV) Oksida (ZrO2)
Zirkonium (IV) oksida (ZrO2), kadang-kadang dikenal sebagai zirkonia
adalah kristal putih oksida dari zirkonium. Zirkonium adalah logam putih keabuan yang jarang dijumpai di alam bebas. Zirkon memiliki lambang kimia Zr dan nomor atom 40. Zirkonia atau Zirkonium (IV) oksida (ZrO2) merupakan bahan
semikonduktor keramik yang mempunyai sifat tahan korosi, titik lebur yang sangat tinggi (>2000 °C), dan sensitif terhadap gas oksigen. Sifat-sifat ini membuat ZrO2 banyak dipakai sebagai sensor gas oksigen di industri otomotif.
Zirkonia sebagai oksida murni tidak ditemukan di alam, akan tetapi zirkonia biasa ditemukan dalam baddeleyite dan zirkon (ZrSiO4). Dari kedua sumber zirkonia
tersebut, zirkon yang didapat memiliki kemurnian yang rendah, dan harus melalui proses-proses tertentu untuk menghasilkan zirkonia. Logam zirkonium digunakan dalam teras reaktor nuklir sebagai bahan kelongsong karena tahan korosi pada suhu tinggi dan mempunyai tampang lintang serapan terhadap neutron thermal sangat rendah (0.18-0.2 barn). Selain itu, logam zirkonium mempunyai ketahanan korosi yang besar, baik terhadap konsentrasi asam maupun basa dan pada berbagai suhu. Logam zirkonium mempunyai titik leleh yang tinggi dan mempunyai sifat mudah dibentuk (Muhammad Hedy Saputro, 2011: 12-1).
10
besar. Di dalam proses produksi, konsentrat zirkon pertama kali dibuat dengan mendekomposisi ikatan yang kuat antara silika dan zirkonia dan larut dalam asam.
Proses pembuatan Zirkonium (IV) Oksida adalah
Pengolahan pasir zirkon menjadi kristal ZrO2 dibagi menjadi beberapa
proses, yaitu
1. Peleburan pasir zirkon dengan NaOH padat pada furnace, pada suhu 750 0C
selama 2,5 jam pada tekanan 1 atmosfer dengan perbandingan pasir zirkon: NaOH padat = 1,0 : 1,5.
2. Proses pelindian hasil leburan dengan air, proses ini bertujuan untuk memisahkan hasil leburan yang larut dalam air, sehingga diperoleh padatan yang tidak larut dalam air, yaitu Na2ZrO3.
3. Proses pelindian dengan asam, larutan asam yang digunakan adalah HCl. Sisa padatan hasil lindi air, dilindi dengan HCl untuk memperoleh ZrOCl2 yang
dikenal dengan zirkon oksiklorid.
4. Proses pengendapan menggunakan NH3 0.6 M agar diperoleh endapan
Zr(OH)4 yang berwarna putih.
5. Proses kalsinasi pada suhu 650 0C hingga diperoleh kristal ZrO2.
Bagan alir proses pengolahan pasir zirkon menjadi kristal ZrO2 dapat dilihat
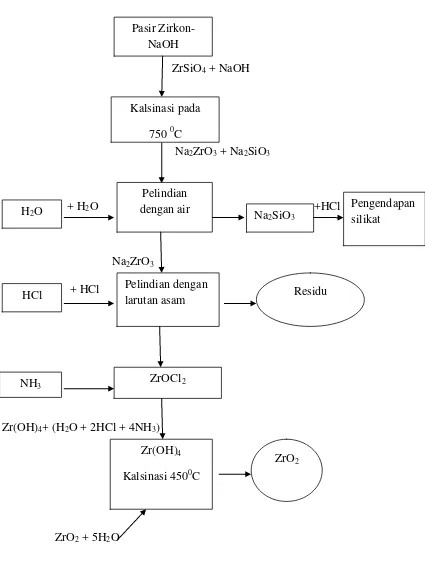
11
ZrSiO4 + NaOH
Na2ZrO3 + Na2SiO3
+ H2O +HCl
Na2ZrO3
+ HCl
Zr(OH)4+ (H2O + 2HCl + 4NH3)
ZrO2 + 5H2O
Gambar 2. Bagan Alir Proses Pengolahan Pasir Zirkon (Dinda Dwi Wulandari, 2013: 60-61)
Na2SiO3
Pasir Zirkon- NaOH
Kalsinasi pada 750 0C
Pengendapan silikat
Pelindian dengan air H2O
Residu Pelindian dengan
larutan asam HCl
NH3 ZrOCl2
ZrO2
Zr(OH)4
12 3. Silika (SiO2)
Kelimpahan silika di kerak bumi berkisar 27,72%. Kelimpahan yang cukup besar tersebut membuatnya menarik untuk dijadikan bahan baku kimia dan fleksibilitasnya mendorong semakin banyak kegunaan untuk dikembangkan melalui penelitian intensif. Silika mempunyai berat molekul 60,08 dan terdiri dari 53,26 % O dan 46,74 % Si. Silika mempunyai sifat-sifat sebagai berikut:
a. Merupakan kristal jernih tidak berwarna b. Mempunyai berat jenis 2,2-2,6
c. Tidak larut dalam air dan asam-asam kecuali asam fluorida (HF) dengan membentuk silikon tetra flourida.
d. Larut dalam leburan alkali
e. Silika mempunyai titik leleh antara 1600 0C – 1750 0C dan akan menyublim pada suhu 1750 0C.
(Ely Kurniati, 2009: 8)
Silika adalah senyawa hasil polimerisasi asam silikat, yang tersusun dari rantai satuan SiO4 tetrahedral dengan formula umum SiO2. Di alam, senyawa
silika ditemukan dalam beberapa bahan alam, seperti pasir, kuarsa, gelas, dan sebagainya. Silika sebagai senyawa yang terdapat di alam berstruktur kristalin, sedangkan sebagai senyawa sintetis adalah amorph (Siti Sulastri dan Susila Kristianingrum, 2010: 211).
SiO2 adalah anhidrat dari asam silikat. Ketika SiO2 dikocok dengan air
13
SiO2 (s) + 2 H2O (g) H4SiO4 (aq)
Kelarutan silika dalam air sangat kecil dan dapat naik pada tekanan dan temperatur yang tinggi, sedangkan konsentrasi larutan asam silikat yang tinggi dapat diperoleh sebagai berikut,
SiCl4 (l) + 4 H2O (l) → H4SiO4 (aq) + 4 HCl (aq)
Atau
Na2SiO3 (aq) + H2O (l) + 2 HCl (aq) → H4SiO4 (aq) + 2 NaCl (aq)
(Ely Kurniati, 2009: 9)
Silika dapat berupa kristal dan amorf. Sifat dari silika bergantung perilaku struktur selama reaksi sintesis. Silika dalam struktur kristal memiliki susunan atom yang lebih teratur daripada silika amorf. Sebagian besar metode yang digunakan untuk memurnikan silika menghasilkan silika amorf sehingga perlu
dilakukan perlakuan lain untuk mengubah strukturnya menjadi kristal (Mashudi, 2015: 32).
Di alam, silika memiliki beberapa bentuk kristal termasuk quartz dan oval.
Silikon (IV) oksida mungkin merupakan salah satu modifikasi kristal yang dikenal sebagai kuarsa. Dua puluh dua fase yang berbeda dari silika telah diidentifikasi. Pada 573 °C yang sering dijumpai α–Quartz berubah menjadi ß-.Quartz yang
memiliki kepadatan rendah. Pada 867 °C ß–Quartz berubah menjadi kristal
modifikasi yang berbeda yaitu β–trydimite. Pada suhu 1470 °C β–tridimit berubah
menjadi β–crystobalit (Idriza Wazamtu, dkk, 2013: 161-162).
14
Tabel 1. Sifat Berbagai Polimer Silika Pada Tekanan Atmosfer Sifat Berbagai Polimer Silika Pada Tekanan Atmosfer
Polimer ∝-Quartz ∝-Tridymite ∝-Cristobalite Sistem Kristal Trigonal Triklinik tetragonal
Sudut Si-O-Si 1440 1400 -
Sistem Kristal Heksagonal Heksagonal Kubus
Sudut Si-O-Si 1530 1800 1510
Pada permukaan silika gel terdapat dua jenis gugus, yaitu gugus silanol dan gugus siloksan. Menurut Morrow dan Gay (2000: 18) dalam Siti Sulastri dan Susila Kristianingrum, (2010: 213), gugus siloksan ada dua macam, yaitu Si-O-Si rantai lurus dan gugus siloksan yang membentuk struktur lingkar dengan empat anggota. Jenis yang pertama tidak reaktif dengan pereaksi pada umumnya, tetapi sangat reaktif terhadap senyawa logam alkali. Jenis gugus siloksan yang membentuk lingkar dengan empat anggota mempunyai reaktivitas yang tinggi, dapat mengadakan kemisorpsi dengan air, amoniak dan metanol. Reaksi dengan air akan menghasilkan dua gugus Si-OH, reaksi dengan amoniak akan menghasilkan gugus Si-NH2 dan silanol, sedangkan reaksi dengan metanol akan
menghasilkan gugus silanol dan Si –O-CH3. Menurut El Shafei (2000: 40) dalam
15
yang berdekatan satu sama lain disebut vicinal silanol atau vicinol, sedangkan dua gugus silanol yang terikat pada satu atom Si disebut geminal silanol atau geminol. Berdasarkan data kristalografi, jarak antar gugus silanol terisolasi adalah sekitar 5 A. Jika jarak antara dua gugus silanol tersebut lebih dari 3,1 A, maka tidak dapat terjadi ikatan hidrogen. Adanya ikatan hidrogen yang kuat antara gugus silanol satu dengan yang lain akan terjadi jika jaraknya kurang dari 3,1 A (antara 2,4 – 2,8 A).Vicinol adalah dua gugus silanol dengan jarak kurang dari 2,8 A.
4. Pelindian
Pelindian adalah suatu cara pemisahan komponen dari suatu campuran padatan (solid) menggunakan pelarut (solvent) tertentu sehingga sebagian zat larut
dan sebagian sebagai ampas (inert). Proses ini dapat dilakukan secara batch, semi batch, dan continue. Reaksi umum yang terjadi selama proses pelindian, sebagai
berikut:
A (padatan) + B (pelarut) → C (larutan) + D (ampas) Pelindian dibagi menjadi 4 jenis yaitu
a. Stasionary Solid Bed, pelindian dilaksanakan dengan padatan diletakkan
dengan posisi tidak bergerak, hanya pelarutnya saja yang mengalir melalui
solid bed, sementara komponen yang mudah larut akan terlarut oleh solvent.
b. Semi Continuous Solid Bed, dimana padatan diletakkan dalam beberapa bak
bertingkat, sementara solvent dialirkan berurutan ke dalam bak-bak tersebut.
c. Moving Solid Bed, dimana padatan yang akan dilindi maupun pelarutnya
bersama-sama bergerak.
16
Faktor-faktor yang mempengaruhi pelindian adalah
a. Luas permukaan, semakin luas permukaan bahan akan menyebabkan meningkatnya interaksi sehingga mempermudah perpindahan massa antara fasa padat dan fasa cair.
b. Kecepatan alir, semakin besar kecepatan alir akan semakin menaikkan frekuensi tumbukan antara molekul-molekul zat pereaksi.
c. Waktu, semakin lama waktu reaksi, maka kesempatan tumbukan antar molekul reaktan semakin besar, shingga hasil yang diperoleh maksimal. d. Suhu, pengaruh suhu tergantung dari panas pelarutan. Bila panas pelarutan
(∆H) negatif, daya larut turun dengan naiknya suhu. Bila panas pelarutan
(∆H) positif, daya larut naik dengan naiknya suhu. Tekanan tidak begitu berpengaruh terhadap daya larut zat padat dan cair, tetapi berpengaruh pada daya larut gas (Sukardjo, 1997: 142).
5. Unsur Pengotor Silika
Penelitian yang dilakukan oleh M.Khalifa,dkk (2012 : 3) mengatakan bahwa pengotor utama (lebih dari 10 mg/kg) di dalam silika alami adalah Al, K, Fe, Na, B, Ca, Mg, dan P. Pengotor dalam jumlah sedikit (kurang dari 1 mg/ kg) adalah Zn, Ni, Cu, dan Cd. Total pengotor dalam silika alami adalah 2379,9 ppm.
a. Kadmium
17
ini melarut dengan lambat dalam asam nitrat encer dan reaksinya adalah sebagai berikut (Vogel, 1979: 235).
Cd (s) + 4HNO3 (aq) → Cd(NO3)2 (aq)+ NO2 (g) + 2H2O (aq)
Penampang lintang kadmium adalah 2.550 barn. Kadmium ditemukan oleh Strohmeyer di tahun 1817 dari impurity (pengotor) dalam seng karbonat.
Kadmium hampir selalu ditemukan dalam jumlah yang kecil dalam bijih-bijih seng, seperti ZnS, CdS merupakan mineral satu-satunya yang mengandung kadmium. Hampir semua kadmium diambil sebagai hasil produksi dalam persiapan bijih-bijih seng, tembaga, dan timbal (Sneed, C.M and Brasted, C.R, 1955: 64).
Kadmium merupakan komponen campuran logam yang memiliki titik cair terendah. Unsur ini digunakan dalam campuran logam poros dengan koefisien gesek yang rendah dan tahan lama. Ia juga banyak digunakan dalam aplikasi sepuhan listrik (electroplating). Kadmium digunakan pula dalam pembuatan
solder, baterai Ni-Cd, dan sebagai penjaga reaksi fisi nuklir. Logam Kadmium ditunjukkan oleh Gambar 3.
Gambar 3. Kadmium
18 b. Kromium
Kromium ditemukan oleh Vauguelin pada tahun 1797 dalam bentuk FeO.Cr2O3. Kromium adalah logam kristalin putih, tidak begitu liat dan tidak
dapat ditempa. Logam kromium ditunjukkan oleh Gambar 4. Kromium merupakan unsur kimia dalam tabel periodik yang memiliki lambang Cr dan nomor atom 24. Kromium melebur pada suhu 1765 0C. Logam ini larut dalam asam klorida encer atau pekat (Vogel, 1979: 270). Penampang lintang kromium adalah 2,9 barn.
Kromium merupakan logam tahan korosi dan dapat dipoles menjadi mengkilat, sehingga kromium banyak digunakan sebagai pelapis pada ornament-ornamen bangunan, komponen kendaraan, maupun sebagai pelapis perhiasan seperti emas. Perpaduan kromium dengan besi dan nikel menghasilkan baja tahan karat (http://id.wiki.detik.com/wiki/Kromium, diakses 15 Juni 2016).
Asam nitrat dapat melarutkan kromium, dan reaksinya adalah sebagai berikut:
Cr (s) + 4HNO3 (aq) → Cr(NO3)3 (aq) + NO (g) + 2H2O (aq)
Logam kromium ditunjukkan oleh Gambar 4.
Gambar 4. Kromium
19 c. Besi
Besi merupakan komponen kerak bumi dengan presentase sekitar 5% yang mempunyai nomor atom 26 dan massa atom relatif 55,847 serta kekerasan 4-5. Besi atau ferrum tergolong unsur logam dengan simbol Fe dan dalam bentuk murni berwarna putih keperakan yang kukuh dan liat, besi melebur pada suhu 1535 0C. Logam ini sangat mudah bereaksi dan mudah teroksidasi membentuk karat. Sifat magnetis besi sangat kuat, dan sifat dalamnya malleable atau dapat
ditempa (Sumber: https://en.wikipedia.org/wiki/Iron, diakses 15 Juni 2016). Logam besi ditunjukkan oleh Gambar 5.
Gambar 5. Besi
(Sumber: https://en.wikipedia.org/wiki/Iron, diakses 15 Juni 2016)
Besi dapat larut dalam asam nitrat pekat yang panas dan membentuk gas nitrogen monoksida, seperti pada reaksi berikut ini:
3Fe (s) + 8HNO3 (aq) → 3Fe(NO3)2(aq) + 2NO (g) + 4H2O (aq)
d Aluminium
20
Gambar 6. Aluminium (Nia Artauli Sinaga, 2014: 4-5).
Aluminium merupakan unsur yang sangat reaktif dan reduktor yang baik. Aluminium bereaksi dengan air dan melepaskan gas H2. Aluminium bersifat
amfoter. Aluminium yang sudah terbuang atau tidak terpakai berpotensi untuk dimanfaatkan kembali, sehingga beberapa pihak mencoba melakukan berbagai percobaan untuk mencari solusi memanfaatkan limbah dari aluminium. Karakteristik aluminium:
1) Logam berwarna putih keperakan dengan sifat ringan, kuat, namun mudah dibentuk.
2) Nomor atom aluminium adalah 13. Aluminium merupakan unsur paling berlimpah ke-3 setelah oksigen dan silikon.
3) Aluminium merupakan konduktor panas dan listrik yang sangat baik, bahkan lebih baik dari tembaga. Logam ini merupakan elemen yang sangat reaktif dan membentuk ikatan kimia yang kuat dengan oksigen.
21 e. Seng (Zn)
Seng (Zn) adalah logam yang putih kebiruan, logam ini sangat mudah ditempa dan liat pada suhu 110-150 oC. Zink melebur pada 410 oC dan mendidih
pada 906 oC. Logamnya yang murni, melarut lambat sekali dalam asam dan dalam alkali, adanya zat-zat pencemar atau kontak dengan platinum atau tembaga, yang dihasilkan oleh penambahan beberapa tetes larutan garam dari logam-logam ini, mempercepat reaksi (Sony, 2009: 9). Zink ditunjukkan oleh Gambar 7.
Gambar 7. Zink (http://www.zinkprijs.eu/, diakses 26 September 2016)
Menurut Vogel (1955: 289-290), zink bereaksi dengan asam nitrat untuk menghasilkan zink nitrat, nitrogen dioksida, dan air yang ditunjukkan persamaan reaksi
Zn (s) + HNO3 (aq)→Zn(NO3)2 (aq) + 2NO2 (g) + 2H2O (aq)
6. Dekomposisi SiO2
Dekomposisi adalah perubahan menjadi bentuk yang sederhana. Pada penentuan kadar unsur pengotor dalam SiO2 dengan metode Spektrofotometri
22
padat menjadi cair sehingga dapat dianalisis dan metode dekomposisi adalah sebagai berikut ini,
a. Bomb Digestion
Bom Digesti asam diperkenalkan oleh Parr pada tahun 1969 untuk menetapkan PTFE (polytetrafluoroethylene). Bom logam model sederhana dan
biaya rendah yang dapat digunakan dengan aman untuk tujuan preparasi sampel secara rutin. Ini diterima secara luas selama bertahun-tahun dengan dibuktikan telah menjadi model yang baik untuk prosedur umum digesti. Suhu dan tekanan tidak di atas 150 0C dan 1200 psi (1 psi= 0,0680 atm). Kadang-kadang dapat digunakan pada suhu di atas 150 0C tetapi akan bertambah sulit untuk menutup bom digesti menjadi rapat pada suhu yang ditinggikan.
Parr bom digesti asam menggunakan PTFE (polytetrafluoroethylene) yang
bersifat inert, tahan terhadap suhu dan tekanan tinggi. Metode bom digesti asam dapat melarutkan sampel lebih cepat dan mempunyai beberapa kelebihan dibandingkan dengan preparasi sampel menggunakan metode konvensional. (Kathryn J. Lamble and Steve J. Hill, 1998: 104).
23
Bom digesti mempunyai beberapa kelebihan, di antaranya: 1) Melarutkan sampel dengan lebih cepat dan efisien.
2) Analisis sampel padat dengan metode ini tidak akan menghilangkan elemen penting yang mudah menguap.
3) Membutuhkan pelarut asam dalam jumlah yang relatif kecil 4) Mencegah kontaminasi dari elemen lain yang tidak diinginkan. b. Pelarut Asam
1. HF (Hidrogen Fluorida)
Hidrogen fluorida adalah senyawa kimia dengan rumus HF. Ini adalah sumber utama industri fluorin, di dalam air membentuk sebagai asam fluorida dan merupakan prekursor untuk senyawa penting, termasuk obat-obatan dan polimer (misalnya teflon). HF secara luas digunakan dalam industri petrokimia dan komponen dari banyak superacids. HF mendidih di bawah suhu kamar, sedangkan
hidrogen halida yang lain mengembun pada temperatur rendah. Berbeda dengan hidrogen lainnya, HF lebih ringan dari udara dan sangat tajam, yang dapat merusak paru-paru (http://en.wikipedia.org/wiki/Hydrogen_fluorida, diakses 15 Juni 2015).
Hidrogen fluorida adalah gas tak berwarna, berasap, bertitik didih rendah (mp -83 0C dan bp 19,5 0C), dengan bau yang mengiritasi. Gas ini biasa
24
asam fluorida dan disimpan dalam wadah polietilen karena asam ini menyerang gelas (http://www.chem-is-try.org/materi_kimia, diakses 15 Juni 2016).
2. HNO3 (Asam Nitrat)
Asam nitrat pertama kali disintesis sekitar 800 M oleh ilmuwan Jabir ibnu Hayyan, yang juga menemukan distilasi modern dan proses kimiawi dasar lainnya yang masih digunakan sekarang ini.
Senyawa kimia asam nitrat (HNO3) adalah sejenis cairan korosif yang tak
berwarna dan merupakan asam beracun yang dapat menyebabkan luka bakar. Larutan asam nitrat dengan kandungan asam nitrat lebih dari 86% disebut sebagai asam nitrat berasap, dan dapat dibagai menjadi dua jenis asam, yaitu asam nitrat berasap putih dan asam nitrat berasap merah.
Asam nitrat murni (100%) merupakan cairan tak berwarna dengan densitas 1.522 kg/m3. Ia membeku pada suhu - 42 0C, membentuk kristal-kristal putih dan mendidih pada 83 0C. Ketika mendidih, terdapat dekomposisi sebagian dengan
pembentukan nitrogen dioksida sesudah reaksi:
4 HNO3 (aq) 720C 2 H2O (aq) + 4 NO2 (aq) + O2 (g)
Hal ini berarti bahwa asam nitrat anhidrat sebaiknya disimpan di bawah 0 0C untuk menghindari penguraian. Nitrogen dioksida (NO2) tetap larut dalam asam
nitrat yang membuatnya berwarna kuning, atau merah pada suhu yang lebih tinggi. Asam dengan nitrogen dioksida terlarut mengeluarkan uap berwarna coklat kemerah-merahan, yang membuatnya dijuluki “asam berasap merah” atau “asam
25
Seperti asam pada umumnya, asam nitrat bereaksi dengan alkali, oksida basa, dan karbonat untuk membentuk garam, seperti ammonium nitrat. Asam nitrat memiliki sifat mengoksidasi sehingga asam nitrat pada umumnya tidak menyumbangkan protonnya (tidak membebaskan hidrogen) pada reaksi dengan logam dan garam yang dihasilkan biasanya berada dalam keadaan teroksidasi yang lebih tinggi (Sumber: http://id.wikipedia.org/wiki/Asam_nitrat, diakses 15 Juni 2016)
3. Air Raja (Aqua regia)
Air raja adalah larutan yang dibuat dari pencampuran asam klorida pekat dan asam nitrat pekat dengan perbandingan volume asam klorida dan asam nitrat 3:1,
6 HCl (aq) + 2 HNO3 (aq) → 2 NO (g) + 3 Cl2 (g) + 4 H2O (aq)
Larutan ini bersifat sangat korosif, mengeluarkan uap berwarna kuning. Hanya larutan inilah yang sanggup melarutkan emas dan platina (logam-logam yang paling mulia), sehingga disebut sebagai air raja. Sifatnya yang kurang stabil, maka larutan ini baru dibuat jika akan dipakai (http://id.wikipedia.org/wiki/Aqua_regia, diakses 15 Juni 2016).
7. Spektroskopi FTIR
26
cm-1 hingga 10 cm-1. Daerah inframerah sedang (4000-400 cm-1) berkaitan dengan transisi energi vibrasi dari molekul yang memberikan informasi mengenai gugus-gugus fungsi dalam molekul tersebut. Daerah inframerah jauh (400-10 cm-1) bermanfaat untuk menganalisis molekul yang mengandung atom-atom berat seperti senyawa anorganik, namun membutuhkan teknik khusus yang lebih baik. Daerah inframerah dekat (12500-4000 cm-1) yang peka terhadap vibrasi overtone
(Schechter,1997).
Pada temperatur di atas temperatur nol absolut, semua atom di dalam molekul bervibrasi antara satu dengan lainnya. Ketika frekuensi dari vibrasi spesifik sama dengan frekuensi dari radiasi inframerah yang mengenai langsung pada molekul, molekul tersebut akan menyerap radiasi.
Syarat suatu gugus fungsi dalam suatu senyawa dapat terukur pada spektra IR adalah adanya perbedaan momen dipol pada gugus tersebut. Vibrasi ikatan akan menimbulkan fluktusi momen dipol yang menghasilkan gelombang listrik. Pengukuran menggunakan IR biasanya berada pada daerah bilangan gelombang 400-4500 cm-1. Daerah pada bilangan gelombang ini disebut daerah IR sedang dan merupakan daerah optimum untuk penyerapan sinar IR bagi ikatan-ikatan dalam senyawa organik.
Suatu ikatan kimia dapat bervibrasi sesuai dengan level energinya sehingga memberikan frekuensi yang spesifik. Hal itulah yang menjadi dasar pengukuran spektroskopi FTIR. Jenis vibrasi terdiri dari 2 macam yaitu vibrasi ulur dan vibrasi tekuk. Vibrasi ulur terdiri dari symmetrical stretching, asymmetrical,
27
twisting. Daerah inframerah dibagi menjadi tiga sub daerah yaitu inframerah dekat
(14000-4000cm-1), inframerah sedang (4000-400 cm-1) dan inframerah jauh (400-10 cm-1) (Ellis, D.I.,2006).
Tabel 2. Rentang Panjang Gelombang dan Jenis Ikatan Berdasarkan Hasil Menggunakan Spektrofotometri Inframerah
Rentang (Cm-1) Jenis Ikatan
3700-2500 Ikatan Tunggal ke Hidrogen
2300-2000 Ikatan Rangkap Tiga
1900-1500 Ikatan Rangkap Dua
1400-650 Ikatan Tunggal Selain ke Hidrogen Ikatan Tunggal ke
Hidrogen
Jenis Ikatan Bilangan Gelombang
(cm-1) Keterangan
C-H 3000-2850 alkana jenuh
=C-H 3100-3000 alkana tak
jenuh atau aromatik
O=C-H 2800-2700 aldehid, dua
puncak lemah
O-H 3400-3000 alkohol, air,
fenol
O-H bebas 3600
N-H 3450-3100 amina
Rangkap Dua C=O 1840-1800 dan
1780-1740 anhidrida Rangkap Tiga C rangkap tiga 2260-2120 C-N rangkap tiga 2260-2220
28
b. Digunakan untuk identifikasi gugus fungsi tertentu dari suatu molekul
c. Spektrum inframerah dapat mengidentifikasi senyawa bersifat unik dapat digunakan sebagai sidik jari dari senyawa tersebut (Febrinaldo, 2008: 3-4). 8. Difraktometer Sinar - X
Komponen dasar XRD ada tiga yaitu sumber sinar-X, material contoh yang diuji, dan detektor sinar-X. Alat difraktometer sinar-X ditunjukkan oleh Gambar 8.
Gambar 8. Difraktometer Sinar-X
a. Sinar -X
1. Prinsip Kerja Difraktometer Sinar-X
29
Gambar 9. Ilustrasi Transisi Elektronik dalam Sebuah Atom
Gambar 10 menunjukkan difraksi sinar-X oleh atom-atom pada bidang atom parallel a dan al yang terpisah oleh jarak d. Dianggap bahwa dua berkas sinar-X il dan i2 yang bersifat parallel, monokromatik dan koheren dengan panjang gelombang� datang pada bidang dengan sudut �. Jika kedua berkas sinar tersebut berturut-turut terdifraksi oleh M dan N menjadi il’ dan i2’ yang masing-masing membentuk sudut � terhadap bidang dan bersifat parallel, monokromatik dan koheren, perbedaan panjang antara il-M-il’ dengan i2-N-i2’ adalah sama dengan n kali panjang gelombang maka persamaan difraksi dapat dituliskan sebagai berikut,
n = ON + NP atau
n = d sin �+ d sin � = 2d sin �
Gambar 10. Difraksi Sinar-X Oleh Atom-Atom Pada Bidang Persamaan tersebut dikenal sebagai Hukum Bragg, dengan n adalah bilangan
material-30
material benda dan serbuk, dan untuk menganalisis sifat-sifat struktur (seperti ukuran butir, fasa komposisi orientasi kristal, dan cacat kristal) dari setiap fasa. Metode ini menggunakan sebuah sinar-X yang terdifraksi seperti sinar yang direfleksikan dari setiap bidang, berturut-turut dibentuk oleh atom-atom kristal dari material tersebut menggunakan berbagai sudut timbul, pola difraksi yang terbentuk menyatakan karakteristik dari sampel. Susunan ini diidentifikasi dengan membandingkannya dengan sebuah data base internasional yang disebut
International Centre for Diffraction Data (Jamaluddin, 2010: 7).
2. Pembangkitan Sinar-X
Sinar-X dihasilkan dari penembakan target (logam anoda) oleh elektron
berenergi tinggi yang berasal dari hasil pemanasan filamen dari tabung sinar-X. Tabung sinar-X tersebut terdiri atas empat komponen utama yakni filament (katoda) yang berperan sebagai sumber elektron, ruang vakum sebagai pembebas
hambatan, target sebagai anoda, dan sumber tegangan listrik.
Gambar 11. Komponen Pada Tabung Sinar-X
31
lain, kemudian pada tabung diberi sumber listrik untuk memanaskan katoda hingga lebih dari 200 0C sampai menyala dengan cara mengantarkan listrik dari transformator, karena panas, maka elektron-elektron dari katoda terlepas dengan memberikan tegangan tinggi sehingga elektron-elektron dipercepat gerakannya menuju anoda (target). Elektron yang bergerak dengan kecepatan tinggi dikarenakan ada beda potensial yang mengenai target anoda. Elektron tiba-tiba akan mengalami perlambatan saat mendekati target karena pengaruh gaya inti atom sehingga menimbulkan Sinar-X yang mana dinamakan Sinar-X Brehmsstrahlung. Elektron-elektron mendadak dihentikan pada anoda (target) sehingga terbentuk panas (99%) dan Sinar-X (1%). Sinar X akan keluar dan diarahkan dari tabung melalui jendela yang disebut diafragma, panas yang ditimbulkan pada target (sasaran) akibat benturan elektron dihilangkan dengan
cooling mechanism
(http://www.medrec07.com/2015/02/proses-terjadinya-sinar-x.html, diakses pada 17 September 2016).
Logam yang digunakan sebagai target harus memiliki titik leleh tinggi dengan nomor atom yang tinggi agar tumbukan lebih efektif untuk menghasilkan sinar-X yang baik. Logam yang biasa digunakan sebagai target (anoda) adalah
Cu, Cr, Fe, Co, Mo, dan Ag. 3. Karakteristik Sinar-X
32
proses ini mempunyai energi yang sama dengan selisih energi antara kedua tingkat energi elektron tersebut, karena setiap jenis atom memiliki tingkat-tingkat energi elektron yang berbeda-beda maka sinar-X yang terbentuk dari proses ini disebut karakteristik sinar-X.
Karakteristik sinar-X terjadi karena elektron yang berada pada kulit K terionisasi sehingga terpental keluar. Kekosongan kulit K ini segera diisi oleh elektron dari kulit terluarnya. Jika kekosongan pada kulit K diisi oleh elektron dari kulit L, maka akan dipancarkan karakteristik sinar-X K . Jika kekosongan itu diisi oleh elektron dari kulit M, maka akan dipancarkan karakteristik sinar-X Kβ
dan seterusnya
4. Material Uji (spesimen)
Material uji (spesimen) dapat digunakan bubuk biasanya 1 mg. 5. Detektor
Sebelum Sinar-X sampai ke detektor melalui proses optik. Sinar-X yang
panjang gelombang dengan intensitas I mengalami refleksi dan menghasilkan
sudut difraksi 2�. Jalannya sinar-X diperlihatkan oleh Gambar 11. berturut-turut sebagai berikut: (1). Sumber sinar-X (2) Celah soller (3) Celah penyebar (4) Spesimen (5) Celah anti menyebar (6) Celah penerima (7) Celah soller dan (8) Detektor.
Jalannya Sinar X hingga sampai ke detektor adalah sebagai beriku, 1. Sinar-X monokromatik dipancarkan dari tabung sinar-X.
2. Sinar tersebut melewati celah soller.
33
4. Sinar monokromatik tersebut mengenai sampel.
5. Pantulan sinar yang mengenai sampel keluar melalui celah anti menyebar. 6. Selanjutnya sinar melewati celah penerima.
7. Diteruskan ke celah soller.
8. Sinar yang melalui celah soller tersebut dibelokkan menggunakan
monokromator grafit.
9. Sinar ditangkap oleh detektor melalui celah detektor.
Gambar 12. Jalannya Sinar-X (Anisa Nurdina, 2016: 21) b. Skema dan Prinsip Kerja Alat Difraktometer Sinar-X
34
Gambar 13. Difraksi Sinar-X Serbuk
Sinar-X tersebut menembak sampel padatan kristalin, kemudian mendifraksikan sinar ke segala arah dengan memenuhi Hukum Bragg. Detektor bergerak dengan kecepatan sudut yang konstan untuk mendeteksi berkas sinar-X yang didifraksikan oleh sampel. Sampel serbuk atau padatan kristalin memiliki bidang-bidang kisi yang tersusun secara acak dengan berbagai kemungkinan orientasi, begitu pula partikel-partikel kristal yang terdapat di dalamnya. Setiap kumpulan bidang kisi tersebut memiliki beberapa sudut orientasi sudut tertentu, sehingga difraksi sinar-X memenuhi Hukum Bragg:
�� = 2d sin �
Keterangan; nμ orde difraksi (1,2,3,….)
Λμ Panjang sinar-X d: Jarak kisi
�: Sudut difraksi
35
Pola difraktogram yang dihasilkan berupa deretan puncak-puncak difraksi dengan intensitas relatif bervariasi sepanjang nilai 2� tertentu. Besarnya intensitas relatif dari deretan puncak-puncak tersebut bergantung pada jumlah atom atau ion yang ada, dan distribusinya di dalam sel satuan material tersebut. Pola difraksi setiap padatan kristalin sangat khas, yang bergantung pada kisi kristal, unit parameter dan panjang gelombang sinar-X yang digunakan. Dengan demikian, sangat kecil kemungkinan dihasilkan pola difraksi yang sama untuk suatu padatan kristalin yang berbeda (Jamaluddin, 2010: 8-9).
9. Spektroskopi Serapan Atom (SSA)
Spektroskopi serapan atom adalah teknik analisis untuk mengukur konsentrasi elemen. Spektroskopi serapan atom sangat sensitif karena dapat
mengukur hingga ke bagian per miliar gram (μg/dm-1) di dalam sampel.
Spektroskopi serapan atom memiliki banyak kegunaan selain pada bidang kimia. Pada analisis klinis, digunakan untuk menganalisis logam pada cairan biologi seperti darah dan urin. Pada analisis lingkungan digunakan untuk pemantauan lingkungan misalnya untuk mengetahui kadar unsur di dalam sungai, air laut, air minum, udara, bensin, dan minuman. Spektroskopi serapan atom juga digunakan dalam bidang farmasi, proses manufaktur, dan industri.
Terdapat lima bagian utama pada alat spektrofotometer serapan atom yaitu: a. Sumber radiasi yaitu bagian untuk menghasilkan sinar yang energinya dapat
36
b. Sistem pengatoman yaitu bagian yang menghasilkan atom-atom bebas, karena pada blok ini, senyawa yang akan dianalisis diubah bentuknya dari bentuk ion menjadi bentuk atom-atom bebas.
c. Monokromator yaitu bagian yang berfungsi untuk mengubah radiasi polikromatis menjadi radiasi monokromatis. Radiasi monokromatis akan diabsorbsi oleh atom bebas dari penguapan larutan sampel.
d. Detektor berfungsi mengubah energi radiasi yang jatuh pada detektor menjadi sinyal elektrik.