PEMISAHAN DAN PEROLEHAN KEMBALI ION LOGAM TIMBAL(II) MENGGUNAKAN ASAM LEMAK HIDROKSAMIK DARI SINTESIS MINYAK INTI
BIJI KETAPANG (Terminalia cattapa) YANG DIIMMOBILISASI DALAM ZEOLIT NASRUDIN
Program Studi Kimia, Fakultas MIPA, Universitas Mataram Email : Nazbilt@gmail.com
Abstrak
Indonesia kaya akan sumber daya alam mineral, sehingga potensial untuk industri pertambangan. Sebagian besar Industri pertambangan tersebut merupakan pertambangan emas rakyat tanpa izin (PETI). Aktivitas ini menimbulkan permasalahan berupa limbah logam berat yang berbahaya yang dibuang langsung lingkungan. Salah satu limbah logam berat terseut adalah timbal (Pb). Timbal dapat menyebabkan kerusakan jaringan pada tubuh dan mengganggu proses fotosintesis tumbuhan. Oleh karenanya dibutuhkan solusi yang tepat untuk menanggulangi permasalahan tersebut. Salah satunya adalah penggunaan metode immobilisasi chelating agent menggunakan asam lemak hidrosamik yang dimmobilisasi ke dalam zeolit untuk menyerap logam timbal. Selain itu digunakan metode ekstraksi padat-cair untuk perolehan kembali dan pemisahan logam timbal dengan logam lain seperti Kadmium (Cd) dan Zink(Zn). Hasil penelitian menunjukkan kondisi optimum untuk pemisahan dan perolehan kembali ion logam Pb2+ pada konsentrasi asam lemak hidrosamik (FHA) 200 ppm dan massa zeolit 0,25 gram dengan daya jerap optimum 5,056 mg/gr dengan proses penyerapan zeolit terhadap FHA mengikuti model isotherm adsorbsi Freundlich. Waktu kontak 7 jam dengan daya jerap optimum 160 mg/gr, pH ion logam Pb2+ = 3 dengan daya jerap optimum 169,64 mg/gr dan konsentrasi ion logam Pb2+ 1200 ppm dengan daya jerap optimum sebesar 204,64 mg/gr dengan proses penyerapan FHA-zeolit terhadap ion logam Pb2+ mengikuti model isotherm adsorbsi Freundlich. Dari hasil ekstraksi padat-cair diperoleh hasil serapan ion logam Pb2+ oleh FHA-zeolit sebesar 1195,5 ppm atau 94,6% dengan hasil recovery sebesar 1085,95 ppm atau 98.78% dan pemisahan ion logam Pb2+ dengan ion logam yang lain sebesar 227,7 ppm atau 19,04%. Nilai dari faktor pemisahan menunjukkan ion logam Pb(II) hanya terpisah sebagian dengan ion logam Cd(II) danZn(II). Faktor pemisahan antara ion logam Pb(II) dengan ion logam Cd(II) sebesar 0,43 dan antara ion logam Pb(II) dengan ion logam Zn(II) sebesar 0,34.
Kata kunci : Industri pertambangan, timbal, asam lemak hidroksamik, immobilisasi chelating agent, zeolit, ekstraksi padat-cair.
A. PENDAHULUAN
Dibeberapa lokasi di Indonesia terkandung emas dengan kadar yang sangat kecil sehingga tidak memungkinkan dilakukan proses pertambangan secara modern. Oleh karena itu, proses pertambangan emas dilakukan secara tradisional oleh masyarakat seperti misalnya di daerah Sekotong Lombok Barat, dimana yang diambil hanya emas sedangkan mineral-mineral lain yang berasosiasi dengan emas dibuang begitu saja dan menjadi limbah berbahaya terhadap lingkungan terutama logam timbal. Adanya aktivitas masyarakat seperti penambangan liar, membuat kadar logam berat timbal bisa berjumlah 300 kali lebih banyak dari yang terdapat secara alami (Rahayu, 2013). ) Seseorang yang terpapar timbal dengan dosis yang tinggi , menyebabkan kerusakan jaringan tubuh pada manusia. Sedangkan pada tumbuhan, menyebabkan berkurangnya kadar klorofil daun, sehingga proses fotosintesis terganggu, selanjutnya berakibat pada berkurangnya hasil produksi dari suatu tumbuhan. Oleh karena itu, dibutuhkan solusi untuk mengatasi masalah pencemaran logam timbal tanpa menimbulkan masalah baru dengan memanfaatkan limbah tersebut menjadi sesuatu yang bermanfaat. Salah satunya adalah penggunaan metode immobilisasi chelating agent menggunakan asam lemak hidrosamik dari minyak inti biji ketapang ( yang dimmobilisasi ke dalam zeolit untuk menyerap logam timbal. Selain itu digunakan metode ekstraksi padat-cair untuk perolehan kembali dan pemisahan logam timbal dengan logam lain.
B. LANDASAN TEORI
dengan konsentrasi antara 0,16-1,25 mg/l. Ion timbal (II) merupakan salah satu ion logam berat berbahaya karena dapat terakumulasi dalam tubuh mahluk hidup dan dapat mencemari lingkungan di daerah pertambangan (Chongprasith et al., 1999). Jadi, pengolahan terhadap limbah ion timbal (II) yang terbuang tersebut sangat perlu dilakukan daripada harus membuangnya secara sia-sia sehingga pada akhirnya tidak menimbulkan pencemaran lingkungan yang lebih parah.
Logam Pb dapat masuk ke dalam tubuh melalui pernapasan, makanan, dan minuman. Logam Pb tidak dibutuhkan oleh manusia, sehingga bila makanan tercemar oleh logam tersebut, timbal dapat menghambat aktivitas enzim yang terlibat dalam pembentukan hemoglobin dan sebagian kecil timbal dieksresikan lewat urin atau feses karena sebagian terikat oleh protein, sedangkan sebagian lagi terakumulasi dalam ginjal, hati, kuku, jaringan lemak, dan rambut (Widowati, 2008). Pada jaringan atau organ tubuh, timbal juga akan terakumulasi pada tulang, karena logam ini dalam bentuk ion Pb2+ mampu menggantikan keberadaan ion Ca2+ (kalsium) yang terdapat dalam jaringan tulang(Palar, 2004).
Asam lemak hidroksamik merupakan agen pengkelat (chelating agent) turunan hidroksilamin dan asam karboksilat, sehingga asam lemak hidroksamik disebut juga dengan N-hidroksi amida karboksilat, dengan rumus umun R-CO-NH-OH dimana R = alkyl atau aril (Suhendra et al., 2005 dan 2006). Kompleks antara asam hidroksamik dengan berbagai ion logam banyak digunakan untuk keperluan kimia analitik yaitu sebagai reagen pada penentuan logam secara gravimetri dan spektrometri (Pacco, 2008), sebagai sensor kimia dalam penentuan logam-logam renik (Isha et al., 2007), dan untuk mengekstrak ion-ion logam dari larutan (Suhendra et al., 2005 dan 2006).
Kegunaan zeolit didasarkan atas kemampuannya melakukan pertukaran ion (ion excangher), adsorpsi (adsorption) dan katalisator (catalyst). Zeolit memiliki bentuk kristal yang sangat teratur dengan rongga yang saling berhubungan ke segala arah yang menyebabkan luas permukaan zeolit sangat besar sehingga sangat baik digunakan sebagai adsorben (Sutarti dan Rachmawati, 1994).
Metode immobilisasi chelating agent biasanya dikenal dengan ekstraksi padat-cair. Kelebihan ekstraksi padat-cair dari ekstraksi cair-cair adalah proses ekstraksi lebih sempurna, pemisahan analit dari pengganggu yang mungkin ada menjadi lebih efisien sehingga untuk memperoleh recovery yang tinggi (>99%) pada ekstraksi padat-cair lebih mudah dibandingkan dengan ekstraksi cair-cair, mengurangi pelarut organik yang digunakan, fraksi analit yang diperoleh lebih mudah dikumpulkan, mampu menghilangkan partikulat, dan lebih mudah diotomatisasi (Lansida, 2010).
C. METODELOGI Alat dan Bahan
Alat-alat yang digunakan : Gelas kimia, labu takar 250 mL, erlenmeyer, rotary evaporator, sokhlet, magnetic stirrer-pemanas, magnetic bar, shaker, kolom vakum, timbangan digital, statif-klem, pH meter digital, kromatografi kolom, FTIR, UV-Vis, AAS.
Cara kerja
1. Ekstraksi minyak inti biji ketapang
Inti biji ketapang yang sudah diblender ditimbang sebanyak 60 gram, kemudian dibungkus dengan kertas saring dan dimasukkan kedalam alat sokhlet selama 6 jam dengan 250 ml pelarut n-heksan. Untuk memisahkan minyak dari pelarutnya, hasil ekstraksi kemudian diuapkan untuk menghilangkan pelarut n-heksan dengan rotary evaporator pada suhu 40 oC dengan kecepatan 110 rpm. Minyak yang diperoleh kemudian ditimbang untuk ditentukan kadarnya dan selanjutnya ditambahkan natrium sulfat anhidrat untuk menghilangkan kadar airnya.
2. Uji KLT
Eluen yang digunakan yaitu dietileter : n-heksana (13:87) yang didiamkan selama kurang lebih 15 menit supaya jenuh. Kemudian sampel minyak ketapang dan standar ditotolkan tepat pada garis awal plat KLT dan dimasukkan kedalam chamber yag berisi eluen yang telah jenuh. Kemudian setelah eluen sampai pada garis batas KLT, langkah selanjutnya yaitu mengeringkan plat KLT dan dimasukkan kedalam botol iodine selama 1 menit. Setelah itu diamati spot yang terbentuk dibawah sinar UV dan dihitung nilai Rf nya.
3. Sintesis Asam Lemak Hidroksamik
Sebanyak 5 gram minyak inti biji ketapang , 0,1 gram hidroksilamin dan 0,075 gr katalis enzim lipase dimasukkan kedalam Erlenmeyer kemudian campuran distirer pada suhu ruangan selama 25 jam.Sebelum mereaksikan reaktan tersebut terlebih dahulu hidroksilamin hidroklorida dilarutkan dengan air (aquades) sedangkan minyak dilarutkan dengan n-heksan (Knochel, 1999)
4. Karakterisasi a. Analisis FTIR
Analisis kualitatif dari gugus fungsi asam hidroksamik yang terbentuk dilakukan dengan mengukur spektrum FTIR dengan menggunakan pelet KBr. Spektrum yang diperoleh kemudian dibandingkan dengan spektrum FTIR sampel minyak ketapang sehingga diperoleh perbedaan spektrum yang menandakan asam lemak hidroksamik telah berhasil disintesis dari minyak ketapang
b. Penentuan jumlah nitrogen total
Ditimbang 0,5 gram asam lemak hidroksamik dan dimasukkan ke dalam labu Kjeldahl. Asam lemak hidroksamik tersebut kemudian ditambahkan 2 gram Na2SO4−CuSO4 (20:1) dan 5 mL H2SO4 pekat dan dipanaskan pada pemanas listrik sampai terbentuk larutan berwarna biru jernih (destruksi). Hasil destruksi yang sudah dingin kemudian ditambahkan 150 mL aquades, 25 mL NaOH 40% dan 3 biji batu didih dan dilakukan destilasi. Destilat ditampung sampai volume 150 mL pada erlenmeyer yang berisi 10 mL asam borat 2% yang sudah diberi indikator campuran. Destilat kemudian dititrasi denganH2SO4 0,1N sampai titik ekivalen yang ditandakan dengan berubahnya warna indikator. Dibuat juga blangko dengan perlakuan yang sama seperti sampel
Zeolit yang sudah ada di panaskan dalam tanur selama 2 jam dalam suhu 4500C untuk memperbesar permukaan zeolit
6. Tahap persiapan Immobilisasi
a. Pengaruh FHA terhadap daya jerap zeolit
Sebanyak 0,5 g Zeolit dikocok dengan 20 mL FHA dalam methanol pada 35 rpm selama 12 jam (konsentrasi FHA berada dalam kisaran 50-250 ppm). Serapan FHA dalam Zeolit diukur secara spektrofotometri. Larutan FHA sebelum dan setelah dikocok dengan Zeolit, ditambahkan dengan 1 tetes larutan Besi 0,1M dalam HCl 0,01M. Kemudian, absorbansi diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimumnya (515 nm) untuk kalkulasi besarnya kapasitas serapan resin.
b. Pengaruh massa zeolit untuk daya jerapnya terhadap FHA
Dimasukkan zeolit kedalam larutan FHA dengan perbandingan massa yang bervariasi (0,25 ; 0,5 ; 0.75 ; 1,00 ; 1,25) gram kemudian dikocok selama 12 jam pada 35 rpm. Serapan FHA dalam Zeolit diukur secara spektrofotometri. Larutan FHA sebelum dan setelah dikocok dengan Zeolit, ditambahkan dengan 1 tetes larutan Besi 0,1M dalam HCl 0,01M. Kemudian, absorbansi diukur menggunakan spektrofotometer UV-Vis untuk kalkulasi besarnya daya jerap zeolit.
c. Tahap immobilisasi
Tahap immobilisasi FHA kedalam zeolit dilakukan dengan pembuatan larutan FHA dalam metanol dengan konsentrasi 200 ppm sebanyak 20 ml kemudian ditambahkan 0.25 gr zeolit dan di shake selama 12 jam menggunakan water shaker. FHA-Zeolit yang didapatkan kemudian disaring dan disimpan pada suhu kurang lebih 50C.
7. Tahap optimalisasi daya jerap terhadap io logam Pb2+ 1. Pengaruh waktu kontak
Sebanyak 0.1 gr FHA-Zeolit dimasukkan dalam larutan Pb(II)1000ppm sebanyak 20 ml dan dikocok dalam shaker pada 100 rpm dengan variasi waktu 3, 5, 7 dan 9 jam. Serapan logam Pb (II) pada masing-masing varian waktu kemudian diukur dengan AAS.
2. Pengaruh pH ion logam Pb2+
Pengaruh pH ini ditentukan oleh teknik kesetimbangan kontinu.Sebanyak 20 ml ion logam standar Pb(II) 1000 ppm dikocok dengan 100 mg FHA-zeolit selama 7 jam untuk memastikan kesetimbangan tercapai pada semua kondisi. Untuk pH dari larutan ion logam diatur antara 2-6 dengan larutan HCl 0,1 M dan larutan NaOH 0,1 M sebelum dikocok. Untuk melihat perbedaan serapan antara yang dikocok (inisial) dengan yang tidak dikocok (finish) maka dibuat dua larutan yang berbeda dengan volume yang sama. Setelah setimbang, konsentrasi ion dalam larutan ditentukan menggunakan AAS untuk kalkulasi besarnya kapasitas serapan.
3. Pengaruh konsentrasi ion Pb2+
Untuk melihat perbedaan serapan antara yang dikocok (inisial) dengan yang tidak dikocok (finish) maka dibuat dua larutan yang berbeda dengan volume yang sama. Setelah setimbang, konsentrasi ion dalam larutan ditentukan menggunakan AAS untuk kalkulasi besarnya daya jerap FHA-zeolit terhadap ion logam Pb(II).
8. Tahap ekstraksi padat-cair
Sebanyak 4 g FHA-Zeolit dimasukkan kedalam sebuah kolom dengan diameter dalam 3 cm dan tinggi 10 cm. Kemudian sebanyak 60 mL larutan campuran yang mengandung ion logam Zn(II), Pb(II), dan Cd(II) dengan konsentrasi masing-masing 1200 ppm, dikondisikan pada pH 3 dan didiamkan selama 7 jam didalam kolom. kemudian dilewatkan melewati kolom dengan kecepatan alir 0,25mL/menit. Konsentrasi ion Pb(II) sebelum dan setelah melewati kolom ditentukan menggunakan AAS untuk kalkulasi persentase serapan ion logam Pb(II).
9. Tahap recovery (perolehan kembali)
Pemisahan kembali ion Pb (II) pada kolom dilakukan dengan menggunakan larutan HNO3 10 % sebagai eluen. Sebanyak 120 ml Asam nitrat dilewatkan melalui kolom yang mengandung FHA-Zeolit-ion logam (Zn, Pb, Cd) dengan kecepatan alir 0,25 mL/menit. Setiap urutan fraksi (20 mL) yang diperoleh, ditampung secara otomatis menggunakan pengumpul fraksi. Konsentrasi masing-masing ion logam (Cd, Pb, Zn) setelah pemisahan ditentukan menggunakan AAS dengan lampu katoda dari masing-masing logam (Pb, Cd, Zn) untuk kalkulasi persentase pemisahan.
D. HASIL DAN PEMBAHASAN a. Kadar minyak inti biji ketapang
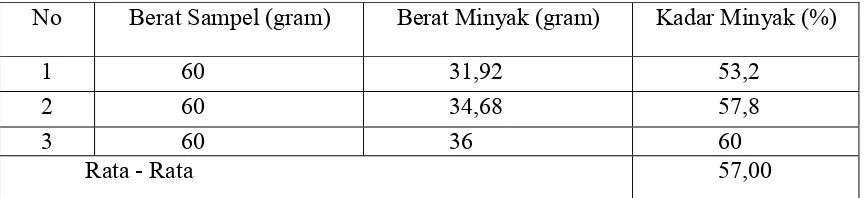
Tabel 1 rata-rata kadar minyak ketapang
Dalam penentuan kadar minyak yang diperoleh dari ekstraksi dengan metode sokletasi sebesar 57% dari 60 gam berat biji kering yang telah dihaluskan. Kadar minyak yang diperoleh ini lebih kecil dari kadar minyak yang diperoleh oleh Rahayu dkk. (2012) yaitu sebesar 57.7 %. Hal ini dipengaruhi oleh kondisi geogafis tempat tumbuhnya tanaman yang mengakibatkan terjadinya perbedaan rendemen minyak (Manzoor dkk., 2007).
b. Uji KLT
Tabel 2 nilai Rf minyak biji ketapang dan standar VCO
R substansi (cm) R Pelarut (cm) Nilai Rf (cm)
VCO (standar) 5,28 8 0,66
Ketapang (sampel) 5,12 8 0,64
No Berat Sampel (gram) Berat Minyak (gram) Kadar Minyak (%)
1 60 31,92 53,2
2 60 34,68 57,8
3 60 36 60
Berdasarkan spot yang diperoleh, didapatkan nilai Rf dari minyak inti buah ketapang hampir sama dengan Rf dari standar berturut-turut 0,82 dan 0,80. Hal ini menunjukkan bahwa komposisi trigiserida dari minyak inti biji ketapang hampir sama dengan standar VCO.
c. Hasil analisis FTIR asam lemak hidroksamik
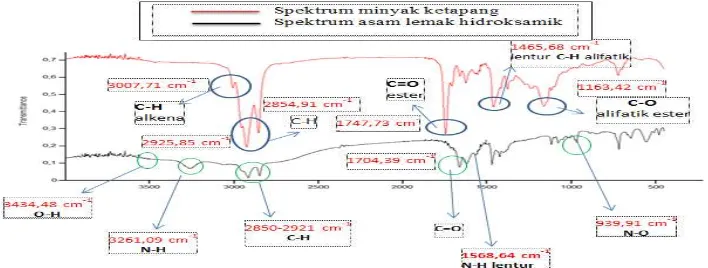
Pada spektrum minyak inti biji ketapang dapat dilihat bahwa terdapat serapan khas antara lain pada bilangan gelombang 2925,85 cm-1 dan 2854,91 cm-1 terdapat regangan C-H rantai alkil alifatik panjang yang didukung oleh serapan lentur C-H alifatik pada 1465,68 cm-1. Pada bilangan gelombang 1747,73 cm-1 terdapat serapan yang dimiliki oleh regangan C=O ester (Suhendra dkk., 2005), serapan ini didukung serapan C-O alifatik ester pada 1163,42 cm-1. Selain itu juga pada bilangan gelombang 3007,71 cm-1 merupakan serapan C-H alkena (C=C-H) yang menandakan adanya ikatan rangkap karbon-karbon (ketidakjenuhan) minyak ketapang, Dibandingkan dengan spektrum minyak ketapang, pada spektrum asam lemak hidroksamik terlihat banyak perbedaan. Pada spektrum sampel tersebut terlihat serapan khas asam hidroksamik yaitu pada 3434,48 cm-1 merupakan regangan O-H, dan pada bilangan gelombang 3261,09 cm-1 terdapat regangan N-Hdan didukung serapan N-H lentur pada 1568,64 cm-1 . Sedangkan pada bilangan gelombang 2921 cm-1 dan 2850 cm-1 terdapat regangan C-H rantai alkil alifatik panjang (Suhendra dkk., 2005). Selain itu juga terlihat serapan regangan C=O pada 1704,39 cm-1 (Yunus dkk, 2010) dan pada bilangan gelombang 939,91 cm-1 merupakan serapan regang N-O yang sebelumnya tidak terlihat pada spektrum FT-IR minyak ketapang (Stuart, 2004).
Gambar 1 Hasil FTIR minyak ketapang dengan asam lemak hidroksamik
d. Penentuan pengaruh konsentrasi FHA terhadap daya jerap zeolit
Gambar 2 Pengaruh konsentrasi FHA terhadap daya jerap zeolit
e. Pengaruh Massa Zeolit Untuk Daya Jerapnya Terhadap FHA
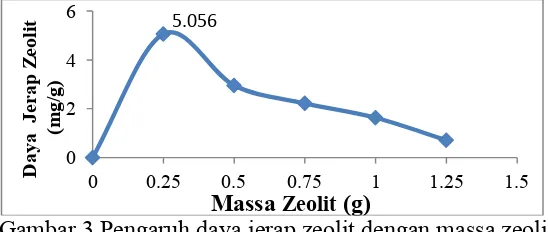
Gambar 3 terlihat bahwa daya jerap zeolit tertinggi yaitu pada massa zeolit 0.25 g. Dan semakin turun dengan bertambahnya massa zeolit. Hal ini dikarenakan pada konsentrasi yang sama yaitu 200 ppm dengan massa yang berbeda menyebabkan daya jerap tertinggi berada pada massa zeolit terkecil. Karena daya jerap zeolit diperoleh dari perbandingan konsentrasi FHA dalam keadaan setimbang pergam zeolit (q=mg/g) (Suhendra,2014).
Gambar 3 Pengaruh daya jerap zeolit dengan massa zeolit
Untuk mengetahui interaksi antara FHA dengan zeolit dan kemampuan optimum yang dapat dicapai oleh zeolit, diperlukan suatu model kesetimbangan sebagai parameternya. Isoterm adsorpsi merupakan parameter yang sangat penting dalam adsorpsi karena ikut berperan dalam menentukan kondisi maksimum untuk menghasilkan adsorpsi yang optimal. Isoterm adsorpsi dapat dikaji dengan beberapa model yang ada untuk mengetahui model adsorpsi isoterm yang sesuai, dimana model adsorpsi isoterm FHA ini akan dikaji menggunakan dua model yaitu isoterm Langmuir dan Freundlich
a b
Gambar 4. a. Model kesetimbangan adsorbsi Langmuir dan b. Model kesetimbangan adsorbsi Freundlich
Terlihat pada gambar 4 bahwa nilai R2 dari model isotherm adsorbsi Freundlich adalah 0,991 lebih besar dari model isotherm adsorbsi Langmuir. Dapat dikatakan bahwa isotherm adsorbsi dari proses penyerapan FHA oleh zeolit lebih cenderung mengikuti model Isotherm Freundlich. Kesesuaian dengan persamaan Model Isoterm Freundlich mengasumsikan bahwa proses adsorpsi terjadi secara fisika (Al-Duri, 1995). Hal ini didasarkan atas terbentuknya lapisan monolayer dari molekul-molekul adsorbat pada permukaan adsorben. Namun pada adsorpsi Freundlich situs-situs aktif pada permukaan adsorben bersifat heterogen.
f. Penentuan waktu kontak optimum
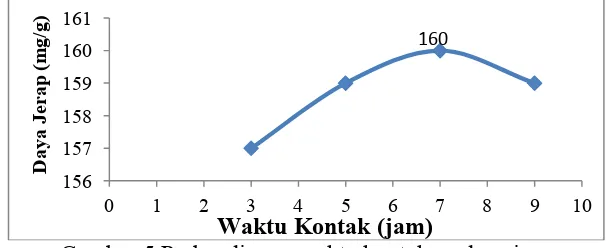
Penentuan waktu kontak optimum absorpsi dilakukan dengan meng-interaksikan FHA-Zeolit dengan Pb2+ dengan variasi waktu 3, 5, 7 dan 9 jam. Seperti terlihat pada Gambar 5
Gambar 5 Perbandingan waktu kontak vs daya jerap
Pengaruh waktu kontak optimum memunjukkan bahwa ion logam yang terabsorpsi meningkat seiring dengan meningkatnya waktu dan mencapai waktu optimum pada waktu kontak 7 jam dengan daya jerap FHA-Zeolit sebesar 160 mg/g, kemudian menurun setelah waktu kontak optimumnya. Adanya peningkatan penyerapan logam oleh FHA-Zeolit menunjukkan belum jenuhnya situs aktif FHA-zeolit oleh molekul ion logam Pb2+, namun apabila kondisi ion logam yang teradsorpsi telah konstan yang diakibatkan oleh jenuhnya situs aktif dari FHA-zeolit oleh molekul adsorbat, maka akan terjadi penurunan serapan. Hal ini menunjukkan bahwa adanya batas FHA-Zeolit dalam mengabsorpsi ion logam Pb2+.
g. Penentuan pH optimum logam Pb2+
Penentuan pH optimum ini dilakukan pada variasi pH 2,3,4,5 dan 6 dengan waktu kontak optimum yaitu 7 jam. Seperti terlihat pada Gambar 7.
Gambar 7 Perbandingan pH ion logam Pb2+ dengan daya jerap
Kemampuan penyerapan suatu adsorben dapat dipengaruhi oleh pH larutan. Hal ini berhubungan dengan protonasi atau deprotonasi permukaan sisi aktif dari sorben. Untuk
asam-asam organik, adsorpsi akan meningkat bila pH diturunkan, yaitu dengan penambahan asam-asam mineral. Nilai pH juga dapat mempengaruhi kesetimbangan kimia. Dengan variasi pH kemungkinan ikatan kimia antara adsorben dan adsorbat dapat terjadi (kurniaty, 2008) Terlihat dengan begitu besarnya rentan daya jerap zeolit pada pH 2 dan pH 3 dan menurun pada pH 4, pH 5 dan pH 6 (gambar 4.16). Ini artinya kondisi pH optimum ion logam timbal(II) berada pada pH 3 dan kompleks logam FHA-zeolit sudah terbentuk dengan stabil. Hal ini sesuai dengan penelitian yang dilakukan oleh Erika (2014) dimana kondisi optimum dari logam Pb2+ berada pada pH rendah antara 3-5. Adapun daya jerap yang ditunjukkan pada pH optimum sebesar 169,64 mg/g artinya sebanyak 169.64 mg ion logam Pb2+ terjerap dalam 1 g FHA-zeolit.
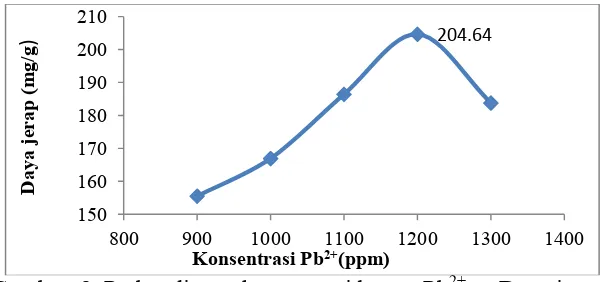
h. Penentuan konsentrasi optimum ion logam Pb2+
Pada tahap penentuan pengaruh konsentrasi ion logam Pb2+ optimum terhadap daya jerap FHA-Zeolit dilakukan variasi konsentrasi ion logam mulai dari 900 ppm- 1300 ppm dengan selisih 100 ppm dalam kondisi pH dan waktu kontak optimum
Gambar 8 Perbandingan konsentrasi logam Pb2+ vs Daya jerap
Dari Gambar diatas terlihat bahwa jumlah ion logam yang terabsorpi meningkat seiring dengan meningkatnya konsentrasi ion logam dan mencapai puncaknya pada konsentrasi 1200 ppm kemudian menurun setelah konsentrasi optimum (1200 ppm). Pada konsentrasi 900 ppm sampai 1100 ppm, jumlah ion logam dalam larutan lebih kecil sehingga yang terjerap juga akan semakin sedikit karena lebih sedikit ion logam yang membentuk ikatan koordinasi dengan adsorben FHA-zeolit. Semakin banyak jumlah ion logam, maka semakin banyak pula ion logam yang terikat pada FHA-Zeolit dan mencapai optimum pada konsentrasi 1200 ppm. Pada konsentrasi tersebut semua ion logam telah membentuk ikatan dengan adsorben (FHA-Zeolit). Penambahan konsentrasi ion logam yang berarti menambah jumlah ion logam dalam larutan ternyata menurunkan daya jerap dari adsorben. Hal ini terjadi karena saat konsentrasi bertambah tidak akan terjadi pembentukan kompleks lagi oleh FHA-Zeolit terhadap ion logam, sehingga terjadi penurunan kecepatan reaksi yang menyebabkan daya jerap menurun.
Untuk mengetahui interaksi antara logam Pb2+ dengan FHA-zeolit dan kemampuan daya jerap optimum yang dapat dicapai oleh FHA-Zeolit tersebut seperti halnya dengan interaksi antara FHA dengan zeolit (pada pembahasan sebelumnya) digunakan model kesetimbangan isotherm absorbsi dengan menggunakan dua model yaitu isoterm Langmuir dan Freundlich seperti pada gambar 9
a b Gambar 9 a. Model kesetimbangan isotherm Absorbsi Langmuir dan
b. Model kesetimbangan isotherm Absorbsi Freundlich.
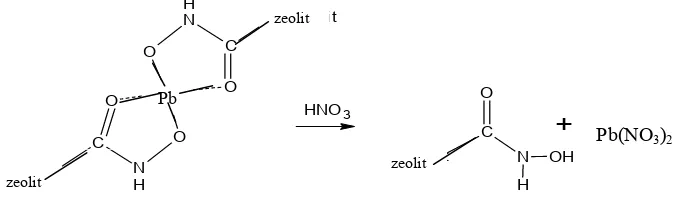
Terlihat pada gambar 9 ; nilai R2 dari model isotherm Freundlich adalah 0,9753 lebih besar dari nilai model isotherm adsorbsi Langmuir. Nilai itu menunjukkan bahwa absorbsi ishoterm dari penyerapan logam Pb(II) oleh FHA-zeolit mengikuti model isotherm absorbsi Freundlich. artinya proses absorbsi pada penyerapan FHA-zeolit terhadap ion logam Pb(II) terjadi secara fisika berdasakan asumsi model isotherm Freundlich (do, 1998). Gambar 4.11 menunjukkan reaksi kompleks FHA-Zeolit dengan ion logam Pb2+
C
Gambar 4.11 Reaksi kompleks FHA-Zeolit dengan ion logam Pb2+
i. Tahap Immobilisasi chelating agent (Ekstraksi padat-cair)
FHA-zeolit sebagai absorbennya dan sebanyak 60 ml campuran logam yaitu Pb2+, Zn2+ dan Cd2+ sebagai sampel absorbatnya. Pada ekstraksi padat-cair ini, digunakan kondisi optimum daya jerap FHA-zeolit terhadap ion logam Pb2+ yang telah diperoleh. Tabel 2 menunjukkan % serapan yang didapatkan dari proses ekstraksi padat-cair (immobilisasi chelating agent).
Table 3 Serapan masin-masing io logam
Ion logam Konsentrasi
Dengan metode AAS diperoleh besarnya pengukuran serapan ion logam dalam FHA-zeolit seperti terlihat pada Tabel 4.3 diatas menunjukkan bahwa ion logam Pb(II) terserap paling besar dalam resin dibandingkan dengan logam yang lainnya. Hal ini disebabkan karena ion logam Pb(II) mempunyai kestabilan kompleks yang tinggi, yaitu pada
konsentrasi dan pH optimum tersebut, sedangkan logam lainnya kurang stabil sehingga hanya bisa terserap sedikit saja. Jika dianalisa secara keseluruhan, besarnya serapan ion Pb(II) dalam resin mencapai 94,6% atau sebesar 1195,5 ppm. Nilai ini menunjukkan bahwa dalam setiap 1 gam FHA-Zeolit terdapat 298,87 ppm ion logam Pb(II) yang terserap.
j. Tahap pemisahan dan recovery ion logam Pb2+ dengan ion logam Cd2+ dan Zn2+.
Tahap perolehan kembali ini didasarkan pada tingkat stabilitas logam dalam kompleks yang umumnya berbeda pada masing-masing ion logam. Perbedaan kestabilan inilah yang mendasari penulis untuk dapat memisahkan ion logam yang satu dengan yang lainnya. Ion logam dapat dengan mudah larut dalam asam sehingga penggunaan asam sangatlah dianjurkan untuk pemisahan logam dari senyawa kompleksnya.
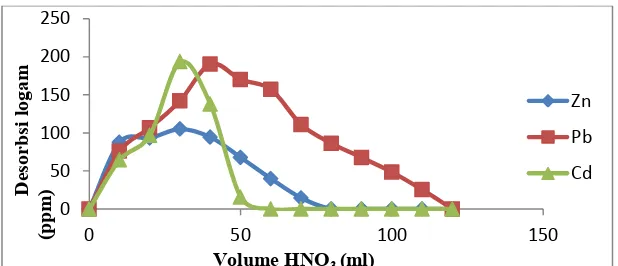
Pada saat perolehan kembali ion-ion logam, larutan asam nitrat 10% dilewatkan kedalam kolom sebagai fase geraknya dimana setiap fraksi 10 ml ditampung dan diukur dengan AAS konsentrasi ion logam yang ter-recovery kembali. Dari hasil AAS yang didapat, diperoleh kurva perolehan kembali ion logam Pb2+ dan ion logam lainnya (Cd2+ dan Zn2+) seperti pada Gambar 10
Gambar 12 Perolehan kembali ion logam timbal(II) menggunakan HNO3 10%
Dari Gambar 12 terlihat bahwa ion logam Pb(II) ter recovery paling tinggi dibadingkan dengan logam-logam yag lain yaitu sebesar 1080,95 ppm atau sebesar 98,78% dari jumlah yang terserap.
Dan untuk pemisahan ion logam Pb(II) dengan logam-logam lainnya (Cd(II) dan Zn(II)) dapat dilihat pada Gambar 13
Gambar 13 Pemisahan logam Pb2+ dengan ion logam logam yang lain
tapi pada raksi volume 70 ml, ion logam Pb2+ sudah terpisah dengan ion logam Cd2+ , namun masih ada sedikit sisa dari ion logam Zn2+ yang terbawa.Namun pada fraksi volume 80ml-120ml ion logam Pb2+ sudah benar-benar terpisah dengan kedua ion logam tersebut. Sehingga diperoleh jumlah ion Pb2+ yang dapat dipisahkan sebesar 227.7 ppm atau 19,04%.
Nilai faktor pemisahan antara ion logam Pb2+ dengan Zn2+ sebesar 0,34 sedangkan ion logam Pb2+ dengan Cd2+ sebesar 0,43, artinya antara ion logam Pb2+ dengan logam Zn2+
Gambar 14 Proses desorpsi ion logam Pb2+
E. KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan hasil penelitian dan kajian pustaka yang telah dilakukan, maka dapat disimpulkan bahwa :
1. Asam lemak hidroksamik (FHA) yang diimmobilisasi dengan zeolit dapat digunakan sebagai pengkhelat ion logam pada proses pemisahan dan perolehan kembali ion logam Pb(II), dengan kondisi optimum FHA 200 ppm dan massa zeolit 0,25 gam. Dari model kesetimbangan adsorbsi, diperoleh bahwa proses immobilisasi FHA dalam zeolit lebih mengikuti model isoterm Freundlich.
2. Daya jerap optimum yang diperoleh dari 200 ppm FHA dalam 0.25 gam zeolit sebesar 5,056 mg/g.
3. Kondisi optimum yang diperoleh untuk mendapatkan serapan logam timbal(II) yang optimal yaitu pada waktu kontak 7 jam dengan daya jerap FHA-Zeolit terhadap logam timbal(II) sebesar 160 mg/g , pH 3 dengan daya jerap 169.64 mg/g dan konsentrasi 1200 ppm dengan daya jerap 204,64 mg/g. Dari model kesetimbangan adsorbs, diperoleh bahwa proses penyerapan FHA-Zeolit terhadap ion logam Pb2+ lebih cenderung mengikuti model isotherm Freundlich.
4. Jumlah ion timbal(II) yang terserap pada 4 gam FHA-Zeolit adalah 1195,5 ppm atau 94,6% dan jumlah recovery sebesar 1085,95 ppm atau 98.78%
5. Jumlah ion logam timbal(II) yang dapat dipisahkan dengan ion logam lain (Cd(II) dan Zn(II)) sebesar 227,7 ppm atau 19,04%.
6. Nilai faktor pemisahan antara ion Pb2+ dengan Zn2+ adalah 0,34 sedangkan antara ion Pb2+ dengan Cd2+ adalah 0,43 yang berarti hanya terjadi pemisahan sebagian antara ion logam Pb(II) dengan ion logam Cd(II) dan Zn(II)
zeolit
Pb
Pb(NO3)2 zeolit
Saran
1.Untuk immobilisasi FHA perlu dicoba menggunakan zeolit alam sebagai perbadingan, karena resin yang digunakan dalam penelitian ini adalah zeolit síntesis.
2. Perlu dilakukan penelitian tentang pengaplikasikan secara langsung pada pencemaran limbah di lingkungan dengan metode ekstraksi padat-cair dari ion logamPb(II) akibat penambangan emas tradisional maupun penambangan zat mineral yang lain.
DAFTAR PUSTAKA
Al-Duri, B. 1995. A Review In Equilebirium In Single And Multicomponent Liquid Adsorpsion System. Review in Chemical engineering, vol. 11, hal : 101-143
Chongprasith, P.,W. 1999. ASEAN Marine Water Quality For Cadmium. ASEAN-Canada CPMS-II AM WQC for cadmium. Marine Environmen Division, Water Quality Management Bureau, Pollution Control Departemen.VII-I to VII-64.
Isha, A., Yusof, N.A.,Ahmad, M., Suhendra, D., Yunus, W.M.Z.W. dan Zainal, Z., 2007, Optical Fibre Chemical Sensor For Trace Vanadium(V) Determination Based On Newly Synthesized Palm Based Fatty Hydroxamic Acid Immobilized In Polyvinyl Chloride Membrane, Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, p:1398-1402
Kurniaty, N. 2008. Kestimbangan Adsorbsi Residu Minyak Dari Limbah Cair Pabrik Minyak Sawit (Pome) Menggunakan Gambut Aktif. Skripsi, Teknik Kimia, Fakultas Teknik UR, Pekanbaru.
Manzoor, M., Anwar, F., dan Iqbal, T., 2007, Physico-chemical Characterization of Moringa concanensis Seeds and Seeds Oil. JAOCS, 84:413-419.
Palar, H. 2004.Pencemaran dan Toksikologi Logam Berat. Rieneka Cipta: Jakarta.
Suhendra, D., Copper Ion Extraction by a Mixture of fatty Hidroxamic Acids Synthesized from Commercial Palm Oil, Solvent Extraction and Ion Exchange, 2005, 23, 713-723.
Suhendra, D., Wan Yunus, W.M.Z., Haron, M.J., Basri M., and Silong S., Separation and Preconcentration Of Copper Ion by Fatty Hydroxamic Acid Immobilized onto Amberlite XAD-4, Indo. J. Chem., 2006, 6 (2), 165-169.
Rahayu. 2013. Perolehan Dan Pemisahan Kembali Ion Logam Timbale(II) Menggunakan Asam Lemak Hidroksamik Yang Diimmobilisasi Kedalam Amberlite-XAD. Fakultas MIPA Universitas Mataram