BAB I
A.
VITAMIN DAN KOENZIM
Vitamin merupakan makanan tambahan (nutrien organik) yang dibutuhkan dalam jumlah kecil yang sifatnya tidak dapat disintesis oleh tubuh. Klasifikasi vitamin terdiri atas vitamin Larut lemak (vitamin A,D,E dan K) serta vitamin Larut air (vitamin B Kompleks dan C)
A.Vitamin Larut Lemak
Vitamin larut lemak bersifat hidrofobik apolar, strukturnya merupakan derivat Isopren serta terikat protein dalam bentuk lipoprotein. Peranan vitamin larut lemak antara lain :
1. Vitamin A yang berperan sebagai fungsi penglihatan
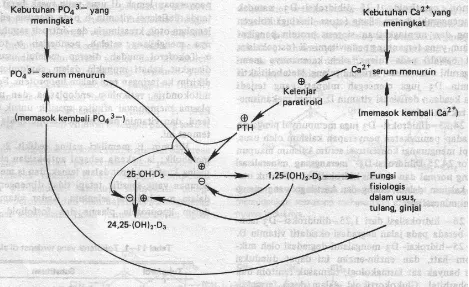
2. Vitamin D yang berperan dalam Metabolisme kKalsium & fosfat serta sebagai prohormon 3. Vitamin E yang memiliki sifat antioksidan
4. Vitamin K yang berperan dalam proses pembekuan darah
1. Vitamin A
Vitamin A mempunyai struktur poliisoprenoid dengan cincin sikloheksenil
Gambar 1A.1. struktur vitamin A
Vitamin A berasal dari provitamin A berupa β-Karotin dan karotinoid, selanjutnya menjadi aktif dalam bentuk derivat ester retinol yaitu retinol dan asam retinoat yang dapat disintesis di hati. Sumber Provitamin A diperoleh dari Semua sayuran dan buah-buahan berwarna terutama berwarna hijau serta seng untuk mempertahankan kadar vitamin A.
Peranan vitamin A terutama adalah meningkatkan integritas jaringan epitel, retinal dan retinol berperan dalam mekanisme penglihatan, retinoid/karotinoid bersifat antioksidan, retinoat berperan dalam pertumbuhan dan diferensiasi (sintesis glikoptotein). Dapat berikatan
dengan protein dalam bentuk CRBP sebagai pembentuk protein nukleus bersifat mirip hormon
Gambar 1A.2. Reaksi Pembentukan vitamin A
Gambar 1A. 3 Pigmen Visual Rodopsin
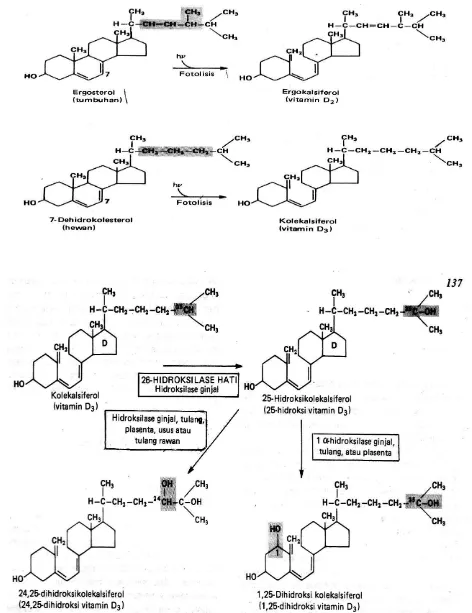
2. Vitamin D
Gambar 1A.5 Pengaturan pembentukan Vit.D
3. Vitamin E (Tokoferol)
Struktur vitamin E terdiri atas Alfa tokoferol (5, 7, 8, trimetil tokol), Beta tokoferol (5,8 dimetil tokol ), gamma tokoferol (7,8 dimetil tokol) dan delta tokoferol (8 metil tokol). Pengangkutan Vitamin E melalui kilomikron dari jaringan ke hati dan pengeluaran dari hati melelui VLDL. Peranan vitamin E sebagai antioksidan terutama pada reaksi peroksida as.lemak tak jenuh ganda membrane yang membentuk radikal bebas
‘OO + TOC-OH ‘OOH + TOCO
‘OO + TOC-O ROOH
Gambar 1A.6 Sinergistik Vitamin E dan selenium
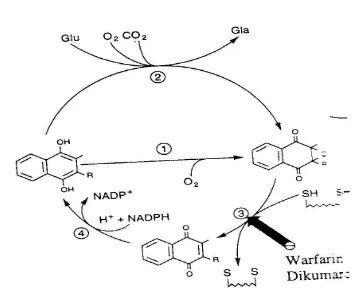
4. Vitamin K
Peranan Vitamin K yaitu dalam proses pembekuan darah dalam mengkatalisis protrombin oleh hati, sebagai antidotum dalam mendetoksikasi obat dikumarol (antikoagulansia). Berperan dalam mensintesis protein tulang menjadi osteokalsin. Sumber vitamin K adalah sayuran berdaun hijau tua (bayam), kacang polong, padi-padian, tomat, keju, kuning telur dan hati
Siklus Vitamin K
Peran vitamin K berperan dalam pembekuan darah dibantu oleh beberapa enzim melalui siklus vitamin K yaitu :
Piridoksin (Piridoksal atau Piridoksamin (B6)), Biotin, Kobalamin (B12) dan Asam Folat (As.Pteroiglutamat).
1. Tiamin
Gambar 1A.9 Tiamin dan Tiamin Pirofosfat
Tiamin Pirofosfat merupakan tiamin aktif menghasilkan ATP berasal dari otak dan hati.Peranan tiamin pirofosfat sebagai koenzim dalam pemindahan gugus aldehid melalui reaksi :
1. Dekarboksilasi oksidatif asam -keto
(-ketoglutarat, piruvat, -keto analog dari asam amino :leusin,isoleusin dan valin) 2. Transketolase Lintasan pentosa fosfat
Defisiensi tiamin menyebabkan karbon reaktif terhadap tiazol membentuk karbanion, menyebabkan peningkatan karbon piruvat akibatnya terjadi penumpukan piruvat, gula pentosa dan asam amino. Makna patologisnya menimbulkan penyakit beri-beri.
2. Riboflavin
Struktur riboflavin mengadung gula alkohol yaitu ribitol, flavin dan cincin isoaloksazin heterosiklik.
Gambar 1A.11 Struktur riboflavin
Riboflavin aktif dapat terjadi bila cahaya menguraikan koenzim flavoprotein menjadi Flavin mononukleotida (FMN) dan Flavin Adenin dinukleotida FAD. Selain itu mengikat logam dalam bentuk metaloflavoprotein serta mempunyai reaksi yang tergolong oksidoreduktase.
Peranan Riboflavin adalah dalam reaksi :
1. Oksidase asam -amino oleh deaminase 2. Xantin Oksidase pada penguraian purin
3. Aldehid dehidrogenase pada penguraian aldehid
4. Gliserol 3 fosfat dehidrogenase pada pengangkutan di mitokondria 5. Suksinat dehidrogenase pada siklus asam sitrat
6. Asil KoA dh & flavoprotein pada asam lemak
7. Dihidrolipol dehhidrogenase pada dekarboksilasi oksidatif piruvat, -ketoglutarat 8. NADH dehidrogenasi pada pembentukan FMNH2 dan FADH2 rantai respirasi di
mitokondria
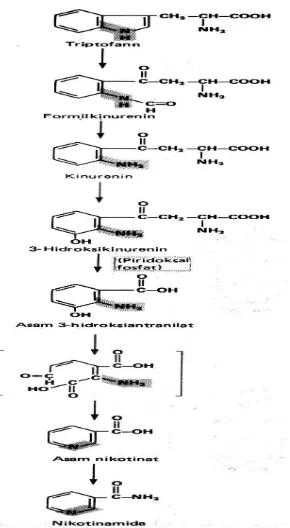
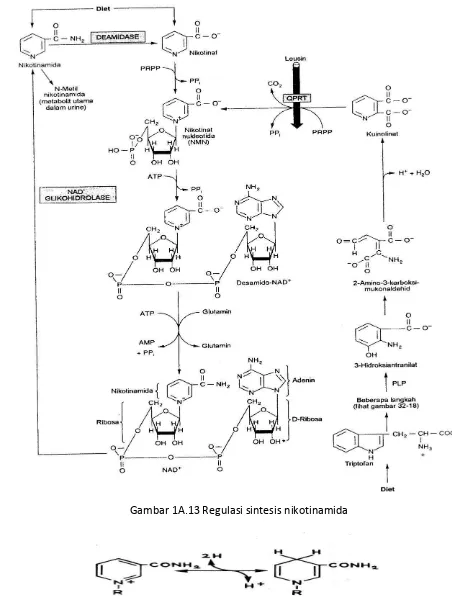
3. Niasin
Gambar 1A.13 Regulasi sintesis nikotinamida
NiasinAktif dalam bentuk koenzim Nikotinamida adenin dinukleotida (NAD) dan Nikotinamida adenin dinukleotida fosfat (NADP). Metabolisme karbohidrat, lipid dan Protein (Asam Amino) membutuhkan NAD dalam reaksi oksidoreduksi pada lintasan oksidatif (SAS) dan NADP dalam reaksi reduktase atau dehidrogenase pada reaksi pentosa fosfat.
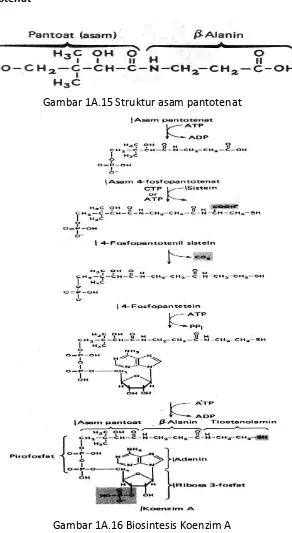
4. Asam Pantotenat
Gambar 1A.15 Struktur asam pantotenat
Gambar 1A.17 Sintesis asetil-KoA
Peranan KoA yaitu dalam siklus asam sitrat, sintesis asam lemak, sintesis kolesterol, oksidasi dan asetilasi.
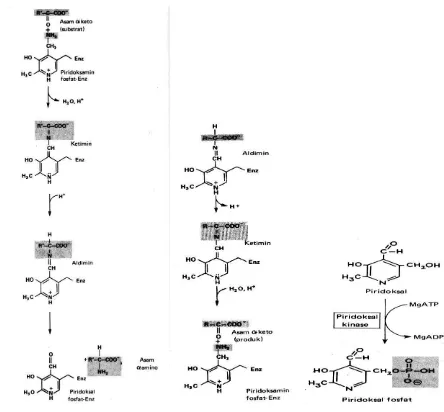
5. Vitamin B6 (Piridoksin, Piridoksal dan Piridoksamin)
Gambar 1A.19 Sintesis Piridoksal fosfat
Piridoksal Aktif dalam bentuk piridoksal fosfat, yang mempunyai peranan dalam metabolism asam amino sebagai kombinasi basa antara aldehid dan amino pada asam alfa amino; mempercepat transaminasi ikatan amino karbon; dekarboksilasi dan aktivitas treonin aldolase serta berperan sebagai fosforilase pada reaksi glikogenolisis.
6. Biotin
Biotin merupakan derivat imidazol yang disintesis oleh bakteri, membentuk biotin aktif dalam bentuk karboksi biotin. Peranan karboksi biotin yaitu adanya beberapa enzim yang aktivitasnya tergantung pada biotin antara lain piruvat karboksilase, asetil KoA karboksilase, propionil KoA karboksilase dan β-metilkrotone koA karboksilase
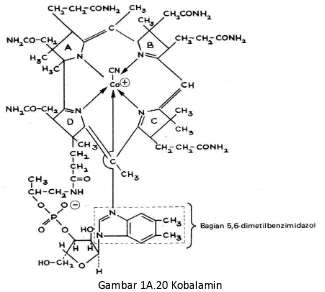
7. Vitamin B12 (Kobalamin)
Vitamin B12 terdapat cincin coorin dimana ion Ca+ berada ditengah, serta disintesis oleh
mikroorganisme pada manusia dalam bentuk metilkobalamin, adenosil kobalamin dan hidroksi kobalamin.
Gambar 1A.20 Kobalamin
Bentuk aktif dari kobalamin yaitu metil kobalamin dan deoksiagnosilkobalamin . Peranan kobalamin yaitu dalam reaksi lintasan konversi propionat (siklus asam sitrat), reaksi glukoneogenesis dan sintesis purin dan pirimidin atau asam nukleat dalam perubahan homosistein menjadi metionin atau perubahan metil tetrahidofolat menjadi tetrahidrofolat
8. Asam Folat atau Folasin
Gambar 1A.22 Struktur asam folat
Bentuk aktif folasin berperan untuk reaksi oksidasi (metil, metilen, formilmino). Inhibitor asam folat yaitu trimetropin dan metotreksat (anti kanker).
B. FREE RADICAL, OSMOSIS END DIFUSI
Homolytic reactions
Equal splitting of a pair of valence electrons between joined atoms. Product is a free radical. A free radical is a chemical species with an unpaired valence electron
Free radicals
Extremely reactive, environmental sources, metabolic processes, superoxide (O2.), hydroxyl (OH.), hydrogen peroxide (H2O2.), singlet oxygen (O.) & nitricoxide (NO.) dan quenched by antioxidants.
• Initiation : free radical first formed
• Propagation : continued generation of free radicals in sequential manner. May lead to chain reaction
• Termination : ending of chain reaction dan two free radicals react together
Diffusion : movement of small particles like molecules and ions due to concentration gradient Osmosis : movement of water through membranes, from dilute to concentrated through Membrane
C.
OKSIDASI BIOLOGI
Bioenergitika disebut juga termodinamika Biokimia merupakan ilmu pengetahuan yang mempelajari perubahan-perubahan energi yang menyertai reaksi-reaksi biokimia. Mekanisme perolehan energi dimana substrat/penyerapan cahaya oleh tumbuh-tumbuhan, dimana reaksi memerlukan tenaga (endergonik), misalnya pembentukan energi. Bioenergitika meliputi coupling eksergonik dan endergonik, tapi energi tidak diciptakan namun serah-terima,
energy-transducing membranes dalam mitokondria.
Oksidasi biologi yaitu transduksi energi melalui rangkaian reaksi enzimatik yang berlangsung di membran mitokondria lapis dalam. Dalam hal ini proses oksidasi biologi tidak hanya di mitokondria. Reaksi oksidasi biologi berlangsung oksidasi yaitu pengeluaran elektron, reduksi dalam perolehan elektron, contohnya oksidasi ion ferro menjadi ferri serta oksidasi selalu disertai reduksi akseptor elektron.
Reaksi respirasi pada bakteri anaerob yang hidup tanpa oksigen, pada manusia mutlak harus ada pasokan oksigen. Proses respirasi ini merupakan proses pengambilan energi dalam bentuk ATP hasil reaksi Hidrogen dan Oksigen membentuk Air oleh enzim oksigenase. Efek samping reaksi respirasi obat, polutan, karsinogenik (Xenobiotik).
Potensial redoks dalam hal ini memprediksi arah aliran elektron, pertukaran energi bebas sebanding dengan kecenderungan reaktan untuk memberi atau menerima elektron melalui enzim golongan oksidoreduktase.
Tabel 1C.1 Enzim golongan oksidoreduktase
1. Oksidase
Oksidase mempunyai sifat mengkatalisis pembebasan H dari substrat, memerlukan aseptor hanya O2, reaksinya memerlukan Cu serta menghasilkan air (H2O), kecuali pada urikase
dan monoamin oksidase H2O2.
Gambar 1C.1 Reaksi oksidase
Oksidase memelukan logam dalam reaksinya, antara lain berperan dalam reaksi sitokrom oksidase (Sit.a3/ Sit.aa3), Sit. Aa3 yang terdiri 3 molekul Heme memerlukan Fe dan Cu. Inhibotor oksidase CO, Sianida, Hidrogen sulfida. Contoh reaksi oksidase antara lain sitokrom oksidase (enzim pernafasan), fenolase (tirosinase) dalam pembentukan dopa dan melanin (met.tirosin), urikase dalam reaksi oksidasi asam urat menjadi alantoin. Monoamin oksidase dalam reaksi oksidasi epinefrin dan tiramin.
2. Dehidrogenase
Dehidrogenase berfungsi dalam pemindahan hidrogen dari substrat satu ke substrat lainnya dalam reaksi oksidasi reduksi yang terangkai (reversibel) ex. Glikolisis fase anaerob serta komponen rantai respirasi pengankutan elktron dari substrat ke oksigen.
2.a. Aerobik dehidrogenase
Aerobik dehidrogenase bersifat katalisis pembebasan H dari substrat, memerlukan aseptor O2 dan metilen Blue. Aerobik dehidrogenase memerlukan koenzim flavoprotein yaitu
flavin mononukleotida FMN dan Flavin adenin dinukleotida(FAD) serta berikatan dengan logam dalam bentuk metaloflavoprotein (Fe dan Mo), dalam reaksinya menghasilkan H2O2.
Reaksi :
Gambar 1C.2 Reaksi aerobic dehidrogenase
Contoh Aerobik dehidrogenase
D-amino acid dehidrogenase (D-amino acid oksidase) memerlukan FAD
L-amino acid dehidrogenase (L-amino acid oksidase) memerlukan FMN
Xantin dehidrogenase (xantin oksidase) memerlukan FAD dan Mo pada reaksi
metabolism basa purin menjadi asam urat
Aldehid dehidrogenase memerlukan FAD, Mo dan Fe
Glukosa oksidase memerlukan FAD
2.b. Anaerobik Dehidrogenase
Anaerobik dehidrogenase bersifat membebaskan H dari substrat, tidak mengandung O2
sebagai akseptor H. Anaerobik dehidrogenase berperan dalam : a. Diluar rantai pernafasan (anaerobik)
AH2 (red) Carier (oks) BH2(red) A(oks) Carier.H2(red) B(oks)
b. Komponen rantai pernafasan (proses pemindahan elektron secara bertahap dari substrat ke oksigen)
AH2 (red) Carier (1) Carier.H2 Carier(2) BH2(red)
A(oks) Carier.H2(red) Carier (2) Carier.H2 B(oks)
Contoh reaksi anaerobik dehidrogenase yaitu
Dehidrogenase yang memerlukan NAD dan NADP (derivate Vitamin asam nikotinat) dan
Zn, missal malat dehidrogenase berfungsi menarik H dari malat
Dehidrogenase yang memerlukan riboflavin, FMN, FAD dalam rantai pernafasan (suksinat dehidrogenase, asil KoA dehidrogenase, alfa-glisero-3-fosfat dehidrogenase dan NADH dehidrogenase di mitokondria sebagai bagian dari rantai respirasi
Sitokrom anaerobik dehidrogenasi dalam mengangkut elektron dari falvoprotein ke
3. Hidroperoksidase
Hidroperoksidase menggunakan H2O2 sebagai substrat :
a. Peroksidase dalam susu, leukosit, trombosit memerlukan akseptor elektron misalnya askorbat, kinon dan sitokrom.C serta memerlukan Fe
b. Katalase merupakan hemoprotein (4 gugus hem) dalam darah, susmsum tulang,
mukosa, ginjal dan hepar
Peran :
O2 → H2O2 → H2O dan 1/2O2
aerobik dh katalase
Fungsi hidroperoksidase
Melindungi tubuh dari penumpukan peroksida yang berbahaya merusak membran yang
menyebabkan kanker
Pada Eritrosit terdapat glutation peroksidase, reaksinya berikatan dengan selenium, bersifat sebagai penghancur peroksida dan hidroperoksida lipid serta Hb dari oksidasi peroksida
Gambar 1C.4 Reaksi Katalase dan Peroksidase
4. Oksigenase
Oksigenase mengkatalisis pemindahan oksigen serta inkoporasi oksigen ke dalam molekul substrat dalam reaksi :
a. Dioksigenase (oxygen transferase) mengkatalisis penggabungan kedua atom dari molekul O2
dengan molekul substrat A + O2 → AO2
Contoh reaksi homogentisat dioksigenase dalam hepar dan L-triptofan dioksigenase dalam hepar
b. Monooksigenase (hidroksilase) bersifat mengkatalisis inkorporasi satu atom saja dari molekul O2 ke dalam substrat. Satu atom lagi direduksi menjadi air
Peranan monooksigenase yaitu dalam sintesis kolesterol, transformasi kolesterol menjadi hormon steroid serta menghasilkan NADPH. Monooksigenase dapat menghidroksilasi obat-obatan (detoksikasi) dengan reaksi sebagai berikut :
Obat-H + O2 + 2Fe2+ (P-450) + 2H+ → o at-OH + → H2O + 2Fe3+ (P-450)
Obat yang dapat didetoksikasi oleh monooksigenase adalah morfin, alkohol, anilin dalam reaksi alkohol dehidrogenase (NAD) dalam oksidase alkohol serta katalase dalam peroksisom dalam memecah H2O2 dalam mengoksidasi alkohol.
MEOS (microsomal ethanol oxidizing system)
MEOS bersifat katalisis etanol di hepar dengan bantuan NADPH, O2 dan sit.P450 dan
lcohol bersaing dengan obat-obatan untuk berikatan dengan monooksigenase, akibatnya jumlah lcohol meningkat dan menjadi toksik obat-obatan meningkat.
Obat yang dimetabolisme dalam sistem Hidrksilase yaitu benzpiren,aminopirin, anilin, morfin, benzfetamin; fenobarbitol dalam menimbulkan pembentukan enzim mikrosomal dan sit.P450; siklus Sit.P450 mikrosom terdapat pada organ korteks adrenal, testis, ovarium, plasenta, biosintesis steroid. Di korteks adrenal dalam sit P450 6 kali lebih banyak dari pada rantai respirasi.
Gambar 1C.5 Siklus Hidroksilase
SOD mengandung Mn2+ , dimana katalase akan memecah H
2O2. Glutation peroksidase
mereduksi peroksida dan antioksidan tokoferol dapat memusnahkan radikal dan mengurangi keracunan yang diakibatkan oleh O2-- -
Reaksi Perlindunngan Sel terhadap radikal bebas 2O2-- + 2H+ → H2O2 + O2 (peroksidase)
H2O2→ H2O + O2 (katalase)
H2O2+ G“H → G““G + H2O (glutation peroksidase)
Metabolisme Superoksida terjadi bila oksigen dapat berubah menjadi zat yang toksik melalui pembentukan radikal dan molekul yang sangat reaktif, anion superoksida (O2--)
(dihasilkan akibat radiasi, oksidasi xantin mjd asam urat olah xantin oksidase); H2O2 dan radikal hidroksil (HO--) (dihasilkan aerobik dehhidrogenase dan SOD.
Efek radikal bebas menyerang Lipid tak jenuh, protein dan DNA. Perubahan struktur membran sel darah merah, paru-paru dan otak. Fe dalam Hb teroksidasi metabolisme Hb yang tidak dapat mengangkut O2. Lipid hidroperoksida inhibitor enzim tertentu dalam membran dan
sel. Contohnya membran sel darah merah dalam kerusakan lipid. Hidroperoksida dalam sel darah merah cepat terdegradasi menjadi anemia
D.
pH, BASE-ACID AND BUFFER SYSTEM
A simple definition of acids and bases is acids have H+ ions, alkalis have OH- ions. Strictly though : acids are substances that form H+ ions when added to water, alkalis are substances that form OH-(hydroxyl) ions when added to water. Valances: we have begun to introduce some more complex ions here such as the hydroxyl ion (OH-). Before going any further we need to befamiliar with the valences of some other common compound ions.
Table 1D.1 Common Valance Values
• The strength of an acid or alkali is determined by the degree to which it dissociates in water to liberate either H+ or OH- ions
Regulation of pH
Figure 1D.2. Enzyme Activity (Crowe et al. 2006)
Measuring pH
• All li uids/solutio s a e eithe a idi , neutral or alkaline
• To dete i e the pH of a solutio e use indicator paper which changes colour depending on whether it is acidic, alkaline or neutral
• Universal indicator paper – Yellow in slightly acidic solutions – Red in strongly acidic ones – Blue in mildly alkaline solutions – Purple when strongly alkaline
• pH probe
pH of Common Solutions
pH
• pH is a easu e of ho a id o alkali e a substance is
• The st e gth of a a id o alkali e is determined by which it dissociates in water to liberate, H+ or OH- ions
Acids
• An acid is a compound that contains H+
• Whe dissol ed i ate the solutio has a pH < • Acidic solutions have a pH of less than 7
• The strongest acids have a pH of 1 and have the highest concentration of H+ ions • The weakest acids have a pH of 6 and have the lowest concentration of H+ ions
Figure 1D.5 Dissociation of Acids (Crowe et al. 2006)
Strong Acids
Acid Formula Location/Use
Hydrochloric acid, HCl Stomach, Sulphuric Acid H2SO4 Car batteries, Nitric acid HNO3 Fertilisers and explosives
• The st ong mineral acids are highly corrosive
• Co ta t ith the ski a lead to se e e burning Stomach
• The sto a h has a st o g p ote ti e mucous membrane to protect the underlying epithelium from these effects
• Loss of i teg it of this p ote ti e li i g can lead to various disease states, which you will become familiar with during your nutritional training.
Dissociation of Strong Acids
• A st o g a id o pletel disso iates i to ions • Leadi g to a st o g o e t atio of H+ HCl → H+ + Cl-
Weak Acids
Figure 1D.7 Weak acids (Crowe et al. 2006)
Figure 1D.8 Dissociation in Aqueous Environment (Crowe et al. 2006)
Dissolving in Water
• No -metal oxides tend to be acidic – CO2, SO2 & NO2
• “t o g a ids HCl o H “O o pletel dissociate into ions • “t o g ases NaOH o KOH o pletely dissociate into ions
Dissociation Constants
• Disso iatio o sta t is a ua titati e expression of the relative strength of weak acids and bases
– Their tendency to ionise
– Stronger acids have lower pK values
• pK of an acid group is that pH at which the protonated and deprotonated species are present at equal concentration
Henderson-Hasselbach Equation
• The elatio ship et ee pH, pKa a d buffering action of any weak acid and its conjugate base is explained by the
Henderson-Hasselbach equation
• p alue ep ese ts -log
• pH 2 units below pKa acid ∼99% Protonated
Buffers
• Buffe s esist ha ges i pH he H+ a e consumed or produced – Maximum buffering capacity occurs at ± 1 pH unit either side of pK
• I po ta t ph siologi al uffe s i lude bicarbonate, orthophosphate and proteins
CAIRAN DAN MINERAL
Cairan
Fungsi air adalah berperan dalam reaksi-reaksi biokimia, media transport proses-proses intra se, sebagai pelicin (Lumbrican) dan pengatur suhu tubuh dengan cara penguapan melalui paru-paru dan kulit.
Ruang air terdiri atas intrasel (50-60%) dan ekstrasel terdapat di plasma, limfe, cairan intersisial, jaringan penyambung, tulang rawan, kulit, tulang, cairan sekresi.
Gambar 1E. 1 Komposisi elektrolit plasma darah dan cairan intrasel
Perbedaan komposisi intrasel dan ekstrasel yaitu kalium merupakan kation utama dalam sel, sedangkan natrium kation utama di ekstrasel. Karena banyak senyawa organik yang terfosforilasi terdapat dalam sel sehingga fosfat adalah anion yang utama dalam sel, klorida merupakan anion utama di ekstrasel. Konsentrasi protein intrasel lebih tinggi dari pada plasma darah.
Tabel 1E.1 Keseimbangan air
Intake air bertujuan untuk mempertahankan keseimbangan cairan, semua air yang hilang harus diganti. Iklim sedang : 1 mL/kkal (dewasa) dan 15 mL/kkal (bayi).
Mineral
Komponen utama molekul tubuh yaitu Carbon, Hidrogen, Oksigen, Nitrogen dan Sulfur. Mineral-mineral penting yaitu Kalsium, fosfor, Magnesium, Natrium, kalium dan klorida. Unsur runutan (trace element) dibutuhkan dalam jumlah sedikit yaitu kromium, kobalt, tembaga, yodium, besi, mangan, molibdenum, selenium dan seng, untuk mencegah kerusakan gigi (flour). Unsur-unsur tambahan tidak diketahui manfaatnya dalam tubuh yaitu Arsen, kadmium, nikel, silikon, timah dan vanadium. Mineral beracun yaitu timah hitam dan air raksa.
Absorpsi mineral, umumnya membentuk garam senyawa lain yang sulit larut (kecuali kalium dan natrium) harus berikatan dengan protein. Ekskresi melalui ginjal. Bila terjadi defisiensi disebabkan oleh malabsorbsi, pendarahan, berlebihan (besi), penyakit ginjal (kalsium) Dan bila kelebihan mineral menjadi toksik, sumber biasanya diperoleh dari makanan.