4 II. TINJAUAN PUSTAKA
A. TONGKOL JAGUNG
Menurut Koswara (1992), tongkol jagung merupakan tempat pembentukan lembaga dan gudang penyimpanan makanan untuk pertumbuhan biji serta merupakan modifikasi dari cabang yang mulai berkembang pada ruas-ruas batang. Tongkol utama umumnya terdapat pada ruas batang keenam sampai kedelapan dari atas dan pada ruas-ruas di bawah biasanya terdapat lima sampai tujuh tongkol yang tidak berkembang secara sempurna. Jagung mengandung kurang lebih 30% tongkol jagung dan sisanya adalah biji dan kulit. Gambar dan proporsi jagung manis utuh dapat dilihat pada Gambar 1 dan Tabel 1.
Gambar 1. Jagung manis utuh (Sharma, 2010)
Tabel 1. Proporsi jagung manis utuh
Jagung manis Parameter
Bobot (gram) Persentase (%) Jagung utuh Tongkol Biji (kernel) Kelobot Tangkai Rambut 229 85 72 59 8 6 100 37,12 31,44 25,76 3,49 2,62 Sumber : Dalem (1990)
Menurut Maynard dan Loosli (1993), tongkol jagung terdiri dari serat kasar sebesar 35,5%, protein 2,5%, kalsium 0,12%, fosfor 0,04% dan zat-zat lain sisanya
Rambut
Kelobot Tongkol
Biji Tangkai
5 38,16%. Menurut Iswanto (2009), serat kasar tongkol jagung mempunyai kandungan lignin sebesar 15%, kadar selulosa 45% dan kadar hemiselulosa 35%. Komposisi kimia tersebut membuat tongkol jagung dapat digunakan sebagai sumber energi, bahan pakan ternak dan sebagai sumber karbon bagi pertumbuhan mikroba.
B. LIGNOSELULOSA 1. Selulosa
Menurut Sjostrom (1995), selulosa hampir tidak pernah ditemui dalam keadaan murni di alam, melainkan selalu berikatan dengan bahan lain yaitu lignin dan hemiselulosa. Serat selulosa alami terdapat di dalam dinding sel tanaman dan material vegetatif lainnya. Selulosa mengandung komponen C sebesar 44.4%, komponen H sebesar 6.2%, dan komponen O sebesar 49.3%. Rumus empiris selulosa adalah (C6H10O5)n, dengan banyaknya satuan glukosa yang disebut dengan derajat polimerisasi (DP), yang jumlahnya mencapai 1.200-10.000 dan panjang molekul sekurang-sekurangnya 5.000 nm. Struktur molekul selulosa dapat dilihat pada Gambar 2. Bobot molekul selulosa rata-rata sekitar 400.000. Mikrofibril selulosa terdiri atas bagian amorf (15%) dan bagian berkristal (85%). Struktur berkristal dan adanya lignin serta hemiselulosa di sekeliling selulosa merupakan hambatan utama untuk menghidrolisis selulosa.
Gambar 2. Struktur molekul selulosa (Cole dan Fort, 2007)
Berdasarkan pemisahan menggunakan alkali (NaOH), selulosa dibagi menjadi tiga jenis yaitu α-selulosa, β-selulosa dan γ-selulosa. α- selulosa dalam keadaan basa ada dalam keadaan tidak larut, β-selulosa ada dalam bagian terlarut melalui katalis oleh asam, dan γ-selulosa adalah bagian yang dapat larut tanpa perlu katalis (Fengel dan Wegener, 1995).
6 Degradasi selulosa merupakan proses pemecahan polimer anhidroglukosa menjadi molekul-molekul yang lebih sederhana. Proses tersebut akan menghasilkan oligosakarida, disakarida atau trisakarida seperti selobiosa, glukosa monomer atau produk degradasinya. Produk utama degradasi selulosa adalah glukosa dan selobiosa (Judoamidjojo et al., 1989). Hasil degradasi tersebut selanjutnya dimanfaatkan sebagai bahan pembuat produk yang lebih bernilai ekonomis seperti asam amino dan asam karboksilat.
2. Hemiselulosa
Hemiselulosa adalah jenis polisakarida selulosik yang berfungsi sebagai bahan/matrik dalam serat kayu, memiliki bobot molekul lebih kecil daripada selulosa, molekulnya lebih mudah menyerap air, bersifat plastis dan mempunyai permukaan kontrol antar molekul yang lebih luas dibandingkan selulosa sehingga dapat memperbaiki ikatan antar serat pada pembuatan kertas. Unit gula (gula anhidro) yang membentuk hemiselulosa dapat dibagi menjadi kelompok seperti pentosa, heksosa, asam heksuronat dan deoksi-heksosa. Rantai utama hemiselulosa dapat terdiri atas satu unit (homopolimer), misalnya xilan atau terdiri atas dua unit atau lebih (heteropolimer), misalnya glukomanan (Fengel dan Wegener, 1995).
Sjostrom (1995) menyatakan bahwa hemiselulosa relatif lebih mudah dihidrolisis oleh asam menjadi komponen monomernya yang terdiri dari D-glukosa, D-manosa, D-galaktosa, D-xilosa dan arabinosa dan sejumlah kecil L-ramnosa disamping asam glukoronat, asam 4-O-metil-glukoronat dan asam D-galakturonat. Menurut Fengel dan Wegener (1995) monomer-monomer tersebut, misalnya xilosa dan manosa selanjutnya dapat dimanfaatkan sebagai bahan pembuatan xilitol dan manitol melalui hidrogenasi secara katalitik. Xilosa dengan perlakuan asam dapat menghasilkan furfural yang selanjutnya dapat dipergunakan sebagai bahan baku pembuatan furfuril alkohol. Struktur hemiselulosa dapat dilihat pada Gambar 3.
7 Gambar 3. Struktur hemiselulosa (Cole dan Fort, 2007)
3. Lignin
Secara morfologi lignin merupakan senyawa amorf yang terdapat dalam lamela tengah majemuk maupun dalam dinding sekunder. Selama perkembangan sel, lignin dimasukkan sebagai komponen terakhir di dalam dinding sel, menembus di antara fibril-fibril sehingga memperkuat dinding sel (Fengel dan Wegener, 1995). Lignin terbentuk melalui polimerasi tiga dimensi turunan dari sinamil alkohol terutama ρ-kumaril, koniferil dan sinapil alkohol dengan bobot molekul mencapai 11.000. Lignin yang melindungi selulosa bersifat tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter (Perez et al., 2002).
Lignin dapat dibagi menjadi beberapa kelas menurut unsur-unsur strukturnya. Lignin yang terdapat di hampir semua kayu lunak disebut dengan lignin guaiasil di mana sebagian besar merupakan produk polimerisasi dari koniferil alkohol. Adapun lignin khas kayu keras adalah lignin guaiasil-siringil yang merupakan kopolimer dari koniferil dan sinapil alkohol, dengan nisbah bervariasi dari 4:1 hingga 1:2 untuk kedua unit monomer (Sjostrom, 1995). Satuan penyusun lignin dapat dilihat pada Gambar 4.
8 Lignin bersifat tahan terhadap degradasi oleh sebagian besar mikroba. Lignin sulit didegradasi karena strukturnya yang kompleks dan heterogen yang berikatan dengan selulosa dan hemiselulosa dalam jaringan tanaman. Lebih dari 30 persen tanaman tersusun atas lignin yang memberikan bentuk yang kokoh dan memberikan proteksi terhadap serangga dan patogen (Orth et al., 1993). Meski demikian, fungi tertentu mampu menguraikan lignin secara selektif.
4. Zat Ekstraktif
Beraneka ragam komponen bahan berlignoselulosa, ada beberapa komponen yang biasanya merupakan bagian kecil, larut dalam pelarut organik netral atau air, komponen tersebut disebut sebagai zat ekstraktif. Menurut Sjostrom (1995), zat ekstraktif sebagian terdiri atas senyawa-senyawa tunggal tipe lipofil maupun hidrofil. Biasanya, bagian-bagian yang berbeda dari pohon, yaitu batang, cabang, akar, kulit kayu, dan tugi, berbeda dalam jumlah maupun komposisi ekstraktifnya. Tipe-tipe ekstraktif yang berbeda adalah perlu untuk mempertahankan fungsi biologis pohon yang bermacam-macam. Sebagai contoh, lemak merupakan sumber energi sel kayu, sedangkan terpenoid-terpenoid rendah, asam-asam resin dan senyawa-senyawa fenol melindungi kayu terhadap kerusakan secara mikrobiologi atau serangan serangga.
Isolasi ekstraktif dapat dilakukan dengan cara ekstraksi dengan menggunakan campuran pelarut netral dan/atau dengan pelarut tunggal secara berurutan. Ekstraksi dengan pelarut dapat dilakukan dengan pelarut seperti eter, aseton, benzena, etanol, diklorometana atau campuran dari pelarut-pelarut tersebut (Fengel dan Wegener, 1995).
C. BIODELIGNIFIKASI
Menurut Singh dan Roymoulik (1993), biodelignifikasi merupakan bagian dari biopulping, yaitu perombakan lignin atau senyawa-senyawa sejenisnya untuk membebaskan serat-serat dari ikatannya dengan menggunakan mikroba seperti fungi, bakteri atau enzim. Biodelignifikasi terjadi karena enzim-enzim ekstraseluler yang diproduksi oleh mikroba perombak lignin pada kayu.
9 Degradasi yang paling efisien harus dapat membebaskan struktur kristal selulosa dengan memperluas daerah amorf serta membebaskan dari lapisan lignin. Ilustrasi degradasi komponen lignin dari bahan berlignoselulosa dapat dilihat pada Gambar 5.
Gambar 5. Ilustrasi degradasi komponen lignin (Mosier et al., 2005)
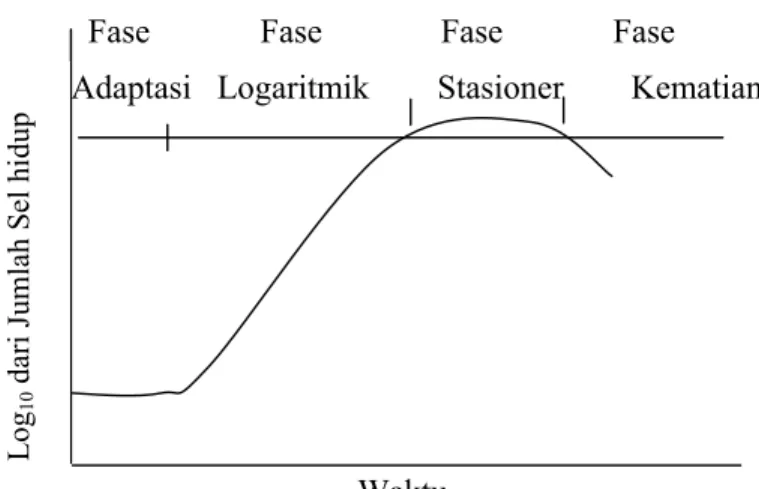
Secara biokimiawi, proses perombakan lignin diawali dengan pertumbuhan fungi yang kemudian memasuki fase stasioner. Fungi secara aktif mengambil dan memanfaatkan karbohidrat selama masa pertumbuhannya untuk mempertahankan metabolisme primernya (fase logaritmik). Metabolisme fungi akan mengalami penurunan jika ketersediaan nitrogen dalam substrat menjadi terbatas, miselia memasuki fase metabolisme sekunder (fase stasioner) dan sistem degradasi lignin dimulai (Eaton dan Hale, 1993). Pertumbuhan mikroba di dalam suatu kultur mempunyai kurva pertumbuhan seperti terlihat pada Gambar 6.
Fase Fase Fase Fase Adaptasi Logaritmik Stasioner Kematian
Waktu
Gambar 6. Kurva pertumbuhan kultur mikroba (Fardiaz, 1992)
Log 10 dari J umlah Sel hi dup
10 Menurut Subhash dan Gopichand (1990), proses pelapukan kayu oleh fungi terjadi karena hifa melakukan penetrasi ke dalam jaringan kayu, kemudian enzim yang dihasilkan bereaksi secara kimiawi dalam penyusutan kayu. Penetrasi ini terjadi melalui dua cara, yaitu fungi tumbuh dan menyebar di dinding sel dengan cara memanfaatkan pori-pori pada dinding sel kayu, selanjutnya enzim yang dikeluarkan oleh fungi tersebut membantu reaksi kimia di dinding sel.
Enzim pendegradasi lignin ini secara umum terdiri dari dua kelompok utama yaitu laccase (Lac) dan peroksidase yang terdiri dari lignin peroksidase (LiP) dan manganese peroksidase (MnP). Ketiga enzim ini bertanggung jawab terhadap pemecahan awal polimer lignin dan menghasilkan produk dengan bobot molekul rendah pada fungi pelapuk putih. Tidak semua fungi pelapuk putih menghasilkan ketiga jenis enzim sekaligus (Perez et al., 2002).
D. FUNGI PELAPUK PUTIH
Fungi yang menyebabkan kerusakan atau pelapukan kayu terdiri dari tiga macam yaitu: soft rot fungi, brown rot fungi dan white rot fungi. Soft rot fungi termasuk golongan Ascomyycetes atau fungi-imperfecti, yang memiliki kemampuan enzimatik pelapukan kayu hanya terbatas pada selulosa dan pentosan. Soft rot fungi terutama hanya terdapat pada daerah dengan lingkungan yang ekstrim seperti lingkungan yang terlalu basah atau terlalu kering (Blanchette et al., 1991). Sedangkan brown root fungi dari golongan Basidiomycetes yang memiliki kemampuan enzimatis melapukkan kayu dengan cara menyerang holoselulosa (Eaton dan Hale, 1993).
White rot fungi atau fungi pelapuk putih (FPP) juga termasuk golongan Basidiomycetes tetapi berkemampuan mendegradasi lignin dan polisakarida (selulosa dan hemiselulosa) (Eaton dan Hale, 1993). Menurut Gandjar et al. (2006), karakteristik golongan Basidiomycetes adalah balistokonidia, hifa dikariotik, adanya clamp conections, teliospora, dan basidium (holobasidium atau phragmobasidium). Basidium merupakan karpus seksual pada Basidiomycetes. Tipe karpus seksual pada Basidiomycetes dapat dilihat pada Gambar 7.
11 Gambar 7. Tipe karpus seksual pada Basidiomycetes (Gandjar et al., 2006)
Beberapa fungi pelapuk putih memiliki kemampuan mengurai lignin secara selektif dan hanya mengurai selulosa dan hemiselulosa dalam jumlah yang sedikit. Fungi ini dapat mendegradasi lignin secara lebih cepat dan ekstensif dibanding mikroba lain. Substrat bagi pertumbuhan mikroba ini adalah selulosa dan hemiselulosa. Degradasi lignin terjadi pada akhir pertumbuhan primer melalui metabolisme sekunder dalam kondisi defisiensi nutrien seperti nitrogen, karbon atau sulfur (Hatakka, 2001). Enzim ligninolitik yang dihasilkan oleh white rot fungi dapat dilihat pada Tabel 2.
Tabel 2. Enzim ligninolitik yang dihasilkan white rot fungi
Enzim Tipe Enzim Peran dalam Degradasi Bekerja sama dengan
LiP Peroksidase Degradasi unit
non-fenolik
H2O2
MnP Peroksidase Degradasi unit fenolik dan
nonfenolik dengan lipid H2O2 dan Lipid
Laccase Lignin
Oksidase Oksidasi unit fenolik dan unit nonfenolik dengan mediator O2 dan mediator : 3- Hidroksibenzotriazol Lain-lain Oksidase Penghasil H2O2 Produksi H2O2 Peroksidase Sumber: Hatakka (2001)
Menurut Hatakka (2001), LiP mengoksidasi unit non fenolik lignin melalui pelepasan satu elektron dan membentuk radikal kation yang kemudian terurai secara kimiawi. LiP dapat memutus ikatan Cα-Cβ molekul lignin dan mampu membuka cincin lignin dan reaksi lain (Gambar 8). Dalam melakukan fungsinya, baik enzim LiP maupun MnP diaktivasi oleh H2O2.
Holobasidium (tidak berseptum)
Phragmobasidium (berseptum lebih dari satu)
12 Gambar 8. Pemotongan ikatan Cα-Cβ molekul lignin dan pembentukan senyawa
antara (Srebotnik et al., 1994)
MnP mengoksidasi Mn2+ menjadi Mn3+. Sifat reaktif Mn3+ yang tinggi selanjutnya mengoksidasi cincin fenolik lignin menjadi radikal bebas tak stabil dan diikuti dengan dekomposisi lignin secara spontan (Hatakka, 2001). Skema pembentukan CO2 dari struktur aromatik lignin oleh MnP dapat dilihat pada Gambar 9.
Gambar 9. Skema pembentukan karbondioksida dari struktur aromatik lignin oleh MnP (Hofrichter, 2002)
Laccase merupakan fenol oksidase yang mengandung tembaga yang tidak membutuhkan H2O2 tetapi menggunakan molekul oksigen. Enzim ini juga ditemukan pada fungi, khamir dan bakteri (Thurston, 1994). Laccase mereduksi O2 menjadi
: Pemutusan ikatan Cα-Cβ molekul lignin
13 H2O dalam substrat fenolik melalui reaksi satu elektron membentuk radikal bebas yang dapat disamakan dengan radikal kation yang terbentuk pada reaksi MnP.
White rot fungi menghasilkan berbagai jenis enzim yang terlibat dalam proses degradasi lignin (Tabel 2), juga menghasilkan selulase, xilanase dan hemiselulase (Hatakka, 2001). Berikut ini merupakan ketiga jenis fungi yang termasuk dalam golongan white rot fungi:
1. Phanerochaete chrysosporium
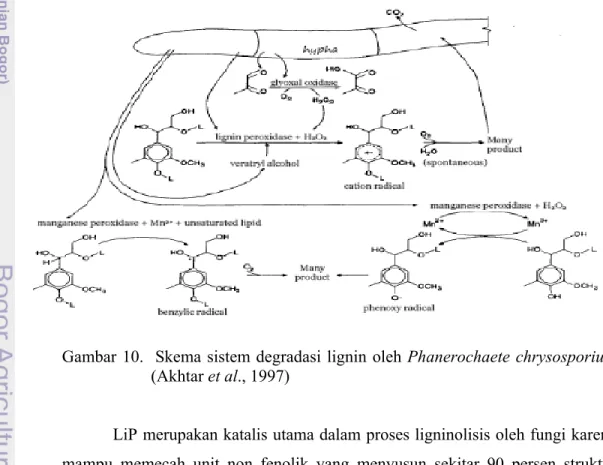
Beberapa fungi, diantaranya P. chrysosporium dapat mendegradasi lignin dan berbagai polutan aromatik selama fase pertumbuhan stasioner yang dipicu oleh kekeurangan nutrisi dalam substrat. Fungi ini menghasilkan dua peroksidase, yaitu Lignin Peroksidase (LiP) dan Manganesse Peroksidase (MnP) yang mempunyai peranan penting dalam proses perombakan lignin (Srebotnik et al., 1994). Skema sistem degradasi lignin oleh P. chrysosporium dapat dilihat pada Gambar 10.
Gambar 10. Skema sistem degradasi lignin oleh Phanerochaete chrysosporium (Akhtar et al., 1997)
LiP merupakan katalis utama dalam proses ligninolisis oleh fungi karena mampu memecah unit non fenolik yang menyusun sekitar 90 persen struktur lignin (Srebotnik et al., 1994). LiP dan MnP mempunyai mekanisme yang
14 berbeda dalam proses ligninolisis (Gambar 10). MnP mengoksidasi Mn2+ menjadi Mn3+ yang berperan dalam pemutusan unit fenolik lignin. LiP mengkatalis oksidasi senyawa aromatik non fenolik (Broda et al., 1996).
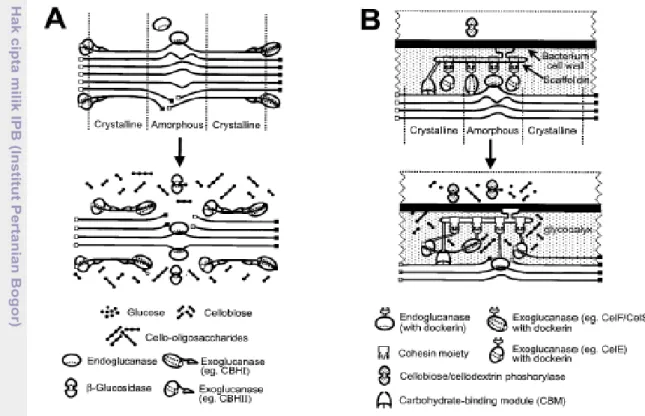
Selain mendegradasi komponen lignin, fungi P. chrysosporium juga menyebabkan terjadinya degradasi selulosa. Skema hidrolisis selulosa menjadi glukosa oleh P. chrysosporium dapat dilihat pada Gambar 11.
Gambar 11. Skema hidrolisis selulosa menjadi glukosa oleh P. chrysosporium (Lynd et al., 2002)
Menurut Lynd et al. (2002) degradasi selulosa oleh fungi merupakan hasil kerja sekelompok enzim selulolitik yang bekerja secara sinergis. Sistem enzim selulolitik terdiri dari tiga kelompok utama yaitu endoglucanases, exoglucanases
dan β-glucosidases. Endoglucanases menghidrolisis secara acak bagian amorf
selulosa menghasilkan oligosakarida dengan panjang yang berbeda dan terbentuknya ujung rantai baru. Exoglucanases bekerja terhadap ujung pereduksi (CHBI) dan non-pereduksi (CHBII) rantai polisakarida selulosa dan membebaskan glukosa. Hidrolisis bagian berkristal selulosa hanya dilakukan secara efisien oleh enzim exoglucanases. Hasil kerja sinergis endoglucanases dan
15
exoglucanases menghasilkan selobiosa. β-glucosidases memecah selobiosa
menjadi 2 molekul glukosa.
Menurut Howard et al. (2003), P. chrysosporium mempunyai suhu pertumbuhan optimum 40 oC, pH 4-7, dan bersifat aerob. Dibandingkan dengan lainnya, fungi pelapuk putih merupakan jenis yang paling aktif mendegradasi lignin dan menyebabkan warna kayu lebih muda. Fungi pelapuk putih memerlukan sumber karbon sebagai energi tambahan atau nutrisinya agar kandungan polisakarida dalam kayu tidak didegradasi. Struktur mikroskopis miselia P. chrysosporium dapat dilihat pada Gambar 12.
Gambar 12. Struktur mikroskopis miselia P. chrysosporium (Michel, 1999) Klasifikasi fungi P. chrysosporium menurut Howard et al. (2003) adalah sebagai berikut:
Kingdom : Fungi
Divisi : Eumycota
SubDivisi : Basidiomycotania
Class : Hymonomycetes
Sub Class : Holobasidiomycetidae
Genus : Sporotrichum (Phanerochaete) Spesies : chrysosporium
2. Pleurotus spp.
Hutan tropis Indonesia kaya akan jenis fungi (Mushroom). Keragaman ini merupakan faktor pendorong perlunya dilakukan usaha pengidentifikasian dari fungi-fungi yang ada, salah satunya Pleurotus spp.. Pleurotus spp. berpotensi sebagai bahan makanan dan bahan obat. Pleurotus spp. merupakan
16 dekomposer bahan organik utama dan diketahui mempunyai daya delignifikasi yang selektif dibanding Pleurotus chrysosporium (Kerem et al., 1992).
Terdapat lebih kurang 67 spesies kelompok Pleurotus yang berhasil dikumpulkan dan dilaporkan oleh para peneliti seluruh dunia, sejak Roussel pada tahun 1805 pertama kali memberi nama Pleurotus. Sampai saat ini penelitian mengenai fungi pleurotoid kelompok Pleurotus asal Indonesia masih sangat terbatas meskipun fungi ini sudah dikenal dan dikumpulkan serta dimanfaatkan masyarakat untuk berbagai keperluan (Herliyana, 2008). Struktur mikroskopis miselia Pleurotus spp. dapat dilihat pada Gambar 13.
Gambar 13. Struktur mikroskopis Pleurotus spp. (Michel, 1999)
Klasifikasi dari Pleurotus spp. menurut Alexopoulos et al. (1996) adalah sebagai berikut: Kingdom : Fungi Divisi : Eumycota Subdivisi : Basidiomycotina Class : Hymenomycetes Subclass : Holobasidiomycetidae Genus : Pleurotus Spesies : Pleurotus spp.
Eaton dan Hale (1993) menyatakan bahwa suhu optimum untuk pertumbuhan Pleurotus spp. yaitu 27oC. Sedangkan Chang dan Miles (1989) menyatakan bahwa kisaran pH optimal untuk pertumbuhan miselia Pleurotus spp. adalah 5.5 – 6.5.
17 Sannia et al. (1991) menemukan bahwa pada fungi pelapuk putih
Pleurotus terdapat aktivitas enzim laccase. Chang dan Quimio (1982)
menyatakan bahwa selain menghasilkan enzim pendegradasi lignin, fungi kelompok Pleurotus juga menghasilkan enzim lain, diantaranya selulase, protease, hemiselulase, dan aminopeptidase.
3. Schizophyllum commune
S. commune merupakan jenis fungi yang keberadaannya tersebar luas di seluruh benua (kecuali antartika) dan menggunakan kayu sebagai substrat untuk pertumbuhannya. Jenis fungi ini merupakan jenis yang dapat dimakan dan tergolong ke dalam keluarga Schizophyllaceae.
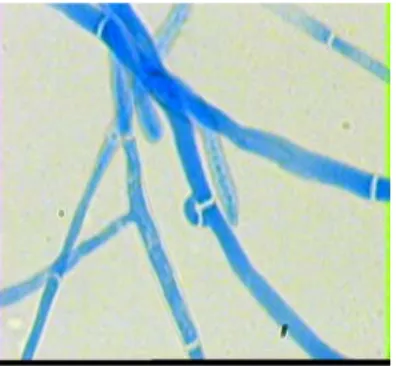
S. commune tumbuh pada media PDA yang telah ditambah 50 g/L NaCl pada suhu optimumnya yaitu 30-35oC, tetapi miselia akan dorman pada suhu 45oC. Fungi dapat tumbuh baik dalam media PDA pada kisaran pH 5 – 6 (Dikin, 2004). Struktur mikroskopis miselia S. commune dapat dilihat pada Gambar 14.
Gambar 14. Struktur mikroskopis S. commune (Buzina et al., 2001) Klasifikasi dari S. commune menurut Alexopoulos et al. (1996) adalah sebagai berikut: Kingdom : Fungi Division : Eumycota Subdivision : Basidiomycotina Class : Hymenomycetes Subclass : Holobasidiomycetidae Genus : Schizophyllum Spesies : commune
18 Martawijaya (1989), mengungkapkan salah satu fungi yang dapat merombak struktur lignoselulosa adalah fungi S. commune. Di daerah tropis, S. commune merupakan fungi perusak kayu. Menurut Ohm et al. (2010) pada S. commune terdapat aktivitas beberapa enzim perusak kayu antara lain lacasse yang berperan dalam degradasi komponen lignin, akan tetapi aktivitas enzim peroksidase tidak ditemukan. Selain itu juga ditemukan aktivitas enzim cellobiose dehydrogenases.