TINJAUAN PUSTAKA
Sapi
Ternak sapi secara zoologi termasuk ke dalam kingdom Animalia, filum Chordata, sub filum Vertebrata, kelas Mamalia, ordo Artiodactyla, famili Bovidae, genus Bos, dan spesies Bos taurus (sapi Eropa), Bos indicus (sapi bergumba), dan Bos sondaicus (Blakely dan Bade, 1998). Spesies Bos taurus memiliki keunggulan pada tingkat pertumbuhan dan produksi yang tinggi, sedangkan spesies Bos indicus lebih unggul dalam hal adaptasinya (resisten pada kondisi lingkungan yang kurang baik) (Gorbani et al., 2009), namun Bos indicus memiliki kelemahan yaitu membutuhkan waktu yang lebih lama untuk mencapai dewasa kelamin dengan periode kebuntingan yang lebih panjang (Parakkasi, 1999). Pengelompokan sapi juga dapat didasarkan pada tujuan produksinya, yaitu tipe sapi perah, tipe sapi pedaging, dan tipe campuran.
Sapi Perah
Bangsa sapi perah yang terdapat di dunia pada dasarnya dapat dikelompokkan menjadi dua, yaitu kelompok sapi perah sub-tropis dan kelompok sapi perah tropis. Menurut Ensminger dan Tyler (2006), bangsa-bangsa sapi perah subtropis, yaitu Friesian Holstein, Yersey, Guernsey, Ayrshire, dan Brown Swiss. Bangsa-bangsa sapi perah tropis, yaitu Red Sindi, Sahiwal, dan PFH (Peranakan Fries Holland). Sapi Friesian Holstein (FH) menduduki populasi terbesar hampir di seluruh dunia, baik negara subtropis maupun tropis.
Sapi FH berasal dari nenek moyang sapi liar Bos taurus, Typicus primigenius yang tidak berpunuk dan ditemukan di provinsi North Holland dan West Friesland, Belanda (Schmidt dan Vleck, 1974). Sapi FH memiliki ciri-ciri berwarna belang hitam putih, pada dahi umumnya terdapat warna putih berbentuk persegi, warna bulu pada bagian bawah kaki dan ekor berwarna putih, memiliki sifat jinak, tenang, mudah dikendalikan, tidak tahan panas dan dapat menyesuaikan diri dengan lingkungan (French, 1996). Sapi FH merupakan bangsa sapi perah yang memiliki tingkat produksi susu tertinggi dengan kadar lemak terendah dibandingkan sapi perah lainnya (Blakely dan Bade, 1998). Produksi susu sapi FH di daerah tropis dapat
4 mencapai 4500-5500 liter per laktasi. Berat badan sapi FH jantan dapat mencapai 1000 kg dan sapi FH betina 650 kg (Chandra et al., 2009).
Peternakan sapi perah dapat dijadikan sumber penghasil susu yang efisien dan secara komersial umum ditemukan di negara-negara seperti Australia, Inggris dan Amerika. Menurut Buckle et al. (2007), seekor sapi perah yang baik akan menghasilkan sekitar 5000 liter susu per tahun (kira-kira sepuluh kali berat badannya sendiri). Di Indonesia, rataan produksi susu sapi perah mencapai 3000 kg/ekor/laktasi (Direktorat Jenderal Peternakan, 2008). Sifat produksi susu pada sapi perah adalah sifat kuantitatif yang dapat dikendalikan oleh banyak gen dan diwariskan serta dipengaruhi oleh faktor lingkungan (Noor, 2000).
Pertumbuhan, reproduksi, dan produktivitas sapi perah dapat dipengaruhi oleh pakan dan manajemen pemeliharaan. Suhu lingkungan yang optimum untuk pemeliharaan sapi perah berkisar antara 5-21 oC, dengan kisaran kelembaban 50-75% (Ensminger dan Tyler, 2006). Pada tingkat pakan tinggi, sapi Holstein dapat mencapai pubertas pada umur 262 hari, sedangkan pada tingkat pakan rendah, pubertas terjadi pada umur 504 hari atau lebih (Tomaszewska et al., 1991). Sifat reproduksi pada peternakan sapi perah rakyat di Indonesia, seperti pada sapi FH menunjukkan umur pertama beranak adalah 3,5 tahun (3-4 tahun), masa kering 45-60 hari, masa kosong 60 hari, calving interval 15-16 bulan, dan service per conception (S/C) = 2 (Dudi et al., 2006).
Sapi Pedaging
Sapi pedaging memiliki keunggulan dalam menghasilkan karkas berkualitas dan tingkat pertumbuhan yang tinggi. Beberapa bangsa sapi pedaging dari spesies Bos taurus yaitu sapi Limousin dan Simental. Sapi Limousin memiliki perdagingan yang bagus dengan laju pertumbuhan yang tinggi (Phillips, 2001), dengan bobot badan sapi betina normalnya adalah 600 kg dan bobot sapi jantan mencapai 1000 kg. Bangsa sapi Simmental memiliki karakter berat sapih dan pertambahan berat badan pasca sapih yang tinggi (Williamson dan Payne, 1993). Sapi yang termasuk dalam spesies Bos indicus, seperti sapi Brahman, memiliki ciri khas yaitu berpunuk di bagian punggungnya, berambut pendek dan halus, serta sebagian besar berwarna putih. Spesies Bos indicus memiliki kemampuan beradaptasi dengan lingkungan panas dan tahan terhadap penyakit caplak (Phillips, 2001).
5 Pemeliharaan sapi potong untuk mempercepat kenaikan bobot badan dapat dilakukan dengan metode penggemukkan yang terdiri atas sistem penggemukkan ekstensif (pasture fattening) dan sistem penggemukkan intensif (dry lot fattening). Sapi yang digemukkan secara intensif memiliki laju pertumbuhan yang lebih tinggi daripada sapi dipelihara pada sistem ekstensif, sehingga waktu yang diperlukan untuk mencapai bobot tertentu menjadi lebih singkat. Sistem pemeliharaan yang bervariasi menyebabkan tingginya keragaman pada respon pertumbuhan sapi (Parakkasi, 1999).
Hormon Pertumbuhan
Menurut Lawrence dan Fowler (2002), pertumbuhan merupakan suatu proses deposisi, pemindahan substansi sel-sel, serta peningkatan ukuran dan jumlah sel pada tingkat dan titik yang berbeda dalam suatu waktu tertentu. Pertumbuhan dikarakterisasikan oleh peningkatan jumlah sel pada jaringan (hyperplasia) dan peningkatan ukuran sel (hypertrophy). Pertumbuhan ternak dapat dipengaruhi oleh faktor lingkungan dan faktor genetik, ataupun interaksi keduanya. Salah satu faktor genetik yang berperan dalam pertumbuhan suatu individu adalah gen GH (growth hormone) atau lebih dikenal dengan gen hormon pertumbuhan.
Hormon pertumbuhan (growth hormone) merupakan hormon peptida yang secara alami dihasilkan oleh somatotropes, subclass dari sel hipofisa acidophilic yang terletak dalam kelenjar hipofisa bagian depan (Reis et al., 2001). Hormon pertumbuhan adalah salah satu faktor yang paling penting dalam pertumbuhan dan perkembangan sel hewan (Pierzchala et al., 2004). Hormon pertumbuhan pada ruminansia diketahui bertanggung jawab untuk galactopoiesis dan persistensi laktasi (Svennersten-Sjaunja dan Olsson, 2005), sehingga sapi perah yang dipilih untuk produksi susu tinggi diharapkan dapat melepaskan sejumlah besar GH endogen dari rata-ratanya.
Gen Hormon Pertumbuhan
Gen merupakan bagian segmen DNA termasuk semua nukleotida yang ditranskripsi ke dalam mRNA yang akan ditranslasi menjadi protein (Brown, 1999; Muladno, 2002). Bagian gen yang mengkode asam amino dan menghasilkan protein disebut daerah penyandi atau coding sequence (CDS) dan terdapat pula bagian
6 segmen depan (leader segment) dan segmen belakang (trailer segment) yang mengapit daerah CDS. Beberapa gen pada eukaryot bersifat tidak kontinyu karena adanya ekson (pengkode protein) dan intron (space internal antara pengkode protein). Pada saat transkripsi, bagian intron hilang (splicing), sehingga proses translasi berjalan baik (Brown, 1999).
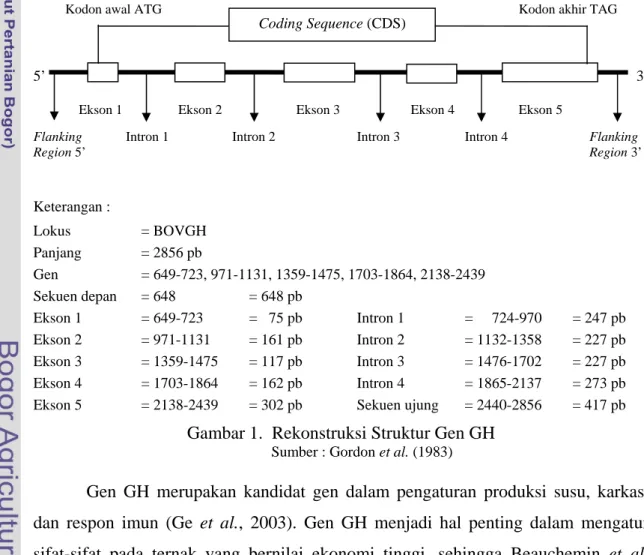
Bovine Growth Hormone (bGH) merupakan sebuah peptida tunggal dengan berat molekul 22 KDa dan disusun oleh 191 asam amino (Wallis, 1973) dengan panjang sekuen nukleotida 2856 pb (Gordon et al., 1983). Gen hormon pertumbuhan sapi Bos taurus (bovine growth hormone gene) terdiri dari lima ekson dan dipisahkan oleh empat intron (Gordon et al., 1983) dan terletak pada kromosom 19 (Hediger et al., 1990). Rekonstruksi struktur gen GH dapat digambarkan berdasarkan sekuens gen GH di GenBank (nomor akses : M57764) (Gambar 1).
Kodon awal ATG Kodon akhir TAG
5’ 3’
Ekson 1 Ekson 2 Ekson 3 Ekson 4 Ekson 5
Flanking Intron 1 Intron 2 Intron 3 Intron 4 Flanking
Region 5’ Region 3’ Keterangan : Lokus = BOVGH Panjang = 2856 pb Gen = 649-723, 971-1131, 1359-1475, 1703-1864, 2138-2439 Sekuen depan = 648 = 648 pb Ekson 1 = 649-723 = 75 pb Intron 1 = 724-970 = 247 pb Ekson 2 = 971-1131 = 161 pb Intron 2 = 1132-1358 = 227 pb Ekson 3 = 1359-1475 = 117 pb Intron 3 = 1476-1702 = 227 pb Ekson 4 = 1703-1864 = 162 pb Intron 4 = 1865-2137 = 273 pb Ekson 5 = 2138-2439 = 302 pb Sekuen ujung = 2440-2856 = 417 pb
Gambar 1. Rekonstruksi Struktur Gen GH
Sumber : Gordon et al. (1983)
Gen GH merupakan kandidat gen dalam pengaturan produksi susu, karkas, dan respon imun (Ge et al., 2003). Gen GH menjadi hal penting dalam mengatur sifat-sifat pada ternak yang bernilai ekonomi tinggi, sehingga Beauchemin et al. (2006) menyatakan bahwa gen GH dapat dijadikan kandidat gen dalam program
7 Marker Asissted Selection pada sapi. Gen GH juga berperan sebagai pengatur utama pada pertumbuhan pasca kelahiran, perkembangan jaringan, otot, tulang, dan jaringan adiposa, pertumbuhan kelenjar mamary, laktasi, reproduksi, serta metabolisme karbohidrat, protein, dan lemak dalam tubuh (Akers, 2006). Gen GH membutuhkan receptor dalam mekanisme ekspresinya ke target jaringan. Menurut Zhou dan Jiang (2005), pada tingkatan jaringan, aksi biologis dari gen GH dimediasi oleh gen GHR.
Polymerase Chain Reaction – Restriction Fragment Length Polymorphism (PCR-RFLP)
Polymerase Chain Reaction (PCR) merupakan suatu reaksi in vitro untuk menggandakan molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA tersebut dengan bantuan enzim polymerase dan oligonukleotida pendek sebagai primer dalam mesin thermocycler (Muladno, 2002). RFLP adalah profil DNA berupa fragmen-fragmen DNA hasil pemotongan enzim endonuklease untuk berbagai individu. Enzim endonuklease atau enzim restruksi (RE) yang mengenali situs pemotongan empat dan enam basa umum dipakai untuk analisis keragaman genetik menggunakan pendekatan analisis RFLP (Green, 1998). Penciri molekuler DNA restriction fragment length polymorphism (RFLP) memiliki tingkat polimorfisme yang tinggi dan secara luas telah digunakan untuk mendapatkan gambaran populasi genetik dan juga untuk mengidentifikasi gen-gen yang mengkode sifat-sifat penting (Montaldo & Herrera, 1998). Analisis RFLP dapat digunakan untuk mendeteksi adanya keragaman gen yang berhubungan dengan sifat ekonomis, seperti produksi dan kualitas susu (Sumantri et al., 2004) dan kualitas karkas (Beauchemin et al., 2006)
Menurut Vasconcellos et al. (2003), teknik PCR-RFLP telah digunakan secara luas untuk mendapatkan variasi pada setiap daerah atau lokasi DNA, baik pada daerah yang bersifat penyandi (coding region) maupun pada daerah yang tidak penyandi atau daerah non-coding pada genom. Tingkat polimorfisme dan mutasi yang tinggi di daerah non-coding diduga dapat mempengaruhi ekspresi gen secara tidak langsung (Funk, 2001).
8 Keragaman Genetik
Keragaman genetik dalam suatu populasi digunakan untuk mengetahui dan melestarikan bangsa-bangsa dalam populasi terkait dengan penciri suatu sifat khusus, serta menentukan hubungan antar subpopulasi yang terfragmentasi dalam suatu spesies (Hartl dan Clark, 1997). Keragaman genetik antara subpopulasi dapat diketahui dengan melihat persamaan dan perbedaan frekuensi alel dan genotipe di antara subpopulasi (Li et al., 2000). Suatu alel dikatakan polimorfik jika memiliki frekuensi alel sama dengan atau kurang dari 0,99 (Nei, 1987). Hukum Hardy-Weinberg menyatakan frekuensi genotipe suatu populasi yang cukup besar akan selalu dalam keadaan seimbang bila tidak ada seleksi, migrasi, mutasi, dan genetic drift; selain itu silang dalam dan silang luar juga dapat mempengaruhi frekuensi genotipe (Noor, 2008). Estimasi perhitungan keragaman genetik dalam populasi secara kuantitatif dapat diperoleh melalui dua ukuran keragaman variasi populasi, yaitu proporsi lokus polimorfisme dalam populasi dan rata-rata proporsi individu heterozigot dalam setiap lokus (Nei dan Kumar, 2000).
Pendugaan nilai heterosigositas diperoleh untuk mendapatkan keragaman genetik dalam populasi yang dapat digunakan untuk membantu program seleksi pada ternak yang akan digunakan sebagai sumber genetik pada generasi berikutnya (Marson et al., 2005). Menurut Javanmard et al. (2005), nilai heterozigositas di bawah 0,5 (50%) mengindikasikan rendahnya variasi suatu gen dalam populasi dan jika nilai Ho lebih rendah dari He maka dapat mengindikasikan adanya proses seleksi yang intensif (Machado et al., 2003; Tambasco et al., 2003). Avise (1994) menyatakan bahwa semakin tinggi derajat heterozigositas suatu populasi maka daya hidup populasi tersebut akan semakin tinggi. Seiring dengan menurunnya derajat heterozigositas akibat dari silang dalam dan fragmentasi populasi, sebagian besar alel resesif yang bersifat lethal semakin meningkat frekuensinya.
Keragaman Gen Hormon Pertumbuhan
Variasi DNA pada lokus gen hormon pertumbuhan banyak dipelajari akhir-akhir ini, dengan kemajuan teknik molekuler, sehingga variasi gen hormon pertumbuhan dapat dideteksi secara lebih cepat dan akurat. Polimorfisme gen GH ekson IV dan intron 3 dengan situs restriksi menggunakan enzim AluI dan MspI telah
9 dilaporkan sebelumnya pada sapi Nadji (Rastegari et al., 2010); serta sapi South Anatolian dan East Anatolian Red (Yardibi et al., 2009).
Identifikasi mutasi pada hormon pertumbuhan dapat diseleksi pada tingkat DNA (Khatami et al., 2005). Cowan et al. (1989) mendeteksi keragaman lokus gen menggunakan enzim restriksi MspI dan berdasarkan data PCR-RFLP telah diketahui bahwa gen GH memiliki keragaman yang tinggi akibat adanya mutasi. Mutasi dapat terjadi pada level DNA akibat adanya perubahan basa-basa DNA (A = Adenin, T = Timin, G = Guanin, S = Sitosin) dalam bentuk (tipe) substitusi (transisi atau transversi), delesi, insersi dan inversi (Nei, 1987). Situs pemotongan enzim restriksi MspI berubah akibat adanya mutasi transisi dari basa C menjadi basa T (Yao et al., 1996). Mutasi transisi dapat terjadi akibat adanya substitusi antara basa Adenin dengan Guanin (Purin) atau antara basa Sitosin dengan Timin (Pirimidin) (Paolella, 1997).
Keragaman gen GH|MspI terletak pada intron 3 dari gen hormon pertumbuhan pada posisi sekuen 1547 (Zhang et al., 1993) dan panjang fragmen gen GH|MspI berdasarkan hasil yang diperoleh Zhou et al. (2005), yaitu 329 pb. Keragaman gen GH|MspI telah dilaporkan pada berbagai ternak seperti sapi Holstein Beijing yang menunjukkan adanya tiga genotipe, yaitu GH|MspI (+/+) (224 pb, 105 pb), GH|MspI (+/-) (329 pb, 224 pb, 105 pb), dan GH|MspI (-/-) (329 pb). Keragaman gen GH pada sifat produksi susu menunjukkan bahwa sapi bergenotipe GH|MspI (+/+) memiliki tingkat produksi susu dan protein susu yang lebih tinggi serta persentase lemak lebih sedikit dibandingkan sapi bergenotipe GH|MspI (+/-), dengan frekuensi alel rata-rata sebesar 0,875 untuk alel GH|MspI (+) (Zhou et al., 2005). Menurut Thomas et al. (2006), fragmen GH|MspI pada sapi Brangus bergenotipe GH|MspI (+/-) (heterozigot) memiliki pengaruh positif terhadap pertambahan bobot badan harian dan karkas; selain itu, genotip GH|MspI (+/+) dan GH|MspI (+/-) fragmen GH|MspI berpengaruh positif pada sifat bobot badan dan kualitas daging (Unanian et al., 2000).
MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini berlangsung dari bulan Agustus sampai dengan Nopember 2010.
Materi
Sampel
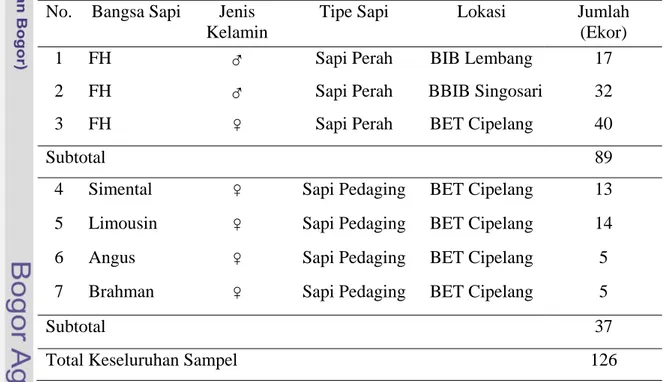
Sampel yang digunakan sebanyak 126 ekor sapi meliputi 89 ekor sapi Friesian Holstein dari BIB Lembang, BBIB Singosari, dan BET Cipelang; serta 37 ekor sapi pedaging (Simental, Limousin, Angus, dan Brahman) dari BET Cipelang sebagai pembanding (Tabel 1). Sampel-sampel tersebut berupa sampel darah yang merupakan koleksi Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor.
Tabel 1. Sampel Darah Sapi Perah dan Sapi Pedaging yang Digunakan No. Bangsa Sapi Jenis
Kelamin
Tipe Sapi Lokasi Jumlah (Ekor)
1 FH ♂ Sapi Perah BIB Lembang 17
2 FH ♂ Sapi Perah BBIB Singosari 32
3 FH ♀ Sapi Perah BET Cipelang 40
Subtotal 89 4 Simental ♀ Sapi Pedaging BET Cipelang 13
5 Limousin ♀ Sapi Pedaging BET Cipelang 14
6 Angus ♀ Sapi Pedaging BET Cipelang 5
7 Brahman ♀ Sapi Pedaging BET Cipelang 5
Subtotal 37
Total Keseluruhan Sampel 126
Keterangan : ♂= jantan dan ♀ = betina
Penanganan dan Pengambilan Sampel
Bahan-bahan yang digunakan adalah ethanol absolute. Alat-alat yang digunakan, yaitu jarum vennoject dan tabung vaccutainer tanpa heparin.
11 Ekstraksi DNA
Bahan-bahan yang digunakan dalam ekstraksi DNA adalah sampel darah 200µl, EDTA (Ethylinediamine tetraacetic), destilation water, 40 µl SDS 10% (Sodium Dodecyl Sulfat), 10 µl enzim Proteinase K 5 mg/ml, 400 µl phenol, 400 µl CIAA, 800 µl etanol absolute, etanol 70%, 40 µl NaCl 5M, 1 x STE (5 M NaCl. 2 M Tris HCL, 0,2 M EDTA), Elution Buffer, dan 100 µl TE 80% (Tris EDTA). Peralatan yang digunakan adalah tabung eppendorf 1,5 ml, satu set mikro pipet, tip, vortexmixer, autoclave, mikrosentrifuge, rotary mixer, inkubator, refrigerator, dan freezer.
Primer
Primer yang digunakan dalam penelitian fragmen gen GH|MspI berdasarkan sumber Mitra et al. (1995), adalah forward : 5’ CCC ACG GGC AAG AAT GAG GC, dan reverse 5’ TGA GGA ACT GCA GGG GCC CA.
Amplifikasi Gen GH|MspI
Bahan yang digunakan dalam analisa PCR-RFLP (Polymerase Chain Reaction-Restriction Fragment Length Polymorphism) adalah sampel DNA, destilated water, 10x buffer PCR, MgCl2, pasangan primer fragmen gen GH|MspI,
enzim Taq DNA polymerase, dNTP (deoxy Nukleotida Triposfat), dan enzim restriksi MspI serta buffernya. Alat yang digunakan adalah satu set pipet mikro, sentrifuge, mesin thermocycler, rak dan tabung eppendorf, tip pipet, dan vortex.
Elektoforesis dan Genotyping (Penentuan Genotipe)
Bahan yang digunakan adalah produk PCR, agarose, loading dye, marker 100 pb, TBE 1x (1 M Tris; 0,9 M Asam Borat; 0,01 M EDTA pH 8,0), dan ethidium bromide. Alat yang digunakan adalah tip pipet, mikropipet 10 P Gilson, gelas kimia, gelas ukur, stirrer, cetakan, power supply electrophoresis, alat foto UV trans iluminator, dan sarung tangan.
12 Prosedur
Pengambilan Sampel
Sampel darah diambil melalui vena jugularis menggunakan jarum vennoject dan tabung vaccutainer tanpa heparin. Sampel darah tersebut ditambahkan etanol absolute dengan perbandingan 1 : 2 dan disimpan pada suhu ruang.
Ekstraksi DNA
Ekstraksi DNA dilakukan dari sampel darah dengan menggunakan metode Sambrook et al. (1989), yang meliputi tahapan :
Preparasi Sampel. Sampel darah 200 µl dimasukkan ke dalam tabung 1,5 ml, kemudian ditambahkan air destilasi 1000 µl. Sampel disentrifugasi pada kecepatan 8000 rpm selama 5 menit, supernatan dibuang.
Degradasi Protein. Sampel yang telah bersih dari alkohol ditambahkan 1xSTE sebanyak 350 µl, 40 µl SDS 10% dan 10 µl proteinase K 5 mg/ml, kemudian dikocok perlahan dalam inkubasi pada suhu 55 ˚C selama dua jam.
Degradasi Bahan Organik. Larutan yang telah diinkubasi ditambahkan 400 µl phenol, 400 µl chloroform isoamyl alcohol (24:1) dan 40 µl NaCl, kemudian dikocok perlahan pada suhu ruang selama 1 jam.
Presipitasi DNA. Larutan disentrifugasi pada kecepatan 12000 rpm selama 5 menit hingga supernatan yang mengandung DNA terpisah dari larutan fenol. Supernatan sebanyak 400 µl dipindahkan ke tabung baru, ditambahkan 40 µl NaCl 5 M dan 800 µl etanol absolute, dihomogenkan, kemudian larutan di-freezing over night. Tahapan selanjutnya, disentrifugasi pada kecepatan 12000 rpm selama 5 menit, kemudian bagian supernatan dipisahkan dan ditambahkan 800 µl EtOH 70%, dan tahap ini diulang kembali, kemudian didiamkan dalam keadaan terbuka. Tahap selanjutnya ditambahkan 100 µl TE 80% dan disimpan dalam freezer sampai akan digunakan.
Amplifikasi Gen GH|MspI
Amplifikasi gen GH menggunakan metode PCR. Pereaksi amplifikasi DNA yang digunakan terdiri dari sampel DNA 1µl, destilated water 9,7 µl, primer 0,1 μl, Taq polymerase 0,05 µl dan buffer 1,25 µl, dNTP 0,1 µl, dan MgCl2 0,25 µl.
13 thermocycler dengan kondisi suhu pradenaturasi 94 °C selama 5 menit, denaturasi 94 °C selama 45 detik, annealing 62 °C selama 45 detik dan extensi 72 °C selama 1 menit, dan extensi akhir 72 °C selama 5 menit. Produk PCR dielektroforesis menggunakan agarose 1,5% untuk mengetahui panjang amplifikasi gen GH.
Elektroforesis, Genotyping (Penentuan Genotipe), dan Penentuan Alel
Penentuan genotipe menggunakan pendekatan RFLP dengan menggunakan produk PCR 5 µl yang ditambahkan 1 µl destilation water, buffer 0,7 µl, dan enzim MspI 0,3 µl, kemudian diinkubasi pada suhu 37 oC selama 16 jam. Produk pemotongan DNA tersebut divisualisasikan pada gel agarose 2% dengan buffer 0,5 x TBE (Tris Borat EDTA) yang diwarnai dengan ethidium bromide, dan dijalankan menggunakan power supply electrophoresis pada tegangan 100 Volt. Hasil elektroforesis diamati dengan bantuan sinar UV trans iluminator.
Pita-pita DNA yang muncul dibandingkan dengan marker untuk diketahui panjang fragmennya dan jumlah pita DNA dari setiap sampel dibandingkan untuk menentukan genotipe pita DNA. Penentuan alel GH|MspI (+) dan GH|MspI (-) ditunjukan dengan jumlah dan ukuran besarnya fragmen yang terpotong berdasarkan sekuen gen GH (Gordon et al., 1983). Alel GH|MspI (+) memiliki titik potong MspI (C|CGG) dan menunjukan adanya dua fragmen yang masing-masing panjangnya 103 pb dan 223 pb, sedangkan alel GH|MspI (-) tidak memiliki titik potong dan hanya menunjukan satu fragmen yang panjangnya 327 pb.
Analisis Data
Frekuensi Genotipe dan Frekuensi Alel
Keragaman genotipe masing-masing sampel dapat dilihat dari pita-pita yang ditemukan. Frekuensi genotipe dan frekuensi alel dapat dihitung dengan rumus Nei dan Kumar (2000). Frekuensi genotipe ) dapat diketahui dengan menghitung perbandingan jumlah genotipe tertentu pada sampel setiap lokasi pengamatan, dengan rumus sebagai berikut :
14 Frekuensi alel ) merupakan rasio relatif suatu alel terhadap keseluruhan alel pada suatu lokus dalam populasi, dengan rumus sebagai berikut :
∑
Keterangan :
= frekuensi genotipe ke-ii = frekuensi alel ke-i
nii = jumlah individu bergenotipe ii nij = jumlah individu bergenotipe ij N = jumlah individu sampel Keseimbangan Hardy-Weinberg
Keseimbangan Hardy-Weinberg diuji dengan menggunakan perhitungan Chi-Kuadrat (Hartl dan Clark, 1997) :
Keterangan :
= uji Chi-kuadrat
O = jumlah pengamatan genotipe ke-i E = jumlah harapan genotipe ke-i Heterozigositas
Keragaman genetik dapat diketahui melalui estimasi frekuensi heterozigositas pengamatan yang diperoleh dari masing-masing lokasi, dengan menggunakan rumus Weir (1996) sebagai berikut :
Keterangan :
Ho = heterozigositas pengamatan nij = jumlah individu heterozigot N = jumlah individu yang diamati
Heterozigositas harapan (He) berdasarkan frekuensi alel dihitung menggunakan rumus Nei dan Kumar (2000) sebagai berikut :
15 Keterangan :
He = nilai heterozigositas harapan = frekuensi alel