1 BAB I PENDAHULUAN BAB I PENDAHULUAN
A. Latar Belakang Masalah
Hiperkolesterolemia atau kadar kolesterol tinggi merupakan permasalahan pada masyarakat. Penyebab hiperkolesterolemia antara lain diet tinggi kolesterol atau tinggi asam lemak jenuh, peningkatan bobot badan, proses penuaan, faktor genetik, dan penurunan kadar estrogen pada wanita yang telah menopause (Grundy, 2006). Prevalensi hiperkolesterolemia di Indonesia pada kelompok usia 25 – 34 tahun adalah 9,3% dan meningkat sesuai dengan bertambahnya usia (Sandjaja, 2004).
Hiperkolesterolemia merupakan salah satu faktor risiko mayor penyakit jantung koroner (Debra, 2004). World Health Organization (WHO) memperkirakan hiperkolesterolemia berkaitan dengan lebih dari separuh kejadian penyakit jantung koroner dan lebih dari 4 juta kematian tiap tahunnya (Rader, 2003). Oleh sebab itu, perlu penanganan yang serius untuk mengatasi masalah hiperkolesterolemia.
Angkak dan kayu manis sendiri merupakan bahan – bahan yang sudah diteliti dapat menurunkan kadar kolesterol. Oleh karena itu, LIPI (Lembaga Ilmu Pengetahuan Indonesia) telah meneliti dan berusaha menghasilkan suatu produk dari angkak dan kayu manis untuk mengatasi masalah hiperkolesterolemia, tetapi produk ini masih berupa sediaan uji yang harus diteliti keefektifan dan toksisitasnya.
Angkak dipercaya mampu meningkatkan trombosit pada penderita demam berdarah dengue, obat asma, diare, disentri, mabuk laut, luka memar, dan anti ngompol, serta dapat menurunkan kadar kolesterol (Triana dan Nurhidayat, 2006; Danuri, 2009). Hasil penelitian yang dilakukan oleh Kasim et al. (2006) menunjukkan bahwa pemberian angkak mampu menekan kenaikan kadar kolesterol total darah tikus sebesar 49,28%.
Kayu manis juga sudah banyak digunakan oleh masyarakat luas, terutama sebagai bumbu masakan. Selain itu, kayu manis juga dapat digunakan sebagai penurun kolesterol. Menurut Azima (2004), ekstrak kulit batang tanaman kayu manis efektif untuk menghambat pembentukan LDL di dalam darah dan terbukti dapat menurunkan trigliserida.
Produk yang akan diteliti ini adalah sediaan penurun kolesterol LIPI 2013 yang berisi kombinasi angkak dan kayu manis. Sediaan ini harus lulus uji praklinik terlebih dahulu sebelum bisa dilakukan uji klinik dan digunakan pada masyarakat. Uji praklinik yang dilakukan adalah uji toksisitas akut, yaitu uji ketoksikan tidak khas yang dirancang untuk mengevaluasi keseluruhan efek toksik suatu senyawa pada hewan uji (Donatus, 2005). Pada pengujian toksisitas akut ini sediaan uji akan diberikan secara oral.
Dua senyawa yang masing – masing tidak toksik ketika digabungkan atau dikombinasi dapat menjadi toksik, begitu juga sebaliknya. Contohnya adalah tanaman black cohosh (Cimicifuga racemosa) dan red clover (Trifolium pratense). Secara tunggal, ekstrak black cohosh dikatakan memiliki potensi hepatotoksisitas pada penilitian in vivo menggunakan mencit dan tikus (Firenzuoli et al., 2011).
Selain itu, LD50biochanin A yang terkandung dan biasa diisolasi dari tanaman red clover tergolong rendah, yaitu 63 mg/kgBB (Yun et al., 1991). Namun, ketika keduanya dikombinasi menjadi sebuah suplemen kesehatan, suplemen tersebut dikatakan aman lewat uji klinik pemakaiannya selama 12 bulan (Geller et al., 2009).
Dalam hal ini angkak dan kayu manis secara tunggal sudah diteliti dan dinyatakan tidak toksik. Namun, ketika keduanya digabung, kemungkinan akan muncul interaksi dan efek toksik yang tidak diketahui. Oleh sebab itu, uji toksisitas akut oral untuk sediaan penurun kolesterol LIPI 2013 perlu dilakukan.
Pengujian toksisitas akut oral dilaksanakan sesuai prosedur OECD Guideline
423 pada tikus betina galur SD. Metode tersebut merupakan metode yang paling disarankan untuk uji toksisitas akut oral bagi suatu senyawa baru (OECD, 2001). Uji toksisitas akut dilakukan untuk mengetahui potensi ketoksikan (LD50), yakni
dosis yang dapat menyebabkan kematian pada separuh hewan uji, mengetahui gejala toksik yang muncul akibat perlakuan, dan untuk mengetahui spektrum efek toksiknya pada organ – organ hewan uji melalui pemeriksaan histopatologi.
B. Rumusan Masalah Permasalahan dalam penelitian ini adalah:
1. Seberapa besar potensi ketoksikan akut oral (LD50 cut off) sediaan penurun
kolesterol LIPI 2013 pada tikus betina galur SD?
2. Apa sajakah gejala – gejala toksik yang muncul akibat pemberian sediaan penurun kolesterol LIPI 2013?
3. Bagaimana spektrum efek toksik sediaan penurun kolesterol LIPI 2013 pada organ – organ vital hewan uji melalui pemeriksaan histopatologi?
C. Tujuan Penelitian
1. Mengetahui potensi ketoksikan akut oral (LD50 cut off) sediaan penurun
kolesterol LIPI 2013 pada tikus betina galur SD.
2. Mengetahui gejala – gejala toksik yang muncul akibat pemberian sediaan penurun kolesterol LIPI 2013.
3. Mengetahui spektrum efek toksik sediaan penurun kolesterol LIPI 2013 pada organ – organ vital hewan uji melalui pemeriksaan histopatologi
D. Tinjauan Pustaka 1. Angkak
Angkak (gambar 1) merupakan hasil fermentasi beras oleh Monascus purpureus.
Gambar 1. Angkak (Astawan, 2008)
Angkak banyak digunakan sebagai pewarna alami untuk minuman dan makanan, antara lain anggur merah, ikan, keju, dan daging (Ma et al., 2000). Selain itu, angkak juga banyak digunakan sebagai obat tradisional untuk berbagai penyakit,
antara lain menaikkan trombosit pada penderita demam berdarah dengue, asma, kelainan urinasi, diare, berbagai penyakit infeksi, dan kolesterol (Triana dan Nurhidayat, 2006 ; Danuri, 2009).
Monascus purpureus (gambar 2) adalah kapang utama pada angkak. Berikut ini adalah klasifikasi dari kapang Monascus purpureus:
Kingdom : Fungi Divisio : Amastigomycotina Subdivisio : Ascomycotina Kelas : Ascomycetes Subkelas : Plectomycetidae Ordo : Eurotiales Famili : Trichocomaceae Genus : Monascus
Spesies : Monascus purpureus
(Wanti, 2008)
Gambar 2. Monascus purpureus (Anonim, 2014)
Menurut Ma et al. (2000), komponen pigmen yang dihasilkan oleh kapang adalah rubropunktatin (merah), monaskorubin (merah), monaskin (kuning), ankaflavin
(kuning), rubropunktamin (ungu), dan monaskorubramin (ungu). Intensitas pigmen merah yang dihasilkan kapang Monascus purpureus tergantung pada nutrisi dan kondisi lingkungannya. Monascus purpureus akan tumbuh dengan baik pada suhu ±30oC dan pH 4 – 8 (Timotius, 2004). Menurut Tisnadjaja et al. (2010), larutan angkak dalam pelarut akuades memiliki pH 4,7 dan dalam etanol 70% memiliki pH 5,6. Angkak stabil dalam suhu kamar (24o – 27oC), 30oC, dan 40oC.
Monascus purpureus yang digunakan untuk membuat angkak secara alami memproduksi suatu senyawa monacolin K sebagai hasil metabolismenya.
Monacolin K memiliki kesamaan struktur dan fungsi dengan lovastatin. Lovastatin merupakan senyawa yang biasa diproduksi oleh Aspergillus terreus dan digunakan sebagai penurun kolesterol (Tisnadjaja, 2007). Monascus purpureus merupakan mikroorganisme yang paling umum digunakan dalam proses fermentasi untuk menghasilkan senyawa monacolin K dan senyawa monacolin lainnya.
Lovastatin berperan dalam mengatur kadar kolesterol darah melalui mekanisme penghambatan kinerja dari enzim HMG-CoA reduktase ( Hydroxy-Methyl-Glutaryl Coenzyme A). Enzim HMG-CoA reduktase merupakan salah satu enzim yang berperan dalam anabolisme kolesterol, yaitu pada tahap pengubahan CoA menjadi asam mevalonat (Tisnadjaja, 2007). Penghambatan HMG-CoA reduktase akan mencegah pembentukan mevalonat dan kolesterol. Senyawa ini merupakan salah satu senyawa yang bersifat kompetitor kuat terhadap HMG-CoA reduktase dalam mengontrol jalur biosintesis kolesterol (Triana dan Nurhidayat, 2006).
Selain monacolin K, angkak mengandung serat, magnesium, kalsium, dan asam lemak tak jenuh, seperti asam oleat, asam linoleat, dan asam linolenat. Angkak juga memiliki komponen sterol, seperti betasitosterol, campesterol, stigmasterol, dan sapogenin, serta isoflavon (Heber et al., 1999).
Beberapa penelitian telah dilakukan untuk membuktikan pengaruh lovastatin untuk pengobatan hiperkolesterolemia. Menurut Heber et al. (1999), lovastatin dapat menurunkan kadar kolesterol darah sebesar 11 – 32% dan kadar trigliserida sebesar 12 – 19%. Hasil penelitian yang dilakukan oleh Kasim et al. (2006) menunjukkan bahwa pemberian angkak yang mengandung lovastatin mampu menekan kenaikan kadar kolesterol total darah tikus sebesar 49,28%.
Penelitian toksisitas angkak sebelumnya yang dilakukan mengunakan metode injeksi peritoneal tikus putih menunjukkan bahwa angkak mempunyai nilai Lethal Dose50 (LD50) sebesar 7 gram/kgBB, serta dalam uji keracunan subakut tidak
menimbulkan gejala yang abnormal pada organ tubuhnya. Selain itu, konsumsi angkak dengan dosis 18 gram/kgBB secara oral tidak menyebabkan kematian dan keracunan (Danuri, 2009).
Penelitian mengenai toksisitas akut oral angkak pada tikus SD dilakukan dengan memberikan angkak dosis tunggal pada 2,5 gram/kgBB, 5 gram/kgBB, 10 gram mg/kgBB, dan 15 gram/kgBB. Hasil penelitian tersebut menyatakan bahwa aktivitas enzim ALT, AST, serta kadar urea darah pada seluruh kelompok mengalami peningkatan yang cukup signifikan dibandingkan sebelum diberikan perlakuan. Organ hati mengalami kongesti, degenerasi lemak, dan nekrosa,
sedangkan organ ginjal mengalami degenerasi protein dan nekrosa pada epitel tubulusnya (Pratiwi, 2006).
2. Kayu manis
Kayu manis tumbuh baik pada tanah yang subur, gembur, agak berpasir, dan kaya bahan organik pada ketinggian 500 – 1500 meter di atas permukaan laut. Pohonnya tinggi bisa mencapai 10 – 15 meter, batang berkayu, tegak, bercabang, dan berwarna hijau kecokelatan. Daun tunggal, lanset, ujung dan pangkal runcing, tepi rata, panjang 4 – 14 cm, lebar 1 – 6 cm, pertulangan melengkung, warna daun muda merah pucat dan setelah tua berwarna hijau. Bunga majemuk, bentuk malai, tumbuh di ketiak daun. Buah muda berwarna hijau dan setelah tua berwarna hitam, serta memiliki akar tunggang. Kayu manis biasa dimanfaatkan kulit batangnya (gambar 3). Berdasarkan penggolongan dan tata nama tumbuhan, tanaman kayu manis termasuk ke dalam klasifikasi sebagai berikut:
Kingdom : Plantae Divisio : Spermatophyta Subdivisio : Angiospermae Kelas : Dicotyledoneae Ordo : Laurales Famili : Lauraceae Genus : Cinnamomum
Spesies : Cinnamomum burmannii
Kandungan fitokimia dalam ekstrak kayu manis antara lain tanin (polifenol), alkaloid, steroid, flavonoid, dan saponin. Senyawa tanin (polifenol) dan flavonoid dilaporkan dapat berfungsi sebagai antioksidan (Azima et al., 2004). Saponin pada bahan pangan diduga dapat berfungsi dalam menurunkan kolesterol (King, 2002 cit. Azima et al., 2004).
Gambar 3. Kulit batang tanaman kayu manis (Troiani, 2008)
Azima dalam penelitiannya tahun 2004 menunjukkan bahwa ekstrak kulit batang pohon kayu manis efektif untuk menghambat pembentukan LDL di dalam darah. Penelitian dilakukan dengan pemberian ekstrak kayu manis sebanyak 100 – 200 mg/kgBB pada kelinci percobaan selama 12 minggu. Pada akhir percobaan ditemukan kolesterol total kelinci turun dari 443,3 mg/dL menjadi 139,1 mg/dL, kadar LDL turun dari 268,5 mg/dL menjadi 95,8 mg/dL, serta trigliserida turun dari 122,2 mg/dL menjadi 61,2 mg/dL. Sebaliknya, HDL naik dari 32,4 mg/dL menjadi 50,0 mg/dL.
Mekanisme penurunan kolesterol ini belum diketahui secara pasti, tetapi diduga hampir sama dengan senyawa – senyawa yang mengandung polifenol. Hal ini berkaitan dengan kemampuan untuk menangkal radikal bebas sehingga efektif dalam menghambat oksidasi, terutama pada senyawa lipida (Azima et al., 2004).
Safithri et al. (2012) dalam jurnalnya mengenai uji toksisitas minuman yang mengandung Piper crocatum dan Cinnamomum burmannii (kayu manis) mengatakan bahwa tidak ada gejala toksik secara fisik pada perlakuan dengan dosis mencapai 1.890 mg/kgBB pada tikus. Dari hasil pemeriksaan darah serta histopatologi pada hati dan ginjal tidak ditemukan gejala hematotoksisitas, hepatotoksisitas, maupun nefrotoksisitas.
Ahmad et al. (2013) dalam penelitiannya mengenai toksisitas akut (14 hari) dan subkronis (28 hari) ekstrak metanol Cinnamomum burmannii pada tikus galur SD mengatakan bahwa tidak ditemukan gejala toksik pada uji toksisitas akut dan subkronis. Ekstrak metanol Cinnamomum burmannii yang diberikan secara oral pada dosis 500, 1.000, dan 2.000 mg/kgBB tidak menimbulkan tanda – tanda toksik yang tampak maupun kematian.
Selain itu, tidak ada perbedaan signifikan pada kondisi umum, pertumbuhan, bobot organ, parameter hematologi, parameter biokimia, dan pemeriksaan histopatologi organ dari kelompok kontrol maupun perlakuan, serta tidak ditemukan adanya kelainan. LD50 ekstrak metanol Cinnamomum burmannii
ditemukan lebih dari 2.000 mg/kgBB. No Observed Adverse Effect Level (NOAEL) pada penelitian selama 28 hari ditemukan sebesar 2.000 mg/kgBB/hari (Ahmad et al., 2013).
3. Toksisitas dan toksikologi
Istilah toksisitas digunakan untuk menunjukkan suatu sifat relatif dari zat kimia yang menimbulkan efek berbahaya atas mekanisme biologis tertentu (Loomis,
1978). Menurut Hodgson (2004), toksisitas merupakan serangkaian kejadian yang dimulai dari pemberian zat toksik, dilanjutkan dengan distribusi, metabolisme hingga terjadi interaksi antara zat toksik tersebut dengan makromolekul seluler (biasanya berupa DNA atau protein), dan berakhir dengan kemunculan tanda – tanda efek toksik.
Secara sederhana, toksikologi diartikan sebagai studi tentang xenobiotika, ilmu tentang racun, dan interaksi antara agen eksogen dengan sistem biologis. Pada perkembangannya toksikologi didefinisikan sebagai ilmu yang berkaitan dengan racun atau sesuatu yang menimbulkan efek berbahaya jika dipaparkan kepada makhluk hidup baik secara sengaja maupun tidak sengaja (Hodgson, 2004).
Untuk mempelajari toksikologi diperlukan pemahaman tentang 4 asas utama toksikologi yang diperoleh berdasarkan alur peristiwa timbulnya efek toksik. Keempat asas tersebut adalah kondisi efek toksik (meliputi kondisi pemejanan dan kondisi makhluk hidup), mekanisme aksi, wujud, dan sifat efek toksik (Donatus, 2005).
a. Kondisi efek toksik. Kondisi efek toksik suatu senyawa adalah berbagai keadaan yang dapat mempengaruhi efektivitas absorbsi, distribusi, dan eliminasi senyawa tersebut dalam tubuh, serta akan menentukan keberadaan zat kimia tersebut secara utuh sebagai zat induk atau sebagai metabolit aktifnya dalam sel sasaran. Adapun yang termasuk dalam kondisi efek toksik adalah kondisi pemejanan dan kondisi makhluk hidup yang terpejani (Donatus, 2005).
Kondisi pemejanan adalah jenis, jalur, lama, kekerapan, saat, dan dosis pemejanan. Kondisi makhluk hidup adalah keadaan fisiologi dan patologi yang
dapat mempengaruhi ketersediaan zat beracun dalam sel sasaran serta efektivitas antaraksi antara zat beracun dengan sel sasaran (Donatus, 2005).
b. Mekanisme efek toksik. Mekanisme efek toksik dapat dibagi menjadi 3, yaitu mekanisme aksi berdasarkan sifat dan tempat kejadian, antaraksi antara racun dan tempat aksinya, dan penumpukan racun dalam gudang penyimpanan tubuh (Donatus, 2005).
1) Mekanisme aksi berdasarkan sifat dan tempat kejadian. Mekanisme dapat dibagi menjadi 2, yaitu mekanisme luka intrasel dan ekstrasel. Mekanisme luka intrasel adalah luka sel yang diawali oleh aksi racun pada tempat aksinya di dalam sel, sering disebut mekanisme langsung atau primer (Donatus, 2005). Respon toksik yang timbul merupakan wujud dari perubahan biokimia, fungsional, atau struktural (Glaister, 1986). Mekanisme luka ekstrasel terjadi secara tidak langsung. Racun beraksi di luar lingkungan sel. Mekanisme ini sering disebut mekanisme tak langsung atau sekunder (Donatus, 2005).
2) Mekanisme aksi berdasarkan antaraksi antara racun dan tempat aksinya. Tempat sasaran molekuler yang terlibat dalam induksi efek toksik di antaranya adalah sisi aktif enzim atau reseptor pada molekul. Mekanisme aksi ini dibagi menjadi 2, yaitu yang reversible dan irreversible.
3) Mekanisme aksi berdasarkan penumpukan racun dalam gudang penyimpanan tubuh. Senyawa yang sangat lipofil di dalam tubuh akan disimpan dalam gudang penyimpanan lemak dan dalam penyimpanan akan bersifat tak aktif. Namun, senyawa tersebut akhirnya terlepas ke
sirkulasi sistemik dan meningkat kadarnya. Bila kadar tersebut melebihi harga KTM nya, maka akan timbul efek toksik (Donatus, 2005).
c. Wujud efek toksik. Wujud efek toksik dapat berupa perubahan biokimia, fungsional, dan struktural:
1) Wujud efek toksik berdasarkan perubahan biokimia. Jenis wujud efek toksik ini berkaitan dengan respon atau kekacauan biokimia terhadap luka sel akibat antaraksi antara racun dan tempat aksi yang terbalikkan (Glaister, 1986).
2) Wujud efek toksik berdasarkan perubahan fungsional. Jenis wujud efek toksik ini berkaitan dengan antaraksi racun yang terbalikkan dengan reseptor atau tempat aktif enzim sehingga mempengaruhi fungsi homeostatis tertentu (Donatus, 2005).
3) Wujud efek toksik berdasarkan perubahan struktural. Termasuk dalam jenis ini di antaranya perlemakan (degenerasi melemak), nekrosis, karsinogenesis, mutagenesis, dan teratogenesis (Donatus, 2005).
d. Sifat efek toksik. Menurut Loomis (1978), secara umum terdapat 2 jenis sifat efek toksik, yaitu reversible (terbalikkan) dan irreversible (tak terbalikkan). Ciri khas sifat efek toksik yang reversible adalah:
1) Jika kadar zat beracun pada tempat aksi atau reseptornya telah habis, maka reseptor atau tempat aksi tersebut akan kembali ke keadaan semula. 2) Efek toksik yang ditimbulkan akan cepat kembali normal.
3) Toksisitas racun bergantung pada dosis serta kecepatan absorbsi, distribusi, dan eliminasi zat beracun.
Ciri khas dari efek toksik yang bersifat irreversible atau tak terbalikkan adalah: 1) Kerusakan bersifat menetap (permanen).
2) Pemberian berikutnya akan menimbulkan kerusakan yang sama sehingga memungkinkan terjadinya akumulasi efek toksik.
3) Pemberian dosis kecil sama efektif dengan yang ditimbulkan oleh pemberian dosis besar dalam jangka waktu pendek.
4. Uji toksisitas
Uji toksisitas atau uji toksikologi sangat penting dalam pengembangan suatu obat baru untuk memastikan keamanannya bagi manusia. Uji toksisitas inilah yang merupakan salah satu bagian dari uji praklinik yang dilakukan pada hewan uji untuk tes keamanan suatu obat baru yang akan dikembangkan. Penelitian toksikologi menggunakan hewan uji ini merupakan sumber data utama bagi evaluasi toksikologi karena mengungkapkan serangkaian efek akibat pemberian zat toksik pada berbagai peringkat dosis dengan waktu pemberian bervariasi serta menunjukkan organ sasaran, sistem yang terpengaruh, atau toksisitas khusus yang muncul (Lu, 1995).
Tujuan uji toksisitas secara umum adalah menentukan dosis suatu sediaan uji yang dapat menimbulkan kematian atau gejala toksik pada organ atau jaringan, mengidentifikasi hubungan kausatif antara dosis yang diberikan dengan terjadinya perubahan fisiologis dan morfologi suatu organisme, serta melakukan monitoring terkait variasi hewan uji dengan responnya terhadap sediaan uji (Donatus, 2005).
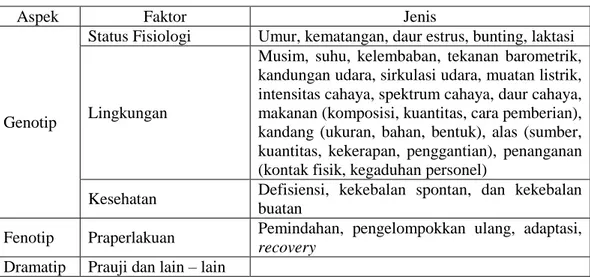
Adapun faktor – faktor yang mempengaruhi hewan uji saat uji toksikologi tertulis dalam tabel I.
Tabel I. Faktor – faktor yang mempengaruhi hewan uji (Hurni, 1970)
Aspek Faktor Jenis
Genotip
Status Fisiologi Umur, kematangan, daur estrus, bunting, laktasi
Lingkungan
Musim, suhu, kelembaban, tekanan barometrik, kandungan udara, sirkulasi udara, muatan listrik, intensitas cahaya, spektrum cahaya, daur cahaya, makanan (komposisi, kuantitas, cara pemberian), kandang (ukuran, bahan, bentuk), alas (sumber, kuantitas, kekerapan, penggantian), penanganan (kontak fisik, kegaduhan personel)
Kesehatan Defisiensi, kekebalan spontan, dan kekebalan
buatan
Fenotip Praperlakuan Pemindahan, pengelompokkan ulang, adaptasi,
recovery
Dramatip Prauji dan lain – lain
Pada dasarnya uji toksikologi dapat dibagi menjadi 2 golongan, yaitu uji ketoksikan khas dan uji ketoksikan tidak khas. Uji ketoksikan tidak khas adalah uji toksikologi yang dirancang untuk mengevaluasi keseluruhan atau spektrum efek toksik suatu senyawa pada aneka ragam jenis hewan uji. Termasuk dalam golongan uji ketoksikan tidak khas ini adalah uji ketoksikan akut, subkronis, dan kronis (Loomis, 1978). Uji toksisitas akut adalah uji toksisitas yang dirancang untuk mengetahui nilai LD50 dan dosis maksimal yang masih dapat ditoleransi oleh hewan
uji yang hasilnya disesuaikan untuk manusia. Pengamatan dilakukan selama 24 jam, lalu diteruskan selama 7 – 14 hari. Uji toksisitas subkronis adalah uji toksisitas senyawa yang diberikan dengan dosis berulang pada hewan uji tertentu. Pengamatan dilakukan dengan 3 dosis selama 4 minggu – 3 bulan dan dengan 2 spesies yang berbeda. Uji toksisitas kronis menggunakan hewan rodent dan
subkronis terletak pada lamanya pemberian sediaan uji, masa pengamatan dan pemeriksaannya, serta tujuannya. Uji toksisitas kronis diperlukan jika nantinya obat akan digunakan dalam waktu panjang (Priyanto, 2009).
Uji ketoksikan khas bertujuan mengevaluasi secara rinci efek yang khas dari suatu zat beracun pada aneka ragam hewan uji. Termasuk dalam uji toksisitas khas adalah uji potensiasi, uji karsinogenesis, uji mutagenesis, uji teratogenik, uji reproduksi, uji kulit dan mata, serta uji perilaku (Donatus, 2005).
5. Uji toksisitas akut
Uji toksisitas akut atau uji ketoksikan akut merupakan uji yang dirancang untuk menentukan efek toksik suatu senyawa yang akan terjadi dalam waktu singkat setelah pemejanannya dalam dosis tertentu (Donatus, 2005). Uji ini dilakukan dengan cara memberikan dosis tunggal senyawa uji pada hewan uji. Dosis yang dianjurkan paling tidak 4 peringkat dosis, berkisar dari dosis terendah yang tidak atau hampir tidak menyebabkan kematian hewan uji sampai dengan dosis tertinggi yang menyebabkan kematian pada seluruh atau hampir seluruh hewan uji. Senyawa uji diberikan melalui jalur yang akan digunakan oleh manusia atau jalur yang memungkinkan manusia terpejani dengan senyawa itu. Biasanya pengamatan dilakukan selama 24 jam, lalu diteruskan sampai 7 – 14 hari. Pengamatan yang dilakukan meliputi gejala – gejala klinis, jumlah hewan yang mati, dan histopatologi organ (Loomis, 1978).
Data kuantitatif yang diperoleh dari uji toksisitas akut adalah LD50, sedangkan
uji. LD50 adalah dosis senyawa uji yang dapat menimbulkan kematian pada separuh
atau lebih dari separuh jumlah hewan uji. Data ini dapat digunakan untuk memperkirakan potensi ketoksikan akut senyawa relatif terhadap senyawa lain. Selain itu, juga dapat digunakan untuk memperkirakan dosis uji toksikologi lainnya (Loomis, 1978; Donatus, 2005).
6. Metode uji toksisitas akut oral OECD Guideline 423
Guideline OECD untuk uji senyawa kimia merupakan salah satu metode yang menjadi acuan untuk uji toksisitas suatu senyawa. Ada beberapa jenis guideline
OECD, salah satunya adalah OECD Guideline 423 untuk uji toksisitas akut oral. Toksisitas akut oral adalah efek – efek samping yang muncul karena pemberian dari dosis tunggal suatu senyawa atau dosis berulang suatu senyawa yang diberikan dalam kurun waktu 24 jam secara oral (OECD, 2001). Metode atau prosedur uji toksisitas akut oral pada OECD Guideline 423 adalah prosedur yang dilakukan secara bertahap dengan menggunakan 3 hewan uji pada setiap step. Bergantung pada tingkat kematian dan kesakitan dari hewan uji, 2 – 4 step mungkin diperlukan dalam menentukan toksisitas akut suatu senyawa (OECD, 2001).
a. Konsiderasi awal. Senyawa yang menyebabkan luka tertentu, luka yang berbekas jelas, korosif, dan menyebabkan iritasi tidak boleh diberikan. Hewan – hewan uji yang sekarat, menunjukkan kesakitan yang luar biasa, atau menunjukkan tanda penderitaan dan menahan stress harus dikorbankan dengan cara yang manusiawi. Metode ini pada prinsipnya tidak dapat memberikan hasil yang benar – benar presisi mengenai data LD50 suatu senyawa, tetapi dapat mendeterminasikan
rentang dosis atau exposure yang dapat menimbulkan kematian hewan uji dalam jumlah banyak atau mayor (OECD, 2001).
b. Prinsip utama uji. Prinsip dasar dari pengujian ini adalah prosedur bertahap dengan menggunakan jumlah hewan uji minimal pada tiap stepnya. Senyawa uji akan diberikan secara oral dengan dosis tertentu pada 1 kelompok hewan uji. Setiap step menggunakan 3 hewan uji dengan jenis kelamin sama. Ada tidaknya kematian pada hewan uji pada satu dosis atau satu step tertentu akan menentukan langkah selanjutnya:
1) Tidak perlu dilakukan pengujian lebih lanjut.
2) Perlakuan pada 3 hewan uji tambahan dengan dosis sama.
3) Perlakuan pada 3 hewan uji tambahan dengan dosis yang lebih tinggi atau dosis yang lebih rendah.
Metode ini akan dapat mengklasifikasikan dan menentukan LD50cut off, yaitu
rentang dosis senyawa uji yang dapat menyebabkan kematian pada separuh atau lebih dari separuh jumlah hewan uji (OECD, 2001).
c. Deskripsi metode. Hewan uji rodent yang biasa digunakan adalah tikus walaupun spesies rodent lain bisa digunakan. Biasanya dalam metode ini yang direkomendasikan adalah jenis kelamin betina. Hal ini disebabkan betina memiliki sensitivitas yang lebih tinggi terhadap ketoksikan daripada jantan sehingga dengan dosis yang sama memungkinkan gejala – gejala toksik secara fisik sudah tampak pada hewan betina, tetapi belum tampak pada hewan jantan. Digunakan hewan yang sudah dewasa dan sehat berumur 8 – 12 minggu dan bobotnya kurang lebih 200 gram (OECD, 2001).
Suhu dari laboratorium seharusnya ±25oC. Kelembaban relatif ruangan sebaiknya 70% (±10%). Penerangan dan cahaya pun harus diatur sehingga tersedia 12 jam terang dan 12 jam gelap. Hewan uji dipilih secara random, dikelompokkan menurut dosis, dan sebaiknya diaklimatisasikan dengan kondisi laboratorium selama 3 – 5 hari (OECD, 2001).
Dosis yang diberikan pada hewan uji sebisa mungkin bukanlah dosis maksimal, begitu juga dengan volume pemberian senyawa uji. Volume maksimal pemberian senyawa uji tergantung dari besarnya hewan uji. Pada rodent volume pemberian tidak boleh melebihi 1 mL/100 gram BB. Senyawa uji harus dibuat baru dan fresh
sebelum pemberian agar stabilitasnya tetap terjaga (OECD, 2001).
d. Prosedur. Senyawa uji diberikan dalam dosis tunggal secara oral. Jika dalam situasi tertentu dosis tunggal tidak dapat diberikan, senyawa uji dapat diberikan secara berulang dalam dosis yang lebih kecil dengan interval waktu tertentu, tetapi harus kurang dari 24 jam.
Hewan uji harus dipuasakan selama beberapa saat sebelum diberi perlakuan. Dipuasakan berarti tidak diberi makanan, tetapi tetap diberi minum. Jika hewan uji adalah tikus, maka harus dipuasakan dalam waktu semalam sebelum perlakuan. Jika hewan uji adalah mencit, maka harus dipuasakan dalam jangka waktu 3 – 4 jam sebelum perlakuan. Hewan uji harus ditimbang dan dicatat bobot tubuhnya sebelum senyawa uji diberikan. Setelah diberi perlakuan hewan uji tetap harus dipuasakan selama 3 – 4 jam pada tikus dan 1 – 2 jam pada mencit (OECD, 2001). Tiga ekor hewan digunakan pada setiap step dosis. Level dosis yang digunakan sebagai dosis awal dapat dipilih dari 4 level yang telah ditetapkan, yaitu 5, 50, 300,
dan 2.000 mg/kgBB. Ketika ada data valid yang dapat memberikan informasi bahwa kematian hewan uji tidak akan terjadi pada dosis tertinggi (2.000 mg/kgBB), maka perlu dilakukan limit test. Ketika tidak ada informasi yang memadai mengenai senyawa uji dan ketoksikannya, dosis yang direkomendasikan sebagai dosis awal adalah 300 mg/kgBB. Interval waktu perlakuan antara satu kelompok hewan uji dengan kelompok yang lain ditentukan berdasarkan onset, durasi, dan keparahan dari gejala toksik yang muncul. Perlakuan pada hewan uji dosis selanjutnya harus dilakukan setelah mendapat kepastian bahwa hewan uji pada perlakuan sebelumnya tidak mati (OECD, 2001).
Limit test digunakan pada situasi di mana terdapat informasi bahwa senyawa uji yang digunakan dicurigai tidak toksik atau baru akan memperlihatkan gejala – gejala toksik pada dosis di atas dosis yang biasa digunakan. Limit test pada dosis 5.000 mg/kgBB dapat dilakukan dengan 3 hewan uji. Apabila dengan dosis ini terjadi kematian hewan uji, maka diperlukan pengujian lebih lanjut dengan dosis yang lebih rendah (OECD, 2001).
e. Observasi dan pengamatan. Hewan uji diamati secara individual setelah pemberian sediaan uji setidaknya pada 30 menit pertama, secara periodikal pada 4 jam pertama, dan setiap hari sekali selama 14 hari. Namun, durasi tiap pengamatan tidak boleh ditetapkan secara kaku. Hal ini harus disesuaikan dengan gejala – gejala toksik yang muncul, onset, dan lamanya waktu pemulihan. Pengamatan meliputi perubahan pada kulit dan bulu, mata, membran mukosal, pernafasan, sirkulasi, otonomi, sistem saraf pusat, aktivitas somatomotor, serta pola perilaku. Perhatian juga harus ditunjukkan pada tremor, kejang, salivasi, diare, lethargi, tidur, dan
koma. Hewan uji yang menunjukkan kesakitan parah, dalam keadaan sekarat, atau dalam kondisi menahan stress berat harus dikorbankan secara manusiawi (OECD, 2001). Pada akhir masa percobaan bobot hewan uji ditimbang lagi dan hewan uji dikorbankan, dibedah, dan diambil organ – organ vitalnya untuk dilakukan pemeriksaan histopatologi (OECD, 2001).
E. Manfaat Penelitian
Dengan mengetahui potensi ketoksikan akut atau LD50 cut off sediaan penurun
kolesterol LIPI 2013 dan bersamaan dengan ED50 (Effective Dose 50) dapat
memperkirakan batas aman farmakologi, yaitu indeks terapinya.
F. Landasan Teori
Pengujian potensi ketoksikan akut angkak dan kayu manis secara terpisah sudah dilakukan. Penelitian sebelumnya tentang angkak menyatakan bahwa pemberian dosis tunggal angkak pada 2,5 gram/kgBB, 5 gram/kgBB, 10 gram/kgBB, dan 15 gram/kgBB meningkatkan aktivitas enzim ALT, AST, dan kadar urea darah secara cukup signifikan, serta terdapat perubahan pada organ hati dan ginjal. Namun, penelitian lain mengenai angkak menyatakan angkak tidak toksik dan tidak memperlihatkan gejala – gejala toksik pada organ. Oleh sebab itu, perlu dilakukan pengujian untuk memastikan potensi ketoksikan angkak. Penelitian sebelumnya mengenai uji ketoksikan akut dan subkronis ekstrak metanol kayu manis mengatakan bahwa kayu manis tidak toksik, tidak menimbulkan gejala –
gejala toksik pada hewan uji, dan tidak menghasilkan kelainan pada organ maupun parameter klinis lainnya.
Pada sediaan ini angkak dan kayu manis dikombinasi karena keduanya memiliki mekanisme yang berbeda dalam menurunkan kolesterol sehingga diharapkan akan meningkatkan fungsinya sebagai penurun kolesterol. Sediaan ini adalah produk atau obat baru yang harus diuji toksisitasnya untuk registrasi. Dalam hal ini angkak dan kayu manis secara tunggal sudah diteliti dan dinyatakan tidak toksik. Namun, ketika keduanya digabung, kemungkinan akan muncul interaksi dan efek toksik yang tidak diketahui. Oleh sebab itu, perlu dilakukan pengujian toksisitas akut oral untuk mengetahui potensi ketoksikan akutnya.
G. Hipotesis
Pemberian sediaan penurun kolesterol LIPI 2013 diduga tidak menimbulkan kematian dan efek toksik yang berarti pada tikus betina galur SD.