AKTIVITAS ANTIHIPERGLIKEMIK DARI EKSTRAK
BUAH MAHKOTA DEWA [Phaleria macrocarpa (Scheff.) Boerl.]
SEBAGAI INHIBITOR ALFA-GLUKOSIDASE
in vitro DAN in vivo PADA TIKUS PUTIH
OLEH :
SRI SUGIWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SRI SUGIWATI. Aktivitas Antihiperglikemik dari Ekstrak Buah Mahkota Dewa [Phaleria macrocarpa (Scheff.)Boerl.] sebagai Inhibitor Alfa-Glukosidase in vitro dan in vivo pada Tikus Putih. Dibimbing oleh MARIA BINTANG dan L. BROTO S. KARDONO.
Inhibitor alfa-glukosidase merupakan obat antidiabetes oral yang digunakan untuk mengobati Diabetes Mellitus (DM) tipe II. Kerja antihiperglikemik dari inhibitor alfa glukosidase berasal dari inhibisi reversibel, kompetitif terhadap enzim hidrolase alfa amilase pankreatik dan enzim-enzim pencernaan di usus halus seperti isomaltase, sukrase dan maltase yang berperan pada hidrolisis karbohidrat makanan menjadi glukosa dan monosakarida lainnya. Pada penderita DM, inhibisi terhadap enzim ini menyebabkan penghambatan absorpsi glukosa sehingga menurunkan keadaan hiperglikemia setelah makan. Penelitian ini bertujuan untuk menguji aktivitas antihiperglikemik dari ekstrak buah mahkota dewa sebagai inhibitor alfa-glukosidase in vitro dan in vivo.
Penelitian ini dilakukan dalam beberapa tahap, yaitu fraksinasi dan ekstraksi buah tua dan buah muda mahkota dewa, penapisan fitokimia, uji inhibisi alfa-glukosidase in vitro dan uji toksisitas dengan metode Brine Shrimp Lethality Test (BSLT) terhadap berbagai ekstrak buah tua dan buah muda mahkota dewa, yang dilanjutkan dengan uji aktivitas antihiperglikemik in vivo dari ekstrak buah tua mahkota dewa dengan Tes Toleransi Glukosa Oral (TTGO) pada model hewan coba tikus.
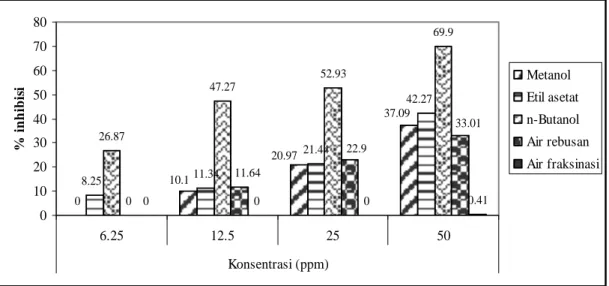
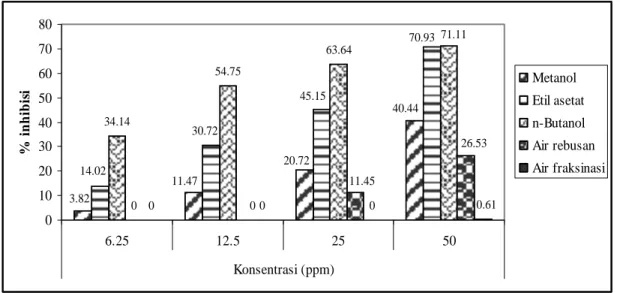
Percobaan uji inhibisi alfa-glukosidase in vitro dilakukan dengan menggunakan enzim alfa-glukosidase dan p-nitrofenil α-D-glukopiranosa sebagai substrat. Hasil percobaan menunjukkan bahwa ekstrak fraksi n-butanol dari buah tua dan buah muda mahkota dewa memiliki aktivitas inhibisi paling tinggi diikuti ekstrak fraksi etil asetat, ekstrak metanol dan ekstrak air hasil rebusan, sedangkan ekstrak air hasil fraksinasi hampir tidak memiliki aktivitas inhibisi.
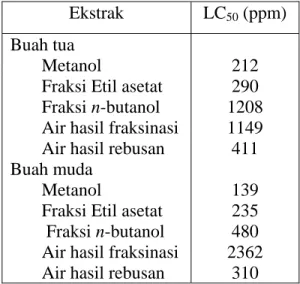
Pada uji toksisitas dengan metode BSLT diamati tingkat mortalitas larva udang Artemia salina Leach yang disebabkan oleh ekstrak buah mahkota dewa. Data yang diperoleh dianalisis dengan menggunakan metode Sam berdasarkan perhitungan jumlah larva yang mati dan hidup. Berdasarkan nilai LC50 dari hasil uji toksisitas dengan BSLT, ekstrak buah muda mahkota dewa lebih toksik daripada ekstrak buah tua, dengan toksisitas paling tinggi adalah ekstrak metanol diikuti ekstrak fraksi etil asetat, ekstrak air hasil rebusan dan ekstrak fraksi n-butanol.
Pada percobaan uji aktivitas antihiperglikemik in vivo digunakan 15 ekor tikus yang dibagi menjadi 3 kelompok perlakuan, yaitu kelompok kontrol positif yang dicekok obat Acarbose, kelompok perlakuan yang dicekok ekstrak air hasil rebusan buah tua dan kelompok perlakuan yang dicekok ekstrak fraksi n-butanol buah tua. Hasil percobaan menunjukkan bahwa pemberian ekstrak air hasil rebusan buah tua dengan dosis 6,20 x 10-4 mg/ g BB tikus dan 1,24 x 10-3 mg/ g BB tikus dan
Acarbose sebagai kontrol positif dengan dosis 1,00 x 10-3 mg/ g BB tikus.
Dari hasil penelitian ini dapat disimpulkan bahwa ekstrak fraksi n-butanol buah muda dan buah tua mahkota dewa memiliki aktivitas antihiperglikemik in vitro tertinggi terhadap inhibisi enzim alfa-glukosidase dan pada percobaan in vivo menggunakan tikus putih, menunjukkan bahwa aktivitas antihiperglikemik dari ekstrak fraksi n-butanol buah tua setara dengan ekstrak air hasil rebusan buah tua dan Acarbose sebagai kontrol positif.
SRI SUGIWATI. Antihyperglycemic Activity of the Mahkota Dewa [Phaleria
macrocarpa (Scheff) Boerl.] Fruit Extracts as Alpha-Glucosidase Inhibitor by in vitro
and in vivo Experiments in the White Rats. Under the direction of MARIA BINTANG and L. BROTO S. KARDONO.
Alpha-glucosidase inhibitor is an oral antidiabetes for use in the management of type 2 diabetes mellitus. The antihyperglycemic activity of alpha-glucosidase inhibitor resulted from a competitive, reversible inhibition of hydrolase enzymes, pancreatic alpha-amylase and intestinal digestion enzymes (i.e., isomaltase, sucrase and maltase) which hydrolyzed dietary carbohydrates to glucose and other monosaccharides. In diabetic patients, inhibition of these enzymes result in a delayed glucose absorption and a lowering of postprandial hyperglycemia. The purpose of this research is to study the antihyperglycemic activity of the fruit extracts of Phaleria
macrocarpa (Scheff) Boerl. as alpha glucosidase inhibitor by in vitro and in vivo
experiments.
The research is performed in several steps: fractionation and extraction of the ripe and unripe fruits, phytochemistry test of the fruit extracts, alpha-glucosidase inhibition test by in vitro experiment, toxicity test of the fruit extracts by using BSLT method and antihyperglycemic activity test by in vivo experiment with Oral Glucose Tolerance Test (OGTT) in the white rats.
The glucosidase inhibition test in vitro is performed by using alpha-glucosidase enzyme and substrate p-nitrophenyl α-D-glucopyranosa. The result of these experiment showed that n-butanol fraction extract of the ripe and unripe fruits have the highest activity followed by ethyl acetate fraction extract, methanol extract and water extract from the boiled of the ripe and unripe fruits. The water fraction extract of ripe and unripe fruits do not have any significant inhibition activity.
Brine Shrimp Lethality Test (BSLT) method used the shrimp larvas of
Artemia salina Leach to study the mortality effect that caused by the fruit extracts of phaleria macrocarpa. The data obtained was analyzed by using Sam’s method. Based
on the LC50 value from the result of BSLT method, the unripe fruit extracts are more toxic than the ripe fruit extracts, with the highest toxicity is methanol extract followed by ethyl acetate fraction extract, boiled water extract and n-butanol fraction extract.
In the antihyperglycemic activity test by in vivo experiment is used fifteen rats which are divided into three treatment groups: the positive control group which is given Acarbose drug, the treatment group which is given the water extract from the boiled ripe fruit and the treatment group which is given the n-butanol fraction extract of ripe fruit. The result of this experiment indicated that giving the water extract from the boiled ripe fruit with dose of 6.20 x 10-4 mg/ g rat and 1.24 x 10-3 mg/ g rat and the n-butanol fraction extract of ripe fruit with dose of 1.81 x 10-3 mg/ g rat and 3.62 x 10-3 mg/ g rat decreased the blood glucose concentration of rats after giving
unripe fruits of Phaleria macrocarpa (Scheff) Boerl. have the highest antihyperglycemic activity by in vitro experiment to inhibition of alpha-glucosidase enzyme and by in vivo experiment in the white rats showed that antihyperglycemic activity from the n-butanol fraction extract of the ripe fruit is the same as the water extract from the boiled ripe fruit and Acarbose as the positive control.
Nama : Sri Sugiwati
NRP : G135010011
Program Studi : Biokimia
Menyetujui,
1. Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, MS L. Broto S. Kardono, Apt. Ph.D, APU
Ketua Anggota
Mengetahui,
2. Ketua Program Studi Biokimia 3. Dekan Sekolah Pascasarjana
Prof. Dr. Norman R. Azwar Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
Berangkat dari suatu perasaan dari lubuk hati yang terdalam,
yang tak terungkap dengan kata-kata tentang keikhlasan hati dari orang-orang terdekat, yang selalu setia dan penuh kasih sayang menemani dan membimbingku dalam menapaki jalan menuju cita. Kupersembahkan karya utama ini kepada
Ibu dan Bapak tercinta
Kakak-Kakak dan Adik-Adikku tersayang Suami dan belahan hatiku terkasih
Di awal kata tak akan pernah kulupa, untuk memanjatkan puji syukur yang terdalam kehadirat Alloh SWT Yang Maharohman dan Maharohim sehingga penulis dapat menyelesaikan karya ilmiah dengan judul “Aktivitas Antihiperglikemik dari Ekstrak Buah Mahkota Dewa [Phaleria macrocarpa (Scheff.) Boerl.] sebagai Inhibitor Alfa-Glukosidase in vitro dan in vivo pada Tikus Putih”.
Ucapan terima kasih dan penghargaan yang tulus penulis sampaikan kepada Ibu Prof. Dr. drh. Maria Bintang, MS sebagai pembimbing I dan Bapak Leonardus Broto Sugeng Kardono, Apt. Ph.D, APU sebagai pembimbing II, yang telah meluangkan waktu memberikan bimbingan, saran, dukungan dan semangat bagi penulis sehingga penelitian dan penulisan karya ilmiah ini dapat diselesaikan dengan baik.
Terima kasih yang sebesar-besarnya juga penulis sampaikan kepada seluruh staf Laboratorium Bahan Alam, Pusat Penelitian Kimia Terapan LIPI, PUSPIPTEK Serpong, terutama kepada Ibu Dra. Puspa Dewi, MSc atas bantuan sarana dan prasarana penelitian. Kepada mbak Mimin, mbak Risna, Lala dan Bapak Achmad,
Kepada Bapak dan Ibundaku tercinta, terima kasih yang tak terhingga atas segala doa dan bimbingannya yang tiada pernah putus-putusnya diberikan kepada penulis dengan penuh kasih dan sayang.
Kepada suamiku, mas Hari Satria dan belahan hatiku, Opik dan Lulu, terima kasih yang amat sangat atas segala doa, pengorbanan, dukungan dan pengertiannya selama ini.
Kepada kakak-kakak dan adik-adikku, mbak Wiwik, Kak Almutholib, Ani, Didi, Herningwang, Parno, keponakan-keponakanku Indri, Arif, Opang, Ilham, Jajang, terima kasih yang tulus atas segala doa dan dukungannya. Mbak Tati dan Mas Suryo, terima kasih atas segala dukungan dan bantuannya tak akan pernah kulupa. Kusweni, terima kasih atas ketulusan dan keikhlasan menjaga dan menemani anak-anakku.
Teman-teman Program Pasca Sarjana Biokimia, FMIPA-IPB, Purbowati, Yosie dan Yuzda, semoga persahabatan yang telah terjalin akan terus berlanjut.
Terima kasih kepada semua pihak yang turut membantu di dalam penelitian dan penulisan karya ilmiah ini yang tidak dapat disebutkan namanya satu persatu.
Penulis menyadari dengan sepenuhnya bahwa karya ilmiah yang telah dapat diselesaikan ini masih jauh dari sempurna dan oleh sebab itu segala saran dan kritik membangun yang diberikan terhadap karya ilmiah ini sangat bermanfaat bagi penulis sebagai penunjang untuk penelitian lebih lanjut.
Bogor, 2 Juli 2005
Sri Sugiwati
Penulis dilahirkan di Jakarta pada tanggal 22 Juni 1970 sebagai anak ketiga dari lima bersaudara, dari pasangan H. Suwarno dan Hj. Sutari.
Pada tahun 1996, penulis menyelesaikan pendidikan sarjana di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Universitas Indonesia.
Pada tahun 1998, penulis menikah dengan Hari Satria Setiawan dan telah dikaruniai seorang putra Muhamad Taufiq Irsyad dan seorang putri Lulu Alya Setyowati.
Penulis bekerja sebagai staf pengajar di Departemen Keperawatan Dasar dan Dasar Keperawatan (DKKD) Fakultas Ilmu Keperawatan Universitas Indonesia sejak tahun 1997 hingga sekarang. Pada tahun 2001 penulis mendapat kesempatan untuk melanjutkan pendidikan ke Program Pascasarjana IPB pada Program Studi Biokimia. Selama pendidikan penulis mendapatkan beasiswa dari BPPS DIKTI.
Halaman
DAFTAR TABEL ………... ix
DAFTAR GAMBAR ……….. x
DAFTAR LAMPIRAN ……… xii
PENDAHULUAN ……… 1
TINJAUAN PUSTAKA Mahkota Dewa ………... 5
Pencernaan dan Absorpsi Karbohidrat ……….. 7
Glikolisis, Jalur Metabolisme Utama Glukosa, Fruktosa dan Galaktosa ... 8
Hormon-Hormon yang Mempengaruhi Kadar Glukosa Darah …………. 14
Diabetes Mellitus (DM) ………. 17
Klasifikasi DM ……….. 18
Diagnosis DM ……… 20
Komplikasi DM ………. 21
Pengobatan DM ………. 23
Mekanisme Kerja Obat sebagai Inhibitor Reaksi Enzim ………... 26
Uji Inhibisi Alfa-Glukosidase ……… 28
Penentuan Kadar Glukosa Darah dengan Glucose Test Strip ……… 29
Model Hewan Percobaan DM ………... 30
BAHAN DAN METODE Waktu dan Tempat ………... 31
Bahan dan Alat ……….. 31
Sampel ………... 32
Model Hewan Coba ………... 32
Rancangan Percobaan ……… 32
Fraksinasi dan Ekstraksi ……… 33
Penapisan Fitokimia ……….. 34
Uji Inhibisi Alfa-Glukosidase ……… 36
Brine Shrimp Lethality Test (BSLT) dengan Larva Udang Artemia salina Leach. ………. 38
Uji Aktivitas Antihiperglikemik dengan Tes Toleransi Glukosa Oral (TTGO) dari Ekstrak Buah Tua Mahkota Dewa pada Hewan Coba Tikus ………. 39
Uji Inhibisi Alfa-Glukosidase ………... 47
Brine Shrimp Lethality Test (BSLT) dengan Larva Udang Artemia salina Leach. ……….. 52
Uji Aktivitas Antihiperglikemik dengan Tes Toleransi Glukosa Oral (TTGO) dari Ekstrak Buah Tua Mahkota Dewa pada Hewan Coba Tikus ………. 55
SIMPULAN DAN SARAN Simpulan ……… 63
Saran ……….. 64
DAFTAR PUSTAKA ……….. 65
Halaman
1 Sistem reaksi enzim untuk satu sampel dengan volume total 2 ml …….. 37 2 Persen rendemen hasil ekstraksi buah mahkota dewa dengan pelarut
metanol ……… 43
3 Persen rendemen hasil fraksinasi dari ekstrak metanol buah muda
mahkota dewa ………. 44
4 Persen rendemen hasil fraksinasi dari ekstrak metanol buah tua
mahkota dewa ………. 44
5 Persen rendemen hasil ekstraksi buah mahkota dewa yang diperoleh
dengan cara rebusan ……… 45
6 Hasil uji toksisitas dengan metode BSLT terhadap berbagai ekstrak
Halaman
1 Tanaman mahkota dewa [Phaleria macrocarpa (Scheff.)Boerl.] …….. 5
2 Pencernaan bertahap dari amilopektin atau glikogen oleh α-amilase dan α(1→6)-glucosidase. α-Amilase pada saliva memutus ikatan glikosida α(1→4) diantara unit maltosa dari amilopektin (atau glikogen), tetapi tidak dapat memutus ikatan glikosida α(1→6) yang terdapat pada titik percabangan (gambar atas). α(1→6) Glukosidase di usus halus memutus ikatan glikosida α(1→6) pada titik percabangan, yang membuka inti amilosa untuk pencernaan lebih lanjut oleh amilase (gambar bawah) ……….. 9
3 Jalur glikolisis ………. 10
4 Jalur masuk fruktosa ke dalam jalur glikolisis ……… 12
5 Perubahan galaktosa menjadi glukosa ……… 13
6 Pengontrolan kadar glukosa darah oleh hormon yang disekresi pankreas, insulin dan glukagon ………... 14
7 Pengontrolan metabolisme glikogen. Fosforilasi menginaktifkan glikogen sintase dan mengaktifkan fosforilase, yang menyebabkan peningkatan glikogenesis dan penghambatan sintesis glikogen ……….. 16
8 Struktur kimia Acarbose ………. 25
9 Inhibisi reversibel kompetitif; inhibitor dan substrat berkompetisi pada sisi aktif enzim. E = enzim; S = substrat; I = inhibitor; ES = kompleks enzim substrat; EI = kompleks enzim inhibitor; P = produk ... 27
10 Inhibisi reversibel non-kompetitif; inhibitor dan substrat terikat secara bersama-sama. E = enzim; S = substrat; I = inhibitor; ES = kompleks enzim substrat; EI = kompleks enzim inhibitor; ESI = kompleks enzim substrat inhibitor; P = produk ... 28
11 Persamaan reaksi enzimatik α-glukosidase dan p-nitrofenil-α-D- glukopiranosa ………. 28
13 Diagram alir penelitian ……… 33 14 Persen inhibisi terhadap enzim alfa-glukosidase dari ekstrak metanol,
ekstrak fraksi etil asetat, ekstrak fraksi n-butanol dan ekstrak fraksi air
dan ekstrak air hasil rebusan dari buah tua mahkota dewa ………. 48 15 Persen inhibisi terhadap enzim alfa-glukosidase dari ekstrak metanol,
ekstrak fraksi etil asetat, ekstrak fraksi n-butanol, ekstrak fraksi air
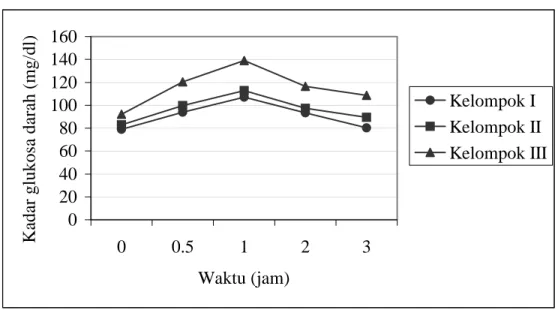
dan ekstrak air hasil rebusan dari buah muda mahkota dewa …………. 50 16 Kurva TGO pada penentuan kadar larutan sukrosa yang akan dicekok
ke tikus. Kelompok I dicekok larutan sukrosa 40% b/v; kelompok II =
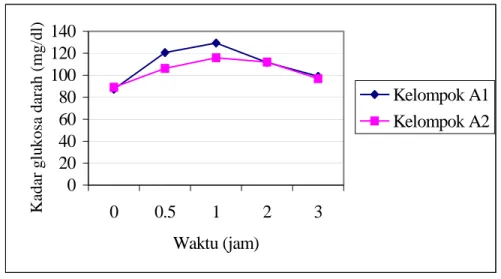
60% b/v dan kelompok III = 80% b/v ………. 57 17 Kurva TGO kelompok A1 (kelompok kontrol positif yang diperlakukan
sebagai kontrol negatif) dibandingkan dengan kelompok A2 (kelompok
kontrol positif) ………. 58
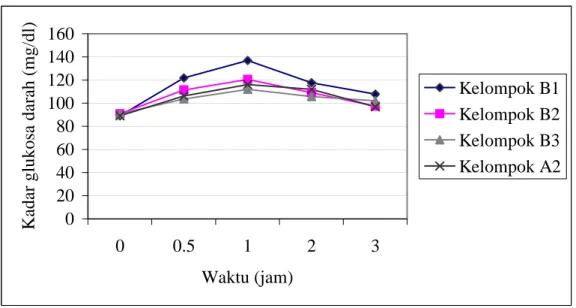
18 Kurva TGO kelompok B2 dan B3 (kelompok perlakuan yang dicekok ekstrak rebusan buah tua dengan dosis masing-masing 6,20 x 10-4 mg/g BB tikus dan 1,24 x 10-3 mg/ g BB tikus) dibandingkan dengan kelompok B1 (kelompok perlakuan B sebagai kontrol negatif) dan
kelompok A2 (kelompok kontrol positif) ……… 60 19 Kurva TGO kelompok C2 dan C3 (kelompok perlakuan yang dicekok
ekstrak fraksi n-butanol buah tua dengan dosis masing-masing
1,81 x 10-3 mg/ g BB tikus dan 3,62 x 10-3 mg/ g BB tikus)
dibandingkan dengan kelompok C1 (kelompok perlakuan C sebagai
Halaman
1 Gambar buah mahkota dewa ……….. 68
2 Bagan fraksinasi dan ekstraksi buah tua dan buah muda mahkota
dewa ………. 70
3 Hasil penapisan fitokimia pada berbagai ekstrak buah tua dan buah
muda mahkota dewa ……… 71
4 Data absorbansi dan persen inhibisi hasil uji inhibisi terhadap enzim alfa-glukosidase secara in vitro dari berbagai ekstrak buah tua
dan buah muda mahkota dewa ……… 72
5 Data hasil uji BSLT dan nilai LC50 dari ekstrak buah tua dan buah muda
mahkota dewa ………. 77
6 Histogram persentase mortalitas larva udang Artemia salina Leach. pada uji toksisitas dengan metode BSLT dari berbagai ekstrak buah
mahkota dewa ………. 82
7 Diagram alir percobaan uji aktivitas antihiperglikemik in vivo dari ekstrak buah tua mahkota dewa dengan Tes Toleransi Glukosa Oral
(TTGO) pada model hewan coba tikus ……….. 83 8 Perhitungan dosis obat Acarbose (Glucobay tablet) yang dicekokkan
pada hewan coba tikus ……… 84
9 Perhitungan dosis ekstrak air hasil rebusan buah tua mahkota dewa
yang dicekokkan pada hewan coba tikus ……… 85 10 Perhitungan dosis ekstrak fraksi n-butanol buah tua mahkota dewa yang
dicekokkan pada hewan coba tikus ……… 86 11 Data hasil pengukuran kadar glukosa darah pada percobaan penentuan
kadar larutan sukrosa yang dicekokkan ke hewan coba tikus ... 87 12 Data hasil pengukuran kadar glukosa darah pada kelompok kontrol positif
14 Data hasil pengukuran kadar glukosa darah pada kelompok perlakuan yang dicekok ekstrak fraksi n-butanol buah tua mahkota dewa
(kelompok C) ……….. 91
15 Hasil Analisis Ragam Faktorial 2x2 RAL kadar glukosa darah kelompok hewan coba tikus pada uji aktivitas antihiperglikemik dengan
Tes Toleransi Glukosa Oral (TTGO) ……….. 93 16 Uji lanjut Duncan pada percobaan uji aktivitas antihiperglikemik
PENDAHULUAN
Latar Belakang
Diabetes Mellitus (DM) merupakan sekumpulan gejala yang timbul pada seseorang, ditandai dengan kadar glukosa darah yang melebihi nilai normal (hiperglikemia) akibat tubuh kekurangan insulin baik absolut maupun relatif (Dalimartha 2003). DM merupakan masalah kesehatan yang serius di seluruh dunia. Menurut laporan terakhir dari International Diabetes Federation (IDF) tahun 2003 penderita DM telah meningkat secara mengkhawatirkan. Global Diabetes Statistic melaporkan tahun 2003 ada 194 juta orang di dunia yang terkena DM dan diperkirakan jumlahnya akan meningkat sampai 333 juta orang pada tahun 2025. Prevalensi DM di Indonesia sekitar 1,2% sampai 2,3% dari jumlah penduduk berusia di atas 15 tahun (Dalimunthe 2004).
DM merupakan penyakit yang perlu diwaspadai karena dapat menyerang semua golongan usia, semua tingkat sosial ekonomi, laki-laki maupun perempuan. Beberapa faktor penyebab penyakit DM adalah faktor keturunan, adanya infeksi virus dan bakteri, bahan kimia toksik seperti aloksan dan streptozotosin, dan nutrisi berlebihan. Nutrisi berlebihan (overnutrition) terutama makanan berkolesterol dan berkadar lemak tinggi, merupakan faktor resiko pertama yang diketahui menyebabkan DM (Utami et al. 2003).
Pada penderita DM menahun yang tidak mengontrol kadar glukosa darahnya, dapat terjadi komplikasi kronis, yang terutama disebabkan oleh kelainan pembuluh
darah seperti makroangiopati dan mikroangiopati. Kelainan pembuluh darah kecil (mikroangiopati) dapat menimbulkan berbagai perubahan pada pembuluh darah kapiler yang ada pada ginjal, mata, dan kaki. Akibatnya, timbul berbagai komplikasi seperti pada kapiler glomerulus ginjal yang menyebabkan nefropati diabetik, pada retina mata menyebabkan retinopati dan berakhir dengan kebutaan. Kelainan pada pembuluh darah besar (makroangiopati) dapat menyebabkan terjadinya penyumbatan pada pembuluh darah jantung yang menyebabkan penyakit jantung koroner. Penyempitan pada pembuluh darah tungkai bawah dapat menyebabkan ulkus dan gangren di kaki, sedangkan kelainan pada pembuluh darah otak menyebabkan penyakit cerebrovaskuler yang mengakibatkan stroke (Dalimartha 2003).
DM merupakan penyakit yang tidak dapat disembuhkan, tetapi dapat dikontrol dengan melakukan upaya-upaya seperti perencanaan diet, mempertahankan bobot badan normal dan melakukan cukup olah raga. Obat hanya perlu diberikan, bila setelah melakukan berbagai upaya tersebut secara maksimal tidak berhasil mengendalikan kadar glukosa darah (Ganiswara et al. 1999). Ada dua macam obat antihiperglikemik, yaitu berupa suntikan insulin dan obat antidiabetik oral yang meliputi golongan sulfonilurea, biguanid, thiazolidinedion, dan inhibitor alfa-glukosidase (Silva 2004).
Inhibitor alfa-glukosidase digunakan untuk mengobati DM tipe II. Berbeda dengan sulfonilurea, obat golongan ini tidak meningkatkan sekresi insulin. Kerja antihiperglikemik dari inhibitor alfa-glukosidase berasal dari inhibisi reversibel, kompetitif terhadap enzim hidrolase alfa-amilase pankreatik dan enzim-enzim pencernaan di usus halus seperti isomaltase, sukrase dan maltase. Enzim-enzim ini
berperan pada hidrolisis karbohidrat makanan menjadi glukosa dan monosakarida lainnya. Pada penderita DM, inhibisi terhadap enzim ini menyebabkan penghambatan absorpsi glukosa sehingga menurunkan keadaan hiperglikemia setelah makan (Slagle 2002; Bayer 2004)).
Beberapa jenis tanaman obat tradisional Indonesia yang secara empiris digunakan sebagai antidiabetes telah diteliti memiliki aktivitas sebagai inhibitor enzim alfa- glukosidase, diantaranya adalah biji alpukat, daun bungur, kulit jamblang, daun salam, daun sukun, daun kesumba dan cocor bebek. Pada penapisan fitokimia, tanaman tersebut memiliki kandungan senyawa golongan fenol (Sutedja 2003). Terdapat beberapa jenis tanaman obat Indonesia lainnya yang secara empiris digunakan sebagai antidiabetes, tetapi belum diteliti aktivitasnya sebagai inhibitor alfa-glukosidase, salah satunya adalah mahkota dewa.
Mahkota dewa [Phaleria macrocarpa (Scheff.) Boerl.] merupakan tanaman asli Indonesia yang berasal dari Papua. Umumnya dibudidayakan sebagai tanaman hias atau tanaman peneduh, tetapi terkadang masih dapat dijumpai tumbuh liar di daerah hutan pada ketinggian 10 m sampai 1.200 m di atas permukaan laut (Hutapea
et al. 1999; Winarto et al. 2003). Tanaman ini telah digunakan secara empirik untuk
mengatasi DM dan berbagai jenis penyakit lainnya seperti kanker, lever, jantung, asam urat, rematik, ginjal, tekanan darah tinggi, eksim, jerawat, dan luka gigitan serangga (Lisdawati 2002). Dari segi kandungan kimia, tumbuhan ini belum banyak diketahui. Evaluasi fitokimia mahkota dewa telah dilakukan, yang antara lain tumbuhan ini diduga mengandung alkaloid, terpenoid, saponin dan poliphenol (Kardono 2003).
Untuk membuktikan secara ilmiah mengenai aktivitas antihiperglikemik dari ekstrak buah mahkota dewa sebagai inhibitor alfa-glukosidase, maka dilakukan penelitian in vitro dan in vivo. Penelitian in vitro dilakukan dengan menggunakan ekstrak buah mahkota dewa sebagai inhibitor terhadap enzim alfa-glukosidase dan
p-nitrofenil α-D-glukopiranosa sebagai substrat. Penelitian in vivo dilakukan dengan
metode uji toleransi glukosa oral pada model hewan coba tikus putih jantan.
Penelitian ini bertujuan menguji aktivitas inhibisi dan membandingkan efektifitas inhibisi terhadap enzim alfa-gukosidase in vitro dari berbagai ekstrak buah muda dan buah tua mahkota dewa secara. Selanjutnya, menguji aktivitas antihiperglikemik in vivo dari ekstrak buah tua dengan metode uji toleransi glukosa oral pada hewan coba tikus putih.
Hipotesis dari penelitian ini adalah ekstrak buah mahkota dewa dapat menginhibisi enzim alfa-gukosidase baik in vitro maupun in vivo.
Penelitian ini diharapkan dapat memberikan pembuktian ilmiah mengenai aktivitas antihiperglikemik pada DM tipe II dari buah mahkota dewa, sehingga penggunaannya sebagai obat antidiabetes dapat dipertanggungjawabkan secara medik. Manfaat lain dari penelitian ini adalah diharapkan dapat meningkatkan penggunaan mahkota dewa sebagai obat antidiabetes alternatif bagi masyarakat terutama masyarakat pedesaan dimana tidak tersedia obat jadi atau karena tidak terjangkau oleh daya beli masyarakat.
TINJAUAN PUSTAKA
Mahkota Dewa
Mahkota dewa [Phaleria macrocarpa (Scheff.) Boerl.] merupakan tanaman asli Indonesia yang berasal dari Papua. Umumnya dibudidayakan sebagai tanaman hias atau tanaman peneduh, tetapi terkadang masih dapat dijumpai tumbuh liar di daerah hutan pada ketinggian 10 m sampai 1.200 m di atas permukaan laut dengan curah hujan rata-rata 1.000-2.500 mm/tahun. Tanaman ini memiliki nama sinonim
Phaleria papuana Warb. Var. Wichannii (Val.) Back., nama daerah Simalakama
(Sumatra), Makuto dewo (Jawa) (Hutapea et al. 1999; Winarto et al. 2003).
Gambar 1. Tanaman Mahkota dewa [Phaleria macrocarpa (Scheff.) Boerl.] Berdasarkan taksonomi tumbuhan, mahkota dewa diklasifikasikan sebagai berikut (Hutapea et al 1999; Winarto et al. 2003) :
Kingdom : Plantae
Divisi : Spermathophyta
Kelas : Dicotyledoneae
Bangsa : Thymelaeales
Suku : Thymelaeaceae
Marga : Phaleria
Spesies : Phaleria macrocarpa (Scheff.) Boerl atau Phaleria papuana Warb var. Winchannii (Val) Back
Morfologi tanaman ini cukup sempurna karena memiliki batang, daun, bunga, dan buah. Buah mahkota dewa terdiri dari kulit, daging, cangkang, dan biji. Buah saat masih muda berwarna hijau muda, tetapi akan berubah menjadi merah marun saat sudah tua. Ukuran buahnya bervariasi, dari sebesar telur ayam kampung hingga sebesar apel merah. Ketebalan kulit berkisar 0,5-1,0 mm. Daging buah berwarna putih dengan ketebalan bervariasi, tergantung ukuran buah (Hutapea et al 1999; Winarto et al. 2003).
Tanaman ini telah digunakan secara empiris untuk mengatasi berbagai jenis penyakit seperti kanker, lever, jantung, kencing manis (diabetes), asam urat, rematik, ginjal, tekanan darah tinggi, eksim, jerawat, dan luka gigitan serangga. Pemakaiannya dapat digunakan sebagai obat dalam dengan cara dimakan maupun diminum atau sebagai obat luar dengan cara dioleskan atau dilulurkan (Lisdawati 2002).
Dari segi kandungan kimia, tumbuhan ini belum banyak diketahui. Evaluasi fitokimia mahkota dewa telah dilakukan, yang antara lain tumbuhan ini diduga mengandung alkaloid, terpenoid, saponin dan poliphenol. Buahnya banyak mengandung berbagai jenis lipid, yang terkonsentrasi pada biji. Sedangkan getahnya mengandung senyawa-senyawa anti-insekta terutama terhadap kumbang tenebrinoid.
Senyawa-senyawa dalam getah antara lain toluquinone, ethylquinone, asam oktanoat, 1-nonene, 1-undecene, 1-pentadecene, 1-heptadene, dan 6-alkyl-1-4-naphtoquinone (Kardono 2003). Dari daging buah mahkota dewa, telah diisolasi beberapa senyawa antikanker (sitostatika), salah satunya adalah suatu lignan, dengan rumus molekul C6H20O6 dan struktur molekulnya 5-[4(4-methoxy-phenyl-tetrahydrofuro-[3,4-c]furan-1-yl]-benzene-1,2,3-triol (Lisdawati 2002).
Pencernaan dan Absorpsi Karbohidrat
Pencernaan karbohidrat (pati dan glikogen) dari makanan, sudah dimulai di dalam mulut, oleh adanya enzim alfa-amilase yang dihasilkan oleh kelenjar saliva. Enzim ini memutus ikatan glikosida α(1→4) pada polisakarida (Mathews dan van Holde 2000).
Pencernaan karbohidrat selanjutnya, berlangsung di usus halus oleh adanya enzim alfa-amilase pankreatik yang disekresi oleh pankreas. Alfa-amilase pankreatik menghidrolisis amilosa menjadi maltosa dan glukosa, sedangkan amilopektin dan glikogen hanya dihidrolisis secara parsial menghasilkan dekstrin, seperti diperlihatkan pada Gambar 2. Enzim ini tidak dapat menghidrolisis sempurna amilopektin dan glikogen, karena tidak dapat memutus ikatan glikosida α(1→6) yang terdapat pada titik percabangan. α(1→6)-Glukosidase (isomaltase) merupakan enzim yang dapat memutus ikatan glikosida α(1→6) pada titik percabangan tersebut, sehingga terbuka kembali gugus baru yang dihubungkan oleh ikatan glikosida α(1→4) dan dapat dihidrolisis lebih lanjut oleh α-amilase hingga mencapai kembali titik percabangan baru yang dihubungkan oleh ikatan glikosida α(1→6). Produk akhir
dari kerja kedua enzim ini secara bertahap adalah penguraian sempurna pati dan glikogen menjadi maltosa dan glukosa. Maltosa dihidrolisis oleh maltase menghasilkan 2 molekul glukosa. Selanjutnya, glukosa dan monosakarida lainnya seperti fruktosa dan galaktosa yang merupakan hasil hidrolisis dari sukrosa dan laktosa diabsorpsi dari usus halus dan dibawa ke hati melalui sirkulasi vena portal (Mathews dan van Holde 2000).
Di dalam hati, lebih dari setengah glukosa yang ada disimpan sebagai glikogen dan juga dioksidasi melalui jalur glikolisis untuk memenuhi kebutuhan energi metabolik hati. Glukosa sisanya, memasuki kembali aliran darah sebagai glukosa bebas untuk dibawa ke jaringan. Di otot, glukosa juga dioksidasi melalui jalur glikolisis untuk menghasilkan energi dan disimpan sebagai glikogen, sedangkan di jaringan adiposa, glukosa diubah menjadi asam lemak dan trigliserida (Schreiber 1984).
Glikolisis, Jalur Metabolisme Utama Glukosa, Fruktosa dan Galaktosa
Glikolisis merupakan jalur metabolisme utama bukan saja bagi glukosa tetapi juga bagi monosakarida lainnya, seperti fruktosa dan galaktosa yang berasal dari makanan. Pada jalur glikolisis, glukosa diubah menjadi piruvat melalui 10 tahapan reaksi seperti diperlihatkan pada Gambar 3. Selanjutnya, piruvat diubah menjadi asetil-KoA dan memasuki siklus asam sitrat yang dirangkai dengan rantai transport elektron dan fosforilasi oksidatif menghasilkan energi kimia dalam bentuk ATP (Schreiber 1984; Strayer 2000).
Gambar 2. Pencernaan bertahap dari amilopektin atau glikogen oleh α-amilase dan α(1→6)-glucosidase. α-Amilase pada saliva memutus ikatan glikosida α(1→4) diantara unit maltosa dari amilopektin (atau glikogen), tetapi tidak dapat memutus ikatan glikosida α(1→6) yang terdapat pada titik percabangan (gambar atas). α(1→6) Glukosidase di usus halus memutus ikatan glikosida α(1→6) pada titik percabangan, yang membuka inti amilosa untuk pencernaan lebih lanjut oleh amilase (gambar bawah).
Fruktosa, sebelum memasuki jalur glikolisis diubah terlebih dahulu menjadi dihidroksiaseton fosfat, gliseraldehid 3-fosfat atau fruktosa 6-fosfat melalui dua jalur reaksi yang berbeda, seperti diperlihatkan pada Gambar 4. Pada jalur pertama, fruktosa difosforilasi menjadi fruktosa 1-fosfat oleh fruktokinase, yang selanjutnya dipecah menjadi gliseraldehid dan dihidroksiaseton fosfat oleh fruktosa 1-fosfat aldolase. Dihidroksiaseton fosfat merupakan intermediet glikolitik, sedangkan gliseraldehid sebelum memasuki jalur glikolisis, difosforilasi oleh tirosin kinase menjadi gliseraldehid 3-fosfat. Pada jalur kedua, fruktosa difosforilasi oleh heksokinase menjadi fruktosa 6-fosfat yang merupakan intermediet glikolitik (Schreiber 1984; Mathews dan van Holde 2000).
Galaktosa memasuki jalur glikolisis dalam bentuk glukosa 1-fosfat yang merupakan intermediet glikolitik, melalui beberapa tahap reaksi seperti diperlihatkan pada Gambar 5. Pada reaksi tahap pertama, galaktosa difosforilasi menjadi galaktosa 1-fosfat oleh galaktokinase. Galaktosa 1-fosfat kemudian bereaksi dengan UDP-glukosa membentuk UDP-galaktosa, dengan melepaskan UDP-glukosa 1-fosfat. Reaksi ini dikatalisis oleh galaktosa 1-fosfat uridil transferase. Selanjutnya, UDP-galaktosa diubah kembali menjadi UDP-glukosa oleh UDP-galaktosa-4-epimerase (Schreber 1984; Mathews dan van Holde 2000).
Gambar 4. Jalur masuk fruktosa ke dalam jalur glikolisis.
Hormon-Hormon yang Mempengaruhi Kadar Glukosa Darah
Pengontrolan kadar glukosa darah dipengaruhi oleh kerja dari beberapa hormon, seperti insulin, glukagon dan epinefrin. Hormon insulin berperan dalam menurunkan kadar glukosa darah, sedangkan glukagon dan epinefrin berperan sebaliknya, yaitu meningkatkan kadar glukosa darah. Mekanisme pengontrolan kadar glukosa darah oleh insulin dan glukagon diperlihatkan pada Gambar 6 (Mathews dan van Holde 2000).
Gambar 6. Pengontrolan kadar glukosa darah oleh hormon yang disekresi pankreas, insulin dan glukagon.
Insulin
Insulin merupakan polipeptida berukuran 5,8 kilodalton, disintesis oleh sel beta pulau Langerhans pankreas, yang disekresi sebagai respon terhadap peningkatan kadar glukosa darah. Aksi insulin terutama pada tiga jaringan organ, yaitu hati, otot
dan jaringan adiposa. Aksi tersebut dapat berupa ambilan, penyimpanan, dan penggunaan glukosa, yang meliputi aktifasi glikolisis di hati; peningkatan sintesis asam lemak dan triasilgliserol di hati dan jaringan adiposa; inhibisi glukoneogenesis di hati; peningkatan sintesis glikogen di hati dan otot serta peningkatan permeabilitas sel terhadap glukosa di hati dan jaringan adiposa (Mathews dan van Holde 2000; Zulfikar 1993).
Glukagon
Glukagon merupakan polipeptida berukuran 3,5 kilodalton, disintesis oleh sel alfa pulau Lagerhans pankreas, yang disekresi sebagai respon terhadap kadar glukosa darah rendah (Mathews dan van Holde 2000).
Jika kadar glukosa darah rendah, glukagon disekresi oleh pankreas dan dibawa oleh aliran darah ke organ sasaran. Hati merupakan organ sasaran utama dari glukagon. Sel-sel hati memiliki reseptor eksternal glukagon. Pada saat berikatan dengan reseptor, glukagon mengaktifasi adenilat siklase, enzim pada permukaan intraselular membran. Adenilat siklase merubah ATP menjadi siklik AMP, yang merupakan second messenger. Selanjutnya, siklik AMP berikatan dan mengaktifasi protein kinase yang bergantung siklik AMP. Protein kinase memfosforilasi beberapa enzim, yang dapat merubah aktifitas enzimatiknya, menjadi bentuk aktif dan tidak aktif. Fosforilasi glikogen sintase merubahnya menjadi bentuk tidak aktif, sehingga menghambat sintesis glikogen. Sebaliknya, fosforilasi pada fosforilase kinase, membuat enzim ini menjadi bentuk aktif. Terbentuknya fosforilase kinase aktif, selanjutnya mengubah glikogen fosforilase tidak aktif menjadi bentuk aktif. Dengan terbentuknya glikogen fosforilase aktif, maka proses glikogenolisis meningkat.
Penghambatan sintesis glikogen dan peningkatan glikogenolisis, menyebabkan peningkatan kadar glukosa darah. Mekanisme pengontrolan metabolisme glikogen oleh hormon glukagon diperlihatkan pada Gambar 7 (Schreiber 1984; Mathews dan van Holde 2000).
Gambar 7. Pengontrolan metabolisme glikogen. Fosforilasi menginaktifkan glikogen sintase dan mengaktifkan fosforilase, yang menyebabkan peningkatan glikogenesis dan penghambatan sintesis glikogen.
Epinefrin
Epinefrin disekresi oleh medulla adrenal, sebagai respon terhadap kadar glukosa darah rendah. Di otot, epinefrin mengaktifasi adenilat siklase, yang menyebabkan peningkatan glikogenolisis dan menghambat sintesis glikogen. Di jaringan adiposa, epinefrin meningkatkan penguraian triasilgliserol menghasilkan bahan bakar untuk jaringan otot. Akibatnya, ambilan glukosa ke dalam otot menjadi berkurang dan menyebabkan peningkatan kadar glukosa darah. Epinefrin juga menghambat sekresi insulin dan menstimulasi sekresi glukagon. Secara keseluruhan kerja dari hormon epinefrin adalah meningkatkan kadar glukosa darah (Mathews dan van Holde 2000).
Diabetes Mellitus
Diabetes Mellitus (DM) merupakan sekumpulan gejala yang timbul pada seseorang, ditandai dengan kadar glukosa darah yang melebihi nilai normal (hiperglikemia) akibat tubuh kekurangan insulin baik absolut maupun relatif (Dalimartha 2003).
Seseorang dapat menderita penyakit DM karena berbagai faktor berikut ini (Utami et al. 2003) :
(1) Faktor genetik atau keturunan
Pada sebagian besar penderita DM memiliki riwayat keluarga yang juga menderita DM.
(2) Virus dan Bakteri
Virus yang diduga menyebabkan DM adalah rubela, mumps, dan human
menyebabkan DM melalui mekanisme infeksi sitolitik pada sel beta yang mengakibatkan kerusakan sel.
(3) Bahan Toksik atau Beracun
Ada beberapa bahan toksik yang mampu merusak sel beta secara langsung, yakni aloksan, pyrinuron (rodentisida), dan streptozotocin (produk dari sejenis jamur).
(4) Nutrisi
Nutrisi berlebihan (overnutrition) merupakan faktor resiko pertama yang diketahui menyebabkan DM. Semakin lama dan berat obesitas akibat nutrisi berlebihan, semakin besar kemungkinan terjangkitnya DM.
Klasifikasi DM
Berikut ini adalah klasifikasi DM dan gangguan toleransi glukosa menurut WHO 1985 (Tjokroprawiro et al. 1988) :
A. Kelas Klinis I. Diabetes Mellitus
1. DM tipe I atau Diabetes Mellitus Tergantung Insulin (DMTI) atau insulin
dependent diabetes mellitus (IDDM)
Kelompok DM tipe I adalah penderita penyakit DM yang sangat tergantung pada suntikan insulin. Kebanyakan penderitanya masih muda dan tidak gemuk. Sekitar 5-10 persen penderita DM menderita DM tipe I. DM tipe I disebabkan karena sebagian besar sel beta pulau Langerhans pankreas yang memproduksi insulin mengalami kerusakan, akibatnya, kadar insulin menjadi kurang atau tidak ada (Dalimartha 2003; Utami et al. 2003).
2. DM tipe II atau Diabetes Mellitus Tidak Tergantung Insulin (DMTI) atau non
insulin dependent diabetes mellitus (NIDDM)
DM tipe II adalah lebih umum daripada tipe I. Di Indonesia 90 persen penderita DM adalah penderita DM tipe II dan umumnya disertai dengan kegemukan. Kebanyakan timbul pada penderita di atas usia 40 tahun. Pada DM tipe II, pankreas masih relatif cukup menghasilkan insulin, tetapi insulin yang ada bekerja kurang sempurna karena jumlah reseptor insulin pada sel target tidak mencukupi, akibat kegemukan. Orang gemuk biasanya memiliki jumlah reseptor insulin yang lebih sedikit daripada orang normal. Kelompok ini terdiri dari penderita tidak gemuk (non-obese) dan penderita gemuk (obese) (Bettelheim dan Jerry 1995; Dalimartha 2003).
3. DMTM (Diabetes Mellitus Terkait Malnutrisi)
Salah satu penyebab terjadinya DMTM diduga karena kekurangan protein jangka panjang yang bersamaan dengan makanan utama singkong, sehingga HCN dari singkong akan merusak sel beta pankreas yang sebenarnya HCN bisa dinetralkan oleh asam amino dari protein makanan, dan selanjutnya dikeluarkan melalui urin (cyanide-cassava hypothesis) (Tjokroprawiro et al. 1988).
4. DM tipe lain yang berhubungan dengan keadaan atau sindrom tertentu
Diabetes tipe ini disebabkan oleh keadaan atau sindrom tertentu seperti penyakit pankreas, penyakit hormonal, keadaan yang disebabkan oleh obat atau zat kimia, gangguan reseptor insulin, dan sindrom genetik tertentu (Ellenberg dan Harold 1983).
II. Gangguan Toleransi Glukosa (GTG)
Penderita gangguan toleransi glukosa (GTG) dinyatakan dengan adanya peningkatan kadar glukosa darah pada tes toleransi glukosa oral (TTGO) dimana nilainya ada di daerah perbatasan yaitu di atas normal, tetapi di bawah nilai diagnostik untuk DM (Dalimartha 2003).
III. DM pada kehamilan (gestational DM)
Pada waktu hamil, perubahan-perubahan biokimiawi akibat kehamilan seperti adanya hormon plasenta yang bersifat insulin antagonis dan meningkatnya pemecahan insulin oleh plasenta, merupakan faktor diabetogenik (Adam 1987). B. Kelas risiko statistik
Semua orang dengan toleransi glukosa normal tetapi mempunyai risiko yang lebih besar untuk mengidap DM. Yang termasuk dalam golongan ini adalah penderita yang kedua orang tuanya menderita DM, pernah menderita GTG kemudian normal lagi, pernah melahirkan bayi dengan berat badan lebih dari 4 kg (Dalimartha 2003).
Diagnosis DM
Diagnosis DM dapat dilakukan dengan pemeriksaan darah, yaitu dengan Tes Toleransi Glukosa Oral (TTGO) standar menurut WHO. TTGO secara umum dilakukan dengan cara mengukur kadar glukosa darah puasa setelah pasien berpuasa selama 10-12 jam, kemudian pasien diberi minum larutan glukosa 75 gram. Selanjutnya, kadar glukosa darah diukur kembali setelah 1 jam dan 2 jam setelah minum larutan glukosa. Darah yang diperiksa adalah darah dari vena sekitar lipat siku (Dalimartha 2003).
Dari hasil pemeriksaan TTGO dapat diketahui apakah seseorang menderita DM, mengalami gangguan toleransi glukosa atau normal, dengan kriteria sebagai berikut (Dalimartha 2003):
(1) Seseorang dikatakan menderita penyakit DM bila hasil pemeriksaan kadar glukosa darah puasanya ≥ 126 mg/dl dan kadar glukosa darah 2 jam setelah minum larutan glukosa ≥ 200 mg/dl.
(2) Seseorang dikatakan terganggu terhadap toleransi glukosa bila hasil pemeriksaan kadar glukosa darah puasanya 110-125 mg/dl dan kadar glukosa darah 2 jam setelah minum larutan glukosa 140-199 mg/dl.
(3) Seseorang dikatakan normal bila hasil pemeriksaan kadar glukosa darah puasanya < 110 mg/dl, kadar glukosa darah 1 jam setelah minum larutan glukosa < 180 mg/dl, dan 2 jam setelah minum larutan glukosa < 140 mg/dl.
Komplikasi DM
A. Komplikasi Akut DM
Komplikasi akut terjadi jika kadar glukosa darah seseorang meningkat atau menurun tajam dalam waktu relatif singkat. Pada komplikasi akut DM dapat terjadi (Utami et al. 2003) :
(1) Hipoglikemia
Hipoglikemia adalah suatu keadaan seseorang dengan kadar glukosa darah di bawah nilai normal (kurang dari 50 mg/dl). Gejala dini hipoglikemia yaitu keringat dingin pada muka terutama hidung, gemetar, lemas, rasa lapar, mual, tekanan darah turun, gelisah, jantung berdebar, sakit kepala,
serta kesemutan di jari tangan dan bibir. Bila dibiarkan tanpa pertolongan maka penderita menjadi tidak sadar (koma) dengan atau tanpa kejang (Dalimartha 2003).
(2) Ketoasidosis Diabetik
Pada penderita DM, kadar glukosa darah tinggi tetapi tidak dapat masuk ke dalam sel karena kekurangan insulin, maka kebutuhan energi tubuh dipenuhi dengan meningkatkan metabolisme lipid (lipolisis), yang mengakibatkan meningkatnya asetil-KoA, dan selanjutnya meningkatkan pembentukan badan keton. Peningkatan badan keton menyebabkan asidosis, yang pada akhirnya dapat menyebabkan darah menjadi asam, jaringan tubuh rusak, tidak sadarkan diri, dan mengalami koma (Ganiswara et al. 1999). B. Komplikasi Kronis DM
Komplikasi kronis terjadi terutama akibat kelainan pembuluh darah seperti makroangiopati dan mikroangiopati. Kelainan pembuluh darah kecil (mikroangiopati) dapat menimbulkan berbagai perubahan pada pembuluh darah kapiler yang ada pada ginjal, mata, dan kaki. Akibatnya, timbul berbagai komplikasi seperti pada kapiler glomerulus ginjal yang menyebabkan nefropati diabetik, pada retina mata menyebabkan retinopati dan berakhir dengan kebutaan. Kelainan pada pembuluh darah besar (makroangiopati) dapat menyebabkan terjadinya penyumbatan pada pembuluh darah jantung yang menyebabkan penyakit jantung koroner. Penyempitan pada pembuluh darah tungkai bawah dapat menyebabkan ulkus dan gangren di kaki, sedangkan
kelainan pada pembuluh darah otak menyebabkan penyakit cerebrovaskuler yang mengakibatkan stroke (Dalimartha 2003).
Pengobatan DM
DM merupakan penyakit yang tidak dapat disembuhkan, tetapi dapat dikontrol. Untuk mengendalikan penyakit DM, Perkumpulan Endokrionologi Indonesia (Perkeni) menetapkan empat pilar utama dalam penatalaksanaan DM, yang meliputi perencanaan diet, latihan jasmani, penyuluhan atau pendidikan kesehatan, dan pemberian obat hipoglikemik oral atau pemberian insulin (Nurul 1997). Pada penderita DM tipe II, obat hanya perlu diberikan, bila setelah melakukan diet dan latihan jasmani secara maksimal tetapi tidak berhasil mengendalikan kadar glukosa darah (Ganiswara et al. 1999).
Ada dua macam obat hipoglikemik, yaitu berupa suntikan dan berupa tablet yang disebut obat hipoglikemik oral atau antidiabetes oral. Antidiabetis oral dapat dibagi dalam 4 golongan, yaitu :
(1) Golongan Sulfonilurea
Derivat sulfonilurea bekerja dengan cara merangsang sel Beta-pulau Langerhans pankreas untuk mengeksresikan insulin. Obat golongan ini tidak berguna bila diberikan pada penderita DM tipe I, karena pada penderita DM tipe I, sel beta pulau Langerhans pankreasnya sudah rusak, sehingga tidak dapat memproduksi insulin. Obat golongan ini dapat berguna bila diberikan pada penderita DM tipe II (Ganiswara et al. 1999). Berikut ini adalah obat-obat yang termasuk golongan sulfonilurea (Ellenberg dan Harold 1983) :
(a) Generasi pertama:
Tolbutamide, Chlorpropamide, Tolazamide, Acetohexamide (b) Generasi kedua: Glibenklamide, Glipizide, Glibonuride (2) Golongan Biguanid
Derivat biguanid mempunyai mekanisme kerja yang berlainan dengan derivat sulfonilurea, obat-obat golongan ini bekerja dengan cara mengurangi resistensi insulin, sehingga glukosa dapat memasuki sel-sel hati, otot dan organ tubuh lainnya. Obat-obat yang termasuk golongan biguanid adalah Metformin, Phenformin dan Buformin (Silva 2004).
(3) Golongan Thiazolidinedion
Derivat thiazolidinedion bekerja dengan cara yang sama dengan derivat biguanid, yaitu dengan mengurangi resistensi insulin, sehingga glukosa dapat memasuki sel-sel hati, otot dan organ tubuh lainnya. Obat yang termasuk golongan thiazolidinedion adalah Troglitazone (Silva 2004).
(4) Golongan inhibitor alfa-glukosidase
Obat ini bekerja dengan cara menginhibisi secara reversibel kompetitif terhadap enzim hidrolase alfa-amilase pankreatik dan enzim-enzim pencernaan di usus halus seperti isomaltase, sukrase dan maltase. Enzim-enzim ini berperan pada hidrolisis karbohidrat makanan menjadi glukosa dan monosakarida lainnya. Pada penderita DM, inhibisi terhadap enzim ini menyebabkan penghambatan absorpsi glukosa, sehingga menurunkan keadaan hiperglikemia setelah makan. Obat yang termasuk golongan ini adalah Acarbose dan di Indonesia telah dipasarkan dengan nama dagang Glucobay.
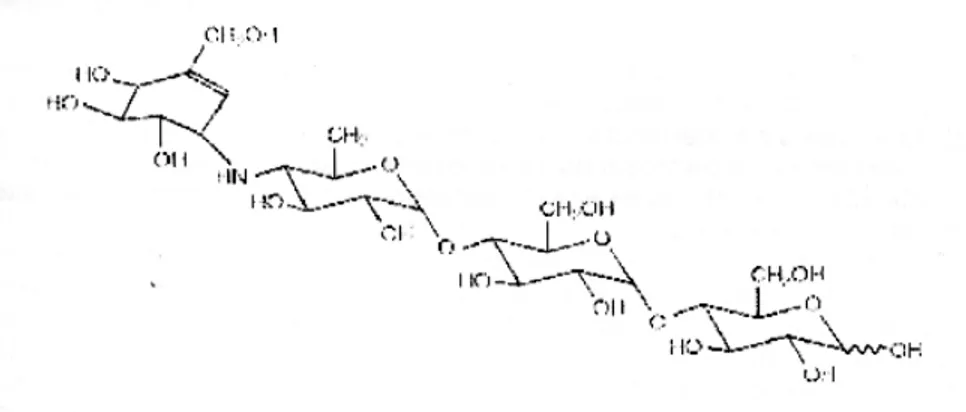
Acarbose adalah suatu oligosakarida yang diperoleh dari proses fermentasi mikroorganisme, Actinoplanes utahensis, dengan nama kimia O-4,6-dideoxy-4-[[(1 S,4 R, 5 S, 6 S)-4,5,6-trihydroxy-3-(hydroxymethyl)-2-cyclohexen-1-yl]amino]1(1 → 4)- O -(alpha)-D-glucopyranosyl-(1 → 4)-D-glucose. Acarbose merupakan serbuk berwarna putih dengan berat molekul 645,6, bersifat larut dalam air dan memiliki pKa 5,1. Rumus empiriknya adalah C25H43NO18 dan struktur kimianya adalah sebagai berikut (Slagle 2002; Bayer 2004) :
Gambar 8. Struktur kimia Acarbose
Acarbose, dapat digunakan secara kombinasi dengan obat antidiabetik oral lainnya seperti sulfonilurea, insulin atau metformin, untuk meningkatkan kontrol hiperglikemia. Hal ini disebabkan karena acarbose memiliki mekanisme kerja yang berbeda dengan ketiga golongan antidiabetik oral tersebut (Bayer 2004).
Mekanisme Kerja Obat Sebagai Inhibitor Reaksi Enzim
Inhibisi reaksi enzim merupakan suatu strategi utama dalam perancangan obat, dan hampir sepertiga dari lima puluh jenis obat terpopuler yang diperdagangkan saat ini merupakan inhibitor enzim. Inhibisi dari suatu reaksi yang dikatalisis enzim dapat menghambat jalur metabolik utama dengan memblok pembentukan dari suatu metabolit esensial maupun metabolit yang tidak diinginkan (King 1994).
Enzim memiliki sisi aktif yang dapat mengenali secara spesifik substratnya yang sesuai, sehingga memungkinkan untuk merancang inhibitor enzim yang dapat menghalangi pengikatan substrat pada enzim. Dengan terikatnya inhibitor pada enzim, maka dapat menghambat terbentuknya produk dari suatu metabolit yang tidak diinginkan (King 1994).
Pada dasarnya, ada dua tipe inhibisi enzim yang disebabkan oleh obat sebagai inhibitor, yaitu inhibisi reversibel dan inhibisi ireversibel (Ophardt 2003).
(1) Inhibisi Reversibel
Inhibisi reversibel ditandai oleh adanya reaksi kesetimbangan diantara enzim dan obat sebagai inhibitor. Inhibitor reversibel berikatan dengan enzim melalui ikatan non-kovalen atau gaya kovalen lemah, dan dapat dilepaskan dari enzim dengan cara pengenceran, filtrasi gel, atau dialisis. Ada dua tipe utama inhibisi reversibel, yaitu (King 1994; Ophardt 2003) :
(a) Inhibisi reversibel kompetitif
Inhibisi kompetitif terjadi apabila obat yang berperan sebagai inhibitor dengan struktur yang menyerupai substrat normal enzim, berkompetisi
dengan substrat normal untuk berikatan pada sisi aktif enzim (Ophardt 2003).
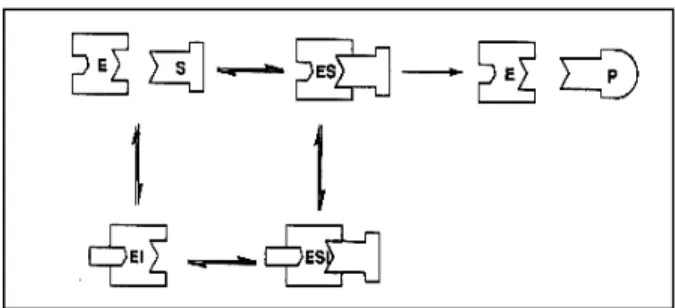
Gambar 9. Inhibisi reversibel kompetitif; inhibitor dan substrat berkompetisi pada sisi aktif enzim. E = enzim; S = substrat; I = inhibitor; ES = kompleks enzim substrat; EI = kompleks enzim inhibitor; P = produk.
(b) Inhibisi reversibel nonkompetitif
Pada inhibisi reversibel nonkompetitif, obat sebagai inhibitor tidak terikat pada sisi aktif enzim, tetapi terikat pada bagian lain dari enzim. Terikatnya inhibitor obat pada enzim, menyebabkan perubahan bentuk enzim, yang mengakibatkan penurunan aktivitas katalitik enzim. Karena inhibitor terikat pada sisi yang berbeda dari substrat, maka enzim dapat berikatan dengan inhibitor, berikatan dengan substrat atau berikatan dengan inhibitor dan enzim secara bersama-sama (Hames & Hooper 2000; Ophardt 2003).
Gambar 10. Inhibisi reversibel non-kompetitif; inhibitor dan substrat terikat secara bersama-sama. E = enzim; S = substrat; I = inhibitor; ES = kompleks enzim substrat; EI = kompleks enzim inhibitor; ESI = kompleks enzim substrat inhibitor; P = produk.
(2) Inhibisi Ireversibel
Pada inhibisi ireversibel, inhibitor terikat secara kovalen pada sisi aktif enzim, membentuk kompleks enzim inhibitor yang bersifat tetap (Hames & Hooper 2000). Inhibitor ireversibel tidak dapat dilepaskan dari enzim dengan cara pengenceran maupun dialisis (King 1994).
Uji Inhibisi α-Glukosidase
Enzim α-glukosidase akan menghidrolisis substrat p-nitrofenil-α-D-glukopiranosa menjadi p-nitrofenol (berwarna kuning) dan glukosa dengan reaksi sebagai berikut :
Gambar 11. Persamaan reaksi enzimatik α-glukosidase dan p-nitrofenil-α-D-glukopiranosa.
Aktivitas enzim diukur berdasarkan hasil absorbansi p-nitrofenol. Apabila tumbuhan memiliki kemampuan menghambat aktivitas enzim alfa-glukosidase maka p-nitrofenol yang dihasilkan akan berkurang (Basuki et al 2002).
Penentuan Kadar Glukosa Darah Dengan Glucose Test Strip
Prinsip dari penentuan kadar glukosa darah dengan glucose test strip adalah menggunakan metode reaksi enzimatik glukosa darah dengan enzim glukosa oksidase dan peroksidase yang dilapis pada kertas strip. Pada metode ini kertas strip dilapisi dengan membran selulosa tipis yang permeabel hanya untuk molekul-molekul kecil seperti glukosa. Apabila setetes darah dikenakan pada kertas strip, maka dengan adanya oksigen, glukosa darah dioksidasi secara enzimatik oleh glukosa oksidase menghasilkan hidrogen peroksida dan asam glukonat. Selanjutnya, peroksidase mengkatalisis reaksi hidrogen peroksida dengan kromogen kalium iodida menghasilkan iodin yang berwarna coklat. Intensitas warna yang terbentuk adalah sebanding dengan jumlah glukosa dalam tetesan darah. Berikut ini adalah persamaan reaksi enzimatik dari glukosa dengan enzim glukosa oksidase dan peroksidase (NCBE 1995) :
β-D-Glukosa + O2 + H2O ⎯⎯ →oksidaseglukosa⎯⎯
H2O2 + asam glukonat H2O2 + kalium iodida ⎯⎯peroksidas⎯⎯e→ iodin + H2O
Gambar 12. Persamaan reaksi enzimatik glukosa dengan glukosa oksidase dan peroksidase.
Model Hewan Percobaan DM
DM spontan menurut Skyler dan George (1981) merupakan kejadian umum yang dijumpai pada berbagai spesies hewan dan telah dikenal sejak beberapa waktu lalu. Leblanc melaporkan kejadian DM pada tikus pada 1851. Kucing, anjing, rubah, ikan lumba-lumba, dan berbagai hewan ternak dapat mengalami DM. Hewan DM dapat dijadikan sebagai model dari penyakit ini pada manusia. Akan tetapi, dikarenakan hewan memperlihatkan keragaman patofisiologi, maka, pada kenyataannya, tidak ada gejala DM pada hewan yang tepat sama dengan tipe DM pada manusia. Gejala DM yang paling umum dijumpai pada hewan adalah berupa obesitas, hiperinsulinemia dan resistensi insulin.
DM selain terjadi secara spontan dapat juga dibuat secara eksperimental dengan infeksi virus, atau melalui pemberian hormon dan senyawa kimia seperti pada berbagai hewan terutama hewan coba laboratorium, seperti tikus dan kelinci. Model hewan DM baik spontan dan eksperimental dapat digunakan secara efektif untuk mempelajari komplikasi, pengobatan dan pencegahan DM.
Penggunaan senyawa kimia untuk menginduksi hewan menjadi DM memungkinkan mempelajari secara mendalam proses-proses biokimia, hormonal dan morfologi yang terjadi selama dan setelah induksi senyawa kimia tersebut pada hewan. Dua senyawa kimia yang telah dipelajari secara ekstensif adalah aloksan dan streptozotocin. Kedua senyawa ini merusak sel beta pulau langerhans pankreas, sehingga menyebabkan hiperglikemia permanen.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini berlangsung selama 10 bulan, mulai dari bulan April 2004 sampai Januari 2005, bertempat di Laboratorium Bahan Alam Pusat Penelitian Kimia-LIPI, Kawasan PUSPIPTEK Serpong.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah pelarut-pelarut teknis dan p.a. antara lain metanol, etil asetat, n-butanol, dimetilsulfoksida, HCl, kloroform, H2SO4, anhidrida asetat, FeCl3, pereaksi Mayer’s, pereaksi Dragendorff, logam Mg, Na2CO3, glukosidase (Saccharomyces sp., Oriental Yeast Co., Ltd.), p-nitrofenil α-D-glukopiranosa (Wako Pure Chemical Industries, Ltd.), buffer fosfat (pH 7,0), bovine serum albumin (Wako Pure Chemical Industries, Ltd.), tablet Glucobay, larva udang Artemia salina Leach., air laut, sukrosa, glukosa strip tes, glukosa meter, akuades, kertas saring.
Alat-alat yang digunakan dalam penelitian ini adalah rotary evaporator merk Buchii, spektrofotometer UV-Vis, pH meter, neraca analitik, mikropipet merk Socorex dan eppendorf, penangas air, oven, alat sentrifuse, lampu UV, kotak bersekat, vial uji, sonde oral, timbangan tikus, jarum suntik dan alat-alat gelas seperti tabung reaksi, erlenmeyer, beaker glass, labu bulat, pengaduk, corong pisah, gelas ukur.
Sampel
Buah tua dan buah muda mahkota dewa [Phaleria macrocarpa (Scheff.) Boerl.] yang telah diiris tipis dan dikeringkan dibawah matahari, diperoleh dari Balai Penelitian Tanaman Obat (BPTO) Tawangmangu, Jawa Tengah. Buah tua dan buah muda kering, selanjutnya dihaluskan dengan menggunakan blender.
Model Hewan Coba
Model hewan coba yang digunakan adalah tikus putih jantan galur Wistar, sehat dan mempunyai aktivitas normal, berusia 6 bulan dengan bobot badan 250-350 gram.
Rancangan Percobaan
Penelitian ini dilakukan dalam beberapa tahap seperti diperlihatkan pada diagram alir penelitian (Gambar 13) yang terdiri dari tahap pertama fraksinasi dan ekstraksi dari buah tua dan buah muda mahkota dewa, tahap kedua penapisan fitokimia terhadap berbagai ekstrak buah tua dan buah muda mahkota dewa, tahap ketiga uji inhibisi alfa-glukosidase in vitro dari berbagai ekstrak buah tua dan buah muda mahkota dewa, tahap keempat uji toksisitas dengan Brine Shrimp Lethality Test (BSLT) dan tahap kelima uji aktivitas antihiperglikemik in vivo dari ekstrak buah tua mahkota dewa dengan Tes Toleransi Glukosa Oral (TTGO) terhadap model hewan coba tikus putih jantan galur Wistar.
Gambar 13. Diagram alir penelitian
Fraksinasi dan Ekstraksi
Sebanyak 200 gram serbuk daging buah muda mahkota dewa diekstraksi dengan pelarut metanol sebanyak 1,5 liter, secara maserasi selama empat hari pada suhu ruang dengan pengulangan sebanyak empat kali, kemudian disaring dan diuapkan pelarutnya dengan rotary evaporator pada suhu 40oC hingga diperoleh ekstrak metanol yang pekat. Ekstrak metanol buah tua diperoleh dengan cara yang sama dengan merendam 200 gram serbuk daging buah tua dalam 1,5 liter metanol.
Fraksinasi dan ekstraksi buah tua dan buah muda
mahkota dewa
Penapisan fitokimia
Uji inhibisi alfa-glukosidase in vitro
Uji aktivitas antihiperglikemik in vivo dengan tes toleransi glukosa oral pada hewan coba tikus
Ekstrak metanol dari buah tua dan buah muda mahkota dewa selanjutnya difraksinasi dengan campuran pelarut etil asetat-air (1:1) menghasilkan fraksi etil asetat dan fraksi air. Fraksi air yang diperoleh difraksinasi kembali dengan n-butanol menghasilkan fraksi air dan fraksi n-butanol. Masing-masing fraksi dipekatkan dengan rotary evaporator pada suhu 40oC hingga diperoleh ekstrak fraksi etil asetat, ekstrak fraksi n-butanol dan ekstrak fraksi air yang pekat. Bagan fraksinasi dan ekstraksi dari buah tua dan buah muda mahkota dewa dapat dilihat pada Lampiran 2.
Pada penelitian ini, untuk memperoleh ekstrak air, selain dilakukan dengan cara fraksinasi, juga dilakukan dengan cara merebus 20 gram serbuk daging buah tua dan buah muda mahkota dewa dengan aquadest sebanyak 300 ml, kemudian disaring dan diuapkan pelarutnya dengan rotary evaporator hingga diperoleh ekstrak air hasil rebusan.
Penapisan Fitokimia
Uji Alkaloid
Sebanyak lebih kurang 10 ml ekstrak ditambahkan 1,5 ml asam klorida 2%. Selanjutnya, larutan dibagi menjadi tiga sama banyak dalam tabung reaksi. Tabung reaksi I sebagai pembanding. Tabung reaksi II ditetesi dengan 2 sampai 3 tetes pereaksi Dragendorff. Tabung reaksi III ditetesi dengan 2 sampai 3 tetes pereaksi Mayer. Adanya senyawa alkaloid ditunjukkan oleh terjadinya kekeruhan atau endapan jingga kecoklatan untuk pereaksi Dragendorff dan endapan putih kekuningan untuk pereaksi Mayer (Depkes 1987).
Uji Flavonoid
Sebanyak lebih kurang 1 ml ekstrak dilarutkan dalam 1 ml etanol 95%, ditambahkan 0,1 g serbuk magnesium dan 10 tetes HCl pekat. Terbentuknya warna merah jingga sampai merah ungu, menunjukkan adanya flavonoid (Depkes 1995).
Uji Fenol
Sebanyak lebih kurang 1 ml ekstrak ditetesi dengan 3 tetes larutan besi (III) klorida. Apabila terjadi warna hijau, ungu, biru sampai hitam, menunjukkan adanya senyawa fenolik terutama fenol-fenol bebas (Depkes 1987).
Uji Saponin
Sebanyak lebih kurang 1 ml ekstrak diencerkan dengan air volume sama dan dituangkan dalam tabung reaksi, kemudian dikocok selama 15 menit. Terbentuknya buih yang stabil menunjukkan adanya saponin (Depkes 1987).
Uji Tanin
Sebanyak lebih kurang 1 ml ekstrak diencerkan dengan 2 ml air. Pada larutan ditambahkan 3 tetes larutan besi(III) klorida. Adanya tanin ditunjukkan oleh adanya perubahan warna larutan menjadi biru kehitaman atau hijau kehitaman (Depkes 1987).
Uji Steroid-Triterpenoid/Uji Lieberman-Burchard
Sebanyak lebih kurang 50 mg ekstrak ditambahkan 5 tetes asam asetat anhidrid dan dikocok. Ke dalam campuran tersebut ditambahkan 2 tetes H2SO4 pekat, kocok dan diamati. Terbentuknya warna hijau biru menunjukkan adanya steroid, sedangkan warna merah/ungu menunjukkan adanya triterpenoid (Juwati et al. 1998).
Uji Molish
Sebanyak lebih kurang 1 ml ekstrak ditambahkan 1 tetes pereaksi Molish segar kemudian dikocok. Selanjutnya, ditambahkan H2SO4 pekat lewat dinding tabung dan tidak dikocok sehingga membentuk dua lapisan. Terbentuknya warna ungu antara kedua lapisan tersebut menunjukkan adanya karbohidrat (Juwati et al. 1998).
Uji Biuret
Sebanyak lebih kurang 2 ml ekstrak dicampur dengan 2 ml NaOH 10%, kemudian ditambahkan 2 tetes larutan CuSO4 0,5% lalu dikocok. Terbentuknya warna merah muda atau ungu menunjukkan adanya protein (Munandar et al. 2001).
Uji Ninhidrin
Sebanyak lebih kurang 1 ml ekstrak dicampur dengan 1 ml pereaksi Ninhidrin 0,2% dalam tabung reaksi, kemudian dipanaskan selama beberapa menit dalam air mendidih. Terbentuknya warna biru atau ungu menunjukkan adanya asam amino (Munandar et al. 2001).
Uji Inhibisi Alfa-Glukosidase (Sutedja 2003)
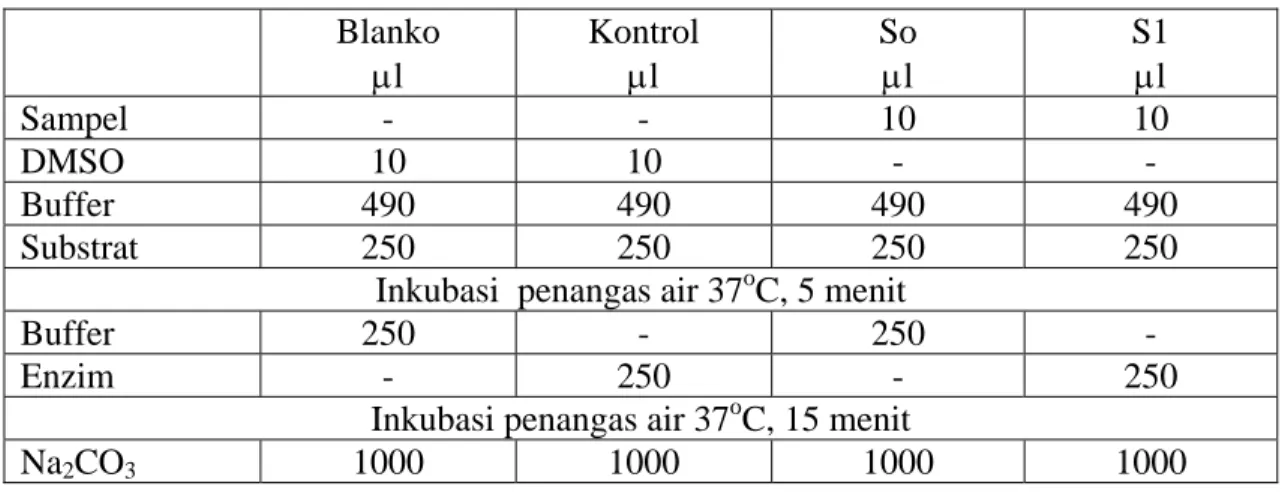
Larutan enzim dibuat dengan melarutkan 1,0 mg α-glukosidase dalam 100 ml buffer fosfat (pH 7,0) yang mengandung 200 mg bovin serum albumin. Sebelum digunakan, sebanyak 1 ml larutan enzim tersebut diencerkan 25 kali dengan buffer fosfat (pH 7,0). Campuran reaksi terdiri dari 250 μl 20 mM p-nitrofenil α-D-glukopiranosa sebagai substrat, 490 μl 100 mM buffer fosfat (pH 7,0) dan 10 μl larutan sampel dalam DMSO. Setelah campuran reaksi diinkubasi pada 37oC selama
5 menit, 250 μl larutan enzim ditambahkan dan selanjutnya diinkubasi selama 15 menit. Reaksi enzim dihentikan dengan penambahan 1000 μl 200 mM natrium karbonat dan p-nitro fenol yang dihasilkan dibaca absorbansinya pada 400 nm.
Sistem reaksi enzim selengkapnya untuk satu sampel dengan volume total 2 ml dapat dilihat pada tabel 1.
Tabel 1. Sistem reaksi enzim untuk satu sampel dengan volume total 2 ml. Blanko μl Kontrol μl So μl S1 μl Sampel - - 10 10 DMSO 10 10 - - Buffer 490 490 490 490 Substrat 250 250 250 250
Inkubasi penangas air 37oC, 5 menit
Buffer 250 - 250 -
Enzim - 250 - 250
Inkubasi penangas air 37oC, 15 menit
Na2CO3 1000 1000 1000 1000
Sampel yang digunakan adalah ekstrak metanol, ekstrak fraksi etil asetat, ekstrak fraksi n- butanol dan ekstrak air dengan variasi konsentrasi 1%, 0,5%, 02,5% dan 0,125% dengan pelarut DMSO. Larutan standar dibuat dengan konsentrasi yang sama dengan larutan sampel, dengan melarutkan tablet Acarbose (Glucobay) dalam
aquadest dan HCl 2N kemudian disentrifus, selanjutnya supernatan digunakan untuk
membuat larutan standar.
Persen inhibisi dapat dihitung dari persamaan : [(C - S) / C] x 100; dengan S = absorbansi sampel (S1-So dengan S1 = absorbansi sampel dengan penambahan enzim dan So = absorbansi sampel tanpa penambahan enzim) dan C = absorbansi kontrol (DMSO), tanpa sampel (kontrol-blanko).
Brine Shrimp Lethality Test (BSLT) dengan Larva Udang Artemia salina Leach. Telur udang Artemia salina Leach. ditetaskan di dalam gelas piala ukuran 1 liter yang telah diisi air laut kemudian diletakkan di bawah lampu UV dan diberi aerasi. Setelah 48 jam telur menetas menjadi larva udang (naupili) dan siap untuk diujicobakan.
Larutan uji dibuat dengan konsentrasi 2000 ppm, 200 ppm dan 20 ppm. Larutan uji 2000 ppm dibuat dengan cara melarutkan 4 mg ekstrak dalam 2,0 ml air laut. Larutan uji 200 ppm dibuat dengan cara melarutkan 1 ml larutan uji 2000 ppm dalam 9 ml air laut, sedangkan larutan uji 20 ppm dibuat dengan cara melarutkan 1 ml larutan uji 200 ppm dalam 9 ml air laut. Jika tidak larut ditambahkan DMSO kurang lebih 10 μl.
Uji bioaktivitas dilakukan dengan cara memasukkan 100 μl air laut yang berisi 10-12 ekor larva udang Artemia salina Leach., yang telah berumur 48 jam ke dalam vial uji. Selanjutnya, ke dalam vial uji ditambahkan 100 μl larutan uji untuk masing-masing konsentrasi sehingga konsentrasi akhir pada tiap-tiap lubang vial uji adalah 1000 ppm, 100 ppm, dan 10 ppm, kemudian disimpan di bawah lampu UV. Sebagai kontrol dipakai 1 ml air laut yang berisi 10-12 ekor larva udang tanpa penambahan ekstrak.
Setelah 24 jam jumlah larva udang yang mati dihitung dan dianalisis menggunakan metode Sam (Colegate et al. 1993) berdasarkan perhitungan jumlah larva yang mati dan yang masih hidup, dan tingkat kematian atau mortalitas (%) diperoleh dengan membandingkan antara jumlah yang mati dibagi dengan jumlah
total larva. Nilai LC50 diperoleh dengan cara menghitung menurut rumus y = a + bx. Harga y yang dimasukkan adalah 50, untuk menyatakan larva udang yang mengalami kematian sejumlah 50% setelah masa inkubasi 24 jam. Nilai a dan b diperoleh dengan perhitungan menggunakan rumus regresi linier berdasarkan data dari tiga titik konsentrasi yang digunakan. Harga x yang diperoleh merupakan konsentrasi larutan yang menyebabkan kematian terhadap 50% larva.
Uji Aktivitas Antihiperglikemik dengan Tes Toleransi Glukosa Oral (TTGO)
dari Ekstrak Buah Tua Mahkota Dewa pada Hewan Coba Tikus
Pengadaptasian
Sebelum melakukan percobaan, tikus diadaptasikan dahulu selama dua minggu untuk menyeragamkan cara hidup dan makanannya.
Penentuan Dosis Obat Acarbose (Glucobay) dan Dosis Ekstrak yang
Dicekokkan pada Hewan Coba Tikus
Penentuan dosis ekstrak yang dicekokkan ke hewan coba tikus didasarkan pada pemakaian tradisional. Dalam penggunaannya sebagai obat tradisional untuk diabetes, sebanyak 5-6 irisan daging buah mahkota dewa kering direbus dengan 5 gelas air sampai hanya tersisa 3 gelas. Air rebusan diminum satu jam sebelum makan pagi, siang dan malam hari masing-masing sebanyak 1 gelas (Winarto et al. 2003). Oleh karena itu, dalam penelitian ini digunakan dosis konversi yang setara dengan bobot ekstrak 2 irisan daging buah mahkota dewa untuk manusia dengan bobot badan 50 kg. Sedangkan dosis obat Acarbose yang digunakan adalah dosis konversi yang setara untuk manusia dengan bobot badan 50 kg. Perhitungan dosis obat Acarbose,
dosis ekstrak air hasil rebusan dan ekstrak fraksi n-butanol yang dicekokkan pada hewan coba tikus, dapat dilihat pada Lampiran 8, 9 dan 10.
Penentuan Kadar Larutan Sukrosa yang Dicekokkan pada Hewan Coba Tikus
Pada percobaan ini digunakan 9 ekor tikus putih sehat yang dibagi menjadi 3 kelompok dengan jumlah 3 ekor untuk tiap-tiap kelompok, yaitu kelompok I, II dan III. Tikus pada masing-masing kelompok dipuasakan selama 18 jam. Setelah dipuasakan diambil darah pada masing-masing kelompok dan diukur kadar glukosa darah puasanya. Selanjutnya, pada kelompok I dicekok larutan sukrosa 40%b/v, kelompok II dicekok larutan sukrosa 60%b/v dan kelompok III dicekok larutan sukrosa 80%b/v masing-masing sebanyak 1 ml. Selanjutnya, kadar glukosa darah pada masing-masing kelompok diukur setelah ½, 1, 2, dan 3 jam.
Uji Aktivitas Antihiperglikemik
Pada percobaan ini digunakan 15 ekor tikus putih sehat yang dibagi menjadi 3 kelompok perlakuan dengan jumlah 5 ekor untuk tiap-tiap kelompok, yaitu kelompok A, B, dan C sebagai berikut :
(1) Kelompok perlakuan A (kontrol positif)
Pada kelompok perlakuan A, tikus dicekok obat Acarbose (Glucobay) dengan dosis 1,00 x 10-3 mg/ g BB tikus.
(2) Kelompok perlakuan B
Pada kelompok perlakuan B, tikus dicekok ekstrak air dari rebusan buah tua mahkota dewa dengan dosis 1 x dosis konversi (6,20 x 10-4 mg/ g BB tikus) dan 2 x dosis konversi (1,24 x 10-3 mg/ g BB tikus).
(3) Kelompok perlakuan C
Pada kelompok perlakuan C, tikus dicekok ekstrak fraksi n-butanol buah tua mahkota dewa dengan dosis 1 x dosis konversi (1,81 x 10-3 mg/ g BB tikus) dan 2 x dosis konversi (3,62 x 10-3 mg/ g BB tikus).
Tikus pada masing-masing kelompok dipuasakan selama 18 jam. Setelah dipuasakan diambil darah pada masing-masing kelompok dan diukur kadar glukosa darah puasanya. Selanjutnya, pada kelompok kontrol positif dicekok acarbose, kelompok perlakuan B dicekok ekstrak air rebusan buah tua mahkota dewa dengan dosis 1 x dosis konversi, kelompok perlakuan C dicekok ekstrak fraksi n-butanol buah tua mahkota dewa 1 x dosis konversi. Lima menit kemudian pada masing-masing kelompok dicekok larutan sukrosa 80% b/v sebanyak 1 ml. Kadar glukosa darah pada masing-masing kelompok diukur setelah ½, 1, 2 dan 3 jam setelah perlakuan. Percobaan untuk dosis 2 x dosis konversi pada kelompok perlakuan B dan C dilakukan dengan cara yang sama.
Pada percobaan ini, sebagai kontrol negatif adalah setiap ekor tikus pada masing-masing kelompok, sebelum perlakuan. Tikus dipuasakan selama 18 jam, diukur kadar glukosa darahnya dan dicekok larutan sukrosa 80% b/v sebanyak 1 ml. Selanjutnya, kadar glukosa darah diukur setelah ½, 1, 2, dan 3 jam setelah perlakuan.
Pengukuran Kadar Glukosa Darah dengan Glucose Test Strip
Pengambilan contoh darah tikus dilakukan dengan menusuk ekor tikus yang sebelumnya telah dibersihkan dengan alkohol 70%(v/v), dengan jarum suntik (lancet), selanjutnya tetesan darah yang keluar dikenakan pada glucose test strip.
Kadar glukosa darah dapat dibaca pada alat glukosa meter secara digital (Anonim 2004).
Analisis Data
Data yang diperoleh dari masing-masing kelompok dianalisis secara statistik menggunakan metode Rancangan Acak Lengkap (RAL). Jika terdapat perbedaan nyata atau signifikan antara perlakuan yang diberikan, analisis dilanjutkan dengan uji Duncan pada taraf α = 0,05 (Matjik & Sumertajaya 2000).