EVALUSI PERUBAHAN METABOLIT PADA TEMULAWAK
DENGAN WAKTU TANAM BERBEDA
LUSI ROSIYANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
ABSTRAK
LUSI ROSIYANI. Evaluasi Perubahan Metabolit pada Temulawak dengan
Waktu Tanam Berbeda. Dibimbing oleh EDY DJAUHARI PURWAKUSUMAH
dan MOHAMAD RAFI.
Temulawak merupakan tanaman asli Indonesia yang mempunyai aktivitas
biologis sebagai antioksidan. Senyawa metabolit yang berperan sebagai
antioksidan pada temulawak adalah kurkuminoid yang kadarnya dipengaruhi oleh
waktu tanam. Spektroskopi FTIR merupakan metode analisis kualitatif yang
digunakan untuk membedakan perubahan metabolit temulawak pada waktu tanam
berbeda. Penelitian bertujuan mengkorelasikan kadar kurkuminoid dan
xanthorizol dengan kapasitas antioksidan dan mengevaluasi serta membedakan
perubahan metabolit rimpang temulawak pada waktu tanam berbeda
menggunakan FTIR. Aktivitas antioksidan ditentukan dengan tiga metode yaitu
DPPH, FRAP dan CUPRAC. Sedangkan kadar kurkuminoid dan xanthorizol
ditentukan dengan metode KCKT. Hasil penelitian menunjukkan temulawak
umur 9 bulan mempunyai kadar kurkuminoid dan xanthorizol tertinggi.
Berdasarkan analisis korelasi diperoleh bahwa kapasitas antioksidan metode
DPPH mempunyai korelasi positif (0.757
r 0.996) dengan kurkuminoid
maupun xanthorizol, begitu pula pada metode FRAP (0.522
r 0.976).
Sedangkan metode CUPRAC mempunyai korelasi yang tinggi dengan jumlah
rendemen (r = 0.986). Analisis spektrum FTIR memberikan serapan untuk gugus
fungsi –OH (3389-3371 cm
-1), gugus karbonil (1628 cm
-1), vibrasi stretching C-H
pada 2855-2962 cm
-1dan 1053 cm
-1. Spektroskopi FTIR dapat digunakan untuk
menganalisis perubahan metabolit pada waktu tanam berbeda.
iii
ABSRACT
LUSI ROSIYANI. Evaluation of Metabolites Changes in Curcuma with
Different Planting Time. Under the direction of EDY DJAUHARI
PURWAKUSUMAH and MOHAMAD RAFI.
Curcuma is an indigenous plant of Indonesia which processes biological
activity as an antioxidants. Metabolites which play a role in the antioxidant
activity of curcuma are curcuminoids the concentration of which are influenced
by planting time. FTIR spectroscopy is a qualitative method of used to distinguish
the changes in metabolites of curcuma at different planting time. The aims of this
research is to correlate levels of curcuminoids and xanthorrizol with the
antioxidants capacity and to evaluate and distinguish metabolite changes in
rhizomes of curcuma at different planting time using FTIR. The antioxidant
activity determined by three methods which is DPPH, FRAP and CUPRAC. The
content of curcuminoids and xanthorrizol determined by HPLC method. The
results showed that the age of nine months of curcuma has the highest
concentration of curcuminoids and xanthorrizol. Based on correlation analysis it
was found that the antioxidant capacity of DPPH method has a positive
correlation (0.757
r 0.996) with curcuminoids or xanthorrizol, like that on
the method of FRAP (0.522
r 0.976). In CUPRAC method a high
correlations indicated by total yield (r = 0.986). FTIR spectral analysis gave
absorption for functional group of OH (3389-3371 cm
-1), carbonyl group (1628
cm
-1), vibration stretching C-H by 2855-2962 cm
-1and 1053 cm
-1. FTIR
spectroscopy can be used to analyze changes in metabolites in different planting
time.
EVALUSI PERUBAHAN METABOLIT PADA TEMULAWAK
DENGAN WAKTU TANAM BERBEDA
LUSI ROSIYANI
Skripsi
sebagai salah syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
v
Judul Skripsi : Evaluasi Perubahan Metabolit pada Temulawak dengan Waktu
Tanam Berbeda
Nama
: Lusi Rosiyani
NIM
: G84050961
Disetujui
Komisi Pembimbing
Drs. Edy Djauhari Purwakusumah M.Si
Mohamad Rafi S.Si.,M.Si
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App. Sc
Ketua Departemen Biokimia
PRAKATA
Alhamdulillah, puji dan syukur bagi Allah SWT atas segala rahmat dan
karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan
karya ilmiah ini. Karya ilmiah ini berjudul Evaluasi Perubahan Metabolit pada
Temulawak dengan Waktu Tanam Berbeda, ditulis berdasarkan hasil penelitian di
Laboratorium Pusat Studi Biofarmaka Lembaga Penelitian dan Pengabdian
Masyarat IPB, Taman Kencana, Bogor selama bulan Oktober 2009 sampai
Februari 2010. Karya ilmiah ini ditulis sebagai prasyarat untuk memperoleh gelar
Sarjana Sains pada Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam. Sebagian penelitian ini dibiayai oleh Kerjasama Kemitraan
Penelitian Pertanian dengan Perguruan Tinggi (KKP3T).
Penulis mengucapkan terima kasih kepada Drs. Edy Djauhari Purwakusumah
M.Si dan Mohamad Rafi S.Si.,M.Si selaku pembimbing atas bimbingan, masukan
serta arahan selama penelitian dan penulisan karya ilmiah ini. Terima kasih
kepada Waras Nurcholis M.Si, seluruh staf Pusat Studi Biofarmaka, Nio, Endi
dan Zaim atas bantuannya selama penelitian, Hairul, Asep, Navies, Agus, Ida,
Dian dan Diana atas bantuan dan masukkannya selama penelitian berlangsung.
Ungkapan terima kasih penulis sampaikan kepada keluarga besar di
Sukabumi, kakak dan adik serta ibu (alm) yang menjadi motivasi penulis,
teman-teman Iswara, Ryan dan keluarga yang memberi semangat, do’a, kasih sayang,
dan dukungan morilnya. Semoga karya ilmiah ini dapat bermanfaat bagi semua
pembaca dan perkembangan ilmu pengetahuan Indonesia khususnya bidang
Bioanalisis. Amin.
Bogor, Agustus 2010
vii
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi, Jawa Barat pada tanggal 20 Maret 1987
dari ayah Empud Syaripudin dan ibu Cicah Marliah (alm). Penulis merupakan
anak ketiga dari lima bersaudara.
Tahun 2005 penulis lulus dari SMU Negeri 3 Kota Sukabumi dan pada
tahun yang sama diterima di Institut Pertanian Bogor melalui jalur Undangan
Seleksi Masuk IPB (USMI). Penulis tercatat sebagai mahasiswa Departemen
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama masa perkuliahan, penulis aktif di himpunan profesi biokimia,
CREBs, (Community of Research and Education in Biochemistry) sebagai Divisi
Mikrob pada tahun 2006/2007 dan sebagai staf Divisi Metabolisme 2007/2008.
Pada tahun 2008 penulis mengikuti praktik lapangan di Pusat Riset Obat dan
Makanan, Badan Pengawas Obat dan Makanan (Badan POM), Jakarta Pusat.
Praktik lapangan dilaksanakan dari bulan Juni hingga Juli 2008 dan melakukan
uji aktivitas antioksidan yang dinyatakan dalam IC
50terhadap 15 tanaman obat
menggunakan metode DPPH. Hasil praktik lapangan ini ditulis dalam karya
ilmiah yang berjudul Uji Aktivitas Antioksidan Ekstrak Etanol Rimpang
Temulawak dan Kulit Batang Jambu Mete.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Temulawak (Curcuma xanthoriza Roxb) ... 1
Antioksidan ... 4
Kromatografi Cair Kinerja Tinggi ... 5
Spektroskopi Inframerah ... 6
BAHAN DAN METODE
Bahan dan Alat ... 7
Metode Penelitian ... 7
HASIL DAN PEMBAHASAN
Kadar Air dan Rendemen ... 9
Kadar Kurkuminoid dan Xanthorizol ... 10
Perbandingan Aktivitas Antioksidan Hasil Tiga Metode Berbeda ... 12
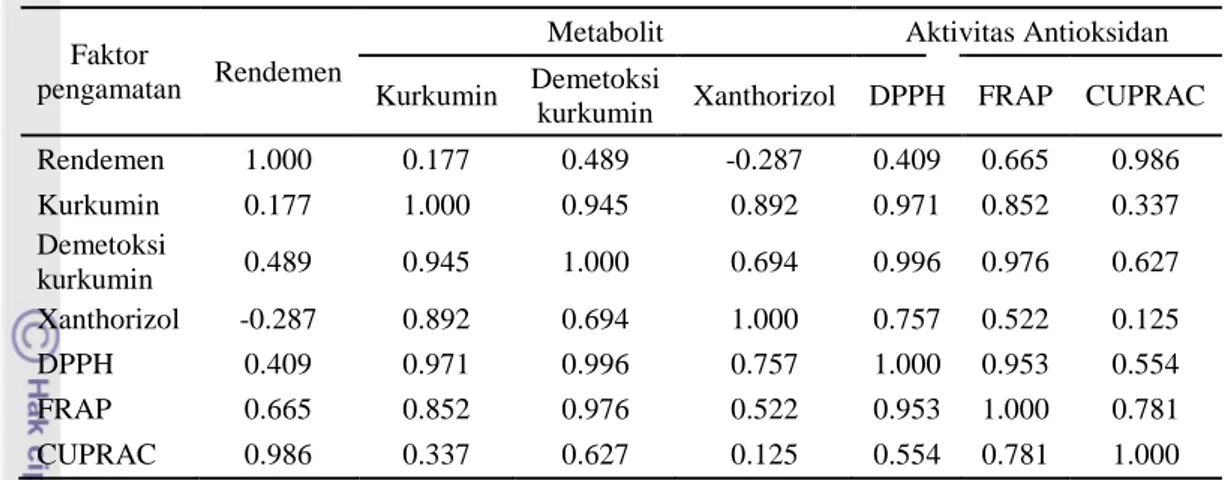
Korelasi Antara Metabolit terhadap Aktivitas Antioksidan ... 13
Analisis Spektrum FTIR ... 15
SIMPULAN DAN SARAN
Simpulan ... 17
Saran ... 17
DAFTAR PUSTAKA ... 17
ix
DAFTAR TABEL
Halaman
1
Komposisi kimia temulawak ... 2
2
Kadar air dan rendemen rimpang temulawak ... 10
3
Hasil pengukuran kadar kurkumin, desmetoksikurkumin, dan xanthorizol
ekstrak rimpang temulawak pada waktu tanam berbeda ... 10
4
Perbandingan kapasitas antioksidan tiga metode berbeda ... 12
5
Hasil korelasi metabolit dengan aktivitas antioksidan ketiga metode ... 14
6
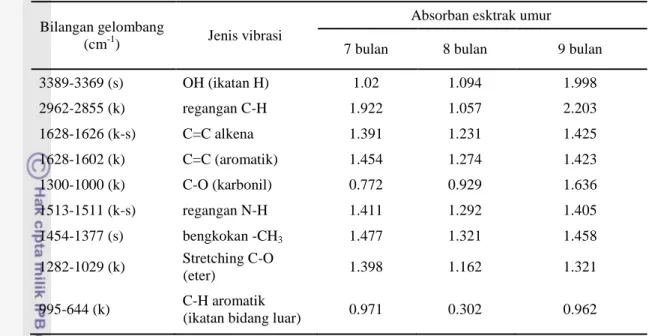
Absorbansi inframerah gugus fungsi ekstrak temulawak dengan standar .. 16
DAFTAR GAMBAR
Halaman
1
Daun temulawak (a), dan rimpang temulawak (b) ... 2
2
Struktur kimia (a) kurkumin, dan (b) desmetoksikurkumin ... 3
3
Struktur kimia xanthorizol ... 3
4
Reaksi penangkapan atom H dari troloks oleh DPPH ... 5
5
Reaksi reduksi Fe
3+-TPTZ oleh antioksidan ... 5
6
Reaksi reduksi kelat neokuproin tembaga (II) oleh troloks ... 5
7
Perbandingan metabolit rimpang temulawak pada umur yang berbeda ... 10
8
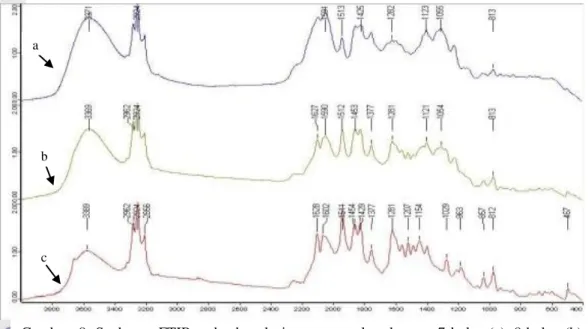
Spektrum FTIR pada esktrak rimpang temulawak umur 7 bulan (a), 8 bulan
(b) dan 9 bulan (c) ... 15
DAFTAR LAMPIRAN
Halaman
1
Gambaran umum penelitian ... 20
2
Penentuan kadar air rimpang temulawak umur 7, 8, dan 9 bulan ... 21
3
Penentuan kadar air basah dan massa padat... 22
4
Penentuan hasil rendemen ekstrak ... 22
5
Penentuan kadar kurkuminoid ekstrak temulawak ... 23
6
Penentuan kadar xanthorizol ekstrak temulawak ... 26
7
Perhitungan kapasitas antioksidan metode DPPH
(2,2-difenil-1-pikrilhidrazil) ... 27
8
Perhitungan kapasitas antioksidan metode ferric reducing
ability of plasma (FRAP) ... 29
9
Perhitungan kapasitas antioksidan metode cupric ion reducing
antioxidant capacity (CUPRAC) ... 30
10 Hasil analisis korelasi menggunakan SAS ... 31
11 Hasil analisis regresi rendemen dengan metabolit menggunakan minitab
versi 14 ... 32
12 Profil spektrum FTIR ekstrak temulawak umur (a) 7 bulan, (b) 8 bulan,
dan (c) 9 bulan ... 33
PENDAHULUAN
Tumbuhan mempunyai dua senyawa metabolit yaitu, metabolit primer dan metabolit sekunder. Metabolit primer seperti karbohidrat, lemak dan protein jumlahnya cukup besar di dalam tumbuhan. Metabolit primer disekresikan oleh tumbuhan untuk selanjutnya digunakan dalam pertumbuhan dan perkembangan. Sedangkan metabolit sekunder adalah kelompok senyawa alkaloid, terpenoid, dan flavonoid. Senyawa-senyawa tersebut digunakan untuk mempertahankan diri dari mikroorganisme patogen maupun herbivora. Selain itu, metabolit sekunder ini dapat digunakan sebagai obat (Heldt 2005).
Temulawak (Curcuma xanthorrhiza
Roxb) merupakan tanaman asli Indonesia yang mempunyai aktivitas biologis, salah satunya sebagai antioksidan. Menurut Jayaprakasa et al. (2002) kurkuminoid pada rimpang temulawak berpotensi sebagai antioksidan. Demikian halnya dengan xanthorizol, selain mempunyai aktivitas antibakteri paling tinggi juga berpotensi sebagai antioksidan (Hwang et al 1999). Metode analisis komponen pada tumbuhan mempunyai peranan penting dalam pengembangan produk kesehatan berbasis tumbuhan obat. Banyaknya senyawa metabolit memainkan peranan penting dalam aktivitas rimpang temulawak sebagai antioksidan. Sedangkan komposisi metabolit dalam rimpang dipengaruhi oleh umur yang juga dipengaruhi oleh waktu tanam berbeda.
Pertumbuhan temulawak dipengaruhi oleh beberapa faktor, diantaranya iklim, budidaya, media tanam, dan ketinggian. Dengan kondisi budidaya dan umur yang berbeda sangat dimungkinkan menghasilkan kadar senyawa kurkuminoid dan xanthorizol yang berbeda. Adzkiya (2006) melaporkan bahwa masa tanam berpengaruh secara signifikan terhadap kandungan kurkumioid temulawak. Pengaruh sangat nyata juga terlihat dari perbedaan masa tanam dan budidaya terhadap kadar xanthorizol, namun kandungannya tidak dapat diprediksi oleh besarnya rendemen (Nurcholis 2006). Biasanya panen dilakukan setelah tanaman mencapai 7-8 bulan atau setelah daunnya menguning dan kering. Panen yang terbaik adalah ketika tanaman berumur 11-12 bulan. Diharapkan pada bulan-bulan tersebut kandungan metabolit sekunder sudah berada pada kadar yang optimum (Darwis et al. 1991).
Penggunaan spektroskopi Inframerah Tranformasi Fourier (FTIR) dalam analisis
tumbuhan masih terbatas, karena matriks dan spektrum yang dihasilkan cukup kompleks. Metode ini mampu melakukan pengukuran secara cepat dan serempak tanpa merusak contoh. Secara kualitatif metode ini dapat digunakan untuk melihat perubahan metabolit dalam contoh.
Adanya aplikasi kemometrik dapat memudahkan hasil analisis spektrum IR. Kekhasan spektrum FTIR yang dipadukan dengan kemometrik dapat dipakai untuk mengklasifikasikan contoh berdasarkan asal atau aktivitasnya. Sim et al. (2004) melakukan pengelompokkan pada Orthosiphon stamineus Benth (teh jawa) berdasarkan perbedaan geografis dan varietas serta senyawa kimianya menggunakan FTIR, Principal Component
Analysis (PCA) dan Soft Independent
Modelling of Class Analogy (SIMCA).
Zagonel et al. (2004) melakukan pengamatan terhadap perubahan reaksi kinetik pada minyak kedelai menggunakan FTIR. Xiao et
al. (2008) melaporkan bahwa kandungan
metabolit ekstrak rosemary dapat dideteksi menggunakan spektroskopi Nuclear magnetic
resonance (NMR) dan analisis data
multivariat menggunakan PCA.
Penelitian bertujuan mengkorelasikan kadar kurkuminoid dan xanthorizol dengan aktivitas antioksidan serta mengevaluasi dan membedakan perubahan metabolit rimpang temulawak pada waktu tanam yang berbeda menggunakan FTIR. Hipotesis penelitian adalah senyawa metabolit kurkuminoid dan xanthorizol berkorelasi dengan aktivitas antioksidan rimpang temulawak. Analisis spektroskopi FTIR dapat melihat perubahan metabolit temulawak pada waktu tanam yang berbeda. Penelitian ini diharapkan dapat memberikan informasi perubahan ,etabolit temulawak pada waktu tanam berbeda sehingga dapat dijadikan acuan dalam pengambilan contoh sesuai kebutuhan.
TINJAUAN PUSTAKA
Temulawak(Curcuma xanthoriza Roxb) Temulawak termasuk salah satu tumbuhan yang banyak digunakan sebagai bahan baku obat tradisional. Di Indonesia temulawak dikenal dengan beberapa nama seperti koneng gede (Sunda), temu lawak (Jawa) dan temu labak (Madura). Klasifikasi tanaman ini termasuk divisi Spermatophyta, subdivisi Angiospermae, kelas Monocotyledonae, ordo Zingiberales, keluarga Zingiberaceae, genus
Curcuma, spesies Curcuma xanthorrhiza
Tanaman temulawak digolongkan ke dalam tanaman terna tahunan berbatang semu yang merupakan metamorfosis dari daun tanaman. Tinggi tanaman dapat mencapai 2 meter. Daun temulawak berbentuk lanset (Gambar 1a), warna hijau tua dengan garis-garis cokelat dibagian tulang daunnya dan tiap batang mempunyai daun 2-9 helai. Lebar helaian daun 10-18 cm, panjang daun mencapai 31-84 cm dan tangkai daun mencapai 43-80 cm. Perbungaan bersifat lateral dengan tangkai yang ramping, berbulu dan bersisik. Bunga berbentuk bulir, bulat dan memanjang mencapai 9-23 cm dan lebar 4-6 cm (Saragih & Haryadi 2000).
Hasil pengamatan diberbagai daerah di Indonesia rimpang temulawak (Gambar 1b) umumnya berbunga sekitar 2-4 bulan sesudah musim hujan. Bunga berwarna merah, merah-ungu atau putih-merah dengan sebagian ujungnya berwarna ungu. Pada umumnya munculnya bunga diawali dengan berkembangnya pertumbuhan vegetatif, namun terkadang dalam keadaan luar biasa perbungaan dapat terjadi bersamaan dengan munculnya daun, bahkan dapat terjadi sebelum pertumbuhan vegetatif. Bunga pada rimpang temulawak umumnya mekar pada pagi hari dan layu beberapa jam kemudian (Sidik et al. 1985). Temulawak dilaporkan mempunyai berbagai aktivitas biologis seperti antitumor, antiinflamasi, antioksidan, hepatoprotektif, dan antibakteri. Aktivitas tersebut disebabkan oleh komponen aktif temulawak berupa kurkuminoid dan xanthorizol (Hwang et al. 1999).
(a) (b)
Gambar 1 (a) daun temulawak dan (b) rimpang temulawak.
Komposisi Kimia Rimpang Temulawak Komposisi kimia rimpang temulawak mengandung zat kuning kurkumin, minyak atsiri, pati, lemak (fixed oil), selulosa dan mineral. Suwiah (1991) menguraikan komposisi rimpang kering temulawak dengan kadar air 10% seperti terlihat pada Tabel 1. Pati merupakan komponen kimia terbesar dalam rimpang temulawak berbentuk serbuk
warna putih kekuningan karena mengandung kurkuminoid. Kadar pati dalam rimpang berkisar antara 48-54 % tergantung ketinggian tempat tumbuh. Semakin tinggi tempat tumbuh, maka kadar pati semakin rendah (Sidik et al. 1985; Afifah 2003). Kandungan kimia rimpang temulawak memberi arti penting dalam penggunaannya sebagai sumber bahan pangan, bahan baku industri atau bahan baku obat. Sehingga kandungan kimia rimpang temulawak dibedakan atas tiga fraksi yaitu fraksi pati, fraksi kurkuminoid dan fraksi minyak atsiri (Sidik et al. 1985). Susunan metabolit kimia rimpang temulawak ditentukan oleh beberapa faktor diantaranya budidaya, tempat tumbuh, iklim, dan umur rimpang.
Tabel 1 Komposisi kimia temulawak Komposisi Senyawa Kadar (%) Pati 27.62 Lemak 5.38 Minyak atsiri 10.96 Kurkumin 1.93 Protein 6.44 Serat kasar 6.89
Sumber: Suwiah (1991) berdasarkan kadar air 10%
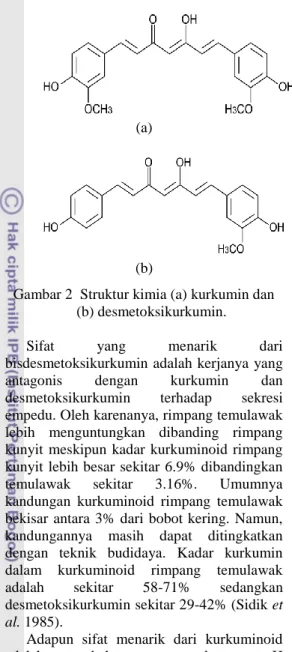
Kurkuminoid dan Xanthorizol Fraksi kurkuminoid pada rimpang temulawak terdiri atas dua komponen yaitu kurkumin dan desmetoksikurkumin. Kurkumin mempunyai rumus molekul C21H20O6 dengan bobot molekul 368 g/mol sedangkan desmetoksikurkumin mempunyai rumus molekul C20H18O5 dengan bobot molekul 338 g/mol. Kurkuminoid berbentuk serbuk dengan rasa sedikit pahit, larut dalam aseton, alkohol, asam glasial, alkohol hidroksida, memiliki aroma yang khas dan tidak bersifat toksik. Kurkuminoid memberikan warna kuning pada temulawak dan mempunyai sifat medis seperti menetralkan racun, menghilangkan rasa nyeri sendi, menurunkan kadar kolesterol, antibakteri dan antioksidan. Diduga gugus aktif pada kurkuminoid terletak pada gugus metoksi. Gugus hidroksil fenolat yang terdapat pada kurkuminoid mempunyai aktivitas antibakteri (Sidik et al. 1985). Kurmuminod pada rimpang temulawak berbeda dengan kurkuminoid pada kunyit. Selain dua komponen di atas, terdapat satu komponen lain yaitu bisdesmetoksikurkumin yang mempunyai kadar yang lebih rendah.
3
(a)
(b)
Gambar 2 Struktur kimia (a) kurkumin dan (b) desmetoksikurkumin.
Sifat yang menarik dari bisdesmetoksikurkumin adalah kerjanya yang antagonis dengan kurkumin dan desmetoksikurkumin terhadap sekresi empedu. Oleh karenanya, rimpang temulawak lebih menguntungkan dibanding rimpang kunyit meskipun kadar kurkuminoid rimpang kunyit lebih besar sekitar 6.9% dibandingkan temulawak sekitar 3.16%. Umumnya kandungan kurkuminoid rimpang temulawak bekisar antara 3% dari bobot kering. Namun, kandungannya masih dapat ditingkatkan dengan teknik budidaya. Kadar kurkumin dalam kurkuminoid rimpang temulawak adalah sekitar 58-71% sedangkan desmetoksikurkumin sekitar 29-42% (Sidik et
al. 1985).
Adapun sifat menarik dari kurkuminoid adalah perubahan warna karena pH lingkungan. Di dalam suasana asam kurkuminoid berwarna kuning atau kuning jingga sedangkan dalam suasana basa berwarna merah. Hal ini disebabkan oleh sistem tautometri pada molekulnya. Selain proses disosiasi, sifat kurkumin dalam suasana basa dapat mengalami degradasi membentuk asam ferulat dan feruloilmetan yang dipengaruhi juga oleh suhu lingkungan (Sidik et al. 1985).
Sifat lain dari kurkuminoid adalah sensitifitasnya terhadap cahaya. Apabila kurkumin terkena cahaya akan terjadi dekomposisi struktur berupa siklisasi kurkumin atau degradasi struktur. Peristiwa ini dibuktikan oleh Sidik et al. (1985) dengan melakukan penelitian terhadap rimpang temulawak yang dikeringkan dengan pemanasan oleh sinar matahari dan tanpa pemanasan. Hasilnya adalah rimpang yang
dikeringkan langsung di bawah sinar matahari mempunyai kadar kurkuminoid yang lebih kecil dibandingkan dengan tanpa pemanasan sinar matahari langsung.
Analisis kurkuminoid dapat dilakukan melalui beberapa cara yaitu spektroskopi sinar tampak, titrasi volumetrik, dan kromatografi. Metode spektroskopi sinar tampak dapat dilakukan dengan menggunakan berbagai pelarut di antaranya asam asetat, aseton, etanol, metanol, etilasetat, dan tetrahidrofuran. Tetrahidofuran merupakan pengekstrak kurkuminoid yang paling baik dibandingkan dengan etanol dan metanol. Di dalam penelitian kadar kurkuminoid dilakukan menggunakan metode Kromatrografi Cair Kinerja Tinggi (KCKT) (Gritter et al. 1991).
Temulawak mempunyai kadar minyak atsiri yang cukup besar yaitu antara 3-12%. Namun, besarnya kandungan tergantung tergantung pada umur rimpang, tempat tumbuh, teknik isolasi dan teknis analisis (Sidik et al. 1985). Kandungan minyak atsirinya merupakan yang paling tinggi diantara jenis Curcuma sp (Herman 1985). Kandungan minyak atsiri dalam rimpang terdiri atas komponen monoterpen dan seskuiterpen. Namun, ada komponen khas seperti trisiklin isofuranogermakren, allo-aromadendren, germakren, dan xanthorizol.
Kadar xantorizol tertinggi adalah 14,25% yang dihasilkan dari kehalusan bahan 60 mesh. Selain xanthorizol komponen minyak atsiri temulawak yang tidak terdapat dalam
Curcuma lain adalah germakren. Senyawa ini
termasuk ke dalam seskuiterpen keton. Menurut Hwang et al. (2004) xanthorizol mempunyai kemampuan yang baik terhadap aktifitas antibakteri dengan spektrum yang luas, stabil terhadap panas dan aman terhadap kulit. Bakteri yang mengalami hambatan pertumbuhan terbesar adalah streptococcus
mutan yang merupakan salah satu bakteri
penyebab sakit gigi. Xanthorizol mampu menghambat S.mutan pada konsentrasi rendah yakni 2 µg/mL sebagai konsentasi hambat minimum. Selain itu, xanthorizol mampu menghambat infeksi pada kulit, dan banyak digunakan sebagai produk seperti pasta gigi, permen karet, pembersih mulut dan kosmetik.
Antioksidan
Antioksidan adalah zat yang dapat memperlambat kerusakan karena radikal bebas dengan cara memperlambat proses terjadinya reaksi oksidasi (Murray 2003). Berdasarkan cara reaksinya antioksidan diartikan sebagai komponen yang menghentikan rantai radikal bebas dan mengubahnya ke dalam bentuk stabil. Berdasarkan fungsinya, antioksidan dibedakan menjadi tiga tipe diantaranya tipe pemutus rantai pada reaksi pembentuk radikal bebas, dengan menyumbangkan atom H, misalnya vitamin E; tipe pereduksi dengan mentransfer atom H atau oksigen atau bersifat pemulung, misalnya vitamin C; dan tipe pengikat logam, mampu mengikat zat peroksidan, seperti Fe3+ dan Cu2+.
Radikal bebas merupakan senyawa yang tidak mempunyai pasangan elektron, sehingga untuk menjaganya tetap stabil radikal bebas akan menerima elektron dari senyawa antioksidan. Umumnya radikal bebas, termasuk Radical Oxygen Species (ROS), penting artinya bagi kesehatan dan fungsi tubuh yang normal dalam memerangi peradangan, membunuh bakteri, dan mengendalikan tonus otot polos pembuluh darah dan organ-organ dalam tubuh kita. Apabila dihasilkan melebihi batas kemampuan proteksi antioksidan seluler, maka dia akan menyerang sel itu sendiri. Struktur sel yang berubah turut merubah fungsinya, yang akan mengarah pada proses munculnya berbagai penyakit (Sauriasari 2006). Antioksidan pada temulawak adalah kurkumin, namun antioksidan tersebut tidak mampu mencegah terjadinya degradasi kurkuminoid secara keseluruhan.
Mekanisme Antioksidan
Antioksidan dapat menghambat atau memperlambat reaksi oksidasi dengan dua cara, yaitu transfer atom hidrogen dan transfer elektron tunggal. Keduanya mungkin terjadi dalam suatu metode. Hasil analisis yang baik diperoleh jika metode antioksidan mempunyai kedua mekanisme tersebut (Gordon et al. 2001). Mekanisme tranfer hidrogen terjadi berdasarkan penjerapan radikal oleh atom hidrogen dan mengubahnya menjadi bentuk yang stabil. Prosesnya terjadi sangat cepat dan spontan karena hidrogen mudah terjerap oleh radikal. Radikal dalam bentuk stabil lebih mudah dianalisis dibandingkan bentuk bebas yang sangat reaktif. Mekanisme kerja antioksidan ini sesuai dengan cara kerja
antioksidan secara fisiologis, yaitu menjerap radikal agar tidak terlalu reaktif terhadap substrat. Mekanisme ini sederhana dan secara langsung dapat menganalisis aktivitas antioksidan berdasarkan daya jerapnya terhadap radikal. Mekanisme transfer atom hidrogen seperti X + AH XH + A (Prior et al. 2005).
Mekanisme transfer elektron tunggal didasarkan atas kemampuan antioksidan dalam mentrasnfer satu elektron untuk mereduksi senyawa karbonil, radikal dan logam. Mekanisme ini lebih memperjelas daya reduksi antioksidan sebagai inhibitor oksidasi pada proses reaksi oksidasi-reduksi (redoks). Biasanya logam bersifat oksidator yang digunakan untuk mengetahui daya reduksi antioksidan. Transfer elektron antara ion logam dan antioksidan menyebabkan reduksi logam yang dapat diketahui dengan pembentukkan kompleks logam dengan senyawa antioksidan. Intensitas warna dari pembentukkan kompleks ini berbanding lurus dengan daya reduksi antioksidan tersebut. Mekanisme transfer elektron seperti M(III) + AH AH+ + M(II) (Prior et al. 2005).
Uji Aktivitas Antioksidan
Aktivitas antioksidan dapat dinyatakan dalam Troloks Equivalent Antioxidant Capacity (TEAC) dengan troloks sebagai
standar dan Ascorbic acid Equivalent Capacity (AEAC) dengan vitamin C sebagai
standar. Standar yang digunakan pada penelitian ini adalah troloks. Troloks merupakan analog vitamin E yang larut dalam air dengan rumus molekul C14H18O4 dan nama IUPAC 6-hidroksi-2,5,7,8-tetrametilkroman-2-asam karboksilat (Prior et
al. 2005).
Pengujian aktivitas antioksidan dilakukan pada contoh yang diduga mempunyai bioaktivitas sebagai antioksidan. Pada tumbuhan senyawa yang mempunyai aktivitas antioksidan adalah golongan flavonoid dan fenolik. Terdapat beberapa cara untuk menentuan aktivitas antioksidan diantaranya DPPH (2,2-difenil-1-pikrilhidrazil), Ferric
Reducing Ability of Plasma (FRAP) dan Cupric Ion Reducing Antioxidant (CUPRAC).
Ketiga metode ini didasarkan atas transfer atom hidrogen dan/atau transfer elektron.
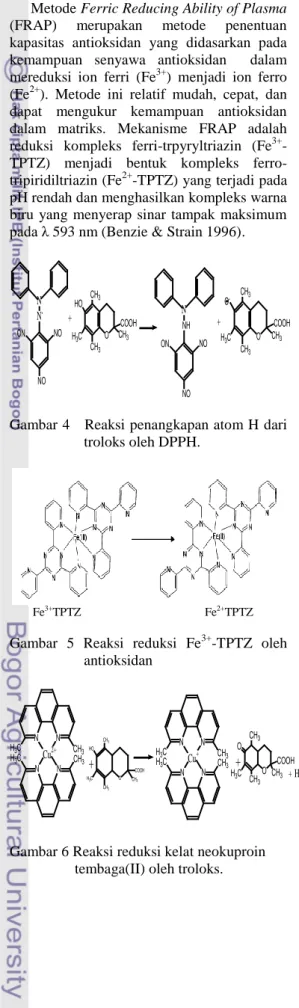
Metode DPPH (2,2-difenil-1-pikrilhidrazil) merupakan metode uji aktivitas antioksidan yang paling banyak dilakukan. Pengujian antioksidan ini pada prinsipnya adalah reaksi penangkapan hidrogen dari antioksidan oleh radikal bebas DPPH yang
5
akan diubah menjadi 1,1-difenil-2-pikrilhidrazin yang stabil dan menghasilkan warna ungu yang dapat diukur pada panjang gelombang 517 nm (Molyneux 2004). Reaksinya ditunjukkan pada Gambar 6. DPPH berperan sebagai radikal bebas yang diredam oleh antioksidan dari sampel.
Metode Ferric Reducing Ability of Plasma (FRAP) merupakan metode penentuan kapasitas antioksidan yang didasarkan pada kemampuan senyawa antioksidan dalam mereduksi ion ferri (Fe3+) menjadi ion ferro (Fe2+). Metode ini relatif mudah, cepat, dan dapat mengukur kemampuan antioksidan dalam matriks. Mekanisme FRAP adalah reduksi kompleks ferri-trpyryltriazin (Fe3+ -TPTZ) menjadi bentuk kompleks ferro-tripiridiltriazin (Fe2+-TPTZ) yang terjadi pada pH rendah dan menghasilkan kompleks warna biru yang menyerap sinar tampak maksimum pada λ 593 nm (Benzie & Strain 1996).
N N. O CH3 HO H3C CH3 COOH CH3 NO NO ON NO NO ON N NH O CH3 O. H3C CH3 COOH CH3 + +
Gambar 4 Reaksi penangkapan atom H dari troloks oleh DPPH.
Fe3+TPTZ Fe2+TPTZ
Gambar 5 Reaksi reduksi Fe3+-TPTZ oleh antioksidan O CH3 HO H3C CH3 COOH CH3 N N H3C Cu2+ CH3 N N CH3 H3C N N H3C Cu+ CH3 N N CH3 H3C O CH3 CH3 O H3C COOH CH3 H+ + + +
Gambar 6 Reaksi reduksi kelat neokuproin tembaga(II) oleh troloks.
Cupric Ion Reducing Antioxidant Capasity
(CUPRAC) mengunakan pereaksi tembaga (II) neokuproin (Cu2+Nc) sebagai agen pengoksidasi kromogenik. Neokuproin merupakan pereaksi kromogenik yang akan membentuk kelat dengan Cu2+ (Gambar 7). Metode ini mengukur kemampuan antioksidan dalam mereduksi kompleks Cu2+ -Nc menjadi komples Cu+-Nc yang berwarna biru, selanjutnya kompleks warna yang terbentuk diukur pada panjang gelombang 450 nm. (Apak et al 2004). Kemampuan reduksi pada metode FRAP dan CUPRAC ditentukan oleh banyaknya senyawa oksidan dalam ekstrak.
Kromatografi Cair Kinerja Tinggi (KCKT)
Metode analisis komponen pada tumbuhan mempunyai peranan penting dalam pengembangan produk kesehatan berbasis tumbuhan obat. Kromatrografi Cair Kinerja Tinggi (KCKT), Kromatografi Gas (KG), Kromatrografi Lapis Tipis (KLT), dan spektroskopi massa merupakan beberapa metode yang biasa digunakan untuk menganalisis tumbuhan obat. Metode-metode tersebut mampu memberikan informasi definitif untuk identifikasi dan kuantifikasi komponen, namun membutuhkan standar otentik yang bervariasi, tahapan analisis yang panjang, dan waktu analisis yang cukup lama (Chang et al 2002).
Kromatografi merupakan teknik pemisahan komponen pada suatu contoh melalui distribusi komponen di antara dua fase, yaitu fase diam dan fase gerak. Kromatografi berdasarkan fase geraknya dapat dibedakan menjadi dua bagian, yaitu kromatografi gas dan cair. Salah satu jenis kromatografi cair adalah Kromatrografi Cair Kinerja Tinggi (KCKT). Fase diam dapat berupa permukaan zat padat berfungsi sebagai medium penjerap, atau permukaan zat cair. Fase gerak pada KCKT dialirkan cepat dengan bantuan tekanan dan hasilnya dideteksi dengan instrumen Day & Underwood 1998.
Metode KCKT digunakan untuk memisahkan senyawa yang tidak mudah menguap, berbobot molekul tinggi dan senyawa yang mudah terdegradasi oleh panas (Hendayana et al. 1994). Sistem pemisahan dibagi menjadi 2 yaitu sistem fase normal dan fase terbalik. Fase diam dapat berupa permukaan zat padat berfungsi sebagai medium penjerap, atau permukaan zat cair.
Terdapat dua jenis pengisi kolom yaitu pengisi yang bersifat polar seperti silika gel dan non polar seperti C18 (n-oktildesil). Pemisahan yang paling baik diperoleh jika fase diam mempunyai luas permukaan yang besar. Untuk memperoleh kesetimbangan yang baik, fase gerak harus bergerak dengan cepat agar proses difusinya kecil (Gritter et al. 1991).
Analisis KCKT banyak digunakan dalam bidang farmasi, kimia, makanan, kosmetik dan aplikasi lingkungan. KCKT terkenal baik untuk analisis pemisahan dan analisis kuantitatif (Chang et al. 2002). Keuntungan menggunakan KCKT adalah jumlah contoh yang digunakan untuk analisis cukup sedikit, waktu retensi hanya beberapa menit dan batas deteksi sampai nanogram per liter (Hendayana et al. 1994).
Spektroskopi Inframerah (IR) Metode spektrofotometri mengukur jumlah radiasi elektromagnetik yang diserap oleh larutan contoh. Jumlah serapan berkaitan dengan konsentrasi analit dalam larutan. Terdapat tiga proses dasar penyerapan radiasi oleh molekul yang melibatkan kenaikkan molekul ke tempat energi yang lebih tinggi, yaitu rotasi, vibrasi, dan transisi elektronik. Energi pada spektroskopi inframerah tidak cukup untuk mengeksitasi elektron, sehingga hanya menyebabkan senyawa organik mengalami rotasi dan vibrasi (Nur et al 1989).
Daerah radiasi spektroskopi IR berkisar pada bilangan gelombang 12800-10 cm-1. Daerah 1400-4000 cm-1 merupakan daerah yang khusus untuk mengidentifikasi gugus-gugus fungsional sedangkan daerah 1400-700 cm-1 merupakan daerah sidik jari (fingerprint region). Daerah spektrum yang paling banyak dipergunakan dalam analisis metabolit adalah daerah pertengahan yakni pada 4000-670 cm-1 (Skoog et al. 1998). Perbedaan struktur dan susunan molekul pada daerah sidik jari ini menyebabkan perubahan distribusi puncak serapan. Spektrum IR diperoleh dengan mengukur intensitas radiasi cahaya sebelum (I0) dan sesudah (I) melewati contoh. Spektrum IR ditampilkan dengan mengalurkan transmitan (T= I/I0) sebagai fungsi dari bilangan gelombang. Nilai transmitan dapat diganti dengan nilai serapan (absorban) yaitu sinar yang diserap oleh contoh. Serapan pada panjang gelombang tertentu dapat menghasilkan nilai konsentrasi contoh berdasarkan hukum Beer (Day et al. 1998).
Spektrofotometri InframerahTranformasi Fourier (FTIR) dan Aplikasinya
Spektrofotometri inframerah mempunyai sistem optik yang berbeda dengan spektrofotometri ultraviolet (UV) atau sinar tampak. Perbedaannya terletak pada sumber energi dan sel (kuvet). Sinar inframerah mempunyai energi yang lebih rendah dibandingkan dengan sinar UV ataupun sinar tampak. Oleh karena itu sel yang digunakan lebih tipis daripada untuk spektrofometer UV (Hendayana et al 1994). Dilihat dari aplikasi dan daerah radiasinya, spektrum inframerah dibagi ke dalam tiga daerah radiasi, yaitu IR dekat (12800 cm-1 – 4000 cm-1), IR pertengahan (4000 cm-1 – 200 cm-1) dan IR jauh (200 cm-1 – 100 cm-1). Penggunaan paling banyak dilakukan pada daerah pertengahan dengan kisaran gelombang 4000 sampai 670 cm-1 (Nur & Adijuwana 1989).
Spectroscopy Fourier Tranformation
Infrared (FTIR) atau spektroskopi inframerah
transformasi fourier merupakan teknik analisis IR dengan daerah IR pertengahan. FTIR merupakan gabungan instrumen dispersif konvensional IR dengan komputer dan mikroprosesor. FTIR mempunyai beberapa keuntungan diantaranya non-destruktif, dapat menganalisis multikomponen dengan cepat, tidak perlu penyiapan contoh, dan gangguan dapat dimimumkan selama penentuan suatu senyawa. Metode yang mendasari penggunaan spektrofotometer inframerah ini adalah penyerapan IR oleh molekul senyawa. Oleh karena panjang gelombang IR lebih pendek dari panjang gelombang sinar uv dan sinar tampak, maka energi IR tidak mampu mentransmisikan elektron melainkan hanya menyebabkan molekul itu bergetar atau bervibrasi (Hendayana et al. 1994).
Monokromator pada FTIR digantikan dengan interferometer yang akan mengatur intensitas sumber sinar inframerah dengan mengubah posisi cermin pemantul dari sumber sinar ke contoh. Keberadaan interferometer ini membuat FTIR dapat mengukur semua frekuensi optik secara serempak dengan mengatur intensitas dari semua frekuensi tunggal sebelum sinyal mencapai detektor. Hasil scanning
interferometor (interferogram) tidak dapat diinterpretasikan dalam bentuk aslinya. Proses matematika akan mengubah interferogram menjadi spektrum antara intensitas dan frekuensi, sehingga informasi dalam spektrum dapat dianalisis.
7
Spektroskopi FTIR berguna untuk menentukan gugus fungsional senyawa organik, mengidentifikasi senyawa dan menganalisis campuran. Contoh yang dianalisis dapat berupa zat cair atau padatan. Kebanyakan contoh berupa zat padat yang dicampur dengan kristal KBr. Campuran tersebut dibuat semacam pellet dengan cara
hand press. Selanjutnya contoh ditempatkan
pada sel spektrofotometri IR dengan mengarah ke sumber radiasi (Hendayana et al 1994; Day & Underwood 1998). Tempat contoh (kuvet) yang digunakan harus terbuat dari bahan yang tidak dapat menyerap inframerah seperti KBr dan NaCl (Harvey 2000).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan adalah rimpang temulawak umur 7, 8 dan 9 bulan, etanol teknis, metanol 96%, etanol 96%, larutan CuCl2.2H2O 0.01 M, larutan neokuproin 0.0075 M dalam etanol 96%, buffer 1 N ammonium asetat pH 7.0, larutan FeCl3.6H2O 0.02 M, larutan TPTZ (2,4,6-tripyridyl-s-triazine) dalam 0.04 M HCl, 0.3 M buffer asetat pH 3.6, larutan DPPH, troloks, asetonitril, asam asetat 2% dan akuades.
Alat-alat yang digunakan di antaranya peralatan gelas, rak tabung reaksi, vorteks, pipet Mohr, pipet volumetrik, pipet tetes, pipet mikro, labu Erlemeyer, neraca analitik, maserator, cawan porselin, oven, eksikator rotarievaforator, freeze-dried, kuvet, kertas saring Whatman No.45, kertas saring Whatman 0.2 µM, spektrofotometri uv-vis, spetrofotometri Transformasi Fourier, kuvet, kromatografi cair kinerja tinggi. Perangkaat lunak yang digunakan adalah OPUS, Microsoft Excel, SAS, dan Minitab 14.
Metode Penelitian
Penelitian dilakukan di Laboratorium Pusat Studi Biofarmaka, Lembaga Penelitian dan Pengabdian kepada Masyarakat (LPPM) IPB, Taman Kencana, Bogor. Penelitian dimulai dari bulan Oktober 2009-Februari 2010. Penelitian dilakukan melalui beberapa tahap diantaranya preparasi bahan baku, ekstraksi, selanjutnya analisis esktrak seperti penentuan kadar kurkuminoid dan xanthorizol, kapasitas antioksidan dengan tiga metode berbeda, serta penentuan spektrum FTIR.
Preparasi Bahan Baku
Rimpang temulawak segar berasal dari Semarang, yang berumur 7, 8 dan 9 bulan. Rimpang induk dicuci bersih, kemudian diiris tipis dengan ketebalan ± 6-7 mm. Setelah itu, simplisia dikeringkan menggunakan oven sampai kering (simplisia dapat dipatahkan). Suhu oven yang digunakan 40oC. Selanjutnya simplisia digiling dengan kehalusan 100 mesh.
Penentuan Kadar Air
Cawan porselin dikeringkan pada suhu 105oC selama 30 menit, kemudian didinginkan dalam eksikator dan ditimbang. Sebanyak 3 gram contoh (dicatat sampai 4 desimal dalam gram) kemudian ditempatkan dalam cawan dan dikeringkan pada suhu 105oC selama 6 jam. Selanjutnya contoh diambil, didinginkan dalam eksikator dan ditimbang. Prosedur ini dilakukan sampai memperoleh bobot yang konstan (pekerjaan dilakukan triplo). Kadar air yang dihitung untuk simplisia serbuk. Kadar air dihitung dengan persamaan.
Kadar air = a-b
a x 100%
Ket: a= bobot bahan sebelum dikeringkan b= bobot bahan setelah dikeringkan
Ekstraksi Rimpang Temulawak
Sebanyak 25 gram serbuk rimpang temulawak dimasukan ke dalam maserator, kemudian ditambahkan 250 mL etanol teknis dan didiamkan selama 24 jam dengan sesekali diaduk. Setelah itu, ekstrak disaring sehingga diperoleh filtrat kemudian diuapkan dengan menggunakan evaporator dan
freeze-dried untuk mendapatkan ekstrak etanolnya,
selanjutnya ekstrak ditimbang.
Penentuan Kadar Kurkuminoid dengan Metode Kromatrografi Cair Kinerja Tinggi (KCKT) (Jayaprakasha et al. 2002)
Persiapan injeksi KCKT dilakukan dengan menyiapkan larutan standar kurkuminoid (kurkumin dan desmetoksikurkumin) dalam metanol dengan beberapa konsentrasi yaitu 0.25, 0.5, 0.75, dan 1 ppm. Selanjutnya semua larutan standar disaring menggunakan filter 0.2 µm. Kurva kalibrasi dibuat dengan menghubungkan konsentrasi kurkuminoid standar dengan luar area.
Preparasi contoh dilakukan pada ekstrak kental temulawak umur 7, 8, dan 9 bulan. Sebanyak ± 30 mg ekstrak di larutkan dalam 10 mL metanol. Selanjutnya larutan stok
diencerkan dengan beberapa kali pengenceran untuk mendapatkan luas kurva yang masuk deret standar. Kemudian semua contoh disaring menggunakan filter 0.2 µm. Selanjutnya contoh siap diinjeksi.
Sistem elusi dilakukan dengan fase gradien dengan laju alir 1 mL/menit, suhu dijaga pada suhu kamar dan volume injeksi sebanyak 20 µL. Detektor yang digunakan adalah uv-vis dengan panjang gelombang 425 nm. Fase gerak yang digunakan terdiri atas campuran asetonitril, asam asetat 2% dan metanol. Kolom yang digunakan adalah C18 dengan panjang 300 x 4.6 mm.
Penentuan Kadar Xanthorizol dengan Metode Kromatrografi Cair Kinerja Tinggi (KCKT)
Persiapan injeksi KCKT terdiri atas beberapa tahapan yaitu persiapan larutan stok, persiapan larutan deret standar xanthorizol dan persiapan larutan ekstrak. Larutan stok yang telah ada adalah 1000 ppm. Lalu deret standar dibuat dari larutan stok yang diencerkan menjadi 50, 100, 200 dan 400 ppm. Selanjutnya semua larutan standar disaring menggunakan filter 0.2 µm.
Larutan ekstrak dibuat dengan menimbang ekstrak pekat temulawak sebesar ± 30 mg dilarutakan dalam 10 mL etanol. Selanjutnya sebanyak 0.5 mL dipipet dan ditera sampai 5 mL sehingga diperoleh larutan ekstrak dengan pengenceran 10 kali. Kemudian larutan ekstrak disaring menggunakan filter 0.2 µm.
Pengukuran dilakukan dengan KCKT untuk selanjutnya ditentukan kadar xantorizolnya. Sistem KCKT yang digunakan ialah kolom C18, detektor uv, volume injeksi 10 µL, elusi gradient dan suhu kolom 40oC. Rincian metode diperoleh dari Pusat Studi Biofarmaka belum dapat diberikan.
Uji Aktivitas Antioksidan dengan Metode DPPH (Aqil et al 2006 )
Larutan DPPH disiapkan dalam metanol dengan konsentrasi 0.1 mM. Sebanyak 100 µL larutan ekstrak yang telah diencerkan dengan metanol ditambahkan ke dalam 2 mL larutan DPPH 0.1 mM dalam metanol. Semua larutan divorteks kemudian larutan didiamkan selama 30 menit pada suhu ruang yang terlindung cahaya. Selanjutnya larutan diukur dengan panjang gelombang 517 nm. Blanko yang digunakan adalah pereaksi tanpa penambahan ekstrak. Kurva kalibrasi dibuat menggunakan troloks dengan konsentrasi 20, 40, 60, 80, 100, 200, dan 400 µM. Kapasitas antioksidan didasarkan pada kemampuan
memecah radikal DPPH dan dinyatakan sebagai µmol troloks/g ekstrak.
Uji Aktivitas Antioksidan dengan Metode Ferric Reducing Ability of Plasma (FRAP) (Benzie & Strain 1996)
Sebanyak 3 mL reagen FRAP (ferric
tripiridyltriazine) disiapkan dalam tabung
reaksi, kemudian ditambahkan 100 µL sampel dan 300 µL akuades. Selanjutnya campuran tersebut di vorteks dan diinkubasi pada suhu 37oC selama 30 menit. Setelah itu, semua larutan uji dibaca serapannya pada panjang gelombang 593 nm. Kurva standar dibuat menggunakan troloks dengan konsentrasi 100, 200, 300, 400, 500, dan 600 µM. Kapasitas antioksidan dinyatakan dalam µmol troloks/g ekstrak.
Uji Aktivitas Antioksidan dengan Metode CUPRAC (Cupric Ion Reducing Antioxidant Capacity) (Apak et al. 2004)
Sebanyak 1 mL larutan CuCl2 0.001 M, 1 mL larutan neokuproin alkoholik 0.0075 M, dan 1 mL larutan buffer ammonium asetat pH 7 ditambahkan ke dalam 0.1 mL akuades dan 1 mL larutan ekstrak yang dilarutkan pada etanol 96%. Volume total sebanyak 4.1 mL. semua larutan divorteks dan didiamkan selama 1 jam tanpa terkena cahaya pada suhu kamar. Selanjutnya diukur pada panjang gelombang 457 nm. Blanko yang digunakan adalah pereaksi tanpa penambahan ekstrak. Kurva kalibrasi dibuat dengan menggunakan larutan troloks dengan konsentrasi 10, 20, 30, 40, 50, 60, 70, 80 dan 90 µM. Kapasitas antioksidan dinyatakan dalam µmol troloks/g ekstrak.
Penentuan Profil Sidik Jari Ekstrak Rimpang Temulawak Menggunakan Spektroskopi FTIR
Sebanyak ± 0.5 gram ekstrak rimpang temulawak umur 7, 8 dan 9 bulan dicampur dengan 180 mg KBr untuk dijadilan pelet. Pelet dibuat dengan menggunakan hand press Shimadzu dengan tekanan 8 kN selama 15 menit. Pengukuran spektrum dilakukan dengan menggunakan spektrofotometer FTIR. Pengukuran dilakukan tiga kali untuk setiap contoh.
Sebuah komputer personal yang dilengkapi dengan perangkat lunak OPUS digunakan untuk mengatur kerja spektometer pada kisaran bilangan gelombang 4000 sampai 400 cm-1. Spektrum yang dihasilkan kemudian disimpan dalam format OPUS.
9
Spektrum asli diberikan perlakuan pendahuluan. Data spektrum dinormalisasi sehingga serapan terkecil diset menjadi 0 sedangkan serapan tertinggi diset menjadi 2.
Analisis Statistik
Data hasil dievaluasi dengan analisis korelasi untuk melihat hubungan keeratan antara senyawa metabolit dengan ketiga metode penentuan aktivitas antioksidan. Analisis korelasi yang dilihat antara lain hasil uji aktivitas antioksidan metode DPPH, FRAP dan CUPRAC dengan kadar kurkuminoid, xanthorizol dan rendemen. Analisis korelasi dilakukan menggunakan SAS.
Spektrum FTIR dianalisis dengan melihat konsistensi panjang gelombang dari setiap ekstrak. Kekhasan spektrum terlihat dari munculnya puncak di tempat yang berbeda untuk setiap contoh. Perbedaan akan terlihat dari puncak serapan setiap contoh. Analisis gugus fungsi dilakukan dengan membandingkan pada standar yang ada.
HASIL DAN PEMBAHASAN
Kadar Air dan RendemenRimpang temulawak yang digunakan dalam penelitian adalah rimpang induk yang berasal dari Semarang. Sebelum digunakan rimpang dipotong-potomg kemudian dikeringkan pada suhu 40oC selama 2-3 hari. Suhu 40oC yang digunakan relatif baik untuk mencegah kerusakan pada senyawa metabolit terutama minyak atsiri yang mudah menguap. Selanjutnya rimpang digiling untuk mendapatkan simplisia serbuk. Kadar air yang diperoleh dari setiap simplisia tidak selalu sama dalam setiap analisis. Oleh karena itu kadar air perlu ditentukan dengan cara metode gravimetri evolusi tidak langsung. Bobot air dihitung setelah proses pengeringan pada suhu 105oC selama periode waktu tertentu sampai diperoleh bobot contoh yang konstan (Harjadi 1993). Penentuan kadar air kering dilakukan untuk mengetahui lama penyimpanan simplisia dan faktor koreksi untuk rendemen, kadar kurkuminoid, xanthorizol dan aktivitas antioksidan.
Kadar air rimpang umur 7 bulan yang diperoleh sebesar 83.219%, umur 8 bulan sebesar 77.734% dan 9 bulan sebesar 77.203%. Nilai kadar air basah ini menurun untuk setiap bulannya. Penurunan ini terjadi karena berkurangnya jumlah air yang diserap oleh tanaman temulawak selama ia tumbuh
sampai pemanenan. Namun, pada umur 8 bulan ke 9 bulan penurunan tidak terlalu signifikan. Hal ini disebabkan oleh kondisi lingkungan dan lamanya curah hujan yang diterima oleh setiap rimpang. Temulawak umumnya ditanam pada saat masuk musim penghujan. Kadar air basah diperoleh dengan mengkonversi kadar air kering terhadap bobot contoh dan massa padat pada masing-masing rimpang (Lampiran 3).
Setelah dilakukan pengeringan, simplisia digiling untuk selanjutnya dilakukan ekstraksi. Ekstraksi rimpang temulawak dilakukan menggunakan teknik maserasi dengan pelarut organik. Metode ini dipilih karena minyak atsiri rimpang temulawak tidak tahan terhadap panas. Suhu yang terlalu tinggi menyebabkan terjadinya dekomposisi yang terkandung dalam minyak atsiri, tetapi suhu yang rendah juga dapat menyebabkan kadar rendemen yang dihasilkan terlalu kecil. Maserasi merupakan metode ekstraksi dengan cara merendam contoh dalam larutan dengan waktu tertentu. Pelarut organik digunakan dalam ekstraksi yaitu etanol dan maserasi dilakukan selama 24 jam dengan harapan semua metabolit yang terkandung dalam rimpang dapat terekstrak. Pemilihan pelarut didasarkan atas sifat kelarutan zat aktif terhadap pelarut organik. Dalam hal ini kurkuminoid dan xanthorizol larut baik dalam etanol. Ekstrak yang telah diperoleh kemudian di uapkan menggunakan rotavapor dan freeze-dried.
Rendemen ekstrak temulawak berkisar antara 9.092%-10.605% (Tabel 2). Uji statistik menunjukkan bahwa rendemen ekstrak pada rimpang dengan umur yang berbeda berpengaruh nyata dengan taraf 95% dan rendemen rimpang umur 8 bulan berbeda nyata dengan rendemen rimpang umur 7 dan 9 bulan. Besarnya rendemen menunjukkan banyaknya komponen yang terekstrak selama proses maserasi. Maka perbedaan rendemen dipengaruhi oleh banyaknya jumlah komponen senyawa aktif yang terdapat dalam rimpang temulawak. Hal ini menunjukkan bahwa rimpang temulawak umur 8 bulan mempunyai komponen senyawa metabolit terbanyak dibanding umur 7 dan 9 bulan. Namun, banyaknya rendemen tidak mampu mengkur kadar kurkuminoid maupun xanthorizol. Hal ini disebabkan tidak hanya metabolit sekunder saja yang teresktrak tetapi semua metabolit yang ikut tertarik sekama proses maserasi. Oleh karena itu jumlah rendemen berbeda untuk setiap umur rimpang.
Tabel 2 Kadar air dan rendemen rimpang temulawak
Umur Rimpang
Kadar air (%) Rendemen (%) Kering Basah
7 bulan 16.094 83.219 9.116 8 bulan 17.297 77.734 10.605 9 bulan 16.401 77.203 9.092
Kadar Kurkuminoid dan Xanthorizol Kadar kurkuminoid yang dianalisis di dalam penelitian adalah kurkumin dan desmetoksikurkumin yang dilakukan dengan cara menghitung kurva standar. Kadar kurkumin dihitung dengan membandingkan pada kurva standar. Hasil pengukuran kadar kurkuminoid dan xanthorizol naik seiring bertambahnya umur (Tabel 3). Kadar kurkumin tertinggi diperoleh rimpang umur 9 bulan. Sedangkan kadar desmetoksikurkumin tertinggi ditunjukkan oleh ekstrak umur 8 bulan. Namun, perbedaan ekstrak umur 9 bulan dan 8 bulan tidak terlalu signifikan.
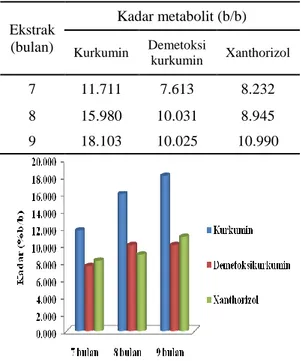
Gambar 7 memperlihatkan bahwa kadar kurkumin menunjukkan nilai yang sangat jauh berbeda dibanding kadar desmetoksikurkumin maupun xanthorizol. Hal ini dikarenakan rimpang temulawak mempunyai kadar kurkumin yang lebih tinggi yakni sekitar 58-71% sedangkan demetoksi-kurkumin berkisar antara 29-42% dalam kurkuminoid (Sidik et al. 1985). Perbedaan kadar kurkumin dan desmetoksikurkumin disebabkan oleh perbedaan waktu tanam rimpang yang akan mempengaruhi biosintesis kurkuminoid. Menurut Adzkiya (2006) masa tanam berpengaruh signifikan terhadap kandungan kurkuminoid temulawak dan umur panen yang baik adalah pada saat umur rimpang 9 bulan setelah masa tanam.
Banyaknya kandungan senyawa aktif yang diperoleh selama ekstraksi dipengaruhi oleh jenis pelarut yang digunakan. Kurkuminoid merupakan senyawa yang bersifat polar. Kepolarannya disebabkan oleh gugus –OH yang terdapat dalam struktur kimianya. Oleh karena itu, kurkuminoid larut dalam pelarut yang mempunyai kepolaran yang sama atau hampir mirip. Pelarut yang digunakan adalah etanol, sifatnya yang polar cocok digunakan untuk mengekstrak kurkuminoid. Sidik et al. (1985) mengatakan bahwa kadar kurkuminoid terbesar yang terekstrak pada pelarut aseton dan etanol.
Selama proses analisis contoh harus terlindung dari cahaya. Karena kurkuminoid
mudah terdegradasi oleh cahaya sehingga terjadi dekomposisi struktur berupa siklisasi kurkuminoid yang menghasilkan asam ferulat. Apabila hal ini terjadi, maka kadar kurkuminoid dalam contoh akan menurun. Perbedaan waktu tanam berpengaruh pada penerimaan unsur hara dan banyaknya air pada musim hujan yang nantinya digunakan untuk perkembangan vegetatif dan biosintesis kurkuminoid.
Penentuan komponen zat aktif dalam suatu tanaman diperlukan metode pemisahan zat aktif yang efektif. Metode yang digunakan dalam setiap penelitian akan berpengaruh terhadap kadar kurkuminoid itu sendiri. Selain menggunakan KCKT, penetapan kurkuminoid dapat dilakukan dengan menggunakan spektrofotometri dan tetrahidrofuran sebagai pelarutnya, seperti yang dilakukan oleh Fatmawati (2008) yakni menganalisis kandungan kurkuminoid dalam temulawak umur 7, 8, 9 dan 12 bulan, hasilnya diperoleh bahwa kadar kurkuminoid tertinggi terdapat pada rimpang umur 12 bulan. Hal ini menunjukkan bahwa kadar kurkuminoid berkorelasi positif terhadap pertumbuhan masa tanam. Semakin tinggi masa tanam maka semakin tinggi kadar kurkuminoidnya.
Tabel 3 Hasil pengukuran kadar kurkumin, desmetoksikurkumin, dan xanthorizol
Gambar 7 Perbandingan metabolit rimpang temulawak pada umur berbeda. Ekstrak (bulan) Kadar metabolit (b/b) Kurkumin Demetoksi kurkumin Xanthorizol 7 11.711 7.613 8.232 8 15.980 10.031 8.945 9 18.103 10.025 10.990
11
Temulawak merupakan salah satu tanaman yang mengandung minyak atsiri dalam kadar yang cukup besar yaitu berkisar antara 3-12%. Komponen khas minyak atsiri rimpang adalah xanthorizol yang mempunyai aktivitas antibakteri. Penentuan kadar xanthorizol dilakukan dengan metode KCKT dengan rincian metode untuk saat ini belum dapat diberikan. Analisis kuantitatif kadar xanthorizol rimpang temulawak dibuat kurva standar antara konsentrasi xanthorizol dengan luas area. Berdasarkan Tabel 3, kadar xanthorizol tertinggi diperoleh ekstrak rimpang umur 9 bulan. Perbedaan signifikan terlihat dari kadar 8 bulan dan 9 bulan. Hal ini karena kecepatan biosintesis xanthorizol setiap rimpang berbeda tergantung unsur hara yang diperoleh dan lamanya waktu tanam. Selain itu juga dipengaruhi oleh beberapa faktor diantaranya tempat tumbuh, ketinggian di atas permukaan laut dan cara budidaya. Perhitungan kadar xanthorizol terdapat di Lampiran 6.
Kandungan xantorizol pada setiap pengukuran akan berbeda apabila dilakukan dengan metode berbeda. Sirait (1985) dalam Sidik (1985) melakukan penelitian terhadap kadar xanthorizol dalam minyak atsiri rimpang temulawak yang berumur 8 sampai 15 bulan dengan metode spektrofotometri ultraviolet pada panjang gelombang 276 nm. Hasil penelitian menunjukkan bahwa kadar xanthorizol tertinggi diperoleh pada rimpang yang berumur 12 bulan.
Beberapa senyawa aktif temulawak, khususnya xanthorizol, berada di kulit atau diantara kulit dan daging rimpang. Nur (2006) dalam penelitiannya melakukan perbandingan sistem ekstraksi terhadap rimpang temulawak untuk menentukan kadar xanthorizol dengan kromatrografi cair kinerja tinggi (KCKT), diketahui bahwa kadar xanthorizol terbesar diperoleh dari rimpang temulawak yang tidak di kupas dengan metode maserasi. Metode ini digunakan untuk mencegah dekomposisi komponen yang tidak tahan panas, salah satunya xanthorizol yang merupakan komponen minyak atsiri pada rimpang. Selain menggunakan KCKT penentuan kadar xanthorizol dapat dilakukan dengan beberapa metode diantaranya spektroskopi ultraviolet pada panjang gelombang 276 nm, analisis infra merah pada KBr yang memberikan spektrum dengan puncak serapan 3000 cm-1, dan analisis spektroskopi massa.
Waktu tanam dan cara tanam berpengaruh terhdap kadar xanthorizol. Pemberian unsur hara yang berbeda akan berpengaruh
langsung terhadap biosintesis xanthorizol. Pupuk urea yang dipakai sebagai pupuk dasar digunakan temulawak terkait dengan biosintesis dari asam-asam amino yang nantinya digunakan untuk biosintesis xanthorizol. Hal ini didukung dengan penelitian Nurcholis (2006) yang menyatakan bahwa cara tanam dan umur panen berpengaruh sangat nyata terhadap kandungan xanthorizol. Selain waktu tanam, perbedaan dapat terjadi pada metode yang digunakan saat penelitian. Selain itu, perbedaan kadar kurkuminoid dan xanthorizol dipengaruhi oleh faktor genetik, iklim, ketinggian jenis tanah, tempat tumbuh (wilayah), dan perlakuan terhadap tanaman seperti pemberian pupuk dan penangan pasca panen. Pemberian pupuk berpengaruh terhadap biosintesis kurkuminoid dan xanthorizol.
Berdasarkan analisis regresi antara rendemen dengan kurkuminoid maupun xanthorizol menghasilkan koefisien determinasi yang sangat rendah yaitu antara 3.1%-24% (Lampiran 12) artinya keragaman dari rendemen belum mampu menjelaskan banyaknya kandungan kurkuminoid maupun xanthorizol dalam ekstrak oleh model regresi sederhana. Keragaman yang besar salah satunya disebabkan oleh adanya galat sistematik yang diperoleh dari galat acak dan galat personal. Rendemen ekstrak merupakan persentase dari semua komponen yang terekstrak selama proses maserasi. Namun, besarnya rendemen tidak dapat menduga hasil kadar kurkuminoid maupun xanthorizol. Hal ini dikarenakan tidak hanya kurkuminoid dan xanthorizol yang terdapat dalam rendemen tetapi juga biomolekul lain yang ikut terekstrak dalam etanol.
Analisis kadar kurkuminoid dan xanthorizol dilakukan dengan menggunakan Kromatrografi Cair Kinerja Tinggi (KCKT) dengan menggunakan fase terbalik artinya fase diam yang digunakan bersifat non polar sedangkan fase gerak bersifat polar. Kondisi KCKT yang digunakan untuk analisis kadar kurkuminoid dikembangkan oleh Jayaprakasha et al. (2002). Kolom yang digunakan adalah C18 yang bersifat nonpolar. Dengan kolom dan kondisi KCKT yang digunakan, senyawa yang memiliki sifat lebih polar akan terelusi lebih dahulu dan senyawa yang bersifat nonpolar akan lebih lama tertahan pada fase diam (Skoog et al. 1998). Kolom C18 lebih cocok untuk pemisahan dan analisis kuantitatif senyawa-senyawa yang bersifat sedikit polar dan nonpolar (Meyer 2004).
Perbandingan Aktivitas Antioksidan Hasil Tiga Metode Berbeda
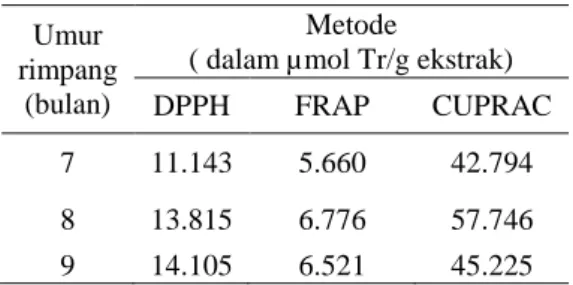
Banyaknya komponen matriks dalam ekstrak rimpang temulawak menyebabkan aktivitas antioksidan menjadi sangat penting diperiksa dengan lebih dari satu metode. Di dalam penelitian ini dilakukan tiga metode diantaranya metode DPPH, FRAP dan CUPRAC. Ketiga metode ini mempunyai karakteristik dengan kelebihan dan kekurangannya masing-masing. Mekanisme yang terjadi dalam ketiga metode tersebut adalah transfer elektron.
Penentuan kapasitas antioksidan ketiga metode dilakukan dengan menghitung kurva kalibrasi troloks (Lampiran 7, 8 dan 9). Dari Tabel 4 menunjukkan bahwa kapasitas antioksidan terus meningkat dengan bertambahnya umur pada metode DPPH. Perbedaan waktu tanam pada rimpang temulawak menghasilkan aktivitas antioksidan yang berbeda. Rimpang yang berumur 9 bulan mempunyai aktivitas yang paling besar dibanding umur 7 dan 8 bulan. Hasil tersebut seiring dengan banyaknya kandungan kurkuminoid dan xanthorizol dalam ekstrak. Semakin tinggi kadar kurkuminoid dan xanthorizol dalam ekstrak maka semakin tinggi pula kapasitas antioksidan tersebut.
Aktivitas antioksidan metode DPPH dipengaruhi oleh komponen aktif dalam ekstrak temulawak yaitu kurkuminoid dan xanthorizol. Senyawa ini bertindak sebagai oksidan dan radikal diubah menjadi bentuk yang stabil melalui mekanisme transfer elektron. Gugus reaktif pada DPPH (1,1-difenil-2-pikrilhidrazil) merupakan gugus nitrogen yang akan berpasangan dengan atom hidrogen pada antioksidan sehingga terbentuk radikal DPPH yang stabil (1,1-difenil-2-pikrilhidrazin).
Kemampuan antioksidan dalam ekstrak temulawak untuk menjerap radikal DPPH terlihat dari adanya perubahan warna. Penurunan intensitas warna terjadi melalui mekanisme transfer elaktron tunggal yang menyebabkan peluruhan warna DPPH dari ungu menjadi kuning. Semakin banyak elektron yang disumbangkan, maka warna ungu akan semakin memudar dan mendekati warna kuning-cokelat, yang menunjukkan tingginya konsentasi antioksidan ekstrak.
Aktivitas antioksidan metode DPPH didasarkan atas penjerapan radikal DPPH oleh senyawa antioksidan dalam ekstrak rimpang temulawak. DPPH merupakan
radikal bebas yang stabil dalam larutan berair atau larutan metanol dan mempunyai serapan yang kuat pada panjang gelombang 517 nm. Metode DPPH dipilih karena mudah, sederhana, cepat dan peka serta hanya diperlukan sedikit ekstrak pengujiannya. Metode ini bekerja secara fisiologis dengan cara menjerap radikal agar tidak terlalu reaktif terhadap subsrat.
Aktivitas antioksidan metode FRAP menunjukkan bahwa nilai kapasitas antioksidan tertinggi terdapat pada ekstrak rimpang umur 8 bulan. Hal ini menunjukkan bahwa besarnya kandungan kurkuminoid dan xanthorizol tidak mempengaruhi aktivitas antioksidan dengan metode FRAP. Dari Tabel 3 dapat diketahui bahwa kapasitas antioksidan metode FRAP mempunyai nilai yang paling kecil dibanding kedua metode yang lain. Hal ini karena reagen FRAP tidak cukup selektif terhadap senyawa antioksidan bersifat tiol (Apak et al. 2004). Metode FRAP hanya menunjukkan adanya antioksidan dalam komlpeks matriks, namun tidak mampu mengukur semua antioksidan dalam ekstrak. Nilai yang rendah pada metode FRAP mungkin disebabkan adanya inhibitor yang mengganggu kestabilan kompleks Fe2+-TPTZ. Kekuatan antioksidan diartikan sebagai daya reduksi senyawa antioksidan terhadap reagen FRAP. Kompleks besi(III)-tripiridiltriazin (Fe3+-TPTZ) akan direduksi menjadi bentuk Fe2+-TPTZ yang berwarna biru. Intensitas warna yang terbentuk diukur pada serapan maksimum 593 nm. Perubahan absorbansi pada contoh linear dengan konsentrasi antioksidan ekstrak dalam larutan dengan terbentuknya kompleks Fe2+-TPTZ. Daya reduksi antioksidan akan berbanding lurus dengan terbentuknya Fe2+, sehingga semakin banyak jumlah Fe2+ maka warna Fe2+-TPTZ akan semakin pekat dan antioksidannya tinggi. Kompleks ini stabil pada pH asam, maka digunakan pH 3.6 dalam penelitian ini. Penggunaan pH rendah dimaksudkan untuk memudahkan proses reduksi Fe3+.
Tabel 4 Perbandingan kapasitas antioksidan ketiga metode berbeda
Umur rimpang
(bulan)
Metode
( dalam µmol Tr/g ekstrak)
DPPH FRAP CUPRAC
7 11.143 5.660 42.794 8 13.815 6.776 57.746 9 14.105 6.521 45.225
13
Metode FRAP memberikan hasil yang cepat, mudah, reaksinya reprodusibel terhadap satu atau campuran antioksidan dan linear terhadap adanya antioksidan dalam contoh (Benzie & Strain 1996). Metode ini baik digunakan untuk menunjukkan kekuatan suatu antioksidan dalam contoh dan dapat menunjukkan jumlah total antioksidan dalam contoh. Namun, metode ini tidak dapat mengukur semua antioksidan dalam kompleks matriks dan antioksidan akan bereaksi lambat dengan reagen sehingga tidak terlalu dianjurkan dalam analisis metode oksidasi (Apak 2004).
Penentuan aktivitas antioksidan metode CUPRAC memberikan hasil yang sangat jauh berbeda dibanding kedua metode yang lain. Peningkatan aktivitas antioksidan terjadi cukup signifikan pada ekstrak umur 7 bulan dan 8 bulan. Namun, terjadi penurunan kembali saat rimpang berumur 9 bulan. Sedangkan aktivitas antioksidan tertinggi ditunjukkan oleh ekstrak rimpang umur 8 bulan (Tabel 3). Hal ini disebabkan oleh banyaknya komponen yang terekstrak dalam contoh. Jadi tidak hanya kurkuminoid dan xanthorizol saja, tetapi juga ada komponen lain yang bersifat antioksidan yang turut terukur oleh metode ini. Hal ini menyebabkan kapasitas aktivitas antioksidan jauh lebih besar dibanding kedua metode lain
Kapasitas antioksidan metode CUPRAC sebanding dengan jumlah total tembaga yang direduksi oleh antioksidan melalui tranfer elektron. Antioksidan akan mengalami oksidasi sedangkan tembaga akan direduksi. Aktivitas antioksidan metode CUPRAC dilihat dari kemampuannya dalam mereduksi kelat Cu2+-Nc (biru) menjadi Cu+-Nc yang berwarna kuning yaitu dengan cara menyumbangkan elektron yang dimiliki oleh antioksidan. Warna yang terbentuk diukur pada panjang gelombang 450 nm. Kelat Cu+ -Nc relatif stabil karena tidak sensitif terhadap perubahan lingkungan seperti kelembapan, pH dan cahaya (Apak et al. 2004).
Penentuan kapasitas antioksidan dengan metode FRAP dan CUPRAC digunakan untuk melihat kemampuan reduksi antioksidan dalam menahan stress oksidatif melalui mekanisme transfer elektron tunggal. Mekanisme ini, lebih memperjelas daya reduksi antioksidan sebagai inhibitor (penghambat) oksidasi. Perbedaan kapasitas antioksidan disebabkan oleh banyaknya matriks dalam ekstrak rimpang temulawak. Selain itu juga dikarenakan oleh penggunaan pH. Metode CUPRAC menggunakan pH
fisiologis yang cocok untuk kondisi tubuh. Sedangkan metode FRAP menggunakkan pH asam.
Kecepatan reaksi redoks untuk kedua metode tersebut disebabkan oleh potensial redoks dan waktu inkubasi. Potensial redoks diartikan sebagai energi yang diperlukan oleh suatu logam untuk melakukan reaksi redoks. Semakin kecil potensial redoks logam, maka reaksi redoks semakin cepat terjadi. Potensial Cu2+ sebesar 0.337 V, lebih kecil dari Fe3+ yang mempunyai potensial redoks sebesar 0.777 V. Potensial redoks yang rendah menjadikan Cu2+ lebih selektif terhadap gula sederhana yang tidak teroksidasi pada FRAP. Oleh karena itu, reaksi redoks Cu2+ terjadi lebih cepat dibanding Fe3+, sehinggga metode CUPRAC menunjukkan sensitivitas yang lebih besar dibandingkan metode FRAP. (Harjadi 1986; Apak et al. 2004).
Waktu inkubasi diperlukan oleh logam tembaga dan besi untuk melakukan reaksi redoks. Di dalam penelitian pengukuran absorbansi dilakukan 30 menit setelah proses inkubasi pada suhu 37oC untuk metode FRAP sedangkan metode CUPRAC membutuhkan waktu 60 menit inkubasi untuk memperoleh kesetimbangan. Diasumsikan reaksi reduksi-oksidasi (redoks) telah selesai dalam waktu 30 menit. Hal inilah yang menyebabkan nilai kapasitas antioksidan metode CUPRAC jauh lebih besar dibanding FRAP.
Metode CUPRAC mempunyai pereaksi yang cukup selektif, stabil, mudah diperoleh, dan sensitif terhadap jenis oksidan tiol. Pereaksi CUPRAC yang selektif mampu bekerja pada pH fisiologis yaitu pH 7.0, tidak seperti pada FRAP yang bekerja pada pH asam. Selain itu, metode CUPRAC mampu mengukur kemampuan senyawa fenol sebagai antioksidan.
Korelasi Antara Metabolit Terhadap Aktivitas Antioksidan
Kemampuan suatu antioksidan ekstrak rimpang temulawak ditentukan oleh banyaknya senyawa oksidan yang akan meredam radikal DPPH atau melakukan reduksi terhadap logam radikal. Oleh karena itu diperlukan analisis korelasi untuk melihat hubungan keeratan antara kadar kurkuminoid dan xanthorizol serta jumlah rendemen dengan aktivitas antioksidan pada ketiga metode. Analisis korelasi dilakuakn terhadap kadar metabolit dan rendemen dengan aktivitas antioksidan ketiga metode (tabel 5). Berdasarkan analisis korelasi antara kadar
![Tabel Hasil pengukuran kadar kurkumin rimpang temulawak waktu tanam berbeda Ekstrak Ulangan pengukuran Luas area [Kurkumin] (mg/L) Bobot ekstrak (mg) fp Kadar kurkumin (%b/b) Rerata 7A 1 426223 0.5389 31.8 333 6.725 11.711 2 426760 0.53](https://thumb-ap.123doks.com/thumbv2/123dok/4260055.2882666/33.892.155.747.236.1158/pengukuran-kurkumin-temulawak-ekstrak-ulangan-pengukuran-kurkumin-kurkumin.webp)
![Tabel Hasil pengukuran kadar demetoksikurkumin rimpang temulawak waktu tanam berbeda Ekstrak Ulangan pengukuran Luas area [demetoksi kurkumin] (mg/L) Bobot ekstrak (mg) fp Kadar demetoksi kurkumin (%b/b) Rerata 7A 1 251564 0.3649 31.8](https://thumb-ap.123doks.com/thumbv2/123dok/4260055.2882666/35.892.155.790.246.1117/pengukuran-demetoksikurkumin-temulawak-ekstrak-ulangan-pengukuran-demetoksi-demetoksi.webp)