of genitalia in two Spodoptera species and their hybrids (Lepidoptera: Noctuidae). Biol J Linn Soc 72: 391–400 Pough, F.H., R.M. Andrews, J.E. Cadle, M.L.
Crump, A.H. Savitzky and K.D. Wells. 1998. Herpetology. New Jersey: Prentice-Hall, Inc.
Rohlf, F.J. and J.W. Archie. 1984. A comparison of Fourier methods for the description of wing shape in mosquitoes (Dipter culicidae). Syst. Zool. 33: 302-317.
Rohlf, F.J. and L.F. Marcus. 1993. A revolution in morphometrics. Tree 8(4): 129–132.
Truong, T.N., J.G. Gwang, Y.J. Park and S.H. Lee. 2005. Genetic Diversity of Soybean Pod Shape Based on Elliptic Fourier Descriptors. Korean J. Crop Sci 50 (1)
Yoshioka, Y., H. Iwata, R. Oshawa and S. Ninomiya. 2004. Analysis of Petal Shape Variation of Primula sieboldii by Elliptic Forurier Descriptors and Principal Component Analysis. Annals of Botany 94: 657-664
Juliandi, B. dan F. Ahmad. 2007. Analisis Va r i a s i B e n t u k K a r a p a s C u o r a amboinensis (Daudin, 1802) dan Cyclemys dentata (Gray, 1831) ( B a t a g u r i d a e ; T e s t u d i n a t a ) Menggunakan Deskriptor Fourier Eliptikal. Seminar Nasional Herpetologi Institut Pertanian Bogor.
Tracey, S.R., M.L. Jeremy and D. Guy. 2006. Application of Elliptical Fourier Analysis of Otolith Form as a Tool for Stock Identification. Fisheries Research 77: 138-147
Pendahuluan
Serangan Organisme Penganggu Tanaman (OPT) sampai saat ini tetap menjadi masalah yang cukup penting dalam bidang usaha pertanian. Salah satu organisme yang banyak meng-ganggu t a n a m a n d a n p e r l u d i p e r h a t i k a n keberadaannya adalah serangga hama Spodoptera litura.
Spodoptera litura (Lepidoptera, Noctuidae) atau lebih dikenal dengan nama ulat grayak merupakan serangga yang banyak ditemukan dan menjadi hama penting di daerah tropis. Biasanya serangga ini terdapat pada tanaman pertanian seperti jagung, sorgum, tomat, cabai, kapas, kubis, kedelai, kacang tanah, ubi jalar dan lain-lain (Kalshoven 1981). Bagian tumbuhan yang diserang adalah daun, batang bahkan buahnya. Kehadiran ulat tersebut pada
tanaman kedelai telah mengakibatkan kehilangan hasil panen sekitar 85% bahkan dapat menyebabkan kegagalan panen (puso) (Arifin 1993).
Pengendalian terhadap ulat grayak pada tingkat petani pada umumnya masih menggunakan insektisida yang berasal dari senyawa kimia dengan menghabiskan dana yang cukup besar. Permasalahan tersebut rupanya semakin banyak menimbulkan persoalan karena penggunaan insek-tisida kimia yang menjadi andalan dalam p e m b e r a n t a s a n h a m a s e m a k i n menunjukkan penurunan efektivitas (Novizan 2004).
Timbulnya gagasan untuk mene-rapkan Pengendalian Hama Terpadu (PHT) d i d o r o n g o l e h p e n g a - l a m a n y a n g menunjukkan bahwa cara pengendalian hama yang terlalu menitikberatkan pada penggunaan pestisida dapat menimbul-kan
Kajian Histologis Infeksi LD50 SLNPV terhadap Kerusakan Membran
Peritrofik Larva
Spodoptera litura
Fabricius
1) 2)
Yayan Sanjaya, Nanin Diah dan Wardono Niloperbowo
1)
Progam Studi Biologi-Universitas Pendidikan Indonesia,
2)
KPP Ilmu Hayati-Institut Teknologi Bandung
Diterima September 2010 disetujui untuk diterbitkan September 2011
Abstrack
The effect of SlNPV infection on peritrophic membrane of Spodoptera litura has been carried out. The damage of histological structure caused by SlNPV (0, 315, 390, 465, 540 and 615 PIB/ml) was investigated after 0, 12, 24 ,72 and 96 hours post infection. The histological material was prepared by using parafin method after fixation with Bouin Solution, then sliced into 7 mm and stained with Hematoxilin-Eosin. The descriptive obsevation on structural intact of peritrophic membrane histology caused by SlNPV infection shows a tendency to decrease, while in control, there was no damage at all. The longer the exposition of virion in the midgut lumen the more damage on peritrophic membrane occurred. The severest damage occurred 96 hour after infection. The result prove that haNPV virion can destroy histological structure of midgut.
Key words: SlNPV, Spirulina litura, peritrophic membrane
Abstrak
Pengaruh infeksi SlNPV pada membran peritrophic Spodoptera litura telah dilakukan. Kerusakan struktur histologis disebabkan oleh SlNPV (0, 315, 390, 465, 540 dan 615 PIB/ml) telah diamati setelah 0,12 24,72 dan 96 jam pasca infeksi. Materi histologis dibuat dengan metode parafin setelah fiksasi dengan Solusi Bouin, kemudian diiris menjadi 7 mm dan diwarnai dengan Hematoxilin-Eosin. Hasil pengamatan deskriptif struktur histologi utuh pada membran peritrofik disebabkan oleh infeksi SlNPV menunjukkan kecenderungan menurun, sedangkan pada kontrol, tidak ada kerusakan sama sekali. Semakin lama pemaparan virion di dalam lumen usus, kerusakan lebih banyak terjadi pada membran peritrofik. Kerusakan terparah terjadi pada 96 jam setelah infeksi. Hasil penelitian membuktikan bahwa virion HaNPV dapat menghancurkan struktur histologis dari usus tengah.
berbagai macam persoalan (Cristian 1994). Salah satu metode alternatif yang kini telah banyak dikembangkan adalah pengendalian hayati dengan menggu-nakan organisme hidup yang meru-pakan musuh alami dari serangga dan bisa dimanfaatkan untuk membantu mengendalikan hama dan penyakit tanaman. Musuh alami tersebut dapat berupa patogen, parasit, predator ataupun jasad renik sebagai musuh-musuh hama (Novizan 2004). Beberapa patogen spesifik serangga telah banyak digunakan secara komersial sebagai bioinsektisida. Salah satunya adalah pemanfaatan mikroorganisme seperti virus.
Beberapa penelitian menunjukkan bahwa beberapa tanaman penting ternyata terserang oleh virus yang dapat mematikan serangga. Diantara virus yang menyerang serangga adalah dari genus Baculovirus yang sering disebut dengan Nuclear Polyhedrosis Virus (NPV) (Cummins 2005). Moscardi (1994) menyatakan bahwa aplikasi dari baculovirus cukup berpotensi dan efektif untuk digunakan sebagai agen kontrol serangga untuk hama Lepidoptera. Dalam penelitian kali ini digunakan SlNPV yang merupakan virus patogen NPV yang dapat menyerang serangga dalam hal ini adalah Spodoptera litura.
NPV diketahui mampu menyerang beberapa larva Lepidoptera pemakan daun yang dapat merusak berbagai jenis tanaman. Sampai saat ini sekitar 700 virus telah berhasil diisolasi dan diidentifikasi dari serangga dan binatang arthropoda lainnya. Virus-virus arthropoda sebagian besar masuk dalam 6 genera virus yaitu B a c u l o v i r u s , P o x i v i r u s , I r i d i v i r u s , Enterovirus dan Rhabdovirus (Cristian, 1994). Menurut Barbehenn dan Marin (1994), baculovirus bekerja spesifik dalam menginfeksi beberapa species serangga, biasanya pada famili yang sama.
Menurut Sutarya (1996) Pemanfaatan NPV untuk mengen-dalikan hama perusak daun Spodoptera exigua (SeNPV) yang menyerang ba-wang merah ternyata mampu menekan serangan ulat daun hingga 84%. Di samping itu, pemakaian NPV untuk tanaman tomat mampu menekan serangan ulat Heliothis sp hingga 65% dan menyelamatkan hasil yang hilang hingga 83% (Novizan, 2004).
Hal ini sangat sesuai untuk digunakan dalam program PHT. Salah satu konsep
utama dari PHT adalah menjaga populasi species serangga hama agar tidak melebihi nilai ambang ekonomi dan menjaga fauna lainnya agar tidak terganggu sehingga keseimbangan ekosistem tetap terpe-lihara (Bonning & Bruce 1996). Organisme ini secara alami bersifat patogen terhadap larva serangga dengan target yang spesifik sehingga tidak mengganggu spesies serangga dan non serangga yang bukan target. Selain itu, agensia ini sangat virulen, mudah menyebar di dalam populasi dan dapat persisten dalam jangka waktu yang l a m a a p a b i l a k o n d i s i l i n g k u n g a n memungkinkan (Teakle et al., 1994).
Diketahui bahwa virus ini meru-pakan patogen yang mematikan karena dapat merusak membran peritrofik pada daerah usus tengah serangga jenis Lepidoptera. G r a n a d o s d a n C o r s a r o ( 1 9 9 0 ) mengemukakan bahwa ketika virus menginfeksi usus tengah serangga, struktur histologis membran peritrofik yang sangat vital dalam proses pencernaan diperkirakan mengalami kerusakan sehingga proses pencernaan menjadi terganggu dan pada akhirnya akan menurunkan berat larva.
Penelitian mengenai keberadaan membran peritrofik dalam melawan serangan patogen pada beberapa larva Lepidoptera telah dilaporkan. Dianta-ranya adalah mekanisme pertahanan larva Trichoplusia ni dengan kebe-radaan membran peritrofik terhadap infeksi virus (Wang & Granados 1998). Begitu pula pada larva Glossina morsitans-morsitans dilaporkan adanya membran peritrofik ternyata cukup berperan dalam perlawanan infeksi yang disebabkan oleh Trypanosoma (Lehane & Msangi 1991). Hasil pengamatan secara deskriptif yang dilakukan oleh Utari (2000) terhadap keutuhan struktur histologi membran peritrofik pada larva Helicoverpa armigera akibat infeksi HaNPV tampak menurun sejalan dengan meningkatnya dosis infeksi.
Meskipun penelitian mengenai infeksi NPV terhadap beberapa larva serangga Lepidoptera telah dilaporkan namun hasil penelitian mengenai pengaruh NPV terhadap daerah membran peritrofik pada usus tengah larva Spodoptera litura masih kurang. Berdasarkan permasalahan tersebut, penelitian tentang pengaruh infeksi SlNPV terhadap kerusakan membran peritrofik yang dilakukan pada larva instar 5
Spodoptera litura sangat diperlukan. Materi dan Metode
Pemurnian Virus
Dua puluh larva yang telah terinfeksi SlNPV dilumatkan dengan 10 ml SDS 0,1 % dan 10 ml Triss Buffer 1 mM pH 7,6 . Larutan larva tersebut disaring menggunakan kain
o
tipis lalu disimpan dalam temperatur 4 C selama 24 jam. Setelah itu, larutan disentrifuge pada kecepatan 5000 rpm pada
o
temperatur 4 C selama 30 menit.
Supernatan hasil sentrifuge dibuang dan pelet dire-suspensi dengan triss buffer 1 mM sebanyak 10 kali volume pelet.
Sesudah tahap ini, dibuat gradien sukrosa 60% dan 50% (W:V). Pelet yang sudah diresuspensi disentrifuge pada gradien sukrosa tersebut dengan kecepatan
o
28.000 rpm, 4 C, 1 jam (rotor Beckman SW 28). Selanjutnya diisolasi band PIB dan diresuspensi dengan NaCl fisiologi, lalu
o
disentrifuge kembali pada 28.000 rpm, 4 C, 1 jam. Hasil dari tahap ini lalu diisolasi setiap lapisan dan dipisahkan dari endapan. Semua hasil diamati dibawah mikroskop. Ternyata pada endapan terlihat PIB yang sangat konsentrat. Selanjutnya sediaan PIB ini ditambah 2-5 ml NaN2 (0,05% Na-azidat) dalam NaCl fisiologis, disimpan pada
o
temperatur 4 C sebagai stok. Persiapan Suspensi
Persiapan suspensi sendiri diawali dengan mengambil 1 ml larutan SlNPV stok kemudian ditambah dengan 9 ml air suling dan diaduk hingga homogen (dengan tujuan agar memudahkan pada saat perhitungan). Pengenceran selan-jutnya dilakukan secara seri dengan mengambil 1 ml suspensi dari tabung yang pertama lalu dimasukkan ke dalam tabung yang kedua yang telah berisi 9 ml air suling. Kocok hingga homogen. Lakukan hal yang sama hingga diperkirakan jumlah polihedra mulai bisa terhitung (tampak dari berkurangnya tingkat k e r a p a t a n p o l i h e d r a p a d a k o l o m haemositometer). Dari pengenceran tersebut, dihitung konsentrasi polihedra dengan bantuan Haemositometer Neubaur. Setiap menghitung jumlah polihedra dilakukan replikasi sebanyak 3 kali perhitungan, sehingga jumlah polihedra yang terhitung sudah cukup untuk mewakili. Seluruh pekerjaan di atas dilakukan dalam
kondisi aseptik (setiap kali akan menghitung p o l i h e d r a m a k a h a e m o s i t o m e t e r dibersihkan menggunakan tissue yang mengandung akohol).
Jumlah PIB dalam larutan ditentukan dengan cara menghitung di bawah m i k r o s k o p c a h a y a m e n g g u n a k a n haemositometer dan kon-sentrasi PIB ditentukan dengan menggunakan rumus sebagai berikut:
keterangan :
N = jumlah PIB yang terhitung pada 5 kotak besar (80 kotak kecil).
0,02 = volume (ml) dari 5 kotak besar (80 kotak kecil).
P = pengenceran
3
10 = angka konversi dari l ke ml
Dari perhitungan terhadap dosis PIB tersebut, maka diperoleh dosis stok SlNPV adalah 32000 PIB/ml. Selan-jutnya dosis yang akan digunakan di dalam penelitian diencerkan sesuai dengan dosis yang diinginkan.
Persiapan
Metode pemberian NPV terhadap larva uji dilakukan dengan metode pakan (Feeding Methode). Pada awal pengujian, terlebih dahulu disiapkan pakan yang akan diberikan berupa daun sawi hijau segar. Dosis yang digunakan dalam penelitian ini diperoleh dari hasil pengenceran stok SlNPV, sehingga diperoleh 5 taraf dosis dengan 1 kontrol. Dosis yang digunakan adalah 0; 3,2; 32; 320; 3200 dan 32000 PIB/ml.
Pada pra penelitian ini, masing-masing perlakuan menggunakan 6 larva uji instar lima dengan 3 kali pengulangan. Pemberian insektisida SlNPV kepada larva uji dilakukan melalui infeksi per oral dengan cara melaparkan larva instar 5 Spodoptera litura selama 24 jam untuk selanjutnya digunakan dalam penelitian. Hal tersebut dilakukan agar pakan yang telah diberi suspensi SlNPV dapat langsung dimakan oleh larva pada saat perlakuan. Keesokan harinya dengan menggunakan mikropipet, larva-larva tersebut diberi pakan yang telah ditetesi suspensi virus sebanyak 10 l sesuai dengan dosis tertentu. Pengamatan dilakukan setiap 24 jam sekali selama 8 hari
m 3 10 02 , 0 ´p´ N
berbagai macam persoalan (Cristian 1994). Salah satu metode alternatif yang kini telah banyak dikembangkan adalah pengendalian hayati dengan menggu-nakan organisme hidup yang meru-pakan musuh alami dari serangga dan bisa dimanfaatkan untuk membantu mengendalikan hama dan penyakit tanaman. Musuh alami tersebut dapat berupa patogen, parasit, predator ataupun jasad renik sebagai musuh-musuh hama (Novizan 2004). Beberapa patogen spesifik serangga telah banyak digunakan secara komersial sebagai bioinsektisida. Salah satunya adalah pemanfaatan mikroorganisme seperti virus.
Beberapa penelitian menunjukkan bahwa beberapa tanaman penting ternyata terserang oleh virus yang dapat mematikan serangga. Diantara virus yang menyerang serangga adalah dari genus Baculovirus yang sering disebut dengan Nuclear Polyhedrosis Virus (NPV) (Cummins 2005). Moscardi (1994) menyatakan bahwa aplikasi dari baculovirus cukup berpotensi dan efektif untuk digunakan sebagai agen kontrol serangga untuk hama Lepidoptera. Dalam penelitian kali ini digunakan SlNPV yang merupakan virus patogen NPV yang dapat menyerang serangga dalam hal ini adalah Spodoptera litura.
NPV diketahui mampu menyerang beberapa larva Lepidoptera pemakan daun yang dapat merusak berbagai jenis tanaman. Sampai saat ini sekitar 700 virus telah berhasil diisolasi dan diidentifikasi dari serangga dan binatang arthropoda lainnya. Virus-virus arthropoda sebagian besar masuk dalam 6 genera virus yaitu B a c u l o v i r u s , P o x i v i r u s , I r i d i v i r u s , Enterovirus dan Rhabdovirus (Cristian, 1994). Menurut Barbehenn dan Marin (1994), baculovirus bekerja spesifik dalam menginfeksi beberapa species serangga, biasanya pada famili yang sama.
Menurut Sutarya (1996) Pemanfaatan NPV untuk mengen-dalikan hama perusak daun Spodoptera exigua (SeNPV) yang menyerang ba-wang merah ternyata mampu menekan serangan ulat daun hingga 84%. Di samping itu, pemakaian NPV untuk tanaman tomat mampu menekan serangan ulat Heliothis sp hingga 65% dan menyelamatkan hasil yang hilang hingga 83% (Novizan, 2004).
Hal ini sangat sesuai untuk digunakan dalam program PHT. Salah satu konsep
utama dari PHT adalah menjaga populasi species serangga hama agar tidak melebihi nilai ambang ekonomi dan menjaga fauna lainnya agar tidak terganggu sehingga keseimbangan ekosistem tetap terpe-lihara (Bonning & Bruce 1996). Organisme ini secara alami bersifat patogen terhadap larva serangga dengan target yang spesifik sehingga tidak mengganggu spesies serangga dan non serangga yang bukan target. Selain itu, agensia ini sangat virulen, mudah menyebar di dalam populasi dan dapat persisten dalam jangka waktu yang l a m a a p a b i l a k o n d i s i l i n g k u n g a n memungkinkan (Teakle et al., 1994).
Diketahui bahwa virus ini meru-pakan patogen yang mematikan karena dapat merusak membran peritrofik pada daerah usus tengah serangga jenis Lepidoptera. G r a n a d o s d a n C o r s a r o ( 1 9 9 0 ) mengemukakan bahwa ketika virus menginfeksi usus tengah serangga, struktur histologis membran peritrofik yang sangat vital dalam proses pencernaan diperkirakan mengalami kerusakan sehingga proses pencernaan menjadi terganggu dan pada akhirnya akan menurunkan berat larva.
Penelitian mengenai keberadaan membran peritrofik dalam melawan serangan patogen pada beberapa larva Lepidoptera telah dilaporkan. Dianta-ranya adalah mekanisme pertahanan larva Trichoplusia ni dengan kebe-radaan membran peritrofik terhadap infeksi virus (Wang & Granados 1998). Begitu pula pada larva Glossina morsitans-morsitans dilaporkan adanya membran peritrofik ternyata cukup berperan dalam perlawanan infeksi yang disebabkan oleh Trypanosoma (Lehane & Msangi 1991). Hasil pengamatan secara deskriptif yang dilakukan oleh Utari (2000) terhadap keutuhan struktur histologi membran peritrofik pada larva Helicoverpa armigera akibat infeksi HaNPV tampak menurun sejalan dengan meningkatnya dosis infeksi.
Meskipun penelitian mengenai infeksi NPV terhadap beberapa larva serangga Lepidoptera telah dilaporkan namun hasil penelitian mengenai pengaruh NPV terhadap daerah membran peritrofik pada usus tengah larva Spodoptera litura masih kurang. Berdasarkan permasalahan tersebut, penelitian tentang pengaruh infeksi SlNPV terhadap kerusakan membran peritrofik yang dilakukan pada larva instar 5
Spodoptera litura sangat diperlukan. Materi dan Metode
Pemurnian Virus
Dua puluh larva yang telah terinfeksi SlNPV dilumatkan dengan 10 ml SDS 0,1 % dan 10 ml Triss Buffer 1 mM pH 7,6 . Larutan larva tersebut disaring menggunakan kain
o
tipis lalu disimpan dalam temperatur 4 C selama 24 jam. Setelah itu, larutan disentrifuge pada kecepatan 5000 rpm pada
o
temperatur 4 C selama 30 menit.
Supernatan hasil sentrifuge dibuang dan pelet dire-suspensi dengan triss buffer 1 mM sebanyak 10 kali volume pelet.
Sesudah tahap ini, dibuat gradien sukrosa 60% dan 50% (W:V). Pelet yang sudah diresuspensi disentrifuge pada gradien sukrosa tersebut dengan kecepatan
o
28.000 rpm, 4 C, 1 jam (rotor Beckman SW 28). Selanjutnya diisolasi band PIB dan diresuspensi dengan NaCl fisiologi, lalu
o
disentrifuge kembali pada 28.000 rpm, 4 C, 1 jam. Hasil dari tahap ini lalu diisolasi setiap lapisan dan dipisahkan dari endapan. Semua hasil diamati dibawah mikroskop. Ternyata pada endapan terlihat PIB yang sangat konsentrat. Selanjutnya sediaan PIB ini ditambah 2-5 ml NaN2 (0,05% Na-azidat) dalam NaCl fisiologis, disimpan pada
o
temperatur 4 C sebagai stok. Persiapan Suspensi
Persiapan suspensi sendiri diawali dengan mengambil 1 ml larutan SlNPV stok kemudian ditambah dengan 9 ml air suling dan diaduk hingga homogen (dengan tujuan agar memudahkan pada saat perhitungan). Pengenceran selan-jutnya dilakukan secara seri dengan mengambil 1 ml suspensi dari tabung yang pertama lalu dimasukkan ke dalam tabung yang kedua yang telah berisi 9 ml air suling. Kocok hingga homogen. Lakukan hal yang sama hingga diperkirakan jumlah polihedra mulai bisa terhitung (tampak dari berkurangnya tingkat k e r a p a t a n p o l i h e d r a p a d a k o l o m haemositometer). Dari pengenceran tersebut, dihitung konsentrasi polihedra dengan bantuan Haemositometer Neubaur. Setiap menghitung jumlah polihedra dilakukan replikasi sebanyak 3 kali perhitungan, sehingga jumlah polihedra yang terhitung sudah cukup untuk mewakili. Seluruh pekerjaan di atas dilakukan dalam
kondisi aseptik (setiap kali akan menghitung p o l i h e d r a m a k a h a e m o s i t o m e t e r dibersihkan menggunakan tissue yang mengandung akohol).
Jumlah PIB dalam larutan ditentukan dengan cara menghitung di bawah m i k r o s k o p c a h a y a m e n g g u n a k a n haemositometer dan kon-sentrasi PIB ditentukan dengan menggunakan rumus sebagai berikut:
keterangan :
N = jumlah PIB yang terhitung pada 5 kotak besar (80 kotak kecil).
0,02 = volume (ml) dari 5 kotak besar (80 kotak kecil).
P = pengenceran
3
10 = angka konversi dari l ke ml
Dari perhitungan terhadap dosis PIB tersebut, maka diperoleh dosis stok SlNPV adalah 32000 PIB/ml. Selan-jutnya dosis yang akan digunakan di dalam penelitian diencerkan sesuai dengan dosis yang diinginkan.
Persiapan
Metode pemberian NPV terhadap larva uji dilakukan dengan metode pakan (Feeding Methode). Pada awal pengujian, terlebih dahulu disiapkan pakan yang akan diberikan berupa daun sawi hijau segar. Dosis yang digunakan dalam penelitian ini diperoleh dari hasil pengenceran stok SlNPV, sehingga diperoleh 5 taraf dosis dengan 1 kontrol. Dosis yang digunakan adalah 0; 3,2; 32; 320; 3200 dan 32000 PIB/ml.
Pada pra penelitian ini, masing-masing perlakuan menggunakan 6 larva uji instar lima dengan 3 kali pengulangan. Pemberian insektisida SlNPV kepada larva uji dilakukan melalui infeksi per oral dengan cara melaparkan larva instar 5 Spodoptera litura selama 24 jam untuk selanjutnya digunakan dalam penelitian. Hal tersebut dilakukan agar pakan yang telah diberi suspensi SlNPV dapat langsung dimakan oleh larva pada saat perlakuan. Keesokan harinya dengan menggunakan mikropipet, larva-larva tersebut diberi pakan yang telah ditetesi suspensi virus sebanyak 10 l sesuai dengan dosis tertentu. Pengamatan dilakukan setiap 24 jam sekali selama 8 hari
m 3 10 02 , 0 ´p´ N
hingga larva menjadi pre pupa. Penggantian pakan dilakukan setiap hari tanpa dikontaminasi oleh susupensi virus.
Penelitian
Dalam penelitian ini digunakan 5 dosis perlakuan dengan 1 macam dosis kontrol. Dosis ini ditentukan berda-sarkan kisaran LD dengan tingkat kepercayaan 95%. Pada 50
percobaan ini digunakan 6 larva uji untuk masing-masing perlakuan dengan 4 kali pengulangan dan pengamatan dila-kukan sampai stadia pre pupa. Tahapan pemberian insektisida virus tidak berbeda dengan metode yang dilakukan pada pra penelitian. SlNPV diberikan ke larva uji melalui metode pakan yang telah ditetesi suspensi virus sebanyak 10 l dengan dosis yang telah ditentukan. Sebelumnya larva dila-parkan terlebih dahulu selama 24 jam. Keesokan harinya seluruh larva diberi pakan segar tanpa pemberian suspensi SlNPV. Untuk k o n t r o l , l a r v a d i b e r i p a k a n t a n p a ditambahkan suspensi virus namun ditetesi dengan akuades.
Setiap harinya dicatat kematian larva yang teramati dari setiap perlakuan selama 8 hari. Hal ini disebabkan karena waktu yang dibu-tuhkan virus dalam berinteraksi dengan inangnya membutuhkan waktu bebe-rapa hari sejak terjadinya infeksi hingga larva mati. Pengukuran terhadap temperatur dan kelembaban dilakukan setiap hari selama waktu pengamatan.
Pengamatan membran peritrofik
Pembuatan sayatan melintang membran peritrofik dilakukan berda-sarkan Utari (2000) yang telah dimodifikasi. Larva instar 5 Spodoptera
litura diambil usus tengahnya pada 0, 24, 48, 72, 96 jam setelah diinfeksi dengan menggunakan dosis infeksi berdasarkan nilai LD 50 SlNPV dari hasil penelitian menggunakan silet yang tajam. Agar memperoleh potongan yang baik, larva dijerat dalam larutan Bouin's di atas bantalan lilin. Bagian usus depan dan usus belakang tusuk dengan jarum. Kira-kira 5 menit setelah perendaman, larva yang telah mati diangkat dari bantalan lilin lalu usus tengahnya diambil.
Tahap selanjutnya adalah usus tengah difiksasi di dalam larutan Bouin's selama 24 jam. Keesokan harinya, dilakukan proses
dehidrasi dengan tahapan sebagai berikut: Alkohol 70 % 3 jam
Alkohol 80% 3jam Alkohol 90% 3 jam Alkohol 96% 3 jam Alkohol 100% 3 jam
Penjernihan organ dilakukan dengan merendam objek di dalam alkohol 100% : xilol. Organ yang telah jernih, kemudian diinfiltrasi dalam parafin pada temperatur tertentu, sebagai berikut:
0
Parafin I (48 C) 30 menit
0
Parafin II (52 C) 60 menit
0
Parafin III (56 C) 90 menit
Selesai tahap infiltrasi selesai selanjutnya organ ditanam dalam parafin sampai beku. Organ disayat melintang setebal 8 mm. Pita sayatan ditempel pada objek glass yang telah diberi perekat albumin Mayer's. Kemudian dilakukan pewarnaan dengan HE. Adapun tata cara pewarnaan dengan menggunakan HE adalah sebagai berikut:
Xilol murni 40 menit Alkohol 100% 3 menit Alkohol 96% 3 menit Alkohol 80% 3 menit Alkohol 70% 30 menit
HE 2 menit
Air ledeng 6 menit Alkohol 70%+ 3 tetes HNO3 2 celup Alkohol 70% 3 menit Alkohol 80% 3 menit Eosin Y 25 menit Alkohol 96% 3 celup Alkohol 100% 6 menit Alkohol 100% 6 menit Xilol murni 10 menit
Jaringan ditetesi entelan dan ditutup dengan kaca penutup
Hasil sayatan penampang melin-tang dan memanjang usus tengah diamati di bawah mikroskop cahaya. Pengamatan terhadap struktur membran peritrofik pada nilai LD dilakukan pada 0, 24, 48, 72 dan 96 50
jam setelah diinfeksi oleh SlNPV. Penentuan tingkat kerusakan akibat SlNPV dilakukan secara deskriptif berdasarkan ada tidaknya kerusakan membran peritrofik, sel regeneratif dan membran basal.
Hasil dan Pembahasan
Pengaruh infeksi SlNPV pada dosis LD50
terhadap keutuhan struktur membran peritrofik
Dari hasil pra penelitian, diperoleh dosis yang mampu menyebabkan kematian
50% larva Spodoptera litura sebesar 465 PIB/ml. Nilai LD50 tersebut kemudian dibuta sayatan selama 0, 12, 24, 48, 72 dan 96 jam
MP SR MB MP SR MB SR MP SR MB
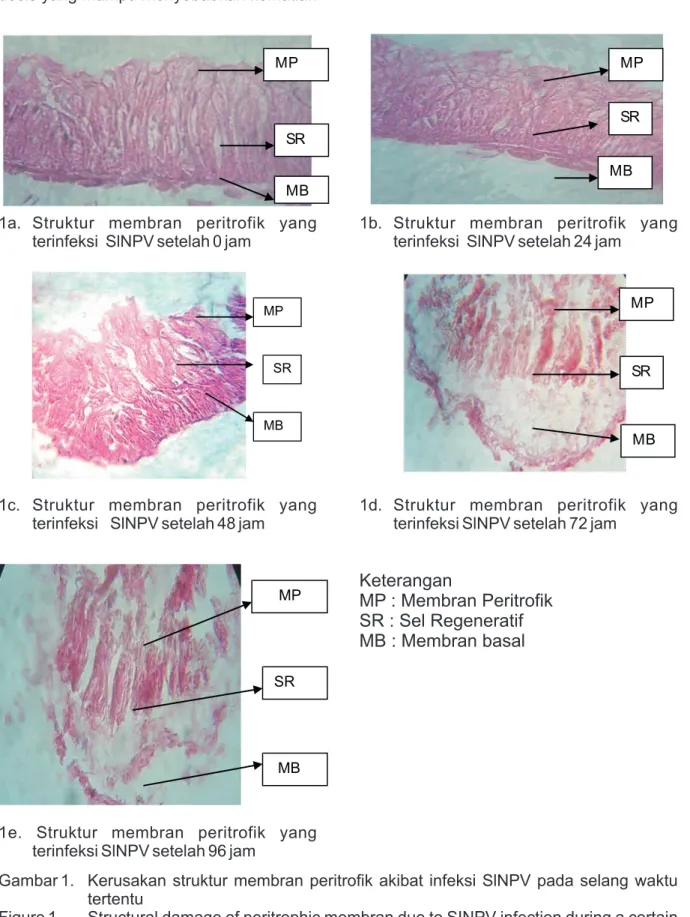
Gambar 1. Kerusakan struktur membran peritrofik akibat infeksi SlNPV pada selang waktu tertentu
Figure 1. Structural damage of peritrophic membran due to SINPV infection during a certain time period
1a. Struktur membran peritrofik yang terinfeksi SlNPV setelah 0 jam
1b. Struktur membran peritrofik yang terinfeksi SlNPV setelah 24 jam
1c. Struktur membran peritrofik yang terinfeksi SlNPV setelah 48 jam
1d. Struktur membran peritrofik yang terinfeksi SlNPV setelah 72 jam
Keterangan
MP : Membran Peritrofik
SR : Sel Regeneratif
MB : Membran basal
1e. Struktur membran peritrofik yang terinfeksi SlNPV setelah 96 jam
hingga larva menjadi pre pupa. Penggantian pakan dilakukan setiap hari tanpa dikontaminasi oleh susupensi virus.
Penelitian
Dalam penelitian ini digunakan 5 dosis perlakuan dengan 1 macam dosis kontrol. Dosis ini ditentukan berda-sarkan kisaran LD dengan tingkat kepercayaan 95%. Pada 50
percobaan ini digunakan 6 larva uji untuk masing-masing perlakuan dengan 4 kali pengulangan dan pengamatan dila-kukan sampai stadia pre pupa. Tahapan pemberian insektisida virus tidak berbeda dengan metode yang dilakukan pada pra penelitian. SlNPV diberikan ke larva uji melalui metode pakan yang telah ditetesi suspensi virus sebanyak 10 l dengan dosis yang telah ditentukan. Sebelumnya larva dila-parkan terlebih dahulu selama 24 jam. Keesokan harinya seluruh larva diberi pakan segar tanpa pemberian suspensi SlNPV. Untuk k o n t r o l , l a r v a d i b e r i p a k a n t a n p a ditambahkan suspensi virus namun ditetesi dengan akuades.
Setiap harinya dicatat kematian larva yang teramati dari setiap perlakuan selama 8 hari. Hal ini disebabkan karena waktu yang dibu-tuhkan virus dalam berinteraksi dengan inangnya membutuhkan waktu bebe-rapa hari sejak terjadinya infeksi hingga larva mati. Pengukuran terhadap temperatur dan kelembaban dilakukan setiap hari selama waktu pengamatan.
Pengamatan membran peritrofik
Pembuatan sayatan melintang membran peritrofik dilakukan berda-sarkan Utari (2000) yang telah dimodifikasi. Larva instar 5 Spodoptera
litura diambil usus tengahnya pada 0, 24, 48, 72, 96 jam setelah diinfeksi dengan menggunakan dosis infeksi berdasarkan nilai LD 50 SlNPV dari hasil penelitian menggunakan silet yang tajam. Agar memperoleh potongan yang baik, larva dijerat dalam larutan Bouin's di atas bantalan lilin. Bagian usus depan dan usus belakang tusuk dengan jarum. Kira-kira 5 menit setelah perendaman, larva yang telah mati diangkat dari bantalan lilin lalu usus tengahnya diambil.
Tahap selanjutnya adalah usus tengah difiksasi di dalam larutan Bouin's selama 24 jam. Keesokan harinya, dilakukan proses
dehidrasi dengan tahapan sebagai berikut: Alkohol 70 % 3 jam
Alkohol 80% 3jam Alkohol 90% 3 jam Alkohol 96% 3 jam Alkohol 100% 3 jam
Penjernihan organ dilakukan dengan merendam objek di dalam alkohol 100% : xilol. Organ yang telah jernih, kemudian diinfiltrasi dalam parafin pada temperatur tertentu, sebagai berikut:
0
Parafin I (48 C) 30 menit
0
Parafin II (52 C) 60 menit
0
Parafin III (56 C) 90 menit
Selesai tahap infiltrasi selesai selanjutnya organ ditanam dalam parafin sampai beku. Organ disayat melintang setebal 8 mm. Pita sayatan ditempel pada objek glass yang telah diberi perekat albumin Mayer's. Kemudian dilakukan pewarnaan dengan HE. Adapun tata cara pewarnaan dengan menggunakan HE adalah sebagai berikut:
Xilol murni 40 menit Alkohol 100% 3 menit Alkohol 96% 3 menit Alkohol 80% 3 menit Alkohol 70% 30 menit
HE 2 menit
Air ledeng 6 menit Alkohol 70%+ 3 tetes HNO3 2 celup Alkohol 70% 3 menit Alkohol 80% 3 menit Eosin Y 25 menit Alkohol 96% 3 celup Alkohol 100% 6 menit Alkohol 100% 6 menit Xilol murni 10 menit
Jaringan ditetesi entelan dan ditutup dengan kaca penutup
Hasil sayatan penampang melin-tang dan memanjang usus tengah diamati di bawah mikroskop cahaya. Pengamatan terhadap struktur membran peritrofik pada nilai LD dilakukan pada 0, 24, 48, 72 dan 96 50
jam setelah diinfeksi oleh SlNPV. Penentuan tingkat kerusakan akibat SlNPV dilakukan secara deskriptif berdasarkan ada tidaknya kerusakan membran peritrofik, sel regeneratif dan membran basal.
Hasil dan Pembahasan
Pengaruh infeksi SlNPV pada dosis LD50
terhadap keutuhan struktur membran peritrofik
Dari hasil pra penelitian, diperoleh dosis yang mampu menyebabkan kematian
50% larva Spodoptera litura sebesar 465 PIB/ml. Nilai LD50 tersebut kemudian dibuta sayatan selama 0, 12, 24, 48, 72 dan 96 jam
MP SR MB MP SR MB SR MP SR MB
Gambar 1. Kerusakan struktur membran peritrofik akibat infeksi SlNPV pada selang waktu tertentu
Figure 1. Structural damage of peritrophic membran due to SINPV infection during a certain time period
1a. Struktur membran peritrofik yang terinfeksi SlNPV setelah 0 jam
1b. Struktur membran peritrofik yang terinfeksi SlNPV setelah 24 jam
1c. Struktur membran peritrofik yang terinfeksi SlNPV setelah 48 jam
1d. Struktur membran peritrofik yang terinfeksi SlNPV setelah 72 jam
Keterangan
MP : Membran Peritrofik
SR : Sel Regeneratif
MB : Membran basal
1e. Struktur membran peritrofik yang terinfeksi SlNPV setelah 96 jam
Histologi Membran Peritrofik a. 0 jam setelah infeksi
Berdasarkan hasil pengamatan histologi terhadap usus tengah larva Spodoptera litura pada 0 jam, ternyata struktur membran peritrofik masih tampak utuh. Dapat dilihat jaringan penyusun dari usus tengah masih berada dalam kondisi normal (Gambar 1. a.)
b. 24 jam setelah diinfeksi SlNPV
Hasil sayatan histologis terhadap usus tengah larva Spodoptera litura pada waktu 24 jam setelah perlakuan menunjukkan mulai tampak adanya suatu kerusakan yang terjadi pada lapisan paling luar yaitu membran peritrofik. Bisa dibedakan hasil yang ditunjukkan bila dibandingkan dengan kontrol, maka profil membran peritrofik mulai mengalami disintegrasi ke arah lumen usus tengah, tampak seperti pada Gambar 1.b c. 48 jam setelah infeksi.
Setelah 48 jam masa infeksi dengan menggunakan SlNPV, penyebaran virus serangga di dalam tubuh larva mulai memasuki daerah yang lebih dalam yaitu masuk ke dalam sel-sel penyusun usus tengah (sel regeneratif) mulai mengalami degradasi hingga tampak bergerak menuju ke arah lumen usus. Kerusakan dapat dilihat pada Gambar 1.c
d. 72 jam setelah infeksi.
Pada sayatan setelah 72 jam setelah perlakuan, tingkat kerusakan jaringan pada usus tengah mulai merata. Kerusakan tampak hingga membran basal. Rusaknya sel-sel tersebut diperkirakan oleh infeksi SlNPV di dalam tubuh larva uji yang terjadi akibat proses termakannya PIB pada larva uji. Kerusakan yang terjadi dapat dilihat pada Gambar 1.d
e. 96 jam setelah infeksi.
Pada 96 jam setelah perlakuan, jaringan penyusun usus tengah semakin tidak jelas. Agak sulit untuk menemukan bagian-bagian penyusunnya. Hal ini diperkirakan proses infeksi virus sudah memasuki tahap lanjut. Virus yang telah mengalami replikasi di daerah usus tengah mulai dilepaskan ke hemosol dan pada tahap selanjutnya akan menyerang bagian tubuh yang lainnya, seperti tampak pada
Gambar 1.e.
Berdasarkan hasil yang diperoleh terhadap keutuhan struktur dari membrane peritrofik larva instar 5 Spodoptera litura selama 0, 24, 48, 72 dan 96 jam dapat dilihat bahwa pada 0 jam belum ditemukan kerusakan yang diakibatkan oleh SlNPV (Gambar 1.a). Epithelium usus tengah masih tampak utuh dengan sel-sel penyusunnya yang terdiri dari kumpulan sel-sel kolumner yang tersusun rapat yang tampak di bagian apek atau ujung dan terdapat sel-sel regeneratif yang terdapat di sebelah basal dari epitelium dan berbatasan langsung dengan membran basal (Levy et al., 2004). Kondisi demikian menegaskan bahwa dengan keutuhan profil membran peritrofik maka aktivitas metabolisme masih berjalan lancar k a r e n a u s u s t e n g a h d a p a t mengoptimalkan fungsinya sebagai tempat penyerapan dan sekresi enzim ( Kikhno 2002). Disebutkan oleh Wang & Granados (1998) yang mempelajari keberadaan membran peritrofik pada Trichoplusia ni bahwa membran peritrofik tersusun oleh protein Insect Intestinal Mucin yang merupakan protein terbesar y a n g d i k a n d u n g o l e h m e m b r a n peritrofik.Pengamatan selanjutnya bahwa akibat infeksi SlNPV yang turut tercerna bersama makanannya, maka struktur dari membran peritrofik pada 24 setelah infeksi mulai mengalami kerusakan seperti terlihat pada Tabel 4.5 sebesar 10%. Hal ini menegaskan keberadaan membran peritrofik juga berfungsi sebagai perlindungan usus tengah terhadap kerusakan yang kuat o l e h p a r t i k e l m a k a n a n ( D a y & Waterhouse 1953). Kerusakan yang terjadi menga-lami peningkatan sejalan dengan semakin lamanya waktu infeksi. Pada infeksi awal, serangan patogen akan direspon oleh sistem pertahanan serangga secara morfologi dengan keberadaan membran peritrofik yang berfungsi sebagai perlindungan terha-dap serangan patogen (Terra 2001). Funakoshi dan Aizawa (1989) me-nyatakan bahwa dengan meningkatnya proses infeksi yang terus-menerus,
Daftar Pustaka
Arifin M. 1993. Perkembangan Pe-nelitian P e n g e n d a l i a n U l a t G r a y a k , Spodoptera litura (F.) Dengan Sl-NPV Pada Kedelai. Disampaikan dalam Simposium Patologi Se-rangga tanggal 12-13 Oktober 1993 yang berlangsung di Kampus UGM. Yogyakarta.
Barbehenn RV, and Marin M. 1994. Peritrophic Envelope Permeability in H e r b i v o r o u s I n s e c t . J . I n s e c t Pshysiology. (41):303-311.
Bonning CB, Bruce. 1996. Develop-ment and recombinant Baculovirus for insect control. Ann Rev Entomol. (41): 191-210.
Borror D, Delong D. 1995. An Introduction to the Study of Insect. New York: Rinehart & Company.
Cristian P. 1994. Recombinant Baculo-virus Insecticides: Catalyst for Change of Heart?. Di dalam: Biopesticides Opportunities for Australian Industry. Symposium on Biopesticides, June 9- 10 1991 , Brisbane, Australia. Hlm 40-50
Engelhard EK, and Volkman LE. 1995. Developmental resistance in fourth instar Tricholupsia ni orally inoculated with Autographa californica M. Nuclear Polyhe-drosis Virus. J. Virol. 209: 381-389.
Fuxa J R. 1993. Insects Resistance to Viruses in Parasites and Pathogens of Insects. Florida: Academic Press. Funakoshi M, K Aizawa. 1989. Viral inhibitory
factor produced in the hemolymph of the silkworm, Bombyx mori, infected with a Nuclear Polyhedrosis Virus. J Invert Pathol. 54: 151 – 155.
Granados RR, Corsaro NG.1990. Baculovirus Enhancing Protein & Their Implications for Insect Control. Youth I n t e r n a t i o n a l C o l l o - q u i n o n i n Invertebrate Patho-logy & Microbial Control.
Kalshoven LGE. 1981. The Pest of Crops in Indonesia. PT. Ichtiar Baru. Indonesia. Kikhno.2002. Characterization of pif, a
Gene Required for the per os Infectivity o f S p o d o p t e r a l i t t o r a l i s Nucleopolyhedrovirus. J. of Gen. Vir. (83). 3013-3022.
maka fungsi dari membran peritrofik tidak dapat dipertahankan lagi.
Salah satu faktor yang mempe-ngaruhi keberhasilan virus dalam merusak struktur histologi membran peritrofik karena virus menghasilkanfaktor pemercepat virus yang membuat virus mampu menginfeksi sel serangga sehingga merusak membran peritrofik (Lehane 1997; Engelhard & Volkman 1995). Dengan demikian membran peritrofik akan lebih mudah untuk ditembus oleh virion NPV yang pada akhirnya akan menyerang sel-sel di sebelah dalamnya. Kerusakan tersebut dapat dilihat setelah 48 jam dimana sel regeneratif (rusak sebesar 30%) mulai meluruh ke arah lumen usus tengah. Dengan terganggunya sel tersebut, maka fungsi usus tengah sebagai penghasil enzim akan terganggu. Disebutkan bahwa salah satu enzim yang disekresikan oleh usus tengah adalah enzim protease yang berperan sebagai anti viral (Terra & Ferreira 2002). Sehingga bila dalam aktivitasnya diganggu oleh kehadiran patogen maka proses metabolisme tidak akan berjalan dengan lancar.
Berdasarkan hasil pengamatan terhadap infeksi tahap lanjut pada 72 dan 96 setelah infeksi, keutuhan membran peritrofik menjadi semakin tidak utuh. Seperti yang dikemukakan oleh Rohrmann (1994), bahwa virion NPV membutuhkan waktu beberapa hari untuk dapat mengekspresikan interaksinya. Dengan demikian, semakin lama waktu kontak antara virion NPV dengan sel inang maka tingkat kerusakan yang ditimbulkan akan semakin tinggi. Kerusakan yang terjadi pada tahap lanjut ini menyebabkan kemampuan epitel dalam membentuk membran peritrofik mengalami gang-guan. Hal ini sesuai dengan pernyataan Patton (1963) bahwa membran peritrofik merupakan sekresi dari epithelium usus tengah.
Struktur histologi membran peri-trofik setelah diinfeksi oleh SlNPV tampak mengalami kerusakan sejalan dengan bertambahnya waktu infeksi SlNPV yang diberikan dimana kerusakan yang terbesar terjadi pada saat 96 jam setelah diinfeksi.
Histologi Membran Peritrofik a. 0 jam setelah infeksi
Berdasarkan hasil pengamatan histologi terhadap usus tengah larva Spodoptera litura pada 0 jam, ternyata struktur membran peritrofik masih tampak utuh. Dapat dilihat jaringan penyusun dari usus tengah masih berada dalam kondisi normal (Gambar 1. a.)
b. 24 jam setelah diinfeksi SlNPV
Hasil sayatan histologis terhadap usus tengah larva Spodoptera litura pada waktu 24 jam setelah perlakuan menunjukkan mulai tampak adanya suatu kerusakan yang terjadi pada lapisan paling luar yaitu membran peritrofik. Bisa dibedakan hasil yang ditunjukkan bila dibandingkan dengan kontrol, maka profil membran peritrofik mulai mengalami disintegrasi ke arah lumen usus tengah, tampak seperti pada Gambar 1.b c. 48 jam setelah infeksi.
Setelah 48 jam masa infeksi dengan menggunakan SlNPV, penyebaran virus serangga di dalam tubuh larva mulai memasuki daerah yang lebih dalam yaitu masuk ke dalam sel-sel penyusun usus tengah (sel regeneratif) mulai mengalami degradasi hingga tampak bergerak menuju ke arah lumen usus. Kerusakan dapat dilihat pada Gambar 1.c
d. 72 jam setelah infeksi.
Pada sayatan setelah 72 jam setelah perlakuan, tingkat kerusakan jaringan pada usus tengah mulai merata. Kerusakan tampak hingga membran basal. Rusaknya sel-sel tersebut diperkirakan oleh infeksi SlNPV di dalam tubuh larva uji yang terjadi akibat proses termakannya PIB pada larva uji. Kerusakan yang terjadi dapat dilihat pada Gambar 1.d
e. 96 jam setelah infeksi.
Pada 96 jam setelah perlakuan, jaringan penyusun usus tengah semakin tidak jelas. Agak sulit untuk menemukan bagian-bagian penyusunnya. Hal ini diperkirakan proses infeksi virus sudah memasuki tahap lanjut. Virus yang telah mengalami replikasi di daerah usus tengah mulai dilepaskan ke hemosol dan pada tahap selanjutnya akan menyerang bagian tubuh yang lainnya, seperti tampak pada
Gambar 1.e.
Berdasarkan hasil yang diperoleh terhadap keutuhan struktur dari membrane peritrofik larva instar 5 Spodoptera litura selama 0, 24, 48, 72 dan 96 jam dapat dilihat bahwa pada 0 jam belum ditemukan kerusakan yang diakibatkan oleh SlNPV (Gambar 1.a). Epithelium usus tengah masih tampak utuh dengan sel-sel penyusunnya yang terdiri dari kumpulan sel-sel kolumner yang tersusun rapat yang tampak di bagian apek atau ujung dan terdapat sel-sel regeneratif yang terdapat di sebelah basal dari epitelium dan berbatasan langsung dengan membran basal (Levy et al., 2004). Kondisi demikian menegaskan bahwa dengan keutuhan profil membran peritrofik maka aktivitas metabolisme masih berjalan lancar k a r e n a u s u s t e n g a h d a p a t mengoptimalkan fungsinya sebagai tempat penyerapan dan sekresi enzim ( Kikhno 2002). Disebutkan oleh Wang & Granados (1998) yang mempelajari keberadaan membran peritrofik pada Trichoplusia ni bahwa membran peritrofik tersusun oleh protein Insect Intestinal Mucin yang merupakan protein terbesar y a n g d i k a n d u n g o l e h m e m b r a n peritrofik.Pengamatan selanjutnya bahwa akibat infeksi SlNPV yang turut tercerna bersama makanannya, maka struktur dari membran peritrofik pada 24 setelah infeksi mulai mengalami kerusakan seperti terlihat pada Tabel 4.5 sebesar 10%. Hal ini menegaskan keberadaan membran peritrofik juga berfungsi sebagai perlindungan usus tengah terhadap kerusakan yang kuat o l e h p a r t i k e l m a k a n a n ( D a y & Waterhouse 1953). Kerusakan yang terjadi menga-lami peningkatan sejalan dengan semakin lamanya waktu infeksi. Pada infeksi awal, serangan patogen akan direspon oleh sistem pertahanan serangga secara morfologi dengan keberadaan membran peritrofik yang berfungsi sebagai perlindungan terha-dap serangan patogen (Terra 2001). Funakoshi dan Aizawa (1989) me-nyatakan bahwa dengan meningkatnya proses infeksi yang terus-menerus,
Daftar Pustaka
Arifin M. 1993. Perkembangan Pe-nelitian P e n g e n d a l i a n U l a t G r a y a k , Spodoptera litura (F.) Dengan Sl-NPV Pada Kedelai. Disampaikan dalam Simposium Patologi Se-rangga tanggal 12-13 Oktober 1993 yang berlangsung di Kampus UGM. Yogyakarta.
Barbehenn RV, and Marin M. 1994. Peritrophic Envelope Permeability in H e r b i v o r o u s I n s e c t . J . I n s e c t Pshysiology. (41):303-311.
Bonning CB, Bruce. 1996. Develop-ment and recombinant Baculovirus for insect control. Ann Rev Entomol. (41): 191-210.
Borror D, Delong D. 1995. An Introduction to the Study of Insect. New York: Rinehart & Company.
Cristian P. 1994. Recombinant Baculo-virus Insecticides: Catalyst for Change of Heart?. Di dalam: Biopesticides Opportunities for Australian Industry. Symposium on Biopesticides, June 9- 10 1991 , Brisbane, Australia. Hlm 40-50
Engelhard EK, and Volkman LE. 1995. Developmental resistance in fourth instar Tricholupsia ni orally inoculated with Autographa californica M. Nuclear Polyhe-drosis Virus. J. Virol. 209: 381-389.
Fuxa J R. 1993. Insects Resistance to Viruses in Parasites and Pathogens of Insects. Florida: Academic Press. Funakoshi M, K Aizawa. 1989. Viral inhibitory
factor produced in the hemolymph of the silkworm, Bombyx mori, infected with a Nuclear Polyhedrosis Virus. J Invert Pathol. 54: 151 – 155.
Granados RR, Corsaro NG.1990. Baculovirus Enhancing Protein & Their Implications for Insect Control. Youth I n t e r n a t i o n a l C o l l o - q u i n o n i n Invertebrate Patho-logy & Microbial Control.
Kalshoven LGE. 1981. The Pest of Crops in Indonesia. PT. Ichtiar Baru. Indonesia. Kikhno.2002. Characterization of pif, a
Gene Required for the per os Infectivity o f S p o d o p t e r a l i t t o r a l i s Nucleopolyhedrovirus. J. of Gen. Vir. (83). 3013-3022.
maka fungsi dari membran peritrofik tidak dapat dipertahankan lagi.
Salah satu faktor yang mempe-ngaruhi keberhasilan virus dalam merusak struktur histologi membran peritrofik karena virus menghasilkanfaktor pemercepat virus yang membuat virus mampu menginfeksi sel serangga sehingga merusak membran peritrofik (Lehane 1997; Engelhard & Volkman 1995). Dengan demikian membran peritrofik akan lebih mudah untuk ditembus oleh virion NPV yang pada akhirnya akan menyerang sel-sel di sebelah dalamnya. Kerusakan tersebut dapat dilihat setelah 48 jam dimana sel regeneratif (rusak sebesar 30%) mulai meluruh ke arah lumen usus tengah. Dengan terganggunya sel tersebut, maka fungsi usus tengah sebagai penghasil enzim akan terganggu. Disebutkan bahwa salah satu enzim yang disekresikan oleh usus tengah adalah enzim protease yang berperan sebagai anti viral (Terra & Ferreira 2002). Sehingga bila dalam aktivitasnya diganggu oleh kehadiran patogen maka proses metabolisme tidak akan berjalan dengan lancar.
Berdasarkan hasil pengamatan terhadap infeksi tahap lanjut pada 72 dan 96 setelah infeksi, keutuhan membran peritrofik menjadi semakin tidak utuh. Seperti yang dikemukakan oleh Rohrmann (1994), bahwa virion NPV membutuhkan waktu beberapa hari untuk dapat mengekspresikan interaksinya. Dengan demikian, semakin lama waktu kontak antara virion NPV dengan sel inang maka tingkat kerusakan yang ditimbulkan akan semakin tinggi. Kerusakan yang terjadi pada tahap lanjut ini menyebabkan kemampuan epitel dalam membentuk membran peritrofik mengalami gang-guan. Hal ini sesuai dengan pernyataan Patton (1963) bahwa membran peritrofik merupakan sekresi dari epithelium usus tengah.
Struktur histologi membran peri-trofik setelah diinfeksi oleh SlNPV tampak mengalami kerusakan sejalan dengan bertambahnya waktu infeksi SlNPV yang diberikan dimana kerusakan yang terbesar terjadi pada saat 96 jam setelah diinfeksi.
Lehane MJ, Msangi AR.1991. Lectin and Peritrophic Membrane Development in the Gut of Glossina-M-morsitans and a Discussion of Their Role in Protecting t h e F l y A g a i n s t Tr y p a n o s o m a Infection. Journal Medical & Vaternity Entomology. (5): 495-501.
Lehane MJ.1997. Peritrophic Matrix Structure and Function. Annual Review Entomology. (42): 525-550. Moscardi, F. 1994. Assesment of The
Appplication of Baculovirus for Control of Lepidoptera. Annual Review of Entomology. (44): 247-249.
Novizan. 2004. Membuat dan Memanfaat-kan Pestisida Ramah Lingkungan. Tangerang: Agro Media Pustaka. Patton RL.1963. Introductory Insect
Physiology. Japan: Toppan Company. Rohrmann GF. 1994. Nuclear Polyhe-drosis
Virus dalam Encyclopedia of Virology. London: Academic Press Hart Court Brace and Company. (1): 130-136. Sutarya, R. 1996. Pengujian Spodoptera
exigua Nuclear Polyhedrosis Virus dalam Hubungannya dengan Sifat Persistensinya untuk Mengenda-likan Spodoptera exigua Hubn. J. Hort. 6 (2): 167 – 171.
Teakle RE, Jensen RE, Mulder, JC. 1985. Susceptibility of Heliothis armiger (Lepidoptera:Noctuidae) on Sorghum to a Nuclear Polyhedrosis Virus. J Econ Entomol. 78: 1373-1378
Terra WR. 2001. The Origin and Functions of the Insect Peritrophic Membrane & Peritrophic Gel. Archives of Insect Biochemistry and Physiology. (47): 47-61.
Terra WR, Ferreira C.2002. Insect Peritrophic Membrane Functions. Journal of Physiology, Bioche-mistry, Toxicology & Molecular Biology.
Utari E. 2000. Pengaruh Infeksi HaNPV terhadap Kerusakan Membran Peritrofik dan Indeks Nutrisi Larva Instar V Helicoverpa armigera (Hubner). Tesis Pasca Sarjana. ITB. Wang, Granados.1998. Observation on the
Presence of the Peritrophic Membrane in Larval Trichoplusia ni and its Role in Limiting Baculovirus Infection. Journal of Invert Pathology. (72): 57-62.
Wa t e r h o u s e . D . M . F. 1 9 5 3 . I n s e c t Physiology. London: Chapman & Hall.
Keragaman Benthos pada Budidaya Rajungan (Portunus
pelagicus) di Tambak Percobaan Maranak, Balai Riset
Perikanan Budidaya Air Payau Maros Sulawesi Selatan
A. Marsambauana Pirzan dan Suharyanto
Balai Riset Perikanan Budidaya Air Payau, Maros Email: yanto@kkp.go.id
Diterima Desember 2010 disetujui untuk diterbitkan September 2011 Abstract
A study has been conducted in Maranak Pond Station of Research Institute for Coastal Aquaculture, Maros South Sulawesi. The objective of this study was to analyse the benthos diversity on the swimming crab (Portunus pelagicus) culture in the brackishwater pond. Sampling of benthos was conducted each month for four times. Benthos samples were obtained from 9 ponds. Pipe (pvc) in diameter of 2 cm was used to collect benthos then preserved in 10% of formalin solution. Microscopically identification of benthos was conducted until genus and counting cell method was used to calculate their population density. Research results showed that benthos composition were 32 genera of phytoplankton
2
and 15 genera of zooplankton. Varies benthos density at the range of 954 – 23,850 ind. / cm and genus at the range of 2 – 14 genera. Gut content of swimming crab were 6 genera of phytoplankton, Copepod nauplii and unknown organism. Benthos diversity indices was classified moderately stable in ponds 2 – 6 and 8 - 9 while in pond 1 and 7 were not stable. Evenness indices of benthos in ponds 3 - 8 were relatively more normal of distribution than ponds 1, 2 and 9. Dominance indices of ponds 3 - 9 relatively better than ponds 1 and 2.
Key words: diversity, benthos, swimming crab, culture, brackishwater pond Abstrak
Studi telah dilaksanakan di Instalasi Tambak Percobaan Maranak, Balai Riset Perikanan Budidaya Air Payau Maros Sulawesi Selatan bertujuan menelaah keragaman benthos pada budidaya rajungan (Portunus pelagicus) untuk mendukung pengelolaan tambak yang produktif dan berkelanjutan. Pengambilan sampel benthos sebanyak empat kali sampling yang dilakukan tiap bulan sekali di sembilan
2
petak tambak berukuran masing-masing 250 m . Sampel benthos dikoleksi menggunakan pipa paralon berdiameter 2 cm, kemudian sampel tersebut diawetkan dengan larutan formalin 10%. Identifikasi organisme benthos dilakukan di laboratorium menggunakan mikroskop yang berpedoman pada buku identifikiasi serta kelimpahannya menggunakan Sedwick Rafter Counting Cell. Organisme benthos terdiri dari 32 genera fitoplankton dan 15 genera zooplankton. Kelimpahan organisme penyusun benthos pada
2
kisaran 954 – 23.850 ind. / cm dan jumlah genus pada kisaran 2 – 14 genera. Hasil analisis isi usus rajungan terdiri dari 6 genera fitoplankton, naupli kopepoda dan organisme tidak diketahui. Indeks biologi: keragaman benthos pada petak 2 – 6 dan 8 - 9 tergolong ke dalam kondisi stabil moderat sedangkan petak 1 dan 7 tergolong tidak stabil, keseragaman pada petak 3 – 8 berindikasi kepadatannya lebih merata dibandingkan dengan petak 1, 2 dan 9, dan dominansi petak 3 – 9 relatif lebih baik dibandingkan dengan petak 1 dan 2.
Kata kunci: keragaman, benthos, rajungan, budidaya, tambak
Pendahuluan
P e r m i n t a a n d a g i n g r a j u n g a n (Portunus pelagicus) semakin meningkat karena selain rasa dagingnya yang lezat juga bergizi tinggi. Hal ini mendorong
aktivitas penangkapan rajungan semakin intensif dan tidak terkendali yang mengarah kepada kerusakan populasi rajungan di alam. Pengurangan dan ancaman populasi rajungan sudah mulai dirasakan, misalnya
saat ini permintaan Philips Seafoods sebanyak 800 ton per bulan sudah sulit terpenuhi (Suharyanto et al., 2006). Produksi daging rajungan di Indonesia baru mencapai sekitar 9.000 ton per tahun, di mana 70% berasal dari hasil tangkapan di alam dan 30% berasal dari kegiatan budidaya sehingga perlu pengembangan budidaya dan pengaturan penangkapan untuk menjaga kelestarian rajungan di alam. Guna mengantisipasi hal tersebut,