TIGA JENIS BAHAN KEMASAN PLASTIK:
PENGARUHNYA TERHADAP SERANGAN CENDAWAN
PASCAPANEN DAN KONTAMINASI AFLATOKSIN PADA
KACANG TANAH
Oleh:
NOVALIANA FACHLENY
G34101013
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
TIGA JENIS BAHAN KEMASAN PLASTIK:
PENGARUHNYA TERHADAP SERANGAN CENDAWAN
PASCAPANEN DAN KONTAMINASI AFLATOKSIN
PADA KACANG TANAH
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
NOVALIANA FACHLENY
G34101013
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
Judul skripsi
: Tiga Jenis Bahan Kemasan Plastik: Pengaruhnya
terhadap Serangan Cendawan Pascapanen dan Kontaminasi
Aflatoksin pada Kacang Tanah
Nama
: Novaliana Fachleny
NRP
: G34101013
Menyetujui :
Pembimbing I, Pembimbing II,
Dr. Okky Setyawati Dharmaputra Santi Ambarwati, M.Si
NIP 131 430 807
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, MS
NIP 131 473 999
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Tiga Jenis Bahan Kemasan Plastik: Pengaruhnya terhadap Serangan Cendawan Pascapanen dan Kontaminasi Aflatoksin pada Kacang Tanah. Penelitian ini dilaksanakan di Laboratorium Fitopatologi SEAMEO BIOTROP, Bogor, dari bulan April sampai dengan November 2005.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Dr. Okky Setyawati Dharmaputra dan Ibu Santi Ambarwati, M.Si selaku pembimbing yang telah memberikan pengarahan dan saran dalam pelaksanaan penelitian dan penulisan karya ilmiah. Terimakasih juga penulis sampaikan kepada Bapak Dr. Ir. Miftahudin, M.Si selaku wakil Komisi Pendidikan Departemen
Biologi atas saran dan koreksinya terhadap karya ilmiah ini, Direktur SEAMEO BIOTROP atas izin penggunaan fasilitas dan bantuan dana penelitian, Ibu Ir. Ina
Retnowati atas kesabaran dan pengarahannya, Pak Edi, Pak Suradi, dan Pak Rahmat atas bantuannya; Jezy, Nani , Indri, Dian, Syamsiyah, Laili, Santi, Sekar, Cynthia, Rusdi, Ruly, dan Pipin atas dukungan dan bantuannya; teman-teman Biologi 38 atas kekompakkan dan kebersamaannya; serta teman-teman di Bagunde 34, Yayu, Teh Ai, Mba Suci, atas dorongan semangat dan duk ungannya.
Teristimewa ucapan terima kasih yang tulus dan mendalam penulis sampaikan kepada ayahanda dan ibunda tercinta, adik-adikku Lely dan Ilham yang dengan sabar dan penuh kasih sayang senantiasa memberi dorongan moril dan semangat, serta rekan-rekan seperjuangan di DKM Al-Ghifari atas dorongan semangat, ukhuwah, dan pengertiannya.
Penulis berharap semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2006
RIWAYAT HIDUP
Penulis dilahirkan di Brebes pada tanggal 10 November 1983 dari ayah bernama Suripno dan ibu Siti Masitoh. Penulis merupakan anak pertama dari tiga bersaudara.
Pada tahun 2001 penulis lulus dari SMU Negeri 1 Bumiayu dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Biologi Dasar pada tahun ajaran 2002/2003, Botani Umum pada tahun ajaran 2002/2003, Biologi Umum pada tahun ajaran 2003/2004, dan Pendidikan Agama Islam pada tahun ajaran 2004/2005 . Pada bulan Juni-Juli 2004 penulis melaksanakan praktik lapangan di PT Nalco Indonesia, Citeureup dengan tema Optimalisasi Pengolahan Limbah Cair Secara Biologis. Pad a bulan Juli 2005 penulis mengikuti Pekan Ilmiah Mahasiswa Nasional di Padang sebagai finalis Program Kreativitas Mahasiswa Bidang Ilmiah, dengan topik Keragaman Liken Kortikolus di Taman Wisata Alam Situgunung, Sukabumi.
DAFTAR ISI
Halaman
DAFTAR TABEL. ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN. ... x PENDAHULUAN. ... 1 Latar Belakang... 1 Tujuan Penelitian. ... 1 BAHAN DAN METODE ... 2
Pemanenan, Pengeringan dan Pengupasan Polong. ... 2
Pengemasan dan Penyimpanan ... 2
Pengambilan Sampel dan Cara Memperoleh Sampel Kerja. ... 3
Penentuan Kadar Air dan Persentase Biji Rusak ... 3
Penentuan Populasi Total Cendawan dan A. flavus. ... 3
Penentuan Kandungan Aflatoksin B1. ... 4
Rancangan Percobaan... 6
HASIL DAN PEMBAHASAN. ... 6
Kadar Air... 6
Persentase Biji Rusak... .... 8
Populasi Total Cendawan. ... .... 8
Populasi A. flavus . ... 11
Kandungan Aflatoksin B1... 13
SIMPULAN DAN SARAN ... .... 14
Simpulan. ... 14
Saran. ... 14
DAFTAR PUSTAKA... 14
DAFTAR TABEL
Halaman
1 Pengaruh interaksi antara jenis bahan kemasan plastik dan konsentrasi oksigen terhadap
kadar air kacang tanah selama penyimpanan ... 7
2 Kadar air kacang tanah selama penyimpana n. ... 7
3 Kisaran dan rata-rata suhu, serta kelembaban relatif ruang simpan selama p enyimpanan ... 7
4 Persentase biji rusak kacang tanah selama penyimpanan ... 8
5 Pengaruh interaksi antara jenis bahan kemasan plastik dan lama penyimpanan terhadap populasi total cendawan pada kacang tanah ... 9
6 Pengaruh interaksi antara konsentrasi oksigen dan lama penyimpanan terhadap populasi total cendawan pada kacang tanah . ... 9
7 Pengaruh interaksi antara jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan terhadap populasi A. flavus pada kacang tanah... 11
8 Pengaruh interaksi antara jenis bahan kemasan plastik dan lama penyimpanan terhadap kandungan aflatoksin B1 pada kacang tanah. ... 13
9 Pengaruh interaksi antara konsentrasi oksigen dan lama penyimpanan terhadap kandungan aflatoksin B1 pada kacang tanah. ... 13
DAFTAR GAMBAR
Halaman
1 Pengukuran konsentrasi oksigen rendah di dalam kantung plastik menggunakan
cosmotector merek COSMOS, model No. XPO -318. ... 2
2 Biji kacang tanah yang dikemas di dalam kantung plastik dengan konsentrasi O2 normal (a) dan rendah (b). ... 2
3 Kantung-kantung plastik berisi biji kacang tanah yang diletakkan secara acak pada rak kay ... 2
4 Skema cara memperoleh sampel kerja. a dan e: sampel untuk penentuan populasi cendawan, b dan f: sampel untuk penentuan persentase biji rusak, c dan g: sampel untuk penentuan kandungan aflatoksin B1, d dan h: sampel untuk penentuan kadar air dan sampel cadangan. ... 3
4 Biji rusak kacang tanah ... 3
6 Struktur kimia aflatoksin B1 ... 4
7 Peta plat mikro analisis aflatoksin B1 dengan metode ELISA. ... 5
8 Hasil isolasi cendawan pada kacang tanah yang dikemas di dalam tiga jenis bahan kemasan plastik pada awal penyimpanan. Media untuk isolasi cendawan: DG18. Faktor pengenceran: 10-1. a = Aspergillus flavus ; b = A. niger; c = A. penicillioides; d = A. tamarii ... 10
9 Hasil isolasi cendawan pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP, NY 80 dan NY 70 pada konsentrasi oksigen normal dan rendah setelah empat bulan penyimpanan. M edia untuk isolasi cendawan: DG18. Faktor pengenceran: 10-1. a = Aspergillus flavus ; b = A. niger ; c = A. penicillioides ... 11
10 Hasil isolasi A. flavus pada kacang tanah yang dikemas di dalam tiga jenis kantung plastik pada awal penyimpanan. Media untuk isolasi cendawan: AFPA. Faktor pengenceran: 10-1.a = A. flavus ... 12
11 Hasil isolasi A. flavus pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP, NY 80 dan NY 70 pada konsentrasi oksigen normal dan rendah setelah empat bulan penyimpanan. Media untuk isolasi cendawan: AFPA. Faktor pengenceran: 10-1. a = A. flavus ... 12
DAFTAR LAMPIRAN
Halaman
1 Karakteristik jenis bahan kemasan plastik yang digunakan sebagai
pengemas kacang tanah. ... 18
2 Satuan percobaan pada berbagai kombi nasi perlakuan kacang tanah ... ... 19
3 Cara perhitungan suhu dan kelembaban relatif rata-rata harian ... 20
4 Komposisi media yang digunakan untuk isolasi dan identifikasi cendawan ... ... 20
5 Analisis ragam pengaruh jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan terhadap kadar air kacang tanah. ... 21
6 Analisis ragam pengaruh jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan terhadap biji rusak kacang tanah ... .. 21
7 Analisis ragam penga ruh jenis plastik, konsentrasi oksigen, dan lama penyimpanan terhadap populasi total cendawan pada kacang tanah. ... 22
8 Analisis ragam pengaruh jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan terhadap populasi A. flavus pada kacang tanah. ... 22
9 Analisis ragam pengaruh jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan terhadap kandungan aflatoksin B1 pada kacang tanah... 23
PENDAHULUAN
Latar BelakangDi Indonesia kacang tanah (Arachis
hypogaea L.) merupakan palawija yang penting
setelah jagung dan kedelai. Kacang tanah dapat dimanfaatkan sebagai bahan pangan, pakan, dan bahan baku industri. Sebagai bahan pangan, kacang tanah antara lain dapat diolah menjadi kacang garing, kacang goreng, kacang rebus, kacang telur, kacang atom, oncom goreng, dan bumbu kacang tanah. Kacang tanah mengandung minyak, protein, karbohidrat, vitamin (E, K, dan B), dan mineral seperti fosfor, kalsium, magnesium, dan kalium (Dwivedi et al. 1996). BPS (2005) melaporkan bahwa pada tahun 2004 produksi kacang tanah di Indonesia mencapai 837 495 ton.
Iklim tropis dan kelembaban yang tinggi di Indonesia menyebabkan kacang tanah mudah terserang oleh cendawan, baik sebelum maupun setelah panen. Menurut Sauer et al. (1992) cendawan merupakan mikroorganisme utama penyebab kerusakan biji-bijian selama penyimpanan. Serangan cendawan dapat menurunkan kualitas fisik biji, keapakan, perubahan warna biji, penurunan kandungan nutrisi, dan dihasilkannya mikotoksin oleh spesies atau galur tertentu suatu spesies cendawan.
Mikotoksin yang umum dijumpai pada produk pertanian adalah aflatoksin, yaitu metabolit sekunder yang dihasilkan antara lain oleh galur tertentu Aspergillus flavus apabila tumbuh pada substrat yang cocok, termasuk kacang tanah (Pitt 1999). Pada umumnya jenis aflatoksin yang mengkontaminasi bahan pangan adalah aflatoksin B1, B2, G1, G2, sedangkan
yang paling berbahaya adalah aflatoksin B1
(Betina 1989). Aflatoksin sangat toksik serta dapat menyebabkan kanker hati pada manusia dan hewan. FAO/WHO (1999) menetapkan batas kandungan maksimum aflatoksin total pada kacang tanah yang akan diproses sebesar 15 ppb. Menurut Pitt dan Hocking (1996) kandungan aflatoksin lebih dari 1 000 ppb dapat menimbulkan efek toksik akut pada hewan dan manusia.
Biji kacang tanah dapat terserang cendawan dan terkontaminasi aflatoksin apabila kegiatan pascapanen seperti pengeringan, pengupasan polong, dan penyimpanan tidak dilakukan secara layak. Kegiatan pengeringan sangat erat kaitannya dengan kadar air biji-bijian sebelum disimpan, dan sangat mempengaruhi kualitas biji setelah penyimpanan.
Dharmaputra et al. (2005a) melaporkan bahwa kisaran kandungan aflatoksin B1 pada 54
sampel kacang tanah di tingkat pengecer di pasar tradisional Kabupaten Wonogiri dan Kota Surakarta pada musim hujan dan kemarau masing-masing adalah <3.6 - 1 859.3 ppb dan <3.6 - 1 804.6 ppb. Sebanyak 33% sampel pada musim hujan dan 74% sampel pada musim kemarau terkontaminasi aflatoksin B1 lebih dari
15 ppb. Dharmaputra et al. (2005b) juga melaporkan bahwa kisaran kandungan aflatoksin B1 pada 45 sampel kacang tanah di tingkat pengecer di Kabupaten Cianjur pada musim hujan adalah <3.6 - 6 073 ppb. Sebanyak 75.6% sampel terkontaminasi oleh aflatoksin B1
lebih dari 15 ppb.
Menurut Abramson (1991) pertumbuhan cendawan pascapanen pada biji-bijian antara lain dipengaruhi oleh ketersediaan oksigen, kelembaban, dan lamanya penyimpanan. Selain itu Ginting dan Beti (1996) menyatakan bahwa jenis kemasan yang digunakan selama penyimpanan erat kaitannya dengan serangan cendawan. Dengan menekan konsentrasi oksigen di dalam kemasan diharapkan dapat menghambat pertumbuhan cendawan yang menyerang biji kacang tanah dan kontaminasi aflatoksin.
Cara dan sarana penanganan pascapanen termasuk penyimpanan kacang tanah yang tidak layak dapat berpengaruh terhadap kualitas kacang tanah. Oleh karena itu penelitian mengenai pengaruh beberapa jenis bahan kemasan plastik terhadap serangan cendawan dan kontaminasi aflatoksin pada kacang tanah selama penyimpanan adalah penting, agar dapat diperoleh informasi mengenai metode yang paling baik untuk meminimalkan serangan cendawan dan kontaminasi aflatoksin.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan informasi mengenai pengaruh tiga jenis bahan kemasan plastik yang digunakan untuk mengemas kacang tanah pada konsentrasi oksigen normal dan rendah terhadap serangan cendawan pascapanen dan kontaminasi aflatoksin selama penyimpanan. Selain itu juga untuk meneliti kadar air dan persentase biji rusak kacang tanah.
BAHAN DAN METODE
Pemanenan, Pengeringan, dan Pengupasan PolongKacang tanah varietas lokal dipanen setelah cukup umur (kurang lebih 100 hari setelah tanam) dan diperoleh dari petani di Kecamatan Jampangkulon, Kabupaten Sukabumi, Propinsi Jawa Barat, pada bulan April 2005.
Polong langsung dipisahkan dari tanamannya, kemudian dikeringkan dengan bantuan sinar matahari dan menggunakan alas lantai semen, sampai kadar air mencapai ±7%. Kulit polong kacang tanah dikupas menggunakan mesin pengupas diesel tipe kipas putar produk Balai Besar Pengembangan Mekanisasi Pertanian di Serpong, Tangerang. Sebelum disimpan, biji kacang tanah difumigasi fosfin (2 g/ton) selama 5 hari, untuk membunuh semua stadium serangga yang mungkin terdapat di dalam dan di luar biji.
Pengemasan dan Penyimpanan
Sebelum pengemasan biji kacang tanah yang rusak (retak, patah, terserang cendawan, dan berubah warna) disortir, kemudian biji yang tidak rusak dikemas di dalam tiga jenis bahan kemasan plastik (1.5 kg/kantung) pada kondisi dengan konsentrasi oksigen normal (konsentrasi O2 pada awal penyimpanan ±21%) dan
konsentrasi oksigen rendah (konsentrasi O2
pada awal penyimpanan ±10%). Selanjutnya disimpan selama satu, dua, tiga, dan empat bulan pada kondisi gudang. Pengukuran konsentrasi oksigen rendah di dalam kantung plastik disajikan pada Gambar 1.
Tiga jenis bahan kemasan plastik yang digunakan diberi kode OPP, NY 80, dan NY 70. Karakteristik masing-masing jenis kemasan plastik disajikan pada Lampiran 1. Kantung plastik diproduksi oleh PT Interkemas Flexipack, Tangerang. Setiap jenis kantung plastik digunakan untuk mengemas biji kacang tanah dengan konsentrasi oksigen, lama penyimpanan, dan ulangan yang berbeda. Untuk setiap perlakuan dibuat empat ulangan. Dengan demikian jumlah satuan percobaan adalah 3 x 2 x 5 x 4 =120 (3 = jenis bahan kemasan plastik; 2 = konsentrasi oksigen; 5 = lama penyimpanan; 4 = ulangan). Satuan percobaan pada berbagai kombinasi perlakuan disajikan pada Lampiran 2.
Biji kacang tanah yang dikemas di dalam kantung plastik dengan konsentrasi oksigen normal dan rendah dapat dilihat pada Gambar 2, sedangkan kantung-kantung plastik berisi kacang tanah yang diletakkan secara acak pada rak kayu disajikan pada Gambar 3. Suhu dan
kelembaban ruang simpan dicatat dengan menggunakan termohigrograf merek Haar-Synth Hygro, setiap hari pada pukul 08.00, 12.00, dan 16.00 WIB. Cara perhitungan suhu dan kelembaban relatif rata-rata harian disajikan pada Lampiran 3.
Gambar 1 Pengukuran konsentrasi oksigen rendah di dalam kantung plastik menggunakan cosmotector merek COSMOS, model No. XPO -318.
Gambar 2 Biji kacang tanah yang dikemas di dalam kantung plastik dengan konsentrasi O2 normal (a) dan
rendah (b).
Gambar 3 Kantung-kantung plastik berisi biji kacang tanah yang diletakkan secara
±375 g ±375 g ±375 g ±375 g ±187.5 g ±187.5 g ±187.5 g ±187.5 g ±187.5 g ± 187.5 g ± 1500 g ± 750 g ± 750 g ±187.5 g
Pengambilan Sampel dan Cara Memperoleh Sampel Kerja
Pengambilan sampel dilakukan pada aw al penyimpanan, selanjutnya setelah satu, dua, tiga, dan empat bulan penyimpanan. Sampel diperoleh dari setiap kantung. Kantung plastik berisi kacang tanah yang diambil setiap bulan berjumlah 3 x 2 x 4 = 24 (3 = jenis bahan kemasan plastik; 2 = konsentrasi oksigen; 4 = ulangan).
Setiap sampel yang berasal dari satu kantung plastik dibagi tiga kali menggunakan pembagi sampel berbentuk boks (box divider) untuk mendapatkan sampel kerja, yaitu sampel untuk penentuan kadar air, persentase biji rusak, populasi cendawan, kandungan aflatoksin B1, dan sampel cadangan. Skema cara memperoleh sampel kerja untuk berbagai penentuan disajikan pada Gambar 4.
Penentuan Kadar Air dan Persentase Biji Rusak
Kadar air kacang tanah (berdasarkan bobot basah) ditentukan dengan menggunakan metode oven (AOAC 2000). Biji kacang tanah digiling terlebih dahulu menggunakan blender merek Nasionaltech hingga diperoleh partikel berukuran <2 mm. Sebanyak 5 g dari setiap sampel biji kacang tanah yang telah digiling ditempatkan di dalam cawan alumunium, kemudian dikeringkan di dalam oven pada suhu 105 oC selama 5 jam. Dari setiap ulangan dibuat dua subulangan.
Kadar air sampel berdasarkan bobot basah ditentukan dengan menggunakan rumus:
% Kadar air = [(m1-m2)/(m1-m0)] x 100
m0 = berat cawan alumunium (g)
m1 = berat cawan alumunium dan sampel
sebelum dikeringkan (g)
m2 = berat cawan alumunium dan sampel
setelah dikeringkan (g)
Biji rusak meliputi biji terserang cendawan dan biji berubah warna. Biji rusak kacang tanah disajikan pada Gambar 5. Persentase biji rusak pada setiap sampel ditentukan dengan menggunakan rumus:
% Biji rusak=
jumlah biji rusak x 100
jumlah seluruh biji yang digunakan untuk penentuan persentase biji rusak
Gambar 5 Biji rusak kacang tanah.
Penentuan Populasi Total Cendawan dan
A. flavus
Populasi setiap spesies cendawan (selain A.
flavus) ditentukan dengan metode pengenceran
berderet yang dilanjutkan dengan metode cawan tuang pada media Dichloran 18% Glycerol
Agar (DG18) (Pitt et al. 1980; Pitt et al. 1992).
Populasi A. flavus ditentukan dengan metode yang sama pada media Aspergillus Flavus and
Parasiticus Agar (AFPA) (Pitt et al . 1983).
Komposisi media DG18 dan AFPA disajikan pada Lampiran 4.
a b c d e f g h Gambar 4 Skema cara memperoleh sampel kerja. a dan e: sampel untuk penentuan populasi
cendawan, b dan f: sampel untuk penentuan persentase biji rusak, c dan g: sampel untuk penentuan kandungan aflatoksin B1, d dan h: sampel untuk penentuan kadar air dan sampel
cadangan.
Biji kacang tanah digiling menggunakan blender merek Nasionaltech hingga diperoleh partikel berukuran <2 mm. Sebanyak 25 g dari setiap sampel biji kacang tanah yang telah digiling ditempatkan di dalam gelas ukur volume 500 ml, kemudian ditambahkan akuades steril hingga volumenya mencapai 250 ml, dengan demikian diperoleh suspensi kacang tanah dengan pengenceran 1:10. Gelas ukur tersebut digoyang dengan tangan kemudian suspensi dipindahkan ke dalam labu Erlenmeyer volume 500 ml, selanjutnya digoyang dengan mesin pengocok (shaker) merek Kottermann 4020 dengan kecepatan 150 rpm selama 2 menit. Sebanyak 10 ml suspensi tersebut dipipet dan ditempatkan di dalam labu Erlenmeyer 250 ml, kemudian ditambahkan 90 ml akuades steril, selanjutnya digoyang dengan mesin pengocok dengan kecepatan 150 rpm selama 2 menit, sehingga diperoleh pengenceran 1:100. Dengan cara yang sama dibuat pengenceran 1:1 000. Sebanyak 1 ml suspensi kacang tanah dari setiap pengenceran dipindahkan dengan pipet steril ke dal am setiap cawan Petri (diameter 9 cm), kemudian dituang sebanyak 12 ml media DG18 atau AFPA yang suhunya ±45
o
C. Selanjutnya diinkubasi pada suhu ruang (±28 oC) selama 7 hari untuk media DG18 dan 4 hari untuk media AFPA. Untuk masing-masing media, setiap pengenceran dibuat di dalam tiga cawan Petri.
Populasi setiap spesies cendawan (termasuk
A. flavus) per gram kacang tanah (berdasarkan
bobot basah) ditentukan dengan menggunakan rumus:
Populasi setiap spesies cendawan/g (bobot basah) kacang tanah
.
Z
.
1
Y
X
=
X=Volume suspensi kacang tanah yangdipindahkan ke setiap cawan Petri (1 ml). Y=Pengenceran yang memberikan koloni
cendawan terpisah.
Z=Rata-rata jumlah koloni setiap spesies cendawan dari tiga cawan Petri.
Identifikasi cendawan dilakukan dengan terlebih dahulu memindahkan sekelumit hifa dari koloni setiap spesies cendawan yang dibedakan berdasarkan warna dan pola pertumbuhannya ke media Czapek Yeast Extract
Agar (CYA) dan Czapek Yeast Extract Agar + 20% Sucrose (CY20S). Selanjutnya cendawan
diidentifikasi berdasarkan pustaka acuan Pitt dan Hocking (1997). Media CYA digunakan untuk mengidentifikasi cendawan pascapanen selain Eurotium , sedangkan media CY20S
untuk mengidentifikasi Eurotium. Komposisi media CYA dan CY20S dapat dilihat pada Lampiran 4.
Penentua n Kandungan Aflatoksin B1
Jenis aflatoksin yang dianalisis adalah B1
(Gambar 6)karena merupakan jenis aflatoksin yang paling berbahaya diantara jenis aflatoksin lainnya dan sering dijumpai pada bahan pangan. Kandungan aflatoksin B1 ditentukan dengan
met ode ELISA (Enzyme-Linked Immunosorbent
Assay) (Lee & Kennedy 2002).
O O OCH3
O
O O
Gambar 6 Struktur kimia aflatoksin B1.
Prinsip dasar metode ELISA adalah mengekstrak sampel dengan metanol 80%, kemudian dicampurkan ke dalam plat pencampuran (mixing well) yang telah berisi enzim konjugat. Demikian pula dengan deret standar aflatoksin B1 (30 ppb, 12 ppb, 4.8 ppb,
1.9 ppb, 0.77 ppb, dan 0.31 ppb). Campuran ini kemudian dimasukkan ke dalam plat mikro yang telah dilapisi antibodi, sehingga terjadi kompetisi antara aflatoksin B1 bebas (yang
berasal dari ekstrak sampel maupun standar) untuk berikatan dengan antibodi. Enzim konjugat yang tidak berikatan akan tercuci, sedangkan yang berikatan dengan antibodi akan membentuk warna biru setelah penambahan substrat.
Semakin tinggi kandungan aflatoksin pada sampel maupun standar, maka semakin sedikit enzim konjugat yang berikatan dengan antibodi. Hal ini menyebabkan intensitas warna biru yang terbentuk semakin pudar. Reaksi dihentikan dengan penambahan H2SO4 sehingga terbentuk
warna kuning dan intensitas warna yang terbentuk diukur menggunakan ELISA reader pada panjang gelombang 450 nm.
Tahapan yang dilakukan untuk menganalisis aflatoksin B1 adalah sebagai berikut:
Ekstraksi Sampel
Sebanyak 75 ml larutan metanol 80% ditambahkan ke dalam 25 g sampel kacang tanah yang telah digiling hingga berukuran 50 mesh, kemudian dikocok dengan menggunakan alat pengocok (shaker) merek Kotterman 4020 selama 15 menit (250 rpm). Larutan jernih ekstrak sampel y ang diperoleh setelah penyaringan diencerkan dengan akuades (1:1) terlebih dahulu sebelum digunakan.
Persiapan Kurva Standar Aflatoksin B1 Dari larutan stok standar aflatoksin B1 9.47 ppm didalam metanol, dipipet sebanyak 15.84
µl ke dalam labu ukur 5 ml dan ditambahkan metanol 40% sampai tanda tera sehingga diperoleh larutan standar aflatoksin B1 dengan
konsentrasi 30 ppb.
Sebanyak 2 ml larutan standar aflatoksin B1
30 ppb dipipet ke dalam labu ukur 5 ml kedua dan ditambahkan 3 ml metanol 40% sehingga diperoleh larutan standar aflatoksin B1 dengan
konsentrasi 12 ppb.
Sebanyak 2 ml larutan standar aflatoksin B1
12 ppb dipipet ke dalam labu ukur 5 ml ketiga dan ditambahkan 3 ml metanol 40% sehingga diperoleh larutan standar aflatoksin B1 dengan
konsentrasi 4.8 ppb.
Sebanyak 2 ml larutan standar aflatoksin B1
4.8 ppb dipipet ke dalam labu ukur 5 ml keempat dan ditambahkan 3 ml metanol 40% sehingga diperoleh larutan standar aflatoksin B1
dengan konsentrasi 1.9 ppb.
Sebanyak 2 ml larutan standar aflatoksin B1
1.9 ppb dipipet ke dalam labu ukur 5 ml kelima dan ditambahkan 3 ml metanol 40% sehingga diperoleh larutan standar aflatoksin B1 dengan
konsentrasi 0.77 ppb.
Sebanyak 2 ml larutan standar aflatoksin B1
0.77 ppb dipipet ke dalam labu ukur 5 ml keenam dan ditambahkan 3 ml metanol 40% sehingga diperoleh larutan standar aflatoksin B1
dengan konsentrasi 0.31 ppb.
Persiapan Plat Mikro Antibodi
Sebanyak 56.45 µl stok murni antibodi (ANNA #5 Rab α Aflatoksin B1 3.72 µg/ml)
dilarutkan ke dalam 21 ml larutan salutan (bufer karbonat), setelah itu dikocok dengan menggunakan vorteks merek Paramix II. Sebanyak 100 µl larutan antibodi tersebut dimasukkan ke dalam masing-masing sumur pada plat mikro dengan menggunakan pipet mikro, kemudian diinkubasi selama satu malam pada suhu kamar. Selanjutnya plat mikro dicuci
dengan akuades sebanyak tiga kali, kemudian dikeringkan dengan tisu dan ditambahkan 200
µl larutan perebat (blocking solution) berupa 1% fish hydrosate di dalam phosphate buffer
saline ke dalam masing-masing sumur . Setelah
itu diinkubasi selama satu jam pada suhu ruang, kemudian dicuci kembali sebanyak tiga kali dengan akuades.
Cara Kerja Pengujian
Sebelum memulai analisis, dibuat peta plat mikro yang mencakup blangko, kontrol, standar, dan sampel (Gambar 7).
Pada plat pencampuran (plat tanpa antibodi), 100 µl larutan enzim konjugat dimasukkan ke dalam masing-masing sumur kecuali pada sumur blangko ditambahkan 100 µl pengencer (1% fish hydrosate di dalam phosphate buffer
saline).
Sebanyak 50 µl metanol 40% dimasukkan ke dalam sumur blangko dan kontrol. Ke dalam sumur standar dan sampel dimasukkan masing-masing 50 µl standar dan sampel seperti tercantum pada peta plat mikro. Setelah itu campuran dibuat homogen dengan cara menggoyangkan plat mikro secara perlahan pada permukaan yang rata.
Dengan menggunakan 8-channel multipipette, 50 µl campuran di dalam plat pencampuran dipindahkan ke dalam plat yang telah berisi antibodi dan dibiarkan selama 5 menit. Setelah itu plat dicuci tiga kali dengan akuades dan dikeringkan di atas tisu. Sebanyak 100 µl larutan substrat dimasukkan ke dalam masing-masing sumur dengan menggunakan
8-channel multipipette . Setelah itu dibiarkan
selama 10 menit pada suhu kamar, kemudian reaksi dihentikan dengan penambahan 50 µl larutan H2SO4 1.25 M. Absorbansi warna
kuning yang terbentuk dibaca dengan menggunakan ELISA reader pada panjang gelombang 450 nm.
1 2 3 4 5 6 7 8 9 10 11 12
A
Blangko Blangko Sampel Sampel Blangko Blangko Sampel Sampel Blangko Blangko Sampel Sampel
B 30 ppb 30 ppb Sampel Sampel 30 pp b 30 ppb Sampel Sampel 30 ppb 30 ppb Sampel Sampel C 12 ppb 12 ppb Sampel Sampel 12 ppb 12 ppb Sampel Sampel 12 ppb 12 ppb Sampel Sampel D 4.8 ppb 4.8 ppb Sampel Sampel 4.8 ppb 4.8 ppb Sampel Sampel 4.8 ppb 4.8 ppb Sampel Sampel E 1.9 ppb 1.9 ppb Sampel Sampel 1.9 ppb 1.9 ppb Sampel Sampel 1.9 ppb 1.9 ppb Sampel Sampel F 0.77 ppb 0.77 ppb Sampel Sampel 0.77 ppb 0.77 ppb Sampel Sampel 0.77 ppb 0.77 ppb Sampel Sampel G 0.31 ppb 0.31 ppb Sampel Sampel 0.31 ppb 0.31 ppb Sampel Sampel 0.31 ppb 0.31 ppb Sampel Sampel H
Kontrol Kontrol Sampel Sampel Kontrol Kontrol Sampel Sampel Kontrol Kontrol Sampel Sampel
Penghitungan Konsentrasi Aflatoksin B1 Nilai absorbansi yang diperoleh digunakan untuk menghitung persentase inhibisi standar dan sampel. Persentase inhibisi standar dan sampel dihitung dengan menggunakan program
excell dengan rumus sebagai berikut:
% Inhibisi standar/sampel =
1- A standar/sampel-A blangko x 100 A kontrol-A blangko
Persentase inhibisi standar yang telah diperoleh kemudian di plotkan dengan konsentrasi standar aflatoksin B1 untuk
memperoleh kurva standar. Dalam hal ini persentase inhibisi sebagai sumbu y dan konsentrasi aflatoksin B1 sebagai sumbu x.
Kurva standar diperoleh dengan menggunakan bantuan program excell. Untuk mengetahui konsentrasi aflatoksin B1 sampel digunakan
rumus baku menurut Lee dan Kennedy (2002). Penghitungan konsentrasi aflatoksin B1 sampel
juga menggunakan bantuan program excell. Konsentrasi aflatoksin B1 sampel yang
diperoleh kemudian dikalikan dengan faktor pengenceran, sehingga konsentrasi aflatoksin B1
sampel yang sebenarnya dapat diketahui. Rancangan Percobaan
Data dianalisis dengan menggunakan rancangan acak lengkap faktorial dengan tiga faktor. Faktor pertama adalah jenis bahan kemasan plastik dengan tiga taraf, yaitu OPP, NY 80, dan NY 70; faktor kedua adalah konsentrasi oksigen dengan dua taraf, yaitu konsentrasi oksigen normal (±21%) dan konsentrasi oksigen rendah (±10%); faktor ketiga adalah lama penyimpanan dengan lima taraf, yaitu awal penyimpanan, satu bulan, dua bulan, tiga bulan, dan empat bulan penyimpanan. Setiap kombinasi perlakuan dibuat empat ulangan.
Model linier dari rancangan acak lengkap faktorial (Steel & Torrie 1995) sebagai berikut: Yijk = µ + αi + βj + γk + (αβ)ij + (αγ)ik + (βγ)j k +
(αβγ)ijk + εijkl
Keterangan :
i = 1,2,3 (taraf jenis bahan kemasan plastik) j = 1,2 (taraf konsentrasi oksigen)
k = 0,1,2,3,4 (taraf lama penyimpanan) l = 1,2,3,4 (ulangan)
Yijkl =Nilai pengamatan pada faktor jenis bahan kemasan plastik taraf ke-i, faktor taraf oksigen taraf ke-j, faktor lama
penyimpanan taraf ke -k, dan ulangan ke -l
µi = Rataan umum
αi = Pengaruh faktor jenis bahan kemasan plastik ke-i
βj = Pengaruh faktor konsentrasi oksigen taraf ke-j
γk = Pengaruh faktor lama penyimpanan taraf ke -k
(αβ)ij = Pengaruh interaksi faktor jenis bahan
kemasan plastik taraf ke-i dan faktor konsentrasi oksigen taraf ke-j (αγ)ik =Pengaruh interaksi faktor jenis bahan
plastik taraf ke-i dan faktor lama penyimpanan taraf ke-k
(βγ)jk = Pengaruh interaksi faktor konsentrasi
oksigen taraf ke-j dan faktor lama penyimpanan taraf ke-k
(αβγ)ijk = Pengaruh interaksi faktor jenis bahan
plastik taraf ke-i, faktor konsentrasi oksigen taraf ke-j dan faktor lama penyimpanan taraf ke-k
εijkl = Pengaruh acak pada faktor jenis bahan plastik taraf ke-i, faktor konsentrasi oksigen taraf ke-j dan faktor lama penyimpanan taraf ke-k, ulangan ke -l
HASIL DAN PEMBAHASAN
Kadar AirKadar air awal biji merupakan salah satu faktor yang berpengaruh terhadap kerusakan biji-bijian selama penyimpanan. Kadar air awal yang tinggi memberikan peluang besar bagi pertumbuhan dan perkembangan cendawan. SNI (1995) menetapkan salah satu persyaratan mutu biji kacang tanah yaitu kadar airnya berkisar 6-8%.
Berdasarkan analisis ragam, jenis bahan kemasan plastik, lama penyimpanan, interaksi antara jenis bahan kemasan plastik dan lama penyimpanan, interaksi antara konsentrasi oksigen dan lama penyimpanan, interaksi antara jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan tidak memberikan pengaruh yang nyata terhadap kadar air biji kacang tanah, sedangkan konsentrasi oksigen memberikan pengaruh yang nyata. Interaksi antara jenis bahan kemasan plastik dan konsentrasi oksigen memberikan pengaruh yang sangat nyata terhadap kadar air biji kacang tanah (Lampiran 5).
Kadar air kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 70 pada konsentrasi oksigen rendah berbeda nyata
dengan kadar air kacang tanah yang dikemas di dalam jenis bahan kemasan plastik yang sama pada konsentasi oksigen normal. Kedua jenis bahan kemasan plastik lainnya (OPP dan NY 80) tidak memberikan perbedaan yang nyata antara kadar air kacang tanah yang dikemas pada konsentrasi oksigen normal dan rendah (Tabel 1).
Tabel 1 Pengaruh interaksi antara jenis bahan kemasan plastik dan konsentrasi oksigen terhadap kadar air kacang tanah selama penyimpanan
Jenis bahan kemasan
plastik
Kadar air kacang tanah (%) Konsentrasi O2 Normal (±21%) Rendah (±10%) OPP 6.75 abc 6.70 cd NY 80 6.71 bcd 6.78 ab NY 70 6.79 a 6.65 d
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf kepercayaan 95%.
Kadar air tertinggi (6.79%) yaitu pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 70 pada konsentrasi oksigen normal (Tabel 1). Hal ini kemungkinan berkaitan dengan nilai laju transmisi uap air jenis bahan kemasan plastik NY 70 (0.6340 g/m2 24 jam) yang lebih tinggi dibandingkan nilai laju transmisi uap air jenis bahan kemasan plastik OPP (0.3053 g/m2 24 jam) dan NY 80 (0.4805 g/m2 24 jam) (Lampiran 1). Diasumsikan bahwa kecepatan transfer uap air pada jenis bahan kemasan plastik NY 70 lebih tinggi dibandingkan kedua jenis bahan kemasan plastik lainnya (OPP dan NY 80), sehingga kadar air kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 70 lebih tinggi. Selain itu mungkin berkaitan dengan ukuran pori, permeabilitas, dan ketebalan bahan kemasan NY 70. Kadar air terendah (6.65%) yaitu pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 70 pada konsentrasi oksigen rendah. Kadar air kacang tanah untuk semua perlakuan tergolong kadar
air yang aman untuk penyimpanan kacang tanah.
Meskipun lama penyimpanan tidak memberikan pengaruh yang nyata terhadap kadar air kacang tanah, namun terlihat adanya perubahan kadar air selama penyimpanan (Tabel 2). Perubahan ini berkaitan dengan kelembaban relatif ruang penyimpanan. Menurut Christensen et al. (1992) kadar air biji berada dalam keseimbangan dengan kelembaban relatif ruang simpan. Untuk mencapai keseimbangan tersebut biji-bijian dapat mengalami kehilangan kelembaban atau mengabsorbsi kelembaban dari lingkungannya. Biji yang disimpan di ruangan dengan kelembaban relatif yang tinggi akan mengabsorbsi kelembaban dari lingkungannya. Sebaliknya, biji akan mengalami kehilangan kelembaban jika disimpan di ruangan dengan kelembaban relatif yang rendah. Menurut Bala (1997) selain dipengaruhi oleh kelembaban relatif, keseimbangan kadar air ini juga dipengaruhi oleh suhu. Kisaran suhu dan kelembaban relatif ruang simpan selama penyimpanan masing-masing 25.5-28.1 oC dan 62.8-80.0% (Tabel 3).
Tabel 2 Kadar air kacang tanah selama empat bulan penyimpanan
Lama penyimpanan
(bulan) Kadar air (%)
0 6.71
1 6.77
2 6.76
3 6.71
4 6.70
Kadar air dipengaruhi oleh aktivitas respirasi biji, aktivitas serangga dan cendawan. Mikroorganisme memanfaatkan nutrisi pada biji dan mengeluarkan air sebagai hasil metabolisme Semakin tinggi suhu, semakin tinggi pula kecepatan pertumbuhan cendawan dan produksi mikotoksin (Richardson 1999). Kelembaban yang tinggi juga mendukung perkembangan Tabel 3 Kisaran dan rata-rata suhu, serta kelembaban relatif ruang simpan selama penyimpanan
Penyimpanan bulan ke - Suhu (
o
C) Kelembaban relatif (%) Kisaran Rata-rata Kisaran Rata-rata
0-1 25.8-28.1 27.0 67.5-79.0 72.1
1-2 25.6-27.1 26.3 63.5-80.0 72.5
2-3 25.5-26.6 26.0 62.8-74.0 69.0
cendawan dan produksi aflatoksin. Suhu dan kadar air yang rendah tidak akan menyebabkan cendawan mati melainkan hanya menyebabkan dorm an dan pertumbuhannya terhambat (Douglas & Boyle 1996). Menurut Lacey dan Magan (1991) diantara mikroorganisme yang mengkolonisasi biji-bijian, cendawan merupakan mikroorganisme yang paling toleran terhadap ketersediaan air yang rendah, sehingga paling berperan dalam kerusakan biji.
Persentase Biji Rusak
Berdasarkan analisis ragam, jenis bahan kemasan plastik, konsentrasi oksigen, interaksi antara jenis bahan kemasan plastik dan konsentrasi oksigen, interaksi antara jenis bahan kemasan plastik dan lama penyimpanan, interaksi antara konsentrasi oksigen dan lama penyimpanan, interaksi antara jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan tidak memberikan pengaruh yang nyata terhadap persentase biji rusak. Lama penyimpanan memberikan pe ngaruh yang sangat nyata terhadap persentase biji rusak (Lampiran 6).
Persentase biji rusak meningkat selama empat bulan penyimpanan. Persentase biji rusak pada awal penyimpanan berbeda nyata dengan persentase biji rusak setelah satu, dua, tiga, dan empat bulan penyimpanan. Persentase biji rusak setelah satu bulan penyimpanan tidak berbeda nyata dengan persentase biji rusak setelah dua bulan penyimpanan, namun berbeda nyata dengan persentase biji rusak setelah tiga dan empat bulan penyimpanan (Tabel 4). Persentase biji rusak tertinggi (5.31%) yaitu setelah empat bulan penyimpanan. SNI (1995) menetapkan bahwa persyaratan mutu biji rusak kacang tanah adalah 0-2%.
Tabel 4 Persentase biji rusak kacang tanah selama penyimpanan
Lama penyimpanan
(bulan) Biji rusak (%)
0 3.07 d
1 3.82 c
2 4.13 c
3 4.71 b
4 5.31 a
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf kepercayaan 95%.
Keberadaan biji rusak pada awal penyimpanan kemungkinan disebabkan antara lain oleh penyortiran yang tidak dapat dilakukan
secara sempurna sebelum biji kacang tanah dikemas. Menurut Christensen et al. (1992) peningkatan persentase biji rusak selama penyimpanan antara lain disebabkan oleh serangan cendawan. Cendawan menyerang biji utuh dengan terlebih dahulu melakukan penetrasi pada kulit biji, merusak testa dan embrio, serta mendekomposisi granula pati pada endosperma (Schmidt 1991). Dharmaputra et al. (1991) melaporkan bahwa pada sampel kacang tanah yang diperoleh dari beberapa pasar tradisional di Bogor, populasi A. flavus pada biji rusak lebih tinggi daripada biji utuh. Blakenship
et al. (1985) melaporkan bahwa pada berbagai
kultivar kacang tanah yang dianalisis, kandungan aflatoksin paling tinggi terdapat pada biji r usak.
Populasi Total Cendawan
Berdasarkan analisis ragam, jenis bahan kemasan plastik, interaksi antara jenis bahan kemasan plastik dan konsentrasi oksigen, interaksi antara jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan tidak memberikan pengaruh yang nyata terhadap populasi total cendawan. Interaksi antara jenis bahan kemasan plastik dan lama penyimpanan memberikan pengaruh yang nyata. Konsentrasi oksigen, lama penyimpanan, dan interaksi keduanya memberikan pengaruh yang sangat nyata terhadap populasi total cendawan (Lampiran 7).
Setelah empat bulan penyimpanan populasi total cendawan tertinggi (1.72 x 104 koloni/g b.b) terdapat pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP (Tabel 5). Hal ini berkaitan den gan nilai laju transmisi oksigen jenis bahan kemasan plastik OPP, yaitu sebesar 37.6800 cc/m2 24 jam (Lampiran 3). Nilai laju transmisi oksigen jenis bahan kemasan plastik OPP lebih tinggi dibandingkan dengan kedua jenis bahan kemasan lainnya (NY 80 dan NY 70), sehingga lebih mendukung transfer oksigen dari lingkungan. Hal ini diasumsikan berakibat terhadap tingginya kecepatan pertumbuhan dan perkembangan cendawan pada kacang tanah yang dikemas di dalamnya. Setelah empat bulan penyimpanan populasi total cendawan terendah (9.06 x 103 koloni/g b.b) terdapat pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 80.
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf kepercayaan 95%. T: Transformasi log (x), TP: Tidak ditransformasi.
Populasi total cendawan pada konsentrasi oksigen normal tidak berbeda nyata dengan konsentrasi oksigen rendah pada awal hingga tiga bulan penyimpanan (Tabel 6)
.
Perbedaan yang nyata antara populasi total cendawan pada konsentrasi oksigen normal dan rendah terlihat setelah empat bulan penyimpanan.Pada Tabel 6 juga dapat dilihat bahwa setelah empat bulan penyimpanan populasi total cendawan tertinggi (2.43 x 104 koloni/g b.b)
terdapatpada kacang tanah yang dikemas pada konsentrasi oksigen normal, sedangkan yang terendah (2.28 x 103 koloni/g b.b) terdapat pada kacang tanah yang dikemas pada konsentrasi oksigen rendah. Populasi total cendawan pada kacang tanah y ang dikemas pada konsentrasi oksigen normal setelah satu, tiga, dan empat bulan penyimpanan lebih tinggi daripada yang dikemas pada konsentrasi oksigen rendah.
Cendawan merupakan mikroorganisme yang bersifat aerob obligat, sehingga dapat diasumsikan pertumbuhannya akan terhambat pada konsentrasi oksigen rendah. Menurut Garraway dan Evans (1984) pertumbuhan cendawan pada umumnya meningkat dengan meningkatnya konsentrasi oksigen. Walaupun demikian, konsentrasi oksigen yang dibutuhkan untuk pertumbuhan optimum spesies cendawan tertentu mungkin relatif rendah. Dharmaputra et
al. (2000) melaporkan bahwa populasi total
cendawan pada jagung dengan kadar air awal 14, 17, dan 20% yang dikemas di dalam kantung polietilena pada kondisi kedap udara (konsentrasi O2 ±1.4%) lebih rendah daripada
yang dikemas pada kondisi normal (konsentrasi O2±21%).
Pada Tabel 5 dan 6 dapat dilihat bahwa secara umum populasi total cendawan pada kacang tanah meningkat selama penyimpanan. Dharmaputra et al. (1993) juga melaporkan bahwa pop ulasi cendawan pada beras cenderung meningkat seiring dengan lamanya penyimpanan.
Melalui Surat Keputusan Nomor 03726/B/SK/VII/89 tertanggal 10 Juli 1985, Direktur Jendral Pengawasan Obat dan Makanan menetapkan batas maksimum populasi cendawan dalam makanan yaitu 104 koloni/g. Pada Tabel 6 terlihat bahwa setelah empat bulan penyimpanan populasi total cendawan pada kacang tanah yang dikemas pada konsentrasi oksigen normal (2.43 x 104 koloni/g b.b) telah melebihi batas maksimum tersebut. Oleh karena itu lama penyimpanan biji kacang tanah pada konsentrasi oksigen normal hendaknya tidak melebihi tiga bulan. Pada penyimpanan tiga bulan populasi total cendawan masih lebih rendah daripada batas maksimum populasi cendawan.
Tabel 6 Pengaruh interaksi antara konsentrasi oksigen dan lama penyimpanan terhadap populasi total cendawan pada kacang tanah
Lama penyimpanan (bulan)
Populasi total cendawan (koloni/g b.b)
Konsentrasi O2 normal Konsentrasi O2 rendah
T T P T T P 0 1.91 d 7.30 x 10 1.99 d 8.70 x 10 1 2.40 c 3.67 x 102 2.34 c 2.36 x 102 2 2.42 c 2.85 x 102 2.51 c 3.75 x 102 3 3.22 b 2.37 x 103 3.20 b 2.34 x 103 4 4.19 a 2.43 x 104 3.24 b 2.28 x 103
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf kepercayaan 95%. T : Transformasi log (x), TP: Tidak ditransformasi.
Lama penyimpanan
(bulan)
Populasi total cendawan (koloni/g b.b)
OPP NY 80 NY 70 T T P T T P T T P 0 1.92 g 7.60 x 10 1.91 fg 7.80 x 10 2.01 ef 8.70 x 10 1 2.27 de 1.95 x 102 2.19 ef 1.57 x 102 2.69 c 5.53 x 102 2 2.54 cd 3.64 x 102 2.25 de 1.85 x 102 2.58 c 4.42 x 102 3 3.13 b 2.13 x 103 3.32 b 2.76 x 103 3.18 b 2.18 x 103 4 3.76 a 1.72 x 104 3.77 a 9.06 x 103 3.62 a 1.35 x 104
Berdasarkan hasil isolasi, tidak terdapat perbedaan jumlah spesies cendawan pada kacang tanah yang dikemas baik pada konsentrasi oksigen normal maupun pada konsentrasi oksigen rendah (Lampiran 10). Diasumsikan bahwa cendawan-cendawan tersebut mampu tumbuh pada kisaran konsentrasi oksigen yang luas. Menurut Lacey dan Magan (1991) meskipun cendawan bersifat aerob, namun kebutuhannya terhadap oksigen seringkali diluar kisaran pada umumnya dan cendawan tersebut mampu tumbuh pada konsentrasi oksigen yang sangat rendah. Pada jagung, pertumbuhan cendawan lebih dipengaruhi oleh penurunan aktivitas air dari 1.0 menjadi 0.7 dibandingkan penurunan konsentrasi oksigen dari 21% menjadi 1%.
Selama empat bulan penyimpanan sebanyak sembilan spesies cendawan telah diisolasi dari semua perlakuan, yaitu Aspergillus flavus, A.
niger, A. penicillioides, A. tamarii, Eurotium chevalieri, Fusarium solani, Mucor hiemalis, Penicillium citrinum, dan Syncephalastrum racemosum (Lampiran 10). Cendawan yang
selalu terisolasi dari semua perlakuan selama penyimpanan adalah A. flavus dan A. niger.
Populasi A. penicillioides mulai meningkat setelah satu bulan penyimpanan, dan merupakan cendawan dominan pada kacang tanah sejak populasinya mulai meningkat. Pitt dan Hocking (1997) melaporkan bahwa populasi A. penicillioides yang tinggi ditemukan pada
berbagai jenis bahan pangan. Aspergillus
penicillioides umum dijumpai pada bahan
pangan yan g memiliki aktivitas air rendah (Samson et al.1996; Pitt & Hocking 1997). Diasumsikan bahwa selama penyimpanan aktivitas air kacang tanah menurun sehingga populasi A. penicillioides cenderung meningkat (Lampiran 10). Selain itu diduga penurunan tersebut masih pada kisaran aktivitas air yang memungkinkan untuk pertumbuhan A. penicillioides. Hasil isolasi cendawan pada
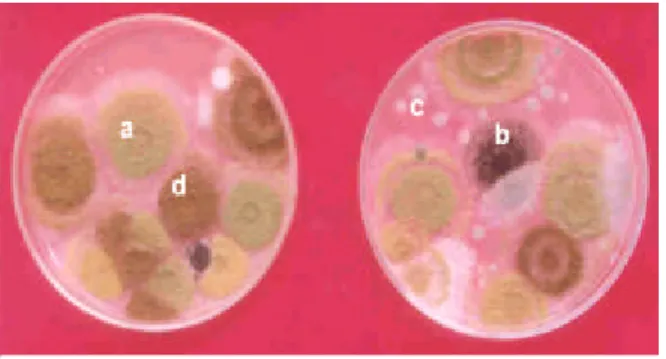
kacang tanah pada awal penyimpanan disajikan pada Gambar 8, sedangkan hasil isolasi cendawan pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP, NY 80, dan NY 70 pada konsentrasi oksigen normal dan rendah setelah empat bulan penyimpanan pada media DG18 disajikan pada Gambar 9.
Gambar 8 Hasil isolasi cendawan pada kacang tanah yang dikemas di dalam tiga jenis bahan kemasan plastik pada awal penyimpanan. Media untuk isolasi cendawan: DG18. Faktor pengenceran: 10-1. a = Aspergillus flavus ; b = A. niger ; c = A. penicillioides; d = A.
Populasi A. flavus
Berdasarkan analisis ragam, jenis bahan kemasan plastik, konsentrasi oksigen, interaksi antara jenis bahan kemasan plastik dan konsentrasi oksigen, interaksi antara jenis bahan kemasan plastik dan lama penyimpanan, interaksi antara konsentrasi oksigen dan lama penyimpanan tidak memberikan pengaruh yang nyata terhadap populasi A. flavus. Lama penyimpanan, interaksi antara jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan memberikan pengaruh yang sangat nyata terhadap populasi A. flavus (Lampiran 8).
Setelah empat bulan penyimpanan populasi
A. flavus tertinggi (65.0 koloni/g b.b) terdapat
pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 70 pada konsentrasi oksigen normal, sedangkan yang terendah (25.3
koloni/g b.b) terdapat pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 70 pada konsentrasi oksigen rendah (Tabel 7).
Selama penyimpanan populasi A. flavus mengalami fluktuasi (Tabel 7), kemungkinan disebabkan oleh adanya cendaw an yang bersifat antagonis atau kompetitif terhadap A. flavus. Menurut Lacey dan Magan (1991) keberadaan
A. flavus selama penyimpanan dipengaruhi oleh
temperatur, aktivitas air, komposisi gas, dan interaksi mikroorganisme. Dharmaputra (2003) melaporkan bahwa A. niger merupakan cendawan yang paling berpotensi dalam menghambat A. flavus toksigen bila dibandingkan dengan A. flavus non-toksigen dan Trichoderma harzianum
.
Tabel 7 Pengaruh interaksi antara jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan terhadap populasi A. flavus pada kacang tanah
Lama penyimpanan
(bulan)
Populasi A. flavus (koloni/g b.b)
Konsentrasi O2 normal Konsentrasi O2 rendah
OPP NY 80 NY 70 OPP NY 80 NY 70
0 49.8 abcdef 52.3 abcde 57.8 abcd 63.8 a 63.5 a 52.3 abcde 1 40.0 bcdefg 56.8 abcd 36.3 defgh 49.3 abcdef 31.8 efghi 39.3 cdefg 2 40.0 bcdefg 26.5 ghi 34.0 efghi 29.0 fghi 20.8 ghi 13.5 i 3 23.8 ghi 23.0 ghi 14.0 hi 41.8 bcdefg 25.0 ghi 39.0 cdefg 4 38.5 cdefg 27.8 fghi 65.0 a 62.0 ab 60.0 abc 25.3 ghi
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf kepercayaan 95%.
Gambar 9 Hasil isolasi cendawan pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP, NY 80 dan NY 70 pada konsentrasi oksigen normal dan rendah setelah empat bulan penyimpanan. Media untuk isolasi cendawan: DG18. Faktor pengenceran: 10- 1.a = Aspergillus flavus; b = A. niger ; c = A. penicillioides.
NY 70 baik pada konsentrasi oksigen normal maupun rendah telah terserang A. flavus pada awal penyimpanan (Tabel 7). Keberadaan A.
flavus pada awal penyimpanan dapat disebabkan oleh serangan A. flavus selama penanganan pascapanen (pengeringan dan pengupasan polong).
Sepert i halnya cendawan lain, A. flavus juga mampu tumbuh pada konsentrasi oksigen rendah (Lampiran 10). Menurut Lacey dan Magan (1991) pertumbuhan A. flavus hanya dapat dihambat pada konsentrasi oksigen
(Heathcote & Hibbert 1978), dan pada kadar air yang rendah (Abramson 1991).
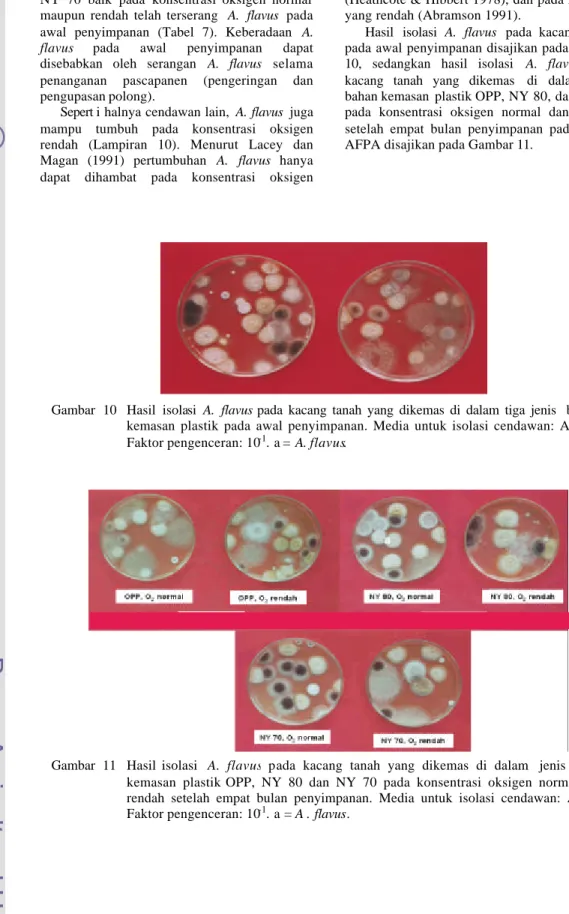
Hasil isolasi A. flavus pada kacang tanah pada awal penyimpanan disajikan pada Gambar 10, sedangkan hasil isolasi A. flavus pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP, NY 80, dan NY 70 pada konsentrasi oksigen normal dan rendah setelah empat bulan penyimpanan pada media AFPA disajikan pada Gambar 11.
a
Gambar 10 Hasil isolasi A. flavus pada kacang tanah yang dikemas di dalam tiga jenis bahan kemasan plastik pada awal penyimpanan. Media untuk isolasi cendawan: AFPA. Faktor pengenceran: 10-1. a = A. flavus.
Gambar 11 Hasil isolasi A. flavus pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP, NY 80 dan NY 70 pada konsentrasi oksigen normal dan rendah setelah empat bulan penyimpanan. Media untuk isolasi cendawan: AFPA. Faktor pengenceran: 10-1. a = A . flavus.
Kandungan Aflatoksin B1
Berdasarkan analisis ragam, interaksi antara jenis bahan kemasan plastik dan konsentrasi oksigen, interaksi antara jenis bahan kemasan plastik, konsentrasi oksigen, dan lama penyimpanan tidak memberikan pengaruh yang nyata terhadap kandungan aflatoksin B1 pada
kacang tanah. Interaksi antara konsentrasi oksigen dan lama penyimpanan memberikan pengaruh yang nyata, sedangkan jenis bahan kemasan plastik, konsentrasi oksigen, lama penyimpanan, interaksi antara jenis bahan kemasan plastik dan lama penyimpanan memberikan pengaruh yang sangat nyata terhadap kandungan aflatoksin B1 pada kacang
tanah (Lampiran 9).
Berbeda halnya dengan populasi A. flavus yang mengalami fluktuasi selama penyimpanan (Tabel 7), kandungan aflatoksin B1 pada kacang
tanah meningkat selama pe nyimpanan (Tabel 8 dan 9). Hal ini menunjukkan bahwa populasi A.
flavus tidak berkorelasi positif dengan kandungan aflatoksin B1. Dharmaputra et al.
(1991) melaporkan bahwa tingginya populasi A.
flavus pada beberapa sampel kacang tanah yang
diperoleh dari beberapa pasar tradisional di Bogor tidak selalu diikuti oleh tingginya kandungan aflatoksin B1 pada sampel tersebut.
Menurut Pitt dan Hocking (1997) produksi aflatoksin bergantung pada galur -galur tertentu
A. flavus. Selain itu, kemungkinan adanya
kompetisi antara A. flavus dengan mikroorganisme lain dalam memanfaatkan substrat juga dapat membatasi atau mengurangi produksi aflatoksin (Diener & Davis 1969). Dharmaputra et al. (2001) melaporkan bahwa
A. niger dan A. flavus non-toksigen mampu
menghambat produksi aflatoksin secara in vitro masing-masing sebesar 80 dan 61%. Peningkatan kandungan aflatoksin B1 pada
kacang tanah selama penyimpanan diasumsikan terjadi karena aflatoksin B1 yang dihasilkan oleh
A. flavus toksigen terakumulasi pada kacang
tanah dan tidak dapat mengalami degradasi oleh mikroorganisme lain.
Pada awal penyimpanan kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP, NY 80, dan NY 70 telah terkontaminasi aflatoksin B1, masing-masing dengan
kandungan sebesar 18.6, 18.8, dan 19.8 ppb (Tabel 8). Kandungan aflatoksin B1 pada awal penyimpanan tidak berbeda nyata pada ketiga jenis bahan kemasan plastik. Keberadaan aflatoksin B1 pada awal penyimpanan dapat
disebabkan terkontaminasinya biji kacang tanah pada waktu pengeringan.
Set elah empat bulan penyimpanan kandungan aflatoksin B1 tertinggi (40.5 ppb)
yaitu terdapat pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 70, sedangkan yang terendah (35.7 ppb) terdapat pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik OPP (Tabel 8).
Tabel 8 Pengaruh interaksi antara jenis bahan kemasan plastik dan lama penyimpanan terhadap kandungan aflatoksin B1 pada kacang tanah
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf kepercayaan 95%.
Setelah empat bulan penyimpanan kandungan aflatoksin B1 tertinggi (38.9 ppb) terdapat pada kacang tanah yang dikemas pada konsentrasi oksigen normal, sedangkan terendah (38.7 ppb) yaitu pada kacang tanah yang dikemas pada konsentrasi oksigen rendah (Tabel 9).
Tabel 9 Penga ruh interaksi antara konsentrasi oksigen dan lama penyimpanan terhadap kandungan aflatoksin B1
pada kacang tanah Lama penyimpanan (bulan) Kandungan aflatoksin B1 (ppb) Konsentrasi O2 normal Konsentrasi O2 rendah 0 19.9 g 18.2 h 1 25.5 e 23.8 f 2 32.0 cd 31.3 c 3 33.2 b 32.6 b 4 38.9 a 38.7 a
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf kepercayaan 95%.
Walaupun kandungan aflatoksin B1 pada
konsentrasi oksigen normal dan rendah setelah dua, tiga, dan empat bulan penyimpanan tidak berbeda nyata, akan tetapi secara umum kandungan aflatoksin B1 pada kacang tanah
yang dikemas pada konsentrasi oksigen normal lebih tinggi daripada yang dikemas pada konsentrasi oksigen rendah. Menurut D iener dan Davis (1969) salah satu faktor yang mempengaruhi produksi aflatoksin pada
Lama penyimpanan (bulan) Kandungan aflatoksin B1 (ppb) OPP NY 80 NY 70 0 18.6 i 18.8 i 19.8 i 1 23.6 h 25.4 g 25.0 f 2 29.0 f 33.7 cd 32.2 e 3 32.0 e 34.1 c 32.6 d 4 35.7 b 40.2 a 40.5 a
substrat alami adalah ketersediaan oksigen. Secara umum penurunan konsentrasi oksigen akan dapat menurunkan kandungan aflatoksin, dan penurunan aflatoksin yang nyata dihasilkan ketika oksigen direduksi dari 5% menjadi 1%. Dharmaputra et al. (2000) melaporkan bahwa kandungan aflatoksin B1 total pada jagung
dengan kadar air awal 14, 17, dan 20% yang dikemas di dalam kantung polietilena pada kondisi kedap udara (konsentrasi O2 ±1.4%)
lebih rendah daripada yang dikemas pada kondisi normal (konsentrasi O2±21%).
SIMPULAN DAN SARAN
SimpulanKadar air kacang tanah berfluktuasi selama penyimpanan. Walaupun demikian, selama penyimpanan kadar air kacang tanah yang dikemas di dalam tiga jenis bahan kemasan plastik, baik pada konsentrasi oksigen normal maupun rendah, merupakan kadar air yang aman untuk penyimpanan kacang tanah (<7%).
Jenis bahan kemasan plastik dan konsentrasi oksigen tidak berpengaruh terhadap persentase biji rusak. Persentase biji rusak kacang tanah meningkat selama penyimpanan.
Setelah empat bulan penyimpanan populasi total cendawan terendah yaitu pada kacang tanah yang dikemas di dalam jenis bahan kemasan plastik NY 80. Setelah empat bulan penyimpanan populasi total cendawan terendah juga terdapat pada kacang tanah yang dikemas pada konsentrasi oksigen rendah. Sebanyak sembilan spesies cendawan telah diisolasi dari kacang tanah pada semua perlakuan selama empat bulan penyimpanan. Cendawan yang selalu terisolasi ada lah A. flavus dan A. niger.
Populasi A. flavus berfluktuasi selama penyimpanan. Setelah empat bulan penyimpanan populasi A. flavus terendah yaitu pada kacang tanah yang dikemas di dalam jenis kemasan NY 70 pada konsentrasi oksigen rendah.
Kandungan afl atoksin B1 meningkat selama
penyimpanan. Setelah empat bulan penyimpanan kandungan aflatoksin B1 terendah
terdapat pada kacang tanah yang dikemas di dalam jenis bahan kemasan OPP. Kandungan aflatoksin B1 pada kacang tanah yang dikemas
pada konsentrasi oksigen normal lebih tinggi daripada yang dikemas pada konsentrasi oksigen rendah.
Ketiga jenis bahan kemasan plastik baik untuk menyimpan kacang tanah pada konsentrasi oksigen rendah (±10%).
Saran
Perlu dilakukan penelitian mengenai pengaruh berbagai konsentrasi gas (oksigen, karbondioksida, nitrogen) terhadap serangan cendawan pascapanen dan kontaminasi aflatoksin pada kacang tanah yang dikemas di dalam tiga jenis bahan kemasan plastik.
DAFTAR PUSTAKA
Abramson D. 1991. Development of molds, mycotoxins and odors in moist cereal during storage. Di dalam: Chelkowski J, editor. Cereal Grain: Mycotoxins, Fungi
and Quality in Drying and Storage.
Amsterdam: Elsevier Science. hlm 119-147.
[AOAC] Association of Official Analytical Chemist. 2000. Nuts and nut product. Di dalam: Horwitz W, editor. Official
Methods of Analysis of Food Composition.
Gaithersburg: AOAC.
Bala BK. 1997. Drying and Storage of Cereal
Grains. New Hampshire: Science
Publishers.
Betina V. 1989. Mycotoxins: Chemical, Biological and Environmental Aspect.
Amsterdam: Elsevier Science.
[BPS] Badan Pusat Statistik. 2005. Production of secondary food crops in Indonesia. http//:www.bps.goid/sector/agri/pangan/tab le2.html.[12 Nov 2005].
Blakenship PD, Cole RJ, Sanders TH. 1985. Comparative suscepbility of four experimental peanut lines and the cultivar florunner to preharvest aflatoxin contamination. Peanut Sci 12 (2): 70-72. Christensen CM, Miller BS, Johnston JA. 1992.
Moisture and its measurement. Di dalam: Sauer DB, editor. Storage of Cereal Grains
and Their Product. Ed ke-4. Minnesota:
American Association of Cereal Chemist. hlm 39-54.
Dharmaputra OS, Tjitrosomo HSS, Susilo HH. 1991. Aspergillus flavus and aflatoxin in peanuts collected from three markets in Bogor, West Java, Indonesia. Di dalam: Naewbanij JO, editor. Grain Postharvest
Research and Development: Priorities for Nineteenth. Proceedings of the 12th ASEAN
Seminar on Postharvest Technology;
Surabaya, 29-31 Aug 1989. hlm 110-124. Dharmaputra OS, Halid H, Susilo HH. 1993.
The effect of m illing degree on fungal infection, protein, and total lipid contents of milled rice. Di dalam: Naewbanij JO, Manilay AA, Frio AS, editor. Increasing
Handling, Processing and Marketing Efficiency in The Grain Postharvest System . Proceedings of the 16th ASEAN Seminar on Grain Postharvest Technology;
Phuket, 24-26 Aug 1993. hlm 177-195. Dharmaputra OS, Amad M, Retnowati I,
Ambarwati S. 2000. Airtight storage of maize: its effect on fungal infection and aflatoxin production. Di dalam: Johnson GI, Le van to, Nguyen DD, editor. Quality
Assurance In Agricultural Produce. Proceedings of the 19th ASEAN and 1st APEC Seminar on Postharvest Technology; Ho Chi Minh City, 9-12 Nov
1999. hlm 474 -482.
Dharmaputra OS, Putri ASR, Retnowati I, Ambarwati S. 2001. Soil mycobiota of peanut fields in Wonogiri Regency, Central Java: their effect on the growth and aflatoxin production of Aspergillus flavus
in vitro. Biotropia No.17. hlm 30-59.
Dharmaputra OS. 2003. Antagonistic effect of three fungal isolates to aflatoxin-producing
Aspergillus flavus. Biotropia No. 21. hlm
19-26.
Dharmaputra OS, Retnowati I, Ambarwati S. 2005a. Aspergillus flavus infection and aflatoxin contamination in peanuts at various stages of the delivery chain in Wonogiri Regency, Central Java, Indones ia. Summary International Peanut
Conference; Bangkok, 9-12 Jan 2005. hlm
109-111.
Dharmaputra OS, Retnowati I, Ambarwati S, Maysra E. 2005b. Aspergillus flavus
infection and aflatoxin contamination in peanuts at various stages of the delivery chain in Cianjur Regency, West Java, Indonesia. Biotropia No. 24. hlm 1-19. Diener UL, Davis ND. 1969. Aflatoxin
formation by Aspergillus flavus. Di dalam: Goldblatt LA, editor. Aflatoxin: Scientific
Background, Control and Implications.
New York: Academic Pr. hlm 13-54.
Douglas PL, Boyle R. 1996. Effect of drying control on mycotoxins production. Di dalam: Highley E, Johnson GI, editor.
Mycotoxin Contamination in Grains. Paper presented at the 17th ASEAN Technical Seminar on Grain Postharvest Technology; Lumut, 25-27 Jul 1995.
Canberra: Australian Centre for International Agricultural Research. hlm 27-33.
Dwivedi SL, Nigam SN, Renard G. 1996. Groundnut: a food crop. Di dalam: Saleh N
et al, editor. Risalah Seminar Nasional
Prospek Pengembangan Agribisnis Kacang-kacangan di Indonesia. Malang: Balai Penelitian Kacang Tanah dan Umbi-umbian. hlm 49-54.
[FAO] Food and Agricultural Organization, [WHO] World Health Organization. 1999. Codex Alimentarius Commision. Food Standar Programme. Report of the 23th Session; Rome, 28 Jun-3 Jul 1999.
Garraway MO, Evans RC. 1984. Fungal
Nutrition and Physiology. New York: John
Willey & Sons.
Ginting E, Beti JA. 1996. Upaya penyediaan bahan baku bebas aflatoksin mendukung agroindustri kacang tanah. Risalah Seminar Nasional Prospek Pengembangan Kacang Tanah di Indonesia. Malang: Balai Penelitian Tanaman Kacang-Kacangan dan Umbi-umbian. Ed khusus 7: 388-405. Heathcote JG, Hibbert JR. 1978. Aflatoxins:
Chemical and Biological Aspect.
Amsterdam: Elsevier Science.
Lacey J, Magan N. 1991. Fungi in cereal grain: their occurrence and water and temperature relationship. Di dalam: Chelkowski J, editor. Cereal Grain: Mycotoxins, Fungi
and Quality in Drying and Storage.
Amsterdam: Elsevier Science. hlm 77-12. Lee NA, Kennedy IR. 2002. Analysis of
aflatoxin B1 in peanuts. Bogor: SEAMEO
BIOTROP.
Mannan ME, Nursiwan MA, Sudarsono. 1986.
Alat Pengukur Cuaca di Stasiun Klimatologi. Bogor: Jurusan Geofisika dan
Meteorologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Pitt JI, Hocking AD, Glenn DR. 1980. Dichloran Glycerol medium for enumeration of xerophilic fungi from low-moisture foods. Appl Environ Microbiol 39 (3): 488-492.
Pitt JI, Hocking AD, Glenn DR. 1983. An improved medium for the detection of
Aspergillus flav us and A. parasiticus. J Appl Bacteriol 54: 109-114.
Pitt JI, Hocking AD, Samson RA, King AD. 1992. Recommended methods for mycological examination of foods. Di dalam: Samson RA, Hocking AD, Pitt JI King AD, editor. Modern Methods in
Food Mycology. Amsterdam: Elsevier.
hlm 365-368.
Pitt JI, Hocking AD.1996. Current knowledge of fungi and mycotoxins associated with food commodities in Southeast Asia. Di dalam: Highley E, Johnson GI, editor.
Mycotoxin Contamination in Grains. Paper presented at the 17th ASEAN Technical Seminar on Grain Postharvest Technology; Lumut, 25-27 Jul 1995.
Canberra: Australian Centre for International Agricultural Research. hlm 5-10.
Pitt JI, Hocking AD.1997. Fungi and Food
Spoilage. London: Blackie Academic &
Professional.
Pitt JI. 1999. Controlling aflatoxins in peanuts by competitive exclusion of toxigenic fungi. Di dalam: Dietzgen RG, editor.
Elimination of Aflatoxin Contamination in Peanut. Canberra: Australian Centre for
International Agricultural Research. hlm 21-22.
Richardson K. 1999. Moulds: their effect on nutrition and prevention. Di dalam: Jin Z, Liang Q, Liang Y, Tan X, Guan LH, editor. Proceedings of the 7th International Working Conference on Stored Product Protection; Beijing, 14-19 Okt 1998.
Chengdu: Sichuan Publishing House of Science and Technology. hlm 255-260. Samson RA, Hoekstra ES, Frisvad JC,
Filtenborg O. 1996. Introduction to
Food-Borne Fungi. Baarn: Centraalbureau voor
Schimmelcultures.
Sauer DB, Meronuck RA, Christensen CM. 1992. Microflora. Di dalam: Sauer DB, editor. Storage of Cereal Grains and Their
Product. Ed ke-4. Minnesota: American
Association of Cereal Chemist. hlm 313-340.
Schmidt HL. 1991. Cereal grain structure and the way in which fungi colonize kernel cells. Di dalam: Chelkowski J, editor.
Cereal Grain: Mycotoxins, Fungi and Quality in Drying and Storage.
Amsterdam: Elsevier Science. hlm 1-22. Steel RGD, Torrie JH. 1995. Prinsip dan
Prosedur Statistika: Suatu pendekatan biometrik. Bambang Sumantri,
penerjemah. Jakarta: Gramedia Pust aka Utama. Terjemahan dari: Principles and
Procedures on Statistic .
[SNI] Standar Nasional Indonesia. 01-39210-1995.1995. Kacang Tanah. Dewan Standardisasi Nasional.
Lampiran 1 Karakteristik jenis bahan kemasan plastik yang digunakan sebagai pengemas kacang tanah *
Nama produk Komposisi
Ketebalan (mm) Laju transmisi uap air (g/m2/24 jam) Laju transmisi oksigen (cc/m2/24 jam) Kode jenis bahan kemasan plastik** TRL.VACUUM BAG 01 OPP 30/PE 15/LLDPE 80 0.1265 0.3053 37.6800 OPP TRL.VACUUM BAG 02 NY 15/PE 15/LLDPE 80 0.1085 0.4805 2.2958 NY 80 TRL.VACUUM BAG 03 NY 15/PE 15/LLDPE 70 0.0974 0.6340 1.8734 NY 70 *
Berdasarkan hasil analisis Laboratorium Uji dan Kalibrasi, Balai Besar Kimia dan Kemasan, Jakarta
**
Lampiran 3 Cara perhitungan suhu dan kelembaban relatif rata-rata harian (Mannan et al. 1986) TH= (2 x Tp) + Ts + Tsr)
4
TH = Suhu rata-rata harian
Tp = Suhu pengamatan pagi
Ts = Suhu pengamatan siang
Tsr = Suhu pengamatan sore
RHH= (2 x RHp) + RHs + RHsr)
4
RHH = Kelembaban relatif rata-rata harian
RHp = Kelembaban relatif pengamatan pagi
RHs = Kelembaban relatif pengamatan siang
RHsr = Kelembaban relatif pengamatan sore
Lampiran 4 Komposisi media yang digunakan untuk isolasi dan identifikasi cendawan (Pitt & Hocking 1997)
Aspergillus flavus and Parasiticus Agar (AFPA)
Ekstrak khamir 20 g
Pepton 10 g
Ferik amonium sitrat 0.5 g Agar-agar batang merek AA 18 g
Dikloran 2 mg (0.2% b/v di dalam etanol, 1 ml)
Kloramfenikol 100 mg
Akuades 1 000 ml
Dichloran 18% Glycerol Agar (DG18)
Pepton 5 g
Glukosa 10 g
K H2PO4 1 g
MgSO4.7H2O 0.5 g Gliserol 220 g Agar-agar batang merek AA 18 g Kloramfenikol 100 mg
Dikloran 2 mg (0.2% b/v di dalam etanol, 1 ml) Akuades 1 000 ml
Czapek Yeast Extract Agar (CYA)
K2HPO4 1 g
Czapek pekat 10 ml
Larutan kelumit logam * 1 ml Ekstrak khamir 5 g
Sukrosa 30 g
Agar-agar batang merek AA 18 g Akuades 1 000 ml *Larutan kelumit logam
CuSO4.5H2O 0.5 g
ZnSO4.7H2O 1 g