5 BAB II
TINJAUAN PUSTAKA
2.1. Sejarah FORTRAN
Pada tahun 1956, saat komputer masih digunakan terutama oleh para ilmuwan untuk menyelesaikan masalah matematis, bahasa FORTRAN pertama kali dikembangkan oleh IBM. Dari asal-usul namanya, FORmula TRANslation, jelaslah kekuatan bahasa ini digunakan dalam masalah matematis. Dalam kurun waktu satu dekade saja, bahasa tersebut telah mempunyai standar di Amerika Serikat dengan kode American National Standard Programming Language FORTRAN, ANSI X3,9-1996 yang biasa dikenal dengan sebutan FORTRAN 66, atau FORTRAN IV.[5]
Sejak ditetapkannya standar tersebut, semakin banyak orang menggunakan bahasa FORTRAN. Hal ini ternyata semakin memperlihatkan banyaknya kekurangan pada FORTRAN IV tersebut. Dengan demikian lama kelamaan banyak pihak yang mengembangkan sendiri-sendiri, yang pada gilirannya menyebabkan satu program FORTRAN yang ditulis di satu sistem menjadi besar kemungkinannya tidak dapat digunakan di sistem lain. Karena itulah American National Standard Institute menetapkan sebuah standar baru yang disebut FORTRAN 77 atau dikenal juga dengan nama ANSI FORTRAN.[5]
Secara umum, FORTRAN 77 merupakan perkembangan ke arah pemrograman terstruktur dibandingkan FORTRAN IV. Misalnya struktur IF THEN-ELSE-END IF yang semula belum ada pada FORTRAN IV mulai dimasukkan pada FORTRAN 77. Tambahan fasilitas baru lainnya misalnya adanya variabel berjenis karakter (dengan spesifikasi CHARACTER) beserta fungsi-fungsi bawaannya (intrinsic function), fasilitas penanganan input dan output (OPEN, CLOSE, dan INQUIRE), juga pendimensian larik dengan indeks yang tidak harus positif (bisa nol atau negatif).[5]
Pada awal perkembangannya, harus diakui, bahwa bahasa FORTRAN (khususnya FORTRAN IV) belum terstruktur seperti sekarang. akibat adanya tuntutan akan adanya bahasa pemrograman yang terstruktur, kini bahasa
6 FORTRAN pun terdapat beberapa hal yang menempatkannya sebagai bahasa pemrograman yang terstruktur, antara lain :
• Adanya struktur pengendali program seperti : Struktur DO-END DO, DO WHILE-END DO, IF THEN-[ELSE IF]-ELSE-END IF.
• Adanya fasilitas untuk membuat unit-unit program seperti : PROGRAM, SUBROUTINE, FUNCTION, BLOCK DATA.
• Adanya fasilitas untuk deklarasi jenis data seperti : REAL, DOUBLE, PRECISION, INTEGER, IMPLICIT REAL, IMPLICIT INTEGER.
• Adanya fasilitas untuk memberikan komentar/keterangan pada program. • Adanya pernyataan pengendali program yang tidak membutuhkan label
pernyataan seperti CYCLE dan EXIT.[5] 2.2. Adsorpsi
Sistem pendingin adsorpsi dapat menggunakan panas tingkat rendah dan menggunakan refrigeran dengan nol ODP (Ozone Depletion Potential) dan GWP (Global Warming Potential). Sistem ini mulai dikembangkan sejak tahun 1990-an. Dibandingkan dengan sistem pendingin absorpsi, yang juga dapat menggunakan panas tingkat rendah, keuntungan dari adsorpsi adalah sebagai berikut:
1) Sistem pendingin adsorpsi dapat didukung oleh sumber dengan kisaran temperatur yang luas. Suhu 50 0C sudah dapat digunakan sebagai sumber panas untuk sistem adsorpsi, tetapi dalam sistem absorpsi sumber harus setidaknya pada 70 oC, bahkan jika dua-tahap siklus diadopsi. Sumber panas mendekati suhu 500 oC dapat digunakan secara langsung dalam adsorpsi tanpa menghasilkan masalah korosi, sedangkan dalam sistem absorpsi, korosi akan mulai terjadi pada suhu di atas 200 oC. [6].
2) Sistem pendingin adsorpsi cocok untuk kondisi dengan getaran yang kuat, seperti di perahu nelayan dan lokomotif, tapi pada sistem absorpsi karena bahan penyerapnya (absorben) dalam bentuk cairan mengalami masalah karena absorben dapat mengalir dari generator ke evaporator atau dari absorber ke kondensor. Ketika absorben berpindah, refrigeran menjadi tercemar dan sistem tidak dapat bekerja secara normal. [6].
7 3) Sistem adsorpsi jauh lebih sederhana dibandingkan dengan sistem absorpsi. Sebagai contoh, dalam sistem adsorpsi NH3-H2O, peralatan dephlegmate
harus digabungkan ke dalam sistem karena titik didih air hampir sama dengan amonia. [6].
Adsorpsi adalah suatu proses yang terjadi ketika suatu fluida (cairan maupun gas) terikat kepada suatu padatan dan akhirnya membentuk suatu film (lapisan tipis) pada permukaan padatan tersebut. Berbeda dengan absorpsi, dimana fluida terserap oleh fuida lainnya dengan membentuk suatu larutan. Untuk mengetahui karakteristik yang terjadi dalam proses adsorpsi dapat diilustrasikan dengan gambar 2.1, padatan berpori (pores) yang menghisap (adsorp) dan melepaskan (desorp) suatu fluida disebut adsorben. Molekul fluida yang dihisap tetapi tidak terakumulasi/melekat kepermukaan adsorben disebut adsorptive, sedangkan yang terakumulasi/melekat disebut adsorbat. [1].
Desorp/melepaskan
8 Pada umumnya proses adsorpsi diklasifikasikan menjadi dua proses yaitu proses adsorpsi secara fisik yang disebabkan oleh gaya van der Waals, dan secara kimia yang disebabkan melalui reaksi kimia antara molekul-molekul adsorbat dengan atom-atom penyusun permukaan adsorben. Jika interaksi antara padatan dan molekul yang mengembun tadi relatif lemah, maka proses itu disebut sebagai adsorpsi fisik. Walaupun adsorpsi biasanya dikaitkan dengan perpindahan dari suatu gas atau cairan ke suatu permukaan padatan, perpindahan dari suatu gas ke suatu permukaan cairan juga terjadi. Substansi yang terkonsentrasi pada permukaan didefinisikan sebagai adsorbat dan material pada mana adsorbat terakumulasi didefinisikan sebagai adsorben. [1].
Pada dasarnya adsorben dibagi menjadi tiga yaitu, adsorben yang mengadsorpsi secara fisik (karbon aktif, silika gel dan zeolit), adsorben yang mengadsorpsi secara kimia (calcium chloride, metal hydrides, dan complex salts ), dan composite adsorbent adsorben yang mengadsorpsi secara kimia dan fisik. [1].
2.2.1 Adsorpsi Secara Fisika
Proses adsorpsi atau penyerapan adalah fenomena fisik yang terjadi saat molekul-molekul gas atau cair dikontakan dengan suatu padatan dan sebagian dari molekul-molekul tadi mengembun pada permukaan padatan tersebut. Apabila interaksi antara padatan dan molekul yang mengembun tadi relatif lemah, maka proses ini disebut adsorpsi fisik yang terjadi hanya karena gaya van der Waals. [1].
Penyerapan yang digolongkan berdasarkan interaksi permukaan adsorben dengan adsorbat dapat dibagi menjadi dua jenis, yaitu penyerapan secara fisika (adsorpsi) dan penyerapan secara kimia.
Pada adsorpsi jenis ini, adsorpsi terjadi tanpa adanya reaksi antara molekul-molekul adsorbat dengan permukaan adsorben. Molekul-molekul adsorbat terikat secara lemah karena adanya gaya van der Waals. Adsorpsi ini relatif berlangsung cepat dan bersifat reversibel (reversible). Karena dapat berlangsung di bawah temperatur kritis adsorbat yang relatif rendah, maka panas adsorpsi yang dilepaskan juga rendah. Adsorbat yang terikat secara lemah pada permukaan adsorben, dapat bergerak dari suatu bagian permukaan ke bagian
9 permukaan lain. Peristiwa adsorpsi fisika menyebabkan molekul-molekul gas yang teradsorpsi mengalami kondensasi. Besarnya panas yang dilepaskan dalam proses adsorpsi fisika adalah kalor kondensasinya. [1].
Proses adsorpsi fisik terjadi tanpa memerlukan energi aktifasi, sehingga proses tersebut membentuk lapisan jamak (multilayers) pada permukaan adsorben. Ikatan yang terbentuk dalam adsorpsi fisika dapat diputuskan dengan mudah, yaitu dengan cara degassing atau pemanasan pada temperatur 150-200 0C selama 2-3 jam. [1].
Gambar 2.2. Siklus refrigerasi adsorpsi (Clapeyron diagram). [6]. Keterangan gambar:
Dalam adsorber: 1-2, panas masuk (pemanasan isosteric); 2-3, panas masuk (pemanasan isobarik dan desorpsi); 3-4, panas keluar (pendinginan isosteric) 3-4-1, panas keluar (pendinginan dan isobarik adsorpsi). Dalam evaporator-kondensor,:2’-3’ panas keluar (kondensasi isobarik); 3’-4’-1, efek pendinginan (isosteric refrigeran pendingin diri dan isobarik penguapan).
Persamaan kuantitas adsorbsi/desorbsi secara fisika di dalam mikropores biasanya dihitung dengan persamaan Dubinin-Astakhov (D-A) [6] :
10 Atau
(2.2)
Dimana : , k, D dan n adalah koefisien, yang tidak hanya berbeda karena pasangan adsorben-adsorbat, tapi juga berbeda untuk pasangan adsorben-adsorbat yang sama, tergantung merek dan tipe adsorben, T adalah temperatur adsorbsi (K), Ps adalah Tekanan saturasi dari refrigeran (Pa), P
adalah tekanan dalam sistem (Pa), x adalah kuantitas adsorbsi refrigeran pada adsorber (kg/kg).
Pasangan adsorben dan adsorbat untuk adsorpsi fisik antara lain : a. Karbon aktif atau serat karbon aktif dengan amonia dan metanol.
Proses adsorpsi karbon aktif-metanol dan karbon aktif-amonia sama, dan larutan adsorbat akan mengisi dan memenuhi pori-pori adsorben. Adsorpsi biasanya terjadi pada micropores, dimana volume jenis sekitar ) 0,15- 0,50 cm3g-1, dan area permukaan sekitar 95% dari luas seluruh permukaan karbon aktif. Fungsi dari besar pori adsorben yang relatif sedang dan besar sebagai penghantar molekul adsorbat ke mikropori.
Karbon aktif-metanol merupakan salah satu yang paling umum digunakan, karena kuantitas adsorpsi besar dan panas adsorpsi rendah, yang sekitar 1800-2000 kJ/kg. Paling utama konsumsi panas dalam fase desorpsi berkaitan dengan panas adsorpsi, nilai nilai yang rendah dari panas adsorpsi bermanfaat bagi COP (Coefficient Of Performance). Karbon aktif-metanol juga merupakan pasangan kerja yang sesuai untuk menggunakan panas matahari sebagai sumber panas karena suhu desorpsi rendah, dimana sekitar 100 0C. Suhu yang lebih tinggi dari 120 0C harus dihindari karena menurut Hu, dekomposisi metanol menjadi senyawa lain terjadi di atas suhu ini. Namun, karbon aktif-metanol tidak dapat bekerja secara maksimal di bawah tekanan sub-atmosfer. Perlunya vakum di dalam mesin pada saat menggunakan pasangan ini meningkatkan kompleksitas manufaktur, dan mengurangi keandalan sistem, bahkan sebuah infiltrasi udara kecil dapat mengubah efisiensi mesin. [6].
11
(2.3)
• Dimana QCool adalah produksi dingin, dan QDrive adalah panas
disediakan.
Koefisien persamaan D-A untuk karbon aktif ( dihasilkan dari tempurung kelapa) dan metanol adalah :
x0 = 0,45 k = 13,38 n = 1,5 [6].
Pasangan karbon aktif-amonia biasa digunakan. Dibandingkan dengan karbon aktif-metanol, walaupun kedua pasangan memiliki panas adsorpsi yang sama, namun pasangan karbon aktif-amonia memiliki keuntungan dari tekanan kerja yang lebih tinggi, yaitu sekitar 16 bar di kondensasi temperatur 40 0C. Karena operasi yang lebih tinggi tekanan pasangan karbon aktif-amonia memiliki kinerja perpindahan massa lebih baik, dan waktu siklus dapat dikurangi. Keuntungan lain dari karbon aktif-amonia bila dibandingkan dengan pasangan karbon aktif-metanol adalah kemungkinan untuk menggunakan sumber panas pada 200 0C atau di atas. Kerugian dari pasangan karbon aktif-amonia berhubungan dengan toksisitas dan bau menyengat dari amonia, ketidakcocokan antara amonia dan tembaga, dan kuantitas adsorpsi siklus yang lebih kecil, jika dibandingkan dengan nilai yang diperoleh dengan pasangan karbon aktif-metanol, pada kondisi kerja yang sama.
Dengan asumsi karbon aktif terbuat dari tempurung kelapa kuantitas adsorpsi tertinggi dengan metanol sebagai refrigeran adalah 0,45 kg / kg, sedangkan dengan amonia, hanya 0,29 kg / kg.
Koefisien persamaan D-A untuk karbon aktif dan amonia adalah :
12 b. Silika gel dan air
Dalam proses adsorpsi antara air dan silika gel, molekul air terhubung dengan kelompok silika alkohol = Si-OH…OH2 dimana tingkat cakupan
permukaan rendah. Untuk memenuhi seluruh tingkat permukaan, ikatan hidrogen menjadi penghubung gaya. Panas adsorpsi untuk pasangan ini adalah sekitar 2500 kJ / kg dan suhu desorpsi bisa sangat rendah, tetapi di atas 50 0C.
Sekitar 4-6% massa air yang terhubung dengan kelompok single hidroksil pada permukaan atom silika, yang tidak dapat dihapus, jika tidak silika gel akan kehilangan kemampuan adsorpsi. Dengan demikian, suhu desorpsi tidak bisa lebih tinggi dari 120 0C, dan umumnya lebih rendah dari 90 0C.
Peneliti di Jepang mengembangkan tiga tahap sistem adsorpsi dengan gel silika/ air sebagai pasangan kerja, dan sistem seperti dapat didukung oleh sumber panas dengan temperatur 50 0C. Pendingin adsorpsi dengan silika gel yang dikembangkan oleh Shanghai Jiao Tong University dapat dijalankan dengan sumber panas dengan suhu 55 0C. Suhu desorpsi rendah sangat cocok untuk pemanfaatan energi surya .
Salah satu kelemahan pasangan silika gel-air adalah kuantitas adsorpsinya rendah, sekitar 0,2 kg / kg. Kelemahan lainnya adalah mustahil untuk menghasilkan penguapan temperatur di bawah 0 0C.
Koefisien persamaan D-A untuk gel silika (Ukuran partikel rata-rata 6 mm, ukuran pori yang bervariasi antara 1,5 nm dan 3,0 nm) dan air adalah :
n = 1,7 x0 = 0,35 D = 6 x 10-6 [6].
c. Zeolit dan air
Struktur dan mekanisme adsorpsi zeolit yang berbeda berbeda. Misalnya, tipe A dan tipe X dan Y zeolit memiliki struktur segi delapan dipotong, dan unit seperti kristal disebut sebagai struktur zeolit sodalite kandang. Ada 24 molekul air dapat terserap di tengah kandang atau pori-pori unit kristal dan di kandang atau pori-pori-pori-pori delapan sodalite kristal zeolit. Struktur kerangka tipe X dan zeolit Y adalah sama dengan zeolit alam.
13 Volume pori untuk jenis dan zeolit X Y lebih besar dari volume jenis zeolit lainnya, dan rasio kekosongan mereka tinggi dapat mencapai 50% bila tidak ada air teradsorpsi. Satu unit kristal yang dapat memiliki 235 molekul air setelah adsorpsi, dan sebagian besar molekul akan terakumulasi di tengah pori.
Pasangan zeolit-air dapat dimanfaatkan dalam sistem pendingin dan sistem pendinginan adsorpsi. Panas adsorpsi untuk pasangan zeolit-air lebih tinggi daripada pasangan silika gel-air, sekitar 3300-4200 kJ / kg. Pasangan zeolit-air stabil pada suhu tinggi, maka pasangan ini dapat digunakan untuk memanfaatkan kembali panas di atas 200 0C. Adsorpsi isoterm sangat sensitif terhadap tekanan kondensasi, demikian sistem dapat beroperasi dengan kinerja yang sama di berbagai macam kondensasi suhu. Karena panas adsorpsi yang besar dan desorpsi suhu tinggi, kinerja pasangan zeolit-air lebih buruk dibandingkan dengan pasangan karbon aktif-metanol pada sumber panas suhu menengah dan rendah (lebih rendah dari 150 0C), tapi pasangan zeolit-air dapat memiliki COP yang lebih tinggi jika suhu sumber panas lebih tinggi dari 200 oC.
Kelemahan pasangan ini serupa dengan pasangan silika gel-air, ketidakmungkinan untuk menghasilkan suhu penguapan di bawah 0 0C dan transfer massa buruk mengarah pada kinerja kerja yang rendah. Disebabkan oleh tingginya nilai panas adsorpsi dan tingginya temperatur desorpsi, untuk sumber panas dengan daya yang sama, siklus waktu untuk pasangan zeolit-air lebih lama dibandingkan dengan pasangan lainnya.
Koefisien persamaan D-A untuk zeolit ( butir diameter 2,38 mm - 4,75 mm) dan air adalah:
x0= 0,261 k = 5,36 n = 1,73 [6].
2.2.2 Adsorpsi Secara kimia
Untuk adsorpsi kimia antara adsorben dan refrigeran, kekuatan pasang kerja adsorpsi kimia umumnya meliputi fungsi kompleksasi, koordinasi, hidrogenasi dan oksidasi.
14 Prinsip kerja adsorpsi kimia dapat dilihat pada Gambar 2.3. Sama dengan siklus adsorpsi fisik, siklus adsorpsi kimia mencakup empat proses dibagi menjadi dua fase: dekomposisi, kondensasi, evaporasi dan sintesis, yang ditunjukkan dalam point 1-4 pada Gambar 2.3.
Gambar 2.3. adsorpsi kimia. titik 1, dekomposisi (Desorpsi); titik 2 kondensasi; titik 3 penguapan; butir 4, sintesis (Adsorpsi). [6].
Pasangan kerja adsorpsi kimia terutama termasuk logam klorida-amonia, logam hidrida-hidrogen dan oksida logam-oksigen.
a. Logam klorida dan ammonia
Gaya antara logam klorida dan amonia adalah kompleksasi kekuatan. Reaksi antara kalsium klorida dan amonia dapat ditulis sebagai:
CaCl2.n1NH3 + n2 Hr CaCl2.(n1 – n2)NH3 + n2NH3
Dimana Hr adalah entalpi reaksi (J / mol), jumlah n1 dan n2 bisa menjadi
2, 4 dan 8. Tekanan ekuilibrium untuk klorida yang berbeda ditampilkan dalam Gambar 2.4, dan reaksi entalpi ( H), reaksi entropi ( S) dan kapasitas panas spesifik (Cp), disajikan pada Tabel 2.1.
15 Tabel 2.1. Reaction parameters for chlorides/ammonia[6].
Keuntungan dari logam klorida-amonia adalah kuantitas adsorpsi besar, yang lebih tinggi dari 1 kg / kg untuk kebanyakan klorida. Kerugian logam klorida-amonia sebagai pasangan kerja terutama terkait dengan garam pemuaian dan aglomerasi pada adsorpsi, yang memgurangi pengumpulan panas dan massa transfer. [6].
16 Gambar 2.4. Garis reaksi kesetimbangan klorida. [6].
b. Logam hidrida dan hidrogen
Sama dengan sintesis dan proses penguraian klorida-amonia, adsorpsi dan proses desorpsi antara logam hidrida dan hidrogen tergantung pada kondisi temperatur atau tekanan tertentu. Mengedepankan logam hidrida bepori (PMHs) atau metal misch (Mm), paduan matriks, termasuk paduan Ni, Fe, La, Al, yang memiliki reaksi panas yang sangat tinggi dan kuantitas adsorpsi.
Kerugian dari kerja pasangan logam hidrida-hidrogen adalah SCP (Specific Cooling Power per kilogram of adsorbent) yang kecil. Salah satu keuntungan adalah bahwa adsorber juga digunakan sebagai kondensor dan evaporator. Keuntungan lain dari logam hidrida adalah densitas besar ( = 6,5-8 kg/L), yang dikombinasikan dengan besar kapasitas adsorpsi menyebabkan kapasitas pendinginan volumetrik tinggi. Fitur ini menarik dalam situasi dimana ruang terbatas, tetapi tidak perlu ringan.
Siklus dasar untuk hidrogen pasangan kerja logam hidrida adalah berbeda dari adsorben fisik dan kimia karena tidak ada pendingin yang dipenuhi. Prinsip dasar siklus ditampilkan pada diagram Hoff Van't dari Gbr. 2.5. . Persamaan digunakan untuk menghitung tekanan kesetimbangan hidrida dan juga jenis lain kimia sorben, seperti klorida bereaksi dengan amonia. [6].
17 Gambar 2.5. Prinsip Kerja siklus dasar dan diagram Van't Hoff .
(a) Adsorpsi prinsip (b) Van't Hoff diagram. [6].
Dalam semi-siklus pertama, logam hidrida B desorb di suhu TDrive dan gas
desorbed memasuki reaktor dengan logam hidrida A. Logam hidrida A didinginkan oleh suhu Tm. Proses semi-siklus kedua didapat pada tekanan rendah.
Proses desorpsi logam hidrida A menyerap panas dan menghasilkan dingin pada suhu TCool. Kinerja pendingin terkait dengan nilai reaksi entalpi. Jika sistem
dengan pasangan ini digunakan untuk pendinginan, COP dapat dihitung dengan Persamaan (2.3), sedangkan jika sistem digunakan sebagai pompa panas, COA (coefficient of amplification) dapat dihitung dengan Persamaan. (2.5). [6].
(2.5)
Kebanyakan pasangan kerja logam hidrida-hidrogen memiliki fenomena histeresis adsorpsi, dan selama proses transisi antara logam hidrida dan logam,
18 tekanan meningkat pada tingkat yang berbeda, seperti dapat dilihat pada Gambar 2.6., di mana x adalah jumlah hidrogen desorbed atau terserap oleh dua reaktor.
Gambar 2.6. Fenomena histeresis adsorpsi dan slope tekanan. [6].
c. Logam oksida dan oksigen
Ada dua jenis oksigen, molekuler oksigen dan atom oksigen, yang dapat terserap oleh logam. Atom oksigen memasuki kisi logam untuk membentuk oksida logam. Jenis oksigen (molekul atau atom) terserap oleh logam tergantung pada kondisi eksternal dan pada jenis logam. Secara umum, setelah molekul oksigen terserap dalam proses pemanasan dan desorpsi, beberapa molekul oksigen terserap, beberapa atom oksigen berubah ke dalam logam yang stabil, dan proses transisi ini membutuhkan energi aktif. [6].
2.2.3 Adsorpsi Komposit
Pasangan kerja utama adsorpsi komposit adalah silika gel-klorida-air. Adsorben komposit dengan silika gel biasanya dihasilkan dengan penambahan klorida. pasangan kerja Klorida-air, misalnya CaCl2-H2O, bukan merupakan
sorpsi padat karena CaCl2 mencair setelah menyerap sejumlah air, tetapi kuantitas
adsorpsi tertinggi CaCl2-H2O sekitar enam kali nilai yang didapat dengan silika
19 Adsorben komposit silika gel dan klorida biasanya dikembangkan oleh proses impregnasi, dimana silika gel direndam dalam larutan garam, kemudian dikeringkan. Menurut Aristov et al [dalam 8] , karakteristik adsorpsi dari adsorben komposit silika gel dapat dimodifikasi dengan :
1) Mengubah struktur pori silika gel 2) Mengubah jenis garam dan
3) Mengubah proporsi antara garam dan silika gel.
Mengenai struktur pori, ketika partikel garam jauh lebih kecil daripada ukuran pori silika gel, seperti dalam kasus mesopore silika gel, karakteristik adsorpsi garam terbatas dalam pori-pori, ini mirip dengan garam curah, Namun jika ukuran pori-pori terlalu kecil, seperti di micropore silika gel, karakteristik adsorpsi dapat sepenuhnya berbeda. Selain itu, beralasan untuk menduga bahwa senyawa silika gel yang diproduksi dengan garam yang berbeda akan menghasilkan karakteristik yang berbeda juga
Adsorpsi isoterm pasangan silika gel-CaCl2-air dengan perbandingan
massa berbeda dari CaCl2 ditunjukkan pada Gambar 2.7.
Gambar 2.7. Isoterm pada 40 oC. [6].
Huruf S yang diberi symbol (gambar 2.7), diikuti dengan nomor, merupakan konsentrasi larutan garam yang digunakan untuk membuat komposit
20 adsorben. Sebagai contoh, S0 merupakan silika gel dengan tidak ada garam, dan S40 mewakili adsorben komposit dibuat dengan 40% CaCl2 . Gambar 2.7.
menunjukkan bahwa peningkatan dalam kesetimbangan kuantitas adsorpsi dengan konsentrasi larutan menurun bila konsentrasi larutan lebih tinggi dari 40%. Garam dengan mudah dapat mencair selama proses adsorpsi, saat campuran ini disusun dengan konsentrasi tinggi, konsentrasi terbaik untuk menghindari masalah seperti dan memastikan kapasitas adsorpsi tinggi akan sekitar 40%.[6].
2.3. Faktor-Faktor Yang Mempengaruhi Adsorpsi Daya adsorpsi dipengaruhi oleh tiga faktor, yaitu :
1. Tekanan (P), tekanan yang dimaksud adalah tekanan adsorbat. Kenaikan tekanan adsorbat dapat menaikan jumlah yang diadsopsi.
2. Temperatur absolut (T), temperatur yang dimaksud adalah temperatur adsorbat. Pada saat molekul-molekul gas atau adsorbat melekat pada permukaan adsorben akan terjadi pembebasan sejumlah energi yang dinamakan peristiwa exothermic. Berkurangnya temperatur akan menambah jumlah adsorbat yang teradsopsi demikian juga untuk pristiwa sebaliknya. 3. Interaksi Potensial (E), interaksi potensial antara adsorbat dengan dinding
adsorben sangat bervariasi, tergantung dari sifat adsorbat-adsorben. [1].
2.4. Adsorben
Luasnya permukaan spesifik, sangat mempengaruhi besarnya kapasitas penyerapan dari adsorben. Semakin luas permukaan spesifik dari adsorben, maka semakin besar pula kemampuan penyerapannya. Volume adsorben membatasi jumlah dan ukuran pori-pori pembentuk permukaan dalam (internal surface) yang menentukan besar atau kecilnya permukaan penyerapan spesifik. Karakteristik adsorben yang dibutuhkan untuk adsorpsi :
1. Luas permukaannya besar, sehingga kapasitas adsorpsinya tinggi. 2. Memiliki aktifitas terhadap komponen yang diadsorp.
3. Memiliki daya tahan guncang yang baik.
4. Tidak ada perubahan volume yang berarti selama proses adsorpsi dan desorpsi. [1].
21 2.4.1 Adsorben Fisik
a. Silika gel
Silika gel cenderung mengikat adsorbat dengan energi yang relatif lebih kecil dan membutuhkan temperatur yang rendah untuk proses desorpsinya, dibandingkan jika menggunakan adsorben lain seperti karbon atau zeolit. Kemampuan desorpsi silika gel meningkat dengan meningkatnya temperatur. Silika gel terbuat dari silika dengan ikatan kimia mengandung air kurang lebih 5%. Pada umumnya temperatur kerja silika gel sampai pada 200 °C, jika dioperasikan lebih dari batas temperatur kerjanya maka kandungan air dalam silika gel akan hilang dan menyebabkan kemampuan adsorpsinya hilang [1]. Bentuk butiran silika gel yang banyak digunakan untuk proses adsorpsi adalah seperti gambar 2.8.
Gambar 2.8 Bentuk butiran silika gel . [1].
b. Karbon Aktif
Karbon aktif dapat dibuat dari batu bara, kayu, gambut,tulang, kulit kacang dan tempurung kelapa melalui proses pyrolizing dan carburizing pada temperatur 700 sampai 800 °C. Hampir semua adsorbat dapat diserap oleh karbon aktif kecuali air. Aktif karbon dapat ditemukan dalam bentuk bubuk dan granular. Pada umumnya karbon aktif dapat mengadsorpsi metanol atau amonia sampai dengan 30%, bahkan karbon aktif super dapat mengadsorpsi sampai dua kalinya. [1]. Bentuk butiran karbon aktif adalah seperti gambar 2.9.
22 Gambar 2.9 Bentuk butiran karbon aktif. [1].
Struktur dari pori karbon aktif terdiri dari saluran yang tidak teratur, yang memiliki luas pori-pori yang lebih besar pada permukaan butiran, dan area pori sempit dalam butiran. Alasan di atas yang membedakan antara karbon aktif dan jenis lainnya adsorben adalah bentuk permukaan. Seluruh permukaan aktif karbon ditutupi oleh oksida matriks dan oleh beberapa bahan anorganik, dan karena itu karbon aktif adalah non-polar atau memiliki polaritas lemah. Panas adsorpsi karbon pasangan aktif lebih rendah dari pada jenis lain atau pasangan adsorben fisik.
Karbon aktif jenis serat umumnya digunakan dalam produksi kain, seperti pakaian, tisu, dll. Dibandingkan dengan karbon aktif jenis butiran, serat karbon mempunyai kinerja pindahan panas yang lebih baik. Permukaan karbon aktif jenis serat lebih besar daripada karbon aktif , pori-pori karbon aktif serat lebih seragam daripada karbon aktif, dan kinerja pindahan panas dari karbon aktif serat juga lebih besar dari karbon aktif . Kelemahan dari serat karbon aktif adalah anisotropic thermal conductivity, dan kontak resistansi termal antara serat yang tinggi terhadap dinding adsorber, bila dibandingkan dengan karbon aktif butiran. [6]. Struktur karbon aktif dapat dilihat pada gambar 2.10.
23 Gambar 2.10 Struktur karbon aktif. [6].
c. Zeolit
Zeolit mengandung kristal zeolit yaitu mineral aluminosilicate yang disebut sebagai penyaring molekul. Zeolit terdiri alkali dan alkali tanah. Mineral aluminosilicate ini terbentuk secara alami. Zeolit buatan dibuat dan dikembangkan untuk tujuan khusus, diantaranya 4A, 5A, 10X, dan 13X yang memiliki volume rongga antara 0.05 sampai 0.30 cm3/gram dan dapat dipanaskan sampai 500 °C tanpa harus kehilangan mampu adsorpsi dan regenerasinya. Zeolit 4A (NaA) digunakan untuk mengeringkan dan memisahkan campuran hydrocarbon. Zeolit 5A (CaA) digunakan untuk memisahakan paraffins dan beberapa Cyclic hydrocarbon. Zeolit 10X (CaX) dan 13X (NaX) memiliki diameter pori yang lebih besar sehingga dapat mengadsorpsi adsorbat pada umumnya. [1]. Bentuk butiran zeolit adalah seperti gambar 2.11.
24 2.4.2 Adsorben Kimia
Pada dasarnya adsorben kimia mencakup logam klorida, logam hidrida dan oksida logam.
a. Logam klorida
Logam klorida untuk refrigerasi adsorpsi pada umumnya adalah kalsium klorida, stronsium klorida, magnesium klorida dan barium klorida . Reaksi adsorpsi antara logam klorida dan refrigeran merupakan sebuah reaksi kompleksasi, dan senyawa kompleks direaksikan berdasarkan dari koordinat senyawa itu. Pada umumnya adsorbat yang dipakai untuk logam klorida adalah ammonia. Selama proses adsorpsi, pemuaian garam dan aglomerasi dapat terjadi dan mempengaruhi kinerja panas dan perpindahan massa. [6]. b. Garam dan Logam hibrida
Hidrogen dapat bereaksi hampir dengan semua elemen, dari semua reaksi ada empat tipe dari hidrida. Tipe pertama terdiri dari garam hidrida, seperti LiH dan CaH. Tipe pertama ini dapat terbentuk dari reaksi antara hirogen
dengan unsur golongan IA dan IIA. Tipe kedua hidrida adalah logam hidrida. Atom hidrogen memasuki kisi kristal dari logam induk bila bereaksi dengan logam transisi, dan bentuk-bentuk hidrida logam. Tipe lain dari hidrida adalah hidrida kovalen polimerisasi tinggi, dan non-logam molekul hidrida.
Garam hidrida dan logam hidrida dapat digunakan untuk refrigerasi adsorpsi. Para garam hidrida mempunyai kisi struktur kristal heksagonal dengan kerapatan besar. Dalam proses adsorpsi, atom H menjadi proton ketika memasuki ruang antara kisi-kisi kristal heksagonal. Gerak electron mirip dengan gerak elektron pada ikatan logam.
Hidrida dengan struktur khusus nampak ketika jumlah hidrogen yang tersedia untuk reaksi memiliki jumlah yang berlebih. Kepadatan dari garam hidrida lebih besar dari kepadatan logam biasa, tetapi kepadatan logam hidrida lebih kecil daripada kepadatan logam sederhana karena volume dan massa jenis terdahulu tidak meningkat secara proporsional dalam proses adsorpsi. [6].
25 c. Logam oksida
Logam oksida biasanya bekerja sebagai katalis untuk oksidasi dan reaksi deoxidation. Ketika oksida logam digunakan sebagai adsorben dalam adsorpsi pompa panas, oksigen merupakan refrigeran. Pada permukaan logam oksida, unsur-unsur yang mempengaruhi kinerja adsorpsi adalah nomor koordinat dari ion logam, tingkat jenuh dari koordinat, arah ikatan kimia pada permukaan bahan kimia, karakteristik simetris logam transisi medan ligan, jumlah electron dari logam transisi ligan , dan susunan pusat atom. [6].
2.4.3 Adsorben Komposit
Adsorben komposit dikembangkan dan dipelajari dengan dua tujuan: 1) Meningkatkan kinerja panas dan kinerja pindahan panas pada adsorben
kimia, khususnya karena pemuaian dan fenomena aglomerasi. Garam yang memuai mengurangi pindahan panas, dan aglomerasi garam mengurangi perpindahan massa. Oleh karena itu, aditif untuk adsorben kimia harus memiliki pori struktur dan konduktivitas termal tinggi, seperti grafit yang diperluas, untuk membantu menghindari masalah yang disebutkan di atas.
2) Meningkatkan kuantitas adsorpsi dari adsorben fisik. Penambahan sorben kimia dalam sorben fisik meningkatkan kapasitas adsorpsi, menghilangkan masalah sebelumnya. [6].
Adsorben komposit dibuat dari media berpori dan sorben kimia umumnya merupakan kombinasi dari logam klorida dan karbon aktif, atau serat karbon aktif, atau grafit , atau silica gel atau zeolit.
Metode untuk menghasilkan adsorben komposit antara lain: 1) Campuran sederhana
Dalam proses tersebut, adsorben kimia dan aditif dicampur sesuai dengan perbandingan massa dan perbandingan volume. Pada umumnya metode ini digunakan ketika bahan aditiv berbentuk butiran, seperti karbon aktif.
26 2) Impregnasi
Pada umumnya metode ini digunakan untuk serat karbon aktif, serat grafit atau grafit yang diperluas. Dalam metode ini, Pertama-tama adsorben kimia dilarutkan dalam air atau pelarut lainnya. Setelah itu aditiv tersebut dimasukkan ke dalam campuran, dan selanjutnya pelarut akan kering. Satu keuntungannya, adsorben jenis ini memiliki porositas besar, dimana akan menguntungkan refrigeran pindahan massa. Adsorben jenis ini dapat memiliki konduktivitas termal yang tinggi pada arah membujur, jika serat karbon dipakai sebagai aditifnya.Kerugian jika menggunakan serat karbon adalah konduktivitas termal rendah pada arah radial dan tahanan termal tinggi antara serat dan dinding reaktor. Tahanan termal bisa menjadi lebih besar jika adsorben komposit memuai pada saat adsorpsi.
3) Campuran atau impregnasi dan konsolidasi
Adsorben konsolidasi dapat dibuat dengan mengompres bubuk komposit yang disiapkan oleh campuran atau impregnasi, seperti yang dijelaskan di atas, atau dengan pertama-tama mengompres aditif atau sorben fisik, dan kemudian, mencampurkan itu dengan larutan garam, selanjutnya dikeringkan sampai pelarut hilang. Keuntungannya jenis adsorben ini adalah konduktivitas termal tinggi dalam arah kompres yang tegak lurus. Kerugiannya terkait dengan jumlah pengoperasian yang luas diperlukan untuk mencapai senyawa akhir. Kinerja pindahan massa sepenuhnya dipengaruhi oleh perbandingan antara komponen dan berat jenis, maka parameter-parameter pemilihannya harus hati-hati. [6].
2.5. Refrigeran
2.5.1 Refrigeran pada umumnya
Teknologi adsorpsi dapat digunakan tidak hanya untuk AC dan pendinginan tetapi juga untuk meng-upgrade panas dengan transformator termal, dan jenis refrigeran harus dipilih sesuai dengan aplikasi.
27 Sifat-sifat yang harus dimiliki oleh refrigeran, antara lain :
1) panas penguapan laten tinggi per satuan volume atau unit massa, 2) stabilitas termal,
3) tidak berbahaya terhadap lingkungan 4) nonflammable,
5) tidak berbahaya,
6) saturasi tekanan antara 1 dan 5 atm pada suhu kerja (nilai sempurna akan mendekati 1 atm). [6].
Sayangnya, tidak ada refrigeran yang memiliki semua karakteristik di atas, dan refrigeran yang biasa di pakai untuk sistem pendingin adsorpsi adalah amonia, air dan metanol. Beberapa sifat fisik refrigeran untuk sistem adsorpsi ditunjukkan pada Tabel 2.2.
Tabel 2.2. Sifat fisik refrigeran [6].
Refrigeran dengan titik didih di bawah -10 oC pada 1 atm adalah refrigeran tekanan positif, sedangkan yang lainnya refrigeran vakum. Ammonia adalah contoh refrigeran tekanan positif, dan dapat digunakan dengan klorida, karbon aktif dan serat karbon aktif. Tekanan saturasi etanol dan metanol adalah sama, tetapi panas laten etanol adalah sekitar 30% lebih rendah dibanding metanol. Metanol biasanya digunakan dengan karbon aktif atau serat karbon aktif. Air dapat dianggap sebagai pendingin yang sempurna, kecuali untuk tekanan saturasi ekstrim yang rendah dan tidak mungkin untuk menghasilkan suhu di bawah 0 0C. Biasanya air dipasangkan dengan silika gel atau zeolit. [6].
28 Refrigeran yang biasa digunakan untuk pendinginan adalah air, metanol, dan ammonia.
1) Air
Merupakan adsorbat yang ideal karena memiliki kalor laten spesifik terbesar, mudah didapat, murah, dan tidak beracun. Air dapat dijadikan pasangan zeolit, dan silika gel. Tekanan penguapan air yang rendah merupakan keterbatasan air sebagai adsorbat, sehingga menyebabkan : - Temperatur penguapan rendah (100 0C), sehingga penggunaan air
terbatas hanya untuk air-conditioning dan chilling.
- Tekanan sistem selalu dibawah tekanan normal (1 atm). Sistem harus memiliki instalasi yang tidak bocor agar udara tidak masuk.
- Rendahnya tekanan penguapan air menyebabkan rendahnya tekanan proses adsorpsi di batasi oleh transfer massa. [1].
2) Metanol
Di banyak hal kemampuan atau performa metanol berada diantara air dan ammonia. Metanol memiliki tekanan penguapan yang lebih tinggi dibandingkan dengan air (meskipun pada tekanan 1 atm), sehingga sangat cocok untuk membuat es. Meskipun demikian pada temperatur lebih dari 120 0C, tekanan menjadi tidak stabil. Untuk temperatur aplikasi lebih dari 200 0C adsorben yang biasa digunakan adalah karbon aktif, silika gel, dan zeolit. [1].
3) Ammonia
Besarnya panas laten spesifik ammonia adalah setengah lebih rendah dari panas laten spesifik air, pada temperatur 0°C dan memiliki tekanan penguapan yang tinggi. Ammonia memiliki keuntungan yang ramah lingkungan dan dapat digunakan sebagai refrigeran sampai -40 0C, dan dapat dipanaskan sampai 200 0C. Kerugian dari ammonia :
- Beracun, sehingga penggunaannya dibatasi.
- Tidak dapat ditampung pada instalasi yang terbuat dari tembaga atau campurannya. [1].
29 2.5.2. Refrigeran yang lain
Hidrogen dan oksigen adalah contoh refrigeran lain yang dapat digunakan dalam sistem refrigerasi adsorpsi. Hidrida adalah adsorben untuk hidrogen, yang dihasilkan dari dekomposisi air, mudah terbakar, meledak dan harus ditangani dengan hati-hati.
Jenis oksigen yang dapat terserap oleh oksida adalah O2, O2-, O- dan O22-.
Reaksi antara oksida dan oksigen memiliki entalpi besar, dengan demikian, biasanya bekerja di pompa panas kimia. Namun, pasangan ini juga cocok untuk sistem cryogenic dengan suhu di bawah 120 K
Refrigeran lainnya adalah R134a, R22, R407c dan etanol, yang dapat menggunakan karbon aktif atau serat karbon aktif sebagai absorbennya. Namun, dibandingkan dengan metanol, mereka memiliki daya pendinginan massa unit yang lebih kecil karena jumlah mereka yang kecil atau adsorpsi karena panas laten penguapan yang rendah. Selain keterbatasan yang dijelaskan di atas, HCFC dan HFC juga tidak direkomendasikan karena mereka relatif high GWP values. [6].
2.6. Prinsip Sistem Pendinginan Adsorpsi
Siklus pendingin adsorpsi berlangsung dengan penyerapan refrigeran/adsorbat dalam fasa uap kedalam adsorben pada tekanan rendah, kemudian refrigeran yang terserap pada adsorben didesorpsi dengan memberikan panas pada adsorben. [1]. Bentuk sederhana dari siklus pendingin adsorpsi seperti dua botol labu yang berhubungan seperti pada Gambar 2.12.
Pada awalnya sistem dikondisikan pada tekanan dan temperatur rendah. Dua buah botol labu (vessel) yang berhubungan, dimana pada labu pertama terdapat adsorben (karbon aktif) yang mengandung adsorbat berkonsentrasi tinggi sedangkan pada labu yang kedua terdapat adsorbat dalam fasa uap (Gambar 2.12a).
30 Gambar 2.12 Siklus sistim pendingin adsorpsi [1].
Labu pertama yang berisi adsorben dengan kandungan adsorbat berkonsentrasi tinggi dipanaskan, sehingga tekanan sistim meningkat dan menyebabkan kandungan adsorbat yang ada di dalam adsorben berkurang atau menguap. Proses berkurangnya kandungan adsorbat pada adsorben pada kasus ini disebut desorpsi.
Adsorbat yang menguap kemudian terkondensasi dan mengalir ke botol labu yang kedua, disini panas dilepaskan ke lingkungan dimana tekanan sistem masih tinggi. Pemanasan pada botol labu pertama dihentikan, lalu pada botol labu yang pertama terjadi perpindahan panas ke lingkungan sehingga tekanan sistem menjadi rendah. Tekanan sistem yang rendah menyebabkan adsorbat cair pada botol labu yang kedua menguap dan terserap ke botol pertama yang berisi adsorben. Proses terserapnya adsorbat ke adsorben pada kasus ini disebut adsorpsi. Proses adsorpsi meghasilkan efek pendinginan yang terjadi pada botol labu kedua, dimana pada tekanan rendah panas dari lingkungan diserap untuk menguapkan adsorbat (Gambar 2.12b) sampai sistem kembali ke kondisi awal dimana pada botol labu pertama berisi adsorben dengan kandungan adsorbat berkonsentrasi tinggi dan pada botol labu kedua terdapat adsorbat dalam fasa gas (Gambar 2.12c). [1].
31 2.7. Siklus Ideal Sistim Pendingin Adsorpsi
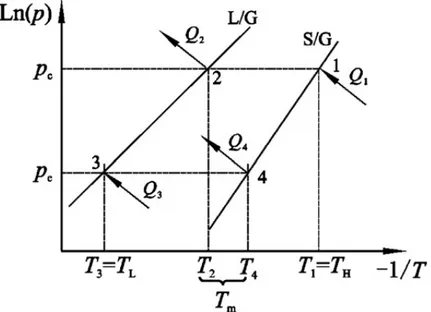
Adsorpi dan desorpsi merupakan suatu proses yang dapat berlangsung secara reversibel. Adsorpsi merupakan proses exothermic dimana adsorben (fluida) dan adsorbat (padatan) melepaskan panas sehingga menyebabkan penurunan pergerakan molekul adsorbat yang mengakibatkan adsorbat tersebut menempel pada permukaan adsoben dan membentuk suatu lapisan tipis. Ketika panas diberikan kepada sistem tersebut maka pergerakan molekul adsorbat akan meningkat sehingga pada jumlah panas tertentu akan menghasilkan energi kinetik molekul adsorbat yang cukup untuk merusak gaya van der Waals antara adsorben dan adsorbat. Proses pelepasan adsorbat dari adsorben disebut sebagai proses desorpsi, dimana proses ini membutuhkan energi panas sehingga disebut proses endothermic. Jumlah adsorbat yang terkandung di dalam adsorban dapat digambarkan oleh garis isosters pada diagram tekanan vs temperatur (Ln P vs -1/T) seperti pada gambar 2.13.
Gambar 2.13. Diagram tekanan vs temperatur yang menggambarkan garis isosters [1].
Siklus mesin pendingin adsorpsi tidak membutuhkan energi mekanis, melainkan membutuhkan energi panas. Pada saat mesin pendingin beroperasi, beberapa proses yang terjadi pada adsorber yang melibatkan proses endothermic dan exothermic. Proses endothermic berlangsung selama proses pemanasan (peningkatan tekanan) dan proses pemanasan-desorpsi-kondensasi, sedangkan proses exothermic berlangsung selama proses pendinginan (penurunan tekanan)
32 dan proses pendinginanadsorpsi- evaporasi. keempat proses tersebut membentuk suatu siklus yang digambarkan oleh diagram clapeyron ideal seperti pada gambar 2.14.
Gambar 2.14. Diagram clapeyron ideal [1].
Keempat proses tersebut adalah sebagai berikut: 1. Proses Pemanasan (pemberian tekanan)
Selama periode ini, tidak ada aliran metanol yang masuk maupun keluar dari adsorber. Adsorber menerima panas sehingga temperatur adsorber meningkat dan diikuti oleh peningkatan tekanan dari tekanan evaporasi menjadi tekanan kondensasi. Proses ini sama seperti proses kompresi pada sistem pendingin mekanik. Proses ini dilustrasikan pada gambar 2.15.
33 2. Proses pemanasan-desorpsi-kondensasi
Selama periode ini, adsorber terus dialiri panas sehingga adsorber terus mengalami peningkatan dan temperatur yang menyebabkan timbulnya uap desorpsi. Sementara itu, katup aliran ke kondensor dibuka sehingga adsorbat dalam bentuk gas mengalir ke kondensor untuk mengalami proses kondensasi menjadi cair. Kalor laten pengembunan adsorbat diserap oleh media pendingin pada kondenser. Siklus ini sama dengan siklus kondensasi pada sistem pendingin mekanik. Proses ini dilustrasikan pada gambar 2.16.
Gambar 2.16. Proses pemanasan-desorpsi-kondensasi [1].
Analisis proses desorpsi (pelepasan methanol dari karbon aktif) pada generator yang juga bertindak sebagai solar kolektor dibuat berdasarkan Diagram Clayperon yang dibuat oleh Pons [4] untuk pasangan karbon aktif dengan merek dagang AC 35, untuk selanjutnya diagram ini disebut Diagram AC 35.
T (0C) P(hPa) 30 20 40 50 60 70 80 90 100 40 60 80 100 125 A B C D Absorbed mass (kg/kg) 0,05 0,1 0,15 0,2 0,25 0,3
34 3. Proses pendinginan (penurunan tekanan)
Selama periode ini, tidak ada aliran metanol yang masuk maupun keluar dari adsorber. Adsorber melepaskan panas dengan cara didinginkan sehingga suhu di adsorber turun dan diikuti oleh penurunan tekanan dari tekanan kondensasi ke tekanan evaporasi. proses ini sama seperti proses ekpansi pada sistem pendingin mekanik. Proses ini ditunjukan pada gambar 2.18.
Gambar 2.18. Proses pendinginan [1].
4. Proses pendinginan-adsorpsi-evaporasi
Selama periode ini, adsorber terus melepaskan panas sehingga adsorber terus mengalami penurunan temperatur dan tekanan yang menyebabkan timbulnyabuap adsorpsi. Sementara itu, katup aliran dari evaporator ke adsorber dibuka sehingga adsorbat dalam bentuk uap mengalir dari evaporator ke adsorber. Adsorbat dalam bentuk uap dihasilkan dari proses penyerapan kalor oleh adsorbat dari lingkungan sebesar kalor laten penguapan adsorbat tersebut. Proses ini berlangsung pada tekanan saturasi yang rendah sehingga penyerapan kalor berlangsung pada temperatur saturasi yang rendah pula. Proses ini dilustrasikan pada gambar 2.19.
35 Gambar 2.19. Proses pendinginan-adsorpsi-evaporasi [1]
2.8. Pindahan Panas
Panas (heat) adalah salah satu bentuk energi yang dapat berpindah dari sebuah sistem ke sistem lain karena adanya perbedaan temperatur [2]. Panas dapat berpindah dengan tiga cara yaitu :
1. Konduksi
Gambar.2.20. Perpindahan panas konduksi [2].
Perpindahan panas konduksi adalah perpindahan energi dari partikel-partikel yang mempunyai energi yang lebih ke partikel yang energinya lebih kecil yang berdampingan dengannya sebagai hasil dari interaksi antar partikel [2]. Perpindahan panas konduksi ini dapat dirumuskan dengan :
(2.6) Qcond = Laju perpindahan panas secara konveksi [Watt]
k = Konduktivitas termal [W/m] As = Luas permukaan benda [m2 atau ft2]
36 Ts = Temperatur benda [Kelvin atau Reamur]
T∞ = Temperatur Sekeliling benda [Kelvin atau Reamur]
2. Konveksi
Konveksi adalah perpindahan energi panas dari permukaan yang padat (solid) ke cairan atau gas yang bergerak, hal ini melibatkan efek kombinasi konduksi dan pergerakan fluida [2].
Gambar 2.21. Perpindahan panas konveksi [2].
Laju perpindahan panas secara konveksi diekspresikan dengan hukum pendinginan Newton,yaitu :
(2.7) Qconv = Laju perpindahan panas secara konveksi [Watt]
h = koefisien konveksi [W/m2]
As = Luas permukaan benda [m2 atau ft2]
Ts = Temperatur benda [Kelvin atau Reamur]
T∞ = Temperatur Sekeliling benda [Kelvin atau Reamur]
Hubungan bilangan Nusselt dan bilangan Rayleigh terhadap sifat-sifat fluida dapat dilihat dari persamaan – persamaan berikut dan pada tabel 2.3:
(2.8)
37 Tabel 2.3. Hubungan empiris untuk bilanganNusselt rata-rata untuk konveksi
38 3. Radiasi.
Gambar 2.22. Perpindahan panas secara radiasi [2].
Radiasi adalah energi yang dipancarkan dalam bentuk gelombang elektromagnetik (atau foton) karena adanya perubahan konfigurasi elektron atom/molekul [2]. Radiasi yang dipancarkan benda dapat dituliskan dengan :
(2.10)
Qrad = Laju perpindahan panas radiasi [Watt]
= Emisivitas permukaan 0 ≤
≤
1
σ
= 5,67.10-8 W/m2K4 atau 0,1714.10-8Btu/h.ft2.R4 (Konstanta Stefan Boltzman)As = Luas permukaan benda [m2 atau ft2]
Ts = Temperatur benda [Kelvin atau Reamur]
Tsurr = Temperatur Sekeliling benda [Kelvin atau Reamur]
Laju perpindahan panas radiasi dari dua buah benda persegi yang berdekatan dapat dihubungkan dengan penjelasan berikut :
Gambar 2.23. Dua buah plat yang berdekatan dengan posisi horizontal [2].
(2.11)
Q1-2 = Laju perpindahan panas radiasi dari dua buah benda persegi
39 2.8.1 Kalor Spesifik
Kalor spesifik adalah energi yang dibutuhkan untuk menaikan atau menurunkan temperatur satu derajat persatu unit massa suatu subtansi. Energi ini tergantung pada bagaimana proses dilakukan. Pada thrmodinamika, terdapat dua jenis kalor spesifik yaitu : kalor spesifik pada volume konstan Cv dan kalor spesifik pada tekanan konstan Cp.
Kuantitas energi kalor (Q) dihitung dalam satuan joule (J). Laju aliran kalor dihitung dalam satuan joules per detik (J/s) atau watt (W). Laju aliran energi ini juga disebut daya, yaitu laju dalam melakukan usaha. [1].
Secara fisik, kalor spesifik pada volume konstan dapat digambarkan sebagai energi yang dibutuhkan untuk menaikan atau menurunkan temperatur satu derajat persatu unit massa suatu subtansi selama volume dijaga konstan. Energi yang dibutuhkan untuk melakukan hal yang sama selama tekanan konstan disebut sebagai kalor spesifk pada tekana konstan atau Cp.
(2.12) (2.13)
Kalor spesifik pada tekanan konstan Cp selalu lebih besar dari Cv karena pada tekanan konstan, sistem dapat memuai dan energi untuk kerja ekspansi ini juga harus disuplai ke dalam sistem tersebut . [1].
2.8.2 Kalor laten
Kalor laten adalah jumlah energi yang diserap ataupun dilepaskan saat perubahan fasa terjadi. Lebih lanjut, jumlah energi yang diserap selama proses pencairan disebut sebagai jumlah kalor laten peleburan dan jumlahnya sama dengan jumlah energi yang dibutuhkan selama proses pembekuan. Begitu pula dengan jumlah energi yang diserap selama proses penguapan yang disebut sebagai jumlah kalor laten penguapan dan jumlahnya sama dengan jumlah energi yang dilepaskan selama proses pengembunan.
40 Besarnya kalor laten tergantung pada temperatur dan tekanan ketika perubahan fasa itu terjadi. [1].
QL = Le . m (2.14)
QL = Kalor laten Zat [J]
Le = Kapasitas kalor spesifik laten[J/kg] m = Massa zat [kg]
2.8.3 Kalor Sensibel
Tingkat panas atau intensitas panas dapat diukur ketika panas tersebut merubah temperatur dari suatu subtansi. Perubahan intensitas panas dapat diukur dengan termometer. Ketika perubahan temperatur didapatkan, maka dapat diketahui bahwa intensitas panas telah berubah dan disebut sebagai panas sensible. Dengan kata lain, kalor sensibel adalah kalor yang diberikan atau yang dilepaskan oleh suatu jenis fluida sehingga temperaturnya naik atau turun tanpa menyebabkan perubahan fasa fluida tersebut. [1].
Qs = m . Cp . ΔT (2.15)
Qs = Kalor sensibel zat [J]
Cp = Kapasitas kalor spesifik sensibel [J/kg. K] ΔT = Beda temperatur [K]
41 2.9. Konduktivitas Panas Efektif
Gambar.2.24. Analogi konduksi murni dan konveksi alamiah dalam ruang tertutup [2].
Ketika bilangan nusselt diketahui, laju pindahan panas melalui sebuah ruang yang tertutup dapat ditentukan dengan rumus :
Q = h (T1 –T2) =
A
s(T1 –T2) ; h =(2.16)
Laju pindahan panas melalui benda padat (konduksi) dengan ketebalan Lc, dan
luas penampang As adalah :
Q
kon= k A
s (2.17)• T1&T2 = Temperatur dua benda yang berdekatan, T1>T2
Perbandingan dua buah persamaan di atas mengungkapkan bahwa perpindahan panas secara konveksi dalam ruangan tertutup mirip dengan pindahan panas konduksi melalui lapisan fluida yang tertutup menghasilkan bahwa konduktivitas termal k digantikan dengan kNu. Dan kNu diistilahkan dengan konduktivitas panas
efektif.
42 2.9.1. Plat Persegi Yang Berdekatan Dengan Posisi Horizontal
Gambar 2.25. Dua buah plat persegi yang berdekatan dengan posisi horizontal [2].
Sebagai pendekatan yang pertama, koefisien konveksi untuk ruang horizontal yang dipanaskan dari bawah dapat diperoleh dari korelasi di bawah ini yang diajukan oleh Globe dan Dropkin dalam [3] :
(2.19)
2.9.2. Plat Persegi Yang Berdekatan Dan Membentuk Sudut Dengan Bidang Datar.
Gambar 2.26. Plat persegi yang berdekatan dan membentuk sudut dengan bidang datar [2].
Perpindahan panas pada dua buah plat yang berdekatan dan membentuk sudut dengan bidang datar bergantung pada aspek perbandingan H/L dengan sudut kemiringan tertentu.
43 Untuk perbandingan H/L yang besar (H/L≥12), persamaan di bawah ini (Hollands et al :1976 dalam [2] dapat digunakan hingga sudut kemiringan mencapai 70o. Untuk RaL<105, 0 < θ < 70o, dan H/L ≤ 12
Nu = 1 + 1,44 (2.20)
• Pangkat + (positif) menunjukkan apabila bilangan yang di dalam kurung lebih kecil dari nol, maka nilainya dibuat menjadi nol.
Dan masih menurut Hollands et al dalam [3], untuk H/L≥12 dan sudut kemiringan lebih kecil dari sudut kritis (tabel 2.4), bilangan nusselt dapat dihitung dengan hubungan berikut :
Nu = 1 + 1,44 (2.21)
• Pangkat + (positif) menunjukkan apabila bilangan yang di dalam kurung lebih kecil dari nol, maka nilainya dibuat menjadi nol.
Tabel 2.4. perbandingan H/L dan Sudut kritis θcr .
Untuk perbandingan H/L yang lebih kecil, Catton dalam [3] menyarankan korelasi di bawah ini :
44 2.9.3. Plat persegi vertikal yang berdekatan.
Gambar 2.27. Plat persegi vertikal yang berdekatan [2].
Untuk plat persegi vertikal yang berdekatan, Catton (1978) dalam [2] merekomendasikan dua korelasi di bawah ini berdasarkan Berkovsky dan Polevikov (1977) :
(2.23)
(2.24)
Dan untuk perbandingan H/L yang lebih besar dapat digunakan korelasi berikut :
(2.25)
(2.26)
Semua sifat fluida dievaluasi pada suhu rata-rata
![Gambar 2.1. Adsorption Nomenclature [1].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/3.892.231.719.623.1060/gambar-adsorption-nomenclature.webp)
![Gambar 2.2. Siklus refrigerasi adsorpsi (Clapeyron diagram). [6].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/5.892.225.755.403.702/gambar-siklus-refrigerasi-adsorpsi-clapeyron-diagram.webp)
![Gambar 2.6. Fenomena histeresis adsorpsi dan slope tekanan. [6].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/14.892.282.658.227.546/gambar-fenomena-histeresis-adsorpsi-dan-slope-tekanan.webp)
![Gambar 2.7. Isoterm pada 40 o C. [6].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/15.892.252.679.695.1005/gambar-isoterm-pada-o-c.webp)
![Gambar 2.11 Bentuk butiran zeolit. [1].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/19.892.369.614.124.366/gambar-bentuk-butiran-zeolit.webp)
![Tabel 2.2. Sifat fisik refrigeran [6].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/23.892.170.758.584.728/tabel-sifat-fisik-refrigeran.webp)
![Gambar 2.13. Diagram tekanan vs temperatur yang menggambarkan garis isosters [1].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/27.892.280.660.594.830/gambar-diagram-tekanan-vs-temperatur-menggambarkan-garis-isosters.webp)
![Gambar 2.14. Diagram clapeyron ideal [1].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/28.892.286.666.219.526/gambar-diagram-clapeyron-ideal.webp)
![Gambar 2.16. Proses pemanasan-desorpsi-kondensasi [1].](https://thumb-ap.123doks.com/thumbv2/123dok/4651044.3407013/29.892.319.616.396.617/gambar-proses-pemanasan-desorpsi-kondensasi.webp)