i SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi ( S.Farm )
Program Studi Farmasi
Oleh :
Cosmas Mora Yudiatmoko NIM : 078114050
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iv
vii
KATA PENGANTAR
Dengan penuh rasa syukur penulis panjatkan kepada Tuhan Yang Maha Esa,
karena dengan anugerah serta kehendakNya penulis dapat menyelesaikan penelitian dan
penyusunan skripsi yang berjudul “DAYA ANTIHELMINTIKA INFUSA DAUN
Macaranga tanarius L. TERHADAP CACING USUS AYAM (Ascaridia galli) BETINA
SECARA IN VITRO ”. Skripsi ini disusun untuk memenuhi salah satu syarat
memperoleh gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta. Penulis menyadari bahwa penulisan skripsi ini bukanlah sesuatu hal
yang mudah, hanya dengan bantuan dan dukungan dari berbagai pihak penulis mampu
menyelesaikan skripsi ini. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta yang telah memberikan ijin kepada penulis untuk melakukan
penelitian ini.
2. Maria Dwi Budi Jumpowati, S.Si selaku Dosen Pembimbing yang telah
memberikan petunjuk, saran dan masukan yang berharga dalam proses
penyusunan skripsi.
viii
4. Dr. C. J. Soegihardjo, Apt. selaku Dosen Penguji, atas kritik dan saran yang telah
diberikan sehingga skripsi ini menjadi lebih baik.
5. Mas Parjiman, Mas Heru, Mas Kayat, Mas Yuwono, Mas Wagiran, dan semua staf laboratorium yang telah bersedia membantu selama penelitian di laboratorium.
6. Laboratorium Parasitologi Kedokteran Umum Universitas Gadjah Mada
Yogyakarta yang telah memberikan ijin untuk melakukan penelitian.
7. Bapak Purwono dan Bapak Suradi yang membantu proses penelitian di
Laboratorium Parasitologi Kedokteran Umum Universitas Gadjah Mada
Yogyakarta.
8. Bapak dan Ibu, atas dukungan, kasih sayang, doa dan segala bantuan yang diberikan, baik dalam materi maupun non-materi sehingga penulis mampu menyelesaikan penulisan skripsi ini.
9. Rekan-rekan penelitian, Aryanti Prima Andini, Dina Wulandari, Ari Widya Nugraha, Andreas Arry Mahendra, Elisa Eka Adrianto, dan Aloysia Yossy Kurniawaty, atas bantuan, kerjasama, dan perjuangan selama penelitian. 10.Pihak-Pihak lain yang turut membantu penulis namun tidak dapat disebutkan
satu persatu.
Akhirnya dengan segala kerendahan hati penulis menyadari bahwa tidak ada yang
sempurna di dunia ini. Skripsi ini jauh dari sempurna karena keterbatasan pikiran, waktu
dan tenaga. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang
ix
Akhir kata, semoga skripsi ini dapat bermanfaat untuk menambah ilmu
pengetahuan, khususnya dalam ilmu kefarmasian. Atas perhatiannya, penulis
mengucapkan terimakasih.
Yogyakarta, Februari 2011
x INTISARI
Penyakit infeksi cacing usus terutama oleh cacing Ascaris lumbricoides memiliki prevalensi yang tinggi di Indonesia sehingga memerlukan pengobatan. Daun Macaranga tanarius L. diduga mengandung senyawa yang berkhasiat anthelmintika sebagai alternatif obat modern. Penelitian ini bertujuan untuk mengetahui ada atau tidaknya daya anthelmintika dalam infusa daun M. tanarius L. terhadap cacing Ascaridia galli serta mengidentifikasi adanya senyawa yang diduga memiliki daya anthelmintika. Besarnya daya anthelmintika infusa daun Macaranga tersebut dinyatakan dengan nilai Median Lethal Concentration (LC50) dan Median Lethal Time (LT50).
Jenis penelitian ini adalah ekperimental murni dengan rancangan acak lengkap pola searah. Uji daya anthelmintika dibagi dalam 3 kelompok perlakuan, yaitu kelompok perlakuan perendaman cacing A. galli dalam infusa daun M. tanarius (konsentrasi 10, 20, 40, 60, 80%), kelompok kontrol positif dengan piperazin sitrat (konsentrasi 0,2; 0,4; 0,6; 0,8; dan 1%), dan kelompok kontrol negatif menggunakan larutan garam fisiologis NaCl 0,9% b/v. Data kematian cacing yang diperoleh diuji menggunakan ANOVA satu arah dengan post hoc LSD, kemudian dianalisa dengan menggunakan probit untuk menentukan nilai LC50 dan LT50.
Hasil penelitian menunjukkan rata-rata waktu kematian cacing dalam kontrol negatif NaCl 0,9% b/v adalah 28,6 jam. Nilai LC50 infusa daun M. tanarius sebesar
17,3% dengan LT50, yaitu 15,8 jam. LC50 piperazin sitrat sebesar 0,3% dengan LT50,
yaitu 10,2 jam. Identifikasi kandungan senyawa dengan metode KLT menunjukkan adanya senyawa terpineol dari golongan monoterpenoid pada infusa daun M. tanarius. Dari hasil penelitian disimpulkan bahwa infusa daun M. tanarius memiliki daya anthelmintika terhadap cacing A. galli.
xi ABSTRACT
The intestinal worm infection caused by Ascaris lumbricoides has a quite high prevalence in Indonesia and required a treatment. The use of herbal medicine should be developed as an alternative to modern anthelmintics. It is suspected that Macaranga tanarius L. contains compounds which have anthelmintic activity. Thus, this study was aimed to determine the presence of anthelmintic activity in the infusion of M. tanarius L.’s leaves against Ascaridia galli worms and identify the presence of the compounds which have an anthelmintic activity. The amount of anthelmintic activity of M. tanarius’s leaves infusion was stated at the Median Lethal Concentration (LC50) and Median Lethal Time (LT50).
This study was purely experimental research with completely randomized one direction design. Subject samples used were A. galli worms as substitution for Ascaris lumbricoides. Anthelmintic activity test was divided into three treatment groups, first was a treated group, A. galli was soaked in M. tanarius’s leaves infusion (concentrations of 10, 20, 40, 60, 80% w/v), positive control group using piperazin citrate (concentration of 0.2, 0.4, 0.6, 0.8, and 1% w/v), and negative control group using saline solution NaCl 0.9% w/v. The obtained worm mortality data were tested using one-way ANOVA with post hoc LSD test, then were analyzed by using probit analysis with 95% confidence level to determine LC50 and LT50 value.
The result showed an average time of death of worms in the negative control NaCl 0.9% w/v was 28.6 hours.. From the test using the probit analysis obtained LC50
of M. tanarius’s leaves infusion was equal to 17.3% and LT50 of M. tanarius’s leaves
infusion was 15.8 hours. LC50 of piperazin citrate was 0.3% and LT50 piperazin
citrate was 10.2 hours. Phytohemical compounds identification with TLC method showed the existence of terpineol, a terpenoid compounds in M. tanarius’s leaf infusion. From these result, it was concluded that M. tanarius’s leaf infusion had anthelmintic activity to the A. galli worm.
Key words: Macaranga tanarius, L.’s leaves infusion, anthelmintics, piperazin citrate, Ascaridia galli, Median Lethal Concentration (LC50), Median
xii
PERNYATAAN KEASLIAN KARYA ... v
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
xiii
1. Keterangan botani ………...……….... 8
2. Deskripsi tanaman ... 8
3. Kandungan kimia ... 9
4. Kegunaan dan khasiat………. ... 9
C. Infundasi ... 10
B. Ascaridia galli ... 10
D. Anthelmintika ... 15
E. Piperazin………. 16
F. Toksisitas……… 17
G. Kromatografi Lapis Tipis (KLT)………... 18
H. Landasan Teori……... 20
I. Hipotesis………...….. 22
BAB III METODE PENELITIAN ... 23
A. Jenis dan Rancangan Penelitian ... 23
B. Variabel Penelitian dan Definisi Operasional ……....………...…... 24
C. Bahan Penelitian ... 25
D. Alat Penelitian ... 26
E. Tata Cara Penelitian ... 27
F. Analisis Hasil ... 32
BAB IV HASIL DAN PEMBAHASAN ... 34
A. Identifikasi Tanaman Macaranga tanarius, L. ... 34
xiv
C. Uji Daya Anthelmintika Infusa Daun M. tanarius, L. ... 38
D. Identifikasi Kualitatif Kandungan Senyawa Dalam Infusa Daun M. tanarius, L. dengan Metode Kromatografi Lapis Tipis (KLT)……… 55
BAB V KESIMPULAN DAN SARAN ... 62
A. Kesimpulan ... 62
B. Saran ... 62
DAFTAR PUSTAKA ... 63
LAMPIRAN ... 67
xv
DAFTAR TABEL
Tabel I. Pembuatan variasi konsentrasi infusa daun M. tanarius... 29 Tabel II. Pembuatan variasi konsentrasi larutan piperazin sitrat sebagai kontrol
positif... 30 Tabel III. Waktu kematian cacing Ascaridia galli pada larutan NaCl 0,9% (Uji
lama waktu hidup cacing)... 40 Tabel IV. Hasil analisa signifikansi dengan post hoc LSD... 43 Tabel V. Jumlah kematian cacing A. galli pada perlakuan infusa daun M.
tanarius……..………... 45 Tabel VI. Data jumlah kematian cacing A. galli pada jam ke-16 perlakuan infusa
daun M. tanarius untuk mencari nilai LC50 menggunakan analisa
probit... 46 Tabel VII. Jumlah kematian cacing A. galli pada larutan piperazin sitrat (kontrol
positif)………... 47 Tabel VIII. Data jumlah kematian cacing A.galli pada jam ke-10 perlakuan larutan
piperazin sitrat (kontrol positif) untuk mencari LC50 menggunakan
analisa probit... 48 Tabel IX. Perbandingan perhitungan LC50 infusa daun M. tanarius dan
piperazin sitrat dengan analisa probit... 49 Tabel X. Kematian cacing A. galli pada konsentrasi yang ekuivalen dengan
LC50 infusa daun M. tanarius…... 50
Tabel XI. Kematian cacing A. galli pada konsentrasi yang ekuivalen dengan LC50 piperazin sitrat... 52
Tabel XII. Perbandingan perhitungan LT50 infusa daun M. tanarius dan
piperazin sitrat dengan analisa probit... 53 Tabel XIII. Hasil pengamatan identifikasi kualitatif kandungan senyawa dalam
xvi
DAFTAR GAMBAR
Gambar 1. Siklus hidup Ascaris lumbricoides... 14 Gambar 2. Grafik konsentrasi kelompok perlakuan vs rata-rata waktu kematian
cacing (jam)... 42 Gambar 3. Grafik hubungan waktu vs mortalitas cacing A.galli berdasarkan
persamaan regresi probit LT50 infusa daun M. tanarius dan piperazin sitrat... 53 Gambar 4. Profil KLT infusa daun M. tanarius, L dengan pembanding
terpineol. (A) Deteksi UV 254 nm. (B) Deteksi UV 365 nm. (C)
Pengamatan langsung dengan sinar tampak (visibel)... 57 Gambar 5. Struktur kimia dari senyawa friedooleanane dan friedelin yang
xvii
DAFTAR LAMPIRAN
Lampiran 1. Surat keterangan determinasi tanaman Macaranga tanarius, L. dari Fakultas Farmasi Universitas Sanata Dharma ……... 67 Lampiran 2. Surat hasil determinasi cacing A. galli dari Fakultas Kedokteran
Hewan Universitas Gadjah Mada Yogyakarta... 68 Lampiran 3. Surat keterangan pengujian kandungan terpenoid dengan metode
KLT ………... 69 Lampiran 4. Foto tanaman dan serbuk daun Macaranga tanarius, L. ... 70 Lampiran 5. Gambar bagian anterior dan posterior cacing A. galli ... 71 Lampiran 6. Gambar bagian anterior dan skema morfologi A. lumbricoides…...… 72 Lampiran 7. Foto seri konsentrasi infusa daun M. tanarius, L., larutan piperazin,
cacing A. galli, dan dokumentasi perlakuan perendaman….………. 73 Lampiran 8. Data pengamatan waktu kematian cacing A. galli ... 75 Lampiran 9. Analisa statistik dengan metode Oneway ANOVA dan post hoc
LSD………... 76 Lampiran 10. Analisa probit untuk mencari LC50 infusa daun M. tanarius... 79 Lampiran 11. Analisa probit untuk mencari LC50 piperazin sitrat... 82 Lampiran 12. Analisa probit untuk mencari LT50 infusa daun M. tanarius pada
konsentrasi yang ekuivalen dengan LC50 infusa daun M.
tanarius... 85 Lampiran 13. Analisa probit untuk mencari LT50 piperazin sitrat pada
1 BAB I PENGANTAR
A. Latar Belakang
Infeksi cacing usus masih merupakan masalah kesehatan masyarakat di negara berkembang, termasuk Indonesia. Infeksi tersebut merupakan infeksi yang paling banyak menyerang anak balita dan anak usia sekolah dasar. Seperti yang tertulis dalam KepMenKes No: 424/MENKES/VI/2006, pemerintah menyatakan bahwa hasil survei Subdirektorat Diare pada tahun 2002 dan 2003 pada 40 sekolah dasar di 10 propinsi menunjukkan prevalensi infeksi cacing usus pada anak-anak usia sekolah dasar berkisar antara 2,2 - 96,3% (Departemen Kesehatan RI, 2006).
Anak-anak paling sering terserang penyakit cacing usus karena kebiasaan mereka memasukkan tangan ke dalam mulut, misalnya pada saat makan tanpa mencuci tangan setelah beraktivitas. Namun demikian, sesekali orang dewasa juga dapat terinfeksi cacing. Cacing usus yang paling sering ditemui adalah cacing gelang, cacing tambang, cacing cambuk, cacing pita dan cacing kremi. Semua cacing masuk ke dalam perut melalui mulut, kecuali cacing tambang yang larvanya dapat menembus kulit (Oswari, 1995).
tersebut menjadi masalah kesehatan masyarakat terutama di pedesaan dan di daerah kumuh perkotaan di Indonesia (Mardiana & Djarismawati, 2008).
Salah satu penyebab infeksi cacing usus pada manusia yang umum adalah Ascaris lumbricoides atau lebih dikenal dengan cacing gelang. Cacing ini penularannya dengan perantaraan tanah (soil transmited helminths). A. lumbricoides merupakan cacing bulat (roundworm) yang biasanya bersarang dalam usus halus. Adanya cacing di dalam usus penderita akan mengakibatkan gangguan keseimbangan fisiologi dalam usus, menyebabkan iritasi setempat sehingga mengganggu gerakan peristaltik dan penyerapan makanan. Infeksi yang disebabkan oleh cacing ini disebut askariasis (Rasmaliah, 2001). Kejadian askariasis juga muncul pada unggas yang disebabkan oleh cacing Ascaridia galli yang merupakan cacing Nematoda dari famili yang sama dengan cacing A. lumbricoides (Levine, 1981).
Dampak yang terjadi akibat infeksi cacing pada manusia dapat mengakibatkan menurunnya kondisi kesehatan, gizi, dan kecerdasan pada anak-anak. Selain itu, akan dapat mengurangi produktivitas kerja pada orang dewasa sehingga secara ekonomi banyak menyebabkan kerugian yang dikarenakan penderita infeksi cacing akan mengalami kehilangan karbohidrat dan protein sebagai sumber makanan serta kekurangan darah yang akhirnya berdampak pada turunnya kualitas sumber daya manusia (Departemen Kesehatan RI, 2006).
penduduk yang kurang mampu. Salah satu solusi yang dipilih adalah menggunakan obat-obatan herbal tradisional (back to nature) yang sudah dikenal murah. Oleh karena itu, dengan meningkatnya penggunaan dan permintaan obat tradisional, kebutuhan penelitian di bidang obat-obatan tradisional pun turut meningkat. Penelitian tentang obat-obatan tradisional ditujukan antara lain untuk mengevaluasi manfaat obat tradisional serta keamanannya secara ilmiah.
memberikan referensi bagi pemanfaatan obat tradisional, khususnya dalam kaitan penanganan masalah infeksi cacing, yaitu sebagai obat anthelmintika. Dengan demikian, pemanfaatan tumbuhan ini sebagai obat dapat menjadi semakin lengkap dan berdasar pada landasan ilmiah, yang kemudian diharapkan turut meningkatkan upaya-upaya pelayanan kesehatan masyarakat.
Infusa dipilih sebagai sediaan dalam penelitian ini dikarenakan adanya pendekatan metode dengan pola penggunaan obat tradisional di masyarakat yang umumya dibuat secara mudah dan praktis, yaitu dengan cara merebus simplisia tanaman sehingga diharapkan nantinya masyarakat dapat dengan mudah mengaplikasikan dan memanfaatkan hasil penelitian ini. Pelarut yang digunakan yaitu air, merupakan pelarut yang murah dan mudah didapat serta jika dilihat dari segi keamanannya, air lebih aman dan praktis digunakan oleh masyarakat daripada pelarut lain seperti eter, metanol, dan n-heksan. Menurut Santoso, Sidik, dan Wattimena (1991), pelarut air dapat digunakan untuk menyari alkaloid, minyak menguap, glikosida, tanin, dan gula. Minyak menguap (atsiri) merupakan senyawa yang tersusun atas senyawa terpenoid, sehingga air bisa digunakan sebagai penyari untuk senyawa terpenoid, terutama terpen penyusun minyak atsiri dan glikosida terpenoid yang larut dalam air.
cacing A. lumbricoides tersebut harus dikeluarkan dari tubuh penderita dalam keadaan hidup tanpa pengaruh obat cacing. Selain itu, A. galli dipilih karena mempunyai kekerabatan yang dekat dengan A. lumbricoides dan infeksinya sama-sama dapat diobati dengan piperazin. Piperazin dipilih sebagai kontrol positif karena merupakan obat pilihan untuk infeksi cacing A. galli dan juga paling banyak digunakan untuk infeksi cacing tersebut (Tabbu, 2002).
Penelitian ini menggunakan rancangan acak lengkap pola searah. Daya anthelmintika diketahui dengan mengamati kematian cacing tiap jamyang kemudian dianalisa menggunakan analisis varian satu arah (one way ANOVA). Analisis varian satu arah digunakan untuk mengetahui ada atau tidaknya perbedaan bermakna antara kelompok kontrol positif, kontrol negatif dan kelompok perlakuan, yang dilanjutkan dengan uji post hoc Least-Significant Difference (LSD). Setelah itu dihitung besar daya anthelmintika yang dinyatakan dengan nilai LC50 (Median Lethal Concentration) dan LT50 (Median Lethal Time) dengan menggunakan analisa probit.
1. Rumusan masalah
Berdasarkan uraian pada latar belakang yang dikemukakan di atas, maka dirumuskan permasalahan sebagai berikut.
a. Apakah infusa daun M. tanarius L. memiliki daya anthelmintika terhadap cacing A. galli betina secara in vitro?
c. Apakah daun M. tanarius mengandung senyawa terpenoid yang diduga memiliki daya anthelmintika terhadap cacing A. galli betina?
2. Keaslian penelitian
Penelitian mengenai daya anthelmintika bahan obat alam sudah banyak dilakukan, antara lain penelitian daun pare untuk obat cacing pada domba (Tarmudji, 2004) dan penelitian daya anthelmintika infusa biji ceguk (Quisqualis indica L.) terhadap cacing kait anjing (Ancylostoma spp.) secara in vitro (Mulyaningsih, 2010). Namun sejauh pengetahuan penulis, penelitian tentang daya anthelmintika infusa daun M. tanarius L. terhadap cacing A. galli belum pernah dilakukan.
Penelitian-penelitian berkait tanaman M. tanarius L. yang sudah pernah dilakukan antara lain pengujian daya antibakteri, antioksidan, sitotoksisitas, dan daya anti-tyrosinase (Lim et al, 2009), serta pengujian atau eksplorasi kandungan senyawa aktif yang ada dalam tanaman M. tanarius L. (Jurgens, Feldhaar, Feldmeyer, & Fiala, 2005; Hui et al., 1974).
3. Manfaat penelitian a. Manfaat teoritis
b. Manfaat praktis
Penelitian ini diharapkan memberikan informasi mengenai daya anthelmintika infusa daun M. tanarius L. kepada masyarakat sehingga mendorong upaya pengembangan dan penggunaan obat bahan alam sebagai obat cacing
B. Tujuan Penelitian
1. Mengetahui ada atau tidaknya daya anthelmintika infusa daun M. tanarius, L. terhadap cacing A. galli betina secara in vitro.
2. Mengetahui besar daya anthelmintika infusa daun M. tanarius, L. terhadap cacing A. galli betina secara in vitro yang dinyatakan dengan nilai Median Lethal Concentration (LC50)dan MedianLethal Time (LT50).
8
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Macaranga tanarius L. 1. Keterangan botani
Tanaman M. tanarius L. ini tergolong ke dalam famili Euphorbiaceae dan termasuk genus Macaranga, dengan nama spesies Macaranga tanarius L.. Tanaman ini di daerah Jawa sering disebut tutup ancur, di Batak disebut mapu, dan di daerah Sunda disebut mara (Plantamor, 2008).
2. Deskripsi tanaman
3. Kandungan kimia
Daun Macaranga mengandung senyawa terpen cis-3-hexenol, cis-3-hexenyl acetate, benzaldehyde, 2 phenyl ethyl alcohol, β-pinen, D-limonen, β-linalool, geranyl acetone, 5-hydroxymethylfurfural, α-copaene, friedelin, friedelan-3β-ol, β-amyrenone, β-amyrin dan banyak terpenoid yang lain (Jurgens et al., 2005; Hui et al., 1974). Selain itu juga ditemukan beberapa senyawa baru di antaranya, yaitu nymphaeol A, nymphaeol B, tannariflavanone B, blumenol A (fomivoliol), blumenol B (7,8-dihydrovomifoliol) dan annuionone E. (Phomart, Sutthivaiyakit, Chimnoi, & Ruchirawat, & Sutthivaiyakit, 2005).
4. Kegunaan dan khasiat
Di Sumatera tanaman Macaranga ini diambil kayunya sebagai bahan bakar yang memiliki kualitas baik. Serat kayunya digunakan sebagai bahan pembuat kertas karena kualitas seratnya halus dan ringan. Daun tanaman ini juga diketahui digunakan sebagai pewarna. Di Indonesia dan di Filipina, getah tanaman ini disadap untuk dijadikan bahan perekat (World Agroforestry Centre, 2010).
dilaporkan oleh Jurgens et al. (2005), dirasa perlu untuk diteliti mengenai khasiat sebagai anthelmintika.
B. Infundasi
Infundasi adalah suatu metode penyarian untuk mengekstraksi simplisia menggunakan air sehingga didapatkan bentuk sediaan infusa. Infusa adalah sediaan cair yang dibuat dengan mengekstraksi simplisia nabati dengan air pada suhu 900C selama 15 menit, sambil sekali-sekali diaduk. Infusa diserkai selagi panas melalui kain flannel, ditambah air panas secukupnya melalui ampas hingga diperoleh volume infusa yang dikehendaki (Departemen Kesehatan RI, 1986).
C. Ascaridia galli
Menurut Levine (1981) cacing A. galli diklasifikasikan dalam filum Nemathelmintes dan kelas Nematoda, serta digolongkan dalam famili Ascarididae, dan genus Ascaridia.
Cacing ini merupakan parasit pada ternak unggas yang termasuk dalam soil transmitted helminthes dan biasa ditemukan pada usus ayam dan unggas lain di seluruh dunia. Panjang cacing jantan 30-80 mm dan diameter 0,5-1,2 mm. Penghisap preanal berdiameter sekitar 220 µm dan mempunyai papila-papila pada tepi tubuh bagian posterior. Panjang spikulum sekitar 4 mm. Cacing betina panjangnya 60-120 mm dan diameter 0,9-1,8 mm dengan telur berukuran 75-80 x 45-50 mikron (Levine, 1981).
dinding usus dan pindah ke dalam jaringan mukosa usus. Setelah dewasa, larva masuk lagi ke dalam rongga usus dan tumbuh menjadi cacing dewasa dan mulai mengeluarkan telurnya (Nugroho, 1989). Sejumlah besar A. galli dewasa di dalam lumen usus halus dapat membunuh induk semang, tetapi biasanya tidak cukup banyak untuk dapat membunuh. Gejala-gejala berkisar dari mulai tidak tampak sampai terjadinya hambatan pertumbuhan badan akibat penyerapan nutrisi yang sangat buruk. Banyak larva masuk ke dalam selaput lendir usus dan menyebabkan perdarahan dan kerusakan yang hebat. Mungkin timbul enteritis berdarah pada infeksi berat. Pengaruh yang paling serius terjadi kira-kira 2 minggu setelah inokulasi (Levine, 1981)
Cacing A. galli secara morfologi dan anatomi tubuhnya dapat dikatakan analog dengan Ascaris lumbricoides yang merupakan parasit pada manusia, namun demikian belum diketahui mengapa cacing A. galli tidak bisa menginfeksi manusia dan begitu pula dengan cacing A. lumbricoides yang tidak dapat menginfeksi unggas meskipun keduanya berada dalam satu golongan famili yang sama. Namun ada dugaan sementara bahwa perbedaan sistem antibodi turut berperan membatasi infeksi cacing tersebut, misalnya pada manusia terdapat imunoglobulin G yang berfungsi dalam pertahanan terhadap parasit, seperti cacing.
Secara morfologi dan anatomi, cacing A. lumbricoides tidak jauh berbeda dengan cacing A. galli. Perbedaan yang paling tampak dari ke duanya, yaitu pada ukuran dimana cacing A. lumbricoides memiliki ukuran yang lebih besar daripada cacing A. galli. Cacing A. lumbricoides dewasa berwarna putih atau merah muda. Cacing ini mudah diidentifikasi karena ukurannya besar (jantan 10-31 cm; betina 20-35 cm), lapisan kutikulum yang rata dan bergaris halus, ujung anterior dan posterior yang membulat (conical), ujung posterior yang melengkung ke ventral dan papil dengan 2 buah spikulum pada cacing jantan, mulut yang mempunyai 3 bibir lonjong dengan papil peraba, sepasang alat kelamin pada 2/3 bagian posterior cacing betina dan 1 saluran panjang yang berkelok-kelok pada cacing jantan (Faust & Russel, 1968).
usus dan menyebabkan kelainan pada penyerapan nutrisi dari makanan. Jika jumlah cacing berlebih maka dapat terjadi obstruksi usus (Hamsafir, 2010). Jika diamati lebih jauh, patogenitas cacing A. galli dan A. lumbricoides memiliki kesamaan sehingga secara patogenitas pun dapat dikatakan analog.
Siklus hidup A. lumbricoides dapat digambarkan pula sebagai berikut.
Gambar 1. Siklus hidup Ascaris lumbricoides (Chiodini, Moody, & Manser, 2001)
Keterangan :
1. Telur dengan embrio matang (telur infektif). 2. Larva cacing keluar dari telur.
3. Larva mampu menembus lapisan mukosa dan jaringan tubuh. 4. Larva cacing berkembang menjadi dewasa berada pada intestinum. 5. Cacing dewasa berkembangbiak pada saluran cerna (intestinum) 6. Telur yang dihasilkan keluar bersama feses dan memulai siklus baru.
1
2
3
4
5
D. Anthelmintika
Anthelmintika atau obat cacing adalah obat yang digunakan untuk memberantas atau mengurangi cacing dalam lumen usus atau jaringan tubuh. Kebanyakan obat cacing diberikan secara oral, pada saat makan atau sesudah makan (Sukarban & Santoso, 1995).
1. Jenis anthelmintika
Obat yang digunakan untuk membasmi cacing secara umum dibagi menjadi dua golongan, yaitu :
a. Vermifuga, yaitu bekerja dengan cara memabukkan (paralisis) cacing dalam dosis rendah.
b. Vermisida, yaitu bekerja dengan cara langsung membunuh cacing. 2. Mekanisme anthelmintika
Siswandono dan Sukarjo (1995) mengelompokkan mekanisme reaksi anthelmintika sebagai berikut :
a. Anthelmintika yang menyebabkan paralisis atau kematian cacing, contoh : levamisol, pirantel pamoat, dan piperazin.
b. Anthelmintika yang mengiritasi dan merusak jaringan cacing, contoh : heksilresorsinol.
d. Anthelmintika yang menghambat enzim tertentu, contoh : levamisol, pirantel pamoat.
Anthelmintika dari bahan alam yang sudah pernah diteliti memiliki mekanisme kerja yang beragam pula, antara lain tannin dan flavonoid yang bekerja dengan mempengaruhi metabolisme glikogen cacing sehingga tidak mampu berkembang menjadi dewasa. Disebutkan pula bahwa flavonoid secara sistemik dapat bertindak sebagai imunostimulator yang dapat meningkatkan respon tubuh hospes terhadap parasit melalui mekanisme peningkatan konsentrasi IgG, sehingga membuat eosinofil bekerja lebih optimal sebagai antiparasit (Ridwan, Satrija, Darusman, dan Handharyani, 2010). Senyawa terpen alkaloid juga disebutkan memiliki daya anthelmintika dengan mekanisme toksisitas akut pada cacing dan juga menghambat perkembangan telur cacing (Tarmudji, 2004).
E. Piperazin
Piperazin terdapat sebagai heksahidrat yang mengandung 44% basa. Juga didapat sebagai garam sitrat, kalsium edetat, dan tatrat. Garam-garam ini bersifat stabil non higroskopik, berupa kristal putih yang larut dalam air, larutannya bersifat sedikit asam (Sukarban & Santoso, 1995).
dan tidak diperlukan pencahar untuk mengeluarkan cacing itu. Cara kerja piperazin diduga pada otot cacing dengan menggangu permeabilitas membran sel terhadap ion-ion yang berperan dalam mempertahankan potensial istirahat, sehingga menyebabkan hiperpolarisasi dan supresi impuls spontan, disertai paralisis (Ganiswarna, Setiabudi, Sjamsudin, dan Bustami, 1987).
Penyerapan piperazin melalui saluran cerna cukup baik. Sebagian obat yang diserap mengalami metabolisme, sisanya diekskresi melalui urin (Beckman,1961).
Piperazin memiliki batas keamanan yang lebar. Dosis terapi pada umumnya tidak menyebabkan efek, kecuali kadang-kadang nausea, vomitus, diare dan alergi. Piperazin dapat memperkuat efek kejang pada penderita epilepsi dan pada penderita gangguan faal ginjal dapat menyebabkan inkoordinasi otot atau kelemahan otot. Oleh karena itu, piperazin tidak boleh diberikan kepada penderita penyakit epilepsi. (Ganiswarna dkk., 1987).
Dosis piperazin untuk dewasa terhadap Ascaris adalah 75 mg/kg berat badan atau dosis tunggal dari 3 gram selama 2 hari. Untuk anak-anak terhadap Ascaris, yaitu 50 mg/kg berat badan, yakni 1-2 tahun sebanyak 1 gram, 3-5 tahun sebanyak 2 gram dan di atas 6 tahun 3 gram sekaligus (Tan & Rahardja, 2002).
F. Toksisitas
suatu senyawa dan untuk menentukan peringkat lethalitas senyawa tersebut (Loomis, 1987).
Data yang diperoleh dari uji ini dapat berupa data kuantitatif yang dinyatakan dengan nilai LC50 (Median Lethal Concentration) atau LD50 (Median Lethal Dose),
atau data kualitatif yang berupa penampakan klinis dan morfologi efek toksik senyawa uji. LC50 merupakan konsentrasi yang dapat menyebabkan kematian separuh
hewan uji, sedangkan LD50 merupakan dosis yang dapat menyebabkan kematian
separuh hewan uji (Loomis, 1978). LC50 dan LD50 sama-sama merupakan parameter
toksisitas, perbedaanya hanyalah pada satuan yang digunakan, yaitu konsentrasi atau dosis.
Data LC50 ini selanjutnya digunakan untuk menghitung nilai LT50 (Median Lethal Time). LT50 merupakan waktu yang dibutuhkan untuk menyebabkan kematian
separuh hewan uji.
G. Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis (KLT) adalah metode pemisahan fisikokimia. Lapisan yang memisah terdiri dari bahan berbutir-butir (fase diam), ditempatkan pada penyangga berupa pelat gelas, logam atau lapisan yang cocok. Campuran yang akan dipisah ditaruh dalam bejana, tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak). Selanjutnya senyawa yang tidak berwarna harus ditampakkan (dideteksi) (Stahl, 1985).
yang digunakan khusus untuk KLT yang dihasilkan oleh berbagai perusahaan. Penyerap yang umum ialah silica gel, alumunium oksida, kieselgur, selulosa dan turunannya, poliamida dan lain-lain. Dari banyak macam fase penyerap, silica gel merupakan fase penyerap yang paling banyak digunakan karena sifatnya inert untuk banyak macam senyawa. Bila dilihat dalam sinar jatuh dan sinar lewat, lapisan yang kering mempunyai kenampakan yang seragam dan membentuk ikatan yang baik dengan penyangga. Panjang lapisan tersebut 200 mm dengan lebar 200 mm atau 100 mm. Untuk analisis, tebalnya 0,1-0,3 mm, biasanya 0,2 mm. Sebelum digunakan, lapisan disimpan dalam lingkungan yang tidak lembab dan bebas dari uap laboratorium (Stahl, 1985).
Fase gerak ialah medium angkut dan terdiri atas satu atau beberapa pelarut. Fase gerak tersebut bergerak di dalam fase diam, yaitu suatu lapisan berpori, karena ada gaya kapiler. Yang digunakan hanyalah pelarut bertingkat mutu analitik, dan bila diperlukan, sistem pelarut multikomponen ini harus berupa suatu campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen (Stahl, 1985).
Identifikasi suatu senyawa dapat menggunakan harga Rf (retention factor), di mana Rf ini didefinisikan sebagai berikut :
Angka Rf antara 0 sampai 1 dan dinyatakan dalam desimal (0,00-1,00), sedangkan angka hRf adalah angka Rf dikalikan faktor 100 (Stahl, 1985).
Senyawa dikatakan sama atau identik jika senyawa tersebut mempunyaiharga Rf dan disertai dengan warna bercak yang sama pula. Kesamaan warna bercak dapat pula menunjukkan adanya kemiripan struktur kimia suatu senyawa (Saifudin, Suparti, Fuad, dan Da’i, 2006).
H. Landasan Teori
Prevalensi penyakit infeksi cacing di Indonesia masih tergolong cukup tinggi. Hal
ini dikarenakan iklim tropis di Indonesia sangat mendukung perkembangan berbagai
macam jenis parasit, terutama cacing. Perilaku hidup yang kurang memperhatikan
kebersihan lingkungan juga turut membuat angka infeksi cacing, terutama cacing usus
tetap tinggi. Dari kondisi tersebut, masyarakat yang pada umumnya memiliki kondisi
sosial ekonomi yang rendah lebih memilih alternatif pengobatan tradisional yang relatif
lebih murah. Oleh karena itu, eksplorasi pengobatan tradisional dewasa ini cenderung
meningkat karena pengobatan herbal dianggap memiliki efek samping yang lebih kecil
Tanaman Macaranga (M. tanarius L.) memiliki banyak potensi sebagai obat
herbal dikarenakan banyaknya kandungan bioaktif yang ada di dalamnya. Beberapa
kegunaan tanaman yang sudah diteliti antara lain sebagai penurun panas (antipiretik), pereda batuk (antitussive), agen emetik, antibakteri, serta antioksidan, namun belum diketahui mengenai daya anthelmintikanya (Lim, et al, 2009).
Daun M. tanarius mengandung senyawa terpen cis-3-hexenol, cis-3-hexenyl acetate, benzaldehyde, 2-phenyl ethyl alcohol, β-pinen, D-limonen, β-linalool, geranyl acetone, 5-hydroxymethylfurfural, α-copaene, friedel-3ene, friedelin, friedelan-3β-ol, β-amyrenone, β-amyrin dan banyak terpenoid yang lain (Jurgens et al., 2005; Hui et al., 1974). Senyawa terpen memiliki efek anthelmintika yang lebih kuat dibandingkan dengan senyawa saponin, gula, dan tanin (Tarmudji, 2004). Senyawa terpen dan alkaloid juga disebutkan memiliki daya anthelmintika dengan mekanisme toksisitas akut pada cacing dan juga menghambat perkembangan telur cacing (Tarmudji, 2004). Dengan adanya banyak senyawa terpenoid yang terkandung dalam tanaman M. tanarius maka tanaman ini diduga memiliki daya anthelmintika.
I. Hipotesis
23 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian uji daya anthelmintik infusa daun Macaranga tanarius, L. terhadap cacing Ascaridia galli ini termasuk dalam jenis penelitian eksperimental murni dengan rancanganacak lengkap pola searah. Penelitian ini menggunakan 3 kelompok perlakuan, yaitu kelompok I adalah kelompok perlakuan dengan infusa daun M. tanarius, kelompok II adalah kelompok pembanding (kontrol positif) dengan menggunakan piperazin sitrat, dan kelompok III adalah kelompok kontrol negatif dengan menggunakan larutan garam fisiologis NaCl 0,9% b/v. Penelitian ini dilakukan di Laboratorium Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma dan Laboratorium Parasitologi Fakultas Kedokteran Hewan Universitas Gadjah Mada, Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
a. Variabel bebas
b. Variabel tergantung
1) Jumlah cacing yang mati setelah diberi perlakuan dengan infusa daun M. tanarius dalam berbagai konsentrasi setiap jam pada periode waktu pengamatan untuk memperoleh nilai LC50.
2) Waktu yang dibutuhkan untuk membunuh cacing setelah diberikan perlakuan dengan larutan infusa daun M. tanarius dengan berbagai konsentrasi untuk mendapatkan nilai LT50.
c. Variabel pengacau
1) Variabel pengacau terkendali yaitu: ukuran cacing yang digunakan (diameter 0,5-1 mm dan panjang 5-8 cm), jenis kelamin cacing (betina), asal tanaman M. tanarius yaitu dari kebun obat Fakultas Farmasi Universitas Sanata Dharma, Paingan, Maguwoharjo, waktu panen (bulan Maret 2010), dan volume larutan uji (30 ml).
2) Variabel pengacau tak terkendali yaitu: umur cacing, suhu ruangan perlakuan.
2. Definisi operasional
b. Infusa daun M. tanarius adalah ekstrak yang diperoleh dari daun M. tanarius yang penyariannya dilakukan dengan cara infundasi dengan menggunakan pelarut air.
c. Daya anthelmintika adalah kemampuan suatu senyawa untuk dapat membunuh atau menghambat perkembangan cacing dan dinyatakan dengan nilai Median Lethal Concentration (LC50) dan Median Lethal Time (LT50) senyawa tersebut
dibandingkan dengan kontrol positif.
d. Median Lethal Concentration (LC50) adalah konsentrasi infusa daun M. tanarius yang dibutuhkan untuk membunuh separuh dari jumlah hewan uji. e. Median Lethal Time (LT50) adalah waktu yang dibutuhkan untuk membunuh
separuh dari jumlah hewan uji akibat pemberian infusa daun M. tanarius pada konsentrasi tertentu.
f. A. galli adalah cacing yang diperoleh dari usus ayam di pemotongan ayam Pasar Terban Yogyakarta, dan digunakan sebagai subjek uji pengganti Ascaris lumbricoides. Jenis kelamin cacing yang digunakan adalah cacing betina dewasa dengan ukuran diameter ± 0,5-1 mm dan panjang 5-8 cm.
C. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut. 1. Cacing A.galli betina sebagai hewan uji, didapat dari pemotongan ayam Pasar
2. Daun M. tanarius sebagai bahan uji, dipanen pada bulat Maret 2010 dan diperoleh dari Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
3. Larutan NaCl fisiologis (NaCl 0,9%) merk Otsuka sebagai kontrol negatif. Digunakan juga sebagai pelarut infusa daun M. tanarius dan piperazin sitrat. 4. Piperazin sitrat sebagai kontrol positif perlakuan diperoleh dari Laboratorium
Kimia Analisis, Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta.
5. Aquades diperoleh dari Laboratorium Farmakologi dan Toksikologi Universitas Sanata Dharma Yogyakarta.
6. Bahan uji KLT :
a. Terpineol sebagai senyawa pembanding KLT didapatkan dari Laboratorium Penelitian dan Pengujian Terpadu (LPPT) Universitas Gadjah Mada Yogyakarta.
b. Vanillin-asam sulfat sebagai pereaksi penampak pada KLT . c. Fase gerak KLT toluena - etil asetat (93:7, v/v)
d. Fase diam KLT : Silica Gel GF254 sebagai fase diam.
D. Alat Penelitian
Oven (Memmert), mesin penyerbuk (Retsch), ayakan, seperangkat alat gelas (Pyrex Iwaki Glass), shaker, seperangkat alat KLT : bejana pengembangan, detektor UV 254 nm dan 365 nm, plat silica gel GF254, panci infundasi, neraca analitik
E. Tata Cara Penelitian 1. Identifikasi tanaman M. tanarius L.
Identifikasi tanaman M. tanarius menggunakan biji, bunga, daun, batang yang dilakukan dengan pengamatan secara makroskopis terhadap bagian-bagian tersebut dan membandingkannya dengan herbarium kering, serta dicocokan dengan buku panduan identifikasi (Koorders dan Valeton, 1918). Identifikasi tanaman dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Pengumpulan, pengeringan, dan pembuatan serbuk daun M. tanarius
3. Pengumpulan cacing Ascaridia galli
Cacing A.galli diambil dari usus ayam yang baru disembelih dan segera dimasukkan dalam toples yang berisi larutan garam fisiologis NaCl 0,9% b/v. Pengumpulan cacing dilakukan di lokasi pemotongan ayam Pasar Terban, Yogyakarta. Cacing yang digunakan adalah cacing betina dewasa dengan ukuran diameter ± 0,5-1 mm dan panjang 5-8 cm serta tidak tampak adanya cacat atau kerusakan pada tubuh cacing.
4. Identifikasi cacing A. galli
Identifikasi cacing A.galli dilakukan secara mikroskopis di Laboratorium Parasitologi Fakultas Kedokteran Hewan Universitas Gadjah Mada Yogyakarta. Cara melakukan identifikasi adalah dengan melihat bagian-bagian preparat cacing A.galli di bawah mikroskop dan mencocokkan preparat bagian posterior dan anterior cacing (seperti pada lampiran 5) dengan buku panduan identifikasi cacing (Yamaguti, 1961).
5. Pembuatan infusa daun M. tanarius
diperoleh sesuai volume yang ditetapkan. Penambahan volume dengan aquadest dilakukan melalui ampas dalam keadaan panas.
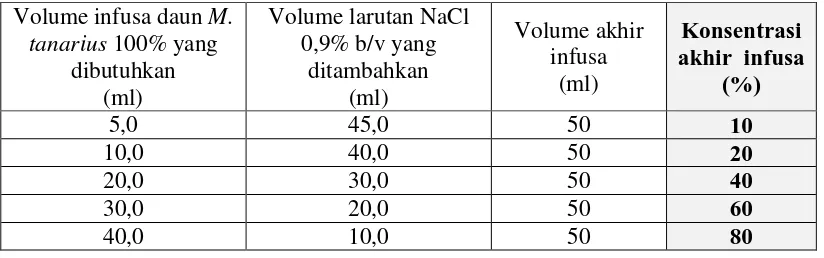
6. Pembuatan variasi konsentrasi infusa daun M. tanarius
Infusa daun M. tanarius yang telah diperoleh pada tahap no.5 diencerkan menggunakan larutan garam fisiologis NaCl 0,9 % b/v menjadi beberapa konsentrasi larutan infusa daun M. tanarius yaitu 10, 20, 40, 60, dan 80%.
Tabel I. Pembuatan Variasi Konsentrasi Infusa daun M. tanarius Volume infusa daun M.
7. Pembuatan larutan piperazin sitrat sebagai kontrol positif
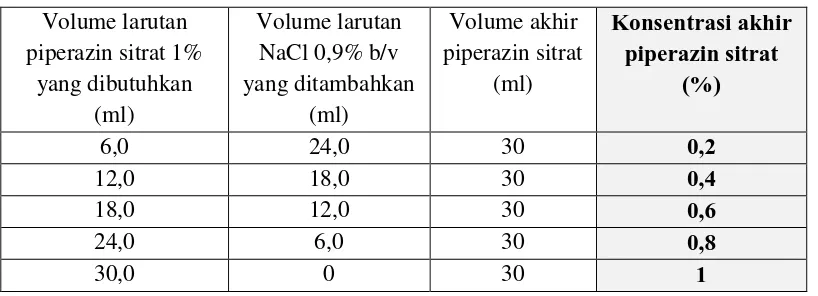
8. Pembuatan variasi konsentrasi larutan piperazin sitrat
Variasi konsentrasi larutan piperazin sitrat dibuat dengan mengencerkan larutan piperazin sitrat 1% b/v dengan larutan NaCl 0,9% b/v. Variasi konsentrasi larutan piperazin sitrat adalah 0,2; 0,4; 0,6; 0,8; dan 1%.
Tabel II. Pembuatan Variasi Konsentrasi Larutan Piperazin Sitrat Sebagai Kontrol Positif
9. Penentuan lama hidup cacing di luar hospes (orientasi waktu pengamatan) Penentuan lama hidup cacing di luar tubuh hospes dilakukan dengan merendam 6 ekor cacing A. galli dalam cawan petri yang berisi 30 ml larutan garam fisiologis (NaCl 0,9% b/v), kemudian diamati waktu yang dibutuhkan sampai cacing mati. Waktu kematian cacing dicatat dan dilakukan replikasi sebanyak 3 kali.
10.Pengujian daya anthelmintika infusa daun M. tanarius
Penentuan LC50 (Median Lethal Concentration) dilakukan dengan
sebagai kelompok perlakuan dalam berbagai konsentrasi, kemudian diamati jumlah cacing yang mati untuk setiap konsentrasi. Parameter kematian cacing A.galli dinilai dengan melihat tubuh cacing yang tidak bergerak atau tidak memberikan respon pada waktu disentuh dengan pinset, baik dalam cairan fisiologis, maupun ketika dimasukkan dalam air bersuhu 40-500 C. Percobaan direplikasi 3 kali. Data kematian cacing yang diperoleh dianalisis dengan menggunakan analisis probit untuk mendapatkan besarnya harga LC50. Penentuan LT50 Median Lethal Time dilakukan
dengan menggunakan melakukan analisa probit terhadap data kematian cacing pada konsentrasi yang ekuivalen dengan LC50 masing-masing perlakuan.
11.Identifikasi kualitatif kandungan senyawa dalam infusa daun M. tanarius dengan metode Kromatografi Lapis Tipis (KLT)
Fase diam berupa silica gel GF254 diberi totolan (2-3 µl) sampel (infusa daun M. tanarius) dan pembanding (terpineol) dengan jarak penotolan 1 cm dan jarak pengembangan 10 cm. Eluasi (pengembangan) dengan fase gerak toluen-etil asetat (93:7 v/v). Diamati dengan sinar visibel, sinar UV pada panjang gelombang 254 nm dan 365 nm, serta dengan pereaksi semprot vanillin-asam sulfat. Kemudian dipanaskan pada suhu 100-110 0C selama 10 menit, serta diamati pada sinar biasa, sinar UV pada panjang gelombang 254 nm dan 365 nm.
Jika nilai hRf kedua bercak saling berdekatan dan warnanya memiliki kemiripan, maka dikatakan dua senyawa tersebut memiliki sifat yang sama.
F. Analisis Hasil
Dalam penelitian ini, kematian cacing A. galli diamati dengan melihat tubuh cacing yang tidak bergerak atau tidak memberikan respon pada waktu disentuh dengan pinset, baik dalam cairan fisiologis maupun ketika dimasukkan dalam air bersuhu 40-500 C. Data waktu kematian cacing didapat dengan mencatat waktu kematian cacing setiap jam selama waktu pengamatan. Data kematian tersebut kemudian diolah menggunakan analisa varian satu arah (One Way Anova) untuk melihat perbedaan kedua kelompok perlakuan. Dari data kematian cacing tersebut dihitung nilai LC50 infusa daun M. tanarius dan piperazin sitrat menggunakan analisis
probit. Nilai LT50 infusa daun M. tanarius dan piperazin sitrat ditentukan dengan
menganalisa data kematian cacing setiap 1 jam pada konsentrasi yang ekuivalen dengan LC50, kemudian dianalisis dengan analisis probit.
Daya anthemintik tersebut diketahui dengan membandingkan LC50 infusa
daun M. tanarius terhadap LC50 piperazin sitrat dan LT50 infusa daun M. tanarius
terhadap LT50 larutan piperazin sitrat. Apabila ada kematian cacing pada kelompok
kontrol negatif lebih dari 10% maka hasil dikoreksi dengan menggunakan formula Abott’s.
Rumus formula Abott’s :
% Kematian =
persen kematian kelompok uji - persen kematian kontrol
100 - persen kematian kontrol
34 BAB IV
HASIL DAN PEMBAHASAN
Penyakit infeksi cacing atau kecacingan merupakan penyakit yang banyak dijumpai di masyarakat dengan angka prevalensi yang tinggi, terutama pada anak-anak usia sekolah dasar (Departemen Kesehatan RI, 2006). Infeksi ini bila tidak ditangani akan berdampak serius pada perkembangan tubuh anak-anak maupun kesehatan orang dewasa karena mengganggu penyerapan nutrisi sehari-hari. Dampak yang lebih parah lagi, yaitu dapat timbul kondisi patologis kronis seperti iritasi dan kerusakan atau obstruksi usus yang memerlukan tindakan pengobatan serius (Hamsafir, 2010). Kondisi penderita yang pada umumnya berada pada tingkat ekonomi menengah ke bawah membuat masyarakat kemudian mencari alternatif pengobatan dengan bahan alam (back to nature) yang lebih murah, mudah dan aman karena dianggap efek sampingnya lebih kecil dari obat modern. Salah satu tanaman obat berkhasiat untuk kesehatan yang diduga memiliki potensi daya anthelmintik, yaitu tanaman Macaranga tanarius, L. dikarenakan kandungan senyawa terpenoid, terutama triterpenoid pada daunnya diketahui memiliki potensi khasiat anthelmintik (Tarmudji, 2004).
A. Determinasi tanaman M. tanarius
digunakan adalah benar-benar tanaman M. tanarius, yang biasa dikenal oleh sebagian masyarakat Indonesia sebagai tanaman mara (Plantamor, 2008) yang biasa dimanfaatkan sebagai pakan ternak. Bagian tanaman yang digunakan dalam determinasi adalah bagian batang, daun, bunga, dan biji.
Determinasi dilakukan secara makroskopis terhadap bagian batang, daun, bunga, dan biji, kemudian dicocokkan dengan herbarium serta buku determinasi tanaman (Kooders & Valeton, 1918) hingga katagori jenis (species) untuk membuktikan bahwa batang, daun, bunga, dan biji yang dideterminasi adalah benar Macaranga tanarius L.
Berdasarkan hasil determinasi tersebut maka terbukti bahwa tanaman yang diuji ini benar merupakan tanaman M. tanarius yang ditunjukkan dengan surat keterangan determinasi pada Lampiran 1.
B. Pembuatan Infusa Daun M. tanarius
Daun kemudian dikeringkan dan diserbuk hingga derajat halus tertentu. Dalam penelitian ini digunakan derajat halus no.40 yang berarti semua serbuk dapat melewati ayakan no.40 (40 lubang tiap inchi ayakan). Penyeragaman derajat halus dimaksudkan agar luas permukaan serbuk daun yang mengalami kontak dengan penyari pada proses infundasi semakin luas sehingga semakin banyak kandungan senyawa pada simplisia yang tersari. Serbuk kemudian dibasahi dengan air sebanyak 4 kali bobot serbuk dan dipanaskan di atas tangas air dengan suhu 90 0C selama 15 menit dihitung saat air mencapai suhu 90 0C. Air hasil infundasi kemudian disaring dengan kain flanel, jika volume tidak mencukupi dapat ditambahkan air panas melewati saringan dan diperas hingga volume tercukupi. Penyaringan dilakukan dalam kondisi panas supaya senyawa yang telah tersari tidak mengendap kembali pada ampas. Infusa yang didapat kemudian dibuat seri konsentrasi dengan menambahkan larutan fisiologis (NaCl 0,9% b/v) sesuai tabel I. Seri konsentrasi pada tabel I dibuat dengan mempertimbangkan konsentrasi maksimal infusa yang masih dapat dibuat yang kemudian diencerkan menjadi beberapa seri konsentrasi yang lebih kecil.
(NaCl 0,9% b/v) kemudian mengencerkannya menjadi beberapa konsentrasi hingga konsentrasi minimal 0,2 %. Karena konsentrasi efektif penggunaan piperazin sitrat menurut Nugroho (1989) adalah pada konsentrasi 0,4%-0,8% , maka seri konsentrasi piperazin sitrat dibuat sedemikian rupa sehingga konsentrasi efektif pemakaian berada dalam range konsentrasi seri penelitian sehingga diharapkan ketika analisa data tidak perlu melakukan ekstrapolasi atau perhitungan perpanjangan data karena hasil berada di luar range konsentrasi yang ditetapkan. Obat cacing lain seperti mebendazol dan pirantel pamoat juga dapat digunakan sebagai kontrol positif, namun piperazin tetap dipilih karena merupakan obat pilihan pertama untuk infeksi A. galli. Selain itu, karena penelitian ini merupakan penelitian tahap awal dan belum bisa diketahui mekanisme kerja dari infusa daun M. tanarius, maka obat yang dipilih adalah obat yang mekanisme kerjanya tidak langsung membunuh atau merusak jaringan tubuh, sehingga dapat digunakan untuk perbandingan tahap awal terhadap infusa daun M. tanarius.
C. Uji Daya Anthelmintika Infusa Daun M. tanarius
digantikan dengan A. galli. Cacing A. galli yang digunakan dalam penelitian ini disesuaikan jenis kelamin dan ukurannya. Hal tersebut dilakukan untuk meminimalkan variasi pada respon cacing terhadap perlakuan yang diberikan. Jenis kelamin cacing dipilih cacing betina karena secara anatomi dan morfologi, cacing betina berukuran lebih besar dari jantan dan memiliki daya tahan terhadap lingkungan yang lebih besar pula. Identifikasi cacing A. galli dilakukan di Laboratorium Parasitologi, Fakultas Kedokteran Hewan Universitas Gadjah Mada Yogyakarta. Identifikasi cacing dilakukan dengan melakukan pengamatan secara makroskopis dan mikroskopis terhadap bagian anterior dan posterior cacing yang merupakan ciri atau penanda khusus pada golongan Nematoda. Bagian yang diamati meliputi spikulum dan kloaka pada bagian posterior serta mulut dan esophagus pada bagian anterior (Lampiran 5), kemudian dicocokkan dengan buku identifikasi cacing (Yamaguti, 1961), sehingga dapat diketahui jenis cacing yang diamati. Identifikasi dimaksudkan agar hewan uji yang digunakan benar-benar merupakan cacing A. galli. Surat keterangan determinasi cacing A. galli dilampirkan pada Lampiran 2.
dalam stage larva diperlukan pembiakan dan penetasan sendiri terhadap telur cacing, sehingga memerlukan waktu yang lama dan biaya yang cukup tinggi.
Pada pengujian dengan metode perendaman dalam penelitian ini, pengamatan dilakukan setiap satu jam sampai semua cacing mati. Pengamatan cacing dilakukan setiap satu jam karena menurut Sukarban dan Santoso (1995), waktu 1 jam adalah waktu yang optimal dalam pengamatan untuk mendapatkan data yang lebih banyak dan diharapkan hasil penelitian yang didapatkan lebih valid, karena semakin sering pengamatan maka linearitas respon cacing akan semakin terlihat. Perlakuan pertama yang dilakukan, yaitu menentukan lama hidup cacing di dalam cairan NaCl fisiologis (NaCl 0,9%). Penentuan lama hidup cacing di luar hospes atau uji lama hidup cacing dilakukan untuk mengetahui seberapa lama cacing dapat hidup di luar tubuh hospes dan kemudian digunakan untuk menentukan lama waktu pengamatan yang diperlukan dalam penelitian (Tabel III).
Tabel. III Waktu kematian cacing Ascaridia galli pada larutan NaCl 0,9% (Uji lama waktu hidup cacing)
Replikasi Rata-rata waktu kematian cacing (jam)
1. 28,2
2. 29,2
3. 28,5
Hasil yang diperoleh dari tiga kali replikasi menunjukkan bahwa rata-rata kematian cacing adalah 28,6 jam. Dengan mengacu hasil tersebut, dapat ditentukan waktu pengamatan yang dipakai dalam penelitian. Lama waktu pengamatan pada uji daya anthelmintik tidak boleh terlalu mendekati atau melebihi lama hidup cacing di luar tubuh hospes, dikarenakan pada waktu mendekati batas lama waktu hidup di luar hospes kondisi cacing yang diberi perlakuan sudah terpengaruh faktor eksternal seperti kerusakan sel akibat ketidaktersediaan nutrisi, cemaran mikroorganisme dan lain sebagainya. Oleh karena itu lama waktu pengamatan yang digunakan kemudian ditetapkan selama 20 jam untuk memudahkan perhitungan data.
Pengujian daya anthelmintika pada penelitian ini merupakan uji yang dilakukan untuk mengetahui aktifitas infusa daun M. tanarius terhadap cacing A. galli dengan menggunakanrancangan uji acak lengkap pola searah. Hasil pengujian yang berupa data kematian cacing kemudian dianalisis menggunakan uji statistik analisis varian satu arah untuk mengetahui ada atau tidaknya perbedaan antar kelompok perlakuan, yang kemudian dilanjutkan dengan uji post hoc LSD untuk menentukan konsentrasi infusa daun M. tanarius yang menunjukkan waktu kematian yang berbeda tidak bermakna dengan kontrol positif, yaitu piperazin sitrat. Selanjutnya dilakukan analisis probit untuk mendapatkan nilai LC50, yaitu konsentrasi yang dapat
menyebabkan kematian cacing sebesar 50% dari populasi dan juga nilai LT50, yaitu
Hasil analisis varian satu arah (Oneway ANOVA) pada data pengamatan waktu kematian cacing (lampiran 9) menunjukkan perbedaan antar kelompok perlakuan dibandingkan dengan kelompok kontrol negatif (NaCl 0,9%) fisiologis dengan mempertimbangkan nilai rata-rata (mean) ± SE. SE merupakan standar error yang menunjukkan ketepatan perhitungan. Semakin kecil nilai SE, maka perhitungan dikatakan makin tepat. Jika digambarkan dalam grafik batang, maka rata-rata waktu kematian cacing tiap kelompok ditampilkan dalan Gambar 2. sebagai berikut.
Dari gambar 2 tersebut dapat dilihat bahwa kelompok perlakuan memiliki perbedaan yang bermakna dibandingkan dengan kelompok kontrol negatif (NaCl 0,9%). Hal tersebut dikarenakan pada grafik tampak tidak ada nilai pada kelompok perlakuan yang melampaui nilai pada kelompok kontrol negatif ± SE. Dari grafik tersebut juga dapat diartikan bahwa kelompok perlakuan infusa daun M. tanarius memiliki perbedaan bermakna dengan kontrol negatif atau dikatakan bahwa infusa daun M. tanarius memiliki efek anthelmintika dibandingkan dengan kontrol negatif. Namun data yang disajikan dengan grafik dengan nilai mean ± SE tersebut tidak dapat menunjukkan letak perbedaan antar kelompol perlakuan. Oleh karena itu dilakukan uji post hoc dengan metode LSD (Least Significant Different) untuk melihat perbedaan antar kelompok perlakuan. Hasil post hoc disajikan dalam tabel IV berikut.
Tabel IV. Hasil analisa signifikansi dengan post hoc LSD
Perlakuan NaCl 0,9% Pipr. 0,2% Pipr. 0,4% Pipr. 0,6% Pipr. 0,8% Pipr. 1%
NaCl 0,9% : NaCl fisiologis 0,9% sebagai kontrol negatif Inf DM : Infusa daun M. tanarius
Pipr. : Piperazin sitrat
BB : Berbeda bermakna
Hasil analisa post hoc menunjukkan bahwa ada perbedaan tidak signifikan antara perlakuan infusa daun M. tanarius pada konsentrasi 80% dengan kontrol positif piperazin sitrat pada konsentrasi 0,2% dan 0,4%. Hal tersebut dapat berarti bahwa daya anthelmintika atau kemampuan infusa daun M. tanarius dalam membunuh cacing atau pada konsentrasi 80% berbeda tidak bermakna dengan daya anthelmintika piperazin sitrat pada konsentrasi 0,2% dan 0,4%
Pengujian daya anthelmintika infusa daun M. tanarius kemudian dilanjutkan dengan penentuan nilai LC50 dan LT50 infusa daun M. tanarius dan piperazin sitrat.
Pada penentuan LC50 infusa daun M. tanarius, pengamatan waktu kematian cacing
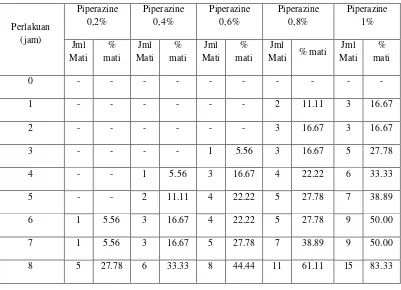
pada tiap konsentrasi dilakukan tiap 1 jam selama 20 jam. Pengamatan kematian cacing dinilai dengan melihat tubuh cacing yang tidak bergerak atau tidak memberikan respon pada waktu disentuh dengan pinset baik dalam cairan garam fisiologis maupun ketika dimasukkan dalam air bersuhu 40-500 C (Kendyartanto, 2008). Pencelupan cacing ke dalam air hangat bertujuan untuk memastikan bahwa cacing benar-benar mati. Jika belum mati, cacing masih akan menunjukkan gerakan karena panasnya air. Penelitian dilakukan dengan 3 kali replikasi dan menggunakan 6 ekor cacing pada tiap perlakuannya. Digunakan 3 kali replikasi supaya mendapatkan hasil yang lebih valid. Hasil pengamatan kematian cacing untuk penentuan LC50
Berdasarkan data pada tabel V, maka dilakukan perhitungan dengan analisis probit. Syarat analisa probit, yaitu prosentase kematian cacing minimal 5-95% dan ada 5 data valid untuk dapat dihitung (Umniyati, 1990). Oleh karena itu, perhitungan data menggunakan data pada jam ke-16 dikarenakan pada jam tersebut didapatkan kematian cacing sebesar 100%, yaitu pada konsentrasi 80% dan juga memenuhi syarat perhitungan probit. Perhitungan analisa probit tersaji pada lampiran 10. Pada kelompok kontrol negatif tidak ditemukan adanya kematian cacing sehingga tidak perlu dikoreksi dengan formula Abbot, yaitu formula yang digunakan untuk faktor kalibrasi jika terjadi kematian pada kelompok kontrol negatif. Selanjutnya untuk penentuan LC50 dengan analisa probit, dapat dibuat tabel data seperti dalam Tabel VI.
Tabel VI. Data jumlah kematian cacing A. galli pada jam ke-16 perlakuan infusa daun M. tanarius untuk mencari nilai LC50 menggunakan analisa probit
Konsentrasi infusa daun
probit yang didapatkan, yaitu y = 1,645x - 2,039, dengan chi square (x2) hitung sebesar 5,142. Nilai x2 menunjukkan homogenitas dari respon cacing terhadap perlakuan. Jika x2 hitung lebih kecil dari x2 tabel berarti data tersebut bersifat homogen atau dapat dikatakan respon cacing terhadap perlakuan sifatnya homogen. Nilai x2 tabel dengan taraf kepercayaan 95% dan derajad kebebasan (df) 3, yaitu 7,80. Karena nilai x2 hitung lebih kecil daripada x2 tabel maka data respon cacing terhadap perlakuan dikatakan homogen.
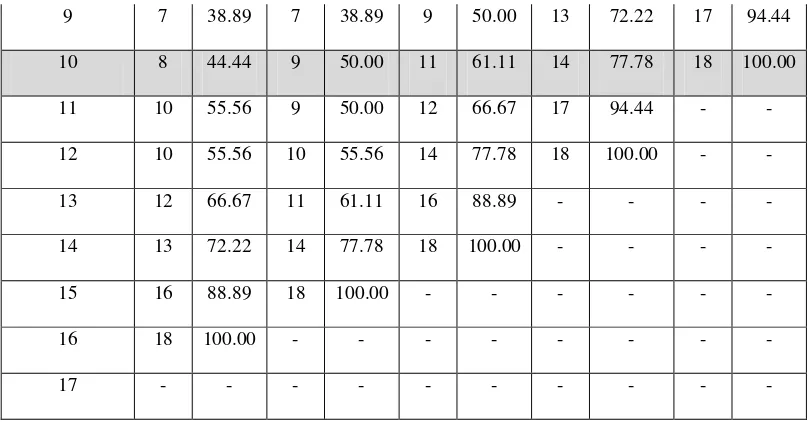
Pada penentuan LC50 piperazin sitrat digunakan data pengamatan yang
diperoleh seperti yang terlihat pada tabel VII.
Tabel. VII Jumlah kematian cacing A. galli pada larutanpiperazin sitrat (kontrol positif)
Penentuan nilai LC50 piperazin sitrat menggunakan data pada jam ke-10
dikarenakan pada jam tersebut terdapat kematian cacing sebesar 100%, yaitu pada konsentrasi 1% dan juga memenuhi syarat perhitungan probit. Selanjutnya untuk penentuan LC50 dengan analisa probit, dapat dibuat tabel data seperti pada Tabel VIII
sebagai berikut.
Tabel VIII. Data jumlah kematian cacing A.galli pada jam ke-10 perlakuan larutan piperazin sitrat (kontrol positif) untuk mencari LC50 menggunakan
Perhitungan LC50 piperazin sitrat ini juga tidak perlu dikoreksi menggunakan
formula Abbot karena pada kelompok kontrol negatif tidak ditemukan adanya kematian cacing selama waktu pengamatan. Hasil yang diperoleh setelah data pada tabel VII dianalisis menggunakan analisa probit seperti pada lampiran 11, yaitu didapatkan nilai LC50 piperazin sitrat sebesar 0,307 % yang dapat diartikan bahwa
piperazin sitrat dapat membunuh 50% populasi cacing A. galli pada konsentrasi 0,307%. Persamaan regresi probit yang diperoleh y = 2,125x + 1,089 dengan nilai chi square (x2) hitung 5,810. Nilai x2 tabel taraf kepercayaan 95% dengan derajad kebebasan (df) 3 adalah sebesar 7,80. Nilai x2 hitung yang lebih kecil daripada nilai x2 tabel menunjukkan bahwa respon cacing terhadap perlakuan adalah homogen. Tabel IX berikut ini adalah tabel perbandingan analisis probit untuk infusa daun M. tanarius dan piperazin sitrat.
Tabel IX. Perbandingan perhitungan LC50 infusa daun M. tanarius dan piperazin
sitrat dengan analisa probit
A.galli dalam penelitian. Hal tersebut dikarenakan dalam infusa daun M. tanarius terkandung banyak senyawa dan bukan merupakan senyawa tunggal yang hanya berkhasiat anthelmintika saja, sedangkan piperazin sitrat sudah merupakan senyawa tunggal yang memiliki khasiat sebagai anthelmintika.
Setelah mendapatkan nilai LC50 infusa daun M. tanarius dan piperazin sitrat,
pengujian daya anthelmintika infusa daun M. tanarius dilanjutkan dengan menghitung nilai LT50 dari data perlakuan infusa daun M. tanarius dan piperazin
sitrat. Perhitungan nilai LT50 dilakukan sama halnya dengan mencari nilai LC50, yaitu
dengan menggunakan analisa probit. Nilai LT50 infusa daun M. tanarius ditentukan
berdasarkan konsentrasi yang mendekati atau dikatakan ekuivalen dengan LC50 infusa
daun M. tanarius sebesar 17,3%, yaitu konsentrasi 20%.
Data yang digunakan untuk menghitung LT50 infusa daun M. tanarius dengan
analisa probit adalah seperti yang tersaji dalam Tabel X sebagai berikut.
Tabel X. Kematian cacing A. galli pada konsentrasi yang ekuivalen dengan LC50
Dari data waktu kematian cacing pada konsentrasi yang ekuivalen dengan LC50 infusa daun M. tanarius pada tabel tersebut kemudian dipilih 8 data yang akan
digunakan untuk analisis menggunakan analisa probit guna mendapatkan nilai LT50
infusa daun M. tanarius. Diambil sebanyak 8 data dikarenakan pada kelompok kontrol positif hanya terdapat 8 data yang bisa dianalisis, sehingga supaya didapatkan korelasi linear yang baik dan setara, maka diperlukan data yang seimbang. Meskipun syarat dari analisa probit hanya memerlukan minimal 5 data yang valid, namun digunakan 8 data supaya perhitungan lebih valid dan korelasi linear respon perlakuan lebih dapat terlihat.
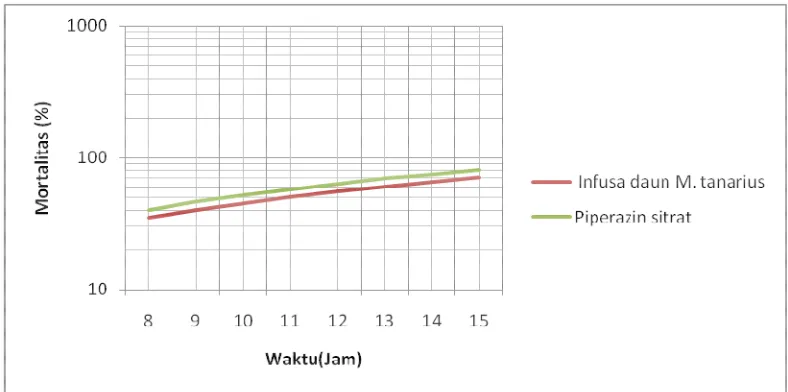
Dari pengolahan data tabel X menggunakan analisa probit seperti pada lampiran 12, didapatkan nilai LT50 infusa daun M. tanarius pada konsentrasi yang
ekuivalen dengan LC50, yaitu pada konsentrasi 20% adalah 15,8 jam. Nilai tersebut
berarti bahwa infusa daun M. tanarius pada konsentrasi 20% dapat membunuh populasi cacing A. galli sebanyak 50% pada jam ke-15,8. Dari pengolahan data didapatkan persamaan regresi probit y = 5,156x - 6,194 dengan nilai x2 sebesar 0,256. Jika dibandingkan dengan nilai x2 tabel dengan derajad kebebasan (df) 6, yaitu 12,59 maka nilai x2 hitung jauh lebih kecil dari x2 tabel dan dapat dikatakan bahwa respon cacing terhadap perlakuan infusa daun M. tanarius bersifat homogen.
Penentuan LT50 piperazin sitrat ditentukan berdasarkan nilai konsentrasi yang
mendekati atau pada data yang ada dianggap ekuivalen dengan LC50 piperazin sitrat
0,307%, yaitu 0,4%. Penentuan LT50 piperazin sitrat dengan menggunakan data
Tabel XI. Kematian cacing A. galli pada konsentrasi yang ekuivalen dengan LC50
Dari data waktu kematian cacing pada konsentrasi yang ekuivalen dengan LC50 piperazin sitrat pada Tabel XI tersebut diambil 8 data yang tesedia untuk
dianalisis menggunakan analisa probit guna mendapatkan nilai LT50 piperazin sitrat.
Perhitungan analisa probit terlampir pada lampiran 13. Dari hasil analisa data diperoleh LT50 piperazin sitrat pada konsentrasi 0,4% adalah 10,2 jam, yang berarti
bahwa piperazin sitrat dengan konsentrasi yang ekuivalen dengan LC50 mampu
membunuh cacing A. galli sebanyak 50% populasi pada jam ke-10,2. Persamaan regresi probit yang diperoleh dari pengolahan data adalah y = 5,802x-5,862, dengan nilai x2 hitung 6,471. Nilai x2 tabel dengan derajad kebebasan (df) 6 sebesar 12,59, sehingga diketahui bahwa x2 hitung lebih kecil dari x2 tabel dan dapat diartikan bahwa respon cacing terhadap perlakuan piperazin sitrat sifatnya homogen.
Perbandingan hasil pengolahan data LT50 infusa daun M. tanarius dan
Tabel XII. Perbandingan perhitungan LT50 infusa daun M. tanarius dan piperazin
sitrat dengan analisa probit Bahan uji Persamaan regresi
probit
LT50
(Jam)
Chi square hitung
Chi square tabel Infusa daun M.
tanarius y = 5,156x - 6,194 15,898 0,256 12,59 Piperazin sitrat y = 5,802x - 5,862 10,244 6,471 12,59
Berdasarkan persamaan tersebut kemudian dibuat grafik garis regresi probit untuk menggambarkan hasil percobaan. Pada Gambar 3, grafik dibuat dalam bentuk semi logaritmik dengan dan menunjukkan hubungan antara % kematian cacing A. galli vs waktu, karena dalam penelitian ini diketahui bahwa respon cacing terhadap perlakuan bersifat homogen, maka garis regresi probit yang dihasilkan dikatakan secara bermakna menggambarkan hasil penelitian.
Gambar 3. Grafik hubungan waktu vs mortalitas cacing A.galli berdasarkan persamaan regresi probit LT50 infusa daun M. tanarius dan
D. Identifikasi Kualitatif Kandungan Senyawa dalam Infusa Daun M. tanarius dengan Metode Kromatografi Lapis Tipis (KLT)
Identifikasi secara kuatitatif kandungan senyawa yang terdapat pada infusa daun M. tanarius bertujuan untuk menegaskan keberadaan senyawa pada infusa daun M. tanarius yang diduga memiliki daya anthelmintika. Senyawa yang diduga memiliki potensi daya anthelmintika dalam sediaan infusa daun M. tanarius tersebut adalah terpenoid.
Berdasarkan penelitian Tarmudji (2004), senyawa terpenoid pada daun pare memiliki daya anthelmintika yang lebih kuat dibandingkan senyawa flavonoid, dan pada daun M. tanarius, seperti yang dilaporkan oleh Hui et al. (1974) memiliki banyak kandungan senyawa terpenoid. Berdasarkan hasil pengujian daya anthelmintika yang telah dilakukan, infusa daun M. tanarius terbukti memiliki potensi daya anthelmintika, namun belum dapat diketahui mengenai keberadaan senyawa terpenoid yang diduga memiliki daya anthelmintika dalam infusa daun M. tanarius. Oleh karena itu, pada penelitian ini perlu ditegaskan keberadaan senyawa terpenoid dalam sediaan infusa daun M. tanarius menggunakan metode kromatografi lapis tipis (KLT).