BAB II
TINJAUAN PUSTAKA
2.1 Biologi Kakao
Kakao merupakan tanaman tahunan (parennial crop)termasuk dalam familia Sterculiaceae dandiperkirakan berasal dari hutan hujan tropis di Pegunungan Andes, Amerika Selatan (Clarence - Smith, 2000). Pada saat ini, kakao sudah dibudidayakan secara luas di dunia terutama di daerah tropis meliputi Amerika Latin, Afrika dan Asia (Aguilar et al., 1992).
2.1.1 Morphologi Kakao
Kakao memiliki akar tunggang dengan akar utama dapat mencapai 5 meter (Miller, 2009). Kakao juga dikenal sebagai surface root feeder, hal ini karena sebagian besar akar lateralnya tumbuh di dekat permukaan tanah (Gambar 2.1; Karmawati et al., 2010). Pada kakao yang diperbanyak secara vegetatif tidak akan tumbuh akar tunggang, tetapi akan tumbuh 2 akar yang mirip akar tunggang (Susanto, 1994).
Gambar 2.1 Akar utama (A) dan akar lateral pada kakao (B) (Karmawati et al., 2010).
Kakao memiliki batang berkayu dan bersifat dimorphisme (Gambar 2.2;
Susanto, 1994) yaitu memiliki cabang ortotrop yang tumbuh ke atas dan cabang B
plagiotrop yang tumbuh ke samping (Susanto, 1994). Tinggi batang kakao sangat bervariasi dan dapat mencapai sekitar 12 meter (Susanto, 1994). Kayu berwarna putih mengkilap sedangkan kulit kayu tipis dan halus berwarna kecoklatan.
Gambar 2.2 Kakao bersifat dimorphisme yang menunjukkan adanya cabang ortotrop (A) dan cabang plagiotrop (B).
Daun kakao sebagian besar berbentuk bulat panjang (elliptic) dengan ujung yang bervariasi, antara lain cuspidate dan aristate (Phillips - Mora et al., 2013). Bentuk daun bagian dasar juga bervariasi, antara lain obtuse, dan cuneiform (Phillips - Mora, et al., 2013). Warna daun juga menunjukkan adanya variasi khususnya antara daun yang masih muda dengan daun yang sudah tua (Gambar
2.3 A). Daun yang masih muda umumnya berwarna merah pudar kehijau -
hijauan, cokelat kehijauan mengkilap, merah muda, dan merah kecokelatan (Phillips - Mora et al., 2013). Selanjutnya daun akan berubah warna menjadi hijau jika sudah mulai dewasa (Gambar 2.3 B).
Gambar 2.3 Daun kakao yang masih muda berwarna merah kecokelatan (A) yang kemudian akan berubah menjadi hijau jika sudah dewasa (B). Kakao mulai berbunga pada umur 4 - 6 tahun dan produksi bunga akan berlangsung secara terus menerus sepanjang tahun (Rahardjo, 2011). Bunga kakao berkembang dari bekas ketiak daun pada batang dan cabang-cabang sehingga dikenal sebagai tanaman yang bersifat kauliflori (Gambar 2.4 A; Susanto, 1994). Produksi bunga ini akan meningkat seiring dengan bertambahnya usia dari tanaman kakao tersebut. Kakao dewasa dapat memproduksi bunga sekitar 50.000 bunga per tahun, namun hanya sebagian kecil yang berhasil melakukan penyerbukan (Rahardjo, 2011).
Bunga kakao merupakan bunga majemuk dengan poros bunga yang pendek sehingga nampak seperti bunga tunggal (Rahardjo, 2011). Dalam satu kuntum bunga (Gambar 2.4 B) terdapat tangkai bunga dengan panjang 1 - 1,5 cm (Backer & van den Brink, 1965), lima helai daun kelopak berbentuk lanset (van Steenis et al., 2008) terpecah submembranous atau coriaceous (seperti kulit) dengan ujung runcing (Backer & van den Brink, 1965), lima helai daun mahkota (van Steenis et al., 2008) berbentuk cakar cekung dengan ujung cucullate, dan terdapat organ kelamin. Bunga kakao bersifat hermaprodit (van Steenis et al., 2008) dengan stamen berjumlah lima buah dan satu buah putik. Di samping itu terdapat alat
kelamin jantan steril (staminodia) yang berjumlah 5 buah dengan letak berselang - seling dengan stamen (Gambar 2.4 C; Rahardjo, 2011). Putik terbagi dalam 5 lobus dan bersifat protogini yaitu putik akan masak terlebih dahulu dibandingkan dengan benang sari (Wahyudi et al, 2008). Hal ini mengakibatkan benang sari pada bunga tersebut tidak dapat membuahi putik pada bunganya sendiri sehingga harus melakukan penyerbukan silang. Pada bagian dasar putik ditemukan bakal buah yang di dalamnya terdapat bakal biji. Bakal biji tersusun dalam 5 lokuli dengan jumlah ovule antara 30 - 60 buah (van Steenis et al., 2008).
Gambar 2.4 Bunga kakao yang tumbuh dari bekas ketiak daun pada batang (A) (http:www.flicr.com/search/?q=cocoa+flower), bunga kakao muda yang dibelah (B), bunga kakao yang sudah mekar (http://en.wikipedia.org/wiki/Theobroma_cacao) (C) bagian - bagian bunga kakao (D,E) (Rahardjo, 2011).
Setelah terjadi penyerbukan dan pembuahan, buah kakao mulai terbentuk dan siap dipanen setelah berumur 5 - 6 bulan (Wahyudi et al., 2008). Buah kakao memiliki bentuk, warna, dan ukuran yang bervariasi tergantung jenis klonnya.
C B
A
Sampai saat ini terdapat sekitar 800 klon kakao yang tersebar di seluruh dunia (Phillips - Mora et al., 2013). Di dalam buah terdapat biji yang berjumlah antara 30 - 60 buah. Biji kakao dibungkus oleh arilus yang berasa manis dengan sedikit masam (Gambar 2.5 B.1; Hii et al., 2009). Biji kakao terdiri dari testa dan kotiledon (Hii et al., 2009) dengan bentuk yang sangat bervariasi (Phillips - Mora et al., 2013). Kotiledon yang telah kering merupakan bagian yang sangat penting dalam industri makanan (Hii et al., 2009).
Gambar 2.5 Buah kakao muda berumur 2 bulan masih di pohon (A), Buah kakao dibelah dengan bagian - bagianya (B) kulit buah (1), arilus (2), biji (3) (http://www.flickr.com/search/?q=cocoa+fruit).
2.1.2 Nilai Ekonomi Kakao
Kakao merupakan tanaman yang mempunyai nilai ekonomis tinggi bagi masyarakat karena hampir seluruh bagian dari kakao bermanfaat bagi kehidupan manusia. Mulai dari batang, kulit buah, arilus biji (pulp), maupun biji dapat digunakan untuk memenuhi kebutuhan manusia. Batang kakao dapat dimanfaatkan sebagai kayu bakar, terutama batang atau cabang yang sudah tua.
Daun kakao dapat dimanfaatkan menjadi produk yang bernilai tinggi yaitu dibuat menjadi bioactive extract (Osman et al., 2004) atau dibuat menjadi teh hijau (Gambar 2.6 A). Daun kakao mengandung polifenol pada khususnya flavonoid (Hii et al., 2009) yang bermanfaat sebagai antioxidan (Osman et al.,
2 3 1
2004). Antioxidan memiliki peran penting bagi kesehatan manusia, khususnya sebagai anti mikroba dan anti kanker (Hii et al., 2009). Daun kakao juga dapat diolah menjadi kompos yang digunakan sebagai pupuk pada lahan perkebunan (Karmawati et al., 2010).
Kakao dibudidayakan untuk diambil buahnya dan hampir semua bagian buah bermanfaat bagi manusia. Kulit buah dapat diolah menjadi kompos (Gambar 2.6B), pakan ternak sapi dan kambing (Gambar 2.6C), biogas, hardboard dan bahan pengental makanan (Edmon & Gafar, 1996). Kulit buah kakao juga dapat dimanfaatkan sebagai bahan bakar dengan dibuat briket arang kulit buah kakao (Usman, 2007). Kulit buah kakao juga dapat dimanfaatkan sebagai bahan baku produksi pektin yang dikenal sebagai pengental jelly dan selai (Gambar 2.6D; Edmon & Gafar, 1996). Pektin yang diisolasi dari kulit buah kakao dapat digunakan dalam industri kosmetik dan farmasi yaitu sebagai bahan aditif dalam pembuatan krim, sabun, minyak rambut dan pasta(Edmon & Gafar, 1996).
Arilus merupakan limbah yang dapat dimanfaatkan menjadi produk yang bernilai tinggi karena banyak mengandung glukosa sehingga dapat dimanfaatkan sebagai bahan baku minuman untuk jus pulp kakao, soft drink, nata (Gambar 2.6E) maupun untuk bioetanol (Hii et al., 2009).
butter dapat dimanfaatkan sebagai bahan baku lotion dan sabun kecantikan.
Gambar 2.6Manfaat kakao (A) teh
hijau(http://commons.wikimedia.org/wiki/File:Leaves_of_green_tea. jpg), (B) kulit buah sebagai pupuk kompos, (C) Kulit buah sebagai pakan ternak (http://cybex.deptan.go.id/lokalita/kulit-kakao-sebagai-pakan-ternak, (D) Kulit buah diolah menjadi pektin
(http://www.tierbistro.de/Hund/Faserzusaetze/Pektin-1-kg.html), (E) Arilus biji diolah menjadi nata de cocoa
(http://maluku.litbang.deptan.go.id/ind/index.php?option=com_conte
nt&view=article&id=314:nata-de-cocoa-yang-terbuang-yang-menyehatkan&catid=7:lain-lain).
2.2 Budidaya Kakao di Indonesia
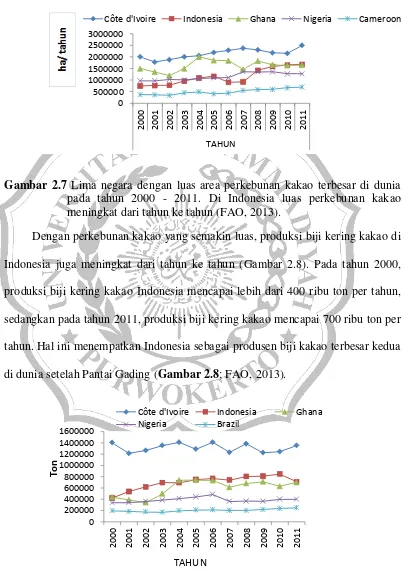
Kakao merupakan tanaman budidaya utama di lebih dari 40 negara tropis termasuk Indonesia (Li et al., 1998). Luas areal kakao di Indonesia meningkat dari tahun ke tahun. Pada tahun 2000, luas area perkebunan kakao di Indonesia hanya sekitar 750 ribu ha, sedangkan pada tahun 2011, luas perkebunan kakao di Indonesia mencapai lebih dari 1,6 juta ha (FAO, 2013). Dengan luas tersebut, Indonesia merupakan negara dengan luas areal kakao terbesar ke - 2 di dunia setelah Pantai Gading (Gambar 2.7).
B C
A
Gambar 2.7 Lima negara dengan luas area perkebunan kakao terbesar di dunia pada tahun 2000 - 2011. Di Indonesia luas perkebunan kakao meningkat dari tahun ke tahun (FAO, 2013).
Dengan perkebunan kakao yang semakin luas, produksi biji kering kakao di Indonesia juga meningkat dari tahun ke tahun (Gambar 2.8). Pada tahun 2000, produksi biji kering kakao Indonesia mencapai lebih dari 400 ribu ton per tahun, sedangkan pada tahun 2011, produksi biji kering kakao mencapai 700 ribu ton per tahun. Hal ini menempatkan Indonesia sebagai produsen biji kakao terbesar kedua di dunia setelah Pantai Gading (Gambar 2.8; FAO, 2013).
Gambar 2.8 Produksi biji kering kakao di 5 negara di dunia pada tahun 2000 - 2011 (FAO, 2013)
2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011
TAHUN
Côte d'Ivoire Indonesia Ghana Nigeria Cameroon
0
2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011
Côte d'Ivoire Indonesia Ghana Nigeria Brazil
TAHUN
2.3 Permasalahan Kakao di Indonesia
2.3.1 Produktivitas kakao di Indonesia
Indonesia dikenal sebagai negara dengan total produksi kakao terbesar kedua di dunia (Gambar 2.8; FAO, 2013). Namun tingginya produksi tersebut lebih banyak disebabkan oleh sangat luasnya area perkebunan kakao di Indonesia (Gambar 2.7 ) dan bukan oleh tingginya produktivitas biji kakao per hektar lahan.
Produktivitas perkebunan kakao di Indonesia menurun dari tahun ke tahun (Gambar 1.1). Pada tahun 2000, produktivitas kakao di Indonesia mencapai hampir 600 kg per ha lahan. Angka tersebut menurun hampir sepertiganya menjadi sekitar 400 kg per ha pada tahun 2011 (FAO, 2013). Jika dibandingkan dengan produktivitas kakao di negara lain, angka tersebut juga jauh dibawah Guatemala dan yang mampu menghasilkan biji kakao sebanyak 2,7 ton per hektar lahan (Gambar 1.1). Bahkan, jika dibandingkan dengan Malaysia, produktivitas perkebunan kakao di Indonesia hampir setengahnya, yaitu lebih dari 700 kg per hektar lahan kakao.
Banyak faktor yang diduga menjadi penyebab rendahnya produktivitas kakao di Indonesia antara lain umur pohon yang mayoritas sudah tua (lebih dari 20 tahun) serangan hama dan penyakit, tenaga kerja yang kurang terampil, kurangnya perawatan, serta penggunaan bahan tanam yang kurang baik (Karmawati et al., 2010).
oleh para petani.
2.3.2 Pembibitan Kakao di Indonesia dan Permasalahanya
Sampai saat ini pembibitan kakao di Indonesia dilakukan secara generatif (Aguilar et al., 1992), yaitu dengan cara mengecambahkan biji segera setelah dikeluarkan dari buahnya. Biji dikecambahkan terlebih dahulu selama 3 - 4 hari kemudian dipelihara pada media tanah atau kompos (Hebbar et al., 2011). Bibit dipelihara selama minimal 6 bulan sebelum siap tanam ke lahan.
Teknik pembibitan tersebut tidak memerlukan teknologi dan keterampilan tinggi sehingga menjadi pembibitan yang paling murah (Hebbar et al., 2011). Di samping itu teknik tersebut juga mampu menghasilkan bibit secara masal. Namun, bibit yang dihasilkan memiliki keragaman genetik yang tinggi (Aguilar et al., 1992). Hal ini karena kakao merupakan tanaman yang melakukan penyerbukan silang (Flynn et al., 1990).
Beberapa alternatif kemudian digunakan oleh para petani untuk mengatasi kelemahan penggunaan bibit secara generatif, yaitu melalui pembibitan secara vegetatif. Terdapat tiga metode umum yang digunakan dalam pembibitan secara vegetatif meliputi stek, okulasi, dan sambung(Traore et al., 2003).
menggunakan stek memiliki kelemahan antara lain tidak dapat diproduksi bibit secara masal, tingkat keberhasilan yang masih rendah, akar yang dihasilkan serabut dan merusak tanaman induk (Susanto, 1994).
Teknik okulasi dilakukan dengan menyisipkan mata tunas dari entres batang atas kakao berkualitas unggul ke batang bawah dari bibit kakao yang diperoleh dari biji yang berumur sekitar 5 bulan. Teknik ini memiliki tingkat keberhasilan yang cukup tinggi (sekitar 90 %), serta mampu menghasilkan tanaman lebih kuat dibandingkan dengan stek, hal ini karena bibit yang dihasilkan memiliki akar tunggang (Susanto, 1994). Namun teknik ini kurang efisien karena memerlukan mata tunas yang banyak, sehingga tidak dapat menghasilkan bibit secara masal. Selain itu karena adanya pengambilan mata tunas maka tanaman induk juga akan mengalami kerusakan (Flynn et al., 1990).
Untuk mengatasi kelemahan pada stek dan okulasi maka salah alternatif pemecahanya adalah dengan sambung pucuk. Sambung pucuk dilakukan dengan menyambung cabang muda kakao unggul (entres) dengan batang kakao dari bibit yang lain. Teknik ini memiliki tingkat keberhasilan lebih tinggi dan waktu yang lebih singkat (9 bulan) dibandingkan dengan okulasi, serta mampu menghasilkan bibit yang seragam (Rahardjo, 2011). Akan tetapi sambung pucuk ini kurang berkembang (Susanto, 1994) karena memiliki kelemahan utama berupa memerlukan entres yang lebih banyak, memerlukan perwatan yang intensif, dan tanaman induk yang digunakan rusak karena batangnya dipotong serta tidak mampu menghasilkan bibit secara masal (Rahardjo, 2011).
atas adalah perbanyakan bibit melalui teknik kultur jaringan. Kultur jaringan merupakan metode perbanyakan tanaman dengan menggunakan eksplan vegetatif suatu tanaman yang dipelihara pada media khusus secara aseptis (Engelmann, 2011).Teknik tersebut mampu menghasilkan bibit yang memiliki tingkat keseragaman genetik yang tinggi (Engelmann, 2011), mampu menghasilkan bibit yang bebas penyakit serta mampu menghasilkan bibit dalam jumlah masal. Namun keberhasilan teknik kultur jaringan untuk menghasilkan bibit kakao masih sangat rendah. Di samping itu teknik tersebut juga membutuhkan tenaga kerja dengan tingkat keterampilan memadai serta peralatan yang cukup.
Beberapa teknik kultur jaringan telah mulai dikembangkan untuk memperbanyak bibit tanaman kakao, antara lain melalui organogenesis (Li et al., 1998), embryogenesis somatik (Emile et al., 2008) dan kultur pucuk (Flynn et al., 1990). Organogenesis adalah teknik pembibitan suatu tanaman dengan menginduksi tunas dari eksplan yang ditanam, baik secara langsung maupun tidak langsung. Upaya pembibitan kakao melalui organogenesis kakao telah dilakukan, namun sampai saat ini teknik organogenesis belum berhasil dikembangkan untuk pembibitan kakao. Embryogenesis somatik merupakan teknik menginduksi embryo dari eksplan yang ditanam. Embryo yang berhasil diinduksi kemudian dikecambahkann dan dipelihara lebih lanjut untuk menghasilkan bibit. Teknik ini mulai banyak dikembangkan oleh para peneliti namun tingkat keberhasilanya masih bervariasi antara 0 - 100 % tergantung klon kakao yang digunakan (Li et al., 1998).
kakao melalui kultur jaringan adalah menggunakan teknik kultur pucuk (shoot tip culture) (Orchard et al., 1979; Janick, 1992; Flynn et al., 1990; Figueira et al., 1991; Figueira & Janick, 1994; Lardet et al., 1998; Traore et al., 2003)., meskipun tingkat keberhasilan teknik ini juga masih rendah namun menunjukan kemajuan yang menggembirakan (Traore et al., 2003).
2.4 Perkembangan Penelitian Kultur Pucuk Kakao
Kultur pucuk adalah teknik perbanyakan suatu tanaman secara in vitro dengan menggunakan eksplan berupa pucuk suatu tanaman. Pucuk tanaman dipelihara secara steril pada medium tanam untuk diinduksi tunas maupun dilakukan multiplikasi tunas. Dengan menggunakan teknik ini pucuk suatu tanaman dapat dilipatgandakan sehingga dihasilkan bibit dalam jumlah yang banyak.
Pada umumnya perbanyakan tanaman melalui kultur pucuk dilakukan melalui empat tahap, yaitu induksi tunas, multiplikasi tunas, induksi akar, dan aklimatisasi (Trigiano & Gray, 2000). Induksi tunas merupakan proses merangsang pertumbuhan dan perkembangan tunas dari eksplan yang ditanam secara in vitro. Tahap ini diawali dengan sterilisasi eksplan kemudian dipelihara pada medium kultur secara aseptis (Zulkarnain, 2009).
banyak. Teknik ini banyak diaplikasikan pada tanam jati (Tectona grandis; Yasodha et al., 2002), kiwi (Actinidia deliciosa; Akbas et al., 2007) , kentang (Solanum tuberosum; Hoque, 2010), dan kapas (Gossypium hirsutum L.; Rauf et al., 2004). Multiplikasi tunas juga dapat dilakukan dengan merangsang pertumbuhan tunas aksiler, kemudian dipisahkan dan dipelihara pada medium yang baru (Zulkarnain, 2009). Teknik ini banyak diaplikasikan pada tanaman pisang (Musa spp; Singh, 2011), Eucalyptus hybrib(Eucalyptus benthamii and Eucalyptus dunnii; Brondani et al., 2011), dan ketela rambat (Ipomea batatas L.; Mervat, 2007).
Induksi akar merupakan proses merangsang pertumbuhan dan perkembangan akar. Tahap ini dilakukan pada tunas yang telah dipisahkan pada tahap multiplikasi tunas kemudian dipelihara di medium baru untuk merangsang pertumbuhan akar. Pada umumnya induksi akar dilakukan dengan memelihara tunas pada medium dengan penambahan zat pengatur tumbuh pada konsentrasi tertentu (Zulkarnain, 2009).
eksternalnya memiliki tingkat kelembapan yang lebih rendah dan suhu yang berfluktuasi. Akibatnya jika plantlet tidak disiapkan untuk tumbuh di lingkungan eksternal secara bertahap maka tanaman tersebut tidak akan bertahan hidup.
Tahap aklimatisasi dilakukan dengan cara memodifikasi kondisi kultur sebelum planlet dipindahkan ke lingkungan luar. Modifikasi dilakukan dengan perubahan lingkungan secara bertahap dengan cara disungkup, kemudian diberi lubang sedikit demi sedikit sehingga tanaman mampu beradaptasi dengan perubahan lingkungan (Zulkarnain, 2009).
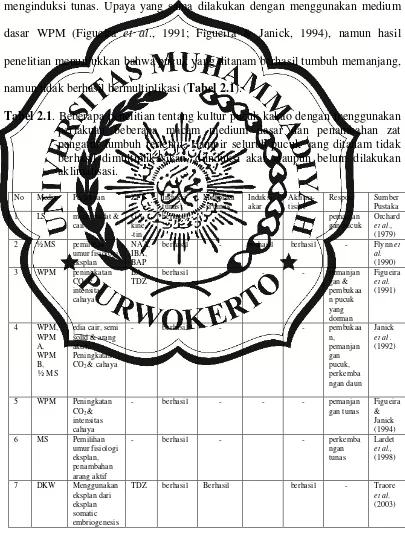
Teknik kultur pucuk merupakan teknik yang paling sederhana pada kultur jaringan untuk perbanyakan bibit suatu tanaman sehingga telah berhasil diaplikasikan pada berbagai tanaman seperti pada tanaman jati (Tectona grandis; Yasodha et al., 2002),duku (Lancium domesticum L.; Suyadi et al, 2009), tebu (Saccharum officinarum; Cheema & Hussain, 2004), dan kiwi (Actinidia deliciosa; Akbas et al., 2007).Teknik ini juga telah dicoba untuk diaplikasikan pada perbanyakan bibit kakao secara in vitro (Orchard et al., 1979; Janick et al.,1992; Figueira et al, 1991; Figueira & Janick, 1994; Lardet et al., 1998), namun tingkat keberhasilan induksi dan multiplikasi tunas masih sangat rendah (Tabel 2.1).
kakao melalui kultur jaringan, namun hasil penelitian menunjukkan bahwa pucuk yang ditanam pada medium tersebut tidak berhasil tumbuh. Flynn et al. (1990) menggunakan medium dasar ½ MS (Murashige dan Skoog, 1962) dan berhasil menginduksi tunas. Upaya yang sama dilakukan dengan menggunakan medium dasar WPM (Figueira et al., 1991; Figueira & Janick, 1994), namun hasil penelitian menunjukkan bahwa pucuk yang ditanam berhasil tumbuh memanjang, namun tidak berhasil bermultiplikasi (Tabel 2.1).
Janick et al. (1992) juga telah menguji medium dasar WPM dan medium MS dengan setengah konsentrasi. Hasil penelitian menunjukan bahwa pucuk kakao lebih responsif terhadap WPM, sehingga Janick et al. (1992)menyarankan untuk digunakan medium WPM daripada medium MS. Hasil tersebut diperkuat oleh Lardet et al. (1998) yang menggunakan medium dasar MS untuk menginduksi pertumbuhan eksplan pucuk kakao, hasil penelitiannya menunjukkan bahwa pucuk yang ditanam tidak berhasil tumbuh. Medium yang lain yang pernah dilaporkan untuk digunakan dalam kultur pucuk kakao adalah medium DKW (Driver & Kuniyuki, 1984). Pada medium tersebut pucuk yang ditanam berhasil tumbuh dan berhasil dimultiplikasikan (Traore et al, 2003), namun tidak dilaporkan tingkat keberhasilan induksi akar.
Beberapa penelitian juga telah dilakukan untuk memilih umur fisiologi eksplan yang tepat. Flynn et al. (1990) menggunakan dua jenis eksplan yaitu pucuk pada cabang ortotrop dan cabang plagiotrop. Kemudian pada setiap pucuk dibagi menjdi tiga macam eksplan dalam menginduksi munculnya tunas. Ketiga eksplan tersebut adalah pucuk terminal, tunas aksiler nomor 2 - 4, dan tunas aksiler nomor 5 - 7. Hasil penelitian menunjukan bahwa pucuk pada cabang plagiotrop telah berhasil diinduksi tunas, pucuk berhasil dimultiplikasikan, serta tunas yang diperoleh berhasil diinduksi akar maupun diaklimatiasikan. Namun tingkat keberhasilan tersebut masih bersifat sporadik dan sering mengalami kematian. Lardet et al. (1998) juga berhasil menginduksi pertumbuhan tunas dorman, namun tunas yang dihasilkan belum berhasil dimultiplikasikan.
secara in vitro adalah dengan optimasi faktor lingkungan. Figueira et al. (1991) berhasil menginduksi pertumbuhan tunas dorman maupun menginduksi akar dengan cara meningkatkan konsentrasi gas CO2 di dalam tabung kultur dengan cara memompakan gas tersebut secara aseptik ke dalam botol kultur. Pada penelitian tersebut juga dilaporkan bahwa pertumbuhan tunas dapat diinduksi dengan meningkatkan intensitas cahaya di ruang kultur. Penelitian yang sama dilaporkan oleh Figueira & Janick (1994) yang menunjukan bahwa peningkatan kadar CO2 berhasil meningkatkan pemanjangan tunas, jumlah daun, luas area daun, berat basah dan berat kering tunas. Namun dari kedua penelitian di atas belum dilaporkan tingkat keberhasilan multiplikasi tunas.
Salah satu faktor penting yang kemungkinan besar dapat digunakan untuk meningkatkan keberhasilan kultur pucuk kakao adalah dengan menggunakan ZPT yang tepat dengan konsentrasi tertentu.
2.5 Zat Pengatur Tumbuh
optimum, penambahan konsentrasi ZPT akan menghambat pertumbuhan dan perkembangan (Salisbury & Ross, 1995).
Golongan ZPT utama yang banyak digunakan dalam kultur jaringan antara lain auksin, sitokinin, giberelin dan asam absisat (Salisbury & Ross, 1995). Auksin berfungsi dalam meningkatkan pemanjangan sel, pembelahan sel, dan pertumbuhan akar adventif. Auksin juga banyak digunakan dalam kultur jaringan untuk menginduksi akar dan tunas. Pada konsentrasi yang sangat rendah (10-7 sampai 10-13 M) auksin dapat memacu pertumbuhan akar, namun tingkat keberhasilannya sangat bergantung pada spesies yang ditanam (Salisbury & Ross, 1995). Golongan auksin yang banyak digunakan dalam kultur jaringan adalah
asam α-naftalenasetat (NAA), asam 2,4- dikloropenoksiasetat (2,4-D), asam
2-metil-4-klorofenoksiasetat (MCPA), dan asam indolbutarat (IBA) (Salisbury & Ross, 1995).
Sitokinin berfungsi dalam memacu pembelahan sel, pembentukan organ, perkembangan tunas aksiler, dan memacu pembesaran sel pada kotiledon. Sitokinin juga banyak digunakan dalam kultur jaringan untuk menginduksi pembesaran sel pada daun muda, kotiledon, batang, akar, dan tunas. Golongan sitokinin yang banyak digunakan dalam kultur jaringan adalah kinetin, zeatin, zeatin ribosida, dan benziladenin (Salisbury & Ross, 1995),
pada biji (perkecambahan), menginduksi embrio dari kalus, dan pemanjangan tunas (Salisbury & Ross, 1995). Golongan giberelin yang banyak digunakan dalam kultur jaringan adalah GA3.
Asam absisat (ABA) berfungsi dalam menginduksi penutupan stomata, perkembangan embrio, dormansi, dan penuaan pada prematur pada sel organ sehingga secara tidak langsung meningkatkan produksi etilen. ABA eksogen atau sintetik dapat digunakan untuk menghambat perkecambahan biji pada spesies tertentu (Salisbury & Ross, 1995).
Salah satu golongan sitokinin yang banyak digunakan untuk meningkatkan keberhasilan kultur pucuk suatu tanaman adalah kinetin.
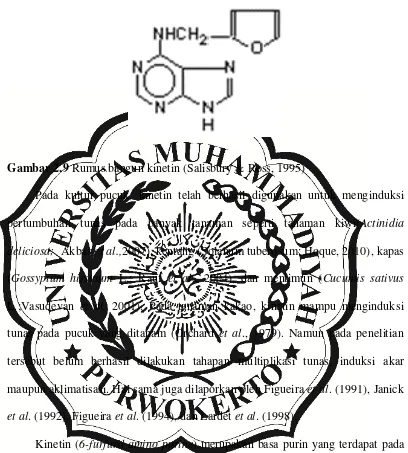
2.5.1 Kinetin
Gambar 2.9 Rumus bangun kinetin (Salisbury & Ross, 1995)
Pada kultur pucuk, kinetin telah berhasil digunakan untuk menginduksi pertumbuhan tunas pada banyak tanaman seperti tanaman kiwi(Actinidia deliciosa; Akbas et al.,2007), kentang (Solanum tuberosum; Hoque, 2010), kapas (Gossypium hirsutum L.; Rauf et al., 2004), dan mentimun (Cucumis sativus L.;Vasudevan et al, 2001). Pada tanaman kakao, kinetin mampu menginduksi tunas pada pucuk yang ditanam (Orchard et al., 1979). Namun pada penelitian tersebut belum berhasil dilakukan tahapan multiplikasi tunas, induksi akar maupun aklimatisasi. Hal sama juga dilaporkan oleh Figueira et al. (1991), Janick et al. (1992), Figueira et al. (1994), dan Lardet et al. (1998).
Kinetin (6-furfuril amino purine) merupakan basa purin yang terdapat pada salah satu basa nitrogen pada DNA. Hal ini menyebabkan jika terjadi peningkatan konsentrasi kinetin maka secara cepat molekul tersebut akan menyatu ke dalam makromolekul di dalam sel seperti RNA sehingga peningkatan ZPT tersebut akan merangsang sintesis RNA dan protein (Moore, 1989).
2.5.2 Asam Giberelat (GA3)
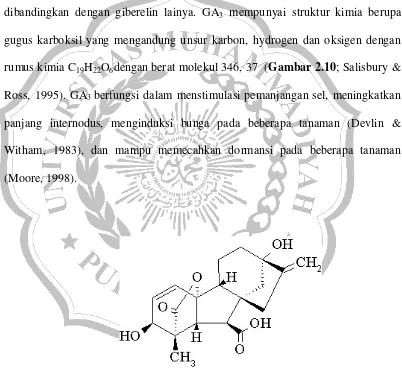
GA3 merupakan giberelin pertama yang sangat aktif dan dimurnikan dari medium biakan cendawan Gibberella fujikuroi. GA3 paling sering digunakan dalam kultur jaringan, karena memiliki sifatpaling lambat terurai jika dibandingkan dengan giberelin lainya. GA3 mempunyai struktur kimia berupa gugus karboksil yang mengandung unsur karbon, hydrogen dan oksigen dengan rumus kimia C19H22O6dengan berat molekul 346, 37 (Gambar 2.10; Salisbury & Ross, 1995). GA3 berfungsi dalam menstimulasi pemanjangan sel, meningkatkan panjang internodus, menginduksi bunga pada beberapa tanaman (Devlin & Witham, 1983), dan mampu memecahkan dormansi pada beberapa tanaman (Moore, 1998).
Gambar 2.10. Rumus bangun GA3(Salisbury & Ross, 1995)
dalam medium tanamtelah berhasil meningkatkan persentase induksi tunas (Orchard et al., 1979). Hasil penelitian tersebut menunjukkan bahwa pucuk yang ditanam berhasil tumbuh dan mampu membentuk tumbuhan secara normal, namun dari hasil penelitian tersebut tunas yang ditanam belum berhasil dimultiplikasikan.
GA3 merangsang pertumbuhan melalui tiga cara, yaitu memacu pembelahan sel serta memacu terjadinya hidrolisis makromolekul. GA3 dapat memacu pembelahan sel karena ZPT tersebut terbukti mampu mempercepat interfase dengan cara memperpendek fase G1 dan mempersingkat fase S (Salisbury & Ross, 1995). GA3 juga mampu merangsang terjadinya hidrolisis pati, fruktan, dan sukrosa menjadi molekul glukosa dan fruktosa. Adanya glukosa dan fruktosa di dalam sel merupakan sumber energi bagi pembentukan dinding sel (Salisbury & Ross, 1995). Glukosa dan fruktosa juga akan menyebabkan potensial air di dalam sel turun sehingga air dari luar sel akan masuk lebih cepat ke dalam sel sehingga sel akan membesar lebih cepat (Salisbury & Ross, 1995).