BAB I PENDAHULUAN
1.1 Latar Belakang
Surfaktan adalah suatu senyawa aktif penurun tegangan permukaan (surface active agent) yang sekaligus memiliki gugus hidrofilik dan gugus hidrofobik dalam satu struktur molekul yang sama. Senyawa ini dapat menurunkan tegangan antarmuka antara dua fasa cairan yang berbeda kepolarannya seperti minyak/air atau air/minyak. Sifat yang unik tersebut, menyebabkan surfaktan sangat potensial digunakan sebagai komponen bahan adhesif, bahan penggumpal, pembasah, pembusa, pengemulsi, dan bahan penetrasi serta telah diaplikasikan secara luas pada berbagai bidang industri proses yang menggunakan sistem multifasa seperti pada industri makanan, farmasi, kosmetika, tekstil, polimer, cat, detergen dan agrokimia (Johnson dan Fritz, 1989).
Seiring dengan meningkatnya kesadaran akan kesehatan dan lingkungan yang baik, permintaan surfaktan yang mudah terdegradasi dan berbasis tumbuhan juga semakin meningkat (Holmberg, 2001), maka diperlukan kajian untuk memperoleh surfaktan yang mempunyai dua kriteria tersebut yaitu diperoleh dari bahan baku yang dapat diperbaharui dan bersifat degradatif di alam sehingga dapat diterima secara ekologis. Salah satu surfaktan yang memenuhi kedua kriteria tersebut adalah surfaktan alkanolamida.
Alkanolamida dapat diperoleh dari hasil reaksi antara alkanolamina dengan asam lemak minyak nabati, dan banyak digunakan sebagai bahan pangan, kosmetika dan obat-obatan (Soledad, dkk. 2000). Surfaktan alkanolamida yang mempunyai ikatan amida banyak dikembangkan dalam industri pembuatan surfaktan karena ikatan amida secara kimia sangat stabil pada media yang bersifat alkali (Maugard, dkk. 1997).
Alkanolamida yang digunakan untuk formula pangan, kosmetika dan obat-obatan haruslah bebas dari bahan beracun, pelarut, asam lemak bebas, amina yang berlebih serta harus tidak berbau dan bentuknya menarik. Namun penelitian untuk memproduksi alkanolamida pada skala industri masih kurang karena penghilangan pelarut dan warna yang tidak diinginkan memerlukan tahapan yang rumit dan biaya yang tinggi.
Selama ini alkanolamida banyak diproduksi menggunakan katalis kimia melalui reaksi Schotten Baumann antara asam lemak atau metil ester asam lemak dengan monoetanolamina atau dietanolamina menggunakan katalis seng oksida (ZnO) pada
suhu 150oC selama 6 - 12 jam (Maag, 1984; Herawan, 1999). Sintesis secara kimia memerlukan tahap reaksi yang rumit yaitu tahap proteksi dan deproteksi gugus hidroksil untuk mencegah terjadinya karbonasi amina dengan CO2 (Dolores, dkk. 2002). Sintesis pada suhu tinggi ini juga menghasilkan warna yang tidak diharapkan pada produk akhir. Selain itu, sintesis secara kimia menghasilkan produk samping berupa garam dan menggunakan pelarut bersifat toksik (DMF, metanol) yang harus dihilangkan dari proses agar diperoleh produk yang murni (Maugard, dkk. 1998; Par Tufvesson, dkk. 2007).
Sintesis alkanolamida menggunakan katalis kimia dari metil ester asam laurat dan N-metil glukamina telah dipatenkan pada European Patent Application (EP-A) nomor 285,768 tahun 1994 dengan judul Preparation of N-methyl-coconut fatty acid glucamide. Sintesis dilakukan di dalam skala laboratorium dengan mencampur 3 mol metil ester asam laurat minyak kelapa dengan 3 mol N-metil glukamina serta penambahan 3,3 gram katalis natrium metoksida secara bertahap. Temperatur reaksi adalah 135 oC dan metanol yang terbentuk dikondensasikan pada kondisi vakum pada 100 hingga 15 mbar. Setelah metanol dihilangkan, campuran reaksi dilarutkan dengan isopropanol, kemudian disaring dan dikristalkan.
Alternatif yang menarik dibandingkan dengan menggunakan bahan yang bersifat toksik seperti tersebut di atas adalah sintesis alkanolamida secara enzimatik menggunakan biokatalis. Sintesis secara enzimatik mempunyai beberapa keunggulan seperti bekerja pada suhu yang lebih rendah (Herawan, 2004), dan dapat dilakukan dengan menggunakan pelarut organik non-toksik seperti tert-amil alkohol dan n-heksan yang secara ekologis lebih aman (Nagao dan Kito, 1989; Ducret, dkk. 1996). Sintesis enzimatik juga tidak memerlukan proteksi/deproteksi reagen karena enzim bersifat regio dan stereo maupun kemoselektif (Ee Lin Soo, dkk. 2003). Pada sintesis enzimatik, pelarut dan biokatalis juga mudah dipisahkan dari produk. Pelarut dipisahkan dengan penguapan pada tekanan rendah sementara biokatalis, karena bentuknya yang granula atau terimobilisasi, dapat dipisahkan dari produk mentah secara filtrasi (Herawan, 2004). Selanjutnya, dalam penelitian ini akan digunakan dietanolamina dan N-metil glukamina sebagai sumber amina serta satu jenis asam lemak yaitu asam laurat. Pemilihan dietanolamina disebabkan karena alkanolamida yang diperoleh dari dietanolamina merupakan salah satu surfaktan alkanolamida yang paling penting karena memiliki tingkat kepolaran yang lebih baik dibandingkan amida lainnya akibat adanya dua gugus hidroksil dalam molekul alkanolamida yang dihasilkan (Kurniasih, 2008).
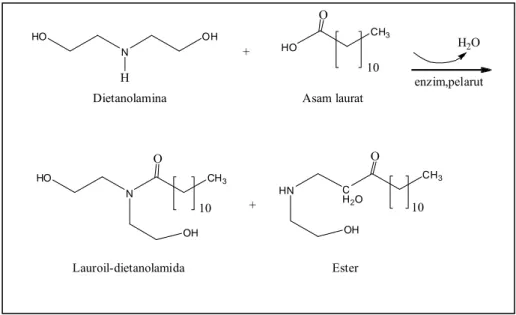
Reaksi pembentukan lauroil-dietanolamida dari asam laurat dan dietanolamina dapat dilihat pada Gambar 1.1 di bawah ini.
Gambar 1.1 Reaksi Pembentukan Lauroil-dietanolamida dari Asam Laurat dan Dietanolamina
Asam laurat dipilih sebagai sumber asam lemak karena amida dari asam laurat banyak digunakan pada berbagai produk kosmetika dan obat-obatan (Sharma, dkk. 2005). Asam laurat banyak terdapat dalam minyak inti sawit, yang dihasilkan sebagai hasil samping pengolahan minyak sawit serta terdapat dalam jumlah besar dan berkesinambungan di Indonesia. Selain itu hasil samping reaksi amidasi dari amina dengan asam lemak adalah air yang lebih aman dan bukannya berupa metanol (Dolores, dkk. 2002). Air mudah dipisahkan dengan melarutkan campuran produk dengan aseton, sementara jika amida diperoleh dari reaksi antara metil ester asam laurat dengan amina, maka hasil samping metanol yang diperoleh harus dipisahkan dengan menguapkan metanol atau bekerja pada tekanan mendekati vakum (Maugard, dkk. 1998).
Pemilihan N-metil glukamina sebagai sumber amina pada penelitian ini didasarkan pada belum banyaknya hasil penelitian tentang sintesis alkanolamida dari N-metil glukamina (Maugard, dkk. 1998), sementara N-metil glukamina dapat diperoleh dari sumber terbarukan (Holmberg, 2001) dan surfaktan asam lemak N-metil glukamida yang dihasilkan merupakan salah satu surfaktan berbasis sugar dengan peluang pasar yang meningkat secara signifikan (Warwel, dkk. 2001). N-metil glukamina merupakan senyawa yang mempunyai banyak manfaat antara lain sebagai anti bakteri (Ee Lin Soo, dkk. 2003), mengatasi kerusakan sendi dan rasa nyeri (Maugard, dkk. 1997), serta
HO N OH H HO CH3 O 10 + H2O HO N CH3 O 10 OH + HN C H2O CH3 O 10 OH enzim,pelarut
Dietanolamina Asam laurat
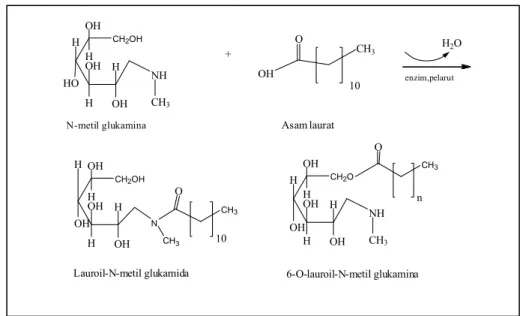
mampu mengikat lemak tanpa diikuti dengan pengikatan vitamin yang larut dalam lemak (Rismana, 2005). Demikian juga reaksi pembentukan lauroil-N-metil glukamida dari asam laurat dan N-metil glukamina terlihat pada Gambar 1.2 di bawah ini.
Gambar 1.2 Reaksi Pembentukan Lauroil-N-metil Glukamida dari Asam Laurat dan N-metil Glukamina
Sintesis alkanolamida secara enzimatik dipengaruhi oleh beberapa variabel antara lain, jenis dan konsentrasi enzim, jenis dan rasio pelarut, rasio molar bahan baku, temperatur dan waktu reaksi (Rahman, dkk. 2003; Kurniasih, 2008). Rahman, dkk. 2003 mengamati pengaruh variabel reaksi pada sintesis alkanolamida berkatalis lipase dari monoetanolamina dengan PKL (palm kernel olein) dan PKS (palm kernel stearin) menggunakan lipase dari Candida rugosa pada berbagai variasi pelarut organik (etil asetat, benzen, n-heksan, n-heptan, iso-oktan, n-dekana, dodekana dan n-heksadekana), rasio molar PKL atau PKS/monoetanolamina (1:1 hingga 1:20), waktu (12 hingga 96 jam) dan temperatur reaksi (30 hingga 60 oC). Mereka melaporkan bahwa yield monoetanolamida sangat bergantung pada pemilihan kondisi reaksi dan kondisi reaksi optimum diperoleh pada konsentrasi enzim 0,035 (b/b PKS atau PKL) menggunakan pelarut iso-oktan, waktu reaksi 72 jam, temperatur 40 oC, dengan yield 77,0% untuk PKL-monoetanolamida dan 39,0% untuk PKS-monoetanolamida.
Pengaruh jenis dan konsentrasi enzim telah diamati antara lain oleh Maugard, dkk. (1998), Infante dkk. (2004) dan Sharma, dkk. (2005). Mereka mengamati dua kelas enzim yang berfungsi sebagai biokatalis pada sintesis surfaktan alkanolamida yaitu protease dan lipase. Namun penggunaan protease dilaporkan tidak begitu berhasil
CH2OH OH H HO OH H H H OH NH CH3 + OH O CH3 10 CH2OH OH H OH OH H H H OH N CH3 CH3 O 10 CH2O OH H OH OH H H H OH NH CH3 CH3 O n
N-metil glukamina Asam laurat
Lauroil-N-metil glukamida 6-O-lauroil-N-metil glukamina H2O enzim,pelarut
karena protease spesifik untuk asam amino tertentu dan lebih sensitif pada media organik. Sebaliknya, lipase lebih spesifik karena sangat baik menghidrolisis ikatan N-H pada amina dan lipase terimobilisasi dapat bekerja pada suhu hingga 90 oC. Lipase terimobilisasi dengan rasio enzim terhadap substrat 0,01 hingga 0,15 telah banyak digunakan pada sintesis chiral amida (Soledad dan Gago, 1998), karbohidrat ester (Herawan, dkk. 1996, 1997), fatty amida (Maugard, dkk. 1997; Dolores, dkk. 2002; Par Tufvesson dkk. 2007) dan N-asil-asam amino (Ee Lin Soo, dkk. 2003,2004).
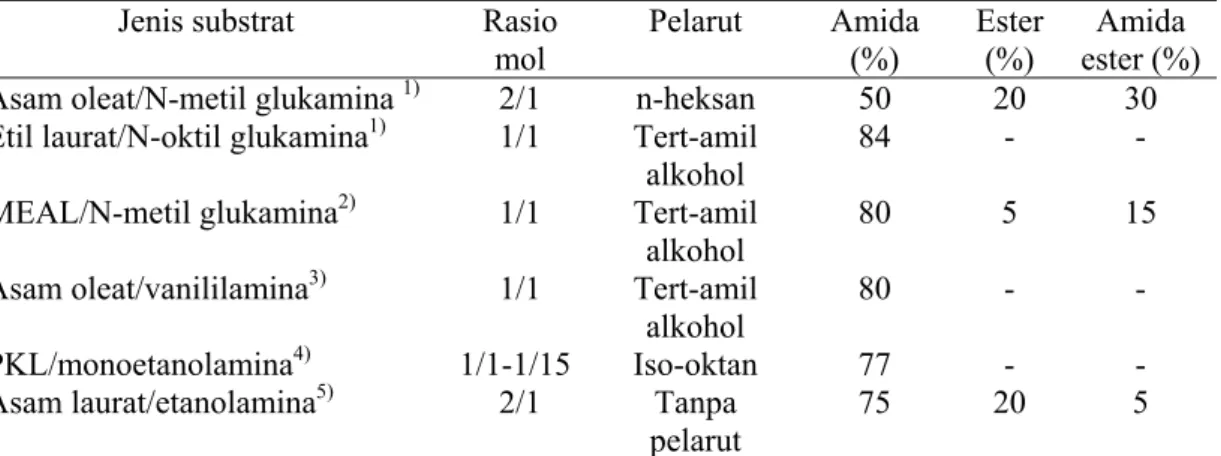
Jenis pelarut dan rasio mol bahan baku menentukan efisiensi dan kemoselektifitas reaksi enzimatik alkanolamida (Dolores, dkk. (2002); Par Tufvesson, dkk. (2007)). Rasio mol bahan baku juga menentukan kondisi asam basa reaksi atau pH yang sangat mempengaruhi perolehan alkanolamida (Maugard, dkk. 1998). Pengaruh jenis pelarut dan rasio mol bahan baku pada sintesis enzimatik alkanolamida telah diamati antara lain oleh Maugard, dkk. (1997) melalui reaksi transasilasi metil ester asam lemak (MEAL) dari minyak Corza dengan N-metil-glukamina. Reaksi dijalankan pada suhu 90oC dan tekanan 500 mBar menggunakan pelarut organik tert-amil alkohol dan n-heksan dengan katalis lipase dari Candida antarctica (Novozym 435®). Dolores, dkk. (2002) juga mengamati pengaruh pelarut n-heksan dan tert-amil alkohol pada sintesis alkanolamida dari vanililamina dan asam oleat menggunakan enzim Novozym 435, serta menyimpulkan bahwa selektivitas reaksi bergantung kepada kelarutan produk di dalam pelarut dan pemilihan bahan pelarut sangat menentukan efisiensi proses. Sementara Rahman, dkk. (2003) mengamati pengaruh berbagai pelarut organik seperti etil asetat, benzene, heksan, heptane, iso-oktan, dekana, dodekana dan n-heksadekana pada sintesis alkanolamida dari monoetanolamin dengan PKL (palm kernel olein) menggunakan enzim lipase dan mengamati bahwa iso-oktan merupakan pelarut yang memberikan hasil terbaik. Rangkuman hasil pengamatan di atas diberikan pada Tabel 1.1 yang menyatakan pengaruh rasio mol bahan baku dan pelarut terhadap yield berbagai alkanolamida.
Pengaruh temperatur dan waktu reaksi pada sintesis alkanolamida secara enzimatik telah diamati oleh beberapa peneliti dan diperoleh hasil yang bervariasi. Pengamatan yang dilakukan oleh Rahman, dkk. (2003) dengan waktu reaksi terbaik adalah 72 jam dan temperatur 40 oC; Maugard, dkk. (1998) pada variasi temperatur 45-90oC dan waktu 25 hingga 140 jam; serta Par Tufvesson, dkk. (2007) yang mengamati pada waktu 10 jam dengan suhu 90oC merupakan beberapa diantara peneliti yang mengamati pengaruh temperatur dan waktu reaksi.
Tabel 1.1 Pengaruh Rasio Mol Bahan Baku dan Pelarut Terhadap Yield Berbagai Alkanolamida
Jenis substrat Rasio
mol Pelarut Amida (%) Ester (%) Amida ester (%)
Asam oleat/N-metil glukamina 1) 2/1 n-heksan 50 20 30
Etil laurat/N-oktil glukamina1) 1/1 Tert-amil
alkohol
84 - -
MEAL/N-metil glukamina2) 1/1 Tert-amil
alkohol
80 5 15
Asam oleat/vanililamina3) 1/1 Tert-amil
alkohol
80 - -
PKL/monoetanolamina4) 1/1-1/15 Iso-oktan 77 - -
Asam laurat/etanolamina5) 2/1 Tanpa
pelarut
75 20 5
Sumber:
1)
Maugard, dkk.., (1997) ; 2)Maugard, dkk. (1998) ; 3)Dolores, dkk. (2002)
4)
Rahman, dkk. (2003) ; 5)Par Tufvesson, dkk. (2007)
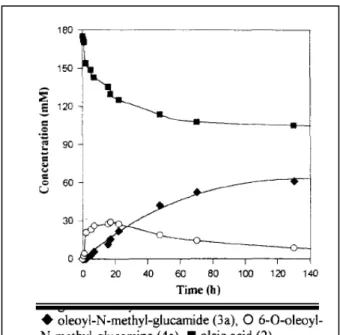
Kemoselektifitas lipase pada sintesis alkanolamida telah diamati dan ditemukan bahwa lipase mampu mengasilasi baik gugus amina maupun gugus alkohol (Soledad, dkk. 2000; Dolores, dkk. 2002). Kebanyakan lipase serentak mengkatalisis reaksi amidasi dan esterefikasi dari alkanolamina, hanya saja jika produk akhir yang diharapkan adalah alkanolamida, maka reaksi perlu dikontrol agar ester yang terbentuk dan migrasi asil dari alkohol ke amina dapat meningkatkan produk amida yang diperoleh. Maugard, dkk. (1998) yang mengamati reaksi amidasi asam oleat dengan N-metil glukamina, sebagaimana ditunjukkan pada Gambar 1.3 dan mengamati hasil analisa HPLC pada Gambar 1.4, menemukan bahwa waktu reaksi berperan mengontrol perolehan amida dimana setelah 130 jam reaksi, ester yang terbentuk akan menjadi amida-ester karena donor asil akan berikatan dengan atom N pada ester.
Dari hasil analisa HPLC pada Gambar 1.4 ditunjukkan bahwa berkurangnya asam oleat (2) sejalan dengan terbentuknya produk N-metil-glukamida (3a). Pada awal-awal reaksi, akan terbentuk amida (3a) dan ester (4a). Kemudian ester (4a) yang terbentuk sebahagian akan hilang diakhir reaksi. Maugard dkk. (1998) menemukan bahwa setelah 130 jam reaksi, 40% asam oleat akan bertransformasi dengan yield amida mencapai 80% dan menyimpulkan bahwa rasio asam/amina akan mengontrol baik efisiensi dan kemoselektivitas dari sintesis enzimatik ini.
Kontrol reaksi sangat berperan pada sintesis alkanolamida secara optimal. Salah satu upaya yang dilakukan untuk mengontrol reaksi adalah dengan mengamati pengaruh interaksi dari variabel penelitian menggunakan Metode Permukaan Sambutan (Response Surface Methodology, RSM) (Montgomery, 1997). Metoda ini dapat digunakan untuk menentukan kondisi reaksi amidasi yang tepat serta mendapatkan konversi asam lemak
dan yield alkanolamida yang maksimum. Beberapa peneliti yang telah mengamati optimasi sintesis surfaktan secara enzimatik, diantaranya Hamsaveni, dkk. (2001); Khrisna, dkk. (2001); Ee Lin Soo, dkk. (2003); Ramkrishna dan Swaminathan (2004) dan Rodrigues, dkk. (2006).
Gambar 1.3 Skema Reaksi Amidasi Asam Oleat dengan N-metil Glukamina oleh Maugard, dkk. (1998). (Keterangan: (1) Amina, (2) Asam Oleat, (3a) Amida, (4a) Ester, (5a) Amida-ester).
Gambar 1.4 Hasil Analisa HPLC Secara Bertahap pada Amidasi N-metil Glukamina dengan Asam Oleat oleh Maugard, dkk. (1998)
Untuk meningkatkan perolehan alkanolamida dan juga meningkatkan efisiensi proses beberapa peneliti melakukan upaya pengembangan. Par Tufvesson, dkk. (2007) mengamati penggunaan kondisi tanpa pelarut, penambahan amina bertahap dan recoveri enzim, Masngut, dkk. (2007) mengamati aplikasi sintesis enzimatik pada bioreaktor berpengaduk multitahap, dan Maugard, dkk. (1998) mengamati sintesis alkanolamida menggunakan asam lemak tidak jenuh rantai panjang yaitu asam oleat.
Par Tufvesson, dkk. (2007) telah mengembangkan sintesis alkanolamida dengan beberapa cara yaitu sintesis tanpa pelarut, penambahan amina secara bertahap, dan recoveri enzim. Fokus utama penelitian mereka adalah pada optimasi yield dan efisiensi penggunaan enzim. Amidasi dari asam laurat dengan monoetanol amina dipilih sebagai model reaksi. Tekanan reaksi adalah pada tekanan atmosfer maupun vakum dengan suhu 90oC dan waktu reaksi 10 jam. Keadaan tersebut dipilih dengan harapan bahwa asam laurat akan melebur pada suhu tersebut. Par Tufvesson, dkk. (2007) menyimpulkan bahwa kondisi tanpa pelarut maupun penambahan amina secara bertahap dapat meningkatkan efisiensi proses. Disamping itu juga disimpulkan bahwa enzim lipase dapat digunakan berulang-ulang hingga 14 hari.
Perancangan bioreaktor yang baik perlu dilakukan agar sintesis alkanolamida secara enzimatik dapat berlangsung optimal pada skala yang lebih besar. Dalam perancangan bioreaktor beberapa hal harus dipertimbangkan seperti tingkat homogenitas yang tinggi, pengadukan yang tidak boleh merusak biokatalis serta konsumsi energi yang minimal. Bioreaktor yang tepat untuk itu adalah reaktor berpengaduk multi tahap (Multistage Mechanically Agitated Compartmented , MSAC) yang tersusun seri. Bioreaktor ini sesuai untuk reaksi yang memerlukan waktu tinggal yang panjang dan homogenitas yang tinggi (Goubet, dkk. 2002; Masngut, dkk. 2007), sehingga reaktor berpengaduk multitahap dipilih sebagai bioreaktor pada pembuatan surfaktan alkanolamida dari asam laurat dengan dietanolamina dan N-metil glukamina.
Penggunaan asam oleat telah banyak digunakan pada sintesis surfaktan karena asam oleat dapat diperoleh dalam jumlah besar dari turunan minyak nabati seperti minyak kelapa sawit. Maugard, dkk. (1998) yang mengamati sintesis alkanolamida menggunakan asam oleat mengamati bahwa wujud asam oleat yang cair menyebabkan asam oleat lebih mudah ditangani dan diinkorporasikan ke dalam suatu produk yang berbentuk cairan.
Berdasarkan paparan di atas dapat disimpulkan bahwa pada sintesis enzimatik alkanolamida dari asam lemak dengan alkanolamina sering terjadi persaingan antara terbentuknya amida, ester dan amida ester apabila kondisi reaksi tidak diatur dengan
baik. Terbentuknya ester ini akan menyebabkan yield surfaktan alkanolamida yang dihasilkan menjadi rendah. Untuk itu diperlukan kajian untuk meningkatkan yield alkanolamida dengan mengoptimalkan kondisi reaksi dan selanjutnya pada kondisi optimal ini dicoba untuk menambahkan alkanolamina secara bertahap, menggunakan enzim secara berulang, aplikasi dalam bioreaktor dan menggunakan kondisi tanpa pelarut.
1.2 Perumusan Masalah
Agar diperoleh surfaktan alkanolamida yang mudah terdegradasi dan berbasis tumbuhan dengan yield yang lebih baik, maka perlu dikaji upaya-upaya yang dapat dilakukan untuk meningkatkan yield alkanolamida. Upaya-upaya yang dapat dilakukan antara lain dengan mengamati pengaruh variabel reaksi (jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi, serta rasio molar amina/asam laurat) dan mengamati pengaruh interaksi serta kondisi optimum variabel reaksi. Upaya-upaya lain seperti menggunakan kondisi tanpa pelarut, penambahan amina bertahap, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multitahap juga perlu untuk diamati. Oleh karena itu yang menjadi permasalahan adalah:
1) Bagaimana pengaruh jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi, serta rasio molar amina/asam laurat, terhadap persen konversi asam laurat.
2) Bagaimana pengaruh interaksi dari variabel penelitian, model persamaan optimasi serta kondisi reaksi amidasi yang optimum untuk mendapatkan persen konversi asam laurat dan yield alkanolamida yang maksimum.
3) Bagaimana upaya meningkatkan perolehan alkanolamida dan efisiensi proses jika menggunakan kondisi tanpa pelarut, penambahan amina bertahap, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multi-tahap.
1.3 Tujuan Penelitian
Sejalan dengan permasalahan yang ingin diteliti, penelitian terdiri dari tiga tahapan pekerjaan yaitu tahapan Pendahuluan, tahapan Optimasi dan tahapan Pengembangan Proses. Secara ringkas tujuan dari masing-masing tahapan penelitian ini adalah:
1) Tahap Pendahuluan bertujuan untuk mengetahui pengaruh jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi serta rasio molar substrat terhadap persen konversi asam laurat.
2) Tahap Optimasi bertujuan untuk mengamati pengaruh interaksi dari variabel penelitian, menyusun model persamaan optimasi serta menentukan kondisi reaksi amidasi yang optimum menggunakan Metode Permukaan Sambutan (Response Surface Methodology, RSM) untuk mendapatkan persen konversi asam laurat dan yield alkanolamida yang maksimum. Variabel penelitian yang diamati adalah temperatur, konsentrasi enzim dan rasio molar substrat.
3) Tahap Pengembangan Proses bertujuan untuk meningkatkan perolehan alkanolamida dan efisiensi proses melalui penambahan amina bertahap, kondisi tanpa pelarut, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multi-tahap. Pada bioreaktor diamati pengaruh putaran motor dan jenis pengaduk terhadap persen konversi asam laurat.
1.4 Hipotesis Penelitian
Hipotesis dari penelitian yang dilakukan adalah:
1) Surfaktan alkanolamida dapat disintesis melalui reaksi amidasi enzimatik antara dietanolamina dan N-metil glukamina dengan asam laurat. Jumlah asam laurat yang terkonversi menjadi alkanolamida dipengaruhi oleh jenis dan konsentrasi enzim, jenis dan rasio pelarut, temperatur, waktu reaksi serta rasio molar substrat.
2) Pengaruh interaksi dari variabel penelitian yaitu konsentrasi enzim, rasio molar substrat dan temperatur, model persamaan optimasi serta kondisi reaksi amidasi yang optimum dapat ditentukan menggunakan Metode Permukaan Sambutan. 3) Perolehan alkanolamida dan efisiensi proses dapat ditingkatkan melalui
penambahan amina secara bertahap, kondisi tanpa pelarut, recoveri enzim, penggunaan asam lemak tidak jenuh rantai panjang dan aplikasi bioreaktor berpengaduk multi-tahap.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan sumbangan baru pada kemajuan ilmu pengetahuan dalam penerapan bioteknologi dan penerapan metode optimasi pada sintesis dua jenis alkanolamida secara enzimatik menggunakan Metode
Permukaan Sambutan, dan masukan bagi industri oleokimia untuk digunakan sebagai salah satu bahan surfaktan baru yang ramah lingkungan.