BAB IV
HASIL PENELITIAN DAN PEMBAHASAN 4.1 Ektraksi dan Fraksinasi
Sebanyak 400 gram sampel halus daun jamblang (Syzygium cumini) dimaserasi dengan pelarut metanol selama 4 × 24 jam, dimana setiap 24 jam pelarut metanol diganti dengan yang baru. Digunakan pelarut metanol dalam dalam maserasi ini dikarenakan pelarut metanol yang diketahui sebagai pelarut universal dapat mengikat komponen kimia baik bersifat polar, semi polar, dan non polar yang ada pada kandungan senyawa tumbuhan tersebut. Maserat yang terkumpul kemudian diuapkan dengan alat penguap vakum pada suhu 40°C dan menghasilkan ekstrak kental metanol sebanyak 31,56 gram.
Ekstrak kental metanol sebanyak 10 gram disuspensi dengan metanol:air (2:1) dan dilakukan partisi menggunakan pelarut dengan tingkat kepolaran pelarut yang berbeda-beda. Proses partisi ini bertujuan untuk menarik atau memisahkan komponen senyawa sesuai dengan tingkat kepolarannya. Proses ini menggunakan pelarut n-heksan dan etil asetat. Partisi pertama dengan pelarut n-heksan sebanyak 4× dan diperoleh fraksi n-heksan dan fraksi air. Fraksi air ini kemudian di partisi lagi dengan pelarut etil asetat dan menghasilkan fraksi etil asetat dan fraksi air. Masing-masing fraksi ini kemudian dievaporasi pada suhu 40°C dan menghasilkan ekstrak kental n-heksan sebanyak 0,41 g, ekstrak kental etil asetat sebanyak 3,32 g dan ekstrak kental air sebanyak 1,37 g.
4.2 Uji Fitokimia
Terhadap ekstrak kental metanol dilakukan uji fitokimia dan fraksi-fraksinya. Data hasil uji fitokimia dapat di lihat pada tabel berikut ini.
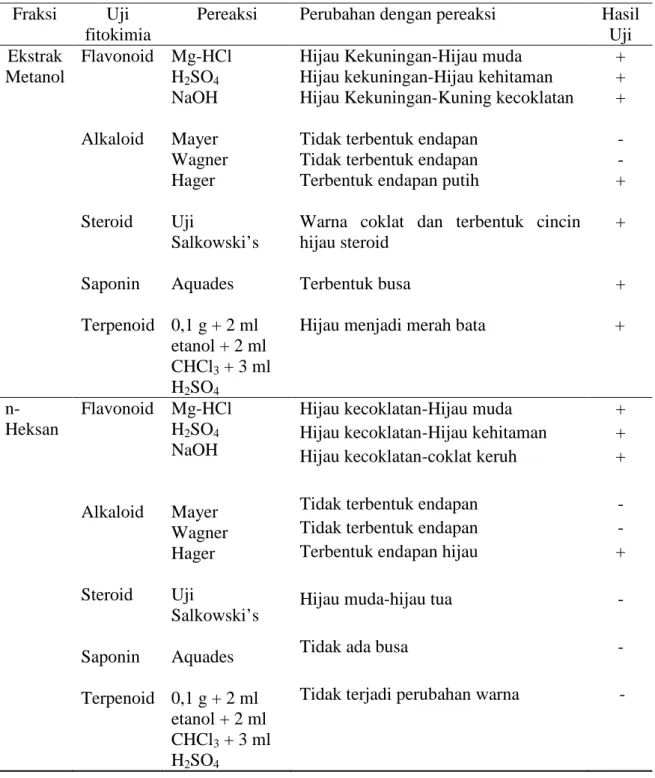
Tabel 4. Hasil uji fitokimia dari berbagai fraksi Fraksi Uji
fitokimia
Pereaksi Perubahan dengan pereaksi Hasil Uji Ekstrak Metanol Flavonoid Alkaloid Steroid Saponin Terpenoid Mg-HCl H2SO4 NaOH Mayer Wagner Hager Uji Salkowski’s Aquades 0,1 g + 2 ml etanol + 2 ml CHCl3 + 3 ml H2SO4
Hijau Kekuningan-Hijau muda Hijau kekuningan-Hijau kehitaman Hijau Kekuningan-Kuning kecoklatan Tidak terbentuk endapan
Tidak terbentuk endapan Terbentuk endapan putih
Warna coklat dan terbentuk cincin hijau steroid
Terbentuk busa
Hijau menjadi merah bata
+ + + - - + + + + n-Heksan Flavonoid Alkaloid Steroid Saponin Terpenoid Mg-HCl H2SO4 NaOH Mayer Wagner Hager Uji Salkowski’s Aquades 0,1 g + 2 ml etanol + 2 ml CHCl3 + 3 ml H2SO4
Hijau kecoklatan-Hijau muda Hijau kecoklatan-Hijau kehitaman Hijau kecoklatan-coklat keruh Tidak terbentuk endapan Tidak terbentuk endapan Terbentuk endapan hijau Hijau muda-hijau tua Tidak ada busa
Tidak terjadi perubahan warna
+ + + - - + - - -
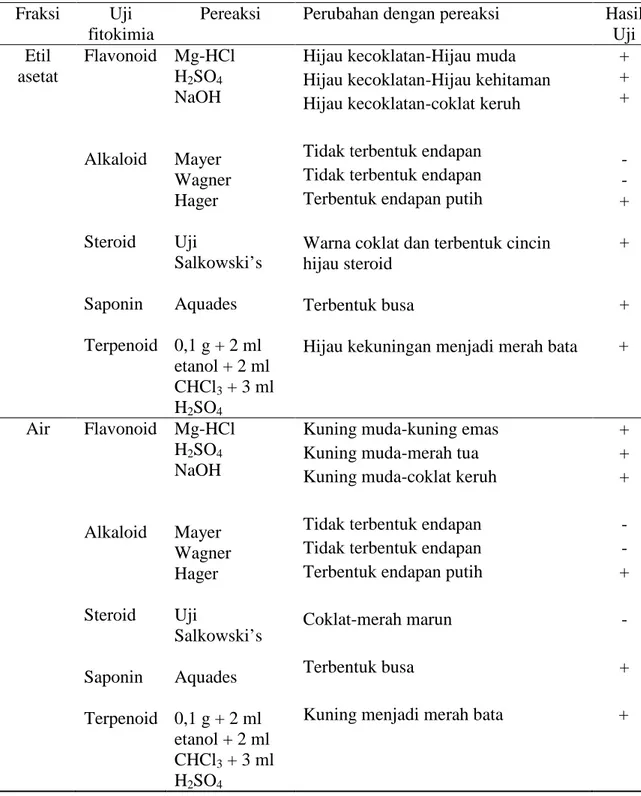
Tabel lanjutan Hasil Uji Fitokimia dari berbagai fraksi Fraksi Uji
fitokimia
Pereaksi Perubahan dengan pereaksi Hasil Uji Etil asetat Flavonoid Alkaloid Steroid Saponin Terpenoid Mg-HCl H2SO4 NaOH Mayer Wagner Hager Uji Salkowski’s Aquades 0,1 g + 2 ml etanol + 2 ml CHCl3 + 3 ml H2SO4
Hijau kecoklatan-Hijau muda Hijau kecoklatan-Hijau kehitaman Hijau kecoklatan-coklat keruh Tidak terbentuk endapan Tidak terbentuk endapan Terbentuk endapan putih
Warna coklat dan terbentuk cincin hijau steroid
Terbentuk busa
Hijau kekuningan menjadi merah bata
+ + + - - + + + + Air Flavonoid Alkaloid Steroid Saponin Terpenoid Mg-HCl H2SO4 NaOH Mayer Wagner Hager Uji Salkowski’s Aquades 0,1 g + 2 ml etanol + 2 ml CHCl3 + 3 ml H2SO4
Kuning muda-kuning emas Kuning muda-merah tua Kuning muda-coklat keruh Tidak terbentuk endapan Tidak terbentuk endapan Terbentuk endapan putih Coklat-merah marun Terbentuk busa
Kuning menjadi merah bata
+ + + - - + - + +
Berdasarkan Tabel 4, senyawa-senyawa kimia yang terkandung dalam daun
Setiap 0,1 g ekstrak dimasukkan kedalam masing-masing tabung reaksi kemudian dilakukan uji fitokimia sesuai dengan pereaksi uji untuk setiap senyawa yang akan diidentifikasi.
1. Uji Flavonoid
Flavonoid yang merupakan suatu senyawa fenol terbesar ditemukan dialam (Harbone, 1987 dalam Rahmawati, 2012). Flavonoid yang ditemukan Fowler dkk (2009) dalam Rahmawati (2012) menunjukkan aktivitas biokimia misalnya antioksidan, antivirus, antibakteri, dan anti kanker. Pada daun Syzygium cumini dilaporkan oleh Gowri dan Vasantha (2010) bahwa digunakan sebagai anti bakteri dan sebagai penguat gigi dan gusi.
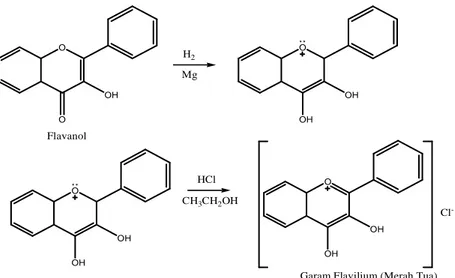
Pada uji flavonoid ini digunakan tiga pereaksi yaitu Mg-HCl, H2SO4, dan NaOH. Perubahan warna yang terjadi menandakan bahwa ekstrak tersebut positif mengandung senyawa flavonoid. Hasil yang ditunjukan dari keempat ekstrak tersebut yakni ekstrak metanol, n-heksan, etil asetat, dan air terjadi perubahan warna. Ini mengindikasikan positif mengandung flavonoid. Hal ini juga didukung oleh hasil penelitian yang dilakukan oleh Gowri dan Vasanta (2010) pada ekstrak metanol dan fraksi air positif mengandung flavonoid. Hasil yang sama pun dilakukan oleh Arifin, dkk (2006) bahwa kandungan daun Syzygium cumini positif mengandung flavonoid. Adanya flavonoid dalam suatu ekstrak tumbuhan akan menghasilkan hasil positif bila direaksi dengan pereaksinya menghasilkan perubahan warna. Berikut reaksi dugaan antara flavonoid dengan Mg-HCl dan H2SO4 yang menghasilkan perubahan warna.
HCl O OH OH OH OH O Cl
-Garam Flavilium (Merah Tua) CH3CH2OH H2 O O OH Flavanol Mg O OH OH
Gambar 5. Perkiraan reaksi antara senyawa Flavonoid dengan Mg-HCl
NaOH O
O
Krisin Asetofenon (Kuning)
OH HO HO OH CO2H OH A B A B C O H3C +
Gambar 6. Perkiraan reaksi senyawa Flavonoid dengan NaOH 2. Uji Alkaloid
Alkaloid adalah senyawa organik siklik yang mengandung nitrogen dengan bilangan oksidatif negatif yang penyebarannya terbatas pada makhluk hidup (Pelletier, 1983 dalam Mestiani, 2001). Menurut Bruneton, 1993 dalam Mestiani 2001 bahwa konsentrasi alkaloid di dalam tumbuhan memiliki kisaran yang lebar yaitu dari hanya beberapa ppm (seperti pada alkaloid antikanker) sampai lebih dari 15% dan bervariasi dari bagian ke bagian, bahkan beberapa bagian mungkin tidak mengandung alkaloid sama sekali.
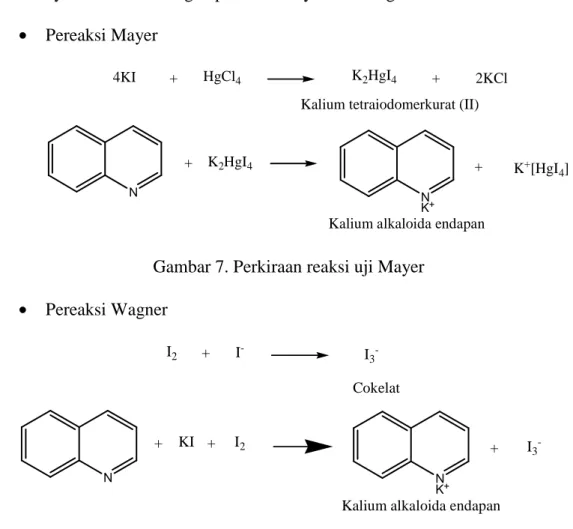
Berdasarkan hasil penelitian pada tabel 4 dari ekstrak metanol, n-heksan, etil asetat, dan air menunjukkan hasil positif alkaloid dengan terbentuknya endapan. Namun, alkaloid pada semua fraksi yang ditunjukkan hanya pada pereaksi Hager yang menghasilkan endapan. Sedangkan pada pereaksi Mayer dan Wagner tidak terbentuk endapan. Ini mengindikasikan bahwa hanya sedikit jumlah alkaloid yang terkandung dalam daun Syzygium cumini. Hal ini didukung oleh hasil penelitian yang dilakukan oleh Gowri dan Vasantha (2010) bahwa senyawa alkaloid dalam daun Syzygium cumini yang diperoleh hanya dalam jumlah sedikit. Positif alkaloid dengan terbentuknya endapan. Berikut dugaan reaksi yang terjadi pada senyawa alkaloid dengan pereaksi Mayer dan Wagner.
• Pereaksi Mayer
+
4KI HgCl4 K2HgI4 2KCl
Kalium alkaloida endapan
N + + N K+ K2HgI4 K+[HgI 4] +
Kalium tetraiodomerkurat (II)
Gambar 7. Perkiraan reaksi uji Mayer
• Pereaksi Wagner
KI
+ I- I3
-Cokelat
+
Kalium alkaloida endapan
N N
K+
+
+ I2 I3
-I2
3. Uji Steroid/Terpenoid
Pada uji steroid, ekstrak di tambahkan dengan 2 ml kloroform kemudian dimasukkan H2SO4 melalui dinding tabung reaksi melalui dinding tabung reaksi secara hati-hati. Hasil positif bila terbentuknya warna coklat disertai dengan adanya cincin hijau steroid. Sedangkan pada terpenoid positif bila terjadi perubahan warna menjadi merah bata. Hasil postif ditunjukkan pada ekstrak metanol dan etil asetat untuk uji steroid, namun untuk uji terpenoid yang tidak menunjukkan hasil positif hanya pada fraksi n-heksan.
Senyawa triterpenoid/steroid akan mengalami dehidrasi dengan penambahan asam kuat dan membentuk garam yang memberikan sejumlah reaksi warna (Mukhlish, 2010). Adapun reaksi perkiraan uji terpenoid/steroid berikut ini
CH3COOH)2O HO H3COC -CH3COOH H3COC -H2O H2SO4 pekat H3COC SO2H
asam 3-aseto-5-kolesterol sulfonat (Hijau) Kolesterol
4. Uji Saponin
Pada uji saponin, positif bila ditambahkan dengan aquades panas akan terbentuk busa/buih selama 15 menit. Hasil positif ditunjukkan pada ekstrak metanol, etil asetat, dan air. Namun, pada fraksi n-heksan tidak terbentuk busa/buih. Timbulnya busa menunjukkan adanya glikosida yang mempunyai kemampuan membentuk buih dalam air yang terhidrolisis menjadi glukosa dan senyawa lainnya (Rusdi, 1990 dalam Marliana, dkk; 2005). Reaksi yang mungkin terjadi pada uji saponin dapat dilihat pada Gambar 10.
1-Arabinopiriosil-3β−asetil olenolat CO O OH OH CH2OH O OH Aglikon O OH OH CH2OH OH CO2H H2O Glukosa +
Gambar 10. Reaksi perkiraan uji saponin
4.3 Pemisahan dan Pemurnian
Sampel yang telah diuji fitokimia kemudian dilakukan pemisahan dan pemurnian yang bertujuan untuk mendapatkan senyawa murni dari ekstrak yang ada. Sebanyak 10 g ekstrak metanol di pisahkan dengan kromatografi kolom dengan menggunakan fase diam silica gel GF60 dan berturut – turut fase gerak n-heksan: etil asetat (9,5:0,5), (9:1), (8,5:1,5), (8:2), (7,5:2,5), (7:3), (6,5:3,5), (6:4), (5,5:4,5), (5:5), (4,5:5,5), (4:6), (3,5:6,5), (3:7), (2,5:7,5), (2:8), (1,5:8,5), (1:9),
(0,5:9,5), etil asetat : metanol sampai terjadi pemisahan. Hasil pemisahan kolom diperoleh 167 fraksi, kemudian keseluruhan fraksi dilakukan KLT penggabungan. Semua fraksi hasil pemisahan dianalisis dengan kromatografi lapis tipis untuk melihat pola noda. Berikut gambar hasil KLT 167 fraksi.
M1 M2 M3 M4 M5
Gambar 11. Profil kromatografi lapis tipis hasil pemisahan kromatografi kolom, fasa gerak n-heksan : etil asetat ( 9:1), M1: ( fraksi 40-41), M2: ( fraksi 42-50), M3: (fraksi 54-102), M4 : (fraksi 105), M5 : (fraksi 107-167) Berdasarkan hasil analisis kromatografi lapis tipis, dari 167 fraksi diperoleh 3 fraksi dan yang dipilih untuk pemurnian kembali adalah fraksi M2 ( 42 – 50) dengan pertimbangan bahwa fraksi ini yang menunjukkan pola noda yang sama dengan pemisahan yang baik. Selain itu, fraksi ini masih menampakkan tiga bercak noda. Hal ini berarti bahwa isolat ini diduga belum murni sehingga perlu di lakukan pemisahan kembali dengan kromatografi kolom menggunakan fasa diam silica gel dan fasa gerak n-heksan : etil asetat dengan perbandingan berturut – turut sampai 100% etil asetat hingga diperoleh 35 fraksi.
Dari 35 fraksi yang diperoleh, fraksi yang terbentuk kristal yaitu terdapat pada fraksi nomor 7-10. Kemudian fraksi-fraksi ini dilakukan analisis kromatogarfi lapis tipis dengan perbandingan eluen n-heksan : etil asetat ( 8:2),
namun hasil analisis menunjukkan ketiga fraksi ini masih menampakkan dua bercak noda. Ini menandakan bahwa isolat dari fraksi ini belum juga murni, sehingga perlu digabung karena juga menghasilkan pola noda dan harga Rf yang sama dan dilakukan pemisahan kembali dengan kromatografi kolom. Berikut gambar hasil analisis kromatografi lapis tipis hasil kromatografi kolom kedua.
Gambar 12. Profil kromatografi lapis tipis hasil pemisahan kromatografi kolom kedua, fasa gerak n-heksan : etil asetat ( 8:2)
Ketiga fraksi diatas digabung dan dilakukan pemisahan kembali dengan kromatografi kolom menggunakan fasa gerak n-heksan : etil asetat berturut- turut sampai perbandingan 5:5 hingga diperoleh 26 fraksi.
Dari 26 fraksi ini dilakukan analisis kromatografi lapis tipis dan hasil menunjukkan pada fraksi nomor 9 dan 10 menampakan pola noda tunggal. Ini menandakan bahwa isolat ini sudah murni dan selanjutnya digabung dan dianalisis lagi dengan kromatografi lapis tipis dua dimensi. Berikut gambar hasil analisis kromatografi lapis tipis.
Gambar 13. Profil hasil kromatografi lapis tipis, fasa gerak n-heksan : etil asetat (8:2)
4.4 Uji Kemurnian
Isolat hasil gabungan fraksi nomor 9 dan 10 yang di duga murni ini sebelum di identifikasi dengan spektrofotometer UV-Vis dan IR, fraksi ini di uji dengan menggunakan kromatografi lapis tipis dua dimensi.
Tujuan dilakukannya kromatografi lapis tipis dua dimensi ini adalah untuk melihat apakah isolat ini benar-benar murni atau belum dengan eluen dan perbandingan yang berbeda. Perbandingan eluen yang digunakan dalam analisis ini yaitu n-heksan : etil asetat (8:2) dan kloroform : metanol (9:1).Hasil analisis menunjukan bahwa pola noda isolat ini tunggal. Ini mengindikasikan bahwa isolat ini sudah murni.
KLT dua dimensi tetap menunjukkan noda tunggal dengan harga Rf yang berbeda untuk setiap fasa gerak, dengan perbandingan eluen n- heksan:etil asetat (8:2) memberikan harga Rf 0,22 dan kloroform:metanol (9:1) memberikan harga Rf 0,94. Berikut gambar hasil analisis kromatografi lapis tipis dua dimensi.
M1
M2
Gambar 14. Profil kromatografi lapis tipis dua dimensi hasil pemisahan kolom ketiga dari penggabungan fraksi menggunakan adsorben silica gel GF254
Keterangan:
(M1): n-heksan : etil asetat (8:2) (M2): kloroform : metanol (9:1)
4.4.1 Uji Flavonoid Isolat Murni
Isolat murni ini kemudian di uji flavonoid untuk mengetahui senyawa awal yang terkandung dalam flavonoid. Hasil uji flavonoid dapat di lihat pada Tabel 5. Tabel 5. Hasil Uji Flavonoid Isolat Murni
No. Uji Fitokimia Pereaksi fitokimia Perubahan dengan pereaksi Hasil Uji 1. Flavonoid Mg-HCl H2SO4 NaOH
Hijau muda-kuning muda Hijau muda-hijau tua Hijau muda- bening
(+) Flavonoid (+) Flavonoid (+) Flavonoid
4.5 Identifikasi Isolat Murni
4.5.1 Spektrofotometer Inframerah (IR)
Spektrum inframerah isolat dapat dilihat pada gambar 15 dan tabulasi data bilangan gelombang, intensitas, dan gugus fungsi dapat dilihat pada Tabel 6.
Gambar 15. Spektrum Inframerah dari Senyawa Isolat
Berdasarkan analisis spektrum inframerah pada gambar 15 menunjukan adanya beberapa gugus fungsi. Hasil analisis isolat ini yaitu adanya serapan
melebar dengan intensitas lemah pada daerah bilangan gelombang 3346,42 cm-1 yang diduga adalah serapan uluran dari gugus O-H. Intensitas serapan infra merah menurut Justik, 2010 bahwa daerah puncak serapan yang tinggi dan transmitannya berkisar antara 0-35% , maka intensitasnya kuat. Sedangkan puncak serapan yang sedang dan transmitanna berkisar pada 75-35% intensitas serapanya sedang. Serta daerah serapan dengan puncak yang pendek dan transmitannya berkisar pada 90-75% intensitasnya lemah. Serapan uluran C-H alifatik yang tajam dan lemah muncul pada daerah bilangan gelombang 2947,22 cm-1 dan 2832,89 cm-1. Hal ini didukung dari hasil penelitian oleh Akbar (2010) bahwa serapan pada bilangan gelombang 2927,36 cm-1 menunjukkan vibrasi ulur C-H di dalam gugus C-H alifatik. Adanya gugus karbonil (C=O) sebagai ciri umum senyawa golongan flavonoid (Sukadana, 2010) diindikasikan oleh adanya serapan pada daerah bilangan gelombang 1654,00 cm-1. Serapan uluran C=C aromatik muncul pada daerah bilangan gelombang 1450,31 cm-1. Kemudian vibrasi ulur C-O dalam senyawaan fenol menghasilkan pita kuat di daerah 1260-1000 cm-1(Silverstein dkk, 1986) dan pada isolat ini serapan C-O muncul pada daerah bilangan gelombang 1113,25 dengan pita lemah dan lemah cm-1 dan 1024,94 cm-1 dengan pita tajam dan kuat. Sementara itu serapan pada bilangan gelombang 613,13 cm-1 adanya gugus C-H aromatik keluar bidang. Adanya gugus fungsi OH, CH alifatik, C=C aromatik dan C-O mengindikasikan isolat ini suatu senyawa flavonoid. Ini diperkuat berdasarkan hasil penelitian yang dilakukan oleh (Akbar, 2010) sesuai dengan hasil spektrum infra merah adanya gugus fungsi O-H, C=O, C-O, C=C
aromatik, dan C-H alifatik yang mendukung bahwa isolatnya positif suatu senyawa flavonoid.
Tabel 6. Interpretasi Spektrum Inframerah (Bilangan Gelombang, Bentuk pita, Intensitas, dan Penempatan Gugus Fungsi ) dari Isolat.
N o
Bilangan Gelombang(cm-1) Bentuk
Pita Intensitas Kemungkinan Gugus Fungsi Isolat Sukadana, (2010) Pustaka ( Creswell,et all, Silverstein ) Akbar, (2010) Arisandy (2010) 1. 3346.42 3000-3500 3200-3400 3350-3200
3500-3000 Melebar Lemah Uluran O-H
2. 2947.22 2800-2950 2700-3000 - 3000-2700 Tajam Lemah Uluran C-H alifatik
2832.89 Tajam Lemah
3. 1654.00 1700-1725 1650-1900 1870-1540
- Melebar Lemah Uluran C=O
4. 1450.31 1400-1650 1500-1475 - 1650-1450 Tajam Lemah Uluran C=C aromatik 5. 1113.25 990-1100 1260-1000 1260-1000 1230-1000 Tajam Lemah C-O alkohol 1024.94 Tajam Kuat
6. 613.33 650-1000 650-1000 - 900-650 Tajam Lemah C-H aromatik kel. bidang
4.5.2 Spektrofotometer UV-Vis
Terhadap isolat murni selanjutnya diuji identitasnya berdasarkan teknik Spektrofotometer UV-Vis. Hasil spektrofotometer UV-Vis ditunjukkan pada Gambar 16 dan tabulasi data panjang gelombang absorpsi isolat dipaparkan pada Tabel 7.
Panjang gelombang (nm) Gambar 16. Spektrum UV-Vis Isolat dalam pelarut metanol
Tabel 7. Tabulasi data panjang gelombang absorpsi spektrum UV-Vis isolat dalam pelarut metanol.
Pita Panjang Gelombang Absorbans
1. 290,00 0,530
2. 216,00 0,907
Dari spektrum yang tampak, terdapat dua pita yang dihasilkan oleh isolat murni dalam pelarut metanol. Pita pertama mempunyai panjang gelombang 290,00 nm dan pita kedua mempunyai panjang gelombang 216,00 nm. Serapan pada panjang gelombang 290,00 nm diduga adanya transisi elektron-elektron yang tidak berikatan ke orbital anti ikatan (n →π*) oleh suatu gugus C=O. Serapan ini
terjadi pada panjang gelombang yang panjang dan intensitasnya rendah (Sastrohamidjojo, 2001). Menurut (Mulja, 1995 dalam Daniel, 2010) bahwa gugus karbonil (C=O) akan menyebabkan eksitasi elektron n → π* yaitu eksitasi
elektron yang berasal dari elektron sunyi oksigen karbonil ke orbital inti ikatan rangkap gugus karbonil sendiri. Sedangkan serapan pada panjang gelombang 216,00 nm diduga adanya transisi elektron π→π* yang dapat diperkirakan adanya
A b so rb an si
ikatan C=C terkonjugasi yang terjadi pada panjang gelombang 210-285 nm (Sastrohamidjojo, 1991 dalam Inayah, 2010). Transisi ini dapat terjadi jika suatu molekul organik mempunyai gugus fungsional yang tidak jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan orbital phi yang diperlukan ( Gandjar dan Rohman2008) Berdasarkan hasil identifikasi spektrofotometer IR dan UV-Vis dapat diduga isolat tersebut merupakan senyawa flavonoid.