3 METODE PENELITIAN
3.1
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bioteknologi Tanah
Departemen Ilmu Tanah dan Sumberdaya Lahan Fakultas Pertanian IPB dan
Indonesian Center for Biotechnology and Biodiversity (ICBB) Cilubang Nagrak
Situgede Kabupaten Bogor. Penelitian ini dilaksanakan mulai bulan Desember
2008 sampai dengan Juli 2009.
3.2
Bahan dan Alat
Bahan yang digunakan adalah sampel ganggang mikro air tawar dan
tanah yang berasal dari berbagai lokasi dan ekosistem di Jawa Barat dan Jawa
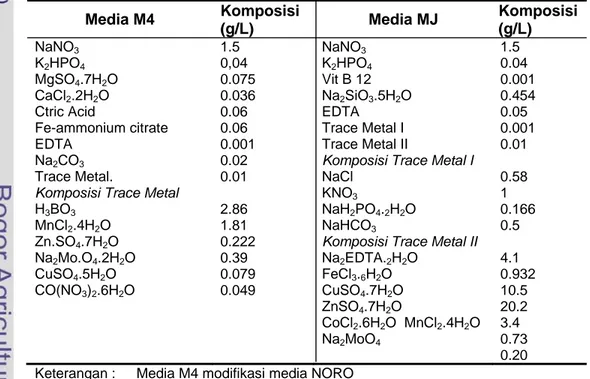
Tengah serta beberapa jenis bahan kimia. Media yang digunakan sebagai media
tumbuh ganggang mikro adalah media M4 (media NORO) dan media MJ (media
Jorgensen) sebagai media standar (Takagi et al., 2005). Media ini akan
digunakan pada tahapan isolasi dan kultivasi ganggang mikro. Komposisi media
standar disajikan pada Tabel 4.
Tabel 4 Komposisi media standar
Media
M4
Komposisi
(g/L)
Media MJ
Komposisi
(g/L)
NaNO3 K2HPO4 MgSO4.7H2O CaCl2.2H2O Ctric Acid Fe-ammonium citrate EDTA Na2CO3 Trace Metal.Komposisi Trace Metal H3BO3 MnCl2.4H2O Zn.SO4.7H2O Na2Mo.O4.2H2O CuSO4.5H2O CO(NO3)2.6H2O 1.5 0,04 0.075 0.036 0.06 0.06 0.001 0.02 0.01 2.86 1.81 0.222 0.39 0.079 0.049 NaNO3 K2HPO4 Vit B 12 Na2SiO3.5H2O EDTA Trace Metal I Trace Metal II
Komposisi Trace Metal I NaCl
KNO3
NaH2PO4.2H2O
NaHCO3
Komposisi Trace Metal II Na2EDTA.2H2O FeCl3.6H2O CuSO4.7H2O ZnSO4.7H2O CoCl2.6H2O MnCl2.4H2O Na2MoO4 1.5 0.04 0.001 0.454 0.05 0.001 0.01 0.58 1 0.166 0.5 4.1 0.932 10.5 20.2 3.4 0.73 0.20 Keterangan : Media M4 modifikasi media NORO
Alat yang digunakan adalah erlenmeyer, autoklaf, shaker, laminar flow,
sentrifuse, spektrofotometer (spektronik 20) dan mikroskop flouresence.
3.3
Pelaksanaan Penelitian
Pelaksanaan penelitian ini disajikan pada bagan alir Gambar 2.
Keterangan: - - - adalah objek kajian
Gambar 2 Bagan alir penelitian
Produksi total lipid
Isolasi dan seleksi
ganggang mikro
28 Isolat
Pengambilan sampel
ganggang mikro di
Jawa Barat dan Jawa Tengah
Potensi ganggang mikro
Identifikasi
ganggang mikro
Bahan Bakar Nabati (BBN)
Optimasi pertumbuhan
ganggang mikro
Analisis pengaruh
salinitas dan pH
Analisis kadar
gula total
Kultivasi
Ganggang Mikro
4 Isolat
Optimasi nitrogen
dan fosfor
3.3.1 Pengambilan Sampel
Pengambilan sampel dilakukan pada berbagai lokasi dan ekosistem di
Jawa Barat dan Jawa Tengah. Lokasi mewakili ekosistem dengan keragaman
yang tinggi yaitu ekosistem Kawah Vulkan (Bledug Kuwu), bendungan besar
yaitu waduk Sempor, Kebumen Jawa Tengah, kolam dan sawah yang
diperkirakan merupakan habitat hidup ganggang mikro. Deskripsi lokasi
pengambilan sampel ganggang mikro disajikan pada Lampiran 1.
3.3.2 Tahapan Isolasi dan Seleksi Ganggang Mikro
Tahapan isolasi dilakukan dengan tujuan untuk mendapatkan sampel
ganggang mikro yang akan digunakan pada tahapan kultivasi. Tahapan isolasi
dilakukan dengan pemurnian biakan pada pengenceran bertingkat. Dari tahapan
isolasi kemudian ganggang mikro diseleksi untuk selanjutnya akan dikultivasi
pada berbagai volume media biakan.
Tahapan isolasi diawali dengan pemurnian sampel ganggang mikro pada
pengenceran bertingkat kemudian seluruh sampel ganggang mikro diisolasi
sebanyak 0,25 ml ke dalam erlenmeyer berisi 5 ml volume media M4 dan Mj.
Isolat diinkubasi pada 27 ± 2
0C dibawah cahaya dengan intensitas 1.2 ± 0.5 klux
dengan 12:12 jam fotoperiode. Setelah tahapan isolasi dilakukan tahapan seleksi
ganggang mikro berdasarkan kecepatan tumbuh, kondisi pertumbuhan, dan
keanekaragaman pigmennya. Isolat ganggang mikro yang terseleksi disimpan
pada agar miring sebagai stok serta pada gliserol 20%, dan diletakkan didalam
freezer.
3.3.3 Tahapan Kultivasi
Tahapan kultivasi dilakukan agar ganggang mikro yang telah terseleksi
diperoleh dalam jumlah atau masa sel yang cukup untuk digunakan pada
tahapan optimasi. Tahapan kultivasi dilakukan dengan menumbuhkan
masing-masing isolat ganggang mikro terseleksi pada erlenmeyer kedalam media
dengan volume yaitu 25 ml, 50 ml 150 ml, dan 250 ml. Kultur tunggal dipastikan
dengan peremajaan berulang dan pengamatan di bawah mikroskop.
Pertumbuhan awal diamati selama selang waktu 7-10 hari setelah ditumbuhkan.
Setelah stok kultur pada volume media 250 ml mencapai optical density (OD)
0.2 atau lebih maka biakan ganggang mikro siap untuk digunakan pada tahapan
optimasi.
3.3.4 Tahapan Optimasi Pertumbuhan ganggang mikro
Tahapan optimasi pertumbuhan dilakukan dengan menguji pertumbuhan
ganggang mikro berdasarkan optimasi nitrogen dan fosfor terhadap produksi total
lipid, salinitas dan pH terhadap media biakan dan kadar gula total ganggang
mikro dalam larutan media biakan
3.3.4.1 Optimasi Nitrogen dan Fosfor
Optimasi nitrogen dan fosfor dilakukan untuk mengetahui produksi
biomasa, dan produksi total lipid ganggang mikro setelah 30 hari masa inkubasi.
Sedangkan laju pertumbuhan ganggang mikro diukur selama masa inkubasi.
Proses optimasi diawali dengan menumbuhkan kultur biakan ganggang
sebanyak 10 ml kedalam media dengan volume 500 ml dengan dua sumber
nitrogen dan fosfor pada berbagai konsentrasi. Biakan diinkubasi pada 27 ± 2
0C
dibawah cahaya dengan intensitas 1.2 ± 0.5 klux dengan 12:12 jam fotoperiode.
Pada beberapa spesies ganggang mikro, laju pertumbuhan diatur dengan
memodifikasikan nitrogen dan fosfor (Lambardi dan Wangersky, 1991). KNO
3dan Urea (CO (NH
2)
2) merupakan hara yang digunakan sebagai sumber
nitrogen. Sebagaimana yang dideskripsikan oleh Change dan Page (1995), laju
pertumbuhan ganggang tertinggi dengan NO
3
-, sedang dengan NH
4 +dan yang
paling rendah dengan Urea. Sumber fosfor ditambahkan dengan menggunakan
KH
2PO
4dan TSP (Ca(H
2PO
4)
2). Komposisi sumber nitrogen dan fosfor pada
berbagai konsentrasi disajikan pada Lampiran 2. Sumber dan konsentrasi
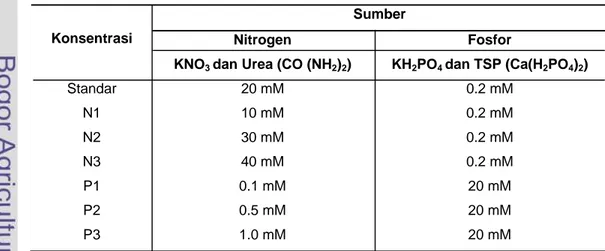
nitrogen dan fosfor disajikan pada Tabel 5.
Tabel 5 Sumber dan konsentrasi nitrogen dan fosfor
KonsentrasiSumber
Nitrogen Fosfor
KNO3 dan Urea (CO (NH2)2) KH2PO4 dan TSP (Ca(H2PO4)2)
Standar 20 mM 0.2 mM N1 10 mM 0.2 mM N2 30 mM 0.2 mM N3 40 mM 0.2 mM P1 0.1 mM 20 mM P2 0.5 mM 20 mM P3 1.0 mM 20 mM
3.3.4.2 Produksi Total Lipid
Setelah 30 hari masa inkubasi, biakan ganggang mikro kemudian diukur
produksi biomasa dan produksi total lipidnya dengan ketetapan biakan ganggang
mikro telah mencapai kerapatan sel (OD) 0.2 atau lebih pada akhir masa
inkubasi. OD diukur pada panjang gelombang (
λ
) 680 nm dengan
spektofotometer (Lee et al., 1998).
Pengukuran produksi total lipid dilakukan dengan proses ekstraksi.
Proses ekstraksi lipid ganggang mikro dilakukan dengan metode chemical
solvent oil extraction (Bligh dan Dyer, 1959),
yaitu dengan menggunakan
bahan kimia sebagai pelarut. Pelarut kimia yang digunakan adalah metanol dan
chloroform dengan tahapan : tabung ditimbang dan dicatat berat tabung reaksi
kosong; dimasukkan perlakuan ganggang, disentrifuse 3500 rpm selama 10
menit; dibuang supernatan lalu disimpan dalam oven selama 1 malam hingga
kering (80
0C); biomasa ganggang mikro yang telah kering ditambahkan dengan 4
ml aquadest bebas ion; ditambahkan metanol 10 ml dan chloroform sebanyak 5
ml; dishaker kembali selama 1 malam; kemudian ditambahkan kembali aquadest
bebas ion 5ml + 5 ml chloroform; sentrifuse 3500 rpm selama 10 menit; diambil
endapan lipid yang mengendap selanjutnya diletakkan di dalam tabung reaksi
dan dipanaskan untuk menghilangkan campuran larutan kimia yang ditambahkan
sebelumnya.
Perhitungan % total lipid ganggang mikro adalah:
Keterangan: Lw
= Berat Lipid (g)
Bw
= Berat biomasa (g)
3.3.4.3 Analisis Pengaruh Salinitas dan pH
Analisis pengaruh salinitas dan pH dilakukan untuk mengetahui kondisi
media biakan yang sesuai terhadap salinitas dan pH bagi pertumbuhan sel
ganggang mikro melalui pengukuran rapat optis (OD) yang diukur setelah 30
hari masa inkubasi. Masing-masing perlakuan di ulang 3x. Kombinasi perlakuan
faktorial 3 x 3 dari 3 taraf salinitas dan 3 taraf pH disajikan pada Tabel 6.
Lw
% Total lipid =
X 100
Bw
Tabel 6 Kombinasi perlakuan faktorial 3 x 3 dari tiga taraf salinitas dan tiga taraf
pH
Salinitas (mol/L) Nacl pH 5.0 (B1) 7.0 (B2) 9.0 (B3)0.2 (A1) A1B1 A1B2 A1B3
0.4 (A2) A2B1 A2B2 A2B3
0.6 (A3) A3B1 A3B2 A3B3