BAB I PENDAHULUAN
A. Latar Belakang Masalah
Perkembangan industri tekstil yang maju dan berkembang pesat, tentu saja akan diikuti
dengan bertambahnya limbah-limbah yang dihasilkan baik volume maupun jenisnya. Limbah
hasil industri yang sengaja dibuang ke alam menyebabkan alam semakin lama semakin
tercemar. Limbah industri banyak jenisnya tergantung pada bahan baku yang digunakan dalam
proses industri. Secara penampakan fisik air limbah industri tekstil terlihat keruh, berwarna,
panas dan berbusa. Kualitas limbah cair sangat tergantung pada jenis proses yang dilakukan.
Pada umumnya limbah cair bersifat basa dan mengandung bermacam-macam senyawa baik
organik maupun anorganik. Limbah cair tersebut terutama berasal dari cairan bekas proses
pewarnaan dan proses pencelupan serta proses-proses lain yang berhubungan dengan proses
tekstil industri. Cairan bekas pencelupan tersebut mengandung zat warna dan zat pengikat
warna. Dengan adanya bermacam-macam limbah maka diperlukan pemecahan tersendiri untuk
penurunan kadar limbah dalam lingkungan.
Pengolahan limbah zat warna menjadi sulit karena struktur aromatik pada zat warna
yang sulit dibiodegradasi, khususnya zat warna reaktif karena terbentuknya ikatan kovalen
yang kuat antara atom C dari zat warna dengan atom O, N atau S dari gugus hidroksi, amina
atau thiol dari polimer (Christie, 2001 : 135). Zat warna reaktif adalah zat warna yang dapat
mencelup serat selulosa dalam kondisi tertentu dan membentuk reaksi kovalen dengan serat
(Isminingsih, 1982). Pada tahun 1956 telah diperkenalkan zat warna reaktif yang pertama dan
dipasarkan dengan nama Procion, suatu zat warna golongan diklorotriazina, yang dapat
mencelup serat selulosa, zat warna reaktif juga mencelup serat-serat wol, sutera dan poliamida
buatan. Salah satu zat warna reaktif golongan diklorotriazina yang dipakai dalam industri
tekstil adalah Procion Red MX 8B.
Munculnya limbah zat warna reaktif yang berasal dari proses industri tekstil
menyebabkan lingkungan sekitar semakin tercemar sehingga perlu pengolahan lebih lanjut.
Beberapa macam perlakuan yang dilakukan untuk pengolahan air limbah yaitu proses filtrasi,
flokulasi, penghilangan warna (decoloring), dan adsorpsi. Proses adsorpsi dilakukan untuk
proses penyerapan senyawa yang mengganggu dalam analisis, pada umumnya digunakan
untuk proses pengolahan limbah. Beberapa penelitian tentang pengolahan limbah zat warna
X5B menggunakan tanah alofan teraktivasi NaOH. Aryunani (2003) telah meneliti adsorbsi zat
warna tekstil Remazol Yellow FG pada limbah batik menggunakan enceng gondok teraktivasi
NaOH. Joko (2003) telah meneliti pemanfaatan limbah genteng sebagai adsorben dengan
aktivator NaOH pada limbah zat warna tekstil jenis Celedon Red X5B. Rochanah (2003) telah
meneliti adsorbsi zat warna Procion Red MX 8B pada limbah tekstil oleh batang jagung.
Salah satu alternatif adsorben yang dikembangkan aplikasinya adalah kitosan. Kitosan
bisa diperoleh melalui deasetilasi kitin. Salah satu sumber kitin adalah cangkang bekicot.
Bekicot merupakan hewan lunak (mollusca) dari kelas gastropoda. Bekicot menurut jenisnya
dapat dibedakan menjadi empat yakni; Achatina variegata, Achatina fullica, Helix pomatia
dan Helix aspersa sedangkan dua jenis terakhir tidak ditemukan di Indonesia. Bekicot di
Indonesia telah dibudidayakan sebagai sumber protein dan menjadi komoditas ekspor. Ekspor
bekicot pada tahun 1983 baru mencapai 245.359 kg, sedangkan pada tahun 1987 ekspor
bekicot naik sekitar tujuh kali lipat menjadi 1.490.296 kg. Besarnya pertumbuhan perdagangan
ini menyebabkan timbulnya limbah cangkang bekicot dalam jumlah yang cukup besar. Limbah
cangkang bekicot banyak ditemukan di desa Minggiran kecamatan Papar kabupaten Kediri
sebagai daerah sentra eksport daging bekicot. Selama ini pemanfaatan cangkang bekicot hanya
digunakan sebagai campuran makanan ternak. Cangkang bekicot mengandung senyawa kitin.
Kitin dalam cangkang berikatan dengan protein, lipid, garam-garam anorganik seperti kalsium
karbonat serta pigmen-pigmen. Agar diperoleh produk yang bernilai ekonomis sekaligus dapat
mengatasi penumpukan limbah cangkang bekicot maka harus dilakukan isolasi kitin yang
terdapat pada cangkang bekicot.
Kitin merupakan senyawa karbohidrat yang termasuk dalam polisakarida, tersusun atas
monomer-monomer asetil glukosamin yang saling berikatan dengan ikatan 1,4 beta
membentuk suatu unit polimer linier yaitu beta-(1,4)-N-asetil-glukosamin (Pujiastuti, 2001:
3). Kitin merupakan bahan organik utama terdapat pada kelompok hewan seperti, crustaceae,
insekta, mollusca dan arthropoda. Kitin diperoleh dengan melakukan sejumlah proses
pemurnian. Proses isolasi kitin terdiri dari dua tahap utama yaitu deproteinasi dan
demineralisasi yang bertujuan menghilangkan protein dan mineral yang terkandung dalam
cangkang.
Kitin hasil deproteinasi dan demineralisasi dapat diubah menjadi kitosan melalui proses
deasetilasi. Tujuan proses deasetilasi adalah untuk menghilangkan gugus asetil dari kitin.
Kitosan (2-asetamida-deoksi--D-glukosa) memiliki gugus amina bebas yang menjadikan
pengolahan limbah dan obat-obatan hingga pengolahan makanan dan bioteknologi (Savant,
dan Torres, 2000). Biopolimer yang alami dan tidak beracun ini sekarang secara luas
diproduksi secara komersial dari limbah kulit udang dan kepiting (No, Lee, dan Mayers, 2000).
Beberapa penelitian tentang kitosan antara lain, Salami (1998) telah mempelajari aplikasi
kitosan dari bahan kulit udang (phenaus monodon) sebagai bahan koagulasi limbah cair
industri tekstil, Majid, Narsito dan Nuryono (2001) menggunakan kitosan dari bahan kulit
udang (phenaus monodon) sebagai adsorben logam. Kusumaningsih (2004) telah berhasil
mengisolasi kitin cangkang bekicot dengan rendemen sebesar 22,04% dan telah melakukan
deasetilasi kitin menjadi kitosan. Arief (2003) telah meneliti pembuatan kitosan dari kitin
cangkang bekicot dan pemanfaatannya sebagai adsorben logam nikel.
Salah satu turunan kitosan yang telah diteliti adalah kitosan-sulfat. Kitosan-sulfat
merupakan salah satu dari modifikasi atau turunan kitosan yang dibuat dengan cara
menempelkan anion sulfat (SO42-) pada gugus aktif kitosan (NH2). Konversi kitosan menjadi
kitosan-sulfat pada dasarnya adalah pengikatan elektrostatik anion sulfat pada gugus NH2 pada
kitosan menjadi NH3+SO42-. Ion sulfat merupakan donor elektron kuat sehingga dapat
memprotonasi NH2 dari kitosan dan membentuk ikatan NH3+ - SO42-. Hal ini dapat menambah
kereaktifan gugus aktif pada kitosan sehingga dapat meningkatkan kapasitas adsorpsi dari
kitosan (Mahatmanti, 2001).
Mahatmanti (2001) menggunakan kitosan dan kitosan-sulfat dari cangkang udang
windu (Phenaus monodon) sebagai adsorben ion logam seng(II) dan timbal(II) sementara
Darjito (2001) menggunakan kitosan-sulfat sebagai adsorben logam kobalt(II) dan
tembaga(II). Dalam penelitian Shofiyani dkk (2001) dilaporkan bahwa modifikasi kitosan
menjadi kitosan-sulfat mampu meningkatkan kapasitas maksimum dan laju adsorpsi ion
Cr(IV).
Pada penelitian sebelumnya, Rochanah (2003) telah meneliti adsorbsi zat warna Procion
Red MX 8B pada limbah tekstil oleh batang jagung, dengan pertimbangan bahwa zat warna
tekstil mengandung gugus yang dapat bereaksi dengan gugus hidroksil dari selulosa sehingga
memungkinkan zat warna tersebut dapat terikat pada bubuk batang jagung. Pada penelitian ini
dipilih kitosan sebagai adsorben dengan pertimbangan karena kitosan selain memiliki gugus
hidroksi juga memiliki gugus amino yang menyebabkan kitosan mempunyai reaktifitas yang
tinggi untuk berikatan dengan zat warna Procion Red MX 8B. Sedangkan modifikasi kitosan
Pada penelitian ini akan meneliti pemanfaatan kitosan dan kitosan-sulfat untuk adsorben
limbah zat warna industri tekstil, khususnya zat warna reaktif jenis Procion Red MX 8B yang
banyak ditemukan di daerah Surakarta dan sekitarnya.
B. Perumusan Masalah
1. Identifikasi Masalah
Kitin adalah biopolimer yang melimpah kedua di alam setelah selulosa. Kitin terdapat
pada jamur, cangkang anthropoda, crustaceae dan mollusca. Cangkang bekicot banyak
ditemukan di desa Minggiran kecamatan Papar kabupaten Kediri.Isolasi kitin dapat dilakukan
dengan metode No. Kitin dapat diubah menjadi kitosan dengan menghilangkan gugus
asetilnya. Kitosan-sulfat dibuat dengan penempelan anion sulfat (SO42-) yang berasal dari
ammonium sufat pada gugus aktif kitosan (NH2). Kitosan yang dihasilkan dari isolasi kitin
diketahui dengan melakukan karakterisasi yang meliputi kadar abu, kadar air, derajat
deasetilasi, berat molekul polimer yang terbentuk, dan analisis gugus fungsi kitosan.
Karakterisasi kitosan-sulfat yang dilakukan meliputi kadar air, kadar abu, dan penentuan
jumlah ion sulfat yang menempel, dan analisis gugus fungsi pada kitosan-sulfat.
Kitosan memiliki kemampuan untuk menyerap zat warna. Penyerapan zat warna
tersebut akan meningkat dengan mengubah kitosan menjadi kitosan-sulfat. Kemampuan
adsorpsi kitosan dan kitosan-sulfat terhadap zat warna Procion Red MX 8B dapat diketahui
dengan melakukan variasi pH larutan zat warna. Waktu kesetimbangan adsorpsi kitosan dan
kitosan sulfat terhadap zat warna Procion Red MX 8B dapat diketahui dengan melakukan
variasi waktu kontak, sedangkan isoterm adsorpsi yang terjadi dapat diketahui dengan
menvariasi konsentrasi zat warna Procion Red MX 8B. Desorpsi kitosan dan kitosan-sulfat
dilakukan untuk mengetahui seberapa besar kemampuan kitosan dan kitosan sulfat untuk
melepaskan kembali limbah zat warna Procion Red MX 8B yang sudah diserap.
2. Batasan Masalah
Berdasarkan identifikasi masalah yang telah disebutkan diatas maka batasan masalah
dalam penelitian ini adalah :
a. Sumber kitin berasal dari limbah cangkang bekicot dari Kediri, Jawa Timur.
b. Kitosan diubah menjadi kitosan sulfat dengan penempelan ion sulfat dari larutan
amonium sulfat 0,1 M.
c. Variasi pH larutan Procion Red MX 8B meliputi pH 1,5; 2; 3; 4; 5; 6; 7; 8; 9; 10; dan
d. Variasi waktu kontak meliputi 5, 10, 15, 20, 25, dan 30 menit.
e. Variasi konsentrasi zat warna meliputi: 15, 20, 25, 30, 35, 40, 45, dan 50 ppm pada pH
dan waktu kontak optimum.
f. Adsorpsi - desorpsi kitosan dan kitosan sulfat terhadap limbah zat warna Procion Red
MX 8B dilakukan pada kondisi optimum.
3. Rumusan Masalah
Dari batasan masalah yang telah disebutkan diatas maka rumusan masalah pada
penelitian ini adalah :
a. Apakah kitosan setelah diubah menjadi kitosan sulfat mampu meningkatkan kapasitas
adsorpsi terhadap zat warna Procion Red MX 8B?
b. Pada kondisi optimum berapa kitosan dan kitosan-sulfat mampu menyerap zat warna
Procion Red MX 8B?
c. Apakah jenis isoterm adsorpsi Procion Red MX 8B oleh kitosan dan kitosan sulfat pada
kondisi optimum?
d. Apakah adsorpsi larutan Procion Red MX 8B dan limbah zat warna oleh kitosan dan
kitosan-sulfat bersifat dapat dilepas kembali atau tidak dapat dilepas kembali ?
C. Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Mengetahui apakah kitosan setelah diubah menjadi kitosan sulfat mampu memberikan
peningkatan kapasitas adsorpsi terhadap limbah zat warna Procion Red MX 8B.
2. Mengetahui kondisi optimum adsorpsi larutan zat warna Procion Red MX 8B oleh
kitosan dan kitosan-sulfat.
3. Mengetahui jenis isoterm adsorpsi yang terjadi pada proses adsorpsi.
4. Mengetahui sifat adsorpsi Procion Red MX 8B oleh kitosan dan kitosan sulfat.
D. Manfaat Penelitian
Manfaat dari penelitian ini adalah :
1. Meningkatkan pemanfaatan limbah cangkang bekicot.
2. Memberikan alternatif cara pengolahan limbah zat cair khususnya yang mengandung
zat warna reaktif.
4. Memberikan informasi tentang karakteristik kitosan dan kitosan-sulfat dari cangkang
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Bekicot
Bekicot merupakan golongan hewan lunak (mollusca) yang termasuk dalam kelas
gastropoda. Badannya lunak dan dilindungi oleh cangkang yang keras. Jenis hewan ini
tersebar di laut, air tawar dan daratan yang lembab.
Bekicot berhabitat di tempat-tempat yang lembab terutama di sekitar tumbuh-tumbuhan
sebagai tempat berlindung pada siang hari. Di beberapa wilayah di Eropa, Asia dan Afrika,
bekicot dijadikan sebagai makanan, yang dikenal sebagai escargot di Perancis dan caracois di
Portugal. Spesies bekicot yang banyak terdapat di Eropa adalah Helix pomatia yang disebut
Burgundy snail dan Helix aspersa yang disebut European brown garden snail. Spesies yang
banyak tersebar di Afrika dan Asia, khususnya Indonesia adalah Achatina fullica. Klasifikasi
bekicot sebagai berikut:
- Divisio : Mollusca
- Kelas : Gastropoda
- Ordo : Pulmonata
- Familia : Achatinidae
- Genus : Achatina
- Spesies : Achatina Fullica
Bekicot banyak dimanfaatkan untuk makanan manusia sebagai sumber protein (dikenal
sebagai escargot ) di Eropa, Asia dan Afrika karena mengandung banyak daging dan
mengandung banyak asam amino esensial. Bekicot juga sudah menjadi komoditas ekspor.
Ekspor bekicot pada tahun 1983 baru mencapai 245.359 kg, pada tahun1987 ekspor bekicot
naik sekitar tujuh kali lipat menjadi 1.490.296 kg (Santoso, 1989: 12-13). Besarnya manfaat
dan pertumbuhan perdagangan ini menyebabkan timbulnya limbah cangkang bekicot dalam
jumlah yang cukup besar. Limbah cangkang bekicot banyak ditemukan kabupaten Kediri.
Selain dapat dimanfaatkan untuk makanan tambahan bagi ternak seperti itik dan ayam, bekicot
juga banyak dipakai untuk obat tradisional. Daging dan lendirnya mujarab untuk pengobatan
abortus, sakit saat menstruasi, gatal-gatal, jantung, sakit gigi, dan radang selaput mata.
mengobati kekejangan, jantung berdebar, insomania, keputihan dan leher bengkak (Prihatman
K., 2000).
Peningkatan ekspor dan juga banyaknya industri pengolahan bekicot menyebabkan
banyaknya limbah cangkang bekicot yang dihasilkan. Selama ini limbah tersebut belum
dimanfaatkan, biasanya hanya dibuang begitu saja atau dimanfaatkan sebagai campuran
makanan ternak.
2. Kitin
Kitin adalah senyawa karbohidrat yang termasuk dalam polisakarida, tersusun atas
monomer-monomer asetil glukosamin yang saling berikatan dengan ikatan 1,4 beta
membentuk suatu unit polimer linier yaitu beta-(1,4)-2-asetamido-2-deoksi-D-glukosa atau
beta-(1,4)-N-asetil glukosamin. Analisis dengan sinar x mengindikasikan bahwa struktur kitin
mirip dengan selulosa. Perbedaan kitin dan selulosa terletak pada adanya gugus 2-asetil amino
pada unit glukosa (Pujiastuti, 2001). Analisis dengan Spektroskopi Infra Merah menunjukkan
adanya serapan pada 1671 cm-1 yang merupakan serapan dari gugus amina terasetilasi
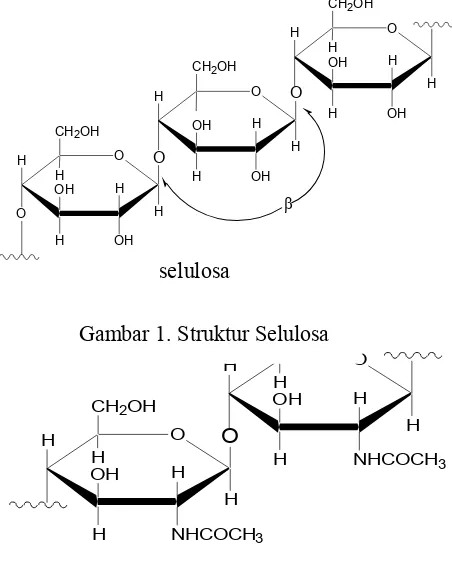
(Saraswathy, Pal, Rose and Sastry, 2001). Struktur selulosa dan kitin adalah sebagai berikut:
Struktur kitin tersusun atas 2000-3000 satuan monomer N-asetil D-glukosamin yang
saling berikatan melalui 1,4-glikosidik. Satu diantara enam monosakarida yang menyusun
rantai kitin adalah glukosamin (Suhardi, 1993: 15).
Kitin merupakan bahan organik utama terdapat pada kelompok hewan seperti,
crustaceae, insekta, mollusca dan arthropoda. Dalam cangkang udang yang termasuk
kelompok crustaceae, kitin berikatan dengan protein, garam-garam anorganik seperti kalsium
karbonat dan lipid termasuk pigmen-pigmen. Stephen (1995: 454) menyebutkan kulit kepiting
terdapat 60% kitin, sedangkan dalam lidah, rahang ataupun contoh yang lainnya dari kelas
gastropoda terdapat 20% kandungan kitin. Kitin juga diketahui terdapat pada kulit keong,
kepiting, kerang dan escargot (Stephen, 1995: 454) yaitu suatu masakan dari bahan bekicot.
Bahan-bahan berkitin terutama berada di bagian ektodermal dalam binatang multiseluler dan
membentuk eksoskeleton yang spesifik dari kebanyakan binatang tidak bertulang belakang.
Tidak ada bukti adanya hubungan antara proporsi kitin dengan derajat kalsifikasi, kekerasan
atau fleksibilitas bahan (Suhardi, 1993: 15). Kitin diperoleh dengan melakukan sejumlah
proses pemurnian. Proses isolasi kitin terdiri dari dua tahap utama, yaitu deproteinasi dan
demineralisasi. Deproteinasi betujuan untuk menghilangkan protein yang terdapat pada
cangkang. Tahap ini dilakukan dengan menambahkan NaOH pada konsentrasi rendah
sehingga terbentuk Na-proteanat yang larut dalam air. Tahap demineralisasi dilakukan untuk
memurnikan kitin dari mineral-mineral yang terkandung dalam cangkang. Tahap ini dilakukan
dengan menambahkan HCl encer. Menurut Beaulieu (2005) protein dihilangkan dengan
menambahkan NaOH (1-10%) pada suhu (85-100ºC), sedangkan demineralisasi dilakukan
dengan menambahkan HCl (1-10%) pada suhu kamar.
Kitin merupakan sumber daya yang dapat diperbaharui dan banyak dipakai untuk
pengolahan limbah, kosmetik dan obat-obatan. Kitin tidak beracun, dapat dibiodegradasi,
tidak larut dalam air dan alkali, larut dalam asam mineral kuat dan asam formiat anhidrid. Kitin
dapat membentuk kompleks dengan ion logam transisi dan dapat menyerap zat warna terutama
dengan mekanisme pertukaran ion. Kitin juga dapat dimanfaatkan untuk agen chelat yang
banyak dipakai untuk pengolahan air minum dengan memisahkan senyawa organik dan logam
berat (Lee, V.R., 2002).
Kitin memiliki gugus hidroksil dan amina primer yang reaktif. Saat pemanasan, kitin
cenderung untuk terdekomposisi daripada meleleh sehingga polimer ini tidak memiliki titik
leleh. Kitin berbentuk kristal, mudah terdegradasi secara biologis, tidak larut dalam air, larutan
larutan asam-asam pekat seperti HCl, H2SO4, HNO3 dan HCOOH anhidrat. (Bastaman, 1989
dalam Darjito 2001).
3. Kitosan
Kitosan adalah kitin yang telah dihilangkan gugus asetilnya melalui proses deasetilasi.
Proses deasetilasi kitin diperoleh kitosan yang memenuhi syarat bila waktu yang diperlukan
selama 90-120 menit, dimana pada waktu 90 menit sampai dengan 120 menit diperoleh kitosan
dengan kondisi setengah gel sampai dengan bentuk gel dalam larutan air (Nasution dan
Citorekso, 1999). Kitosan terbentuk saat kitin ditambahkan NaOH (>40%) pada suhu tinggi
(90-120ºC) (Beaulieu, 2005). Kitosan merupakan suatu senyawa polimer dari glukosamina
pada ikatan beta-1,4 atau polimer dari 2-amino-2-deoksi-D-glukosa. Kitosan adalah kitin yang
terdeasetilasi sebanyak mungkin, tetapi tidak cukup sempurna untuk dinamakan poli
glukosamin (Bastaman 1989 dalam Darjito 2001). Struktur kitosan dapat dilihat pada Gambar
3.
Kebanyakan mutu kitosan komersil mengandung 75-95 % glukosamin dan 5-25 % unit
N-asetilglukosamin (Stephen, 1995: 442). Menurut Pujiastuti (2001), derajat deasetilasi kitin
terhadap kitosan biasanya berkisar antara 70-100% tergantung penggunaannya. Spesifikasi
kitosan untuk kualitas teknis mempunyai derajat deasetilasi sekitar 85%, untuk kualitas
makanan derajat deasetilasinya sekitar 90%, sedangkan untuk kitosan berkualitas farmasetis
derajat deasetilasinya sekitar 95% (Pujiastuti, 2001). Derajat deasetilasi menentukan muatan
Kitosan
gugus amino bebas dalam polisakarida serta digunakan dalam membedakan antara kitin dan
kitosan (Khan, Peh dan Hung, 2002). Semakin tinggi derajat deasetilasi maka kualitas kitosan
semakin baik.
Biopolimer yang alami dan tidak beracun ini sekarang secara luas diproduksi secara
komersial dari limbah kulit udang dan kepiting (No, Lee, dan Mayers, 2000). Penelitian kitosan
sebagai adsorben telah banyak dilakukan dan kesemuanya menunjukkan karakteristik sifat
pada : (1) kemampuannya yang cukup tinggi dalam mengikat ion logam, (2) kemungkinan
pengambilan kembali yang relatif mudah terhadap ion logam yang terikat pada kitosan dengan
menggunakan pelarut tertentu (Muzzarelli, 1997 dalam Darjito, 2001).
Kitosan bersifat hidrofil yang lebih tinggi dari pada kitin (Salami, 1998). Kitosan
memiliki gugus-gugus amino dan hidroksil yang terikat, adanya gugus-gugus tersebut
menyebabkan kitosan mempunyai reaktifitas yang tinggi. Ketika kitosan dilarutkan kedalam
campuran asam berair, proporsi dari amina primer pada molekul kitosan menjadi terprotonasi
dan memperoleh muatan positif, karena itu molekul kitosan yang terlarut adalah polikationik.
Kitosan tidak larut dalam pelarut alkali, karena pengaruh gugus amina (Kim, Cho and Lee,
2000).
Kitosan dengan sifat penukar ionnya dapat membentuk komplek dengan barbagai logam
transisi, hal ini melibatkan donasi pasangan elektron bebas dari nitrogen dan atau oksigen dari
gugus hidroksil kepada ion logam berat. Tingkat dari formasi dan stabilitas dari komplek
sangat tergantung pada konsentrasi ion logam berat yang bersaing, temperatur, pH larutan,
ukuran partikel, kristalitas dan derajat deasetilasi dari kitosan (Stephen, 1995: 446). Kitosan
dengan sifatnya yang polikationik juga dapat berikatan dengan zat warna. Hal ini dikarenakan
dalam keadaan terprotonasi, gugus amina pada kitosan dapat berikatan dengan gugus sulfonat
dari zat warna (Sakkayawong, et.al., 2005)
Kitosan dengan sifatnya yang non toksik, digunakan dalam berbagai bidang seperti
agrikultur, penjernihan dan pemurnian air dan minuman. Kitosan juga digunakan dalam bidang
farmasi, imobilisasi sel dan enzim, kosmetik (Stephen, 1995: 450-451). Pemanfaatan kitosan
untuk pemurnian air telah dilakukan selama lebih dari tiga puluh tahun. Dengan menyebarkan
kitosan ke permukaan air yang tercemar, zat-zat pencemar (minyak, logam berat dan
makromolekul lain) akan diserap oleh kitosan (Kusumawati, 2006).
4. Kitosan Sulfat
Kitosan sulfat merupakan salah satu dari modifikasi atau turunan kitosan yang dibuat
menjadi kitosan sulfat pada dasarnya adalah pengikatan elektrostatik anion sulfat pada gugus
NH2 pada kitosan menjadi NH3+SO42-. Ion sulfat merupakan donor elektron kuat sehingga
dapat memprotonasi NH2 dari kitosan dan membentuk ikatan NH3+ - SO42-. Hal ini dapat
menambah kereaktifan gugus aktif pada kitosan sehingga dapat meningkatkan kapasitas
adsorpsi dari kitosan (Mahatmanti, 2001).
Dengan terbentuknya kompleks amin -NH3+ - SO42- maka dimungkinkan terjadi
perubahan mekanisme adsorpsi dari mekanisme pembentukan kompleks menjadi pertukaran
ion. Kemungkinan reaksi yang terjadi dalam suasana asam adalah sebagai berikut :
R-NH2 + H+ R-NH3+ ………...(1)
R- NH3+ + (NH4)2SO4 R-NH3+SO42- + 2 NH4+……….(2)
(Mahatmanti, 2001)
Darjito (2001), Cahyaningrum (2001), dan Mahatmanti (2001) telah menggunakan
kitosan sulfat sebagai adsorben logam. Penelitian-penelitian tersebut menunjukkan bahwa
kapasitas adsorpsi kitosan sulfat terhadap ion logam lebih tinggi dibandingkan dengan kitosan.
Dari hasil penelitian tersebut juga dapat disimpulkan bahwa ion sulfat yang terimpregnasi akan
lebih stabil bila berasal dari larutan ammonium sulfat 0,1 M dan kapasitas adsorpsi kitosan
sulfat yang dihasilkan paling tinggi.
Karakterisasi kitosan sulfat dapat dilakukan dengan spektroskopi IR untuk analisa gugus
fungsi, penentuan derajat deasetilasi dan analisis turbidimetri untuk mengetahui banyaknya ion
sulfat yang dapat terikat pada kitosan (Mahatmanti, 2001).
5. Derajat Deasetilasi
Kitosan dibuat dengan melakukan deasetilasi pada kitin, sehingga istilah derajat
deasetilasi digunakan untuk mengkarakterisasi kitosan. Nilai derajat deasetilasi
menggambarkan proporsi unit monomer yang telah dihilangkan gugus asetilnya, dan
mengindikasikan proporsi gugus amina bebas pada kitosan. Derajat deasetilasi kitosan berkisar
70-100% tergantung pada metode pembuatannya. (Beaulieu, 2005).
Derajat deasetilasi tergantung pada metode pemurnian dan kondisi reaksi. Metode yang
dapat dipakai untuk penentuan derajat deasetilasi antara lain ninhydrin tes, titrasi potensiometri
linier, spektroskopi inframerah dekat, titrasi hydrogen bromida, spektroskopi NMR,
Pengukuran dengan spektroskopi IR menggunakan range frekuensi 4000 – 400 cm-1.
Penghitungan derajat deasetilasi (DD) kitosan menggunakan baseline yang dikemukakan
Baxter dengan persamaan sebagai berikut :
Baseline oleh Baxter et. al.
DD = 100-[(A1655/A3450) X 115]
Dengan menghitung (A1655) amida = Log 10 (DF2 / DE) dan
(A3450) hidroksil = Log 10 (AC / AB)
Dimana :
(A1655) amida = absorbansi pada 1655 cm –1 pada pita amida.
Diartikan sebagai muatan N-asetil.
(A3450) hidroksil = absorbansi pada 3450 cm –1 pada pita hidroksil.
Diartikan sebagai standar internal untuk mengkoreksi ketebalan film atau perbedaan
konsentrasi kitosan dalam bentuk bubuk.
DF2, DE = tinggi absolut pita absorbansi dari gugus fungsi pada masing-masing panjang
gelombangnya.
Pemilihan garis dasar metode base line dapat dilihat pada Gambar 3.
6. Zat Warna Procion Red MX 8B
Zat warna reaktif pertama kali diproduksi tahun 1956. Zat warna jenis ini pada
aplikasinya akan sulit dihilangkan karena adanya ikatan kovalen yang kuat antara atom karbon
dari zat warna dengan atom O, N, atau S dari gugus hidroksi, amino atau thiol dari polimer.
Zat warna reaktif mempunyai berat molekul yang relatif kecil. Keuntungan zat warna reaktif
adalah spektra absorpsinya runcing dan jelas, strukturnya relatif sederhana, dan warnanya lebih
terang (Hunger K, 2003).
Zat warna reaktif adalah suatu zat warna yang dapat mengadakan reaksi dengan serat,
sehingga zat warna tersebut merupakan bagian dari serat. Oleh karena itu hasil celupan zat
warna reaktif mempunyai ketahanan cuci yang sangat baik (Djufri, 1976). Zat warna reaktif
yang sering digunakan pada industri batik antara lain Procion, Cibracon, Drimaren, dan
Lavafix, yang dapat mengadakan reaksi substitusi dengan serat dan membentuk ikatan ester,
dan zat warna Remazol, Remalan, dan Primazin, yang dapat mengadakan reaksi adisi dengan
serat dan membentuk ikatan eter.
Menurut pemakaiannya zat warna reaktif dapat pula dibagi menjadi :
1. Pemakaian secara dingin, yaitu zat warna reaktif yang mempunyai kereaktifan tinggi,
misalnya Procion M dengan sistem dikloro triazin.
2. Pemakaian secara panas, yaitu zat warna reaktif yang mempunyai kereaktifan rendah,
misalnya Procion H, Cibacron dengan sistem reaktif monokhloro- triazin, Remazol dengan
sistem reaktif vinil sulfon.
Pada tahun 1940 telah mulai dipelajari sifat zat warna triazin atau yang mengandung
klorida sianurat seperti yang ditunjukkan pada Gambar 5.
Gambar 5. Klorida Sianurat.
Dengan senyawa diatas ada kemungkinan untuk mengganti gugusan klorida dengan satu,
dua, atau tiga senyawa yang mengandung gugus hidroksil atau amino yang bergabung pada
molekul zat warna (Isminingsih, 1982). Adapun struktur kimia zat warna ditunjukkan pada
Gambar 6.
Zat warna procion dibuat dari senyawa zat warna mengandung gugusan amina dalam
suatu kondensasi dengan klorida sianurat, dengan reaksi sebagai berikut :
Gambar 7. Reaksi Pembuatan Zat Warna Procion
Gugus-gugus reaktif merupakan bagian dari zat warna dan mudah lepas, sehingga bagian
zat yang berwarna mudah bereaksi dengan serat. Pada umumnya agar supaya reaksi dapat
berjalan dengan baik maka diperlukan penambahan alkali atau asam sehingga mencapai suatu
pH tertentu (Rasjid D., 1976).
Pada kondisi asam, kitosan dapat berikatan dengan zat warna. Menurut Sakkayawong et.
al. (2005), hal ini dikarenakan dibawah kondisi asam atom-atom hidrogen (H+) pada larutan
dapat memprotonasi gugus amina (-NH2) dari kitosan seperti ditunjukkan pada reaksi (1).
R′-NH2 + H+ R′-NH3+ (1)
Dalam larutan encer, zat warna akan terlarut dan gugus sulfonat pada zat warna Procion Red
MX 8B terdissosiasi dan berubah menjadi ion-ionnya. Reaksinya ditunjukkan pada reaksi (2).
DSO3Na DSO3- + Na+ (2)
Proses adsorpsi kemudian dihasilkan dari interaksi elektrostatik antara dua ion tersebut seperti
ditunjukkan pada reaksi (3).
R′-NH3+ + DSO3- R′-NH3+-O3SD (3)
Menurut Isminingsih (1982), zat warna reaktif Procion Red MX 8B dapat mewarnai serat
selulosa dalam kondisi asam dan membentuk ikatan hidrogen dengan selulosa. Kemungkinan
reaksi yang terjadi adalah sebagai berikut :
Gambar 8. Reaksi antara Procion Red MX 8B dan Selulosa pada Kondisi Asam
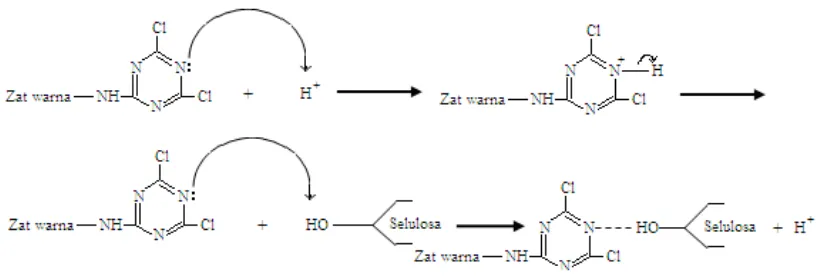
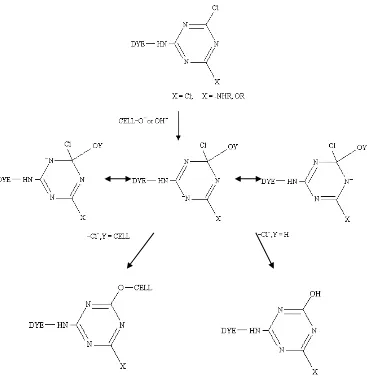
Christie (2001) dan Sakkayawong et. al. (2005) menyebutkan bahwa pada proses
pewarnaan, gugus hidroksi dari selulosa (HO–selulosa) terdeprotonasi pada kondisi basa
menjadi ion selulosa (¯O–selulosa) yang kemudian berikatan kovalen dengan zat warna.
Disamping terjadi reaksi antara zat warna dan serat dengan membentuk ikatan primer kovalen
yang merupakan ikatan ester atau eter, molekul airpun dapat juga mengadakan reaksi hidrolisa
dengan molekul zat warna, dengan memberikan komponen zat warna yang tidak reaktif lagi
Gambar 9. Reaksi antara Zat Warna dan Selulosa pada Kondisi Basa (Christie, 2001)
Struktur kimia dari Procion Red MX 8B dapat dilihat pada Gambar 10.
Gambar 10. Struktur Procion Red MX 8B (Isminingsih, 1982)
Atom-atom di dalam suatu molekul tidak diam melainkan bervibrasi (bergetar). Ikatan
kimia yang menghubungkan dua atom dapat dimisalkan sebagai dua bola yang dihubungkan
oleh suatu pegas.
Bila radiasi infra merah dilewatkan melalui suatu cuplikan, maka molekul-molekulnya
dapat menyerap energi dan terjadilah transisi di antara tingkat vibrasi dasar (ground state) dan
tingkat tereksitasi (exited state).
Daerah dimana vibrasi terjadi dapat diperkirakan berdasarkan hukum Hooke sebagai
berikut:
dalam setiap adsorpsi, gugus fungsional untuk suatu molekul tampak pada daerah-daerah yang
agak spesifik, seperti misalnya ikatan C-C, C-N, dan CO biasanya terletak pada daerah
800-1300 cm-1 , sementara ikatan C=C, C=N, dan C=O biasanya terlatak pada daerah 1500-1900
cm-1. Beberapa harga kira-kira absorbansiinfra merah ditunjukkan pada Tabel 1.
Tabel 1. Harga kira-kira Absorbansi Infra Merah
No Ikatan Daerah absorbansi (cm-1)
Daerah antara 1400-4000 cm-1 pada spektra disebut sebagai daerah infra merah. Daerah
sebelah kiri 1400 cm-1 menunjukkan absorpsi oleh modus uluran yang berguna untuk
identifikasi gugus fungsional. Daerah spektra sebelah kanan 1400 cm-1 terjadi karena adanya
modus uluran dan tekukan sehingga gugus fungsional sulit diamati, disebut sebagai daerah
sidik jari (fingerprint). (Pudjaatmaka, 1986).
8. Spektroskopi UV-Vis
Pada spektrometer UV, sinar kontinyu dihasilkan oleh lampu awan muatan hidrogen atau
deuterium (D2), sedangkan sinar Visibel dihasilkan oleh lampu Wolfram. Panjang gelombang
cahaya UV-Vis jauh lebih pendek daripada panjang gelombang radiasi IR. Panjang gelombang
UV-Vis berada pada kisaran 180-800 nm.
Prinsip dasar spektroskopi UV-Vis adalah terjadinya transisi elektronik yang disebabkan
penyerapan sinar UV-Vis yang mampu mengeksitasi elektron dari orbital yang kosong.
Umumnya, transisi yang paling mungkin adalah transisi pada tingkat energi tertinggi (HOMO)
ke orbital molekul yang kosong pada tingkat terendah (LUMO). Pada sebagian besar molekul,
orbital molekul terisi pada tingkat energi terendah adalah orbital yang berhubungan dengan
ikatan , sedangkan orbital berada pada tingkat energi lebih tinggi. Orbital non ikatan (n)
yang mengandung elektron-elektron yang belum berpasangan berada pada tingkat energi yang
lebih tinggi lagi, sedangkan orbital-orbital anti ikatan yang kosong yaitu * dan * menempati
tingkat energi yang tertinggi (Pavia, et. al., 2001).
Absorpsi cahaya UV-Vis mengakibatkan transisi elektronik, yaitu promosi
elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital dasar yang berenergi
tinggi. Transisi ini memerlukan 40-300 kkal/mol. Panjang gelombang UV-Vis bergantung
pada mudahnya promosi elektron. Molekul-molekul yang memerlukan lebih banyak energi
untuk promosi elektron akan menyerap pada panjang gelombang yang lebih pendek. Molekul
yang memerlukan energi lebih sedikit akan menyerap pada panjang gelombang yang lebih
panjang. Senyawa yang menyerap cahaya pada daerah tampak (yaitu senyawa yang berwarna)
mempunyai elektron yang lebih mudah dipromosikan daripada senyawa yang menyerap pada
panjang gelombang UV yang lebih pendek.
Serapan dinyatakan dengan nilai intensitas absorbsi pada panjang gelombang maksimal.
Absortivitas molar diperoleh dari turunan hukum Lambert-Beer dengan persamaaan sebagai
berikut :
A = .b. c
Dimana A = intensitas absorbsi
= koefisien absortivitas molar
b = tebal lintasan
9.Adsorpsi
Adsorpsi adalah suatu peristiwa fisik yang terjadi pada permukaan suatu padatan.
Adsorpsi terjadi jika gaya tarik menarik antara zat terlarut dengan permukaan penyerap dapat
mengatasi gaya tarik menarik antara pelarut dengan permukaan penyerap (Oscik, 1982). Zat
atau molekul yang terserap ke permukaan disebut adsorbat sedangkan zat atau molekul yang
menyerap disebut adsorben (Sukardjo, 1985).
Jenis adsorpsi yang umum dikenal adalah adsorpsi kimia (kemisorpsi) dan adsorpsi
fisika (fisisorpsi).
a. Adsorpsi Kimia (Kemisorpsi)
Adsorpsi kimia terjadi karena adanya gaya-gaya kimia dan diikuti oleh reaksi kimia.
Pada adsorpsi kimia hanya satu lapisan gaya yang terjadi. Besarnya energi adsorpsi kimia
sekitar 100 kj/mol. Adsorpsi jenis ini menyebabkan terbentuknya ikatan secara kimia sehingga
diikuti dengan reaksi kimia, maka adsorpsi jenis ini akan menghasilkan produksi reaksi berupa
senyawa yang baru. Ikatan kimia yang terjadi pada kemisorpsi sangat kuat mengikat molekul
gas atau cairan dengan permukaan padatan sehingga sangat sulit untuk dilepaskan
kembali. Artinya pelepasan kembali molekul yang terikat di adsorben pada kemisorpsi sangat
kecil (Alberty, 1997).
b. Adsorpsi Fisika (Fisisorpsi)
Adsorpsi fisika terjadi karena adanya gaya-gaya fisika. Pada jenis adsorpsi fisika ini,
terjadi beberapa lapisan gas. Besarnya energi adsorpsi fisika sekitar 10 kj/mol.
Molekul-molekul yang diadsorpsi secara fisika tidak terikat kuat pada permukaan, dan biasanya terjadi
proses balik yang cepat, sehingga mudah untuk diganti dengan molekul yang lain. Adsorpsi
fisika didasarkan pada gaya Van Der Waals, dan dapat terjadi pada permukaan yang polar dan
non polar. Adsorpsi juga mungkin terjadi dengan mekanisme pertukaran ion. Permukaan
padatan dapat mengadsorpsi ion-ion dari larutan dengan mekanisme pertukaran ion. Karena
itu ion pada gugus senyawa permukaan padatan adsorbennya dapat bertukar tempat dengan
ion-ion adsorbat. Mekanisme pertukaran ini merupakan penggabungan dari mekanisme
kemisorpsi dan fisisorpsi, karena adsorpsi jenis ini akan mengikat ion-ion yang diadsorpsi
dengan ikatan secara kimia, tetapi ikatan ini mudah dilepas kembali untuk dapat terjadinya
pertukaran ion (Atkin, 1990).
Isoterm adsorpsi adalah adsorpsi yang menggambarkan hubungan antara zat yang
teradsopsi oleh adsorben dengan tekanan atau konsentrasi pada keadaan kesetimbangan dan
temperatur tetap (Barrow, 1988; Alberty dan Daniel, 1983). Ada beberapa jenis isoterm
1. Isoterm Adsorpsi Langmuir
Isoterm adsorpsi langmuir dapat diturunkan secara teoritis dengan menganggap
bahwa hanya sebuah adsorpsi tunggal yang terjadi. Adsorpsi tersebut terlokalisasi,
artinya molekul-molekul zat hanya dapat diserap pada tempat-tempat tertentu dan
panas adsorpsi tidak tergantung pada permukaan yang tertutup oleh adsorben. Isoterm
adsorpsi langmuir digunakan untuk menggambarkan adsorpsi kimia (Alberty, 1997).
Persamaan isoterm adsorpsi langmuir yang merupakan jenis adsorpsi monolayer
dapat dijelaskan sebagai berikut :
dimana : m = massa yang teradsorpsi
b = kapasitas adsorpsi (mg/g)
p = konsentrasi akhir larutan (mg/L)
K = konstanta kesetimbangan adsorpsi
Dengan membuat plot antara 1/m terhadap 1/p maka harga konstanta K dan d dapat
dihitung dari slope dan intercept grafik.
2. Isoterm Adsorpsi Freundlich
Isoterm adsorpsi freundlich menggambarakan adsorpsi yang terjadi pada
beberapa lapis dan ikatannya tidak kuat.
Dengan persamaan Barrow (1988) Jika persamaan Barrow dilogaritmakan akan terbentuk persamaan :
log m = log k +
n
1
log C
dimana : m = berat adsorben (g)
C = konsentrasi sebelum teradsorpsi (mg/L)
K dan n adalah konstanta (Castellan, 1983)
Faktor-faktor yang mempengaruhi adsorpsi adalah (Pohan dan Tjiptahadi, 1987):
1). Karakteristik fisika dan kimia dari adsorben antara lain luas permukaan, ukuran pori dan
komposisi kimia.
2). Karakteristik kimia dan fisika dari adsorbat antara lain luas permukaan, polaritas molekul,
dan komposisi kimia.
4). Karakteristik fasa cair antara lain: pH dan temperatur.
5). Sistem waktu adsorpsi.
B. Kerangka Pemikiran
Kitin adalah bahan utama penyusun eksoskeleton invertebrata. Invertebrata yang banyak
mengandung kitin adalah berasal dari kelompok crustaceae, insekta, fungi, mollusca dan
arthropoda. Beberapa bahan yang sering dimanfaatkan sebagai sumber kitin adalah cangkang
udang dan cangkang kepiting. Bahan lain yang dapat dimanfaatkan sebagai sumber kitin
adalah cangkang bekicot yang merupakan kelompok hewan lunak (mollusca).
Kitin yang berasal dari cangkang bekicot dapat diubah menjadi kitosan melalui proses
deasetilasi. Deasetilasi merupakan proses peghilangan gugus asetil dari kitin. Kitosan memiliki
gugus amina bebas dan hidroksil yang menyebabkan kitosan mempunyai reaktifitas yang
tinggi. Dengan adanya gugus amina bebas tersebut, kitosan dapat digunakan sebagai adsorben
zat warna.
Ion sulfat merupakan donor elektron kuat sehingga dapat memprotonasi gugus amina
dari kitosan membentuk ikatan NH3+ - SO42-. Kapasitas adsorpsi kitosan dapat ditingkatkan
dengan cara mengubah kitosan menjadi kitosan sulfat dengan penempelan ion sulfat dari
larutan amonium sulfat.
Adsorpsi zat warna Procion Red MX 8B oleh kitosan dan kitosan sulfat dipengaruhi oleh
kondisi proses adsorpsi, antara lain pH awal larutan dan waktu kontak. Proses adsorpsi zat
warna Procion Red MX 8B oleh kitosan dan kitosan sulfat dilakukan pada pH asam dan pH
basa karena pada pH asam atom-atom hidrogen (H+) pada larutan dapat memprotonasi gugus
amina (-NH2) dari kitosan dan kitosan sulfat. Pada kondisi asam, gugus reaktif kitosan sulfat
yang telah terprotonasi permanent akan lebih stabil sehingga hasil adsorpsi lebih maksimal.
Sedangkan pada pH basa, gugus hidroksil dari kitosan dan kitosan sulfat menyerang gugus
klorida dari zat warna dan berikatan kovalen dengan zat warna.
Adsorpsi zat warna Procion Red MX 8B oleh kitosan dan kitosan sulfat selain
dipengaruhi oleh pH awal larutan juga dipengaruhi oleh lamanya waktu kontak dan konsentrasi
larutan. Variasi pH dan waktu kontak dilakukan untuk mengetahui kondisi optimum adsorpsi,
sedangkan variasi konsentrasi dilakukan untuk mengetahui jenis isoterm adsorpsi. Desorpsi
kitosan dan kitosan sulfat dengan akuades dilakukan pada kondisi optimum dan dapat dipakai
Kemungkinan isoterm adsorpsi antara zat warna Procion Red MX 8B dengan kitosan dan
kitosan sufat adalah isoterm Langmuir karena dimungkinkan terjadi ikatan kimia antara zat
warna dengan gugus aktif pada kitosan dan kitosan sulfat.
C. Hipotesis
Berdasarkan kerangka pemikiran tersebut maka dapat diajukan hipotesa sebagai
berikut:
1. Pengubahan kitosan menjadi kitosan-sulfat mampu meningkatkan kapasitas adsorpsi
terhadap limbah zat warna Procion Red MX 8B.
2. pH optimum adsorpsi zat warna Procion Red MX 8B oleh kitosan dan kitosan sulfat
terjadi pada pH asam.
3. Isoterm adsorpsi Langmuir akan terjadi pada proses adsorpsi.
4. Interaksi kimia antara Procion Red MX 8B dengan kitosan dan kitosan-sulfat akan