BAB I PENDAHULUAN A.Latar Belakang Masalah
Minyak goreng merupakan salah satu kebutuhan pokok manusia sebagai
bahan dasar yang penting dalam proses penggorengan dengan fungsi sebagai
medium penghantar panas, penambah rasa gurih, menambah nilai gizi, dan kalor
bahan pangan. Minyak goreng dapat diproduksi dari berbagai macam bahan
mentah, misalnya kedelai, biji kapas, kacang tanah, rape seed, bunga matahari,
kelapa, dan zaitun (olive) (Buckle, et al, 1987).
Minyak goreng yang telah dimurnikan dapat mengalami kerusakan akibat
adanya proses oksidasi, proses ini dapat menyebabkan terjadinya bau dan rasa
tengik pada minyak goreng tersebut. Kemungkinan yang lebih besar dapat terjadi
pada minyak goreng krengseng yang memiliki kualitas lebih rendah dibandingkan
minyak goreng murni.
Ketengikan yang terjadi disertai bau tidak sedap tersebut disebabkan oleh
adanya oksigen yang menyebabkan proses oksidasi dan pembentukan
senyawa-senyawa hasil pemecahan hidroperoksida (hidrolisis). Kerusakan lemak yang
ditandai dengan bau tengik ini disebut dengan proses ketengikan (rancidity). Proses
ketengikan sangat dipengaruhi oleh adanya prooksidan dan antioksidan. Prooksidan
akan mempercepat terjadinya oksidasi, sedangkan antioksidan akan menghambat
proses oksidasi.
Antioksidan dapat menghambat atau mencegah kerusakan lemak atau bahan
pangan berlemak akibat proses oksidasi (Ketaren, 1986: 86). Secara alamiah
macam, yaitu antioksidan primer dan antioksidan sekunder. Antioksidan primer
meliputi antioksidan alami dan sintetik. Antioksidan alami, antara lain tokoferol,
asam askorbat, lesitin, dan lain-lain. Antioksidan alami ini mempunyai banyak
ikatan rangkap yang mudah dioksidasi, sehingga akan melindungi lemak dari proses
oksidasi. Antioksidan sintetik biasanya ditambahkan ke dalam lemak atau bahan
pangan untuk mencegah ketengikan dan agak beracun. Contoh antioksidan sintetik
antara lain Butylated Hidroxyanisole (BHA), Butylated Hidroxytoluene (BHT),
Nordhidroqualaretic (NDGA), dan lain-lain. Antioksidan sekunder adalah suatu zat
yang dapat mencegah kerja prooksidan, sehingga kerjanya tergolong sinergik.
Contohnya adalah vitamin C, vitamin E, dan betakaroten yang dapat diperoleh dari
buah-buahan.
Pemakaian antioksidan sintetik mulai mendapatkan respon negatif karena
berpotensi kanker dalam tubuh. Di beberapa negara maju, seperti Jepang dan
Kanada, penggunaan antioksidan sintetik seperti BHA, BHT, dan TBHQ telah
dilarang (Iqbal dan Anwar, 2005 dalam Ayucitra, 2011: 1). Oleh karena itu,
penggunaan antioksidan alami sebagai pengganti karena dipercaya lebih aman
untuk kesehatan.
Sekitar 950 spesies tumbuhan yang ada di Indonesia memiliki potensi
sebagai tanaman yang berguna bagi manusia, salah satunya adalah antioksidan.
Pandan wangi merupakan tanaman yang sering dimanfaatkan sebagai bahan
tambahan pangan, pada umumnya digunakan sebagai pemberi aroma dan pewarna
Prameswari dan Widjaksono (2014: 17) menyatakan daun pandan wangi
memiliki aktivitas antidiabetik pada ekstrak air, antioksidan pada ekstrak air dan
etanol, antikanker pada ekstrak etanol dan metanol, dan antibakteri pada ekstrak
etanol dan etil asetat. Ekstrak etanol daun pandan wangi mengandung alkaloid,
saponin, flavonoid, tanin, dan polifenol (As’ari, et al., 2014: 119).
Pada penelitian ini akan dilakukan penambahan antioksidan alami pada
minyak kelapa krengseng, yaitu antioksidan yang digunakan berasal dari ekstrak
etanol daun pandan wangi. Pemilihan ekstrak tersebut didasarkan pada penelitian
sebelumnya, dimana ekstrak etanol mengandung senyawa alkaloid, saponin,
flavonoid, tanin, polifenol, dan zat warna. Hal ini menunjukkan bahwa pada esktrak
etanol daun pandan wangi terdapat senyawa yang berperan aktif sebagai
antioksidan, yaitu flavonoid, polifenol, dan tanin.
B. Identifikasi Masalah
Berdasarkan latar belakang masalah yang dikemukakan, maka ada beberapa
masalah yang dapat diidentifikasi berkenaan dengan penelitian ini, yaitu:
1. Terdapat berbagai macam varietas tanaman pandan yang dapat digunakan
sebagai sumber antioksidan, seperti pandan kaku, pandan duri, pandan wangi,
pandan melintir, pandan laut dan pandan suji.
2. Ada berbagai pelarut yang dapat digunakan untuk ekstraksi senyawa antioksidan
yang terekstrak, seperti etanol, eter, aseton, etil asetat, petroleum eter, dan
kloroform.
3. Ada berbagai metode ekstraksi yang dapat digunakan pada ekstraksi senyawa
4. Ada berbagai metode yang dapat digunakan dalam uji aktivitas antioksidan,
diantaranya metode TBA, DPPH, dan FTC.
5. Aktivitas antioksidan dipengaruhi oleh berbagai faktor, diantaranya waktu
pengujian, konsentrasi, dan suhu.
C. Pembatasan Masalah
Untuk menghindari adanya pengertian yang meluas dan kesalahan persepsi,
maka perlu dikemukakan batasan-batasan masalah sebagai berikut:
1. Jenis tanaman pandan yang digunakan adalah pandan wangi.
2. Pelarut yang digunakan untuk ekstraksi adalah etanol.
3. Metode ekstraksi yang digunakan adalah metode maserasi.
4. Metode yang digunakan untuk uji aktivitas antioksidan adalah metode FTC.
5. Faktor yang akan diteliti yang mempengaruhi aktivitas antioksidan adalah
konsentrasi ekstrak etanol daun pandan wangi, yaitu 0,01%, 0,05%, 0,1%
menurut rekomendasi Food and Drug Administration (Ketaren, 2008: 135), dan
waktu pengujian, yaitu 0 hari (sebagai kontrol), 1, 2, 3, 4, 5, 6, 7, dan 8 hari.
D. Perumusan Masalah
Berdasarkan latar belakang dan pembatasan masalah, maka dapat
dirumuskan masalah:
1. Apakah ekstrak daun pandan wangi berpotensi sebagai antioksidan alami
2. Bagaimanakah pengaruh variasi konsentrasi ekstrak etanol daun pandan wangi
terhadap aktivitas antioksidan pada minyak kelapa krengseng?
3. Bagaimanakah pengaruh waktu inkubasi terhadap aktivitas antioksidan ekstrak
etanol daun pandan wangi pada minyak kelapa krengseng?
E. Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui:
1. Potensi ekstrak etanol daun pandan wangi sebagai antioksidan alami minyak
kelapa krengseng.
2. Ada tidaknya pengaruh variasi konsentrasi ekstrak etanol daun pandan wangi
terhadap aktivitas antioksidan pada minyak kelapa krengseng.
3. Ada tidaknya pengaruh waktu inkubasi terhadap aktivitas antioksidan ekstrak
etanol daun pandan wangi pada minyak kelapa krengseng.
F. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat bagi banyak
pihak, antara lain:
1. Bagi industri makanan, memberikan pilihan kepada industri untuk
memanfaatkan daun pandan wangi sebagai sumber antioksidan alami, sehingga
mampu menekan seminimal mungkin penggunaan antioksidan sintetik.
2. Bagi masyarakat, memberikan wawasan mengenai zat-zat bermanfaat yang ada
dalam daun pandan wangi yang salah satunya sebagai antioksidan alami.
3. Bagi dunia pendidikan, menambah wawasan keilmuan di bidang penelitian
4. Bagi mahasiswa Jurusan Pendidikan Kimia, sebagai inspirasi ide penelitian
BAB II
TINJAUAN PUSTAKA A.Deskripsi Teori
1. Minyak Kelapa
Pohon kelapa (cocos nucifera L) telah lama dikenal sebagai pohon
serbaguna pada masyarakat desa. Kelapa merupakan salah satu komoditi
perkebunan yang sangat penting di Indonesia selain kopi, kakao, lada, dan vanili.
Salah satu olahan buah kelapa adalah minyak kelapa yang merupakan salah satu
komponen bahan pokok. Komposisi kimia daging buah kelapa ditentukan oleh
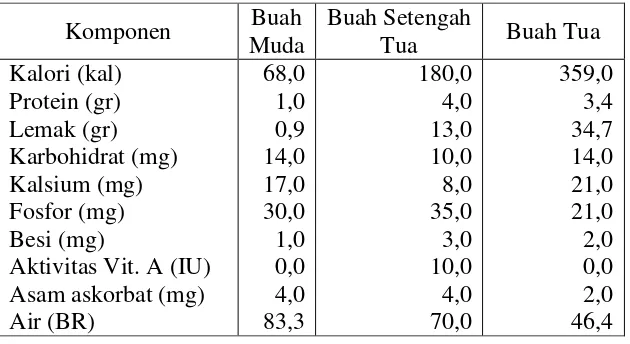
umur buahnya, seperti terlihat pada tabel 1.
Tabel 1. Komposisi daging buah kelapa 1000 gram (Ketaren, 2008: 312)
Komponen Buah
Muda
Buah Setengah
Tua Buah Tua
Kalori (kal) Protein (gr) Lemak (gr) Karbohidrat (mg) Kalsium (mg) Fosfor (mg) Besi (mg)
Aktivitas Vit. A (IU) Asam askorbat (mg) Air (BR) 68,0 1,0 0,9 14,0 17,0 30,0 1,0 0,0 4,0 83,3 180,0 4,0 13,0 10,0 8,0 35,0 3,0 10,0 4,0 70,0 359,0 3,4 34,7 14,0 21,0 21,0 2,0 0,0 2,0 46,4
Daging kelapa dapat diolah menjadi santan (juice extract). Santan kelapa ini
dapat dijadikan sebagai bahan pengganti susu atau dijadikan minyak nabati. Minyak
nabati yang berasal dari pohon kelapa disebut dengan minyak kelapa (coconut oil).
Minyak kelapa terdapat didalam sel daging buah yang merupakan minyak yang
Minyak kelapa berdasarkan kandungan asam lemaknya digolongkan ke
dalam minyak asam laurat, karena kandungan asam lauratnya paling besar jika
dibandingkan dengan asam lemak lainnya. Berdasarkan tingkat ketidakjenuhannya
yang dinyatakan dengan bilangan iod (Iodine Value), maka minyak kelapa dapat
dimasukkan ke dalam golongan non drying oils, karena bilangan iod minyak
berkisar antar 7,5 - 10,5 (Ketaren, 2008: 314).
Berikut ini disajikan jenis asam lemak yang terdapat pada beberapa minyak
nabati yang digunakan untuk minyak goreng (Noriko, et al., 2012: 148).
Tabel 2. Komposisi Beberapa Asam Lemak dalam Tiga Minyak Nabati
Asam Lemak Jumlah
Atom C Minyak Sawit (%) Minyak Inti (%) Minyak Kelapa (%) Asam Lemak Jenuh:
Asam oktanoat Asam dekanoat Asam laurat Asam miristat Asam palmitat Asam stearat 8 10 12 14 16 18 - - 1 1 - 2 32 - 47
4 - 10
2 - 4 3 - 7 41 - 55 14 - 19 6 - 10
1 – 4
8 7 48 17 9 2 Asam Lemak Tak Jenuh
Asam oleat Asam linoleat Asam linolenat 18 18 18
38 - 50 5 - 14
1
10 - 20 1 - 5 1 - 5
6 3 -
Minyak kelapa krengseng adalah minyak kelapa yang dibuat dari bahan
baku kelapa segar, diproses dengan pemanasan terkendali tanpa bahan kimia.
Prinsip pemisahan minyak kelapa krengseng dilakukan secara basah. Proses
pengolahan secara basah, yaitu dengan cara mengekstrak daging buah kelapa
dengan air. Daging buah diparut, kemudian ditambah air dan diperas sehingga
mengeluarkan santan. Setelah itu dilakukan pemisahan minyak dari santan dengan
menggumpal. Gumpalan padatan ini disebut blondo. Minyak dipisahkan dari
blondo dengan disaring. Blondo masih banyak mengandung minyak sehingga
masih dapat diambil minyaknya dengan diperas. Minyak kelapa krengseng
merupakan modifikasi proses pembuatan minyak kelapa sehingga dihasilkan
produk dengan kadar air dan kadar asam lemak bebas yang rendah.
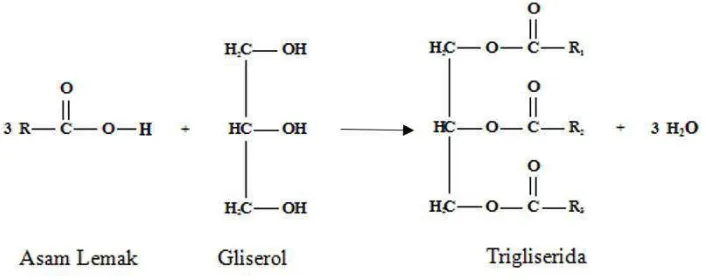
Minyak kelapa terdiri atas gliserida, yaitu persenyawaan antara gliserin dan
asam lemak.
Gambar 1. Reaksi Penyusunan Trigliserida (Ketaren, 2008: 7)
Disamping itu minyak kelapa mengandung asam lemak tidak jenuh yang dapat
menyebabkan rasa tengik. Minyak kelapa juga mengandung sejumlah komponen
bukan lemak, misal fosfatida, gum sterol (0,06 – 0,08%), tokoferol (0,003%) dan
asam lemak bebas (< 5%), sterol yang terdapat didalam minyak nabati disebut
phitosterol dan mempunyai dua isomer, yaitu beta sitoterol (C29H50O) dan
stigmasterol (C29H48O). tokoferol mempunyai tiga isomer, yaitu α-tokoferol (titik
cair 158o – 160oC), β-tokoferol (titik cair 138o – 140oC) dan ϒ-tokoferol.
Persenyawaan tokoferol bersifat tidak dapat disabunkan dan berfungsi sebagai
Kandungan asam lemak jenuh minyak kelapa diperkirakan sekitar 91%
(terdiri atas kaproat, kaprilat, kaprat, laurat, miristat, palmitat, stearat, dan
arakhidat), sedangkan kandungan asam lemak tidak jenuh sekitar 9% (terdiri dari
oleat dan linoleat). Asam lemak tidak jenuh dan asam lemak bebas akan mudah
teroksidasi oleh oksigen di udara. Oleh sebab itu, minyak kelapa yang disimpan
terlalu lama akan berubah menjadi tengik, karena terbentuknya bermacam-macam
aldehid dan peroksida (Siti Sulastri, 2005: 3).
Proses ketengikan pada minyak kelapa disebabkan oleh autooksidasi radikal
asam lemak tidak jenuh dalam lemak. Autooksidasi dimulai dengan pembentukan
radikal-radikal bebas yang disebabkan oleh faktor-faktor yang dapat mempercepat
reaksi seperti panas, peroksida lemak, logam-logam berat seperti Cu, Fe, Co, dan
Mn, logam porfirin seperti hematin, hemoglobin, moiglobin, klorofil, dan
enzim-enzim lipoksidase. (Winarno, 1982: 106). Dalam keadaan yang ekstrim, reaksi
oksidasi dapat menghasilkan residu yang sifatnya toksik (Tranggono, et al., 1988:
326-327).
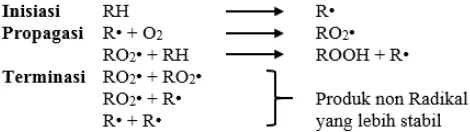
Oksidasi lemak dapat berlangsung melalui tiga jalan yaitu autooksidasi,
fotooksidasi, dan oksidasi enzimatis. Ranciditas (ketengikan oksidatif) adalah
terbentuknya off flavor sebagai hasil reaksi autooksidasi lemak. Autooksidasi
berlangsung melalui proses pembentukan radikal. Proses ini meliputi tahapan
inisasi, propagasi, dan terminasi (Tranggono, et al., 1988: 328-329).
Tahap inisiasi merupakan pembentukan radikal bebas lemak bila hidrogen
meninggalkan atom karbon α-metilen pada gugus asam lemak tak jenuh dari
molekul lemak (RH). Hasilnya berupa radikal bebas menjadi sangat peka terhadap
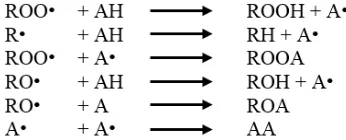
serangan oksigen atmosfer dan membentuk radikal peroksida tak stabil (ROO•).
Hal ini juga merupakan alasan pemberian istilah mekanisme radikal bebas oksidasi
lemak. Radikal bebas ini berperan sebagai inisiator dan pemacu kuat oksidasi
berikutnya, sehingga pemecahan oksidasi lemak dan minyak menjadi proses yang
dipacu oleh dirinya sendiri (autokatalitik) atau autooksidasi. Akibatnya terjadi
reaksi berantai antara peroksi radikal (ROO•) dengan minyak (RH) menghasilkan
hidroperoksida (ROOH) dan radikal baru (R•). Radikal baru ini kemudian berperan
dalam reaksi berantai, karena reaksinya dengan molekul oksigen lain.
Hiroperoksida dapat mengalami pemecahan menjadi senyawa organik yang lebih
kecil, seperti aldehida, keton, dan asam yang memberikan bau dan cita rasa tidak
enak yang dikenal sebagai rancidity.
RH = molekul asam oleat lainnya R• = molekul radikal bebas baru
Molekul-molekul lemak yang mengandung radikal asam lemak tidak jenuh
mudah sekali mengalami oksidasi. Proses ini dapat dipercepat oleh adanya cahaya,
suasana asam, kelembaban udara dan katalis. Maka untuk dapat menghambat atau
mencegah kerusakan lemak akibat proses oksidasi dibutuhkan suatu senyawa yang
dapat mencegah proses oksidasi tersebut. Beberapa macam persenyawaan yang
dapat menghambat proses oksidasi tersebut seperti yang dikenal sebagai
antioksidan.
2. Antioksidan
Antioksidan merupakan suatu inhibitor yang bekerja menghambat oksidasi,
yaitu bereaksinya senyawa antioksidan dengan radikal bebas reaktif membentuk
radikal bebas tidak reaktif yang stabil. Oleh karena itu antioksidan mampu
menetralisir radikal bebas dan mencegah kerusakan dengan menghambat terjadinya
reaksi berantai pada pembentukan radikal bebas (Resi dan Andis, 2008: 8).
Antioksidan dalam makanan dapat berada secara alamiah atau sengaja
ditambahkan. Sifat antioksidan yang diharapkan, yaitu harus efektif pada
konsentrasi rendah, tidak beracun, mudah dicari dan aman dalam penanganannya,
dan tidak memberikan sifat yang tidak dikehendaki seperti perubahan warna, bau,
dan cita rasa.
Antioksidan dapat dibedakan menjadi dua macam, yaitu:
a. Antioksidan primer
Suatu senyawa dapat digolongkan sebagai antioksidan primer apabila
senyawa tersebut dapat menyebabkan berhentinya reaksi rantai pembentukan
memiliki kemiripin molekul dasarnya, yaitu mengandung setidaknya satu
cincin aromatik dan sebuah gugus hidroksil (Winarno, 1982: 106).
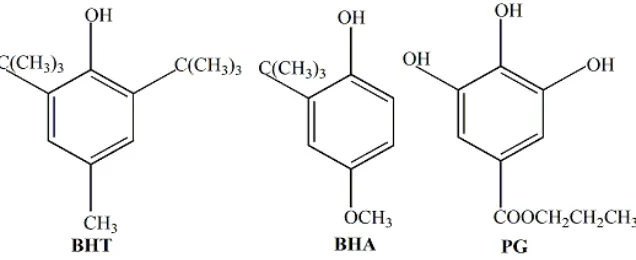
Senyawa ini meliputi asam fenolat, isoflavon, ester gallat, kumarin,
flavonon, dan oligomer proantosianidin. Senyawa yang tergolong antioksidan
sintetik adalah BHT (Butylated Hidroxy Toluene), BHA (Butylated Hidroxy
Anisole), PG (Propyl Gallat), NGDA (Nor Dihydro Guaiaretic Acid), dan
TBHQ (Tert Butylated Hidroxy Quinone).
Gambar 4. Struktur Molekul BHT, BHA, dan PG
Struktur antioksidan sintetik ini memiliki kemiripan dengan struktur
antioksidan alami, yaitu mengandung cincin aromatik dan gugus hidroksil.
Perbedaannya terletak pada subtituen yang ditambahkan. Dengan kata lain,
bagian yang aktif sebagai antioksidan jenis ini adalah senyawa fenol.
Oleh karena fungsinya menghentikan reaksi berantai, antioksidan jenis
ini disebut juga sebagai antioksidan pemutus rantai (chain breaking
antioxidant). Adanya antioksidan alami maupun sintetik dapat menghambat
oksidasi lipid, mencegah kerusakan, perubahan komponen organik dalam suatu
bahan makanan sehingga dapat memperpanjang umur simpan (Rohdiana, 2001
akseptor radikal bebas sehingga dapat menunda tahap inisiasi pembentukan
radikal bebas.
Gambar 5. Reaksi Penghambatan Antioksidan Primer terhadap Radikal Lipida (Shahidi, 2005 dalam Aning Ayucitra, 2011: 3)
Antioksidan yang ditambahkan pada minyak goreng bertujuan untuk
menghambat laju oksidasi. Antioksidan primer (AH) dapat memberikan atom
hidrogen secara cepat ke radikal lipida (R•, ROO•) dan mengubahnya ke
bentuk lebih stabil, sementara turunan radikal antioksidan (A•) tersebut
memiliki keadaan lebih stabil dibanding radikal lipida. Penambahan
antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat
menghambat atau mencegah reaksi autooksidasi lemak dan minyak.
Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi
maupun propagasi. Radikal-radikal antioksidan (A•) yang terbentuk pada
reaksi tersebut relatif stabil dan tidak mempunyai cukup energi untuk dapat
bereaksi dengan molekul lipida lain membentuk radikal lipida baru.
Radikal-radikal antioksidan dapat saling bereaksi membentuk produk non Radikal-radikal
(Trilaksani, 2003 dalam Aning Ayucitra, et al., 2011: 2).
b.Antioksidan sekunder
Antioksidan sekunder adalah suatu senyawa yang dapat menurunkan
senyawa yang mencegah kerja proksidan. Beberapa mekanisme kerja
antioksidan jenis ini, seperti menangkap oksigen, menyerap radiasi UV,
deaktivasi oksigen singlet, dan mengikat logam.
Beberapa asam organik tertentu, biasanya asam di- atau trikarboksilat
dapat mengikat logam-logam (squestran), misalnya satu molekul asam sitrat
akan mengikat prooksidan Fe seperti yang dilakukan pada minyak kacang
kedelai. EDTA (etilendiamin tetraasetat) adalah sequestran logam yang sering
digunakan dalam minyak salad (Winarno, 1982: 107).
Secara teoritis antioksidan dapat kehilangan potensinya jika tidak
mempunyai kemampuan lagi untuk mengikat hidrogen atau elektron yang menjadi
bagian dari molekul lemak. Beberapa jenis antioksidan yang dapat kehilangan
potensinya terutama adalah golongan fenolat, karena golongan fenolat bersifat
dapat menguap pada suhu kamar, terlebih lagi pada proses menggoreng (Ketaren,
2008: 136).
Faktor yang mempengaruhi aktivitas antioksidan antara lain:
a. Waktu inkubasi. Aktivitas antioksidan sangat dipengaruhi oleh lama
waktu inkubasi. Semakin lama waktu inkubasi, maka aktivitas
antioksidan semakin kecil.
b. Suhu. Suhu sangat berpengaruh pada kecepatan oksidasi lemak. Semakin
tinggi suhu dapat menyebabkan aktivitas antioksidan menurun.
c. Konsentrasi antioksidan. Semakin besar konsentrasi antioksidan yang
ditambahkan pada minyak, maka semakin tinggi pula aktivitas
Penelitian ini menggunakan 2 faktor yang dapat mempengaruhi aktivitas
antioksidan, yaitu waktu inkubasi dan konsentrasi antioksidan.
3. Pandan Wangi (Pandanus amaryllifolius Roxb.)
Pandan wangi (Pandanus amaryllifolius Roxb.) atau biasa disebut sebagai
pandan ini adalah jenis tumbuhan monokotil dari famili pandanaceae. Pandan
wangi merupakan satu-satunya spesies pandanus yang memiliki daun yang wangi
(Sheila Margareta, et al., 2011: 22). Tumbuhan ini dikenal dengan bau wangi yang
khas, sehingga disebut fragrant screw pine.
Menurut Nonato MG. et al. (2008: 26), tumbuhan pandan wangi memiliki
taksonomi sebagai berikut:
Kingdom : Plantea
Subkingdom : Tracheobionta
Super Divisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Liliopsida
Sub Kelas : Arecidae
Ordo : Pandanales
Famili : Pandanaceae
Genus : Pandanus
Spesies : Pandanus amaryllifolius Roxb.
Pandan wangi adalah tanaman asli Indonesia yang berasal dari Bangka dan
tersebar luas di daerah Asia Tenggara. Budidaya tanaman ini umumnya dilakukan
tepi sungai, tepi rawa, dan di tempat-tempat yang agak lembab, tumbuh subur dari
daerah pantai sampai daerah yang memiliki ketinggian 500 m di atas permukaan
laut. Tanaman ini adalah tanaman perdu tahunan, memiliki tinggi 1 - 2 m, batang
bulat dengan duduk daun, bercabang, tumbuh menjalar, akar tunjang menjalar di
sekitar pangkal batang dan cabang daun tunggal, duduk dengan pangkal memeluk
batang, tersusun berbaris tiga dengan dudukan dalam garis spiral.
Pandan wangi selain sebagai rempah-rempah juga digunakan sebagai bahan
dasar pembuatan minyak wangi. Daunnya yang harum ketika diremas atau
diiris-iris, sering digunakan sebagai bahan penyedap, pewangi, dan pemberi warna hijau
pada masakan atau pangan. Selain itu masyarakat juga memanfaatkannya sebagai
tanaman obat untuk mengobati lemah syaraf, rematik dan pegal linu, gelisah,
rambut rontok dan juga berkhasiat untuk menghitamkan rambut dan menghilangkan
ketombe pada rambut. Secara ilmiah daun pandan wangi diketahui mengandung
metabolit sekunder seperti alkaloid, flavonoid, saponin, tanin, dan polifenol (As’ari,
et al., 2014: 119).
4. Polifenol
Polifenol merupakan kelompok terbesar dari fitokimia tumbuhan dan
banyak ditemukan dalam makanan nabati. Polifenol merupakan senyawa aromatik
yang dihasilkan dari metabolit sekunder tanaman. Beberapa senyawa polifenol
antara lain isoflavon, katekin, quersetin, dan lain-lain. Senyawa polifenol adalah
senyawa yang bersifat sebagai nukleofilik (Eko Suhartono, 2006: 154).
Senyawa polifenol merupakan antioksidan kuat yang melengkapi dan
yang disebabkan oleh spesies oksigen reaktif yang berlebihan. Senyawa polifenol
dibagi menjadi flavonoid dan tanin. Dari semua senyawa aromatik, flavonoid dan
tanin merupakan senyawa yang umum di organ tanaman. Flavonoid dan tanin tidak
hanya memiliki peran fungsional pada tanaman, tetapi juga signifikan secara
komersial dalam farmakologi dan industri makanan.
a. Flavonoid
Flavonoid merupakan senyawa yang memiliki kerangka dasar 15 atom
karbon yang terdiri dari dua cincin benzene (C6) yang terikat pada rantai
propana (C3) sehingga membentuk suatu susunan C6-C3-C6. Kerangka
karbonnya terdiri atas dua gugus C6 (cincin benzene tersubtitusi) yang
disambungkan oleh rantai alifatik tiga karbon. Susunan ini dapat menghasilkan
tiga jenis struktur, yakni 1,3-diarilpropana atau flavonoid, 1,2-diarilpropana
atau isoflavon, dan 1,1-darilpropana atau neoflavonoid.
Senyawa-senyawa flavonoid terdapat dalam semua bagian tumbuhan,
seperti bunga, daun, ranting, buah, kayu, dan akar. Berikut rumus umum
flavonoid.
Gambar 6. Kerangka Dasar Flavonoid (Markham, 1988: 3)
Flavonoid adalah senyawa polar sehingga senyawa ini dapat larut pada
pelarut polar seperti, metanol, etanol, butanol, aseton, kloroform dan lain-lain.
dalam air. Sehingga campuran pelarut diatas dengan air merupakan pelarut
yang lebih baik pada glukosida (Markham, 1988: 15).
Pengelompokkan flavonoid dibedakan berdasarkan cincin
heterosiklik-oksigen dan gugus hidroksilnya. Salah satu kelompok senyawa flavonoid
adalah quersetin yang memiliki lima gugus hidroksil.
Gambar 7. Struktur Quersetin (Senyawa Flavonoid)
Quersetin merupakan senyawa flavonoid yang masuk dalam
kelompok flavon. Senyawa ini merupakan senyawa polar. Larutan etanol
memiliki sifat semi polar. Sehingga quersetin dapat larut dalam etanol sesuai
hukum like dissolve like. Glikosida quersetin yang paling umum adalah
quercetin 3-rutinosida atau dikenal sebagai rutin. Nama kimia dari rutin adalah
3,3’,4’,5,7-pentahidroksi flavon-3-ramnoglukosil.
Rutin merupakan turunan dari senyawa flavonoid yang memiliki
aktivitas antioksidan cukup kuat dan dapat memperkuat daya kapilaritas
pembuluh darah dan membantu menghentikan edem atau pembengkakan vena.
Rutin dapat digunakan sebagai kontrol positif pada uji aktivitas antioksidan
karena memiliki kemiripan struktur kimia dengan flavonoid.
b. Tanin
Tanin merupakan golongan senyawa fenol yang terdapat pada daun,
buah yang belum matang, merupakan golongan senyawa aktif tumbuhan yang
termasuk golongan flavonoid, mempunyai rasa sepat dan mempunyai
kemampuan menyamak kulit. Secara kimia tanin dibagi menjadi dua golongan,
yaitu tanin terkondensasi atau tanin katekin dan tanin terhidrolisis atau tanin
galat (Robinson dalam Sriwahyuni, 2010).
1) Tanin terhidrolisis
Tanin terhidrolisis biasanya berikatan dengan karbohidrat
membentuk jembatan oksigen sehingga dapat dihidrolisis menggunakan
asam sulfat atau asam klorida. Tanin terhidrolisis penyebarannya terbatas
pada tumbuhan berkeping dua (Harborne, 1987: 104).
Gallotanin Ellagitanin
2) Tanin terkondensasi
Tanin terkondensasi hampir terdapat semesta di dalam paku-pakuan
dan gimnospermae, serta tersebar luas dalam angiospermae, terutama pada
jenis tumbuhan berkayu. Tanin terkondensasi atau flavolan secara
biosintesis dapat dianggap terbentuk dengan cara kondensasi katekin
tunggal (atau galokatekin) yang membentuk senyawa dimer dan kemudian
oligomer yang lebih tinggi. Nama lain untuk tanin terkondensasi ialah
proantosianidin (Harborne, 1987: 103 - 104).
Gambar 10. Struktur tanin terkondensasi atau proantosianidin (Karamali, (2001: 642 - 643) dalam Ayu Sulung, 2016: 35)
5. Ekstraksi
Prosedur pemisahan digunakan bagi keperluan pemurnian suatu senyawa,
identifikasi, dan penentuan kadar suatu bahan. Beberapa hal yang harus
diperhatikan dalam penyiapan pelarut dan bahan yang akan diekstrak antara lain
adalah selektivitas, kelarutan, kemampuan tidak saling bercampur, kerapatan,
reaktivitas, dan titik didih.
Jenis ekstraksi meliputi ekstraksi secara dingin dan ekstraksi secara panas.
perkolasi, sedangkan ekstraksi secara panas terdiri atas metode refluks dan metode
destilasi uap (Ibtisam, 2008: 3).
Metode dasar dari esktraksi adalah maserasi dan perkolasi. Biasanya metode
ekstraksi dipilih berdasarkan beberapa faktor, seperti sifat dari bahan dan daya
penyesuaian dengan tiap macam metode ekstraksi, dan kepentingan dalam
memperoleh ekstraksi yang sempurna atau mendekati sempurna dari sampel
(Ibtisam, 2008: 4).
Maserasi berasal dari bahasa latin macerace, yang berarti mengairi dan
melunakkan. Maserasi merupakan metode ekstraksi paling sederhana. Dasar
maserasi adalah melarutnya bahan kandungan simplisia dari sel rusak yang
terbentuk pada saat penghalusan bahan kandungan dari sel yang masih utuh. Setelah
selesai waktu maserasi, yaitu terjadinya keseimbangan antara bahan yang
diekstraksi pada bagian dalam sel dengan masuk ke dalam cairan telah tercapai,
maka proses difusi segera berakhir (Istiqomah, 2013: 12).
Pada penelitian ini dilakukan dengan metode maserasi. Pemilihan metode
ini dilakukan karena lebih efektif untuk mengekstraksi bahan dalam jumlah besar
dengan waktu yang cepat. Maserasi umumnya dilakukan dengan meredam 10
bagian sampel dengan derajat kehalusan yang sesuai ke dalam suatu bejana.
Kemudian dituang 75 bagian pelarut, ditutup dan dibiarkan selama 5 hari. Selama
keadaan tersebut proses maserasi harus dalam kondisi terlindungi dari cahaya.
Maserat yang dihasilkan disaring sehingga didapatkan filtrat yang diinginkan.
Proses maserasi menggunakan pelarut etanol sebagai cairan
menyebabkan pembengkakan membran sel dan memperbaiki stabilitas bahan
terlarut, etanol juga mampu mengendapkan albumin dan menghambat kerja enzim.
Penggunaan etanol dengan skala kecil yang di dalam cairan pengekstraksi
seringkali dapat menghasilkan bahan aktif yang optimal (Agus Purboyo, 2009: 19).
6. Analisis Screening Fitokimia
Analisis screening fitokimia dilakukan dengan tes uji warna. Analisis ini
digunakan untuk mengetahui golongan suatu bahan menggunakan beberapa
pereaksi untuk golongan senyawa alkaloid, tanin dan polifenol, saponin, kardenolin
dan bufadianol, flavonoid, dan antrakuinon. Pereaksi-pereaksi spesifik yang
digunakan pada analisis ini kebanyakan bersifat polar sehingga dapat berinteraksi
dengan sampel menggunakan prinsip like dissolve like (Soerya, et al., 2005: 27-28).
a. Uji tanin dan polifenol.
Sebanyak 3 mL sampel diekstraksi dengan akuades panas kemudian
didinginkan. Setelah itu ditambahkan 5 tetes NaCl 10% dan di saring. Filtrat
dibagi menjadi 3 bagian A, B, dan C. Filtrat A digunakan sebagai blanko.
Kedalam filtrat B ditambahkan 3 tetes preaksi FeCl3, hasil positif apabila warna
larutan berubah menjadi hijau kehitaman, biru, atau hitam. Filtrat C
ditambahkan garam gelatin, hasil menunjukkan positif apabila terjadi endapan.
b. Uji flavonoid
Sebanyak 3 mL sampel diuapkan, kemudian dicuci dengan heksana
Filtrat dibagi menjadi 3 bagian, yaitu A, B, dan C. Filtrat A digunakan sebagai
blanko, filtrat B ditambahkan 0,5 mL HCl pekat kemudian dipanaskan pada
penangas air, jika terjadi perubahan warna merah tua sampai ungu
menunjukkan hasil positif (metode Bate Smith-Metchalf). Filtrat C
ditambah-kan 0,5 mL HCl dan logam Mg, kemudian diamati perubahan warna yang
terjadi (metode Wilstatter). Warna merah sampai jingga diberikan oleh
senyawa flavon, warna hijau sampai biru diberikan oleh aglikon atau glikosida.
Selain itu uji flavonoid dapat dilakukan dengan analisis KLT. Sampel
ditotolkan pada plat silica gel G60. Dielusi menggunakan butanol : asam asetat
: air = 3:1:1. Lalu plat dikeringkan dan diamati cahaya tampak pada panjang
gelombang 254 nm dan 366 nm. Selanjutnya plat disemprot dengan amonia,
dikeringkan diudara dan diamati pada cahaya tampak 254 nm dan 366 nm.
Noda kuning sampai orange mengidentifikasikan adanya flavonoid.
Pada penelitian ini menggunakan 2 metode, pertama menggunakan pereaksi
FeCl3 untuk uji polifenol dan yang kedua menggunakan metode wilstatter dengan
pereaksi Mg-HCl.
7. Spektrofotometri UV-Vis
Spektrofotometer UV-Vis biasanya beroperasi pada trayek panjang
gelombang 190 sampai 1100 nm. Semua molekul dapat menyerap radiasi dalam
daerah UV-VIS, karena molekul mempunyai elektron yang dapat dieksitasi ke
tingkat energi yang lebih tinggi. Spektrofotometri UV-VIS secara ideal diambil dari
berwarna, maka radiasi dengan panjang gelombang tertentu akan diserap (absorpsi)
sedangkan radiasi lainnya akan diteruskan (transmisi).
Spektrum UV-Vis terdiri dari pita absorbansi lebar pada daerah panjang
gelombang yang lebar. Panjang gelombang absorbansi biasanya dilaporkan sebagai
גmaks, yakni panjang gelombang yang memberikan nilai absorbansi terbesar.
Absorbansi suatu senyawa dengan panjang gelombang tertentu akan bertambah
dengan makin banyaknya molekul yang mengalami transisi. Panjang gelombang
tergantung pada kuat lemahnya elektron yang terikat pada molekul (Harjono S,
1991: 11-12).
Dasar kerja pada metode spektrofotometri UV-Vis berdasarkan atas
absorban sinar tampak oleh suatu larutan berwarna. Oleh karena itu, metode ini
dikenal juga sebagai metode kolorimetri. Hanya larutan berwarna saja yang dapat
ditentukan dengan metode ini. Senyawa tidak berwarna dapat dibuat berwarna
dengan mereaksikannya dengan pereaksi yang menghasilkan senyawa berwarna.
Contohny. Ion Fe3+ dengan CNS- menghasilkan larutan berwarna merah (Bintang,
2010: 194).
8. Metode FTC (Feritiosianat)
Pengukuran aktivitas antioksidan pada penelitian ini menggunakan metode
feritiosianat. Metode ini didasarkan pada kemampuan senyawa antioksidan dalam
menghambat terbentuknya radikal yang reaktif. Pembentukan radikal bebas
disebabkan oleh oksidasi asam oleat.
Metode FTC digunakan untuk mengukur jumlah peroksida pada proses
pada panjang gelombang 500 nm (Aris, et al., 2009 dalam Muhtadi, et al., 2014).
Aktivitas antioksidan yang ditentukan dengan metode FTC membutuhkan suatu
kontrol positif yang biasanya merupakan senyawa yang telah diketahui sifat
antioksidannya, seperti vitamin C, butil hidroksi toluena (BHT), atau tokoferol.
Oksidasi asam oleat dalam kondisi buffer yang diinkubasi pada suhu 55°C
menggunakan FeCl2 dan amonium tiosianat sebagai pereaksi oksidator yang dapat
mengoksidasi Fe2+ menjadi Fe3+, sehingga menghasilkan warna merah yang
menyerap sinar tampak pada panjang gelombang antara 450 - 550 nm. Peroksida
lemak meningkatkan bilangan oksidasi Fe2+ menjadi Fe3+ yang kemudian bereaksi
dengan ligan CNS- membentuk kompleks berwarna merah [Fe(SCN)3].
Penggunaan metode FTC ini digunakan sebagai pengganti metode DPPH,
disebabkan DPPH adalah radikal nitrogen stabil yang berbeda dengan radikal
peroksil yang ada di peroksida lemak. Antioksidan bereaksi cepat dengan radikal
peroksil namun bereaksi lambat atau bahkan netral terhadap radikal DPPH
Gambar 11. Mekanisme Penghambatan Oksidasi Asam Oleat dengan Metode Tiosianat (Risqa Uswatun, 2011:22)
B.Penelitian yang Relavan
Penelitian yang dilakukan oleh Risqa Uswatun pada tahun 2011 yang
melakukan penelitian tentang pengaruh ekstrak cabai rawit merah (Capsium
frutescens L.) sebagai antioksidan terhadap proses autooksidasi minyak kelapa
krengseng yang menunjukkan bahwa adanya pengaruh variasi konsentrasi ekstrak
cabai rawit hijau 0,01%, 0,05%, dan 0,1% terhadap aktivitas antioksidan pada
minyak kelapa krengseng. Semakin besar konsentrasi ekstrak cabai rawit merah
yang ditambahkan pada minyak kelapa krengseng, maka aktivitas antioksidan
semakin besar.
Penelitian lainnya yang relevan dilakukan oleh Putu Puspita Sari, Wiwik
Susanah Rita, dan Ni Made Puspawati pada tahun 2015 yang meneliti tentang
(Jarq.) Merr) sebagai antibakteri Escherichia coli (E. coli). Hasilnya menunjukkan
bahwa etanol merupakan pelarut terbaik dibandingkan dengan kloroform untuk
ekstraksi daun trembesi yaitu menghasilkan ekstrak 36,8 gram.
Penelitian lainnya dilakukan Yondra Arif D, Christine Jose, dan Hildan
Yuda Teruna (2014), yaitu meneliti tentang total fenolik, flavonoid, serta aktivitas
antioksidan ekstrak n-heksana diklorometan dan methanol Amaranthus spinosus L
EM5-bawang putih. Hasil penelitian menunjukkan bahwa aktivitas antioksidan
menggunakan metode FTC (27,615% mg/mL) lebih baik dibandingkan dengan
metode DPPH (0,374 % mg/mL) maupun penangkapan radikal NO (0,025%
mg/mL).
Berdasarkan ketiga hasil penelitian tersebut menunjukkan persamaan
dengan penelitian yang akan dilakukan, yaitu dalam hal metode ekstraksinya
menggunakan metode maserasi, media uji yang digunakan adalah minyak kelapa
krengseng, dan pelarut yang digunakan adalah etanol, dengan metode penentuan aktivitas antioksidan, yaitu metode FTC (Feritiosianat).
C.Kerangka Berpikir
Penggunaan antioksidan sintetik sebagai bahan pengawet pada makanan
berlemak ternyata berdampak buruk bagi kesehatan manusia, karena antioksidan
sintetik tersebut memiliki daya toksisitas yang tinggi. Oleh karena itu penggunaan
antioksidan harus ditekan seminimal mungkin supaya hal yang tidak diinginkan
yang berkaitan dengan kesehatan dapat dihindari. Salah satu upaya yang dapat
dilakukan berkenaan dengan masalah ini adalah eksploitasi sumber antioksidan
Sekitar 950 spesies tumbuhan yang ada di Indonesia memiliki potensi
sebagai pangan bermanfaat bagi kesehatan, diantaranya sebagai antioksidan. Salah
satu bahan alami yang diduga berpotensi sebagai antioksidan alami adalah daun
pandan wangi yang keberadaannya dengan mudah ditemukan dan dengan mudah
pula dibudidayakan.
Berbagai penelitian yang dilakukan sebelumnya mengemukakan bahwa
senyawa-senyawa pada ekstrak etanol daun pandan wangi memiliki aktivitas
antioksidan. Mekanisme kerja senyawa antioksidan dalam proses oksidasi, antara
lain adanya gugus fenol yang akan mendonorkan atom H-nya ketika berinteraksi
dengan senyawa radikal bebas, sehingga pada akhirnya radikal bebas akan berubah
menjadi senyawa netral yang tidak berbahaya bagi kesehatan.
Pada penelitian ini akan dilakukan ekstraksi daun pandan wangi dengan
metode maserasi dan menggunakan pelarut etanol p.a pada berbagai variasi
konsentrasi dan waktu pengujian. Aktivitas antioksidan ditentukan dengan
meng-gunakan metode FTC (Feritiosianat). Harapannya dari hasil penelitian ini dapat
diperoleh data secara empiris tentang potensi daun pandan wangi sebagai
BAB III
METODE PENELITIAN A.Subjek dan Objek Penelitian
1. Subjek Penelitian
Subjek penelitian ini adalah ekstrak etanol daun pandan wangi.
2. Objek Penelitian
Objek penelitian ini adalah aktivitas antioksidan ekstrak etanol daun pandan
wangi dalam berbagai variasi konsentrasi dan waktu pengujian.
B.Variabel Penelitian 1. Variabel Bebas
Variabel bebas dalam penelitian ini adalah konsentrasi ekstrak etanol daun
pandan wangi dan waktu pengujian.
2. Variabel Terikat
Variabel terikat dalam penelitian ini adalah aktivitas antioksidan ekstrak
daun pandan wangi pada minyak kelapa krengseng yang dinyatakan dalam
persentase penghambatan oksidasi terhadap kontrol negatif.
C.Alat dan Bahan Penelitian 1. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah:
a. Spektrofotometer Thermo-Genesys 20
b. Inkubator
d. Vortex mixer
e. Mikro pipet 1000-100 µL
f. Botol flakon 10 mL berwarna bening bermulut sempit
g. Alat-alat gelas meliputi: labu ukur, pipet ukur, erlenmeyer, tabung reaksi, gelas
ukur, cawan kaca, dan gelas kimia, spatula
2. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah:
a. Daun pandan wangi
b. Tanin (Berasal dari toko Chem-Mix)
c. Minyak kelapa krengseng (Berasal dari pasar Gejayan)
d. Etanol 96% p.a
e. Akuades
f. FeCl3 2%
g. Buffer fosfat 0,05 M (pH 7,00)
h. NH4SCN 30%
i. FeSO4.7H2O 0,02 M
j. HCl pekat
k. Magnesium
Penelitian dilakukan di Laboratorium Biokimia dan Organik Jurusan
Pendidikan Kimia, FMIPA, Universitas Negeri Yogyakarta.
E.Prosedur Penelitian 1. Persiapan Bahan Uji
Daun pandan wangi disortir sesuai dengan kriteria lalu dicuci bersih dengan
air mengalir selanjutnya dilakukan pengecilan ukuran sebesar 3 – 5 cm. Daun
pandan wangi yang telah dikecilkan lalu dikeringkan dengan oven selama 4 jam.
Daun pandan wangi yang sudah kering diblender sampai halus, sehingga diperoleh
serbuk daun pandan wangi.
2. Ekstraksi Daun Pandan Wangi dengan Metode Maserasi
Sebanyak 40 g serbuk daun pandan wangi dimasukkan ke dalam jerigen,
kemudian ditambahkan sebanyak 200 mL etanol 96% p.a, didiamkan selama 24
jam. Filtrat disaring, dan residu yang dihasilkan dimaserasi kembali dengan 200 mL
etanol 96% p.a. Semua filtrat yang dihasilkan sebanyak 400 mL. Lalu dievaporasi
pada suhu 600C hingga diperoleh ekstrak daun pandan wangi. Ekstrak diuji secara
kualitatif untuk mengetahui adanya kandungan fitokimia (flavonoid dan polifenol)
yang mempunyai aktivitas sebagai antioksidan dan uji antivitas antioksidannya
dengan metode FTC.
3. Screening Fitokimia
Screening fitokimia dapat dilakukan dengan uji warna (kualitatif), yaitu
senyawa polifenol. Keberadaan senyawa flavonoid dalam sampel dilakukan dengan
uji wilstatter. Sedangkan uji adanya senyawa polifenol dilakukan dengan larutan
penambahan FeCl3 adapun uji tersebut secara lengkap sebagai berikut:
a. Uji Wilstatter
Ambil ekstrak etanol daun pandan wangi 2 mL tambahkan 3 mL HCl
pekat dan 2 – 3 potong kecil logam Mg. Perubahan warna yang terjadi diamati,
yaitu merah sampai jingga untuk flavon dan hijau sampai biru untuk aglikon
atau glikosida (Sarah dan Ratna, 2014: 3).
b. Identifikasi Polifenol
Ambil ekstrak etanol daun pandan wangi sebanyak 1 mL, masukkan
dalam tabung yang pertama. Ambil tabung reaksi kedua sebagai kontrol positif
yang diisi dengan larutan tanin. Ke dalam kedua tabung masing-masing
ditambahkan 3 tetes pereaksi FeCl3 (Nur Ismiyati, et al., 2015: 345). Terjadinya
warna biru kehitaman menunjukkan adanya tanin galat sedang warna hijau
kehitaman menunjukkan adanya tanin katekol (Tri Utami Putri (2014: 18 - 19)
dalam Ayu Sulung, 2016: 67).
4. Uji Aktivitas Antioksidan
Pengujian aktivitas antioksidan menggunakan metode FTC.
Langkah-langkahnya sebagai berikut:
a. Persiapan larutan sampel uji
Larutan induk ekstrak etanol daun pandan wangi 1 % mg/mL (b/v)
mL etanol 96% p.a). Lalu membuat variasi konsentrasi dari ekstrak etanol daun
pandan wangi 0,01% (b/v); 0,05% (b/v); dan 0,1% (b/v).
b. Pembuatan larutan blanko, kontrol negatif, dan kontrol positif
Larutan blanko adalah larutan yang seluruh komponennya sama dengan
larutan sampel, tetapi larutan sampel diganti dengan akuades. Sebelum
membuat kontrol positif, terlebih dahulu dibuat larutan induk tanin, yaitu
melarutkan 1 gram kristal tanin dalam 100 mL etanol p.a hingga batas.
Selanjutnya dari larutan induk tanin tersebut dibuat larutan tanin dengan
konsentrasi 0,05%. Setelah larutan tanin 0,05% jadi, maka diambil 4 mL dan
ditambah 4,1 mL minyak kelapa krengseng 2,51% dalam etanol p.a, juga 8 mL
buffer fosfat 0,05 M dan 3,9 mL akuades. Sebagai kontrol negatif adalah 4,1
mL minyak kelapa krengseng 2,51% dalam etanol p.a, ditambahkan 8 mL
buffer fosfat 0,05 M (pH 7) dan 3,9 mL akuades.
c. Penentuan panjang gelombang maksimum kontrol negatif
Penentuan panjang gelombang yang menghasilkan serapan maksimum
diukur pada rentang panjang gelombang antara 400 – 550 nm dengan
mengukur absorbansi dari larutan kontrol negatif yang telah direaksikan
dengan reagen hingga terbentuk kompleks berwarna merah [Fe(SCN)6]3-.
Mula-mula mengambil 0,1 mL larutan kontrol negatif kemudian
menambahkan 9,7 mL etanol 96% p.a dan 0,1 mL NH4SCN 30%, dikocok
mL FeSO4 0,02 M yang dilarutkan dalam HCl 3,5% dikocok hingga homogen
dan didiamkan selama 6 menit. Tepat 6 menit setelah penambahan FeSO4,
dilakukan pengukuran dengan menggunakan Spektrosfotometer UV-20 sampai
diperoleh panjang gelombang pada serapan maksimum.
d.Penentuan waktu kestabilan kontrol positif
Waktu kestabilan, yaitu waktu yang menghasilkan absorbansi yang
stabil dari larutan yang sebelumnya digunakan untuk penentuan panjang
gelombang maksimum. Untuk menentukan jangka waktu larutan yang
menghasilkan absorbansi stabil, pengukuran absorbansi dilakukan terhadap
larutan kontrol positif pada panjang gelombang maksimum selama 20 menit
dengan selang waktu pengukuran setiap 1 menit. Waktu kestabilan ditetapkan
berdasarkan absorbansi yang tetap (stabil) pada selang waktu tertentu yang
telah digunakan untuk pengukuran absorbansi tersebut.
e. Pengujian aktivitas antioksidan (Yondra, Christine, dan Hilwan, 2014:363)
Setiap sampel ekstrak etanol daun pandan wangi pada berbagai variasi
konsentrasi diambil 4 mL (dilakukan secara triplo), lalu ditambahkan 4,1 mL
minyak krengseng 2,51% dalam etanol p.a, 8 mL buffer fosfat 0,05 M, dan 3,9
mL akuades. Kemudian diinkubasi pada suhu 55°C selama 24 jam. Setelah itu
diambil sebanyak 0,1 mL dan ditambahkan 9,7 mL etanol p.a, 0,1 mL NH4SCN
30% dan dihomogenkan, lalu didiamkan selama 3 menit. Setelah itu
ditambahkan 0,1 mL FeSO4 0,02 M dalam HCl 3,5% dan kembali
maksimum dan waktu kestabilan. Setiap sampel diukur kembali absorbansinya
setelah 24 jam berlalu selama 8 hari. Dengan kata lain, pengukuran absorbansi
sampel pada setiap konsentrasi dilakukan pada 1, 2, 3, 4, 5, 6, 7, dan 8 hari.
F.Teknik Analisis Data
Penelitian ini merupakan penelitian deskriptif untuk mengetahui
kemampuan ekstrak etanol daun pandan wangi dalam menghambat proses oksidasi
pada minyak kelapa krengseng. Melalui prosedur kerja yang telah dilakukan, maka
diperoleh data kualitatif dan kuantitatif senyawa antioksidan dalam ekstrak etanol
daun pandan wangi. Data tersebut selanjutnya digunakan sebagai dasar dalam
perhitungan aktivitas antioksidan ekstrak etanol daun pandan wangi pada berbagai
variasi konsentrasi dan waktu pengujian.
Data yang diperoleh dari uji kuantitatif, yaitu data hasil pengukuran
absorbansi pada uji peroksida dan data persentase penghambatan oksidasi oleh
antioksidan. Aktivitas antioksidan dihitung berdasarkan persentase inhibisi (%I)
oksidasi terhadap kontrol negatif. Semakin besar persentase berkurangnya
absorbansi, maka penghambatan oksidasi akan semakin besar atau kuat. Adapun
perhitungan aktivitas antioksidan dilakukan dengan menggunakan rumus:
% I = A�A− A�
� x %
Keterangan:
% I = Persentase Inhibisi (hambatan) AK = Absorbansi kontrol negatif
Dari data absorbansi yang diperoleh dibuat persamaan regresi linier yang
menyatakan hubungan antara konsentrasi bahan uji (x) dengan aktivitas antioksidan
rata-rata (y) dari sampel ekstrak daun pandan wangi yang terukur sehingga
diperoleh harga IC50 yaitu konsentrasi uji yang dapat menangkap 50% radikal
peroksida dari persamaan: Y = a + bX (Rahmawati et al., 2009: 98)
Untuk penentuan IC50 dapat dihitung dengan menggunakan rumus:
IC50 = 5 − ab
Keterangan:
Y = % aktivitas
a = Intercept (pemotongan garis di sumbu Y) b = Slope (kemiringan)
BAB IV
HASIL DAN PEMBAHASAN A.Hasil Penelitian
1. Preparasi Sampel
Bahan utama yang digunakan dalam penelitian ini adalah pandan wangi
(Pandanus amaryllifolius Roxb.) 500 gram yang diperoleh dari padukuhan
Demangan, Caturtunggal, Depok, Sleman, Yogyakarta pada bulan Juni 2016.
Pandan wangi dibersihkan kemudian dikeringkan dengan oven selama ± 4 jam pada
temperatur 60oC. Daun pandan wangi yang telah kering dipotong kecil-kecil dengan
ukuran 3 x 3 cm lalu dihaluskan menggunakan blender dan hasilnya berupa serbuk
daun pandan wangi sebanyak 146 gram.
2. Ekstraksi Daun Pandan Wangi dengan Metode Maserasi
Ekstraksi senyawa antioksidan pada daun pandan wangi dilakukan dengan
metode maserasi. Maserasi dilakukan dengan memasukkan 40 gram serbuk daun
pandan wangi ke dalam jerigen dan menambahkan pelarut etanol 96% sebanyak
400 mL. Selanjutnya hasil ekstraksi daun pandan wangi dipekatkan menggunakan
evaporator hingga diperoleh ekstrak kental sebanyak 8,31 gram.
3. Screening Fitokimia
Pemeriksaan adanya kandungan flavonoid dilakukan dengan menggunakan
metode wilstatter, yaitu ke dalam isolat ditambahkan 4 tetes HCl pekat dan
potongan logam Mg. Sedangkan untuk menguji adanya kandungan polifenol
Tabel 3. Hasil Uji Fitokimia Ekstrak Etanol Daun Pandan Wangi
Uji Fitokimia Pereaksi Perubahan Warna Hasil Uji
Flavonoid Mg-HCl Kuning tua – jingga +
Polifenol FeCl3 Hijau Kehitaman +
4. Penentuan Panjang Gelombang Maksimum Kontrol Negatif
Penentuan panjang gelombang maksimum ditentukan dengan mengukur
absorbansi larutan kontrol negatif pada rentang panjang gelombang 400 - 550 nm.
Data panjang gelombang maksimum ditunjukkan pada Tabel 4.
Tabel 4. Data Penentuan Panjang Gelombang Maksimum
Berdasarkan data tersebut menunjukkan absorbansi maksimum diperoleh
pada panjang gelombang 490 nm, sehingga panjang gelombang tersebut ditetapkan
sebagai panjang gelombang maksimum yang akan digunakan untuk pengukuran
absorbansi larutan-larutan berikutnya.
5. PenentuanWaktu Kestabilan Kontrol Posotif pada גmaks
Setelah panjang gelombang maksimum ditentukan, selanjutnya dilakukan
penentuan waktu kestabilan. Dalam hal ini menggunakan larutan kontrol positif
(larutan kontrol negatif dengan penambahan tanin) pada panjang gelombang
Panjang Gelombang (nm) Absorbansi Panjang Gelombang (nm) Absorbansi
400 0.128 480 0.226
410 0.132 490 0.239
420 0.137 500 0.233
430 0.142 510 0.224
440 0.154 520 0.212
450 0.165 530 0.197
460 0.189 540 0.186
[image:39.595.112.525.331.470.2]maksimum (490 nm), dimana absorbansi diukur setiap selang waktu 1 menit hingga
diperoleh data absorbansi yang stabil. Data tersebut diambil pada hari ke-0
(sebelum diinkubasi). Adapun hasil pengukuran absorbansi pada berbagai waktu
[image:40.595.147.478.234.395.2]dapat disajikan pada Tabel 5 berikut ini.
Tabel 5. Data Penentuan Waktu Kestabilan
Waktu (menit) Absorbansi Waktu (menit) Absorbansi
1 0.239 11 0.298
2 0.255 12 0.298
3 0.273 13 0.298
4 0.283 14 0.301
5 0.286 15 0.303
6 0.288 16 0.305
7 0.295 17 0.302
8 0.298 18 0.304
9 0.298 19 0.307
10 0.298 20 0.302
Berdasarkan data diatas menunjukkan harga absorbansi yang stabil dari
menit ke-8 sampai ke-13. Selanjutnya dalam penelitian ini ditetapkan waktu
kestabilan pada menit ke-10 sebagai acuan pengukuran absorbansi pada uji
antioksidan.
6. Penentuan Aktivitas Antioksidan Ekstrak Etanol Daun Pandan Wangi
Tahap selanjutnya adalah menentukan aktivitas antioksidan ekstrak etanol
daun pandan wangi (pandanus amiryllifolius Roxb.) dengan menggunakan metode
FTC. Data absorbansi larutan kontrol negatif, kontrol positif, dan ekstrak etanol
daun pandan wangi ditunjukkan pada Lampiran 4.Data rata-rata absorbansi larutan
kontrol negatif, kontrol positif, dan ekstrak etanol daun pandan wangi ditunjukkan
Tabel 6. Data Absorbansi Rata-rata Larutan Kontrol, Kontrol Positif, dan Ekstrak Etanol Daun Pandan Wangi.
Larutan Absorbansi Rata-rata Hari Ke -
0 1 2 3 4 5 6 7 8
Kontrol (-) 0.180 0.288 0.338 0.299 0.336 0.377 0.428 0.485 0.586 Kontrol (+) 0.155 0.167 0.193 0.183 0.237 0.242 0.295 0.357 0.488 A 0.123 0.144 0.134 0.158 0.182 0.255 0.300 0.348 0.426 B 0.118 0.135 0.127 0.138 0.178 0.237 0.274 0.323 0.384 C 0.109 0.116 0.124 0.12 0.184 0.214 0.259 0.297 0.368
Keterangan:
A : Ekstrak etanol daun pandan wangi konsentrasi 0,01 mg/mL B : Ekstrak etanol daun pandan wangi konsentrasi 0,05 mg/mL C : Ekstrak etanol daun pandan wangi konsentrasi 0,1 mg/mL Kontrol (-) : Larutan minyak tanpa penambahan antioksidan (4,1 mL minyak
kelapa krengseng 2,51% (v/v) dalam etanol 96%, 8 mL buffer
fosfat (pH 7) 0,05 M dan 3,9 mL akuades)
Kontrol (+) : Ekstrak etanol tanin 0,05 mg/mL (4 mL ekstrak etanol tanin, 4,1 mL minyak kelapa krengseng 2,51% (v/v) dalam etanol 96%, 8
mL buffer fosfat (pH 7) 0,05 M dan 3,9 mL akuades)
Data absorbansi rata-rata tersebut digunakan untuk menghitung besarnya
aktivitas antioksidan yang dinyatakan sebagai persen inhibisi oksidasi terhadap
kontrol negatif ditunjukkan pada Lampiran 6. Adapun hasil perhitungan
[image:41.595.113.526.128.246.2]ditunjukkan pada pada Tabel 7.
Tabel 7. Data Persentase Penghambatan Oksidasi Minyak Kelapa Krengseng
Larutan Persentase Penghambatan Oksidasi Hari Ke -
0 1 2 3 4 5 6 7 8
Kontrol (+) 13.73 41.9 42.94 38.91 29.37 35.78 30.94 26.44 16.73 A 31.73 50.12 60.32 47.16 45.73 32.33 29.77 28.37 27.21 B 34.32 53.13 62.49 53.96 47.02 37.19 35.85 33.45 34.43 C 39.52 59.84 63.38 59.75 45.14 43.29 39.36 38.74 37.22
Keterangan:
B : Ekstrak etanol daun pandan wangi konsentrasi 0,05 mg/mL C : Ekstrak etanol daun pandan wangi konsentrasi 0,1 mg/mL Kontrol (+) : Ekstrak etanol tanin 0,05 mg/mL (4 mL ekstrak etanol tanin, 4,1
mL minyak kelapa krengseng 2,51% (v/
v) dalam etanol 96%, 8
mL buffer fosfat (pH 7) 0,05 M dan 3,9 mL akuades)
B.Pembahasan 1. Preparasi Sampel
Bahan uji yang digunakan untuk penelitian ini adalah daun pandan wangi
yang diperoleh dari padukuhan Demangan, Caturtunggal, Depok, Sleman,
Yogyakarta. Pemilihan pandan wangi didasarkan pada kebiasaan masyarakat yang
lebih banyak menggunakan pandan wangi dalam kehidupan sehari-hari
dibandingkan dengan pandan jenis lainnya.
Mula-mula daun pandan wangi yang digunakan untuk kebutuhan penelitian
dipilih, lalu dibersihkan dan dikeringkan menggunakan oven pada suhu 60oC
selama ± 4 jam. Pengeringan ini bertujuan untuk menghilangkan kadar air yang ada
pada daun pandan wangi. Setelah dikeringkan daun pandan wangi dihaluskan
menggunakan blender. Proses tersebut dilakukan supaya zat aktif yang terkandung
dalam daun pandan wangi dapat terekstraksi dengan baik. Serbuk daun pandan
wangi yang diperoleh sebanyak 146 gram.
2. Ekstraksi Daun Pandan Wangi dengan Metode Maserasi
Metode ekstraksi yang digunakan pada penelitian ini adalah metode
maserasi. Metode maserasi dipilih karena metode ini tidak menggunakan
pemanasan, sehingga bahan alam tidak terurai dan tidak mengalami kerusakan.
Pelarut yang digunakan untuk mengekstraksi senyawa antioksidan pada
sifatnya yang mampu melarutkan hampir semua zat, baik yang bersifat polar, semi
polar, dan non polar. Selain itu etanol dipilih sebagai pelarut dalam penelitian ini
karena bersifat sebagai penyaring yang lebih selektif, dan tidak beracun.
Pertimbangan lainnya bahwa penggunaan etanol sebagai pelarut tidak berbahaya
untuk dikonsumsi.
Langkah awal dalam penentuan aktivitas antioksidan ekstrak etanol daun
pandan wangi adalah mengambil serbuk daun pandan wangi sebanyak 40 gram
dimasukkan ke dalam jerigen kemudian ditambahkan etanol p.a 96% sebanyak 200
mL. Serbuk yang telah bercampur dengan pelarut dimaserasi selama 24 jam pada
suhu ruangan. Proses maserasi akan menghasilkan filtrat dan residu. Filtrat yang
dihasilkan kemudian disaring. Sedangkan residu yang dihasilkan dimaserasi
kembali dengan pelarut etanol 96% 200 mL. Lalu residu dan filtrat dicampurkan
sehingga dihasilkan warna hijau pekat sebanyak 400 mL. Filtrat yang diperoleh
kemudian dievaporasi untuk menguapkan etanolnya, sehingga yang tersisa hanya
ekstrak daun pandan wangi. Dalam hal ini ekstrak yang diperoleh sebanyak 8,31
gram.
3. Screening Fitokimia
Screening Fitokimia ini bertujuan untuk mengetahui ada tidaknya
kandungan flavonoid dan polifenol dalam ekstrak daun pandan wangi.
a. Identifikasi Senyawa Polifenol
Ada tidaknya kandungan senyawa polifenol dalam ekstrak etanol daun
pandan wangi dilakukan dengan penambahan pereaksi FeCl3. Hasil yang
mengandung senyawa polifenol dengan memberikan warna hijau kehitaman.
Sedangkan untuk tanin sebagai pembandingnya menunjukkan warna biru
kehitaman. Terjadinya warna biru kehitaman menunjukkan adanya tanin galat
(tanin terhidrolisis) sedang warna hijau kehitaman menunjukkan adanya tanin
katekol (tanin terkondensasi). Maka tanin yang terdapat pada ekstrak etanol
daun pandan wangi adalah tani terkondensasi. Terbentuknya warna tersebut
dikarenakan polifenol bereaksi dengan ion Fe3+ membentuk senyawa kompleks
(Widiastuti Agustina, et al., 2011: 276). Reaksi polifenol dengan FeCl3
[image:44.595.152.469.333.504.2]ditunjukkan pada Gambar 12.
Gambar 12. Reaksi antara Polifenol dengan FeCl3
b. Identifikasi senyawa flavonoid
Mg dan HCl pada uji ini bereaksi membentuk gelembung-gelembung
yang merupakan gas H2, sedangkan logam Mg dan HCl pekat pada uji ini
berfungsi untuk mereduksi inti benzopiron yang terdapat pada struktur
flavonoid, sehingga terbentuk perubahan warna menjadi merah atau jingga
(Harbone, 1987 dalam Widiastuti Agustina, et al., 2011: 275). Jika dalam suatu
saat penambahan logam Mg dan HCl yang berwarna jingga dengan reaksi
[image:45.595.167.458.143.310.2]seperti Gambar 13.
Gambar 13. Mekanisme Pembentukan Garam Flavilium
Pada identifikasi flavonoid menggunakan metode wilstatter
menunjukkan warna jingga pada sampel ekstrak etanol daun pandan wangi
yang berarti positif terhadap flavonoid. Sedangkan pembandingnya, yaitu tanin
yang diujikan menggunakan metode wilstatter menunjukkan perubahan warna
dari kuning menjadi putih jernih yang berarti tidak menunjukkan adanya
senyawa flavonoid. Maka dalam sampel ekstrak etanol daun pandan wangi
mengandung senyawa lain selain tanin, yaitu flavonoid.
4. Penentuan Panjang Gelombang Maksimum Kontrol Negatif
Tahap awal analisis kuantitatif dalam penelitian ini, yaitu menentukan
panjang gelombang maksimum yang akan digunakan dalam pengukuran. Panjang
gelombang maksimum ditentukan dengan cara mengukur absorbansi larutan
nm menggunakan metode FTC. Grafik hubungan antara absorbansi dengan panjang
[image:46.595.125.505.138.315.2]gelombang ditunjukkan pada Gambar 14.
Gambar 14. Grafik Hubungan Panjang Gelombang dengan Absorbansi
Berdasarkan grafik tersebut menunjukkan bahwa absorbansi terbesar terjadi
pada puncak kurva, yaitu pada panjang gelombang 490 nm dengan absorbansi
sebesar 0,239. Selanjutnya panjang gelombang maksimum (גmaks) 490 nm tersebut
digunakan untuk mengukur absorbansi pada penelitian selanjutnya.
5. Penentuan Waktu Kestabilan Kontrol Positif pada גmaks
Penentuan waktu kestabilan ditentukan dengan cara mengukur absorbansi
larutan kontrol positif pada panjang gelombang maksimum (490 nm) dimulai dari
menit ke-1 sampai menit ke-20. Pengukuran absorbansi dilakukan setiap selang 1
menit, mulai dari 1 menit setelah penambahan FeCl3 0,02 M dalam HCl 3,5%
sebanyak 0,1 mL.
Hasil pengukuran menunjukkan kestabilan dimulai dari pada menit ke-8
hingga menit ke-13, namun dalam penelitian ini ditetapkan menit ke-10 sebagai
waktu kestabilan yang digunakan pada penelitian selanjutnya. Penentuan kestabilan 0
0,03 0,06 0,09 0,12 0,15 0,18 0,21 0,24 0,27 0,3
0 70 140 210 280 350 420 490 560
A
b
so
rb
an
si
ini bertujuan untuk mengetahui kapan waktu larutan menunjukkan absorbansi
stabil, sehingga dengan kestabilan ini diharapkan absorbansi senyawa yang diukur
tidak mengalami penurunan maupun penaikan absorbansi. Grafik hubungan antara
[image:47.595.123.499.195.367.2]waktu dan absorbansi yang terukur ditunjukkan pada Gambar 15.
Gambar 15. Grafik Hubungan Waktu dengan Absorbansi pada גmaks
6. Penentuan Aktivitas Antioksidan Ekstrak Etanol Daun Pandan Wangi
Pengujian aktivitas antioksidan yang terkandung dalam ekstrak etanol daun
pandan wangi menggunakan minyak kelapa krengseng sebagai substrat. Pengujian
dilakukan dengan cara membandingkan antara proses oksidasi minyak kelapa
krengseng tanpa dan dengan penambahan ekstrak etanol daun pandan wangi. Proses
oksidasi tanpa ekstrak etanol daun pandan wangi bertindak sebagai kontrol negatif.
Pengujian dilakukan dengan menggunakan metode FTC. Penggunaan metode ini
dengan pertimbangan karena mudah dilakukan, akurat, dan menggunakan alat
sederhana.
Prinsip pengujian ini adalah pembentukan senyawa radikal bebas dari
oksidasi minyak kelapa pada proses autooksidasi yang dihambat karena adanya 0
0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4
1 3 5 7 9 11 13 15 17 19 21 23
A
b
so
rb
an
si
senyawa antioksidan yang berasal dari ekstrak etanol daun pandan wangi tersebut.
Besarnya penghambatan oksidasi yang terjadi dapat ditentukan dengan
membandingkan absorbansi larutan kontrol negatif terhadap larutan sampel ekstrak
etanol daun pandan wangi dengan konsentrasi berturut-turut 0,01% mg/mL, 0,05%
mg/mL, dan 0,1% mg/mL.
Dalam penelitian ini juga digunakan kontrol positif, yaitu larutan yang
mengandung tanin 0,05% mg/mL. Adapun kegunaan dari larutan kontrol positif ini
adalah untuk mengetahui bahwa pada larutan sampel yang diduga mengandung
senyawa polifenol (tanin) dengan perbandingan absorbansi yang minimal sama
dengan absorbansi kontrol positif atau lebih besar yang disebabkan kemungkinan
adanya antioksidan lain dalam ekstrak etanol daun pandan wangi selain tanin.
Pengujian dilakukan selama 8 hari dengan menginkubasi kontrol negatif,
kontrol positif, dan sampel dalam berbagai variasi konsentrasi pada suhu 55oC.
Suhu 55oC dipilih karena pada suhu tersebut minyak kelapa dapat mengalami
oksidasi (Ketaren, 2008: 139). Absorbansi yang terukur dari hari ke-0 hingga hari
ke-8 mengalami kenaikan yang tajam. Hal ini menandakan bahwa proses
autooksidasi yang terjadi pada minyak kelapa krengseng yang diinkubasi pada suhu
55oC bertambah setiap hari.
Penambahan ekstrak etanol daun pandan wangi dan tanin menyebabkan
penurunan nilai absorbansi apabila dibandingkan dengan larutan kontrol tanpa
penambahan ekstrak etanol daun pandan wangi dan tanin.
Berdasarkan hasil pengujian yang telah dilakukan, absorbansi rata-rata dari
dan kontrol positif setiap 24 jam ditunjukkan pada Tabel 6. Grafik hubungan antara
[image:49.595.113.485.139.339.2]absorbansi rata-rata terukur dengan lama pengujian ditunjukkan pada Gambar 16.
Gambar 16. Grafik Hubungan Absorbansi Rata-rata Larutan Kontrol (-), Kontrol (+), dan Ekstrak Etanol Daun Pandan Wangi dengan Lama Penyimpanan (Hari)
Semakin besar konsentrasi ekstrak etanol daun pandan wangi yang
ditambahkan pada pengujian aktivitas antioksidan menunjukkan hasil absorbansi
semakin kecil. Dengan kata lain semakin besar konsentrasi, maka semakin besar
pula aktivitas antioksidannya. Nilai absorbansi yang dihasilkan dari hari ke hari
akan semakin meningkat seiring bertambahnya waktu inkubasi yang dilakukan.
Hal ini terjadi karena proses autooksidasi pada minyak kelapa terus
menghasilkan senyawa radikal peroksida. Radikal peroksida dengan adanya
oksigen tunggal (On) akan membentuk hidroperoksida (ROOH) dalam suasana
asam. Oksigen tunggal (On) ini dapat mengoksidasi ion besi(II) menjadi ion
besi(III) yang apabila ada ammonium tiosianat (NH4SCN) akan membentuk
kompleks [Fe(SCN)6]3- yang berwarna merah.
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45 0,5 0,55 0,6
0 1 2 3 4 5 6 7 8 9 10
A b so rb an si Hari
Kontrol Kontrol (+) A (0,01% mg/mL)
Semakin banyak hidroperoksida yang terbentuk dari radikal minyak kelapa,
maka oksigen tunggal (On) yang dihasilkan semakin banyak pula. Dengan demikian
oksidasi ion besi(II) menjadi ion besi(III) juga semakin banyak, sehingga kompleks
yang terbentuk semakin banyak. Peristiwa ini ditunjukkan dengan nilai absorbansi
[image:50.595.115.509.221.529.2]yang semakin besar seiring berjalannya waktu penyimpanan.
Gambar 17. Mekanisme Penghambatan Asam Oleat dengan Metode Tiosianat (Ayu Sulung, 2016: 36)
Antioksidan flavonoid dan polifenol yang terdapat pada ekstrak etanol daun
pandan wangi akan menghambat oksidasi dari minyak kelapa dengan melepaskan
atom hidrogen dari salah satu cincinnya, sehingga menimbulkan radikal flavonoid
tersebut relatif stabil dan tidak reaktif karena adanya efek stabilisasi dari inti
aromatis flavonoid dan polifenol.
Semua larutan uji yang digunakan dalam penelitian ini memiliki aktivitas
antioksidan sebagai penghambat reaksi oksidasi minyak kelapa. Persentase
penghambatan rata-rata oksidasi minyak kelapa oleh ekstrak etanol daun pandan
[image:51.595.113.483.273.473.2]wangi dan tanin sebagai pembanding dengan metode FTC ditunjukkan pada
Gambar 18.
Gambar 18. Grafik Hubungan Persentase Penghambatan Oksidasi Rata-rata Minyak Kelapa oleh Ekstrak Etanol Daun Pandan Wangi dan Tanin pada Berbagai Waktu Penyimpanan
Data yang diperoleh tersebut didapatkan dari nilai rata-rata hasil persentase
dari tiap ekstrak dan tanin (sebagai kontrol positif) dengan menggunakan
persamaan:
% I = A�A− A�
� x %
Absorbansi yang diperoleh digunakan untuk menghitung persen inhibisi
menggunakan rumus diatas. Kemudian dilakukan regresi antara % I dengan 0 8 16 24 32 40 48 56 64 72
0 1 2 3 4 5 6 7 8 9
A b so rb an si Hari
konsentrasi ekstrak etanol daun pandan wangi. Hasilnya diperoleh kurva baku
dengan persamaan Y= a+bX. Dimana a adalah intersep, dan b adalah slope, yang
selanjutnya dihitung nilai IC50 menggunakan rumus.
IC50 = 5 − ab
Berdasarkan hasil perhitungan persentase inhibisi oksidasi minyak kelapa
pada Lampiran 7 menunjukkan bahwa ekstrak etanol daun pandan wangi 0,1 %
mg/mL memiliki aktivitas antioksidan yang paling besar dibandingkan dengan
aktivitas antioksidan ekstrak etanol daun pandan wangi 0,05 % mg/mL, 0,01 %
mg/mL dan tanin 0,05 % mg/mL. Hasil tersebut menunjukkan bahwa dalam ekstrak
etanol daun pandan wangi tidak hanya mengandung senyawa tanin namun terdapat
senyawa antioksidan lain, yaitu flavonoid. Ketaren (2008: 134), menyatakan
ekfektivitas antioksidan dapat ditingkatka