i
OPTIMASI KOMPOSISI DAN KECEPATAN ALIR FASE GERAK SISTEM KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) FASE TERBALIK
PADA PENETAPAN KADAR NIKOTIN DALAM ROKOK “MEREK X” MENGGUNAKAN STANDAR INTERNAL ASETANILIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Eric Antonius NIM : 098114108
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
ii
Persetujuan Pembimbing
OPTIMASI KOMPOSISI DAN KECEPATAN ALIR FASE GERAK SISTEM
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) FASE TERBALIK
PADA PENETAPAN KADAR NIKOTIN DALAM ROKOK “MEREK X”
MENGGUNAKAN STANDAR INTERNAL ASETANILIDA
Skripsiyang diajukan oleh: Eric Antonius NIM : 098114108
telah disetujui oleh
Pembimbing Utama
iii
Pengesahan Skripsi berjudul
OPTIMASI KOMPOSISI DAN KECEPATAN ALIR FASE GERAK SISTEM KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) FASE TERBALIK
PADA PENETAPAN KADAR NIKOTIN DALAM ROKOK “MEREK X” MENGGUNAKAN STANDAR INTERNAL ASETANILIDA
Oleh : Eric Antonius NIM : 098114108
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma Pada tanggal : 22 Februari 2013
iv
HALAMAN PERSEMBAHAN
Kehidupan terkadang menyakitkan saat kita tahu kebenarannya. Cinta terkadang menyakitkan saat kita tahu kejujurannya.
Pengetahuan terkadang menyakitkan saat kita tidak mampu meraihnya.
Tekad terkadang menjadi arang saat kegagalan melanda. TETAPI
Kehidupan terkadang menyenangkan saat kita mampu menghadapinya.
Cinta terkadang membahagiakan saat kita tahu pengorbanannya.
Pengetahuan terkadang menghibur saat kita mampu mendapat solusinya.
Tekad menjadi batu karang saat kita berani menggenapinya. BERMIMPILAH dan BERUSAHALAH
Kesuksesan merupakan buah kemauan yang dilakukan berulang kali dengan sepenuh hati.
Karya ini kudedikasikan untuk orang tuaku, kekasih hatiku, teman-temanku dan almamaterku.
“You have to dream before your dreams can come true.” – Abdul Kalam
“Anyone who has never made a mistake has never tried anything new” – Albert Einstein
“Life is just liked a tunnel, we don’t know when we will out of that tunnel, keep going ‘till we get our purpose.. Success is when we out of
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya susun ini tidak memuat karya atau bagian dari pekerjaan orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya sebuah karya ilmiah.
Apabila dikemudian hari ditemukan adanya indikasi plagiarisme dalam naskah yang saya susun ini, maka saya bersedia menanggung segala resiko dan sanksi sesuai dengan peraturan perundang-undangan yang berlaku.
Yogyakarta, 18 Februari 2013 Penulis,
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama : Eric Antonius
Nomor Mahasiswa : 09811410
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Sanata Dharma karya ilmiah yang berjudul:
“OPTIMASI KOMPOSISI DAN KECEPATA ALIR FASE GERAK SISTEM KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) FASE TERBALIK
PADA PENETAPAN KADAR NIKOTIN DALAM ROKOK “MEREK X” MENGGUNAKAN STANDAR INTERNAL ASETANILIDA”
Beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikannya secara terbatas, dan mempubliksaikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Dengan demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 18 Februari 2013 Yang menyatakan
vii
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas cinta kasih, berkat, ijin dan peryertaan-Nya yang begitu besar, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Optimasi Metode Kromatografi Cair Kinerja Tinggi (Kckt) Fase Terbalik Pada Penetapan Kadar Nikotin Dalam Rokok “Merek X” Menggunakan
Standar Internal Asetanilida” sebagai salah satu syarat yang harus dipenuhi demi memperoleh gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa penelitian dan penyusunan skripsi ini dapat terselesaikan karena adanya masukan, kritikan, diskusi, arahan, saran, dan bimbingan dari berbagai pihak. Penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Ipang Djurnarko, M.Sc., Apt. Selaku Dekan Fakultas Farmasi Uninversitas Sanata Dharma Yogyakarta atas teladan seorang pemimpin yang diberikan
viii
3. Christine Patramurti, M.Si., Apt. selaku dosen pembimbing di laboratorium dan teman selama penelitian skripsi yang telah memberikan masukan, diskusi, saran, dan dukungan moral kepada penulis selama penelitian skripsi ini.
4. Jeffry Julianus, M.Si. selaku dosen penguji yang memberikan banyak kritik dan saran yang membangun untuk skripsi ini.
5. Prof. Dr. Sri Noegrohati, Apt. selaku dosen penguji yang memberikan banyak kritik dan saran yang membangun untuk skripsi ini.
6. C.M.Ratna Rini Nastiti, M.Pharm., Apt. sebagai Kaprodi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta atas teladan kepemimpinan, masukan, dan saran yang diberikan selama penulis berkuliah dan menyusun naskah.
7. Rini Dwi Astuti, M.Sc., Apt. sebagai Kepala Laboratorium Fakultas Farmasi Universitas Sanata Dharma Yogyakarta
8. Prof. Dr. Sudibyo Martono, M.S., Apt. atas waktu yang diluangkan untuk memberikan sedikit masukan diawal penelitian
9. Bimo Adithya, Suparlan, dan Kunto dan segenap staf laboran yang senantiasa siap membantu dan meluangkan waktunya dalam penyediaan bahan dan alat selama penelitian.
10.Semua dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma atas pengalaman, masukan, keceriaan, semangat, dan persahabatan yang diberikan. 11.Demas dan Is Sumitro sebagai rekan kerja dalam penelitian skripsi ini. Terima
ix
12.Lucia Shinta R, Sisilia Mirsya A, Metri S.K., Agnes Mutiara, Victor Purnama Agung, dan Novia Sarwoningtyas sebagai teman seperjuangan dalam satu lantai Laboratorium Analisis Instrumental. Terima kasih atas diskusi, canda tawa, semangat selama kita bekerja bersama-sama.
13.Yenni Soenardi Tjokro terima kasih atas perhatian, kasih sayang, semangat, dan dukungannya yang diberikan selama penelitian yang dilakukan.
14.Sihendra Ze selaku kakak dan teman berbagai cerita selama penyusunan naskah skripsi, terima kasih atas masukan dan kritik yang diberikan.
15.Fendy, Joe dan Kenny selaku sahabat, teman berbagi cerita dan teman seperjuangan atas semangat, diskusi, canda tawa yang diberikan selama penulis berkuliah di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
16.Teman-teman “Konco Dolan”, terima kasih atas dukungannya dan canda tawa yang diberikan selama penelitian.
17.Teman angkatan 2009 yang bersama-sama berjuang dan mengisi sebagian cerita hidupku, terima kasih atas kebersamaan, diskusi, dan bantuan selama perkuliahan. 18.Semua pihak yang tidak dapat disebutkan satu persatu, atas segala bantuan,
semangat dan doa yang menyertai penulis dari awalnya penelitian hingga diselesaikannya penulisan skripsi ini.
x
yang berarti bagi para pembaca. Akhir kata, penulis mempersembahkan skripsi ini demi majunya ilmu pengetahuan farmasi.
Yogyakarta, 18 Februari 2013
xii
BAB II PENELAAHAN PUSTAKA... 6
A. Rokok... 6
B. Nikotin... 7
C.Ekstrak Tumbuhan... 9
D.Spektrofotometri UV... 10
E. Kromatografi Cair Kinerja Tinggi (KCKT)... 14
1. Definisi dan Instrumentasi KCKT... 14
2. Optimasi Metode... 23
3. Pemisahan Puncak Dalam Kromatografi... 24
F. Standar Internal... 34
G.Landasan Teori... 36
H.Hipotesis... 36
BAB III METODE PENELITIAN... 38
A. Jenis dan Rancangan Penelitian... 38
B. Variabel Penelitian... 38
1. Variabel Bebas... 38
2. Variabel Tergantung... 38
3. Varianel Pengacau Terkendali... 38
C. Definisi Operasional... 39
D. Bahan Penelitian... 39
xiii
F. Tata Cara Penelitian... 40
1. Pembuatan Fase Gerak... 40
2. Pembuatan Larutan Internal Standar Asetanilida... 41
3. Pembuatan Larutan Baku Nikotin... 41
4. Preparasi Sampel... 42
5. Penentuan Panjang Gelombang Pengamatan Nikotin dan Asetanilida... 44
6. Optimasi Metode KCKT Fase Terbalik... 44
G. Analisis Hasil... 45
1. Bentuk Peak... 45
2. Retention time (tR)... 46
3. Resolusi (Rs)... 46
4. HETP... 46
5. Reprodusibilitas retention time... 46
BAB IV HASIL DAN PEMBAHASAN... 47
A.Penentuan Fase Gerak... 47
B. Pembutan Seri Larutan Baku Nikotin dan Asetanilida... 49
C.Preparasi Sampel... 50
D.Penentuan Panjang Gelombang Pengamatan Nikotin dan Asetanilida... 53
xiv
BAB V KESIMPULAN DAN SARAN... 75
A.Kesimpulan... 75
B.Saran... 75
DAFTAR PUSTAKA... 76
LAMPIRAN... 80
xv
DAFTAR TABEL
Tabel I. Ringkasan Sifat/Karakteristik yang dimiliki nikotin... 8 Tabel II. Deret elutropik dan indeks polaritas beberapa pelarut KCKT... 19 Tabel III. Komposisi fase gerak yang dibuat dalam penelitian... 40 Tabel IV. Perbandingan panjang gelombang maksimum nikotin hasil
pengukuran terhadap panjang gelombang maksimum teoritis... 55 Tabel V. Perbandingan panjang gelombang maksimum asetanilida hasil
pengukuran terhadap panjang gelombang maksimumteoritis... 57 Tabel VI. Perbandingan komposisi fase gerak dan indeks polaritas
masing-masing komposisi fase gerak... 63 Tabel VII. Hasil optimasi peak baku nikotin dan asetanilida pada berbagai
komposisi fase gerak dan kecepatan alir... 65 Tabel VIII. Perbandingan hasil parameter optimasi baku nikotin dan
asetanilida dengan fase gerak metanol : ammonium asetat 10 mM + TEA 0,1%... 70 Tabel IX. Tekanan pompa pada berbagai komposisi fase gerak dan
kecepatan alir... 71 Tabel X. Hasil perhitungan CV nilai retention time larutan baku nikotin
xvi
Tabel XI. Hasil perhitungan CV nilai retention time larutan baku asetanilida dengan fase gerak metanol : ammonium asetat 10mM + TEA 0,1% (70:30) pada kecepatan alir 1,0 mL/min... 72 Tabel XII. Hasil perhitungan CV nilai retention time larutan sampel dan
sampel yang ditambahkan adisi nikotin sebanyak 20 µg/mL dengan fase gerak metanol : ammonium asetat 10mM + TEA 0,1% (70:30) pada kecepatan alir 1,0 mL/min... 73 Tabel XIII. Hasil perhitungan CV resolusi sampel dengan fase gerak metanol
xvii
DAFTAR GAMBAR
Gambar 1. Struktur nikotin (3-(1-metil-pirolodinil)pirindin)... 7 Gambar 2. Struktur dari macam alkaloid yang terdapat dalam tembakau... 9 Gambar 3. Diagram tingkat energi elektronik... 11 Gambar 4. (A) Pengaruh pelarut polar terhadap – transisi π → π* dan (B) –
transisi n → π*... 13
Gambar 5. Dasar pemisahan kromatografi partisi... 15 Gambar 6. Skema instrumentasi KCKT... 16 Gambar 7. Skema sampler KCKT. (A) – posisi load, sampel diinjeksikan
dan terisolasi dari fase gerak. (B) – posisi inject, sampel terbawa fase gerak dan memasuki kolom... 21 Gambar 8. Gambaran peak kromatogram untuk mengukur resolusi... 27 Gambar 9. Ilustrasi gambar yang menyebabkan pelebaran puncak selama
pemisahan menggunakan KCKT. Simbol merepresentasifkan molekul analit sebelum migrasi, simbol menyatakan molekul analit setelah migrasi, dan ---> menyatakan pergerakan dari molekul analit... 29 Gambar 10. Ilustrasi difusi Eddy saat memasukin kolom dan menyebabkan
xviii
Gambar 12. Pengaruh perubahan nilai α, k’, dan N terhadap pemisahan peak
kromatogram... 33 Gambar 13. Penentuan asymmetry factor (As) dan tailing factor (TF)... 34 Gambar 14. Gambaran interaksi yang teerjadi antara TEA dengan sisi silanol
bebas yang tidak tercapping oktil silika... 48 Gambar 15. Nikotin yang berada dalam bentuk terprotonasi diubah menjadi
bentuk molekulnya karena dikondisikan dalam suasana basa dengan penambahan KOH... 51 Gambar 16. Distribusi bentuk nikotin dalam posisi protonated atau
unprotonated berdasarkan variasi pH larutan... 53 Gambar 17. Gambaran struktur nikotin dan kromofor yang dimiliki... 54 Gambar 18. Spektra yang didapatkan dari hasil percobaan dan dibandingkan
dengan sumber acuan. (A) - Spektra teoritis asetanilida. (B) – Spektra pengujian dengan konsentrasi nikotin 0,02 µg/mL. (C) – Spektra pengujian dengan konsentrasi asetanilida 0,03 µg/mL. (D) – Spektra pengujian dengan konsentrasi asetanilida 0,04 µg/mL... 55 Gambar 19. Gambaran struktur asetanilida dan kromofor yang dimilikinya.... 56 Gambar 20. Spektra yang didapatkan dari hasil percobaan dan dibandingkan
xix
Spektra pengujian dengan konsentrasi asetanilida 5 µg/mL. (D) – Spektra pengujian dengan konsentrasi asetanilida 10 µg/mL... 58 Gambar 21. (A) – Perbedaan pengukuran absorbansi pada panjang gelombang
maksimum dan tidak pada panjang gelombang maksimum. (B) – Pengukuran pada panjang gelombang maksimum akan memberikan garis linear. (C) – Pengukuran tidak pada panjang gelombang maksimum memberikan garis yang tidak linear... 60 Gambar 22. A) – Kromatogram baku asetanilida konsentrasi 20 µg/mL. (B) –
Kromatogram baku nikotin konsentrasi 20 µg/mL. Komposisi fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% (60:40) dengan kecepatan alir 0,5 mL/min... 61 Gambar 23. A) – Kromatogram baku nikotin konsentrasi 20 µg/mL. (B) –
Kromatogram baku asetanilida konsentrasi 20 µg/mL. Komposisi fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% (50:50) dengan kecepatan alir 1,0 mL/min... 66 Gambar 24. (A) – Kromatogram baku nikotin konsentrasi 20µg/mL. (B) –
Kromatogram baku asetanilida konsentrasi 20 µg/mL. Komposisi fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% (60:40) dengan kecepatan alir 0,8 mL/min... 67 Gambar 25. (A) – Kromatogram baku nikotin konsentrasi 20µg/mL. (B) –
xx
xxi
DAFTAR LAMPIRAN
Lampiran 1. Certificate of Analysis baku nikotin E.Merck... 80 Lampiran 2. Certificate of Analysis baku asetanilida E.Merck... 81 Lampiran 3. Perhitungan polaritas fase gerak yang dioptimasi... 82 Lampiran 4. Kromatogram hasil optimasi fase gerak metanol : ammonium
asetat + TEA 0,1% (50 : 50)... 83 Lampiran 5. Kromatogram hasil optimasi fase gerak metanol : ammonium
asetat + TEA 0,1% (60 : 40)... 89 Lampiran 6. Kromatogram hasil optimasi fase gerak metanol : ammonium
asetat + TEA 0,1% (70 : 30)... 95 Lampiran 7. Contoh kromatogram sampel dengan fase gerak yang telah
teroptimasi (metanol : ammonium asetat + TEA 0,1% (70:30)).. 101 Lampiran 8. Contoh kromatogram seri baku dengan fase gerak yang telah
xxii
INTISARI
Telah dilakukan penelitian mengenai optimasi komposisi dan kecepatan alir fase gerak sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik pada penetapan kadar nikotin dalam rokok “merek X” menggunakan standar internal asetanilida. Penelitian ini bertujuan untuk menentukan kondisi optimal sistem KCKT fase terbalik sehingga dapat digunakan untuk validasi metode dan penetapan kadar nikotin dalam ekstrak etanolik tembakau rokok.
Penelitian ini merupakan penelitian eksperimental deskriptif. Sistem KCKT fase terbalik yang dipakai dalam penelitian ini menggunakan fase diam oktil silika (C8) dan fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% dengan detektor UV pada panjang gelombang 260 nm. Optimasi dilakukan dengan mengubah komposisi fase gerak 50:50, 60:40, dan 70:30 serta kecepatan alir 0,5; 0,8 dan 1,0 mL/min untuk menentukan bentuk peak, retention time yang efisien, nilai resolusi, nilai tailing factor, dan reprodusibilitas retention time.
Kondisi optimum sistem KCKT fase terbalik hasil optimasi yakni fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% (70:30) pada kecepatan alir 1,0 mL/min. Kondisi ini memenuhi parameter pemisahan yang baik yaitu Rs 3,915; tR nikotin 4,638 menit; TF 1,983 dan tR asetanilida 3,645 menit; TF 1,699.
xxiii
ABSTRACT
A research about optimization of reversed phase High Performance Liquid Chromatography (HPLC) to determine nicotine in cigarette “brand X” using acetanilide as internal standard have been done. The purpose of this research are finding an optimum mobile phase composition and flow rate of reversed phase HPLC system used for method validation and determination levels of nicotine in ethanolic extract of tobacco cigarettes.
This research is conducted with a descriptive experimental design. The reversed phase HPLC system uses in this research using octyl silica (C8) as stationary phase, methanol:ammonium acetate 10 mM + TEA 0.1% as mobile phase, and UV detector at wavelength 260 nm. Optimization is done by changing the composition of the mobile phase 50:50, 60:40 and 70:30 with flow rate at 0.5; 0.8 and 1.0 mL/minute to determine a peak shape, efficient retention time, resolution value, tailing factor value, and retention time reproducibility.
This research resulted in an optimum condition of reversed phase HPLC system in mobile phase composition of methanol:ammonium acetate 10 mM + TEA 0.1% (70:30) and a flow rate of 1.0 mL/min. This conditions fulfills the parameters of good separation which contains resolution value 3.λ15; nicotine’s tR 4.638 minutes with tailing factor 1.λ83; acetanilide’s tR 3.645 minutes with tailing factor 1.699.
1 BAB I
PENGANTAR
A. Latar Belakang
Rokok adalah hasil olahan dari tanaman Nicotiana Tabacum, Nicotiana Rustica dan spesies lainnnya atau sintetisnya yang mengandung nikotin dan tar
dengan atau tanpa bahan tambahan (Presiden Republik Indonesia, 2003). Perokok aktif di Indonesia mencapai 60 juta penduduk, sehingga Indonesia menduduki peringkat ketiga dunia jumlah perokok terbanyak dan nomor satu dalam lingkup Asia Tenggara (Yahya, 2010). Pada tahun 2007, tembakau memberikan sumbangan pendapatan negara sebanyak 52 triliun rupiah dan devisa ekspor tembakau sebesar 1,9 triliun rupiah. (Anonima, 2012).
Dipandang dari tingkat keterbahayaan rokok, pemerintah sejauh ini melakukan usaha pengamanan rokok, dengan pencantuman label informasi kandungan kadar nikotin dan tar untuk setiap batang rokok yang diproduksi (Presiden Republik Indonesia, 2003). Adanya label pencantuman kadar nikotin dan tar terkait upaya penjaminan mutu rokok menjadi perhatian penting terkait peraturan pemerintah dalam upaya pengamanan rokok. Menurut Peraturan Pemerintah Republik Indonesia nomor 109 tahun 2012 tentang Pengamanan Bahan Yang Mengandung Zat Adiktif Berupa Produk Tembakau Bagi Kesehatan, Pasal 10 Ayat 1 menyatakan “Setiap orang yang memproduksi produk tembakau berupa rokok harus melakukan pengujian kandungan kadar nikotin dan tar per batang untuk setiap varian yang diproduksi” (Presiden Republik Indonesia, 2012).
Pada penelitian ini akan dilakukan penetapan kadar nikotin yang terkandung dalam ekstrak etanolik tembakau rokok “merek X” melalui serangkaian proses penelitian.
Penelitian ini akan melalui serangkaian proses yang mencakup optimasi metode analisis, validasi metode analisis, dan penetapan kadar nikotin dalam ekstrak etanolik tembakau rokok “merek X”. Pada penelitian ini penulis mengupayakan optimasi metode penetapan kadar ekstrak etanolik tembakau rokok “merek X” tersebut.
penelusuran literatur, penelitian terhadap penetapan kadar nikotin dalam tembakau menggunakan KCKT fase terbalik sudah pernah dilakukan oleh Putri (2011).
time, bentuk peak, nilai resolusi, dan tailing factor, nilai resolusi yang dihasilkan,
reprodusibilitas retention time baku dan sampel serta reprodusibilitas resolusi sampel. Retention time yang efisien untuk analisis rutin ialah < 10 menit (Smith, 2002), bentuk peak dengan TF ≤ 2 (Center for Drug Evaluation and Research, 1994), nilai resolusi ≥ 1,5 (base line resolution) akan mampu memisahkan komponen lebih baik (Gandjar dan Rohman, 2010).
1. Permasalahan
Berdasarkan latar belakang, pemasalahan yang muncul adalah bagaimana komposisi fase gerak dan kecepatan alir yang optimal untuk menghasilkan pemisahan yang baik dengan metode KCKT fase terbalik pada penetapan kadar nikotin ekstrak etanolik tembakau rokok “merek X” yang dilihat dari bentuk peak, retention time yang efisien, resolusi, nilai tailing factor, nilai resolusi yang
dihasilkan, reprodusibilitas retention time baku dan sampel serta reprodusibilitas resolusi sampel?
2. Keaslian Penelitian
kromatografi gas, spektrofotometri massa dan kromatografi cair-MS (LC-MS) (Nakajima, Yamamoto, Kuroiwa dan Yokoi, 2000); analisis nikotin, 3-hidroksikotinin, kotinin dan kafein dalam urin pada perokok pasif dengan KCKT-Tandem Mass (Tuomi, Johnson dan Reijula, 1999); studi kadar nikotin dan tar sembilan merk rokok kretek filter yang beredar di wilayah Kabupaten Nganjuk (Kusuma, Sudarminto dan Siti, 2012).
3. Manfaat Penelitian
a. Manfaat metodologis. Penelitian ini diharapkan menjadi sumbangan ilmiah sebagai alternatif metode penelitian dalam upaya optimasi metode kromatografi cair kinerja tinggi (KCKT) fase terbalik pada penetapan kadar nikotin dalam ekstrak etanolik tembakau rokok.
b. Manfaat praktis. Penelitian ini diharapkan dapat memberikan informasi terkait upaya pemilihan dan perbandingan komposisi fase gerak yang paling baik pada penetapan kadar nikotin dalam rokok dengan metode kromatografi cair kinerja tinggi (KCKT) fase terbalik.
B. Tujuan Penelitian
Menentukan kondisi optimal pada penetapan kadar nikotin ekstrak etanolik tembakau rokok “merek X” dengan metode KCKT fase terbalik dilihat
6 BAB II
PENELAAHAN PUSTAKA
A. Rokok
B. Nikotin
Gambar 1 Struktur Nikotin (3-(1-metil-2-pirolodinil)pirindin) (Anonimb,2012)
Nikotin yang terkandung dalam rokok berkisar 1,5% b/b dan rata-rata antara 1-1,5 mg nikotin yang terabsorspi secara sistemik selama merokok (Benowitz, Hukkanen dan Jacob, 2009). Nikotin dan senyawa alkaloida lainnya ditemukan pada tanaman Nicotiana. Nikotin yang terkandung biasanya 2-8% berat kering dari daun tembakaunya, terklasifikasi sebagai senyawa organik dengan sifat basa. Nikotin dalam bentuk murni berupa cairan minyak yang hampir tidak berwarna atau kuning pucat. Paparan cahaya atau udara serta penyimpanan dalam waktu lama dapat menyebabkan nikotin teroksidasi dan berubah menjadi warna kecoklatan (Domino, 1999).
mempengaruhi protonasi atom nitrogen dalam nikotin, bentuk molekul utuh/tak terprotonasi mengindikasikan sifat lipofilik dan sebalikanya bentuk terprotonasi akan mengidentifikasi sifat hidrofilik (Domino, 1999).
Tabel I Ringkasan sifat/karakterisitik yang dimiliki nikotin (Domino, 1999) No. Sifat/Karakteristik Keterangan
Nikotin merupakan suatu basa lemah dan lebih sulit terabsorpsi melewati membran saat berada dalam kondisi terprotonasi. Absorpsi cepat nikotin dapat terjadi dari asap rokok karena terfasilitasi oleh luas permukaan yang luas dari alveoli dan disolusi nikotin dalam cairan paru-paru (pH 7,4) (Benowitz, Hukkanen dan Jacob,2009).
C. Ekstrak Tembakau
Ekstrak merupakan sediaan pekat yang telah diekstraksi dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, setelahnya dilakukan penguapan terhadap pelarut hingga keseluruhan atau hampir keseluruhan pelarut dan masa serbuk atau serbuk yang tersisa diperlakukan hingga memenuhi baku yang telah ditetapkan (Departemen Kesehatan Republik Indonesia, 1995). Tanaman tembakau (Nicotiana tabacum L.) termasuk genus Nicotinae, merupakan familia dari Solanaceae (Anonimc, 2012). Daun tumbuhan ini (folia nicotianae) mengandung 1-3% nikotin, nornikotin, nikotimin, nikotein,
isonikotein, nikotoin, nikotelin (Tjitrosoepomo, 1994).
Pada kebanyakan varietas tembakau, nornikotin dan anatabin merupakan komponen yang berlimpah diikuti anabasin yang semuanya merupakan senyawa alkaloid yang terkandung dalam tembakau (Benowitz, Hukkanen dan Jacob,2009).
D. Spektrofotometri UV
Spektrofotometeri UV merupakan salah satu teknik analisis spektroskopik yang menggunakan radiasi elektromagnetik UV dekat dengan menggunakan alat spektrofotometer (Skogg, West dan Holler, 1994). Radiasi elektromagnetik pada daerah UV dan visibel biasanya ditulis dalam satuan nanometer. Ketika sampel mengabsorbsi radiasi elektromagnetik (foton), terjadi perubahan energi pada sampel tersebut. Energi yang diserap mempunyai hubungan terhadap Persamaan Planck (Harvey,2000).
Molekul yang dikenakan gelombang radiasi elektromagnetik pada frekuensi yang sesuai dapat terjadi penyerapan/absorpsi, adanya serapan tersebut menghasilkan perbedaan energi serapan. Selisih energi tersebut setara dengan energi foton yang diserap. Energi yang melompat dari keadaan dasar (ground state) ke keadaan tereksitasi (excited state) disebut dengan transisi.
− = ℎ . � = ℎ.�
Dimana, E1= energi pada keadaan dasar/lebih rendah E2= energi pada keadaan tereksitasi/lebih tinggi h = konstanta Planck
υ = frekuensi foton yang diabsorpsi/diserap = panjang gelombang
c = kecepatan
gelombang tertentu setara dengan sinar yang diabsorpsi sehingga spektra juga dapat digunakan sebagai bahan analisis kuantitatif (Gandjar dan Rohman, 2010).
Pada analisis dengan spektrofometer, dilakukan pembacaan absorbansi yang disebut sebagai absorban (A) yang tidak memiliki satuan (Mulja dan Suharman, 1995). Spektrum absorpsi merupakan plot absorbansi analit yang merupakan fungsi dari panjang gelombang (Skogg, West dan Holler, 1994).
Gambar 3. Diagram tingkat energi elektronik (Gandjar dan Rohman, 2010)
Penyerapan foton yang dialami molekul mengakibatkan terjadinya eksitasi elektron-elektron ikatan. Transisi elektronik yang terjadi antara tingkat energi suatu molekul ada empat, yakni :
1. Transisi sigma–sigma star (σ → σ*)
Energi pada transisi ini terletak pada daerah < 180nm atau terjadi pada daerah UV vakum dan kurang begitu bermanfaat untuk analisis spektrofotometri UV-VIS (Gandjar dan Rohman, 2010).
2. Transisi non bonding elektron–sigma star (n → σ*)
Energi yang diperlukan untuk jenis transisi ini lebih kecil dibandingkan transisi σ → σ*, sehingga sinar yang diserap memiliki panjang gelombang yang
3. transisi n → π* dan transisi π → π*
Transisi ini terjadi pada molekul organik yang memiliki gugus fungsional tidak jenuh, ikatan rangkap dalam gugus tersebut memberikan orbital phi yang diperlukan. Transisi jenis ini paling cocok digunakan dalam analisis menggunakan spektrofotometri UV–visibel karena berada diantara panjang gelombang 200–700 nm (Gandjar dan Rohman, 2010).
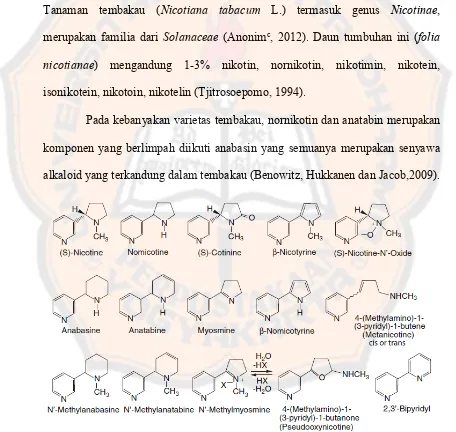
Pelarut dapat memberikan pengaruh transisi n → π* dan π → π*, hal ini
berkaitan dengan adanya perbedaan kemampuan dari pelarut untuk mensolvasi antara keadaan dasar dengan keadaan tereksitasi. Pada transisi π → π*, molekul yang berada dalam keadaan dasar akan relatif non polar dan keadaan tereksitasinya lebih polar dibandingkan dari keadaan dasar. Penggunaan pelarut polar akan menyebabkan interaksi lebih kuat saat keadaan tereksitasi dibandingkan keadaan dasar sehingga perbedaan energi transisi π → π* lebih
Gambar 4. (A) Pengaruh pelarut polar terhadap tra sisi π → π* da B tra sisi → π* (Gandjar dan Rohman, 2010)
Dalam memilih panjang gelombang terkait hubungan sifat optik cuplikan dan pelarut. Penyerapan radiasi UV atau visibel terkait dari elektron terluar atau elektron valensi dari molekul dan tergantung pula pada jenis ikatan kimia dalam molekul, adanya ikatan kimia penyebab terjadinya serapan sinar UV-Vis disebut kromofor (Johnson dan Stevenson, 1978). Sinar UV mempunyai panjang gelombang 200-400 nm, sedangkan sinar visibel mempunyai panjang gelombang 400-750 nm (Gandjar dan Rohman, 2010).
(A)
Kromofor merupakan ikatan rangkap tak jenuh selang-seling yang menyerap radiasi pada daerah UV dan visibel, sedangkan aukosokrom merupakan gugus jenuh yang terikat pada kromofor dapat menyebabkan adanya perubahan panjang gelombang dan intensitas serapan maksimum. Ciri auksokrom adalah gugusan heteroatom seperti –OCH3, -Cl, OH, dan NH2. Penambahan auksokrom menyebabkan pergeseren batokromik. Pergeseran batokromik merupakan pergeseran panjang gelombang ke arah yang lebih panjang akibat adanya subsitusi gugus atau atom atau adanya pengaruh pelarut (Sastrohamidjojo, 2001).
E. Kromatografi Cair Kinerja Tinggi (KCKT)
1. Definisi Dan Instrumentasi KCKT
Kromatografi adalah proses pemisahan komponen dari campuran (solut) yang terdistribusi diantara fase diam dan fase gerak berdasarkan kemampuan solut terangkut melewati fase diamnya. Perpindahan solut melewati fase diam tergantung pada afinitas relatif antar fase yang ditentukan dari parameter retensi (Kealey dan Hainesm, 2005).
KCKT digunakan untuk senyawa yang tidak mudah menguap, contohnya seperti terpenoid rantai panjang, golongan fenolik, alkaloid, lipid dan gula. KCKT dapat menganalisis dengan sangat baik untuk senyawa yang dapat dibaca dengan detektor UV-VIS (Harborne, 1998).
lainnya yang terelusi lebih awal atau lebih akhir. Fase diam bertindak sebagai penjerap (Departemen Kesehatan Republik Indonesia, 1995).
KCKT dapat menghasilkan pemisahan yang cepat, dengan keunggulan zat yang tidak menguap atau zat yang tidak tahan panas dapat dipisahkan tanpa terurai atau tanpa perlu diderivatisasi. Pada kromatografi partisi digunakan fase gerak dan fase diam dengan polaritas yang berbeda. Jika fase gerak bersifat polar dan fase diam bersifat nonpolar maka disebutlah sebagai kromatografi fase terbalik, senyawa nonpolar yang larut dalam hidrokarbon dengan BM < 1000 dapat dipisahkan berdasarkan atas afinitasnya terhadap fase diam (Departemen Kesehatan Republik Indonesia, 1995).
Gambar 5. Dasar Pemisahan Kromatografi Partisi (Lennan, 2010)
analit yang meningkat, analit yang mudah larut dalam air maka makin cepat analit terelusi (bila digunakan fase gerak metanol-air) (Johnson dan Stevenson, 1978).
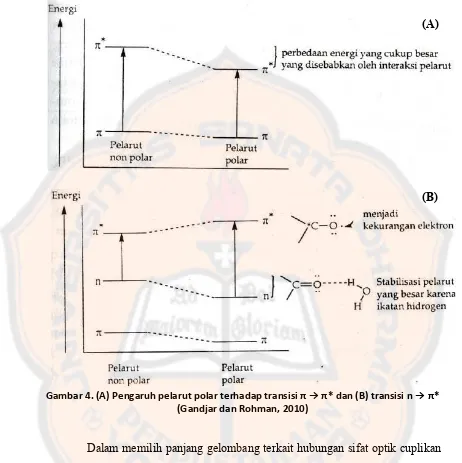
Gambar 6. Skema Instrumentasi KCKT (Gandjar dan Rohman, 2010)
Instrumentasi KCKT pada dasarnya terdiri atas beberapa komponen, yaitu : wadah fase gerak, sistem penghantaran fase gerak, alat untuk memasukan sampel, kolom, detektor, wadah penampung buangan fase gerak, tabung penghubung dan suatu komputer atau perekam peak (Gandjar dan Rohman, 2010). Kedelapan komponen tersebut dapat dilihat skemanya seperti yang tertera pada gambar 6.
terlebih dahulu untuk menghindari partikel kecil yang mungkin timbul sebagai pengotor, adanya pengotor tersebut dapat menyebabkan gangguan pada sistem kromatografi. Partikel pengotor yang terkumpul pada kolom atau pada selang penghubung yang sempit dapat menimbulkan penyumbatan. Selain itu, fase gerak yang digunakan haruslah diawaudarakan terlebih dahulu untuk menghilangkan gas yang terdapat pada fase gerak, akibat gas yang berkumpul dengan komponen lain pada pompa ataupun detektor dapat mengacaukan analisis. Saat membuat fase gerak, sangat dianjurkan menggunakan pelarut dengan kemurnian yang sangat tinggi agar tingkat pengotor yang ada rendah dan tidak mengacaukan sistem kromatografi (Gandjar dan Rohman, 2010).
dipakai dalam pemisahan ialah air-metanol dan air-asetonitril (Johnson dan Stevenson, 1978).
Pemilihan fase gerak dalam suatu metode pemisahan berdasarkan pada indeks polaritas (P’) campuran fase gerak tersebut. Semakin besar nilai indeks polaritasnya menyatakan semakin polar fase gerak yang digunakan. Fase gerak yang sering digunakan merupakan kombinasi dari dua atau lebih campuran pelarut yang saling bercampur secara keseluruhan. Campuran fase gerak tersebut akan menghasilkan nilai polaritas tersendiri yang disebut indeks polaritas fase gerak (Harvey, 2000).
�′ = Φ . �′ + Φ . �′
Dengan ΦA dan ΦB merupakan fraksi volume pelarut yang digunakan
pada pelarut A dan B, sedangkan P’Adan P’B merupakan indeks polaritas pelarut yang digunakan pada pelarut A dan B (Harvey, 2000).
Tabel II. Indeks polaritas dan karakteristik solvent selectivity beberapa pelarut KCKT (Snyder, Kirkland dan Dolan, 2010)
anilai ∑ merupakan total dariα, β danπ* dari setiap solven bindeks polaritas
Deret elutropik yang disusun berdasarkan polaritas pelarut merupakan suatu panduan yang berguna dalam memilih fase gerak yang akan digunakan dalam sistem KCKT. Nilai UV cut-off (pemenggalan UV) merupakan panjang gelombang dimana pada kuvet 1 cm yang digunakan pelarut akan memberikan absorbsi lebih dari satu satuan absorbansi. Pentingnya mengetahui panjang gelombang pemenggalan UV sangat berguna saat menggunakan detektor UV, penggunaan panjang gelombang deteksi dianjurkan tidak bertepatan atau disekitar panjang gelombang pemenggalan UV dari pelarut yang digunakan sebagai fase gerak (Gandjar dan Rohman, 2010).
yang digunakan sebaiknya memiliki kemampuan memberikan tekanan hingga 500 psi dan mampu mengalirkan fase gerak hingga 3 mL/min. Penggunaan pompa atau sistem penghantaran fase gerak ialah agar dapat menjamin proses penghantaran fase gerak yang berlangsung dengan tepat, reprodusibel, konstan dan bebas ganggunan (Gandjar dan Rohman, 2010).
Metode pencampuran fase gerak dibedakan menjadi dua, yakni metode isokratik dan metode gradien. Metode isokratik merupakan metode pencampuran fase gerak secara manual dengan tangan dan saat memasuki sistem KCKT tidak dibutuhkan adanya pencampuran fase gerak kembali dan dilakukan dengan satu pompa. Metode gradien merupakan metode pencampuran fase gerak yang dilakukan didalam sistem KCKT, beberapa pompa digunakan untuk memompa pelarut ke dalam wadah pencampuran fase gerak dan hasil pencampuran fase gerak tersebut yang dialirkan kedalam kolom (Snyder, Kirkland, dan Dolan, 2010).
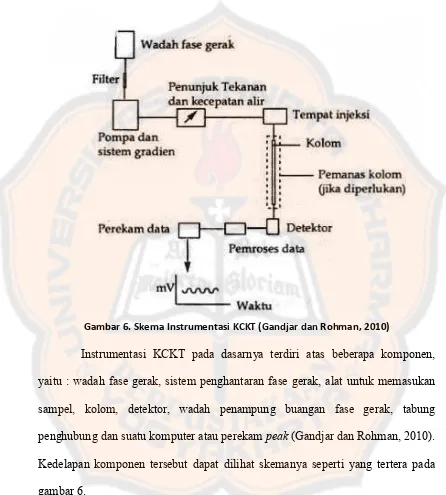
Penyuntikan sampel pada KCKT dilakukan secara langsung ke dalam fase gerak yang mengalir menuju kolom. Penggunaan syringe ataupun autosampler merupakan wadah yang digunakan dalam penyuntiksan sampel (Gandjar dan Rohman, 2010). Pada sistem KCKT, penyuntikan sampel melalui loop injector yang dapat menyimpan volume dari 0,5 µL – 2 mL. Pada posisi load, loop sampler terisolasi dari fase gerak. Ketika katup dipindahkan ke posisi
loading, injektor berpindah ke posisi inject dan saat itu pula fase gerak mengaliri
Gambar 7. Skema sampler KCKT. (A) – posisi load, sampel diinjeksikan dan terisolasi dari fase gerak. (B) – posisi inject, sampel terbawa fase gerak dan
memasuki kolom (Harvey, 2000)
Kolom pada KCKT memuat fase diam, kebanyakan merupakan silika yang dimodifikasi secara kimiawi. Permukaan silika merupakan permukaan yang polar dan sedikit asam karena adanya residu gugus silanol (Si-OH). Modifikasi secara kimia akan menutupi gugus silanol dan menggantinya dengan gugus fungsional lain. Hasil reaksi kimiawi tersebut akan menghasilkn silika yang stabil terhadap hidrolisis karena terbentuk ikatan siloksan (Si-O-Si). Dibandingkan dengan gugus silanol bebas tadi, hasil modifikasi kimiawi mempunyai karakter kromatografi dan selektivitas yang berbeda dengan gugus silanol bebas (Gandjar dan Rohman, 2010).
mengalami mekanisme sorpsi partisi pada sistem KCKT fase terbalik dan analit basa akan mengekor (Gandjar dan Rohman, 2010).
Deteksi pada KCKT dibagi menjadi empat secara umum, yakni bulk property, sample specific, mobile-phase modification, dan hyphenated techiniques.
a. Bulk property detector. Detektor ini dianggap sebagai detektor universal yang dapat mengukur banyak komponen. Detektor ini memiliki keuntungan karena dapat mendeteksi semua senyawa, sekaligus memiliki kelemahan karena semua senyawa dari sampel yang terelusi akan terbaca sebagai sinyal. Secara umum, detektor universal memiliki sensitivitas yang rendah (Snyder dkk., 2010).
b. Sample specific detectors. Beberapa karakteristik sampel mempunyai sifat unik yang mana tidak secara umum dimiliki oleh semua analit. Detektor ini merespon terhadap keunikan karakteristik yang dimiliki analit tersebut. Detektor UV merupakan detektor yang paling banyak digunakan dan merespon analit yang mengabsorbsi sinar UV pada panjang gelombang tertentu. Selain detektor UV, terdapat detektor lain seperti fluoresen dan detektor conduct electricity (Snyder dkk., 2010). Detektor UV-VIS dapat mengukur analit yang
c. Mobile–phase modification detectors. Detektor ini mengubah fase gerak setelah kolom KCKT menghasilkan pengubahan karakteristik analit, seperti perubahan reaksi analit dan detektor spektometrik masa (Snyder dkk., 2010).
d. Hyphenated techniques. Teknik mengacu pada kopling dari analisis KCKT yang dipadukan dengan teknik lain, seperti LC-MS dan LC-IR (Snyder dkk., 2010).
Detektor pada KCKT idealnya memiliki beberapa karakteristik sebagai berikut :
a. Respon terhadap analit cepat dan reprodusibel
b. Mampu mendeteksi analit hingga kadar yang sangat kecil c. Stabil saat dioperasikan/digunakan
d. Memiliki sel volume yang kecil sehingga mampu meminimalkan pelebaran pita.
e. Sinyal yang dihasilkan berbanding lurus dengan konsentrasi analit pada kisaran luas/AUC
f. Tidak peka terhadap perubahan suhu dan kecepatan alir fase gerak.
Komputer atau integrator merupakan alat yang dihubungkan dengan detektor unuk mengukur sinyal yang dihasilkan dan diplotkan sebagai suatu kromatogram sehingga dapat dievaluasi oleh analis (Gandjar dan Rohman, 2010). 2. Optimasi Metode
dimaksimalkan tersebut ialah resolusi, bentuk puncak, jumlah lempeng, asimetri, kapasitas, dan retention time (Gandjar dan Rohman, 2010).
Kecepatan alir yang optimal biasanya 0,8 mL/min, 1,2 mL/min dan 2,5 mL/min untuk kolom dengan yang memiliki diameter internal 4,6 mm dan ukuran partikel berkisar 3-10µm. Semakin kecil partikel menghasilkan pemisahan yang lebih cepat dan optimal (Ahuja dan Rasmussen, 2007).
3. Pemisahan Puncak Dalam Kromatografi
Empat karakteristik umum yang biasanya digunakan untuk mendeskripsikan kolom, sistem dan pemisahan kromatografi ialah faktor retensi (k’), efisiensi (N), selektivitas(α), dan resolusi(R) (Ahuja dan Rasmussen, 2007).
a. Faktor retensi (k’). Faktor retensi (k’) merupakan pengukuran retensi senyawa tertentu pada sistem kromatografi tertentu dan pada kondisi tertentu. Faktor retensi didefinisikan dengan persamaan sebagai berikut :
�′= − = − =
Dimana VR merupakan retensi volume analit, V0 merupakan retensi volume fase cair dalam sistem kromatografi dalam mL, tR merupakan retention time dalam menit, t0 disebut sebagai retention time analit yang tidak tertahan dalam menit (Ahuja dan Rasmussen, 2007), Vs merupakan volume sampel juga disebut sebagai volume dari fase diam yang ada didalam kolom dalam µL dengan pendekatan persamaan sebagai berikut :
= , √ �√ �
(3)
Dimana L merupakan panjang kolom dalam mm, dc merupakan diameter internal kolom dan dp merupakan packing diameter parkikel penyusun kolom dalam µm. Seluruh kondisi dari sistem kromatografi dapat mempengaruhi retensi analit. (Snyder dkk, 2010).
Retention time analit yang tidak tertahan (t0) atau dihubungkan dengan volume fase gerak dalam kolom sebagai hasil perkalian antara retention time analit yang tidak tertahan terhadap kecepatan alir fase gerak yang melewati kolom. Retention time analit yang tidak tertahan dapat dihitung berdasarkan dimensi kolom dan kecepatan alirnya, persamaan matematika yang menghubungkannya dituliskan sebagai berikut :
= � − �
L merupakan panjang kolom dalam mm, dc merupakan diameter internal kolom dalam mm, F merupakan kecepatan alir fase gerak yang melewati kolom dalam mL/min serta t0 sendiri dalam menit (Snyder dkk., 2010).
Faktor retensi mengukur waktu dari komponen sampel yang tinggal pada fase diam dihubungkan terhadap waktu dari komponen sampel yang terbawa pada fase gerak (Ettre,1993). Kecepatan migrasi analit melalui fase diam ditentukan koefisen distribusinya (D), besarnya nilai D tersebut ditentukan oleh afinitas relatif analit pada kedua fase (fase diam dan fase gerak). Dalam konteks kromatografi, koefisien distribusi (D) didefinisikan sebagai perbandingan konsentrasi analit dalam fase diam (Cs) dan fase gerak (Cm), yang dituliskan sebagai berikut :
(6)
=
Semakin besar nilai D, maka migrasi analit semakin lambat, sebaliknya semakin kecil nilai D, maka migrasi analit semakin cepat. Jika perbedaan koefisien distribusinya (D) dan faktor retensinya adalah 0 sehingga nilai tr=t0. Dalam sistem kromatografi umumnya diatur agar nilai k’<20 untuk menghindari retention time yang terlalu panjang (Gandjar dan Rohman, 2010). Retention time yang efisien untuk analisis rutin ialah < 10 menit (Smith, 2002).
b. Resolusi (Rs). Resolusi dapat didefinisikan sebagai perbedaan waktu antara retention time dua puncak peak yang saling berdekatan dibagi dengan rata-rata lebar puncak, sehingga yang sangat berpengaruh terhadap pemisahan komponen analit merupakan retention time (tR) masing-masing analit dan lebar puncaknya (W). Nilai Rs harus mendekati atau lebih dari 1,5 untuk memberikan pemisahan yang baik (Gandjar dan Rohman, 2010).
= +−
(7)
Pemisahan komponen analit pada sistem KCKT diharapkan memiliki Rs yang minimum dengan baseline separation. Baseline separation dapat dicapai ketika detektor membaca peak kromatogram pertama secara utuh hingga baseline sebelum detektor membaca peak kromatogram berikutnya. Baseline separation dapat dicapai saat Rs > 1,5 atau mendekati 1,5 (Snyder, Kirkland dan Glajch, 1997).
Gambar 8. Gambaran peak kromatogram untuk mengukur resolusi (Snyder dkk., 1997)
c. Efisiensi kolom. Efisiensi merupakan karakteristik penting dalam kolom. Efisiensi diekspresikan sebagai jumlah lempeng teoritis (N) yang dihitung dengan persamaan sebagai berikut :
= ( )
Dimana tR merupakan retention time analit dan W merupakan lebar peak pada posisi baseline (Ahuja dan Rasmussen, 2007).
Pengukuran terhadap efisiensi kolom membutuhkan faktor lebar peak (W) karena waktu retensi berpengaruh terhadapnya, peningkatan nilai W akan meningkatan retention time. Semakin tinggi nilai N mengindikasikan efisiensi kolom yang lebih baik (Miller dan Crowther, 2010).
Terdapat parameter lain terkait efisiensi kolom, yakni plate height/tinggi plat (H) yang dirumuskan dengan persamaan berikut :
� =
Dimana L merupakan panjang kolom. Plate height/tinggi plat (H) atau biasanya disebut sebagai HETP (Height Equivalent to one Theoretical Plate) menggunakan satuan unit panjang, pengukuran plate height lebih baik untuk penentuan efisiensi kolom karena adanya faktor panjang kolom sebagai pembandingnya daripada hanya dilihat dari jumlah lempeng teoritisnya (N). (Miller dan Crowther,2010). HETP merupakan panjang kolom kromatografi (dalam mm) yang diperlukan sampai terjadinya satu kali kesetimbangan molekul solut dalam fase gerak dan fase diam) (Gandjar dan Rohman, 2010).
Pada saat pemisahan kromatografi, analit individual akan membentuk profil konsentrasi yang simetri/profil Gaussian dalam arah aliran fase gerak. Peak kromatogram secara perlahan akan melebar dan sering membentuk profil asimetrik karena analit melanjutkan migrasinya ke fase diam (Gandjar dan Rohman, 2010). Alasan timbulnya bentuk puncak dan pelebaran puncak didasarkan pada difusi Eddy, difusi longitudinal, dan transfer massa (Snyder dkk., 2010).
fase gerak sehingga berkontribusi terhadap pelebaran pita secara simetris (Gandjar dan Rohman, 2010).
Gambar 9. Ilustrasi gambar yang menyebabkan pelebaran puncak selama pemisahan menggunakan KCKT. Simbol merepresentasifkan molekul analit sebelum migrasi,
simbol menyatakan molekul analit setelah migrasi, dan ---> menyatakan pergerakan dari molekul analit (Snyder dkk., 2010).
Gambar 10. Ilustrasi difusi Eddy saat memasukin kolom dan menyebabkan pelebaran pita (Miller dan Crowther, 2010)
Transfer massa dapat menyebabkan pelebaran pita, terjadinya transfer massa disebabkan oleh transfer massa fase gerak yang merupakan kecepatan alir analit yang mempengaruhi pelebaran pita, diantara partikel fase diam terdapat rongga yang bilamana analit melewatinya akan lebih cepat keluar terbaca detektor dan bila analit cenderung lebih menyamping maka akan terjadi interaksi dahulu terhadap partikel fase diam yang dapat dilihat dari gambar 9d. Transfer massa fase diam merepresentatifkan analit yang terpenetrasi ke dalam partikel fase diam dan tinggal lebih lama sebelum meninggalkan partikel fase diam. Perbedaan lama waktu tinggal dan adanya analit yang terlebih dahulu terelusi keluar akan menyebabkan pelebaran pita (Snyder dkk., 2010).
d. Selektivitas (α). Menurut Ahuja dan Rasmussen (2007), selektivitas merupakan kemampuan sistem kromatografi untuk memisahkan dua analit dan dapat digambarkan sebagai rasio faktor retensi, dengan persamaan sebagai berikut :
� =�′�′
Kesempurnaan pemisahan pada kromatogram seperti yang pada persamaan (6) belum memanfaatkan berbagai faktor, terdapat persamaan lain yang menggunakan faktor – faktor lain seperti pada persamaan berikut :
= (√ ) [� −� ] [ − ��′ ′]
Persamaan (10) menjelaskan bahwa terdapat faktor lain yang turut menentukan resolusi, yaitu jumlah lempeng (N), selektivitas (α), dan faktor retensi (k’)
(Gandjar dan Rohman, 2010).
Selektivitas pemisahan dapat dicapai dengan mengganti fase gerak, parameter yang digunakan digambarkan oleh sebuah diagram solvent selectivity triangle. Solvent selectivity triangle menggambarkan perbedaan antara solven
dengan melihat sifat keasaman (α), kebasaan (β), dan dipolar (π*). Perbedaan pola
elusi dari perbedaan solven yang besar dapat diharapkan dapat memisahkan peak dengan baik. Solven A dalam kromatografi fase terbalik biasanya digunakan fase gerak aquabidest dan solven B digunakan senyawa golongan alkohol (Meyer, 2004).
Gambar 11. Solvent Selectivity Triangle (Meyer, 2004)
Selektivitas dapat menghasilkan pergeseran satu puncak relatif terhadap puncak lainnya dengan menaikan nilainya. Efisiensi pemisahan yang ditunjukan oleh faktor N akan berubah dengan mengubah panjang kolom (L) atau mengubah kecepatan alir fase gerak. Menaikan lempeng teoritis (N) suatu kolom akan mengakibatkan penyempitan dua puncak sehingga lebar puncak (W) menjadi kecil dan resolusi yang dihasilkan menjadi lebih besar. Pengubahan nilai k’ dengan menurunkannya akan menghasilkan pemisahan yang jelas dan retention time yang pendek, sebaliknya menaikan nilai k’ akan memberikan resolusi yang lebih baik
Gambar 12. Pe garuh perubaha ilai α, k’, da N terhadap pemisahan peak
kromatogram (Gandjar dan Rohman, 2010)
e. Faktor asimetri/pengekoran. Pita kromatogram biasanya tidak menghasilkan bentuk yang Gaussian dan menimbulkan pengekoran. Pengekoran pita/peak tailing dapat dihitung berdasarkan dua cara yakni menggunakan asymmetry factor (As) atau menggunakan tailing factor (TF). Nilai As dapat dikorelasikan dengan TF menggunakan persamaan sebagai berikut :
� ≈ + , −
Melihat dari persamaan (11), nilai As akan cenderung lebih besar dibandingkan nilai TF (Snyder dkk., 2010).
Menurut Center for Drug Evalution and Research (1994), nilai tailing factor yang baik ≤ 2.
Gambar 13. Penentuan asymmetry factor (As) dan tailing factor (TF) (Snyder dkk.,2010).
F. Standar Internal
Standar internal digunakan untuk menghasilkan presisi yang baik karena masalah yang timbul akibat ketidakpastian jumlah analit saat preparasi sampel dapat dihindari. Teknik kuantitatif dengan standar internal didasarkan pada jumlah senyawa yang dimasukan pada baku dan sampel pada awal pengerjaan. Tinggi peak atau area yang muncul pada analit uji dan senyawa yang berperan sebagai
internal standar akan dibandingkan untuk dianalisis (Chan, Lam, Lee, dan Zhang, 2004).
diketahui secara tertentu dan harus memenuhi beberapa kriteria dalam analisis kromatografi :
1. Senyawa yang digunakan sebagai standar internal harus terelusi didekat peak yang diamati, tetapi terpisah dengan baik terhadap peak tersebut
2. Senyawa yang digunakan sebagai standar internal memiliki kemiripan sifat kimia terhadap analit yang diteliti dan tidak menimbulkan reaksi dengan komponen yang terdapat dalam sampel uji
3. Standar internal harus tersedia dalam kemurnian yang tinggi (Miller dan Crowther, 2000).
Kehadiran standar internal dalam sistem kuantifikasi yang dilakukan harus menjamin pemisahan antar peak dengan baik. Pemisahan yang baik memiliki resolusi > 1,5 atau baseline separation (Chan, Lam, Lee, dan Zhang, 2004).
Standar internal yang digunakan pada sampel untuk memimic respon analit. Standar internal harus ditambahkan sebelum dilakukannya preparasi sampel/ekstraksi untuk melihat kehilangan atau kesalahan yang muncul selama proses yang dilakukan, hal ini didasarkan pada proses preparasi yang panjang maka kesalahan yang muncul akan semakin besar. Penggunaan internal standar disini untuk meminimalisir kesalahan yang muncul tersebut (Chan, Lam, Lee, dan Zhang, 2004).
G. Landasan Teori
Rokok merupakan produk tembakau yang terbungkus kertas dalam bentuk seperti silinder dengan panjang mendekati 90 mm. Dalam tembakau rokok terdiri dari sekitar 4000 macam zat kimia, salah satunya nikotin. Nikotin yang terkandung dalam rokok antara 1-1,5 mg. Nikotin berupa cairan minyak yang hampir tidak berwarna dan merupakan basa lemah yang bersifar dibasic (pKa 4,23 dan 9,15). Dengan adanya paparan cahaya atau udara nikotin dapat teroksidasi dan berubah warna menjadi kecoklatan.
Ekstrak etanolik tembakau rokok merupakan senyawa multikomponen yang mengandung nikotin dan beberapa metabolit lain. Metode KCKT fase terbalik memiliki selektivitas dan sensitifitas yang tinggi sehingga mampu memisahkan sampel multikomponen sekaligus mengkuantifikasinya.
Optimasi terhadap komposisi fase gerak dan kecepatan alir sistem KCKT fase terbalik dengan penggunaan metode standar internal asetanilida dilakukan untuk menghasilkan pemisahan analit uji yang baik dengan retention time yang efisien yakni kurang dari 10 menit (Smith, 2002), bentuk peak dengan nilai TF ≤ 2 (Center for Drug Evaluation and Research, 1994), nilai resolusi > 1,5 (Gandjar dan Rohman, 2010).
H. Hipotesis
peak dengan nilai TF ≤ 2, retention time efisien < 10 menit, nilai resolusi ≥ 1,5,
38 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis rancangan penelitian eksperimental deskriptif karena adanya perlakuan pada subjek uji.
B. Variabel Penelitian
1. Variabel Bebas
Variabel bebas dalam penelitian ini adalah perbandingan komposisi fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% dan kecepatan alir yang digunakan.
2. Variabel Tergantung
Variabel tergantung dalam penelitian ini adalah bentuk peak, retention time, dan nilai resolusi yang dihasilkan
3. Variabel Pengacau Terkendali
a. Kemurnian pelarut, digunakan pelarut pro analysis yang memiliki kemurnian tinggi.
C. Definisi Operasional
1. Sistem Kromatografi Cair Kinerja Tinggi (KCKT) merupakan seperangkat alat KCKT fase terbalik yang menggunakan fase diam oktil silika (C8) dan fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% dengan perbandingan yang optimal.
2. Optimasi dilakukan dengan cara melakukan pengubahan terhadap komposisi fase gerak dan kecepatan alir.
3. Parameter pemisahan yang optimal dengan metode KCKT fase terbalik terlihat dari bentuk peak, retention time, nilai resolusi, nilai TF dan resolusi yang dihasilkan.
D. Bahan Penelitian
Bahan yang digunakan memiliki kualitas pro analysis kecuali dinyatakan lain yaitu baku nikotin (E. Merck), baku asetanilida (E. Merck), ammonium asetat (E.Merck), metanol (E. Merck), natrium hidroksida (E. Merck), kloroform (E. Merck), asam klorida (E. Merck), trietilamin (E. Merck), etanol teknis, aquadest, dan aquabidest yang didapatkan dari Laboratorium Kimia Analisis Instrumen Universitas Sanata Dharma Yogyakarta. Sampel yang digunakan dalam penelitian ini adalah rokok “Merek X” yang dibeli di Lotte Mart Yogyakarta .
E. Alat Penelitian
Shimadzu dengan sistem gradien (pompa merek Shimadzu, detektor UV-VIS merek Shimadzu), kolom oktil silika (C8) merek Shimadzu (spesifikasi ukuran diameter internal 4,6 mm x 25 cm, ukuran diameter partikel 5 µm fully encapped residual silanol), seperangkat komputer merek Dell B6RDZ1S Connexant System
RD01-D850 A0-0382 JP France S.A.S, printer HP Deskjet D2566 HP-024-000 625 730, ultrasonikator merek Retsch tipe T460 No V935922013 EY, destilator aquabidest merek Thermo Scientific, syringe, neraca analitik Scaltec SBC 22 (maks 60/120 g, min 0,001g, d=0,01/0,1 mg, milipore filter, mikropipet Socorex, organic and anorganic solvent membrane filter (Whatman) ukuran pori 0,45 m
dengan diameter 47 mm, vakum, dan seperangkat alat gelas (Pyrex).
F. Tata Cara Penelitian
1. Pembuatan Fase Gerak
Fase gerak yang digunakan yaitu campuran metanol : ammonium asetat + TEA 0,1%. Masing-masing larutan disaring menggunakan kertas saring Whatman yang dibantu dengan pompa vaccum dan diawaudarakan selama 15 menit. Pencampuran fase gerak dilakukan didalam sistem KCKT.
Tabel III. Komposisi fase gerak yang dibuat dalam penelitian
No
Komposisi Fase Gerak
Metanol p.a. Ammonium asetat + Tea 0,1%
1 50 50
2 60 40
2. Pembuatan Larutan Internal Standar Asetanilida
a. Pembuatan larutan stok asetanilida. Menimbang seksama kurang lebih 0,5 gram asetanilida, larutkan dengan metanol pada labu takar 10,0 mL hingga tanda. Didapatkan larutan stok asetanilida 0,05 g/mL (50 mg/mL).
b. Pembuatan larutan intermediate asetanilida. Larutan intermediate dibuat dengan mengambil 0,5 mL larutan stok asetanilida 50 mg/mL ke dalam labu takar 10,0 mL, encerkan hingga tanda dengan metanol. Didapatkan larutan intermediate asetanilida 2,5 mg/mL
c. Pembuatan larutan intermediate kerja asetanilida. Larutan intermediate kerja dibuat dengan mengambil 0,2 mL larutan intermediate asetanilida 2,5 mg/mL ke dalam labu takar 5,0 mL, encerkan hingga tanda dengan metanol. Didapatkan larutan intermediate kerja 0,1 mg/mL (100 µg/mL).
3. Pembuatan Larutan Baku Nikotin
a. Pembuatan larutan stok nikotin. Larutan stok dibuat dengan dengan cara mengambil 497 µL baku nikotin (ρ = 1,00λ g/mL) dan dimasukkan ke dalam labu takar 5,0 mL. Larutan diencerkan dengan metanol hingga tanda. Didapatkan larutan stok nikotin 0,1 g/mL (100 mg/mL).
b. Pembuatan larutan intermediate nikotin. Larutan intermediate nikotin dibuat dengan mengambil 500 µL larutan stok nikotin dan dimasukkan ke dalam labu takar 5,0 mL. Larutan diencerkan dengan metanol hingga tanda. Didapatkan larutan intermediate nikotin 10 mg/mL.
dan dimasukkan ke dalam labu takar 10,0 mL, larutan diencerkan dengan metanol hingga tanda. Didapatkan larutan intermediate kerja nikotin 0,2 mg/mL (200 µg/mL).
d. Pembuatan seri larutan baku nikotin. Membuat 3 seri larutan baku nikotin dengan konsentrasi 20, 60 dan 100 µg/mL dengan cara mengambil larutan intermediate kerja nikotin dengan menggunakan mikropipet sebanyak 100, 300 dan 500 µL ke dalam syringe yang terpasang milipore diujung syringe. Masing– masing seri larutan baku nikotin tersebut ditambahkan 100 µL larutan intermediate kerja asetanilida untuk mendapatkan konsentrasi standar internal asetanilida 10 µg/mL. Campuran baku nikotin dan asetanilida yang telah siap kemudian ditambahkan masing–masing 800, 600 dan 400 µL metanol 30% ke dalam syringe, saring menggunakan milipore ke dalam vial KCKT kemudian diawaudarakan selama 2 menit. Setiap seri larutan baku direplikasi sebanyak 3x. 4. Preparasi Sampel
a. Pembuatan KOH 10 M. Menimbang seksama lebih kurang 56,11 g (BM=56,11), masukan ke dalam labu takar 100,0 mL, kemudian dilarutkan dalam aquadest hingga tanda.
b. Pembuatan KOH 0,1 M. Mengambil 2,0 mL KOH 10 M, masukkan ke dalam labu takar 200,0 mL, kemudian encerkan dengan aquadest hingga tanda.
diblender. Campuran serbuk hasil blender yang dihasilkan kemudian diayak dengan ayakan nomor mesh 16, didapatkan campuran serbuk halus tembakau yang siap untuk diekstraksi lebih lanjut.
5. Penentuan Panjang Gelombang Pengamatan Nikotin dan Asetanilida
a. Penentuan panjang gelombang pengamatan nikotin. Dilakukan screening larutan baku nikotin 20, 30 dan 40 µg/mL pada daerah panjang
gelombang 225–300 nm menggunakan spektrofotometer UV-Vis. Panjang gelombang pengamatan ditentukan berdasarkan spektra serapan maksimum yang dihasilkan.
b. Penentuan Panjang Gelombang Pengamatan asetanilida. Dilakukan screening larutan baku asetanilida 1, 5 dan 10 µg/mL pada panjang gelombang 225–300 nm menggunakan spektrofotometer UV-Vis. Panjang gelombang pengamatan ditentukan berdasarkan spektra serapan maksimum yang dihasilkan.
6. Optimasi Metode KCKT Fase Terbalik
a. Optimasi pemisahan nikotin dalam sampel fraksi kloroform ekstrak etanolik tembakau rokok. Diambil 100 µL larutan baku nikotin 200 µg/mL, tambahkan 100 µL larutan internal standar asetanilida 100 µg/mL dan tambahkan 800 µL metanol 30%. Saring dengan milipore dan diawaudrakan selama 2 menit, diinjeksikan dalam sistem KCKT fase terbalik dengan pengaturan detektor pada panjang gelombang 260 nm. Dilakukan pengubahan kecepatan alir 0,5; 0,8 dan 1,0 mL/min dan komposisi fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% (50:50; 60:40; 70:30) pada sistem KCKT fase terbalik. Data kromatogram baku yang diperoleh diamati sehingga diperoleh kondisi sistem KCKT fase terbalik yang dapat memberikan pemisahan nikotin yang baik.
diinjeksikan dalam sistem KCKT dengan komposisi fase gerak dan kecepatan alir optimal, dilakukan replikasi tiga kali. Retention time dari kromatogram yang didapatkan kemudian dihitung nilai CV-nya sebagai paramater reprodusibilitas.
c. Reprodusibilitas resolusi sampel. Sampel hasil ekstraksi diinjeksikan ke dalam sistem KCKT dengan komposisi fase gerak dan kecepatan alir optimal, dilakukan repetisi tiga kali. Resolusi kromatogram yang didapat kemudian dihitung nilai CV-nya sebagai parameter reprodusibilitas. Penentuan reprodusibilitas sampel juga dilakukan pada sampel yang ditambahkan baku nikotin 20 µg/mL, dilakukan repetisi tiga kali.
G. Analisis Hasil
Hasil optimasi menggunakan fase gerak dan kecepatan alir yang telah ditentukan untuk menetapkan kadar nikotin dalam ekstrak etanolik daun tembakau yang dapat dilihat dari bentuk peak, retention time, nilai resolusi, reprodusibilitas retention time baku, reprodusibilitas nilai retention time dan resolusi sampel yang
dihasilkan. Perhitungan terhadap parameter ini dilakukan secara otomatis oleh sistem yang terprogram diintegrator. Hasil output perhitungan tersebut dibaca dan dipilah berdasarkan syarat yang diijinkan.
1. Bentuk peak
2. Retention time (tR)
Menurut Smith (2002), syarat retention time yang efisian ialah kurang dari 10 menit.
3. Resolusi (Rs)
Menurut Gandjar dan Rohman (2010), senyawa analit terpisah baik apabila mempunyai nilai resolusi antar peak terdekat ialah ≥ 1,5
4. Reprodusibilitas retention time dan resolusi
Reprodusibilitas retention time ditentukan dari nilai % CV yang didapatkan dengan persamaan berikut :
% = � �� �� ��� �
� � − � � � %
Pada pengujian dengan KCKT, nilai % CV dipersyaratkan <2% untuk senyawa aktif dalam jumlah yang banyak (Gandjar dan Rohman, 2010).
47 BAB IV
HASIL DAN PEMBAHASAN
A. Penentuan Fase Gerak
Fase gerak yang digunakan dalam penelitian ini merupakan perbandingan antara metanol, ammonium asetat yang terlarut dalam aquabidest, dan ditambahkan 0,1% trietilamin (TEA) ke dalam sistem. Dilakukan optimasi terhadap komposisi fase gerak untuk menemukan komposisi optimal fase gerak sehingga dapat menghasilkan pemisahan yang optimal. Pada penelitian ini digunakan campuran fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% dengan perbandingan 50:50; 60:40 dan 70:30 untuk menemukan komposisi optimal dari fase gerak yang digunakan untuk menghasilkan pemisahan yang optimal.
Metanol digunakan sebagai salah satu komponen campuran fase gerak karena metanol dapat melarutkan nikotin dan standar internal. Metanol merupakan senyawa yang tidak berbahaya dan mempunyai viskositas 0,55 cP sehingga penggunaan metanol dapat menurunkan tekanan pada kolom. Penggunaan metanol yang merupakan golongan alkohol juga merupakan fase gerak yang sering digunakan dalam sistem KCKT (Gandjar dan Rohman, 2010).
KCKT yang menganalisis analit basa, ammonium asetat akan mengkondisikan pH fase gerak < 8,0 (Snyder dkk., 2010). Campuran fase gerak metanol : ammonium asetat 10 mM + TEA 0,1% 50:50 dengan perbandingan 50:50; 60:40 dan 70:30 menghasilkan nilai pH sekitar 7.
Penggunaan TEA sebanyak 0,1% didasarkan oleh penelitian Bao, He, Ding, Prabhu, dan Hong (2005) yang meneliti nikotin dan turunannya. Fungsi TEA disini untuk meningkatkan pemisahan dari analit yang bersifat basa dan juga untuk menutupi sisi silanol bebas pada kolom sehingga diharapkan dapat meningkatkan bentuk peak yang dihasilkan (Snyder dkk., 2010).
B. Pembuatan Seri Larutan Baku Nikotin dan Asetanilida
Pada penelitian ini digunakan baku nikotin (E.Merck) dengan kemurnian 99,7% dan baku standar internal asetanilida (E.Merck) dengan kemurnian 99,9%. Kedua larutan baku ini awalnya dipersiapkan masing-masing dan dilarutkan dalam metanol. Alasan digunakannya metanol karena metanol merupakan salah satu komponen penyusun fase gerak sehingga menghindari perbedaan kekuatan pelarut yang mungkin muncul bila dilarutkan dalam pelarut selain komponen fase geraknya. Saat baku nikotin dan asetanilida dicampurkan untuk diinjeksikan ke dalam sistem KCKT, digunakan pelarut metanol 30% (30 bagian metanol dalam 100 bagian aquabidest), alasan digunakanya metanol 30% karena menyerupai komponen dari fase gerak yang merupakan campuran dari metanol : ammonium asetat 10 mM + TEA 0,1%. Ammonium asetat dilarutkan dalam aquabidest dan kemudian baru ditambahkan TEA, sehingga komponen dasar penyusun fase gerak dalam penelitian ini merupakan metanol dan aquabidest.
respon detektor yang muncul pada ketiga level konsentrasi campuran larutan baku tersebut pada fase gerak yang sudah teroptimasi.
C. Preparasi Sampel
Sampel yang digunakan dalam penelitian ini merupakan rokok “merek X” yang banyak beredar dipasaran. Serbuk rokok “merek X” yang telah diambil
kemudian diblender dan diayak. Tujuan serbuk rokok diblender dan diayak disini ialah untuk menghomogenkan dan mengecilkan ukuran partikel serbuk kasar, diharapkan kehomogenan dan kecilnya ukuran dapat meningkatan luas permukaan serbuk yang dapat terbasahi dan terekstraksi oleh pelarut. Pelarut yang digunakan disini ialah etanol. Digunakannya etanol disini karena nikotin dapat terlarut kedalam etanol dan mengurangi senyawa lain yang ada dalam serbuk yang tidak dapat terlarut dalam etanol.