BAB 2
TINJAUAN PUSTAKA
2.1 Bahan Cetak Alginat
Bahan cetak alginat merupakan bahan cetak hidrokoloid bersifat ireversibel yang telah diperkenalkan sejak tahun 1940. Bahan cetak alginat bersifat hidrofilik sehingga dapat mencetak detail jaringan keras dan lunak dalam keadaan lembap (Nassar, 2011).
2.1.1 Komposisi Bahan Cetak Alginat
Komponen aktif utama bahan cetak hidrokoloid ireversibel adalah salah satu alginat yang larut air, seperti natrium, kalium, atau alginat trietanolamin. Bila alginat larut air dicampur dengan air, bahan tersebut akan membentuk sol. Bubuk alginat yang diproduksi pabrik mengandung sejumlah komponen. Komposisi alginat bervariasi tergantung pada produsen, namun ada konsentrasi relatif konsisten untuk masing-masing bahan (McCabe, 2008). Tabel 2.1 menunjukkan suatu formula untuk komposisi bubuk bahan cetak alginat dengan fungsi dari masing-masing komponen (Anusavice, 2013; McCabe, 2008).
Tabel 2.1 Komposisi bubuk bahan cetak alginat (Anusavice, 2013)
Pada proses gelasi bubuk alginat yang dicampur air akan menghasilkan bentuk pasta. Dua reaksi utama terjadi ketika bubuk bereaksi dengan air selama proses setting. Tahap pertama, sodium fosfat bereaksi dengan kalsium sulfat yang menyediakan waktu pengerjaan yang adekuat (Anusavice, 2013).
2Na3PO4 + 3CaSO4→ Ca3(PO4)2 + 3Na2SO4
Komponen Persentase Fungsi
Potassium alginat 15 Melarutkan alginat dalam air
Kalsium sulfat 16 Reaktor
Oksida seng 4 Partikel pengisi
Kalium titanium fluorid 3 Pemercepat
Diatomaceous earth 60 Partikel pengisi
Tahap kedua, setelah sodium fosfat telah bereaksi, sisa kalsium sulfat bereaksi dengan sodium alginat membentuk kalsium alginat yang tidak larut, yang dengan air akan membentuk gel:
a alginat a a alginat a (bubuk) (gel)
Menurut kecepatan proses gelasinya, alginat dibedakan menjadi dua jenis, yakni: (McCabe, 2008)
a. Quick Setting Alginate, mengeras dalam 1 menit dan digunakan untuk mencetak rahang anak-anak atau penderita yang mudah mual.
b. Regular Setting Alginate, mengeras dalam 3 menit dan dipakai untuk pemakaian rutin.
2.1.2 Pemanipulasian Bahan Cetak Alginat
Peralatan yang bersih merupakan faktor penting karena kontaminasi selama pengadukan dapat membuat bahan mengeras terlalu cepat, kekentalannya tidak sempurna, atau dapat menyebabkan cetakan robek saat dikeluarkan dari rongga mulut (Anusavice, 2013). Bubuk alginat harus ditimbang dan air ditakar mengikuti petunjuk pabrik. Air yang digunakan sebaiknya air destilasi steril karena apabila air mengandung banyak mineral maka akan memengaruhi keakuratan dan setting time dari bahan cetak alginat (Nassar, 2011). Air yang digunakan sebaiknya steril untuk menghindari kontaminasi mikroorganisme yang berasal dari air (Correia-Sousa, 2013).
Lama penyimpanan bubuk bahan cetak alginat dipengaruhi temperatur penyimpanan dan kontaminasi kelembapan udara yang merupakan faktor utama.
Bahan yang sudah disimpan selama satu bulan pada 65ºC tidak dapat digunakan dalam perawatan gigi, karena bahan tersebut tidak dapat mengeras sama sekali atau mengeras terlalu cepat. Bahan cetak alginat harus disimpan pada lingkungan yang dingin dan kering (Anusavice, 2013; McCabe, 2008).
di kaleng. Bubuk yang dibungkus per kantung lebih disukai karena mengurangi kontaminasi selama penyimpanan dan perbandingan air dengan bubuk lebih terjamin karena dilengkapi dengan takaran plastik untuk mengukur banyaknya air (McCabe, 2008).
2.1.2.1 Teknik Pencampuran Bahan Cetak Alginat
Teknik pencampuran bahan cetak alginat adalah sebagai berikut: (Mc Daniel, 2012)
a. Pencampuran manual (manual mixing)
Ketika bahan cetak alginat yang dicampur manual menggunakan mangkuk dan spatula (Gambar 2.1), udara berpotensi besar terjebak. Untuk teknik pencampuran manual, beberapa penulis menentukan bahwa operator harus menambahkan bubuk perlahan-lahan ke dalam air yang sudah ditakar pada rubber bowl untuk meminimalkan pembentukan gelembung. Selama pencampuran manual, alginat dicampur dan diaduk selama 60 detik, sesuai petunjuk pabrik.
Gambar 2.1 Rubber bowl dan spatula (Mc Daniel, 2012)
b. Pencampuran mekanis (mechanical mixing)
1. Spinning mixing
Alat semi automatic mechanical mixing disebut spinning bowl (Cadco
Alginator II-Dux Dental) merupakan rubber bowl konvensional yang terpasang pada spinning turntable (Gambar 2.2.a). Setelah penambahan bubuk alginat ke dalam air
mangkuk, sehingga terjadi pencampuran dan oleskan alginat ke dinding rubber bowl. Pencampuran membutuhkan waktu 30 detik.
2. Centrifuge mixing
Alat centrifuge mixing disebut centrifugal force mixer (Rite-Dent Alginate Mixing Machine-Rite-Dent Manufacturing Corporation) (Gambar 2.2.b). Bubuk alginat dan air ditambahkan ke dalam wadah pencampuran dan dimasukkan ke dalam centrifugal force mixer. Tutup mixer ditutup, diaktivasi dan mesin mencampur selama 10 detik. Wadah dikeluarkan dari mixer dan adonan alginat dikeluarkan dengan spatula.
3. Vacuum mixing
Alat yang untuk vacuum mixing sering disebut vacuum mixer (Whip Mix Vac-U-Mixer-Whip Mix Corporation) (Gambar 2.2c). Vacuum mixer menggunakan mangkuk dengan tutup kedap udara. Tutupnya memiliki spatula berputar yang
beroperasi dalam kondisi vakum ketika terhubung ke Whip Mix Unit. Setelah pencampuran selama 15 detik, tutup dibuka dan adonan alginat dikeluarkan dengan
spatula.
Gambar 2.2 (a) Cadco Alginator II (Dux Dental); (b) Rite-Dent Alginate Mixing Machine (Rite-Dent Manufacturing Corporation); (c) Whip Mix Vac-U-Mixer (Whip Mix Corporation) (Mc Daniel, 2012)
Penggunaan alat pencampuran mekanis (mechanical mixing device) dapat mengurangi porositas. Udara yang terjebak atau porositas pada cetakan alginat dapat memengaruhi keakuratan cetakan dan model (Culhaoglu, 2014). Porositas permukaan
pada cetakan secara signifikan minimal untuk pencampuran dengan centrifugal mixer bila dibandingkan dengan manual, sedangkan porositas internal secara signifikan lebih sedikit untuk pencampuran dengan centrifugal mixer dibandingkan dengan semua teknik pencampuran lain (Mc Daniel, 2012).
2.1.3 Sifat-Sifat Bahan Cetak Alginat
2.1.3.1Waktu Kerja (Working Time)
Bahan fast-set memiliki waktu kerja 1,25-2 menit, sedangkan waktu bahan regular-set biasanya 3 menit, tapi mungkin bisa selama 4,5 menit. Dengan waktu pencampuran 45 detik untuk jenis fast-set, 30-75 detik sisa waktu kerja sebelum penempatan sendok cetak. Untuk bahan regular-set, waktu pencampuran 60 detik, 2-3,5 menit sisa waktu kerja untuk bahan yang mengeras 3,5-5 menit (Sakaguchi, 2012).
2.1.3.2Waktu Pengerasan (Setting time)
Waktu pengerasan berkisar antara 1-5 menit. ANSI/ADA (American National Standards Institute/American Dental Association) spesifikasi No.18 (ISO [International Organization for Standardization] 1563) mensyaratkan bahwa minimal nilai yang terdaftar oleh produsen dan setidaknya 15 detik lebih lama dari waktu kerja. Menggunakan air yang lebih dingin dari 18°C atau lebih hangat dari 24°C tidak dianjurkan. Waktu pengerasan secara klinis dapat terdeteksi dengan hilangnya kelengketan permukaan. Jika memungkinkan, cetakan harus dibiarkan di tempat 2 sampai 3 menit, karena tear strength dan elastic recovery (recovery dari deformasi) meningkat secara signifikan selama periode ini. Warna alginat yang berubah memberikan indikasi visual waktu kerja dan waktu pengerasan. Mekanisme
perubahan warna adalah perubahan pH-terkait dari pewarna (Sakaguchi, 2012).
2.1.3.3Elastic Recovery
elastic recovery lebih dari 95% ketika bahan dikompresi 20% selama 5 detik pada saat itu biasanya akan dikeluarkan dari mulut. Nilai khas untuk elastic recovery 98,2%, sesuai dengan deformasi permanen 1,8% (Sakaguchi, 2012).
2.1.3.4Pengerutan (Shrinkage) dan Pengembangan (Expand)
Bahan cetak hidrokoloid gel dapat kehilangan kandungan air melalui penguapan pada permukaan atau cairan merambat ke permukaan dengan proses yang disebut sineresis. Pengerutan gel merupakan hasil dari penguapan dan sineresis. Bila gel ditempatkan di dalam air, air akan diabsorpsi dan proses ini disebut imbibisi (Anusavice, 2013).
2.1.4 Syarat Hasil Cetakan Alginat
Syarat hasil cetakan alginat adalah harus merekam sebagai berikut: (Power, 2008)
a. Semua gigi pada rahang atas dan bawah b. Seluruh tulang alveolar
c. Daerah hamular notch pada rahang atas d. Daerah retromolar pada rahang bawah
e. Reproduksi dari sebuah detail, tidak distorsi, dan bubble-free pada jaringan rongga mulut
2.1.5 Penyimpanan Cetakan Alginat
2.1.6 Keakuratan Cetakan Alginat
Keakuratan cetakan alginat dapat dievaluasi dari stabilitas dimensi dan surface detail. Keakuratan dimensi dan surface detail merupakan faktor penting untuk menghasilkan struktur anatomis yang tepat (Power, 2008).
2.1.6.1Surface Detail Cetakan Alginat
Bahan cetak harus merekam detail dari jaringan keras dan lunak pada rongga mulut dan detail ini juga harus dapat dipindahkan ke model. Kualitas permukaan yang kurang baik dengan detail yang rendah dapat berpengaruh terhadap keakuratan cetakan dan model serta kenyamanan protesa yang akan digunakan pasien. Efek disinfektan terhadap surface detail menunjukkan bahwa bahan cetak alginat mempunyai sifat imbibisi yang menyerap disinfektan sehingga menimbulkan kerusakan pada permukaan alginat (Amin, 2009), karena sifat dari cetakan alginat yang mempertahankan larutan disinfektan dan disalurkan ke dalam model gipsum, sehingga memengaruhi surface detail dan kekerasan (hardness). Cetakan harus didisinfeksi dengan bahan disinfektan yang adekuat dalam jangka waktu yang singkat sehingga dapat meminimalkan distorsi dan perubahan surface detail pada cetakan dan model (Sinavarat, 2014). Surface detail cetakan alginat tidak berubah bila konsentrasi rendah dan waktu pemaparan disinfektan sesingkat mungkin (Amin, 2009).
Permukaan cetakan dapat dinilai melalui reproduksi garis dari test block.
Cetakan diamati di bawah sudut-rendah pencahayaan dengan atau tanpa pembesaran. Untuk pembedaan yang lebih baik, sebuah sistem pemindaian dengan skor 1-4 adalah
sebagai berikut: (Culhaoglu, 2014)
a. Skor 1: garis jelas, detail yang jelas, garis bersambung (Gambar 2.3.a) b. Skor 2: garis bersambung dengan keburaman (Gambar 2.3.b)
c. Skor 3: detail yang buruk atau garis tidak bersambung (Gambar 2.3.c) d. Skor 4: tipis atau tidak tampak sama sekali
Gambar 2.3 a. Skor 1: Garis jelas, detail yang jelas, garis bersambung; b. Skor 2: Garis bersambung dengan keburaman; c. Skor 3: Detail yang buruk atau garis tidak bersambung (Culhaoglu, 2014).
2.2 Hemimaksilektomi
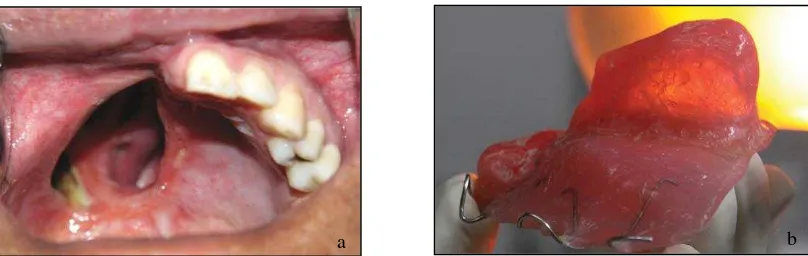
Hemimaksilektomi merupakan operasi pengangkatan salah satu sisi rahang atas, termasuk premaksila, rahang atas, dan palatum keras yang dilakukan untuk pengangkatan tumor di palatum keras, hidung, sinus maksilaris atau tumor lain yang telah tumbuh melibatkan rahang atas. Pasca hemimaksilektomi akan menimbulkan defek maksila. Defek maksila yang disebabkan karena tindakan operasi (tumor, benjolan, kista) merupakan suatu kelainan berbentuk sebuah celah atau gerong pada rahang atas (Gambar 2.4.a). Defek maksila melibatkan palatum keras dan palatum lunak yang diperpanjang sampai daerah vellopharyngeal, defek maksila yang ada ini dapat menyebabkan penderita saat bicara terdengar suara sengau, dapat pula menyebabkan seseorang mengalami kesulitan saat berbicara, pengunyahan, menelan, dan estetik (Bidra, 2012). Pasien pasca hemimaksilektomi
yang menjalani terapi radiasi mengalami trismus temporomandibular joint yang dapat terjadi dengan pengurangan pembukaan mulut (10-15 mm atau kurang) (Vojvodic, 2013).
Rehabilitasi prostetik diperlukan dengan pembuatan obturator (Vojvodic, 2013). Obturator adalah protesa maksilofasial yang digunakan untuk menutup
a b
pembukaan jaringan didapat, terutama dari palatum, dan/atau struktur jaringan alveolar atau lunak berdekatan yang telah dibuang karena operasi. Pembuatan obturator definitif dapat dipertimbangkan setelah sekitar 3 bulan setelah terapi radiasi, walaupun obturator interim (Gambar 2.4.b) dapat dibuat sekitar 10 hari setelah pembedahan untuk memfasilitasi penutupan defek setelah penyembuhan awal (Vojvodic, 2013).
Pada luka pasca operasi dapat ditemukan bakteri Gram positif (22,5%) dan Gram negatif (77,5%). Klebsiella pneumoniae merupakan bakteri patogen Gram negatif yang sering ditemukan pada luka pasca operasi berdasarkan penelitian di rumah sakit Dar Es Salaam, Tanzania pada September 2011 sampai Februari 2012 (Manyahi, 2012).
Gambar 2.4 (a) Defek maksila pasca hemimaksilektomi; (b) Hollow bulb interim obturator (Daniel, 2015)
2.3 Klebsiella pneumoniae
Klebsiella pneumoniae pertama kali ditemukan oleh Carl Friedlander. Carl
Friedlander mengidentifikasi bakteri Klebsiella pneumoniae dari paru-paru orang yang meninggal karena pneumonia. Klebsiella pneumoniae adalah bakteri Gram
negatif yang berbentuk batang (basil) dan tidak dapat melakukan pergerakan (non motil). Klebsiella pneumoniae mempunyai diameter berkisar 0,3-1,0 µm dan panjang 0,6-6,0 µm serta terdapat fimbria. Berdasarkan kebutuhannya akan oksigen, Klebsiella pneumoniae merupakan bakteri fakultatif anaerob. Klebsiella pneumoniae berperan utama dalam menyebabkan infeksi nosokomial pada pasien immunocompromised (Samaranayake, 2012).
Centers for Disease Control and Prevention (2015) menyatakan untuk
mendapatkan infeksi Klebsiella pneumoniae, seseorang harus terpapar bakteri. Misalnya, Klebsiella pneumoniae yang masuk ke dalam saluran pernafasan dapat menyebabkan pneumonia, atau ke dalam darah yang menyebabkan infeksi aliran darah. Bakteri Klebsiella pneumoniae dapat menyebar melalui kontak orang-ke-orang (misalnya, dari pasien ke pasien melalui tangan yang terkontaminasi personil kesehatan, atau orang lain) atau, lebih jarang, oleh kontaminasi lingkungan. Bakteri ini tidak menyebar melalui udara. Pasien dapat terpapar Klebsiella pneumoniae melalui ventilator (mesin pernapasan), intravena (pembuluh darah), kateter atau luka (yang disebabkan oleh cedera atau pembedahan). Alat-alat dan kondisi medis memungkinkan Klebsiella pneumoniae untuk masuk ke dalam tubuh dan menyebabkan infeksi.
Untuk mencegah penyebaran infeksi Klebsiella pneumoniae antara pasien, tenaga kesehatan harus mengikuti tindakan pencegahan dan pengendalian infeksi tertentu. Tindakan pencegahan ini dapat mencakup ketaatan kebersihan tangan dan mengenakan baju pelindung dan sarung tangan saat mereka memasuki kamar di mana pasien terkait dengan penyakit Klebsiella pneumoniae dirawat. Fasilitas kesehatan
juga harus mengikuti prosedur pembersihan yang ketat untuk mencegah penyebaran Klebsiella pneumoniae (Siegel, 2007).
Untuk mencegah penyebaran infeksi, pasien juga harus membersihkan tangan mereka sangat sering, termasuk: (Siegel, 2007)
Sebelum menyiapkan atau makan makanan.
Sebelum menyentuh mata, hidung, atau mulut.
Sebelum dan setelah mengganti perban.
Setelah menggunakan toilet.
Setelah meniup dengan hidung, batuk, atau bersin.
Setelah menyentuh permukaan rumah sakit seperti tempat tidur yang
2.3.1 Klasifikasi Klebsiella pneumoniae
Klasifikasi Klebsiella pneumoniae adalah sebagai berikut Domain/Kingdom : Bacteria
Phylum : Proteobacteria
Class : Gammaproteobacteria Order : Enterobacteriales Family : Enterobacteriaceae Genus : Klebsiella
Species : Klebsiella pneumoniae
2.3.2 Struktur sel Klebsiella pneumoniae
Klebsiella pneumoniae mengandung kapsul besar yang terbuat dari
polisakarida sekitar selnya, sehingga koloni berlendir (mukoid) dan berguna untuk mempertahankan diri. Klebsiella pneumoniae dapat menyebabkan penyakit karena
mempunyai dua tipe antigen pada permukaan selnya: 1. Antigen O
Antigen O adalah lipopolisakarida yang terdapat dalam sembilan varietas. 2. Antigen K
Antigen K adalah polisakarida yang dikelilingi oleh kapsula dengan lebih dari 77 varietas.
Kedua antigen ini meningkatkan patogenitas Klebsiella pneumoniae. Selain itu, Klebsiella pneumoniae mampu memproduksi enzim ESBL (Extended Spectrum Beta-Lactamase) yang dapat melumpuhkan kerja berbagai jenis antibiotik. Hal ini dapat menyebabkan bakteri kebal dan menjadi sulit dilumpuhkan (Sikarwar, 2011). Klebsiella pneumoniae memiliki karakteristik fiksasi nitrogen. Klebsiella pneumoniae dapat mengambil gas nitrogen atmosfer dan mengurangi menjadi asam amonia dan amino. Suhu untuk kondisi pertumbuhan terbaik adalah 37ºC. Klebsiella pneumoniae efektif memetabolisme melalui fermentasi (Schmitz, 2002).
penyebab penting infeksi pada manusia. Infeksi atau penyakit biasanya nosokomial atau didapat di rumah sakit. Penyakit termasuk infeksi saluran kemih dan pneumonia. Penyakit yang disebabkan oleh Klebsiella pneumoniae dapat mengakibatkan kematian bagi pasien yang imunodefisiensi (Kumar, 2013).
2.3.3 Identifikasi Klebsiella pneumoniae
Identifikasi Klebsiella pneumoniae dapat dilakukan beberapa tahap, yaitu : a. Kultur bakteri pada BloodAgar
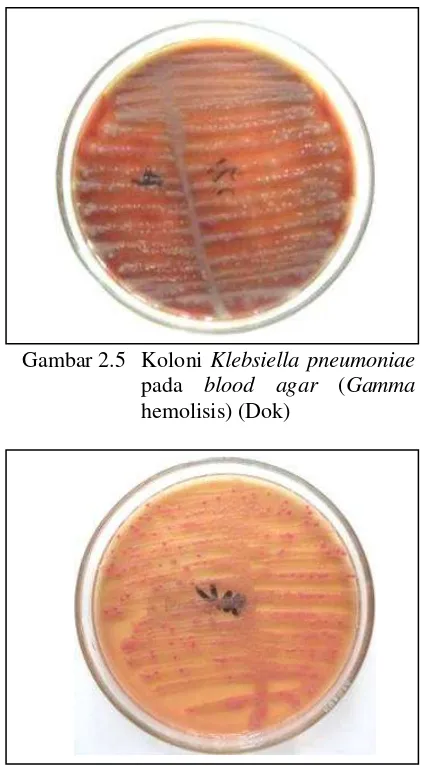
Media blood agar digunakan untuk isolasi, menumbuhkan berbagai macam bakteri patogen dan menetapkan bentuk hemolisa dari bakteri tersebut. Media kultur ini kaya nutrien yang menyediakan kondisi pertumbuhan bakteri yang optimal. pH media ini sekitar 6,8 untuk menstabilkan sel darah merah dan menghasilkan media hemolisa yang jelas. Kandungan utama pada agar darah adalah nutrien agar dan 5-10% darah domba. Blood agar merupakan media diferensial yang berfungsi membedakan bakteri berdasarkan kemampuan bakteri melisiskan sel darah merah. Ekspresi dari hemolisis bakteri dapat diketahui ada atau tidaknya zona bening di sekeliling koloni bakteri. Terdapat 3 tipe sifat hemolisis yaitu alpha, beta, dan gamma. Klebsiella pneumoniae tumbuh sebagai koloni yang berwarna, besar, dome-shaped, mukoid, dan tidak melisiskan darah (gamma hemolisis (γ-haemolysis)) pada media blood agar (Kumar, 2013) (Gambar 2.5).
b. Kultur Media MacConkey Agar
Media MacConkey agar termasuk salah satu media isolasi primer. MacConkey
Gambar 2.5 Koloni Klebsiella pneumoniae pada blood agar (Gamma hemolisis) (Dok)
Gambar 2.6 Koloni Klebsiella pneumoniae
pada MacConkey agar (Dok)
c. Pewarnaan Gram
Pewarnaan Gram atau metode Gram adalah suatu metode untuk membedakan spesies bakteri menjadi dua kelompok besar, yakni Gram positif dan Gram negatif, berdasarkan karakteristik pewarnaan dinding selnya. Reaksi atau sifat bakteri tersebut
ditentukan oleh komposisi dinding selnya (Samaranayake, 2012).
Bakteri Gram positif akan mempertahankan zat warna metil ungu gelap
ditambahkan setelah metil ungu, yang membuat semua bakteri Gram negatif menjadi berwarna merah atau merah muda. Pengujian ini berguna untuk mengklasifikasikan kedua tipe bakteri ini berdasarkan perbedaan struktur dinding sel (Samaranayake, 2012).
Perbedaan dasar antara bakteri Gram positif dan Gram negatif adalah pada komponen dinding selnya. Kompleks zat iodin terperangkap antara dinding sel dan membran sitoplasma organisme Gram positif, sedangkan penyingkiran zat lipida dari dinding sel organisme Gram negatif dengan pencucian alkohol. Bakteri Gram positif memiliki membran tunggal yang dilapisi peptidoglikan yang tebal (25-50 nm) sedangkan bakteri negatif lapisan peptidoglikan yang tipis (1-3 nm) (Samaranayake, 2012). Bakteri Klebsiella pneumoniae terlihat berwarna merah, berbentuk batang lurus berpasangan atau tunggal, pendek, dan memiliki kapsul secara mikroskopik (Kumar, 2013).
d. Uji biokimia
Uji biokimia dilakukan untuk melihat karakteristik bakteri melalui reaksi
biokimia, yang biasa dilakukan diantaranya: (Sikarwar, 2011) 1. Uji Indol
Uji indol untuk melihat kemampuan suatu organisme menghasilkan indol dari degradasi asam amino triptopan. Bila positif menghasilkan warna merah sedangkan apabila negatif menghasilkan warna kuning. Klebsiella pneumoniae merupakan bakteri dengan indol negatif.
2. Uji metil merah
Uji metil merah digunakan untuk mendeteksi produksi asam kuat selama proses
fermentasi glukosa. Pembentukan asam pada fermentasi glukosa memberikan warna
merah dengan indikator metil merah. Klebsiella pneumoniae menghasilkan warna merah.
3. Uji Voges Proskauer
Voges Proskauer merupakan uji untuk menentukan organisme yang memproduksi
dan mengelola asam dan fermentasi glukosa, memperlihatkan kemampuan sistem buffer
aseton) dari hasil fermentasi glukosa. Klebsiella pneumoniae memberikan hasil positif
terhadap reaksi uji Voges-Proskauer.
4. Uji Sitrat (Simmons)
Biakan diinokulasi pada media Simmons sitrat agar dengan inokolum yang tipis
kemudian diinkubasi pada suhu 35ºCselama 48 jam. Jika hasil positif terjadi perubahan
warna indikator dari hijau menjadi biru yang bermakna pertumbuhan bakteri pada
medium sitrat menghasilkan keadaan alkalis dan bakteri telah menggunakan sitrat.
Klebsiella sp. memberikan reaksi positif terhadap penggunaan sitrat.
5. Uji urease
Bakteri tertentu dapat menghidrolisis urea dan membentuk amonia dengan terbentuknya warna merah karena adanya indikator phenol red,
Klebsiella pneumoniae pada media urea memiliki pertumbuhan yang lambat, memberikan hasil positif, dan membentuk amonia.
6. Pergerakan bakteri
Dilakukan untuk mengetahui apakah bakteri ini yang akan diidentifikasi dapat aktif bergerak (motile). Klebsiella pneumoniae merupakan bakteri yang non-motile.
7. Uji Triple Sugar Iron (TSI)
Uji TSI digunakan untuk membedakan bakteri Gram negatif yang memiliki kemampuan untuk memetabolisme laktosa dan sukrosa, menghasilkan asam dari fermentasi, memproduksi gas selama proses fermentasi dan menghasilkan H2S dengan bakteri yang tidak mempunyai kemampuan tersebut. Media ini terdiri dari 0,1% glukosa, 1% sukrosa, 1% laktosa. Klebsiella pneumoniae memfermentasi glukosa yang bersifat asam sehingga terbentuk warna kuning.
8. Fermentasi karbohidrat
Media ini berfungsi untuk melihat kemampuan bakteri memfermentasikan jenis karbohidrat, jika terjadi fermentasi maka media terlihat berwarna kuning karena perubahan pH menjadi asam. Klebsiella pneumoniae memfermentasi glukosa,
2.4 Kontrol Infeksi
Infeksi silang didefinisikan sebagai transmisi agen infeksi antara pasien dengan dokter gigi, perawat, tekniker dalam lingkungan klinik. Transmisi dapat terjadi dari seseorang ke orang lain yang berkontak atau melalui suatu objek yang terkontaminasi (Al-Jabrah, 2007; Almortadi, 2010).
Transmisi infeksi dari seseorang ke orang lain memerlukan: (Lamont, 2006; Samaranayake, 2012)
a. Sumber infeksi
Sumber infeksi dalam kedokteran gigi sebagian besar berasal dari manusia termasuk:
- Seseorang dengan penyakit infeksi (contoh: influenza, cacar, atau tuberkulosis).
- Seseorang dengan infeksi tertentu pada masa prodormal. Selama masa prodormal atau inkubasi, organisme membelah diri tanpa menunjukkan adanya infeksi; meskipun pasien sehat pada masa ini, tetapi pasien tersebut merupakan highly
infectious (contoh: infeksi virus, seperti campak, cacar, dan mumps).
- Seseorang yang sehat sebagai pembawa dari penyakit yang disebabkan mikroorganisme (contoh: Streptococcus pyogenes, Neisseria meningitidis, dan Haemophilus influenzae).
- Lingkungan sekitar seperti mikroorganisme yang terdapat di udara, biofilm dalam saluran air pada dental unit, atau pada instrumen (contoh: Acinetobacter, Pseudomonas aeruginosa, Mycobacterium spp.,dan Legionella spp.).
b. Perantara (darah, saliva, instrumen yang terkontaminasi darah, saliva dan debris).
c. Jalur penyebaran infeksi
- Contact routes pada infeksi silang melalui seseorang ke orang lain (melalui tangan dan pakaian), benda (melalui instrumen, chairs and units dan bahan cetak) dan cairan (melalui saluran air).
Kontrol infeksi merupakan komponen penting yang harus diterapkan di lingkungan klinik dan fakultas kedokteran gigi. Banyak penyakit yang dapat ditularkan dalam kedokteran gigi maka dokter gigi memiliki tanggung jawab dalam profesinya untuk memastikan keamanan dokter gigi, pasien, perawat, dan tekniker (Rutala, 2008).
Prosedur kontrol infeksi ada beberapa tahap yaitu: (Rutala, 2008; Rampal, 2010)
a. Evaluasi pasien
Pemeriksaan medis pada pasien diperlukan pada setiap kunjungan. Hal ini penting karena berhubungan dengan infeksi silang dan dapat memengaruhi perawatan
rongga mulut pada pasien. b. Perlindungan diri
Perlindungan diri meliputi personal hygiene, clinic clothing, barrier protection (sarung tangan, masker wajah, kacamata, dan isolasi rubber dam), dan
ketika membersihkan instrumen; dan isolasi rubber dam untuk mengurangi aerosol yang terkontaminasi saliva dan darah) dan imunisasi. Meskipun telah dilakukan imunisasi, kontrol infeksi tetap diperlukan untuk mencegah penyakit infeksi lainnya.
c. Sterilisasi instrumen
Instrumen harus dibersihkan segera setelah digunakan. Sterilisasi adalah proses untuk membunuh semua organisme (termasuk sporanya) pada instrumen atau benda mati, biasanya digunakan pada instrumen yang dapat digunakan kembali. Autoklaf sangat dianjurkan untuk prosedur sterilisasi. Setelah disterilisasi, instrumen harus disimpan di tempat yang steril.
d. Menggunakan alat sekali pakai seperti jarum, bur, dan skalpel.
e. Disinfeksi merupakan proses untuk membunuh organisme patogen pada suatu bahan atau objek. Metode disinfeksi yaitu dengan pemanasan (pasteurisasi; air mendidih), fisis (ultrasonik), dan kemis.
f. Asepsis laboratorium
Cetakan beserta sendok cetak dan peralatan lain harus dibilas air mengalir atau
dengan bahan disinfektan untuk menyingkirkan saliva dan darah kemudian disimpan dalam wadah yang sesuai kemudian dikirim ke laboratorium.
g. Limbah
Alat sekali pakai yang tajam seperti jarum, bur, skalpel, dan wadah anestesi lokal harus ditangani dengan hati-hati untuk mencegah terjadinya cedera. Semuanya itu harus diletakkan pada wadah kaku yang dapat disegel sebelum dibuang.
2.5 Disinfeksi
2.5.1 Disinfektan
Disinfektan secara umum dapat dikategorikan mempunyai potensi high, intermediate, atau low potency, tergantung kemampuannya untuk membunuh berbagai macam kelompok mikroorganisme: (Samaranayake, 2012)
a. Disinfektan tingkat tinggi (high-level disinfectant)
formaldelhid). Glutaraldelhid merupakan disinfektan yang bersifat tuberkulosidal, fungisidal, virusidal, dan bakterisidal tetapi tidak bersifat sporosidal. Glutaraldehid mampu mengalkilasi kelompok sulfahydryl, hydroxyl, carboxyl, dan amino pada mikroorganisme, yang mana mengubah sintesis RNA, DNA, dan protein.
b. Disinfektan tingkat sedang (intermediate-level disinfectant)
Disinfektan yang menghancurkan Mycobacterium tuberculosis, bakteri vegetatif, kebanyakan virus dan fungi, tetapi sedikit spora. Contoh: chlorine(sodium hipoklorit), phenolic (Chloroxylenol), iodophor (povidone iodine), alcohol (alkohol 70%, isopropyl). Chloroxylenol adalah fenol yang tidak mengiritasi, digunakan secara umum sebagai antiseptik, lemah melawan banyak bakteri dan kegunaannya terbatas untuk disinfeksi secara lokal. Iodophor merupakan disinfektan yang bersifat tuberkulosidal, fungisidal, virusidal, dan bakterisidal tetapi tidak bersifat sporosidal. Iodophor dapat melakukan penetrasi dengan cepat ke dalam dinding sel
mikroorganisme dan efek letal dipercaya dapat mengganggu struktur protein dan asam nukleat dan sintetis. Alkohol 70% merupakan disinfektan yang bersifat
bakterisidal, tuberkulosidal, fungisidal, dan virusidal tetapi tidak dapat menghancurkan spora bakteri. Aksi antimikroba dari alkohol yaitu denaturasi protein.
c. Disinfektan tingkat rendah (low-level disinfectant)
Cl2 + 2NaOH ⇌ NaOCl + NaCl + H2O 2.5.1.1 Sodium Hipoklorit
Sodium hipoklorit adalah salah satu bahan kimia yang berfungsi sebagai disinfektan karena dapat melepaskan klorin yang mampu membunuh mikroorganisme. Sodium hipoklorit termasuk golongan halogen yang teroksigenasi. Bahan tersebut bekerja cepat, sangat efektif melawan virus hepatitis B dan Human Immunodeficiency Virus (HIV) (Fukuzaki, 2006).
Struktur kimia sodium hipoklorit adalah NaOCl. Sodium hipoklorit diproduksi dengan adanya reaksi antara gas klorin (Cl2) dengan larutan sodium hidroksida (NaOH) yang akan menghasilkan sodium hipoklorit (NaOCl), garam (NaCl) dan air (H2O). Reaksi adalah seperti berikut:
Sodium hipoklorit dapat melepaskan klorin sehingga dapat menjadi bahan antimikroba yang mampu membunuh mikroorganisme. Ketika sodium hipoklorit larut dalam air akan terbentuk asam hipoklorit atau ion hipoklorit. Asam hipoklorit kemudian terdegradasi membentuk asam klorida dan oksigen. Oksigen merupakan oksidator yang sangat kuat, oleh karena itu, sodium hipoklorit sering digunakan untuk membunuh bakteri, virus, dan jamur. Larutan ini bermanfaat karena kemampuannya mengoksidasi dan menghidrolisa sel dan secara osmosis mengalirkan air keluar dari sel akibat sifatnya yang hipertonis. Sodium hipoklorit mempunyai pH antara 11-12.
Biofilm dilarutkan dan efek antimikrobanya mampu masuk lebih dalam dan membersihkan area yang terinfeksi secara lebih baik (Rutala, 2008). Efektivitas dari
sodium hipoklorit pada proses disinfeksi tergantung konsentrasi klorin yang tersedia dan pH larutan (Fukuzaki, 2006).
Sodium hipoklorit berupa larutan berwarna putih agak kekuningan, berbau khas dan sedikit menyengat. Sodium hipoklorit adalah salah satu zat aktif yang jika dilarutkan dalam air akan menimbulkan efek bleaching karena dapat melepaskan ion klorida ke dalam larutan dan juga efektif digunakan untuk pemurnian permukaan, pemutih, penghilang bau, dan disinfektan air. Sodium hipoklorit yang sering digunakan sebagai pemutih rumah tangga (household bleach) mempunyai konsentrasi 5,25%. Larutan dengan konsentrasi yang rendah, sebagai contoh sodium hipoklorit 1%, dapat ditoleransi oleh jaringan karena compatible secara biologi. Centers for Disease Control and Prevention (2003) merekomendasikan penggunaan sodium hipoklorit sebagai salah satu bahan disinfektan yang dapat digunakan untuk disinfeksi cetakan alginat dengan pengenceran 1:10 (0,525%).
Penggunaan sodium hipoklorit sebagai bahan disinfektan pada cetakan alginat terdapat keuntungan dan kekurangan. Keuntungan penggunaan sodium hipoklorit
sebagai bahan disinfektan adalah dapat membunuh bakteri Gram positif dan Gram negatif, spora, Mycobacterium tuberculosis, HIV dan HBV, mudah diperoleh, harga
murah, mudah digunakan, dan fast acting. Kekurangan penggunaan sodium hipoklorit sebagai bahan disinfektan adalah dapat mengalami inaktif bila permukaan yang akan didisinfeksi terdapat bahan organik (saliva, darah, debris) sehingga harus dibersihkan terlebih dahulu, dapat mengiritasi kulit dan membran mukosa, harus digunakan pada ruangan dengan ventilasi yang baik dan sangat toksik bila dicampur amonia (Fukuzaki, 2006).
2.5.2 Metode Disinfeksi
Metode disinfeksi yang dapat diaplikasikan pada cetakan alginat secara kimia ada dua yaitu: (Correia-Sousa, 2013)
a. Perendaman
disinfektan terhirup. Kekurangan metode perendaman yaitu distorsi hasil cetakan alginat bila direndam terlalu lama (Bustos, 2010).
Cetakan yang direndam dalam sodium hipoklorit konsentrasi 0,5%-1% selama 10-15 menit mampu menghambat pertumbuhan mikroorganisme seperti Streptococcus sanguis, Streptococcus pyogenes, Streptococcus agalactiac, Staphylococcus aureus, Staphylococcus epidermidis, Pseudomonas aeruginosa (Memarian, 2007). Disinfeksi cetakan dengan perendaman dalam sodium hipoklorit 0,5% selama 10 menit paling efisien dimana mikroorganisme berkurang sampai 99,99% (Correia-Sousa, 2013). Cetakan alginat yang direndam dengan sodium hipoklorit 0,5% selama 10 menit menghasilkan perubahan dimensi yang kecil sehingga tidak signifikan secara klinis dan tidak terdapat pengaruh terhadap kualitas permukaan cetakan alginat (Amin, 2009). Kekurangan metode perendaman cetakan alginat dengan menggunakan sodium hipoklorit 0,5% dapat diatasi dengan
mempersingkat waktu perendaman yang kurang dari 10 menit supaya tidak terjadi perubahan surface detail dan mampu menghambat pertumbuhan mikroorganisme
yang terdapat pada cetakan. b. Penyemprotan
e
r
an
gk
a Te
or
Bahan cetak alginat digunakan untuk mencetak detail jaringan keras dan lunak pasien pasca hemimaksilektomi. Sebelum kita melakukan pengambilan cetakan sebaiknya kita mengetahui komposisi, pemanipulasian, sifat-sifat bahan cetak alginat dan penyimpanan cetakan alginat. Pemanipulasian bahan cetak alginat memerlukan teknik pencampuran bahan cetak. Teknik pencampuran bahan cetak ada dua yaitu pencampuran manual dan mekanis. Pencampuran mekanis meliputi spinning mixing, centrifuge mixing, dan vacuum mixing.
Pengambilan cetakan alginat dilakukan pada pasien pasca hemimaksilektomi. Bakteri Klebsiella pneumoniae yang terdapat pada pasien hemimaksilektomi ditemukan di cetakan alginat. Pencegahan terhadap infeksi silang yang dapat terjadi dari pasien ke dokter gigi, perawat, dan tekniker maka diperlukan kontrol infeksi dengan mendisinfeksi cetakan alginat. Syarat disinfektan yaitu efektif sebagai antimikroba dan tidak ada respon negatif terhadap keakuratan cetakan. Disinfektan
secara umum dapat dikategorikan mempunyai potensi high, intermediate, atau low potency, tergantung kemampuannya untuk membunuh berbagai macam kelompok
mikroorganisme. Cetakan alginat yang terdapat Klebsiella pneumoniae didisinfeksi menggunakan disinfektan sodium hipoklorit 0,5% yang merupakan salah satu disinfektan kategori intermediate dengan metode semprot dan rendam.
e
r
an
gk
a K
on
se
2.8 Hipotesis
Berdasarkan rumusan di atas maka dapat disusun hipotesis penelitian bahwa: 1. Bakteri Klebsiella pneumoniae merupakan bakteri dominan pada pasien pasca hemimaksilektomi di Rumah Sakit Gigi dan Mulut Fakultas Kedokteran Gigi Universitas Sumatera Utara.
2. Ada pengaruh perendaman cetakan alginat pasien pasca hemimaksilektomi dengan larutan sodium hipoklorit 0,5% selama 1, 3, dan 5 menit terhadap jumlah bakteri Klebsiella pneumoniae.