8
TINJAUAN PUSTAKA
2.1 Keguguran berulang
Keguguran berulang secara tradisional didefinisikan sebagai tiga atau
lebih berturut-turut keguguran yang terjadi sebelum kehamilan 20 minggu
paska menstruasi (Bricker dan Farquharsson, 2002). Tapi wawasan baru telah
dimasukkan untuk mendefinisikan kembali keguguran berulang sebagai dua
atau lebih keguguran karena alasan seperti di bawah ini.
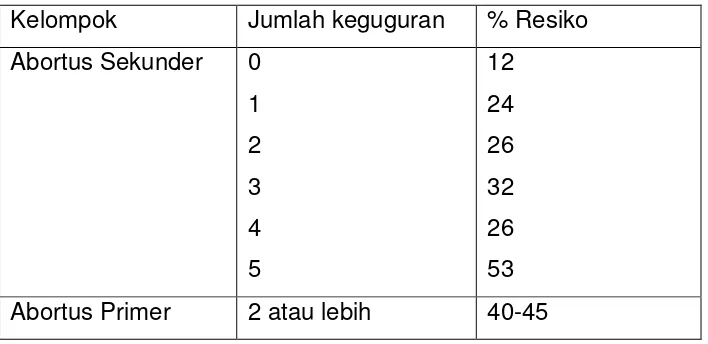
1. Resiko keguguran berulang setelah 2 kali keguguran adalah tinggi
sekitar 26% (Roman, 1984).
2. Dorongan dan tuntutan yang kuat dari pasangan untuk mencari
penyebab lebih lanjut dan pengobatan.
3. Dalam era modern ini sebagian besar pasangan menikah pada usia
lanjut.
Oleh karena itu, mereka tidak ingin menunggu sampai keguguran yang
ketiga untuk mencari bantuan pengobatan.
Keguguran berulang dapat menyebabkan perasaan frustasi dan kecewa bagi
kedua belah pihak, baik dokter maupun pasien. Berbagai tes diagnostik dan
pengobatan telah direkomendasikan dan dipublikasikan secara luas baik
dalam literatur medis maupun literatur awam. Namun, hanya sedikit yang telah
cukup diuji dengan penelitian yang dirancang tepat. ASRM telah merevisi
definisi keguguran berulang dengan mengacu sebagai dua atau lebih
keguguran (ASRM, 2008).
2.1.1 Konsepsi dan Pertumbuhan
Memahami pertumbuhan konsepsi dan proses perkembangan
kehamilan adalah sangat penting untuk mempelajari teori etiologi dan
keguguran.
Ada tiga tahap pertumbuhan konsepsi sebagai berikut (Branch dan Heuser,
2010).
1. Tahap Preembrionik, dimulai dari hari pertama haid dan berlangsung
sampai minggu ke-4 kehamilan. Oosit tumbuh menjadi oosit metafase 2 dan
berovulasi kemudian dibuahi oleh sperma dan menjadi morulla. Selanjutnya
pada endometrium. Pra-embrio tumbuh menjadi lempeng bilaminar dan
kemudian menjadi lempeng trilaminar.
2. Tahap embrio, dimulai dari minggu 5 sampai 10 minggu kehamilan. Selama
tahap ini, lempeng trilaminar berubah menjadi bentuk silinder untuk membentuk
kepala dan ekor. Semua proses organogenesis terjadi pada tahap ini.
3. Tahap janin mulai dari minggu 10 kehamilan sampai melahirkan. Tahap ini
ditandai dengan pertumbuhan dan diferensiasi semua organ terbentuk pada
tahap embrio.
Ada juga dua tahap yang berbeda dalam perkembangan plasenta dan
sirkulasi janin ibu. Pada kehamilan normal, ditandai oleh invasi sel trofoblas oleh
obstruksi arteri uteroplasenta. Pada 10 minggu pertama kehamilan, hal ini
ditandai dengan aliran darah yang sangat terbatas ibu ke dalam jaringan intervili
dan ruang intervili diisi dengan cairan acellular dan dalam keadaan hipoksia
(Burton et al, 2002). Pada periode ini, oksigenasi ke jaringan embrionik
sebagian besar terjadi melalui proses difusi antara jaringan yang berdekatan
daripada melalui sistem peredaran darah (Jauniaux et al, 2006). Setelah 10
minggu kehamilan, regresi trofoblas dan dislokasi colokan arteriol dimulai dan
memungkinkan inisiasi aliran darah intervili yang sebenarnya dan pada saat
yang bersamaan terjadi peningkatan dalam tegangan oksigen intervili (Toth et
al, 2010). Konsep dari sirkulasi plasenta dan plasentasi ini adalah penting dan
relevan dengan keguguran berulang, yang mana menggarisbawahi kerentanan
yang berbeda dari konseptus pada tahap yang berbeda dari konsepsi dan
ditandai dengan perbedaan dua diagnosis yang berbeda: keguguran berulang
dini (< 10 minggu) dan keguguran berulang lanjut (> 10 minggu). Terminologi
lain sebagai keguguran preembrionik atau embrionik dan kematian janin (Harlap
et al, 1980). Keguguran embrionik lebih umum daripada kematian janin (Bricker
dan Farquharsson, 2002). Perbedaan ini telah menjadi isu penting karena
etiologi dan tingkat rekurensi yang berbeda.
2.1.2 Klasifikasi
Klasifikasi keguguran menurut usia kehamilan acara adalah sebagai berikut:
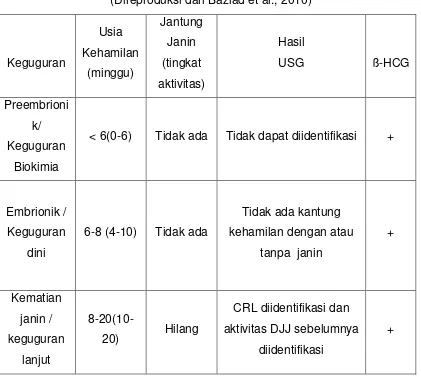
1. Keguguran Preembrionik (keguguran biokimia) dengan usia kehamilan
0-4 minggu
2. Keguguran Embrionik (keguguran dini) dengan usia kehamilan 4-10
minggu
3. Kematian Janin (keguguran lanjut) dengan usia kehamilan 10-20 minggu
Tabel 1 Klasifikasi keguguran berulang sesuai dengan usia kehamilan
(Direproduksi dari Baziad et al., 2010)
< 6(0-6) Tidak ada Tidak dapat diidentifikasi +
Klasifikasi keguguran sesuai dengan urutan kejadian adalah sebagai berikut:
1. Abortus Primer adalah kondisi dengan 2 atau lebih keguguran berturut-turut
2. Abortus sekunder adalah kondisi dengan 2 atau lebih keguguran
berturut-turut setelah riwayat kehamilan dengan usia kehamilan di atas 20 minggu
3. Abortus Tersier adalah kondisi dengan keguguran sebelumnya diikuti oleh
kehamilan dengan usia kehamilan di atas 20 minggu dan kemudian diikuti
dengan keguguran 2 atau lebih berturut-turut.
Resiko keguguran berturut-turut akan meningkat setelah ada riwayat
keguguran sebelumnya. Ini adalah alasan mengapa kita perlu menggali lebih
dalam etiologi keguguran berulang karena tingkat kekambuhannya yang tinggi.
Tabel 2 Resiko keguguran dini pada wanita muda (Roma, 1984)
Kelompok Jumlah keguguran % Resiko
Abortus Primer 2 atau lebih 40-45
2.1.3 Insiden
Insidensi dua kali keguguran adalah sekitar 5% dan hanya 1%
mengalami tiga atau lebih keguguran dari semua kehamilan (Rai dan Regan,
2006). Angka keguguran spontan di Indonesia adalah 10-15% dan ada sekitar 5
juta kehamilan per tahun di Indonesia yang mengalami keguguran spontan dan
diperkirakan sekitar 500.000-7.500.000 per tahun (Azhari, 2002; Baziad et al,
2010). Angka keguguran per tahun adalah sekitar 37 per 1000 wanita usia
reproduksi di Indonesia, angka ini cukup tinggi dibandingkan dengan Negara
Negara lain di Asia secara keseluruhan: regional sekitar 29 per 1000 wanita usia
reproduksi (Guttmacher, 2008). Keguguran berulang adalah sekitar 3-5% di
Indonesia (Harijanto, 2010). Di RS Dr.Hasan Sadikin Bandung, kejadian 2 kali
keguguran adalah 1,79% (Ningrum et al, 2004).
Sementara itu di HFC Medan, jumlah kasus keguguran berulang adalah 123
pasien dari seluruh 2876 pasien infertilitas yang berobat, diperkirakan sekitar
4,28% (HFC, 2011).
2.1.4 Etiologi
Banyak etiologi telah dipostulasikan terhadap keguguran berulang,
namun kebanyakan masih tetap kontroversial dan diklasifikasikan sebagai
idiopatik, di mana tidak ada penyebab yang dapat diidentifikasi pada pasangan.
Secara umum diketahui bahwa dalam kelompok idiopatik masih terdapat
heterogenitas yang cukup besar dan bahwa tidak mungkin hanya satu
mekanisme patologis tunggal yang menyebabkan terjadinya keguguran
berulang (Stirrat, 1990). Selain itu, ada perdebatan tentang penyebab dan
asosiasi, sebagai mekanisme patofisiologi yang tepat dari etiologi kebanyakan
dikenal belum tepat dijelaskan. Penelitian saat ini diarahkan pada teori tentang
kegagalan dalam kontrol alamiah terhadap kualitas gamet, implantasi, invasi
trofoblastik dan plasentasi, serta faktor-faktor lain yang mungkin seperti
embriopatik (Brigham et al, 1999). Kebanyakan wanita, dengan keguguran
berulang mungkin memiliki beberapa faktor risiko untuk keguguran (Jauniaux et
al, 2006).
Walaupun manfaatnya telah dilaporkan untuk berbagai pengobatan
endokrinologik dan imunologik, banyak pendekatan terapi masih kontroversial.
Penelitian acak terkontrol terbaru dan meta-analisis yang baru-baru ini
diterbitkan dalam literatur internasional menunjukkan beberapa faktor etiologi
berdasarkan kedokteran berbasis bukti.
a. Genetik / kromosom penyebab.
Analisis kromosom yang dilakukan dari darah orang tua mengidentifikasi
kelainan genetik yang diturunkan kurang dari 5% dari pasangan. Tampaknya
kemungkinan etiologi ini akan meningkat pada kelompok dengan: pasangan
dengan usia ibu yang rendah <35 tahun, riwayat tiga atau lebih keguguran
dari garis keluarga tingkat satu (orang tua atau saudara kandung) (Toth et al,
2010). Translokasi adalah kelainan kromosom yang paling umum diwariskan.
Meskipun orang tua dengan kromosom translokasi sering terlihat normal,
embrio yang mereka hasilkan dapat menerima materi genetik terlalu banyak
atau terlalu sedikit yang dapat mengakibatkan keguguran. Bertolak belakang
diwariskan, banyak keguguran terjadi karena kelainan kromosom acak pada
embrio (Franssen et al, 2005). Bahkan, 50-75% atau lebih dari keguguran dini
disebabkan oleh kelainan kromosom secara acak, kelainan kromosom ini
biasanya numerik (Fritz dan Speroff, 2005).
b. Usia ibu yang lanjut.
Pada usia 40, lebih dari sepertiga dari seluruh kehamilan, pada usia 43,
setengah dari seluruh kehamilan dan setelah usia 45, hampir semua
kehamilan akan mengalami keguguran. Sebagian besar embrio memiliki
jumlah abnormal kromosom (Fritz dan Speroff, 2005; ASRM 2008).
c. Kelainan hormonal.
Progesteron diperlukan untuk kehamilan agar dapat berlanjut (Pritts dan
Atwood, 2002). Masih ada kontroversi mengenai kondisi yang disebut dengan
defek fase luteal dimana kadar progesteron rendah selama kehamilan dan ini
dinyatakan dapat menyebabkan keguguran (Erdem et al, 2009).
d. Kelainan metabolik.
Diabetes yang tidak terkontrol meningkatkan risiko keguguran pada wanita.
Obesitas (Clark et al, 1998) dan Sindrom Ovarium polikistik (PCOS), memiliki
resiko yang lebih tinggi terjadinya keguguran karena adanya resistensi insulin
(Wang et al, 2001) atau karena meningkatnya kadar androgen dan LH
(Clifford, 1996). Pasien dengan gangguan tiroid yang tidak diobati juga dapat
mengakibatkan keguguran berulang (Abalovich et al, 2002).
e. Kelainan uterus.
Distorsi rongga rahim dapat ditemukan pada sekitar 10% sampai 15% dari
wanita dengan keguguran berulang. Kelainan bawaan seperti uterus didelphys, bicornis, unicornis, septum uterus, sedangkan sindrom ashermann, fibroid dan polip rahim yang merupakan kelainan yang didapat juga menyebabkan keguguran berulang (Salim et al, 2003).
f. Sindrom antifosfolipid.
Tes darah untuk antibodi anticardiolipin, β glicoprotein dan lupus antikoagulan dapat mengidentifikasi wanita dengan sindrom antifosfolipid,
yang menyebabkan trombosis pasokan darah ke konsepsi. Sekitar 3%
sampai 15% dari keguguran berulang disebabkan oleh kondisi ini (Empson,
2002).
Kelainan bawaan yang meningkatkan risiko pembekuan darah yang serius
(trombosis) juga dapat meningkatkan risiko kematian janin pada semester
kedua kehamilan. Namun, tidak ada manfaat yang terbukti untuk
pemeriksaan atau pengobatan dengan trombofilia pada keguguran berulang
semester pertama kehamilan (Mico dan D'uva, 2009).
h. Rhesus tidak cocok.
Sekarang diketahui bahwa tanpa profilaksis, ada kemungkinan 15% dari
imunisasi rhesus menyebabkan konsekuensi bencana keguguran pada
kehamilan berikutnya untuk wanita Rhesus negatif dengan suami Rhesus
positif (ACOG, 1996).
i. Tidak diketahui
Pada 50-70% pasangan dengan keguguran berulang umumnya tidak
diketahui penyebabnya (ASRM, 2008).
j. Infeksi bakteri, virus dan parasit semua bisa mengganggu perkembangan
awal kehamilan, tetapi tidak ada yang tampaknya menjadi penyebab
signifikan keguguran berulang. Penapisan Toksoplasmosis - Rubella - Cytomegalovirus - Herpes (TORCH) oleh karenanya mempunyai nilai terbatas dalam penyelidikan keguguran berulang, di luar sebuah episode
infeksi akut (Charles dan Larsen, 1990).
k. Lingkungan yang mengandung racun seperti pestisida, logam berat seperti air
raksa dan timah, pelarut organik, dan konsumsi alkohol yang berlebihan,
radiasi pengion (Korrick et al, 2001). Perokok berat, kafein, dan hipertermi
juga diduga menyebabkan keguguran berulang (Gardella dan Hill, 2000).
l. Faktor laki-laki.
Ada penemuan dari studi yang kontroversial bahwa kerusakan DNA sperma
dapat mempengaruhi perkembangan embrio dan kemungkinan dapat
menyebabkan keguguran. Namun, data ini masih awal dan tidak diketahui
seberapa sering cacat sperma berkontribusi pada keguguran berulang
(Hankel et al, 2004).
2.1.5 Pemeriksaan
Berdasarkan Evidence Based Medicine maka pemeriksaan yang dianjurkan untuk pasangan dengan keguguran berulang adalah berikut:
a. Pemeriksaan status Koagulasi darah.
Wanita dengan riwayat tiga atau lebih keguguran sebelum 10 minggu, atau
kematian janin ≥ 10 minggu yang tidak dapat dijelaskan dengan janin morfologis normal, atau lahir prematur ≤ γ4 minggu dengan preeklamsia berat atau insufisiensi plasenta, harus ditawarkan tes Lupus Antikoagulan,
antibodi anticardiolipin, antibodi ß2 glycoprotein-1 untuk memastikan
diagnosa sindroma antifosfolipid (Micco and D’uva ,β009; Empson et al, 2002) . Hubungan wanita yang mengalami keguguran <10 minggu dengan
trombofilia yang diturunkan, termasuk Faktor V Leiden, defisiensi resistensi
protein C teraktivasi, prothrombin G20210A dan defisiensi protein S masih
simpang siur. Studi epidemiologi yang lebih besar jelas diperlukan untuk
membenarkan pengujian penapisan trombofilia diwariskan dalam praktek
klinis rutin (Dawood et al 2003; Bohlmann et al, 2004).
b. Pemeriksaan endokrinologis.
Data-data epidemiologi awal telah menunjukkan hubungan antara keguguran
berulang dengan hipotiroidisme atau diabetes mellitus. Meskipun bukti saat
ini menunjukkan bahwa hipotiroidisme dan diabetes yang terkendali tidak
berkaitan dengan keguguran berulang, tes fungsi tiroid dan pengukuran
HbA1c yang akurat dan murah masih dapat dianggap sebagai bagian dari
evaluasi keguguran berulang (Mills, dkk, 1994; Abalovich et al, 2002).
Obesitas dikaitkan dengan peningkatan risiko yang signifikan secara statistik
dengan keguguran berulang semester pertama. Hubungan Sindrom Ovarium
Polikistik (PCOS) dan keguguran berulang telah ditunjukkan, dan dapat
merupakan akibat dari hubungan antara obesitas dan keguguran (Clark et
al, 1998). Gangguan endokrinologi lainnya seperti hipersekresi LH (Regan
et al, 1990), resistensi insulin tinggi, hiperandrogenemia (Rai et al, 2000),
hiperprolaktinemia (Hukum, 2005) dan defek fase luteal telah dikaitkan
dengan keguguran berulang (Karamadian dan Grimes, 1994).
c. Pemeriksaan imunologis .
Respon imun yang berlebihan terhadap antigen ayah sehingga
menghasilkan sel-sel imun yang abnormal dan produksi sitokin telah dan
masih dianggap sebagai salah satu penyebab keguguran berulang. Secara
khusus, perhatian saat ini difokuskan pada hubungan antara keguguran
berulang dan sel Natural Killer (NK). Meskipun banyak bukti-bukti yang
bertentangan, studi ini menunjukkan perbedaan kadar darah perifer-sel NK
pada wanita dengan keguguran berulang (Tang et al, 2011). Perbedaan
fenotipik dan fungsional antara sel-sel darah perifer NK, dan tes untuk
mengukur sel-sel NK dalam darah perifer tidak memberikan informasi yang
berguna mengenai jumlah sel NK uterus . Dalam konteks ini, pengujian sel
darah perifer NK tidak boleh dilakukan secara rutin dalam evaluasi
keguguran pada keguguran spontan secara umum dan keguguran
berulang pada khususnya (Jauniaux et al, 2006). Keseimbangan antara
sitokin Th1 dan sitokin Th2 adalah penting untuk menunjang berlanjutnya
kehamilan. Sitokin Th1 membantu penolakan allograft dan sitokin Th2
menghambat respon Th1 (Piccinni, 2006).
d. Pemeriksaan sitogenetika orang tua.
Insiden kelainan struktur kromosom, biasanya berupa translokasi seimbang
meningkat pada pasangan dengan keguguran berulang. Semua empat
faktor, yaitu usia ibu muda pada keguguran kedua, riwayat tiga atau lebih
keguguran, riwayat dari dua atau lebih keguguran pada seorang saudara
atau saudari, dan sejarah dari dua atau lebih keguguran pada orangtua
pasangan baik dari istri maupun suami akan meningkatkan probabilitas
status karier bila ada empat faktor yang digabungkan. Setelah satu
keguguran, secara umum masih dapat diterima untuk menahan diri dari
pemeriksaan analisa kromosom. Insiden status karier setelah satu
keguguran adalah 2,2%. Dengan demikian disarankan untuk merujuk untuk kariotipe orangtua hanya bila probabilitas status carrier ≥ β,β% (Franssen et al, 2005).
e. Pemeriksaan histopatologi dan sitogenetika.
Sementara ini merupakan praktik rutin mengirim produk dari konsepsi untuk
pemeriksaan histologis, terutama untuk menyingkirkan kemungkinan
jaringan plasenta dan / atau janin pada kasus keguguran berulang untuk
kepentingan penanganan kehamilan di masa yang akan datang masih harus
dipelajari . Secara keseluruhan, tidak tepatnya dalam laporan morfologi vili
dan keterbatasan klinis yang bermakna dari temuan tentang adanya
aneuploidi pada keguguran sporadis telah membuat banyak penulis
menyimpulkan bahwa klasifikasi histologis adalah pemeriksaan klinis yang
tidak berharga (Fox et al, 1993).
f. Pemeriksaan kelainan anatomi.
Prevalensi dan dampak malformasi uterus terhadap fungsi reproduksi pada
populasi umum belum jelas dapat dipastikan. Secara tradisional,
laparoskopi, Histerosalpingografi (HSG) dan / atau histeroskopi telah
digunakan untuk mendiagnosa malformasi uterus pada wanita dengan
keguguran berulang. USG, USG 3D khususnya, cukup akurat,hasilnya
terpercaya , non-invasif, dengan basis rawat jalan untuk diagnosis kelainan
kongenital rahim. Telah dilaporkan bahwa wanita dengan rahim ber septum
memiliki insiden yang lebih tinggi keguguran trimester pertama, sedangkan
wanita dengan rahim arkuata lebih sering terjadi keguguran pada trimester
kedua dan kelahiran prematur (Salim et al, 2003).
g. Pemeriksaan infeksi.
Sangat kecil kemungkinan infeksi pada ibu dapat menyebabkan keguguran
berulang. Tidak ada hasil positif dan korelasi keguguran berulang dengan
TORCH (Toxoplasmosis - Rubella - Cytomegolavirus - Herpes) dan
pemeriksaan klamidia. Di Inggris, sebagian besar unit di rumah sakit telah
berhenti melakukan tes ini (Li et al, 2002).
Vaginosis bakterial adalah infeksi vagina yang dapat menyebabkan
kelahiran prematur dan kematian janin tetapi tidak terkait dengan keguguran
dini (Hay et al, 1994; Trabert dan Misra, 2007; Waters et al, 2008).
2.1.6 Pemeriksaan keguguran berulang dini
Yang diusulkan pemeriksaan untuk keguguran berulang dini untuk menemukan
penyebabnya adalah sebagai berikut:
a. Pemeriksaan sitogenetika orangtua
Semua empat faktor, yaitu usia ibu yang masih muda pada keguguran kedua
keguguran pada seorang saudara atau saudari, dan sejarah dari dua atau
lebih keguguran pada orangtua dari istri maupun suami dapat meningkatkan
kemungkinan status karier yang diperoleh saat ini bila empat faktor
digabungkan. Setelah satu keguguran, secara umum diterima untuk
menahan diri dari pemeriksaan analisa kromosom. Insiden status karier
setelah satu keguguran adalah 2,2%. Dengan demikian disarankan untuk
melakukan pemeriksaan untuk kariotipe orangtua hanya bila probabilitas
status carrier ≥ β,β% (Franssen et al, β005). b. Gangguan metabolik
Hanya diabetes yang tidak terkontrol dapat menyebabkan keguguran
berulang. Kadar gula darah puasa atau HBA1c cukup untuk penapisan
diabetes (Mills et al,1994)
Hipotiroidisme sebagai penyebab keguguran dapat disaring dengan
pengujian kadar TSH (Abalovich et al, 2002).
c. Gangguan endokrin reproduksi
Beberapa gangguan endokrin reproduksi adalah:
1. PCOS dapat didiagnosis dari kriteria Rotterdam yang memenuhi
setidaknya 2 dari berikut: oligo / anovulasi, tanda biokimia dan / atau
klinis hiperandrogenisme; ovarium Polikistik setelah eksklusi gangguan
terkait (Wang et al, 2001).
2. Hiperprolakinemia dapat didiagnosis dari tes kadar prolaktin jika> 25
mIU / Ml diidentifikasi sebagai hiperprolaktinemia (UU, 2005).
3. Defek Fase luteal ini dapat didiagnosis dari riwayat menstruasi yang
singkat di mana periode menstruasi kurang dari 26 hari atau dengan uji
progesteron mid luteal yang <10 ng / dl dianggap sebagai tanda defek
fase luteal (Karamadian dan Grimes, 1994).
d. Gangguan imunologi
Wanita dengan riwayat tiga atau lebih keguguran dengan usia kehamilan
sebelum 10 minggu, atau kematian konsepsi yang tidak dapat dijelaskan pada ≥ 10 minggu dengan janin morfologis normal, atau lahir prematur ≤ γ4 minggu dengan preeklampsia berat atau insufisiensi plasenta, harus
e. Idiopatik
Ketika semua pemeriksaan di atas dinyatakan normal.
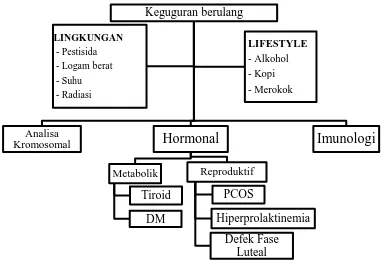
Gambar 1 Bagan pemeriksaan Keguguran berulang dini (Dimodifikasi dan
direproduksi dari Baziad et al, 2010)
Keguguran berulang
Analisa
Kromosomal
Hormonal
Metabolik
Tiroid DM
Reproduktif
PCOS
Hiperprolaktinemia Defek Fase
Luteal
Imunologi
LINGKUNGAN
- Pestisida
- Logam berat - Suhu
- Radiasi
LIFESTYLE
- Alkohol - Kopi - Merokok
2.1.7 Pemeriksaan pada kematian janin
Pemeriksaan pada kematian janin meliputi seluruh pemeriksaan pada
keguguran berulang dini ditambah dengan pemeriksaan tambahan sebagai
berikut:
1 Gangguan hematologi
a. Wanita dengan keturunan trombofilia, termasuk Factor V Leiden defisiensi,
resistensi protein C teraktivasi, prothrombin G20210A, dan defisiensi protein
S dapat diselidiki dengan pemeriksaan waktu prothrombin, activated
prothrombin time (aPTT), protein C, protein S, resitensi protein C
teraktivasi, fungsi trombosit (Dawood et al, 2003; Bohlmann et al, 2004).
b. Ketidakcocokan rhesus akan menyebabkan keguguran setelah kehamilan
berikutnya dari ibu dengan golongan darah rhesus negatif yang mengandung
bayi dari suami dengan golongan darah rhesus positif dengan kemungkinan
sebanyak 15% (ACOG, 1996).
2. Kelainan Anatomi
a. Kelainan kongenital rahim seperti rahim unikornuat, septum, didelfis,
bikornuat, dan arkuata.
b. Kelainan rahim yang didapat seperti mioma, polip, dan Sindrom Ashermann
itu.
c. Serviks inkompeten (Salim et al, 2003).
3. Infeksi cervicitis dan vaginitis yang disebabkan oleh vaginosis bakterial
(Waters et al, 2008).
2.1.8 Pengelolaan keguguran berulang
Manajemen keguguran berulang berdasarkan pada etiologi nya (Baziad et al,
2010):
A. Kelainan kromosom
Pasien harus diberitahu dan ditawarkan untuk skrining prenatal. Tidak ada
pengobatan khusus untuk kelainan genetik yang diturunkan kecuali
dengan donor embrio atau sel gamet.
a. Gangguan metabolik
1. Diabetes mellitus, gula darah harus dikontrol dengan menggunakan obat
antidiabetik oral seperti kelompok sulfonilurea atau metformin.
2. Hipotiroidisme dapat diobati dengan suplemen tiroksin.
b. Gangguan endokrin reproduksi
1. PCOS dan defek fase luteal dapat diobati dengan induksi ovulasi dan obat
penyokong fase luteal.
2. Hiperprolaktinemia dapat diobati dengan dopamine agonis seperti
bromokriptin.
c. Gangguan imunologi
Sindrom antifosfolipid dapat diobati dengan kombinasi antikoagulan seperti
heparin dan agen anti trombotik seperti aspirin dosis rendah.
d. Gangguan hematologi
Trombofilia dapat diobati dengan antikoagulan seperti heparin.
e. Kelainan Anatomi
Kelainan rahim dapat dikelola dengan operasi khusus seperti septum dapat
diobati dengan reseksi histeroskopi.rahim bikornuat dapat diobati dengan
metroplasti. Mioma dapat diobati dengan miomektomi, Sindrom Ashermann
bisa diobati dengan histeroskopi adhesiolisis.
Serviks inkompeten dapat dikelola dengan circlage serviks
f. Infeksi bakteri vaginosis dapat diobati dengan antibiotik tertentu seperti
metronidazol atau klindamisin.
g. Gaya hidup
Gaya hidup seperti perokok berat, peminum alkohol berlebihan atau
peminum
kopi yang berlebihan harus mengurangi atau berhenti dari kebiasaan itu.
Bagi mereka yang bekerja dengan pestisida, logam berat atau lingkungan
panas
yang berlebihan harus diubah dan menghindari lingkungan seperti itu.
i. Idiopathik
Tidak ada pengobatan spesifik.
2.2 Faktor Pria faktor dan keguguran berulang
Banyak aspek wanita telah diteliti untuk mencari berbagai faktor
penyebab terjadinya keguguran berulang, tetapi sangat sedikit yang dilakukan
terhadap faktor laki-laki. Gamet jantan memberikan kontribusi 50% dari bahan
genom untuk embrio dan berkontribusi untuk perkembangan plasenta dan
embrio (Sutovsky et al, 2000). Perubahan genetik dan epigenetik sperma oleh
karena itu mungkin memiliki konsekuensi penting pada awal kehamilan.
Perubahan epigenetik dalam sperma, seperti pengepakan kromatin yang
berubah, kesalahan pencetakan, ketiadaan atau perubahan pemendekan,
Sentrosom telomer, dan tidak adanya RNA sperma, dapat mempengaruhi
beberapa karakteristik fungsional yang menyebabkan keguguran embrio dini(Gill
Villa dkk, 2007 ).
Ada standar penilaian faktor pria dengan menggunakan analisis semen
standar untuk menilai jumlah, motilitas dan indeks morfologi sperma. Tidak ada
asosiasi yang kuat antara keberhasilan fertilisasi dan pembelahan embrio
pada program fertilisasi in vitro dengan morfologi sperma berdasarkan Kriteria
Kruger, yang menunjukkan bila sperma dengan morfologi yang abnormal akan
menghasilkan embrio kualitas buruk . Embrio dengan kualitas yang jelek ini
kemudian mungkin akan menyebabkan keguguran berulang, tetapi korelasi
keguguran berulang dengan indeks morfologi sperma yang buruk masih belum
signifikan (Kazerooni et al, 2009). Semua parameter dalam analisis semen
gagal tampil sebagai faktor etiologi yang penting dalam keguguran (Hommonai
et al, 1980; Sbracia et al, 1996). Tes fungsi sperma lain seperti uji
Hypoosmotik (HOS) , status acrosomal dan dekondensasi kromatin nukleus
juga diselidiki dalam kaitan dengan keguguran, tetapi hasilnya masih
kontroversial (Saxena et al, 2008; Gill Villa et al, 2010).
Sebuah petanda yang lebih baik dan dapat berkorelasi dengan kelainan
sperma diperlukan dalam konteks ini. Salah satu tes yang tersedia adalah tes
DNA sperma fragmentasi untuk melihat integritas kromatin sperma . Hasil
berkorelasi baik dengan potensi sperma untuk menghasilkan embrio yang akan
cukup "kompeten untuk menghasilkan kelahiran hidup". Tingkat kelainan pada
materi genetik sperma dinyatakan secara numerik sebagai Fragmentasi DNA
Index (DFI) (Evenson et al, 2006). Kerusakan DNA mungkin ada dalam sperma
fragmentasi DNA sperma dapat mengungkapkan kelainan tersembunyi dalam
DNA sperma pada pria tidak subur yang saat ini diklasifikasikan sebagai
kelainan yang mana tidak dapat dijelaskan dengan parameter sperma normal
standar (Irvine et al, 2000). Pria infertil dengan karakteristik analisa sperma
yang abnormal menunjukkan peningkatan kadar kerusakan DNA pada sperma
mereka. Sperma dari pria infertil dengan sperma yang kelihatan normal dapat
terlihat level kerusakan DNA sebanding dengan laki-laki infertil dengan
parameter sperma yang abnormal. Data menunjukkan bahwa tes abnormal
lebih mungkin terjadi dalam kasus-kasus parameter sperma abnormal. Dengan
demikian, uji ini idealnya cocok untuk klinik kesuburan untuk menilai integritas
DNA sperma laki-laki dalam kaitannya dengan potensi kesuburan dan
perkembangan embrio serta efek dari bahan beracun reproduktif (Saleh et al,
2002).
Fertilisasi dan perkembangan embrio mamalia selanjutnya tergantung
sebagian pada integritas yang melekat pada DNA sperma (Ahmadi dan Ng,
1999). Memang, tampaknya ada batas ambang kerusakan DNA sperma
(fragmentasi DNA, kemasan kromatin yang abnormal, dan defisiensi protamine)
yang mana bila dilewati akan timbul gangguan perkembangan dan kehamilan
(Cho et al, 2003). Uji integritas DNA telah dikembangkan dan diterapkan dalam
praktek klinis. Namun, data dari studi untuk mengevaluasi pengaruh integritas
DNA sperma pada luaran reproduksi belum pernah dianalisis secara sistematis.
2.3 Fragmentasi DNA Sperma
2.3.1 DNA sperma Manusia dan struktur kromatin
Tidak seperti sel somatik kromatin, kromatin sperma sangat erat
dipadatkan berdasarkan asosiasi unik di antara DNA, matriks nukleus, dan
protein nukleus sperma. Selama tahap akhir pematangan spermatid,
kondensasi chromatin dan reorganisasi histon dan digantikan oleh protamin
dan hanya 15% DNA yang tetap berkondensasi dengan histon (Gatewood et al,
1990). Dimasukkannya protamin ke dalam inti sperma memungkinkan untai
DNA untuk membentuk struktur toroidal (berbentuk donat), memfasilitasi
pemadatan yang erat kepala nukleus sperma untuk menyediakan sarana untuk
menonaktifkan sementara transkripsi dari genom haploid laki-laki dan untuk
integritas genom ayah selama transportasi melalui saluran reproduksi laki-laki
dan perempuan dan menjamin DNA ayah disalurkan kedalam proses penyatuan
dari dua genom gamet dan mewariskan informasi genetik kepada embrio yang
telah terbentuk (Ward dan Zalensky, 1996). Disulfida cross-link inter dan
intramolekular antara protamin memungkinkan pemadatan lebih lanjut dan
stabilisasi inti sperma, melindungi DNA sperma dari stres eksternal dan
kerusakan DNA berikutnya. Kurangnya protamin yang kaya sistein akan
menyebabkan instabilisasi DNA sperma. Ada 3 jenis protamin pada manusia.
Protein ini kecil, hanya berukuran setengah dari histon dan sangat basa, 55% -
70% mengandung arginin (Cho et al, 2003).
Pria subur dengan parameter semen normal hampir semua memiliki
tingkat kerusakan DNA yang rendah, sedangkan laki-laki tidak subur, terutama
mereka dengan parameter sperma yang abnormal mempunyai derajat
kerusakan DNA yang lebih tinggi. Selain itu, sampai dengan 8% dari pria subur
akan memiliki integritas DNA yang abnormal meskipun parameter semen
normal (konsentrasi, motilitas, dan morfologi) (Spano et al, 2000).
2.3.2 Etiologi kerusakan DNA sperma
Etiologi kerusakan DNA sperma sama seperti etiologi infertilitas pria,
tampaknya multifaktorial dan berupa faktor intrinsik atau eksternal dan sampai
sekarang tidak sepenuhnya dipahami.
Gangguan intrinsik yang dapat mempengaruhi kerusakan DNA sperma meliputi:
1. Defisiensi protamin, yang mungkin menyebabkan masalah dalam
pemadatan DNA dan stabilisasi, di mana jika longgar, DNA akan mudah
terfragmentasi (Cho et al, 2003; Oliva, 2006).
2. Mutasi yang mempengaruhi merusak proses pemadatan DNA (Gatewood et
al, 1990).
3. Defek proses pengemasan DNA. Selama tahap akhir pematangan sperma,
untai DNA dipecahkan oleh topoisomerase secara temporer dan ditemukan
pada spermatid bulat dan lonjong, sementara itu inti histon dalam spermatid
dihancurkan dan digantikan oleh protamin untuk proses pengemasan
kromatin ulang. Jika pemecahan sementara DNA tidak diperbaiki karena
berlebihan topoisomerase atau kekurangan topisomerase inhibitor maka
fragmentasi DNA akan terjadi (Balhorn, 1982; Sharma et al, 2004).
4. Apoptosis abortif. Sampai dengan 75% spermatozoa potensial
menyelesaikan proses kematian sel terprogram (apoptosis) selama
spermatogenesis (Hikim et al, 1999). Proses ini bertujuan untuk membatasi
garis sel germinal supaya sebanding dengan jumlah sel Sertoli yang
mendukung mereka. Spermatozoa yang mulai menjalani apoptosis tetapi
kemudian terhindar dari proses ("apoptosis abortif") akan menderita
peningkatan kerusakan DNA (Sakkas et al, 2003). Teori ini didukung dengan
ditemukannya Fas spermatozoa pada ejakulasi, spermatozoa yang
mengandung banyak mitokondria yang apoptotik (Donnelly et al, 2000) dan
adanya kehadiran aktivitas endonuklease, salah satu mediator potensial
dalam apoptosis (Spadofora, 1998).
5. Tingginya kadar Reactive Oxygen Species (ROS) yang terdeteksi dalam
cairan semen 25% dari pria infertil (Agarwal et al, 1994), dan kerusakan
DNA sperma telah dikaitkan dengan kadar yang tinggi ROS dalam semen
(Zini dan Lamirande, 1993). Sumber utama ROS dalam semen berasal dari
leukosit (Ozgocmen et al, 2003) dan morfologi sperma dengan bentuk
abnormal (Aitken dan Barat, 1990). Dalam keadaan normal, ROS berguna
untuk meningkatkan fungsi sperma untuk kapasitasi, reaksi akrosom dan
fusi sperma ke dalam oosist (Gagnon et al, 1991). Jumlah ROS juga
dikendalikan oleh antioksidan semen. Ketika ROS berlebihan dibanding
jumlah antioksidan semen ,keadaan ini disebut sebagai stres oksidatif
(Aitken dan Fisher, 1994), ini akan mengoksidasi asam lemak tak jenuh
ganda pada membran sperma dan selanjutnya akan terjadi kerusakan
DNA (Lopes et al, 1998).
6. Usia ayah yang lanjut telah dikaitkan dengan kerusakan DNA sperma yang
mungkin karena disebabkan proses mutasi dan apoptosis (Singh et al,
2003).
Faktor eksternal yang dapat menyebabkan fragmentasi DNA sperma
seperti panas (Bank et al, 2005), agen kemoterapi (Hales et al, 2005), radiasi
(Aitken dan Luliis, 2007), dan gonadotoxin lain seperti pestisida, kimia berkaitan
dengan peningkatan dalam persentase spermatozoa ejakulasi dengan
kerusakan DNA, (Bian et al, 2004) meskipun mekanisme yang tepat yang
terlibat belum dapat digambarkan (Brinkworth et al, 2000). Merokok (Kunzle et
kriptorkismus dan kanker semua telah dikaitkan dengan peningkatan kerusakan
DNA pada model binatang atau manusia (Evenson et al, 2006). Kurangnya
stimulasi FSH juga akan meningkatkan fragmentasi DNA (Hikim et al, 1999).
Akhirnya, tehnik preparasi sperma dengan menggunakan sentrifugasi
kecepatan tinggi dan isolasi sperma dari cairan semen, yang mengandung
antioksidan yang bersifat protektif , dapat berkontribusi terhadap kerusakan
DNA sperma (Donnelly et al, 2000; Younglai et al, 2001).
2.3.3 Konsekuensi kerusakan DNA sperma
Sperma dengan fragmentasi DNA yang tinggi akan kehilangan
kemampuannya untuk membuahi sel telur (Ahmadi dan Ng, 1999). Sampai
tingkat tertentu kerusakan DNA sperma, oosit memiliki kemampuan untuk
memperbaiki kerusakan DNA sperma dan telah dibuktikan dalam telur hamster
(Genesca dan Caballin, 1992). Jika sel telur dibuahi dan menjadi embrio,
kemungkinan menjadi cacat akan lebih tinggi. Hasil kehamilan dapat berakhir
dengan keguguran atau keturunan dengan kelainan genetik (Crow, 1997).
2.3.4 Interpretasi hasil indeks fragmentasi sperma
Kerusakan DNA sperma dapat diukur dan dinyatakan sebagai Indeks
Fragmentasi DNA sperma (DFI) dengan menghitung jumlah sperma dengan
DNA terfragmentasi dan bandingkan dengan total sperma dihitung. Ambang
batas DFI untuk manusia pertama kali dibuat menggunakan data-data dari 200
pasangan usia subur diduga berusaha untuk hamil secara alami dalam "Studi
Faktor Infertilitas Pria Georgetown". Data-data dari studi ini digunakan untuk
menetapkan ambang statistik DFI> 30% untuk 'lag signifikan', DFI 15-30% untuk
'batas ambang' dan DFI <15% untuk 'status kesuburan tinggi' (Evenson et al,
2006 ).
Studi dilakukan untuk menyelidiki hubungan fragmentasi DNA sperma pada
hasil kehamilan menggunakan in-vivo dan prosedur IUI dan hasil menunjukkan
bahwa pasien 7.1 kali lebih mungkin untuk mencapai kehamilan / persalinan jika
indeks fragmentasi DNA (DFI) adalah <30%. Ketika IVF rutin dipertimbangkan,
pasangan itu ~ 2,0 kali lebih mungkin untuk menjadi hamil jika mereka DFI
<30% (Bungum et al, 2004). Studi menggunakan ICSI dan / atau pembuahan
IVF untuk menyelidiki hubungan fragmentasi DNA sperma pada hasil
kehamilan menunjukkan tren di mana pasien 1,8 kali lebih mungkin untuk
signifikan memprediksi keberhasilan kehamilan yang rendah dengan
menggunakan in-vivo, IUI, dan IVF dan tingkat fertilisasi yang lebih rendah
dengan ICSI (Morris et al, 2002). Data ini jelas menunjukkan bahwa DFI
merupakan komponen penting dari pemeriksaan infertilitas dan menyarankan
bahwa jika seorang pria memiliki DFI dari> 30% bahwa IUI seharusnya tidak
dipertimbangkan dan bahwa langkah untuk pasangan ini adalah lebih tepat IVF
atau ICSI (Bungum et al, 2004 ).
2.3.5 Metode untuk penilaian fragmentasi DNA sperma
Ada beberapa metode dalam penilaian fragmentasi DNA sperma:
a. Pewarnaan Asam anilin biru, dengan mendeteksi histon kaya lisin dan dan
dan protamin kaya arginin. Histon akan menyerap warna biru dan protamin
tidak akan menyerap warna biru (Hammadeh et al, 2001).
b. Acridine orange Test (AOT), dengan mendeteksi kerusakan DNA sperma
menggunakan flow cytometer . Sperma yang dipanaskan sampai 100 ° C
selama 5 menit untuk denaturasi DNA dan diikuti dengan pewarnaan
dengan acridine Orange (AO), AO interkalasi ke dalam DNA asli dan
berfluoresensi hijau bila terkena cahaya biru dan berfluoresensi merah bila
dikaitkan dengan DNA beruntai tunggal (Agarwal et al, 2008).
c. Dalam uji in situ nick translation incorporation of biotinylated deoxyuridine
trifosfat (dUTP) pada rantai tunggal DNA yang pecah dalam reaksi yang
dikatalisis oleh enzim yang dependen DNA polimerase I. Secara khusus
sperma yang mengandung cukup banyak kerusakan DNA endogen akan
terwarnai (Manicardi et al, 1998).
d. Terminal Deoxynucleotidyl Mediated dUTP transferase Nick end labeling
assay (Tunel), esensi dari tes adalah untuk mentransfer nukleotida berlabel
ke 3 ° OH dari untai DNA yang pecah dengan menggunakan terminal
deoxynucleotidyl transferase. Intensiatas Fluoresens dari masing-masing
diperiksa sperma ditentukan sebagai ya atau tidak untuk sperma pada slide
mikroskop cahaya fluoresence atau dengan saluran intensitas fluoresen
dalam alat flow cytometer (Sailer et al, 1995).
e. Uji komet, terdiri dari untai DNA yang pecah terdeteksi dalam sel tunggal
pada slide mikroskop. Metodologi ini terdiri dari pencampuran sperma
dengan agarosa meleleh, yang ditempatkan pada slide kaca. Sel-sel
molekul tinggi, DNA yang tidak rusak tetap di kepala sperma, sedangkan
pecahan yang lebih kecil dari DNA bermigrasi keluar untuk mengambil
bentuk komet (Morris et al, 2002).
f. Sperm chromatin Structure Assay (SCSA) mengukur kerentanan DNA situ
terhadap asam yang menginduksi transisi kumparan heliks konformasi
terhadap pewarnaan fluoresensi AO dengan menggunakan flow cytometry
untuk mencari pergeseran metachromatic fluoresensi hijau (DNA asli)
menjadi fluoresensi merah(DNA yang terdenaturasi) sebagai perubahan
struktur kromatin yang termasuk kemungkinan adanya fragmentasi DNA,
denaturasi protein yang memungkinkan denaturasi DNA (Apedaile, 2004).
g. Fluoresece in situ Hibridization (FISH) Assay. Kemasan kromatin sperma
abnormal meningkatkan aksesibilitas ligan DNA dan sensitivitas denaturasi
DNA oleh alkali dan ini berkaitan dengan adanya pelabelan intens
(fluoresensi merah) oleh FISH (Fernandez et al, 1998).
h. 8-hidroksi-2-deoxyguanosine level assay, uji yang mewakili biomarker
kerusakan DNA oksidatif menggunakan kromatografi cairan berkinerja tinggi
(Shen dan Ong, 2000).
i. Sperma Kromatin Dispersi (SCD) assay, dasar teknologi terletak pada
respon yang berbeda yang ditawarkan oleh inti sperma dengan DNA
terfragmentasi dibandingkan dengan mereka yang utuh. Denaturasi
dikendalikan dari DNA diikuti oleh ekstraksi protein nukleus menimbulkan
nucleoids yang terdeproteiniisasi sebagian di mana untai DNA akan
melebar , membentuk lingkaran cahaya dari dispersi kromatin dan nukleotida
sperma yang terfragmentasi tidak akan membentuk atau sedikit halo. Tes
ini juga disebut sebagai tes halosperm (Evenson et al, 2005; Fernandez et
al, 2005).
2.4 Hiperhomosisteinemia
2.4.1 Metabolisme Homosistein
Homosistein adalah asam amino yang mengandung sulfur dengan
rumus SCH2CH2CH (NH2) CO2H. Ini adalah homolog dengan sistein ,
berbeda oleh adanya tambahan kelompok metilen (CH2). Dia dibuat dari
metionin dengan menghilangkan kelompok metil terminal C nya. Homosistein
dapat didaur ulang menjadi metionin atau diubah menjadi sistein (Ueland et al,
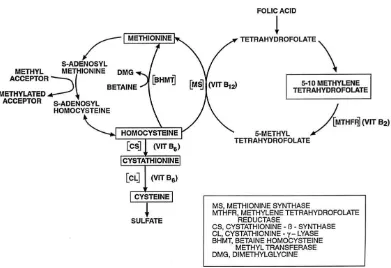
Gambar 4 Metabolisme homositein direproduksi dari Malinow et al, 1999
Homosistein adalah molekul alami dalam tubuh, tidak diperoleh dari
makanan dan diperlukan dalam beberapa reaksi yang terjadi dalam sel-sel yang
membentuk tubuh manusia (Sonmez et al, 2007). Reaksi yang rinci ada dalam
gambar di atas, mereka menghasilkan pembentukan sistein dan metionin, yang
dapat lebih digunakan oleh tubuh. Jika jalur ke sistein atau metionin diblokir,
maka kadar homosistein akan meningkat (Ueland et al, 1993).
Tiga enzim dalam diagram di atas akan difokuskan pada, karena mereka
berhubungan dengan tingkat homosistein tinggi. Enzim ini adalah
Methylenetetrahydrofolate Reduktase (MTHFR), Beta-Cystathionine Synthase
(CBS) dan Synthase Metionin (MS). Selama remethilasi ke metionin, suatu
kelompok metil yang disediakan oleh 5 tetrahidrofolat metil ditransfer ke
homosistein oleh MS dan diperlukan vitamin B12 (methycobalamin) dalam
rangka untuk melaksanakan reaksi nya. Jalur homosistein, alternatif juga dapat
menjadi metionin oleh remethylated Betaine-Homosistein methyltransferase
(BHMT) di mana kelompok metil disediakan oleh betaine. Metionin oleh
kemudian akan digabungkan dengan berbagai peptida berubah menjadi
S-Adenosyl-Metionin (SAM). SAM memiliki peran penting sebagai donor metil
universal dalam sejumlah besar proses metilasi. Selama proses demetilasi,
untuk bentuk S-Adenosylhomocysteine (SAH). Akhirnya, SAH dihidrolisis dalam
reaksi areversible menjadi homosistein (Forges et al, 2007).
Flavine dinukleotida adenin tergantung metilen 5,10 THF reduktase
(MTHFR) diperlukan untuk membentuk 5-metil tetrahidrofolat dari tetrahidrofolat
metilen 5-10. Hal ini diperlukan dalam rangka untuk mengubah homosistein
untuk metionin. Jika hal ini tidak dapat dibentuk, maka tingkat homocysteine
akan meningkat (Brattstrom et al, 1998).
Enzim akhir terkait dengan tingkat homosistein tinggi adalah CBS, ini
dengan vitamin B6 sebagai kofaktor yang dibutuhkan untuk mengkonversi
homosistein untuk cystathionine, yang oleh liase Beta Cystathionine (CBL) akan
mengkonversi cystathionine untuk sistein. Dengan tidak adanya CBS, tingkat
homosistein akan meningkat (Nelson dan Cox, 2000).
2.4.2 Tingkat homosistein plasma
Dalam tubuh manusia sekitar 75% dari homosistein terikat pada protein
dan sisanya 25% dalam tiga bentuk: teroksidasi, campuran disulfida dicampur
dan homosistein bebas (Aubard et al, 2000). Kadar total secara umum pada populasi Barat adalah 10 sampai 1βμmol / L dan kadar setinggi β0μmol / L ditemukan di populasi dengan asupan rendah vitamin B (NewDelhi). Kadar
homosistein 30% lebih rendah pada anak dan kelompok usia lanjut memiliki 50
% lebih tinggi dari kadar dewasa normal (Selhub et al, 1993). Perempuan
memiliki 10-15% homosistein lebih rendah selama dekade reproduksi mereka
dibanding pria, tetapi setelah 60 tahun kadar meningkat sekitar 1 μml / L untuk setiap sepuluh tahun (Brattstorm et al, 1994).
Kadar homosistein dipengaruhi oleh hormon . Seorang wanita pramenopause
memiliki kadar 2 umol / L lebih rendah dibandingkan laki-laki usia yang sama.
Wanita normal yang memiliki kadar 6 - 10μml / L, sedangkan pria memiliki 8 -1βμmol / L. Setelah menopause, kadarnya menyerupai kadar laki-laki pada usia yang sama (Kang et al, 1986).
Kadar homosistein dapat dipengaruhi hormon tiroid. Pada hipothiroidisme
kronis kadar homosistein dapat naik dan menyebabkan penyakit vaskular
(Nedrebo et al, 1998). Asupan makanan juga mempengaruhi kadar
homocysteine.Kadar akan naik bila dalam asupan makanan terdapat
ketidakseimbangan yang kaya metionin, kurang vitamin B6 , Vitamin B12 dan
Tabel 3 Rujukan batas kadar homosistein (Selhub et al, 1999)
Kondisi dengan peningkatan kadar homosistein dalam darah dikenal
sebagai hiperhomosisteinemia. Ada banyak nilai acuan yang berbeda untuk
hiperhomosisteinemia.
Kondisi ini dapat ditemukan pada pasien yang memiliki mutasi pada CBS
atau MTHFR. Sebuah mutasi heterozigot umumnya memiliki peningkatan ringan
pada kadar homosistein. Tipe lain mutasi yang dapat terjadi adalah dengan
MTHFR. Mutasi ini menghasilkan varian termolabil (yang berarti bahwa protein
menjadi inaktif jika dipanaskan). Penderita yang heterozigot mutasi ini tidak
akan memiliki gejala hiperhomosisteinemia atau peningkatan risiko gangguan
trombotik. Penderita yang homozigot dapat timbul hiperhomosisteinemia yang
signifikan (Selhub et al, 1993). Prevalensi hiperhomosisteinemia pada populasi
umum belum diketahui, tetapi penelitian melihat prevalensi homozigositas dari
gen untuk mutasi varian termolabil di MTHFR menunjukkan prevalensi hampir
15% di Eropa, Tengah timur dan populasi Jepang, dibandingkan dengan
rentang di bawah 1,4%, pada orang Afro Amerika. Pasien dengan heterozigot
terlihat pada 30-40% dari populasi (Brattstrom et al, 1998; Selhub et al, 1999).
Kadar homosistein lebih tinggi di antara perokok dan peminum kopi berat.
homosistein lebih rendah dalam pekerja berat daripada mereka yang bekerja
banyak duduk. Ada juga sejumlah obat yang dapat mengganggu metabolisme
folat seperti methotrexate, niasin, fenofibrate, metformin, levodopa, phenitoin,
fenotiazin, carbamazapine yang dapat meningkatkan kadar homocysteine.
Sama untuk obat yang dapat mengganggu vitamin B6 seperti teofilin,
azarabine, estrogen - yang mengandung kontrasepsi oral, merokok dan
terhadap vitamin B12 seperti oksida nitrat (Passwater, 2002).
Individu yang memiliki status gizi buruk dan penyalahgunaan gizi seperti
alkoholisme kronis, penyakit usus kronis / malabsorpsi, penyakit metabolik
seperti diabetes, gangguan fungsi ginjal (Robinson et al, 1996), psoriasis berat,
anemia pernisiosa, insufisiensi zincum, beberapa neoplasia (leukemia
limphoblastik akut, kanker payudara, ovarium dan pankreas), paska stroke dan
serangan jantung juga akan meningkatkan kadar homosistein (Hankey dan
Eikelboom, 1999).
2.4.4 Risiko hiperhomosisteinemia
Pasien dengan hiperhomosisteinemia yang berat dan mengarah ke
homocystinuria, umumnya mengalami kelainan tulang dan okular (mata) (Kang
et al, 1992) serta keterlambatan perkembangan dan keterbelakangan mental
serta komplikasi trombotik (Wilcken dan Dudman, 1989). Masalah-masalah ini
terlihat pada pasien yang homozigot baik yang defisiensi CBS atau MTHFR.
Gagasan bahwa peningkatan homosistein berhubungan dengan penyakit
trombotik arteri pertama kali dikemukakan pada tahun 1969 dalam
hubungannya dengan pasien homocystinuria oleh Mc Cully (Passwater, 2002).
Selama mencari hubungan kausal ini dilihat juga apakah peningkatan ringan
(seperti dari kekurangan vitamin, heterozigositas untuk kekurangan CBS atau
MTHFR atau homozigositas untuk varian termolabil dari MTHFR) juga
meningkatkan risiko. Sejumlah penelitian telah menunjukkan adanya
peningkatan risiko untuk penyakit jantung, stroke (Perry et al, 1995) dan
penyakit pembuluh darah perifer (Stampfer dan Malinow, 1995; Graham, 1997)
dan trombosis vaskular retina (Cahill et al, 2000).
2.5 Hiperhomosisteinemia dan fragmentasi DNA
2.5.1 hiperhomosisteinemia dan kerusakan DNA
Homosistein, suatu metabolit dari asam amino esensial metionin,
memainkan peran kunci dalam menhasilkan kelompok metil diperlukan untuk
sintesis DNA, dan homosistein dapat diremetilasi menadi metionin oleh enzim
yang memerlukan folat atau kobalamin (vitamin B12) atau dikatolobilisasi oleh
CBS, suatu enzim yang bergantung kepada piridoksin, untuk membentuk sistein
(Selhub, 1999).
Sebuah studi baru-baru ini telah mengungkapkan peran homosistein
dalam memberikan kontribusi patogenesis gangguan neurodegenerative yang
menunjukkan bahwa homosistein menginduksi kematian sel pada sel saraf otak
tikus. Untai DNA mengalami pemecahan dengan cepat setelah terpapar
homosisstein sebelum terjaidnya disfungsi mitokondria, stres oksidatif dan
aktivasi caspase (enzim yang mendegradasi DNA selama kematian sel) (Inna et
al, 2000).
Peristiwa pada jalur apoptosis yang diaktifkan oleh homosistein
tampaknya terjadi dengan urutan sebagai berikut: kerusakan DNA yang
berhubungan dengan aktivasi Poli-ADP-ribosa Polymerase (PARP), aktivasi
aktivasi caspase dan aktivasi p53, penurunan potensial membran mitokondria
dan disintegrasi nukleus. Selanjutnya, aktivasi PARP meningkatkan ingkat
ROS, kalsium intraseluler, p53 (Sakhi et al, 1996).
Akumulasi konsentrasi yang relatif tinggi dari homosistein dalam sel
dapat menyebabkan untai DNA pecah dengan mengganggu siklus metilasi
DNA dan selanjutnya menyebabkan kerusakan DNA. Peningkatan kadar
homosistein juga terbukti menyebabkan kerusakan sel hati mencit dengan
menginduks terjadinya hipometilasi DNA (Liu et al, 2008).
2.5.2 Hiperhomosisteinemia maternal dan luaran reproduksi
Hiperhomosisteinemia ibu akan meningkatkan risiko infertilitas dan
keguguran berulang dengan peningkatan terjadinya pemecahan untai DNA ,
hipometilasi DNA, ketidakstabilan kromosom dan aneuploidi embrio atau oosit.
Ada 14% dari pasien keguguran berulang primer dan 33% dari keguguran
sekunder primer berulang dengan hiperhomosisteinemia (Wouters et al, 1993).
Meta-analisis memastikan adanya peningkatan risiko keguguran berulang dini
dengan rasio odd sebesar 14,2 pada penderita dengan MTHFR allele 677T
dan 1298C dan risikonya bahkan bisa lebih tinggi jika ibu dan janinnya adalah
homozigot (Zetterberg et al, 2002). Kemungkinan terjadinya trisomi 21 juga
meningkat (Passwater, 2002). Bukti yang paling jelas pengaruh homosistein
terhadap luaran reproduksi adalah adanya peningkatan risiko cacat tabung
saraf pada janin dari ibu yang kekurangan asam folat (Cristiansen et al, 2005;
Forges et al, 2007). Pada akhir kehamilan, hiperhomosisteinemia dikaitkan
dengan insiden yang lebih tinggi pre-eklampsia. Hal ini dilaporkan bahwa di
antara penderita pra-elampsia berat, terdapat 17% memiliki
hiperhomosisteinemia (Leeda et al, 1998).
Insiden hiperhomosisteinemia pada solusio plasenta adalah 31% dibandingkan
dengan hanya 9% pada kelompok kontrol (Goddjin-Wessel et al, 1996).
Sebesar 38,2% Kasus PJT yang tidak diketahui penyebabnya dikaitkan
dengan hyperhomocysteinemia (De Vries et al, 1997). Burke et al menemukan
10% kematian perinatal berhubungan dengan hiperhomosisteinemia.
Kehamilan dengan risiko tinggi hiperhomosisteinemia memiliki resiko
terjadinya thromboemboli. Kehamilan itu sendiri merupakan faktor risiko
trombotik. Kombinasi hiperhomosisteinemia dan kehamilan membuat risiko
meningkat terjadinya thromboembolic. Apakah tromboprofilaksis diperlukan ,
pertanyaan ini masih kontroversial.
2.5.3 Hiperhomosisteinemia paternal dan luaran reproduksi
Dampak dari hiperthomosisteinemia untuk infertilitas pria masih
kontroversial. Dalam penelitian di Jerman, prevalensi dari polimorfisme MTHFR
secara signifikan lebih tinggi di antara pasien laki-laki tidak subur dibandingkan
dengan kontrol (18,8% vs 9,5%) (Bezold et al, 2001). Sebaliknya, hasil di atas
tidak diperoleh pada kelompok Belanda yang tidak menemukan perbedaan yang
signifikan dalam prevalensi polimorfisme MTHFR antara kelompok normal dan
subur (Ebisch et al, 2003). Namun, efek peningkatan kadar homosistein dalam
sel gamet ayah terhadap embrio dan luaran kehamilan masih tetap belum
diketahui. Studi baru dibutuhkan untuk mengeksplorasi pengaruh homosistein
terhadap sperma dan dampaknya terhadap janin dari akibat peningkatan kadar
homocysteine ayah. Secara teoritis, kadar yang tinggi homosistein juga dapat
meningkatkan ROS yang telah terbukti menyebabkan kerusakan DNA sperma.
Demikian jugaa, homosistein itu sendiri dapat menyebabkan kerusakan DNA
sperma.
2.6 Kadar homosistein dalam cairan semen
Pada manusia, gluthatione tiol (GSH) (L- -glutamil-L-sistein-glisin)
berfungsi sebagai antioksidan endogen yang paling penting yang terlibat dalam
menjaga keseimbangan pro-oksidan-antioksidan dalam jaringan manusia. Tiol
sistein endogen lainnya adalah (Cys), homosistein (hcy) dan Cysteinglycine
(CGS). GSH juga terlibat dalam metabolisme dan detoksifikasi senyawa
sitotoksik dan karsinogenik dan dalam eliminasi Reactive Oxygen Species
(ROS) (Tremellen et al, 2008).
Tiol dan ROS terlibat dalam proses reproduksi manusia. Pada manusia,
spermatozoa menghasilkan ROS yang diketahui mempengaruhi hiperaktivasi
spermatozoa, reaksi akrosom dan penempelan spermatozoa ke oosit, sehingga
berkontribusi untuk pembuahan oosit (Aitken et al, 1998). Tiol adalah berfungsi
memangsa ROS dan karena itu menjadi penting dalam fungsi sperma dan
pembuahan . DNA dalam kepala sperma sangat dipadatkan sebagai hasil dari
jembatan disulfida antara residu Cys teroksidasi dalam molekul protamine yang
penting selama pematangan spermatozoa pada epididimis. Oksidasi dari tiol
juga penting untuk stabilisasi struktur ekor, motilitas sperma dan perlindungan
kerusakan DNA sperma dari kerusakan fisik atau kimia (Aitken dan Clarkson,
1987). Setelah pembuahan oosit, sperma inti yang dipadatkan mengalami
dekondensasi untuk membentuk pronuclear laki-laki (PN). Dekondensasi
tergantung pada kehadiran sejumlah kecil Cys bebas yang mampu memulai
proses pertukaran tiol-disulfida (Rousseaux et al, 1995). Selain efek yang
menguntungkan, ROS yang berlebihan berakibat buruk terhadap spermatozoa
dan menyebabkan kerusakan DNA dan membran plasma. Karena spermatozoa
telah dibuang sebagian besar sitoplasma mereka selama tahap akhir
spermatogenesis, ketersediaan enzim sitoplasma defensif menadi sangat
terbatas. Sel-sel ini secara khusus rentan terhadap kerusakan terutama untuk
ROS. Hal ini dapat menyebabkan disfungsi sperma (Agarwal et al, 1994).
Peningkatan kadar homosistein dalam plasma semen dapat meningkatkan
konsentrasi ROS dan mengganggu metilasi DNA yang selanjutnya dapat
Kadar homosistein dalam cairan semen ditemukan sebesar 4,8 ±
0.52uM/ml pada kasus normozoospermia dan 6,18 ± 1.17uM/ml pada kasus
sperma abnormal (Zarghami dan Khosrowbeygi, 2005).
2.7 Penanganan hiperhomosisteinemia
Dalam reaksi yang dikatalisis oleh vitamin B12-metil transferase,
homosistein dapat memperoleh gugus metil dari methyltetrahydrofolate untuk
menghasilkan metionin .Kelebihan homosistein yang tidak diselesaikan dengan
jalur methinonin dapat dikatabolisasi menjadi sistein melalui dua jalur yang
melibatkan enzim yang tergantung kepada vitamin B6 (Forges et al, 2007).
Pada jalur metabolism diatas kelihatan peran vitamin cyanocobalamin,
piridoksin dan asam folat dalam metabolism homosistein. Dengan pemberian
cyanocobalamin,piridoksin ,asam folat diharapkan dapart menurunkan kadar
homosistein
Badan FDA Ameriksa Serikat melakukan fortifikasi folat ke dalam
gandum pada Januari 1998 dan laporan pertama dari pengaruh fortifikasi
menunjukkan pengurangan 92% dari prevalensi konsentrasi sirkulasi folat yang kurang dari 7μmol / L dan penurunan 48% dalam prevalensi homosistein lebih besar dari konsentrasi 1γμmol / L (Jacques et al, 1999).
Folat, piridoksin, dan sianokobalamin dapat mengurangi tingkat
homosistein dalam tubuh manusia dan selanjutnya juga akan mengurangi
fragmentasi DNA sperma dan akhirnya dapat mengurangi kejadian keguguran
berulang. Studi lebih lanjut diperlukan untuk menyelidiki apakah folat, piridoksin,
dan suplemen cyanocobalamin pada pasien laki-laki akan mengurangi
fragmentasi DNA sperma dan kejadian keguguran berulang.