Laporan Resmi Praktikum Kimia Koordinasi “PENENTUAN KOMPOSISI ION KOMPLEKS”
Nama / NIM : Muhamad. Syaiful Ampri.(652015011) Judul : Penentuan Komposisi Ion Kompleks Tanggal Praktikum : 23 Februari 2017
Landasan teori
1. Senyawa Kompleks
Senyawa kompleks adalah senyawa yang terdiri dari satu atom pusat atau lebih yang menerima sumbangan pasangan elektron dari atom lain, gugus atom penyumbang elektron ini disebut ligan (Pudyaatmaka, 2002). Ligan didalam ion kompleks berupa ion-ion negatif seperti F- dan CN- atau berupa molekul-molekul polar dengan muatan negatifnya mengarah pada ion pusat seperti H2O atau NH3. Ligan seperti I-, NH3,CN- hanya memiliki satu atom donor pasangan elektron, dan disebut monodentat. Ligan yang mempunyai atom donor lebih dari satu disebut multidentat. (Harjadi, 1990).
Satu ion (molekul) kompleks terdiri dari satu atom pusat dengan sejumlah ligan yang terikat erat dengan atom pusat. Atom pusat ditandai dengan bilangan koordinasi. Suatu angka bulat yang ditunjukkan dengan ligan monodentat yang dapat membentuk kompleks stabil dengan atom pusat (Vogel, 1989).
Kemampuan ion kompleks melakukan reaksi yang mengahasilkan pergantian satu atau lebih ligan dalam lingkungan koordinasinya oleh yang lain disebut kelabilan. Kompleks inert adalah yang reaksi pergantian ligannya cukup lambat. Dengan cara memasukkan bersama-sama zat pereaksi di dalam wadah (Cotton, 1989).
Faktor-faktor yang Mempengaruhi Stabilitas Ion Kompleks
1. Aspek ion pusat.
b. Stabilitas ion kompleks bertambah dengan adanya CFSE, karena CFSE merupakan energi penstabilan tambahan yang diakibatkan oleh terjadinya splitting orbital d.
c. Ion-ion logam klas a (asam keras) yaitu yang memiliki muatan tinggi dan ukuran kecil akan membentuk kompleks ysng stabil jika ligannya berasal dari basa keras, yaitu yang elektronegatifitasya besar dan berukuran kecil
2. Aspek ligan
a. Kompleks khelat lebih stabil dibanding kompleks nonkhelat analog (yang atom donornya sama). [Ni(en)3]3+ dengan β3 sebesar
4.1018adalahlebih stabil dibanding [Ni(NH
3)6]3+ β6 sebesar 108
b. Ukuran cincin : Jika ligan tidak memiliki ikatan angkap, ikatan cincin 5 adalah yang paling stabil, tetapi jka ligan memiliki ikatan rangkap, maka yang paling stabil adalah ikatan cincin 6.
c. Steric effect : Ligan-ligan bercabang pada umumnya kurang stabi dibanding ligan-ligan tak bercabang yang analog.
d. Polarisabilitas : Ion-ion logam klas a (asam keras) yaitu yang memiliki muatan tinggi dan ukuran kecil akan membentuk kompleks ysng stabil jika ligannya berasal dari basa keras, yaitu yang elektronegatifitasya besar dan berukuran kecil (Cotton, 1989).
2. Spektrofotometer UV-Vis
Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk terjadinya transisi elektronik. Dengan demikian, spektra uv-visible disebut spektra elektronik. Keadaan energi yang paling rendah disebut dengan keadaan dasar (ground state). Transisi-transisi elektronik akan meningkatkan energi molekuler dari keadaan dasar ke satu atau lebih tingkat energi tereksitasi. Penentuan kadar secara spektrofotometri sinar tampak dilakukan dengan mengukur absorbansi maksimum (Pudyaatmaka, 2002). Apabila senyawa fisik tidak berwarna maka senyawa diubah dulu menjadi senyawa berwarna melalui reaksi kimia dan absorbansi ditentukan dalam daerah sinar tampak (Khopkar, 1990).
3. Metode Job
Variasi kontinyu merupakan suatu cabang ilmu kimia yang sangat penting karena dapat menentukan dan melakukan suatu proses perubahan-perubahan secara fisika maupun kimia yang dapat kita amati melalui variasi kontinyu. (Khopkar, 1990.)
Metode variasi kontinyu yang dikemukakan oleh Job dapat menimbulkan kondisi optimum pembentukan dan konstanta kestabilan senyawa kompleks yang mengandung konsentrasi ion logam maupun konsentrasi ligan divariasikan (Ewing, 1985).
Metode Job dilakukan dengan pengamatan terhadap kuantitas molar pereaksi yang berubah-ubah, namun molar totalnya sama. Sifat fisika (massa, volume, suhu, daya serap) diperiksa dan perubahannya digunakan untuk meramal stoikiometri sistem. Dari grafik aluran sifat fisik terhadap kuantitas pereaksi, akan diperoleh titik maksimal atau minimal yang sesuai dengan titik stoikiometri sistem yang menyatakan peerbandingan pereaksi dalam senyawa (Khopkar, 1990.).
Tujuan
2. Menentukan panjang gelombang maksimum untuk kompleks besi(III) dengan asam salisilat.
3. Menentukan nilai n (jumlah ion asaam salisilat-) dalam senyawa kompleks
yang terbentuk.
Alat dan bahan
a. Alat-alat yang diperlukan
- 1 set spektrofotometer UV-Vis - 20 buah tabung reaksi
- 1 buah pipet ukur 10 mL b. Bahan-bahan yang dibutuhkan
- Larutan ammonium besi(III) sufat - Larutan asam salisilat
Metode
1. Disiapkan larutan Fe3+ dan asam salisilat dalam 2.10-3 M asam khlorida yang
konsentrasinya masing-masing 2.10-3 dan disiapkan juga 20 buah tabung reaksi.
2. Diisilah labu ukur pertama dengan larutan Fe3+, kemudian dengan menggunakan
tabung reaksi yang lain, buatlah larutan campuran Fe3+ dan asam salisilat
sebanyak 5 mL dengan fraksi mol asam salisilat (X) 0; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; dan 0,9 (masing-masing 2).
3. Dicari panjang gelombang maksimum dari setiap larutan tersebut pada panjang gelombang 350 – 700 nm. Kemudian diukur serapan dari semua larutan itu pada setiap panjang gelombang maksimum yang diperoleh.
4. Dihitunglah harga Y pada setiap panjang gelombang untuk semua larutan tersebut di atas.
5. Dibuat kurva hubungan antara Y dengan X untuk setiap panjang gelombang yang diberikan. Kemudian dari harga X yang memberikan kurva maksimum, tentukan harga n untuk kompleks [Fe(asa)n]3+ yang ada dalam larutan.
Pembahasan
Pada percobaan kali ini, dilakukan penentuan komposisi larutan kompleks ion besi salisilat menggunakan metode job. Pada percobaan ini digunkan logam Fe3+
sebagai atom pusat dan asam saisilat sebagai ligan. Untuk menentukan variasi Fe3+
dan asam salisilat maka dibuat perbandingan terhadap variasi volume Fe3+ : asam
salisilat dimana kosentrasi Fe3+ dan asam salisilat sama yaitu 0,002 M. Digunakan
konsentrasi yang sama dengan tujuan agar jumlah molar logam dan ligan tetap sama sehingga yang berbeda adalah komposisi antara jumlah Fe3+ dan asam salisilat. Jika
komposisi ligan semakin banyak maka komposisi logam semakin sedikit dan jika komposisi ligan semakin sedikit maka komposisi logam semakin besar. Reaksi yang terjadi antara larutan Fe3+ dan asam salisilat tersebut adalah :
Fe3+ + asa- → [Fe(asa)]3+
Fe3+ + asa- → [Fe(asa) 2]2+
Fe3+ + asa- → [Fe(asa) 3]+
Kemudian disiapkan juga 20 buah tabung reaksi. Kemudian diisi tabung reaksi pertama dengan larutan Fe3+ dengan volume 5 mL sebagai blanko, Fungsi dari blanko
sampel (mengandung pereaksi dan Fe) dikurangi serapan pereaksinya. Kemudian dengan menggunakan tabung yang lain, dibuat larutan fraksi mol asam salisilat (X) 0,1;0,2;0,3;0,4;0,5;0,6;0,7;0,8; dan 0,9 (masing-masing dua) . Lalu dicari λmaksimal dari setiap larutan terebut λ pada = 350 – 700 nm pada salah satu ulangan. Kemudian diukur serapan dari semua larutan itu pada setiap panjang gelombang maksimum yang telah diperoleh. Campuran asam salisilat dengan larutan Fe3+ , menghasilkan
warna ungu. Warna ini disebabkan oleh adanya transisi elektronik dari kompleks tersebut. Kompleks ini menunjukan warna komplementernya kerena atom pusatnya memiliki orbital d yang belum terisi penuh elektron. Adanya orbital d yang belum terisi penuh ini menyebabkan kemungkinan terjadinya transisi elektronik dari orbital d yang tingkat energinya terendah ke orbital d yang tingkat energinya tinggi. Struktur kompleks ini adalah oktahedral sehingga transisi yang terjadi adalah dari orbital t2g ke orbital eg. Yang kemudian dianalisis dengan menggunakan spektrometer
UV-Vis.
itu mengalami penurunan ini diakibatkan karena reaksi pada campuran yang sudah melampaui kesetimbangan. Pada percobaan ini, panjang gelombang maksimum yang diperoleh yaitu 530 nm dengan absorbansi 1,403. Secara teoritis, panjang gelombang maksimum untuk kompleks besi(III) salisilat adalah 520 nm.
Sehingga dapat dikatakan bahwa pada penentuan panjang gelombang maksimum terjadi pergeseran ke panjang gelombang yang lebih panjang (bathokromik). Hal ini disebabkan oleh adanya perpanjangan konjugasi atau ikatan jenuh berselang-seling dengan ikatan tunggal yang berpengaruh pada penyerapan sinar. Selain itu dapat juga disebabkan karena kompleks ini menyerap warna dari warna koplementer ungu yaitu kuning. Namun munculnya panjang gelombang maksimum pada daerah UV disebabkan adanya trasisi elektronik yang disebabkan adanya gugus kromofor yakni cincin benzena yang terdapat pada kompleks tersebut.
Pada panjang gelombang maksimum (530 nm) tersebut, diperoleh absorbansi larutan Fe3+ sebesar 0,022 nm dan menghasilkan absorbansi tertinggi pada larutan
dengan fraksi mol 0,5 yaitu 0,1380 dengan perbandingan volume (2,5 : 2,5). Absorbansi maksimum dapat terjadi karena larutan sudah tidak dapat mampu lagi melewati ketinggian serapan maksimumnya. Ketika fraksi mol mulai masuk dari 0,6 sampai 0,9 terjadi penurunan absorbansi pada campuran Fe3+ dan asam salisilat. Hal
ini dikarenakan absorbansi sebanding dengan banyaknya ligan yang bereaksi jadi ketika perbandingan Fe3+ dan asam salisilat sama, atau (1:1) akan menghasilkan
nilaiabsorbansi yang besar.
Pada percobaan ini, penentuan komposisi ion kompleks dilakukan dengan metode job atau metode variasi kontinyu. Dalam metode variasi kontinyu, larutan kation dan ligan dicampur sesuai dengan komposisi yang diinginkan dengan volume total yang sama. Kemudian absorbansi dari tiap komposisi larutan diukur pada panjang gelombang 530 nm. Pada percobaan dapat diperoleh nilai n (bilangan bulat). n adalah komposisi ion asam salisilat- dalam kompleks. Tapi sebelum nemcari nilai n,
harus lebih dahulu mencari nilai Y. Nilai Y dapat cari dengan memasukan rumus :
dimana : Az = 0,022
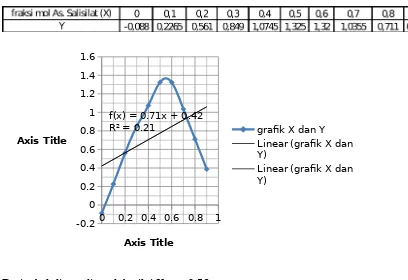
Setelah itu dibandingkan fraksi mol dengan nilai Y dan dibuat grafik. Hasil perbandingan dan bentuk grafuk yang didapat yaitu :
0 0.2 0.4 0.6 0.8 1 -0.2 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
f(x) = 0.71x + 0.42
R² = 0.21 grafik X dan Y
Linear (grafik X dan Y)
Linear (grafik X dan Y)
Axis Title Axis Title
Dari tabel diatas diperoleh nilai Xmax = 0,56
n = xmaks / (1 - xmaks)
= 0,56/ (1- 0,56) n = 1,27
Pada percobaan ini diperoleh besarnya n = 1,27, karena n adalah bilangan bulat maka nilai n tersebut dibulatkan menjadi 1. Sehingga dapat disimpulkan bahwa pada percobaan ini, komposisi ion asa- dalam kompleks yang terbentuk adalah sebanyak 1.
Sehingga rumus senyawa dari kompleks besi(III) salisilat yang terbentuk adalah : Fe3+ + asa- → [Fe(asa)]3+
Kesimpulan
2. Panjang gelombang maksimum untuk kompleks besi(III) salisilat yang diperoleh adalah 530 nm.
3. Nilai n yang didapat yaitu 1. Jadi Kompleks yang terbentuk adalah Fe3+ + asa- →
[Fe(asa)]3+.
Cotton F.A, Wilkinson G, 1989, Kimia Anorganik Dasar, UI Press, Jakarta
Ewing, G. W, 1985. Instrument Method of Chemical Analysis. New York: Mc Graw-Hill Khopkar. 1990. Konsep Dasar Kimia Analitik. UI Press. Jakarta
Harjadi, W., 1990, Ilmu Kimia Analitik Dasar, Penerbit Gramedia, Jakarta Pudyaatmaka, A.Hadyana, 2002, Kamus Kimia, Balai Pustaka, Jakarta