INDUKSI EMBRIO SOMATIK KOPI ROBUSTA (Coffea
canephora Piere ex Froehner) DENGAN PENAMBAHAN
AUKSIN DAN SITOKININ SECARA IN VITRO
DWI FITRIA ASTARI LUBIS
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Induksi Embrio Somatik Kopi Robusta (Coffea canephora Piere ex Froehner) dengan Penambahan Auksin serta Sitokinin secara in Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir penelitian ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Dwi Fitria Astari Lubis
ABSTRAK
DWI FITRIA ASTARI LUBIS. Induksi Embrio Somatik Kopi Robusta (Coffea canephora Piere ex Froehner) dengan Penambahan Auksin dan Sitokinin secara In Vitro.
Dibimbing oleh NI MADE ARMINI WIENDI
Kopi Robusta (Coffea canephora Piere ex Froehner) merupakan komoditas penting yang mempengaruhi perekonomian nasional Indonesia. Tujuan penelitian ini adalah memperoleh media terbaik untuk menginduksi embrio somatik kopi Robusta untuk produksi benih. Eksplan yang digunakan adalah daun kopi Robusta varietas BP 42 x BP 358 dan diinduksi dengan 2,4-D sebagai auksin serta BA atau 2iP sebagai sitokinin. Zat pengatur tumbuh auksin 2,4-D dan sitokinin BA atau 2iP serta interaksinya tidak berpengaruh nyata terhadap pembentukan kalus. Persentase eksplan berkalus tertinggi 86.7 % pada media kombinasi 5 µM 2,4-D dan 20 µM BA. Interaksi antara auksin 2,4-D dan sitokinin BA atau 2iP tidak berpengaruh nyata terhadap pembentukan proembrio. Persentese kalus membentuk proembrio tertinggi adalah 81.04 % pada media konsentrasi sitokinin 20 µM BA. Media induksi embrio serta interaksi antara media asal proembrio dan media induksi embrio tidak berpangaruh terhadap pembentukan embrio. Media asal proembrio berpengaruh nyata pada 19 MSP dan berpengaruh sangat nyata pada 20 dan 21 MSP terhadap pembentukan embrio. Persentase proembrio membentuk embrio somatik tertinggi adalah 33.3% pada kombinasi media 0 mg l-1 2,4-D dan 4 mg l-1 BA. Persentase embrio somatik berkecambah tertinggi adalah 82 % dengan menggunakan media 5 µM GA3. Jumlah kecambah tertinggi diperoleh pada media dengan GA3 10 µM dari proembrio yang berasal dari media kombinasi 1 µM 2,4-D dan 20 µM BA sebesar 14.8 embrio per 5 clump.
Kata kunci: 2iP, BA, embrio somatik, GA3, Robusta ABSTRACT
DWI FITRIA ASTARI LUBIS. Somatic Embryos Induction of Robusta Coffee (Coffea canephora Piere ex Froehner) by addition of auxin and cytokinin In Vitro. Supervised by NI MADE ARMINI WIENDI
Robusta coffee (Coffea canephora Piere ex Froehner) is an essential commodity in Indonesia. The objective of this research was to obtain the best media to induce somatic embryos of Robusta coffee for seedlings production. The explants were Robusta coffee (Coffea canephora Piere ex Froehner) variety BP 358 x BP 42 and induced by 2,4-D as auxin and BA or 2iP as cytokinins. Auxin and cytokinin as plant growth regulator and the interaction itself have no significant difference to induce callus from leaves explant. The highest persentage of callus from leaves explant is 86.7% in the medium with 5 µM 2,4-D and 20 µM BA. The interaction between 2,4-D as the auxin and BA or 2iP cytokinin has no significant difference to induce proembryo to become cotiledinary embryo. The highest persentage of proembryo was 81.04% in the medium with addition of 20 µM BA as cytokinin concentration. Embryo induction medium and also the
interaction embryo induction medium with proembryo medium have no significant difference to induce proembryo become cotiledinary embryos. The effect of proembryo medium was significant difference the embryo growth at 19 treatment and also the embryo growth in 20 and 21 week-after-treatment. The highest persentage of proembryo become cotiledonary embryo is
33.3% in combination medium 0 mg l-1 2,4-D and in ½ MS medium with 4 mg l-1 BA. The highest persentage of germination is 82 % using 5 µM GA3. The
highest number of embryo germination is 14.8 per 5 clumps in medium with 10 µM GA3 from proembryo which came from combination medium added with 1 µM 2,4-D dan 20 µM BA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
INDUKSI EMBRIO SOMATIK KOPI ROBUSTA (Coffea
canephora Piere ex Froehner) DENGAN PENAMBAHAN
AUKSIN SERTA SITOKININ SECARA IN VITRO
DWI FITRIA ASTARI LUBIS
A24080036
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Induksi Embrio Somatik Kopi Robusta (Coffea canephora Piere ex Froehner) dengan Penambahan Auksin serta Sitokinin secara in Vitro.
Nama : Dwi Fitria Astari Lubis NIM : A24080036
Disetujui oleh
Dr Ir Ni Made Armini Wiendi, MS Pembimbing
Diketahui oleh
Dr Ir Agus Purwito, MSc.Agr Ketua Departemen
]lIdlll Skripsi: Induksi Embrio Somatik Kopi Robusta (CoJJea canephora Piere ex
Froehner) dengan Penambahan Auksin serta Sitokinin seeara in Vitro.
Nama : Dwi Fitria Astari Lubis
NIM : A24080036
Disetujui oleh
~
c..../Dr lr Ni Made Arrnini Wiendi, MS Pembimbing
PRAKATA
Puji syukur penulis ucapkan kepada Allah SAW yang telah memberikan kemudahan dan kelancaran dalam penelitian ini. Penelitian dengan judul Induksi Embrio Somatik Kopi Robusta (Coffea canephora Piere ex Froehner) dengan Penambahan Auksin serta Sitokinin secara In Vitro ini dilakukan di Laboratorium
Tissue Culture 2, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis berterima kasih kepada keluarga dan kerabat yang telah mendukung sepenuhnya kegiatan penulis. Selain itu, Dr. Ir. Ni Made Armini Wiendi, MS. sebagai dosen pembimbing skripsi dan Dr. Ir. Eny Widajati, MS sebagai dosen pembimbing akademik yang telah membimbing dan mengarahkan penulis selama menjalankan penulisan ilmiah ini.
Semoga penelitian ini bermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 2 Latar Belakang 1 Tujuan 2 Hipotesis 2 TINJAUAN PUSTAKA 2Kopi Robusta (Coffea canephora Piere ex Froehner) 2
Zat Pengatur Tumbuh 3
Embriogenesis Sel Somatik 4
BAHAN DAN METODE 4
Tempat dan Waktu 4
Bahan dan Alat 4
Metode Penelitian 5
HASIL DAN PEMBAHASAN 11
Percobaan I. Induksi Kalus dari Eksplan Daun Kopi Robusta Varietas BP 42 x
BP 358 12
Percobaan II. Induksi Embrio Somatik Kopi Robusta Varietas BP 42 x BP 358 17 Percobaan III. Perkecambahan Embrio Somatik Kopi Robusta Varietas BP 42 x
BP 358 19
KESIMPULAN 21
DAFTAR PUSTAKA 21
LAMPIRAN 23
DAFTAR TABEL
1 Eksplan yang hidup dan terkontaminasi dari eksplan daun kopi Robusta
varietas BP 42 x BP 358 12
2 Rataan waktu pembentukan kalus dan proembrio dari eksplan daun
kopi Robusta varietas BP 42 x BP 358 pada media induksi kalus 13 3 Rataan persentase kalus kopi Robusta varietas BP 42 x BP 358
berwarna kuning pada 12-14 MSP 14
4 Rekapitulasi analisis ragam pengaruh media perlakuan terhadap
pembentukan kalus kopi Robusta varietas BP 42 x BP 358 15 5 Rekapitulasi analisis ragam pengaruh komposisi media terhadap
persentase eksplan yang membentuk proembrio kopi Robusta varietas
BP 42 x BP 358 16
6 Pengaruh sitokinin terhadap persentase eksplan yang membentu
proembrio kopi Robusta varietas BP 42 x BP 358 17 7 Rekapitulasi analisis ragam pengaruh media induksi embrio dan media
asal proembrio terhadap pembentukan kotiledonari kopi Robusta
varietas BP 42 x BP 358 18
8 Pengaruh media asal proembrio terhadap pembentukan kotiledonari
kopi Robusta varietas BP 42 xBP 358 dari inokulum proembrio 19 9 Rata-rata jumlah embrio berkecambah dari inokulum embrio kopi
Robusta varietas BP 42 x BP 358 pada media dengan GA3 20 10 Persentase eksplan daun kopi Robusta varietas BP 42 x BP 358 yang
membentuk planlet melalui proses embriogenesis sel somatik 20
DAFTAR GAMBAR
1 Skema bagan alir percobaan induksi embriogenesis somatik kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358 8 2 Ekplan daun kopi Robusta (Coffea canephora Piere ex Froehner) yang
ditanam pada media prekondisi 11
3 Rata-rata persentase kalus berwarna cokelat pada 2-14 MSP dari
eksplan daun kopi Robusta varietas BP 42 x BP 358 14 4 Pembentukan kalus dari ekspan daun kopi Robusta varietas BP 42 x BP
358 pada media induksi kalus, 4 MSP 15
5 Diferensiasi kalus membentuk sel proembrio pada eksplan daun kopi
Robusta varietas BP 42 x BP 358 16
6 Fase perkembangan embriogenesis sel somatik daun kopi
DAFTAR LAMPIRAN
1 Komposisi Murashige dan Skoog (MS) 1962 23
2 Persentase eksplan daun kopi Robusta varietas BP 42 x BP 358 yang membentuk planlet melalui proses embriogenesis sel somatik 24
1
PENDAHULUAN
Latar Belakang
Peranan kopi Robusta (Coffea canephora Piere ex Froehner) dalam perekonomian nasional cukup penting sebagai salah satu komoditas perkebunan di Indonesia. Kopi juga memberikan sumbangan devisa negara yang berperan sebagai komoditi ekspor. Total ekspor kopi Robusta tahun 2010 sebesar 360 600 ton, menurun 26 % menjadi 265 368 ton tahun 2011. Namun, pendapatan yang didapat meningkat dari US$571 977 000 pada tahun 2010 menjadi US$580 266 000. Ini membuktikan bahwa pasar kopi Robusta potensial. Total ekspor kopi Robusta juga lebih besar empat kali lipat dari kopi Arabika pada tahun 2010 dan 3.5 kali lipat pada tahun 2011 (AEKI 2012). Rata-rata persentase peningkatan konsumsi kopi dari masyarakat di benua Asia sebesar 5-8% setiap tahun. Hal ini juga didukung dengan peningkatan konsumsi masyarakat di benua Amerika dan Eropa naik hingga 8% per tahun (Panggabean 2011).
Permintaan kopi Robusta harus dipenuhi melalui peningkatan produksi. Cara peningkatan produksi yakni intensifikasi dengan meningkatkan kualitas bibit yang ada. Selain itu, kuantitas bibit juga dibutuhkan tetapi persediaan bibit berkualitas sulit diperoleh. Solusi secara konvensional adalah stek, tetapi hasil stek dapat memberikan dimorfisme dari sumbu vegetatif, jumlah stek ortotrop yang sangat membatasi produksi bibit kopi untuk skala besar, perbanyak hasil stek butuh waktu lama untuk diproduksi dan butuh ketersediaan lahan yang memadai untuk menyimpan bibit stek (Berthouly dan Etienne 2000). Pemecahan masalah ini adalah dengan cara kultur jaringan.
Upaya perbanyakan kopi melalui kultur jaringan sudah mulai berkembang di Indonesia. Hal ini didukung oleh pemerintah melalui Pusat Penelitilian Kopi dan Kakao sehingga bibit kopi berjumlah besar tersedia dalam jangka waktu singkat. Perbanyakan tanaman melalui in vitro diharapkan juga dapat membantu penyediaan bibit kopi bebas patogen berbahaya, dan seragam secara genetik untuk penanaman dalam skala luas tanpa meninggalkan jaminan kualitasnya. Salah satu teknik paling banyak digunakan dalam perbanyakan tanaman secara in vitro
adalah embriogenesis sel somatik.
Embriogenesis sel somatik merupakan suatu proses pembentukan embrio dari sel-sel somatik yang berkembang menjadi tumbuhan baru melalui tahapan embrio yang spesifik tanpa melalui proses fertilisasi alami. Proses embriogenesis somatik dapat terjadi secara langsung maupun tidak langsung. Proses secara langsung terjadi pembentukan proembrio atau embrioid pada potongan eksplan, sedangkan proses tidak langsung diawali dengan pembentukan kalus terlebih dahulu (Wattimena et al. 1992). Keuntungan perbanyakan secara embriogenesis sel somatik memberikan banyak keuntungan antara lain perbanyakan lebih cepat, waktu pembiakan lebih pendek, dan jumlah bibit yang dihasilkan tidak terbatas jumlahnya (Mariska 1996). Penelitian tentang embrio somatik kopi Robusta sudah ada di Indonesia tetapi masih belum optimal oleh karena itu penelitian ini perlu dikembangkan lagi.
Media dasar dan zat pengatur tumbuh sangat dibutuhkan dalam perbanyakan melalui embriogenesis. Faktor penting dalam induksi dan perkembangan embriogenesis sel somatik adalah komposisi nutrisi pada media
2
kultur (Santos-Briones dan Hernández-Sotomayor 2006). Penelitian ini menggunakan media dasar dan konsentrasi zat pengatur tumbuh auksin dan sitokinin. Media dasar yang digunakan adalah setengah konsentrasi garam makro dan mikro MS (Murashige dan Skoog 1962) yang dilengkapi dengan vitamin B5 dengan auksin 2,4-D (asam 2,4-Diklorophenoksiasetat), dan sitokinin 2iP (6-t,t-dimethyl allyl amino purine) dan BA (6-benzyl adenine), serta PVP untuk menyerap senyawa fenolik.
Penelitian ini diharapkan dapat menghasilkan protokol perbanyakan bibit kopi Robusta unggul dan bermutu sehingga produksi kopi Robusta di Indonesia tidak menurun. Disamping itu, penelitian ini diharapkan membantu dunia pengetahuan dalam menemukan solusi untuk perbanyakan kopi Robusta secara optimum.
Tujuan
1. Mempelajari pengaruh interaksi antara konsentrasi auksin dan sitokinin terbaik dalam induksi kalus kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358.
2. Mempelajari pengaruh interaksi antara auksin 2,4-D dan sitokinin BA terhadap perkembangan embrio somatik pada kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358.
3. Mempelajari pengaruh konsentrasi GA3 terhadap perkecambahan embrio somatik kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358.
Hipotesis
1. Konsentrasi auksin dan sitokinin maupun interaksinya berpengaruh nyata dalam induksi kalus kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358.
2. Konsentrasi auksin 2,4-D dan sitokinin BA maupun interaksinya berpengaruh nyata dalam perkembangan embrio somatik kopi Robusta (Coffea canephora
Piere ex Froehner) varietas BP 42 x BP 358.
3. Konsentrasi GA3 berpengaruh nyata dalam perkecambahan embrio somatik kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358.
TINJAUAN PUSTAKA
Kopi Robusta (Coffea canephora Piere ex Froehner)
Secara agronomi pertumbuhan dan produksi tanaman kopi sangat tergantung pada keadaan iklim dan tanah. Faktor lain adalah mencari bibit unggul yang produksinya tinggi dan tahan terhadap hama dan penyakit. Setelah persyaratan tersebut dapat dipenuhi, suatu hal yang juga penting adalah pemeliharaan, seperti: pemupukan, pemangkasan, pohon peneduh, dan pemberantasan hama dan penyakit (Wintgen 2009).
3
Persyaratan iklim kopi Robusta adalah ketinggian tempat , yaitu 300-600m diatas permukaan laut. Curah hujan 1 500 – 3000 mm/tahun. Bulan kering (curah hujan < 60 mm/bulan) 1 ‐ 3 bulan. Suhu udara rata‐rata 24‐30°C. Pada umumnya kopi tidak menyukai sinar matahari langsung dalam jumlah banyak, tetapi menghendaki sinar matahari teratur. Angin berpengaruh besar terhadap jenis kopi yang bersifat self-steril. Hal ini untuk membantu penyerbukan yang berbeda klon. Kopi Robusta dapat hidup di tanah agak masam, yaitu pH 5.5 - 6.5 dan tanaman kopi tidak menghendaki tanah bersifat basa (Badan Penelitian dan Pengembangan Pertanian 2008)
Menurut Migro (2009) perbanyakan kopi secara in vitro dapat digunakan potongan daun kopi muda yang masih berwarna hijau kemerahan atau hijau segar. Daun tersebut dipotong kecil berukuran kurang lebih 5 mm berbentuk segi empat. Potongan daun tadi ditanam di dalam botol dengan media yang berisi berbagai zat hara tertentu. Potongan daun tersebut akan membentuk gumpalan - gumpalan yang berwarna putih-kekuningan, berbentuk bulat atau lonjong yang disebut sebagai kalus. Selanjutnya kalus ini akan tumbuh dan berkembang menjadi calon atau bakal bibit yang disebut embrio. Dalam beberapa percobaan, ada juga dari potongan daun langsung membentuk embrio. Embrio inilah yang akan tumbuh dan berkembang menjadi bibit yang ukurannya kecil. Selanjutnya, bibit dipindah ke dalam botol yang sesuai dengan ukuran bibit agar tumbuh dan berkembang lebih jauh menjadi tanaman yang lebih besar.
Zat Pengatur Tumbuh
. Embriogenesis sel somatik dengan menggunakan daun kopi Arabika sebagai eksplan dapat diinduksi dengan menggunakan sitokinin BAP (Santos-Briones dan Hernandez-Sotomayor 2006). Kumar et al. (2006) menjelaskan dalam penelitiannya penggunaan BA 1 mg l-1 berhasil menginduksi embriogenesis sel somatik dari eksplan daun kopi Arabika selama 5 bulan sebesar 76%.
Peneliti Indonesia sudah banyak melakukan penelitian embriogenesis sel somatik dengan mengkombinasikan zat pengatur tumbuh. Kombinasi adenine sulfat dan 2iP berhasil memproduksi embrio somatik tanpa melalui tahap induksi kalus (Priyono et al. 1991). Oktavia et al (2003) melaporkan induksi embrio
somatik primer per eksplan terbaik diperoleh pada medium kombinasi 0.221 mg l-1 2,4-D dan 3.049 mg l-1 2iP Selanjutnya, Riyadi et al. (2004)
melaporkan penggandaan embrio somatik kopi melalui eksplan daun varietas Kartika berhasil diperoleh dengan perlakuan kombinasi 2 mg l-1 2,4-D dan 0.1 mg l-1 kinetin dalam waktu 6 minggu setelah disubkultur. Penelitian terbaru yaitu kombinasi terbaik untuk pembentukan embriogenesis sel somatik pada daun kopi Arabika dengan perlakuan kombinasi 1.105 mg l-1 2,4-D dan 1.016 mg l-1 2iP (Arimarsetiawati 2011). Zat pengatur tumbuh giberelin pada 1.73 mg l-1 GA3 menghasilkan persentase perkecambahan Embrio somatik sebesar 40 % pada minggu ketiga dan 90.1 % pada minggu ke enam setelah disubkultur ke medium perkecambahan (Oktavia et al. 2003).
4
Embriogenesis Sel Somatik
Proses terbentuknya embrio ada dua macam yaitu embrio yang terbentuk secara langsung dari sel atau jaringan tanpa melalui pembentukan kalus dan embrio yang terbentuk secara tidak langsung yaitu melalui tahapan pembentukan kalus (Yuwono 2008). Umumnya, metode embriogenesis sel somatik langsung sulit untuk mendapatkan embrio. Jaringan yang mengalami browning disebabkan oleh akumulasi senyawa fenolik banyak ditemukan pada proses embrigenesis somatik pada kopi (Santos-Briones dan Hernandes-Sotomayor 2006). Media perlu ditambah PVP (Polyvinylpyrrilidone) untuk menyerap senyawa fenolik pada kopi.
Pertama kali Carneiro (1997) berhasil menginduksi embriogenesis sel somatik Robusta yang berasal dari ruas batang yang lunak. Santos-Briones dan Hernandes-Sotomayor(2006) didalam penelitiannya menggunakan kultur anther, daun, dan biji pada kopi Arabika var. Mundo Novo dan Bourbon Amanelo, melaporkan induksi kalus yang baik di tempat gelap bersuhu 28 °C.
Penelitian embrio somatik menggunakan daun muda sudah dilakukan sebelumnya. Priyono (2010) melakukan penelitian dengan menggunakan daun ketiga dan keempat dari pucuk dari kopi Robusta dengan media MS dengan penambahan vit B5, 1.125 mg l-1 BAP, 30 mg l-1 gula dan 8 g l-1 bacto agar untuk induksi kalus. Produksi embrio somatik dengan menggunakan media MS dengan penambahan vit B5, 30 g l-1 gula, dan 3 mg l-1 gelrite. Hasilnya untuk induksi kalus 98% dari klon BP 409 dan klon FRT 31 selama 7 bulan, sementara itu, 91% dari klon BP 409 dan 99% dari klon FRT 31 untuk produksi embrio somatik. Penelitian dilakukan di ruang gelap dengan suhu 25 °C selama 3 bulan.
Oktavia (2003) melaporkan bahwa pada kultur embriogenesis kopi Arabika klon BP 426A dengan membandingkan eksplan daun, epikotil, hipokotil, dan akar tanaman menunjukkan bahwa persentase induksi embrio somatik dengan daun muda palng tinggi yaitu 77.2% dengan menggunakan setengah konsentrasi MS, vit B5, 250 mg l-1 PVP dan 20 g l-1 sukrosa ditambah zat pengatur tumbuh kombinasi 0.221 mg l-1 2,4-D dan 3.05 mg l-1 2iP kultur diinkubasi dalam ruang gelap dengan suhu 28 °C.
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura IPB Darmaga. Penelitian berlangsung dari bulan Juli 2012 sampai Februari 2013.
Bahan dan Alat
Bahan yang digunakan dalam penelitian meliputi bahan tanaman, bahan media, dan bahan sterilan. Bahan tanaman yang digunakan untuk menginduksi proembrio adalah daun yang berada pada posisi ketiga dan kedua dari pucuk, serta daun dipucuk kopi Robusta Varietas BP 42 x BP 358. Menurut Wachjar (2002) tanaman varietas BP 42 x BP 358 berasal dari Pusat Penelitian Kopi dan Kakao Jember, Jawa Timur. Tanaman berumur 7 bulan setelah semai ditanam pada Juli
5
2000 di Kebun Percobaan IPB, Cikabayan, Dramaga. Tinggi tempat 250 meter di atas permukaan laut dan jenis tanah latosol.Bahan sterilan adalah fungisida, bakterisida, NaClO, dan alkohol 70% dan air filter steril. Bahan lain yang diperlukan di dalam proses pengkulturan eksplan adalah alkohol 70% dan spiritus. Bahan media terdiri atas media prekondisi, media induksi kalus, media induksi embrio somatik, dan media perkecambahan. Media prekondisi adalah media MS dengan penambahan 30 g l-1 gula dan 7 g l-1 agar. Media induksi kalus adalah media setengah konsentrasi garam makro dan mikro MS yang ditambahkan dengan vitamin B5, 100 mg l-1 asparagine, 30 g l-1 gula, 7g l-1 agar, dan 500 mg l-1 arang aktif dengan pH 5.8 sebelum diautoklaf. Zat pengatur tumbuh yang ditambahkan terdiri atas 2,4-D yang dikombinasikan dengan dua sitokinin yaitu BA dan 2iP. Media induksi embriogenesis sel somatik adalah media setengah konsentrasi garam makro MS dengan penambahan 100 mg l-1
asparagine, 200 mg l-1 tryptone, 800 mg l-1 yeast extract, 20 mg l-1 thiamine, 20 mg l-1glycine, 3 mg l-1adenine hemisulphate, 200 mg l-1myo-inositol, 30g l-1 gula, 7 g l-1 agar, dan 500 mg l-1 arang aktif dengan pH 5.8 sebelum autoklaf. Zat pengatur tumbuh yang ditambahkan terdiri dari 2,4-D dan BA. Media maturasi (pendewasaan) yaitu media MS yang ditambahkan 30 g l-1 gula dan 7 g l-1 agar. Media perkecambahan adalah media MS dengan penambahan 30 g l-1 gula dan 7 g l-1 agar. Zat pengatur tumbuh yang ditambahan adalah 2 perlakuan yaitu 1.73 mg l-1 GA3 dan 3.46 mg l-1 GA3 dan di pH 5.7 sebelum autoklaf.
Alat yang digunakan terdiri atas alat untuk sterilisasi, alat untuk membuat media, dan alat tanam. Alat sterilisasi terdiri atas autoclave dan oven. Alat untuk membuat media adalah botol kultur, gelas ukur, gelas piala besar, corong, plastik gulung, pH meter, kompor, dan karet gelang. Alat untuk menanam adalah laminar airflow cabinet, pinset, gunting, scalpel, lampu spiritus, dan korek.
Metode Penelitian
Penelitian ini terdiri atas tiga percobaan yang berkesinambungan. Percobaan pertama adalah percobaan induksi kalus, percobaan kedua adalah induksi embrio somatik, dan percobaan ketiga adalah perkecambahan.
Percobaan I. Induksi Kalus dari Eksplan Daun Kopi Robusta Varietas BP 42 x BP 358
Percobaan ini menggunakan rancangan acak lengkap dua faktor. Faktor pertama adalah auksin dengan dua taraf, yaitu 1 µM (0.221mg l-1) 2,4-D dan 5 µM (1.105 mg l-1) 2,4-D. Faktor kedua adalah sitokinin dengan 8 taraf yaitu 5 µM (1,016 mg l-1), 10 µM (2.033 mg l-1), 15 µM (3.049 mg l-1), 20 µM (4.066 mg l-1) 2iP dan 5 µM (1.126 mg l-1), 10 µM (2.252 mg l-1),15µM (3.378 mg l-1), 20 µM (4.504 mg l-1) BA. Ada 16 kombinasi perlakuan dan setiap perlakuan diulang 3 kali berdasarkan hasil penanaman, sehingga diperoleh 48 satuan percobaan. Setiap satuan percobaan terdiri atas 3 botol dan 1 botol terdiri atas 5 eksplan sebagai satuan amatan. Total yang diamati adalah 720 eksplan. Model linear dari percobaan ini adalah :
6
Keterangan :
Yijk = Nilai pengamatan faktor auksin dan faktor konsentrasi sitokinin taraf ke-j dan dari ulangan ke-k (k = 1,2,3)
µ = Rataan umum
αi = Pengaruh konsentrasi auksin taraf ke-i ( i = 1,2) βi = Pengaruh konsentrasi sitokinin ke-j ( j = 1,2,3,...,8)
(αβ)ij = Interaksi antara perlakuan auksin taraf ke-i dengan konsentrasi konsentrasi sitokinin ke-j
εij = Galat percobaan pada konsentrasi auksin ke –i, sitokinin ke –j, dan ulangan ke -k
Peubah yang diamati adalah persentase kultur yang membentuk kalus dan warnanya, persentase kultur yang membentuk proembrio, serta waktu terbentuknya kalus dan proembrio serta persentase kultur terkontaminasi. Data pengamatan diuji menggunakan uji F pada taraf 5%. Apabila pengaruh perlakuan berbeda nyata, maka dilakukan uji lanjut menggunakan DMRT (Duncan Multiple Range Test) pada taraf 5%.
Percobaan II. Induksi Embrio Somatik Kopi Robusta Varietas BP 42 x BP 358
Penelitian induksi embrio somatik menggunakan rancangan acak lengkap dua faktor. Faktor pertama adalah media embrio somatik dengan dua taraf, yaitu 0 mg l-1 2,4-D ditambah 4 mg l-1 BA dan 0.97 mg l-1 2,4-D ditambah 4 mg l-1 BA. Faktor kedua adalah media asal proembrio. Sumber inokulum adalah clump
(proembrio dan kalus) yang berasal dari media induksi kalus. Media induksi kalus terdiri atas 14 media. Ada 28 kombinasi perlakuan dan setiap perlakuan diulang berdasarkan sumber inokulum yang ada , sehingga diperoleh 82 satuan percobaan. Setiap satuan percobaan terdiri dari 5 inokulum. Total yang diamati adalah 410 inokulum. Model linear dari percobaan ini adalah :
Yijk= µ + αi + βj + (αβ)ij+ εijk Keterangan :
Yij = Nilai pengamatan faktor komposisi media induksi embrio
somatik ke –i, faktor asal proembrio taraf ke-j, dari ulangan ke –k ( k = 1,2,3)
µ = Rataan umum
αi = Pengaruh perlakuan komposisi media induksi embrio somatik taraf ke-i ( i = 1,2)
βi = Pengaruh asal proembrio ke-j ( j = 1,2,3,..., 16)
(αβ)ij = Interaksi antara perlakuan komposisi media induksi embrio somatik taraf ke-i dengan asal proembrio ke-j
εij = Galat percobaan faktor komposisi media induksi embrio
somatik ke –i, faktor asal proembrio taraf ke-j, dari ulangan ke –k ( k = 1,2,3)
7
Peubah yang diamati adalah persentase embrio membentuk kotiledonariri dan proses perkembangan sel dari kalus hingga membentuk embrio somatik secara mikroskopik. Data pengamatan diuji menggunakan uji F pada taraf 5%. Apabila pengaruh perlakuan berbeda nyata, maka dilakukan uji lanjut menggunakan DMRT (Duncan Multiple Range Test) pada taraf 5%.
Percobaan III. Perkecambahan Embrio Somatik Kopi Robusta Varietas BP 42 x BP 358
Percobaan ini menggunakan rata-rata eksplan berkecambah. Faktornya adalah GA3 dengan dua taraf, yaitu 5 µM (1.73 mg l-1) GA3 dan 10 µM (3.46 mg l-1) GA3. Sumber eksplan adalah inokulum clump yang berasal dari media induksi embrio somatik. Ada 4 media perlakuan yang menghasilkan kotiledonari. Media ini terdiri atas kombinasi 1 µM 2,4-D dan 5 µM BA, 1 µM 2,4-D dan 10 µM BA, 1 µM 2,4-D dan 20 µM BA serta kombinasi 1 µM 2,4-D dan 5 µM 2iP. Kriteria yang diamati adalah persentase embrio berkecambah.
Persentase embrio berkecambah = 𝐽𝑢𝑚𝑙𝑎ℎ 𝑒𝑚𝑏𝑟𝑖𝑜 𝑏𝑒𝑟𝑘𝑒𝑐𝑎𝑚𝑏𝑎ℎ
𝑗𝑢𝑚𝑙𝑎ℎ 𝑘𝑜𝑡𝑖𝑙𝑒𝑑𝑜𝑛𝑎𝑟𝑖 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑎𝑛𝑎𝑚 × 100%
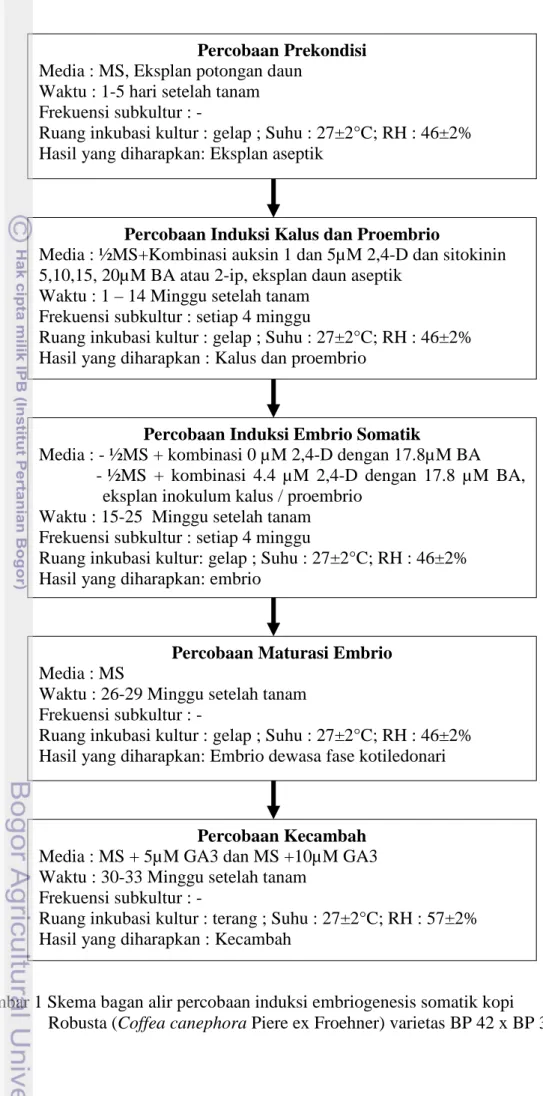
Bagan alir percobaan secara keseluruhan untuk percobaan induksi embriosomatik kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358 disajikan pada gambar 1.
8
Pelaksanaan Penelitian
Gambar 1 Skema bagan alir percobaan induksi embriogenesis somatik kopi Robusta (Coffea canephora Piere ex Froehner) varietas BP 42 x BP 358
Percobaan Kecambah Media : MS + 5µM GA3 dan MS +10µM GA3 Waktu : 30-33 Minggu setelah tanam
Frekuensi subkultur : -
Ruang inkubasi kultur : terang ; Suhu : 27±2°C; RH : 57±2% Hasil yang diharapkan : Kecambah
Percobaan Prekondisi Media : MS, Eksplan potongan daun
Waktu : 1-5 hari setelah tanam Frekuensi subkultur : -
Ruang inkubasi kultur : gelap ; Suhu : 27±2°C; RH : 46±2% Hasil yang diharapkan: Eksplan aseptik
Percobaan Induksi Kalus dan Proembrio
Media : ½MS+Kombinasi auksin 1 dan 5µM 2,4-D dan sitokinin 5,10,15, 20µM BA atau 2-ip, eksplan daun aseptik
Waktu : 1 – 14 Minggu setelah tanam Frekuensi subkultur : setiap 4 minggu
Ruang inkubasi kultur : gelap ; Suhu : 27±2°C; RH : 46±2% Hasil yang diharapkan : Kalus dan proembrio
Percobaan Induksi Embrio Somatik
Media : - ½MS + kombinasi 0 µM 2,4-D dengan 17.8µM BA - ½MS + kombinasi 4.4 µM 2,4-D dengan 17.8 µM BA,
eksplan inokulum kalus / proembrio Waktu : 15-25 Minggu setelah tanam
Frekuensi subkultur : setiap 4 minggu
Ruang inkubasi kultur: gelap ; Suhu : 27±2°C; RH : 46±2% Hasil yang diharapkan: embrio
Percobaan Maturasi Embrio Media : MS
Waktu : 26-29 Minggu setelah tanam Frekuensi subkultur : -
Ruang inkubasi kultur : gelap ; Suhu : 27±2°C; RH : 46±2% Hasil yang diharapkan: Embrio dewasa fase kotiledonari
9
Pelaksanaan Penelitian Persiapan dan Sterilisasi Alat
Dalam kegiatan ini, seluruh alat yang digunakan harus dalam keadaan streril. Seluruh alat dicuci bersih kemudian dikeringkan, kemudian disterilkan dengan menggunakan autoklaf pada temperatur 121°C dengan tekanan 1.1 kgcm2 selama 1 jam.
Pembuatan Larutan Stok
Pembuatan larutan stok berfungsi untuk memudahkan pembuatan media. Larutan stok dibuat sesuai dengan komposisi media yang dibutuhkan dan disimpan dalam konsentrasi yang lebih pekat dalam suhu kamar.
Pembuatan Media Kultur a. Media Induksi Kalus
Media dasar yang digunakan adalah ½ konsentrasi hara makro dan mikro MS. Penambahan zat pengatur tumbuh auksin (2,4-D) dan sitokinin (BA dan 2iP) sesuai dengan konsentrasi perlakuan. Pada saat pembuatan ditambahkan auksin dan sitokinin sesuai dengan konsentrasi perlakuan. Proses membuat 1 liter ½ MS, pertama 30 g gula dilarutkan ke dalam 100 ml aquades, larutan gula dipindahkan ke dalam labu takar 1 liter. Kemudian 10 ml masing-masing larutan stok A dan B ditambahkan, 2,5 ml masing-masing larutan stok C, stok D, dan stok E ditambahkan. Setelah itu, 5 ml masing-masing larutan stok F dan 10 ml vitamin B5 dan myo ditambahkan. Penambahan lainnya adalah asparagine 100 mg l-1, setelah itu diaduk dengan magnetic stirer agar larutan homogen dan pH media ditera dengan penambahan HCl 1 N atau KOH 1 N hingga mencapai 5.8, lalu 7-8 gram agar-agar dan 500 mg l-1 arang aktif ditambahkan. Media dipanaskan sampai agar-agar larut (sambil diaduk), lalu dituang ke dalam botol kultur steril. Selanjutnya, media disterilisasi selama 15-20 menit pada suhu 121 °C tekanan 17.5 psi.
b. Media Embrio Somatik
Media dasar yang digunakan adalah ½ konsentrasi hara makro dan mikro MS. Penambahan zat pengatur tumbuh auksin (2,4-D) dan sitokinin (BA) sesuai dengan konsentrasi perlakuan. Pada saat pembuatan ditambahkan auksin dan sitokinin sesuai dengan konsentrasi perlakuan. Proses pembuatan media 1 liter ½ MS dibuat sama dengan media induksi kalus. Penambahan lainnya adalah 100 mg
l-1 asparagine, 200 mg l-1 tryptone, 800 mg l-1 yeast, 20 mg l-1 thiamine, 20 mg l-1 glycine, 3 mg l-1 adenine hemisulphate, dan 200 mg l-1 myo-inositol.
Setelah itu, larutan diaduk dengan menggunakan magnetic stirrer agar larutan homogen, kemasaman (pH) media diatur dengan menambahkan HCl 1 N atau KOH 1 N hingga mencapai 5.8, lalu ditambahkan 7-8 gram agar-agar dan 500 mg l-1 arang aktif.
10
c. Media Perkecambahan
. Media dasar yang digunakan adalah MS. Penambahan zat pengatur tumbuh GA3 ke dalam media perkecambahan sesuai dengan konsentrasi perlakuan. Pada saat pembuatan ditambahkan auksin dan sitokinin sesuai dengan konsentrasi perlakuan. Proses 1 liter MS dibuat sama dengan media induksi kalus dengan 30 gram gula ditambahkan. Setelah itu, diaduk dengan magnetic stirrer agar larutan homogen dan pH media ditera dengan penambahkan HCl 1 N atau KOH 1 N hingga mencapai 5.8, lalu 7-8 gram agar-agar ditambahkan.
c. Pemilihan Eksplan
Eksplan yang digunakan adalah daun kopi yang berada pada posisi ketiga, kedua, dan pertama dari pucuk berwarna hijau segar dan sehat. Pohon berpenampilan baik dan sehat secara keseluruhan dan daun kopi berpenampilan baik dan utuh.
d. Sterilisasi Eksplan
Daun kopi terlebih dahulu disterilkan dengan cara dibersihkan menggunakan detergen dan dibilas sampai bersih. Daun direndam dalam larutan Agrept dan Dithane M-45 sebanyak 2 g l-1 selama 2 jam, kemudian dibilas sekali di dalam air steril. Setelah itu daun direndam di dalam NaClO 10% selama 10 menit dan NaClO selama 40 menit, kemudian dibilas sekali di dalam air steril. Daun direndam di dalam alkohol 70% selama 1 menit, kemudian dibilas sekali di dalam air steril. Setelah itu, daun direndam di NaClO 10% selama 10 menit kemudian daun diletakkan di cawan petri steril kemudian dipotong dengan tulang daun dihilangkan. Penghilangan tulang daun bertujuan untuk menghindari kontaminasi bakteri. Daun direndam kembali dalam NaClO 5% selama 5 menit. Selanjutnya, daun dipotong ±0.5 cm x ±0.5 cm. Daun dicelupkan sebentar ke dalam cefotaxim dengan dosis 4 mg ml-1. Seluruh pengerjaan dilakukan di dalam
Laminar Air FlowCabinet. e. Penanaman Eksplan
Penanaman eksplan dilakukan dalam laminar air flow cabinet yang sudah dibersihkan dengan alkohol 70% sebelum penanaman. Semua alat juga disterilisasi dengan alkohol 70% agar tidak terjadi kontaminasi eksplan. Kultur disimpan dalam ruang kultur yang gelap dan bertemperatur 26-28°C.
Penanaman eksplan dibagi beberapa tahap, antara lain: a. Penanaman eksplan pada tahap prekondisi
b. Penanaman eksplan pada tahap perlakuan induksi embriogenik c. Penanaman inokulum pada tahap perlakuan induksi embrio d. Penanaman inokulum pada tahap pendewasaan
11
HASIL DAN PEMBAHASAN Kondisi Umum
Penelitian ini bertujuan untuk mencari media terbaik untuk embrio somatik kopi Robusta (Coffea canephora Piere ex Froehner). Kopi Robusta yang digunakan adalah varietas BP 42 x BP 358. Bahan tanaman yang diambil sebagai eksplan adalah daun pertama hingga daun ketiga dari pucuk. Daun dipotong dengan ukuran 0.5 cm x 0.5 cm dengan tulang daun dihilangkan. Penghilangan tulang daun bertujuan untuk menghindari kontaminasi bakteri. Seluruh pengerjaan dilakukan di dalam Laminar Air Flow.
Daun dikulturkan ke media prekondisi selama 5 hari seperti pada gambar 2. Tujuannya adalah untuk menyeleksi eksplan aseptik sebelum dikulturkan ke dalam media perlakuan. Setelah itu, daun dimasukkan ke media perlakuan. Media perlakuan untuk menginduksi proembrio adalah media MS setengah konsentrasi hara makro dan mikro dengan penambahan auksin dan sitokinin. Zat Pengatur Tumbuh yang digunakan untuk menginduksi proembrio adalah 2,4-D sebagai auksin serta BA dan 2iP sebagai sitokinin. Eksplan disubkultur setiap bulan. Pada tahap awal kalus yang terbentuk berwarna putih dan kompak, selanjutnya berubah warna menjadi kuning dan bentuknya remah serta berdiferensisasi membentuk proembrio. Proembrio yang terbentuk disubkultur ke media induksi untuk menginduksi embrio yaitu media MS setengah konsentrasi hara makro dengan penambahan 2,4-D sebagai auksin dan BA sebagai sitokinin. Proembrio berkembang membentuk menjadi embrio pada media ini, dengan perkembangan mulai dari fase globular sampai kotiledonari.
Embrio fase kotiledonari disubkultur ke media maturasi selama 1 bulan. Tujuannya adalah untuk membuat kotiledonari menjadi siap untuk perkecambahan. Medianya adalah media MS tanpa zat pengatur tumbuh.Setelah satu bulan, embrio disubkultur ke media perkecambahan untuk menghasilkan planlet. Embrio diamati selama 1 bulan.
Gambar 2 Ekplan daun kopi Robusta (Coffea canephora Piere ex Froehner) yang ditanam pada media prekondisi
12
Percobaan I. Induksi Kalus dari Eksplan Daun Kopi Robusta Varietas BP 42 x BP 358
Eksplan yang ditumbuhkan pada media prekondisi yaitu MS tanpa zat pengatur tumbuh tidak menunjukkan perubahan selama 5 hari sejak dikulturkan. Eksplan yang aseptik di media prekondisi selanjutnya disubkultur ke media perlakuan induksi proembrio.
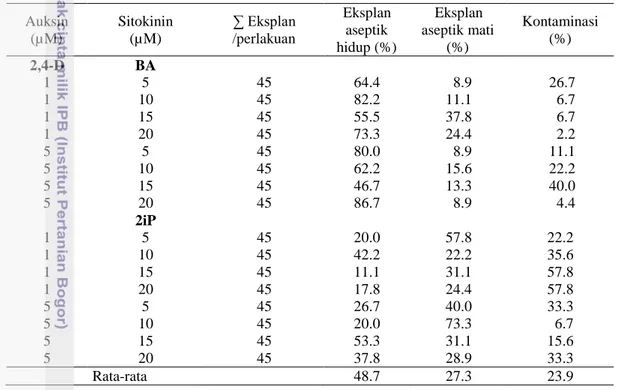
Tabel 1 Eksplan yang hidup dan terkontaminasi dari eksplan daun kopi Robusta varietas BP 42 x BP 358 Auksin (µM) Sitokinin (µM) ∑ Eksplan /perlakuan Eksplan aseptik hidup (%) Eksplan aseptik mati (%) Kontaminasi (%) 2,4-D BA 1 5 45 64.4 8.9 26.7 1 10 45 82.2 11.1 6.7 1 15 45 55.5 37.8 6.7 1 20 45 73.3 24.4 2.2 5 5 45 80.0 8.9 11.1 5 10 45 62.2 15.6 22.2 5 15 45 46.7 13.3 40.0 5 20 45 86.7 8.9 4.4 2iP 1 5 45 20.0 57.8 22.2 1 10 45 42.2 22.2 35.6 1 15 45 11.1 31.1 57.8 1 20 45 17.8 24.4 57.8 5 5 45 26.7 40.0 33.3 5 10 45 20.0 73.3 6.7 5 15 45 53.3 31.1 15.6 5 20 45 37.8 28.9 33.3 Rata-rata 48.7 27.3 23.9
Data Tabel 1 menyajikan persentase eksplan hidup berkisar antara 11.11 - 86.67 %. Persentase eksplan terkontaminasi adalah berkisar antara 2.22-57.78 %. Secara umum tingkat kontaminasi sangat tinggi. Hal ini disebabkan eksplan yang digunakan adalah daun dari tanaman di lapangan. Organ daun dalam tanaman merupakan organ luar yang langsung berhubungan dengan berbagai mikroorganisme sebagai sumber kontaminan.
Eksplan aseptik yang mati adalah eksplan aseptik yang tidak menghasilkan kalus dan tetap aseptik hingga akhir pengamatan. Persentase eksplan aseptik berkisar antara 8.9-73.3 %. Media yang mempunyai eksplan aseptik tertinggi adalah media dengan kombinasi 5 µM 2,4-D dan 10 µM 2iP. Hal ini diduga respon eksplan daun kopi Robusta varietas BP 42 x BP 358 rendah di dalam pembentukan kalus. Penyebab lain adalah daun lebih tipis dan zat lilin lebih tipis sehingga ketika terkena bahan sterilan, sel lebih mudah rusak dan mati. Faktor lain adalah kesalahan dalam penanaman eksplan daun kopi Robusta. Alat tanam masih dalam keadaan panas saat menyentuh eksplan daun ketika ditanam ke dalam media perlakuan.
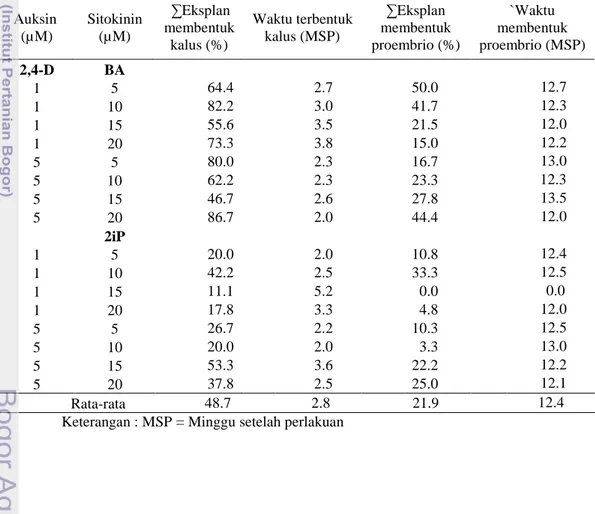
Data pada Tabel 2 menunjukkan bahwa waktu inisiasi kalus terjadi antara 2 hingga 5 minggu setelah perlakuan (MSP). Rata-rata pembentukan kalus secara
13
keseluruhan adalah 2.8 MSP. Pada media perlakuan induksi kalus juga menghasilkan proembrio, hasil dari proses diferensiasi kalus. Waktu untuk membentuk proembrio dari kalus adalah 12.4 MSP. Menurut Priyono et al. (2010) pada eksplan daun dari tanaman kopi Robusta klon FRT 80 penambahan kinetin 5 mg l-1 berinisiasi kalus pada 4 minggu setelah perlakuan. Penelitian Gatica et al.
(2007) menyatakan bahwa dengan menggunakan 1 mg l-1 BA, inisiasi kalus kopi Arabika cv. Caturra dan Catuai pertama kali pada 2 minggu setelah perlakuan. Pada penelitian ini waktu pembentukan kalus dan proembrio cukup seragam dengan rata eksplan hidup 48.7% dan kalus membentuk proembrio 21.9%. Perlakuan yang berbeda adalah perlakuan 1 µM 2,4-D dan 15 µM 2iP. Hal ini diduga respon eksplan daun kopi Robusta varietas BP 42 x BP 358 rendah dalam menginduksi kalus dan tidak dapat menginduksi proembrio.Indikator sel dikatakan sebagai proembrio adalah kalus menjadi remah dan berwarna kuning. Tabel 2 Rataan waktu pembentukan kalus dan proembrio dari eksplan daun kopi
Robusta varietas BP 42 x BP 358 pada media induksi kalus Auksin (µM) Sitokinin (µM) ∑Eksplan membentuk kalus (%) Waktu terbentuk kalus (MSP) ∑Eksplan membentuk proembrio (%) `Waktu membentuk proembrio (MSP) 2,4-D BA 1 5 64.4 2.7 50.0 12.7 1 10 82.2 3.0 41.7 12.3 1 15 55.6 3.5 21.5 12.0 1 20 73.3 3.8 15.0 12.2 5 5 80.0 2.3 16.7 13.0 5 10 62.2 2.3 23.3 12.3 5 15 46.7 2.6 27.8 13.5 5 20 86.7 2.0 44.4 12.0 2iP 1 5 20.0 2.0 10.8 12.4 1 10 42.2 2.5 33.3 12.5 1 15 11.1 5.2 0.0 0.0 1 20 17.8 3.3 4.8 12.0 5 5 26.7 2.2 10.3 12.5 5 10 20.0 2.0 3.3 13.0 5 15 53.3 3.6 22.2 12.2 5 20 37.8 2.5 25.0 12.1 Rata-rata 48.7 2.8 21.9 12.4
Keterangan : MSP = Minggu setelah perlakuan
14 2.1 40.8 75.3 43.4 0 20 40 60 80 100 120 2 MSP 6 MSP 10 MSP 14 MSP K al u s b erw ar n a co k el at ( % )
Minggu setelah perlakuan
Warna Kalus dari Eksplan Daun Kopi Robusta Varietas BP 42 x BP 358 Kalus memiliki warna putih saat pertama kali terbentuk, secara berangsur-angsur kalus berwarna krem dan kuning. Ada kalus yang berwarna kecokelatan setelah berwarna krem. Warna cokelat ini terjadi karena proses browning. Proses ini terjadi karena kalus menjadi tua. Kalus yang berwarna cokelat terjadi pada sebagian sel-sel pada clump. Pada gambar 3 dapat dilihat bahwa kalus membentuk warna cokelat meningkat dari 2.1% sampai 75.3% pada minggu 2 sampai ke-10 setelah perlakuan, tetapi kalus membentuk warna cokelat ini menurun 43.4% pada minggu ke-14. Hal ini karena ada pembentukan kalus baru.
Gambar 3 Rata-rata persentase kalus berwarna cokelat pada 2-14 MSP dari eksplan daun kopi Robusta varietas BP 42 x BP 358
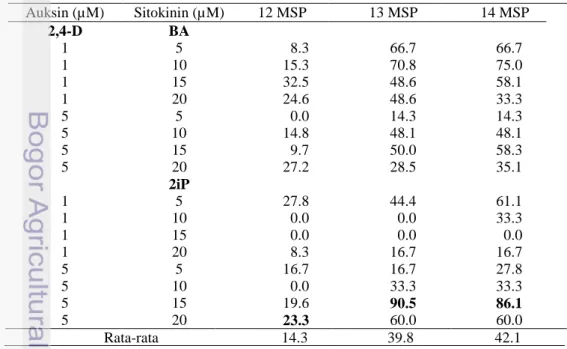
Tabel 3 Rataan persentase kalus kopi Robusta varietas BP 42 x BP 358 berwarna kuning pada 12-14 MSP
Keterangan : MSP = Minggu setelah perlakuan
Auksin (µM) Sitokinin (µM) 12 MSP 13 MSP 14 MSP 2,4-D BA 1 5 8.3 66.7 66.7 1 10 15.3 70.8 75.0 1 15 32.5 48.6 58.1 1 20 24.6 48.6 33.3 5 5 0.0 14.3 14.3 5 10 14.8 48.1 48.1 5 15 9.7 50.0 58.3 5 20 27.2 28.5 35.1 2iP 1 5 27.8 44.4 61.1 1 10 0.0 0.0 33.3 1 15 0.0 0.0 0.0 1 20 8.3 16.7 16.7 5 5 16.7 16.7 27.8 5 10 0.0 33.3 33.3 5 15 19.6 90.5 86.1 5 20 23.3 60.0 60.0 Rata-rata 14.3 39.8 42.1
15
Kalus yang diharapkan terbentuk dari proses induksi kalus pada daun kopi Robusta varietas BP 42 x BP 358 ini adalah kalus yang berwarna kuning dan memiliki struktur remah. Kalus berwarna kuning adalah kalus yang berpotensi membentuk proembrio. Tabel 3 menunjukkan bahwa persentase rata-rata ekplan membentuk kalus berwarna kuning sampai 14 MSP adalah meningkat dari 14.3% menjadi 42.1 %. Persentase tertinggi diperoleh dari media dengan kombinasi 5 µM 2,4-D dan 15 µM 2iP yaitu 86.1 %. Hal ini menunjukkan respon eksplan terhadap zat pengatur tumbuh dalam pembentukan warna kalus berbeda-beda. Menurut Wattimena (1988) selain konsentrasi, jenis zat pengatur tumbuh juga mempengaruhi respon eksplan tanaman. Pada eksplan daun kopi Robusta varietas BP 42 x BP 359 kombinasi 1 µM 2,4-D dengan peningkatan konsentrasi sitokinin BA dan 2iP cenderung menurun persentase kalus berwarna kuning, namun terjadi respon terbalik dengan kombinasi 5 µM 2,4-D dengan peningkatan konsentrasi sitokinin BA dan 2iP cenderung meningkatkan persentase kalus berwarna kuning. Kalus
Respon awal yang terjadi adalah eksplan mulai menggulung ke dalam dan warna daun berubah menjadi hitam pada minggu pertama setelah disubkultur. Kalus sebagian besar muncul pada minggu kedua dan satu media muncul pada minggu kelima setelah disubkultur. Kalus dini seperti yang ditunjukkan pada gambar 4 muncul pada pinggiran daun eksplan (bekas luka sayatan).
Gambar 4 Pembentukan kalus dari ekspan daun kopi Robusta varietas BP 42 x BP 358 pada media induksi kalus, 4 MSP. (A) Ekplan awal, (B) Kalus
Tabel 4 Rekapitulasi analisis ragam pengaruh media perlakuan terhadap pembentukan kalus kopi Robusta varietas BP 42 x BP 358
Umur(MSP) Auksin (A) Sitokinin (S) Interaksi KK (%) (%
2 tn tn tn 32.48 3 tn tn tn 29.02 4 tn tn tn 34.01 5 tn tn tn 33.99 6 tn tn tn 32.52 7 tn tn tn 31.45 8 tn tn tn 30.98 9 tn tn tn 41.00 10 tn tn tn 30.97 11 tn tn tn 30.97
Keterangan: tn=tidak nyata KK (%)= koefisien keragaman; data di transformasi (x+4) ½ sebelum diolah menggunakan SAS. MST= Minggu setelah tanam
A
16
Pengamatan kalus dilakukan dari 2 MSP hingga 11 MSP. Eksplan berumur 1 MSP belum mengalami pembentukan kalus. Tabel 4 menunjukkan bahwa auksin dan sitokinin tidak memberikan pengaruh nyata terhadap pembentukan kalus Robusta varietas BP 42 x BP 358. Hasil diatas menunjukkan bahwa kombinasi auksin dan sitokinin dengan dosis rendah memberikan pengaruh sama dengan auksin dan sitokinin dengan dosis tinggi berdasarkan uji statistik. Namun, hal ini belum tentu terjadi pada genotipe kopi Robusta lain. Oktavia et al. (2003) menyatakan setiap genotipe atau jaringan mempunyai respons yang berbeda dalam penyerapan zat pengatur tumbuh dalam medium dan memiliki kandungan zat pengatur tumbuh endogen yang berbeda.
Kalus proembrio
Tahap selanjutnya dari kalus adalah proembrio. Proembrio ini mempunyai potensi untuk menjadi embrio. Proembrio terbentuk dari kalus pada 12 MSP. Proembrio seperti gambar 5 berwarna kuning memiliki struktur nodul dan remah. Kalus proembrio bersifat lunak dan mengeluarkan cairan. Tidak semua media perlakuan berpotensi menginduksi embrio.
`
Gambar 5 Diferensiasi kalus membentuk sel proembrio pada eksplan daun kopi Robusta varietas BP 42 x BP 358. A) Kalus B) Proembrio
Tabel 5 Rekapitulasi analisis ragam pengaruh komposisi media terhadap
persentase eksplan yang membentuk proembrio kopi Robusta varietas BP 42 x BP 358
Umur (MSP) Auksin (A) Sitokinin (S) Interaksi (A x S) KK (%)
12 tn tn tn 14.3
13 tn * tn 17.7
14 tn tn tn 17.8
Keterangan: *) berpengaruh nyata p≤0.05; tn=tidak nyata. KK (%)= koefisien keragaman; data di transformasi (x+0.5) ½ sebelum diolah menggunakan SAS.
MSP= Minggu setelah perlakuan
Tabel 5 menunjukkan bahwa perlakuan auksin tidak berpengaruh nyata terhadap pembentukan proembrio. Interaksi auksin dan sitokinin juga tidak memberikan pengaruh nyata terhadap pembentukan proembrio. Perlakuan
B
A
17
sitokinin memberikan pengaruh nyata terhadap pembentukan proembrio pada 13 MSP.
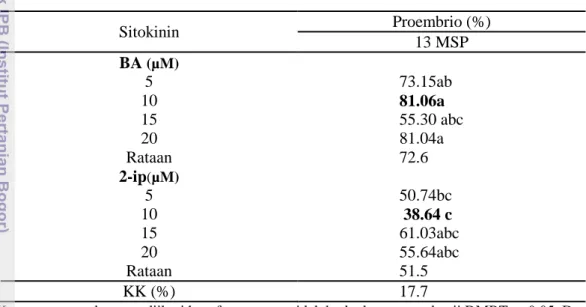
Data Tabel 6 diatas menunjukkan bahwa sitokinin 10 µM BA memiliki persentase membentuk proembrio terbesar yaitu 81.06 % pada 13 MSP. Namun, 10 µM BA tidak berbeda dengan 5 µM BA, 15 µM BA, 20 µM BA, 15 µM 2iP ,dan 20 µM 2iP secara statistik. Konsentrasi sitokinin 10 µM BA berbeda nyata dengan 5 µM 2iP dan 10 µM 2iP.
Hasil percobaan ini menunjukkan bahwa konsentrasi BA dengan dosis rendah lebih baik digunakan yaitu 5-10 µM dibandingkan konsentrasi yang lebih tinggi . Sitokinin memiliki peran penting dalam pembentukan proembrio. Tabel 6 juga menunjukkan bahwa sitokinin BA lebih baik digunakan daripada sitokinin 2iP untuk membentuk proembrio kopi Robusta varietas BP 42 x BP 358.
Tabel 6 Pengaruh sitokinin terhadap persentase eksplan yang membentuk proembrio kopi Robusta varietas BP 42 x BP 358
Sitokinin Proembrio (%) 13 MSP BA (µM) 5 73.15ab 10 81.06a 15 55.30 abc 20 81.04a Rataan 72.6 2-ip(µM) 5 50.74bc 10 38.64 c 15 61.03abc 20 55.64abc Rataan 51.5 KK (%) 17.7
Keterangan: angka yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT α=0.05. Data di transformasi (x+0.5) ½ sebelum diolah menggunakan SAS
Menurut Santos-Briones dan Hernandes-Sotomayor (2006) menyatakan induksi embriogenesis dengan menggunakan eksplan daun kopi Arabika dapat dilakukan hanya menggunakan BAP. Mereka melaporkan bahwa sitokinin juga berperan penting dalam induksi embrio somatik.
Percobaan II. Induksi Embrio Somatik Kopi Robusta Varietas BP 42 x BP 358
Menurut Santos-Briones dan Hernandes-Sotomayor (2006) dengan penelitian menggunakan ekspan daun kopi Arabika, proses induksi embrio somatik itu ada dua, yaitu single-step procedure dan double-step procedure.
Single-step procedure berperan untuk menghasilkan kalus embriogenik hingga embrio kotiledonari dalam satu media. Double-step procedure berperan untuk menghasilkan pembentukan kalus dan pembentukan embrio dengan media yang berbeda. Oleh karena itu, pemindahan kalus ke media induksi sangat penting agar menghasilkan embrio dengan cepat.
18
Pada percobaan ini embrio somatik diinduksi melalui metode double-step procedure. Subkultur proembrio ke dalam media pembentukan embrio pada 14 minggu setelah perlakuan. Sumber inokulum yang dipindahkan adalah proembrio. Sumber inokulum dipecah menjadi inokulum proembrio berukuran diameter ±5 mm untuk proses induksi embrio somatik.
Proembrio yang dikulturkan pada media induksi embrio somatik diamati selama 11 minggu. Proembrio berubah fase menjadi globular berwarna putih jantung, torpedo hingga terbentuk kotiledonari. Hasil pengamatan menunjukkan proembrio mulai membentuk fase globular pada tiga minggu setelah disubkultur.
Perubahan fase globular menjadi embrio fase kotiledonari embrio pada 4-8 minggu setelah perlakuan. Perkembangan proembrio membentuk embrio
somatik tidak terjadi serempak pada satu inokulum.
Rekapitulasi analisis ragam pada Tabel 7 menunjukkan bahwa media induksi embrio tidak memberikan pengaruh nyata terhadap pembentukan embrio. Media asal proembrio berpengaruh nyata pada 19 MSP dan berpengaruh sangat nyata pada 20-21 MSP. Media asal proembrio tidak berpengaruh nyata pada 18 MSP dan 22-25 MSP. Interaksi antara media embrio dan media asal proembrio tidak memberikan pengaruh nyata dari awal hingga akhir pengamatan.
Tabel 7 Rekapitulasi analisis ragam pengaruh media induksi embrio dan media asal proembrio terhadap pembentukan kotiledonari kopi Robusta varietas BP 42 x BP 358 Umur (MSP) Media induksi embrio Media asal proembrio
Interaksi antara media induksi embrio dengan media asal proembrio
18 tn tn tn 19 tn * tn 20 tn ** tn 21 tn ** tn 22 tn tn tn 23 tn tn tn 24 tn tn tn 25 tn tn tn
Keterangan: **) berpengaruh sangat nyata p≤0.01; *) berpengaruh nyata p≤0.05; tn=tidak nyata MSP = Minggu setelah perlakuan
Data Tabel 8 menunjukkan bahwa pembentukan kotiledonari tidak serempak. Media dengan kombinasi 1 µM 2,4-D dan 10 µM 2iP membentuk kotiledonari pada 21 MSP. Media kombinasi 1 µM 2,4-D dan 10 µM BA membentuk kotiledonari pada 20 MSP sementara media kombinasi 1 µM 2,4-D dan 15 µM belum membentuk sama sekali hingga 21 MSP. Persentase rata-rata pembentukan kotiledonari tertinggi adalah media dengan kombinasi 1µM 2,4-D dan 5µM BA yaitu 100 % pada 21 MSP.
19
Tabel 8 Pengaruh media asal proembrio terhadap pembentukan kotiledonari kopi Robusta varietas BP 42 xBP 358 dari inokulum proembrio
Media asal proembrio (µM)
∑ inokulum proembrio
Proembrio membentuk embrio fase kotiledonari (%)
19 20 21
Umur (Minggu setelah perlakuan)
2,4-D BA
1
5 15 20.0a 80.0a 100.0a
10 20 0.0b 5.0b 5.0b 15 50 0.0b 0.0b 0.0b 20 30 3.3b 10.0b 23.3b 2iP 10 45 0.0b 0.0b 2.5b KK (%) 29.18 40.39 34.45
Keterangan: angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT α=0.05. Data di transformasi (x+5) ½ sebelum diolah menggunakan SAS
Percobaan III. Perkecambahan Embrio Somatik Kopi Robusta Varietas BP 42 x BP 358
Perlakuan yang digunakan dalam perkecambahan adalah media dasar MS dengan penambahan 5µM GA3 dan 10 µM GA3. Embrio somatik yang dikecambahkan adalah embrio somatik yang diperoleh dari media pendewasaan sebelumnya. Pertumbuhan kecambah diamati selama 4 minggu setelah perlakuan.
Gambar 6 Fase perkembangan embriogenesis sel somatik daun kopi Robusta varietas BP 42 x BP 358 A) Kalus. B) Proembrio. C) Globular. D) Jantung E) Torpedo. F) Kotiledonari. G) Kecambah
Pengamatan pada 1 minggu setelah perlakuan embrio mulai berubah warna menjadi hijau. Embrio menjadi kecambah pada 2 MSP. Tabel 9 menunjukkan bahwa persentase embrio berkecambah pada 5 µM adalah 46.9 % dan 10 µM adalah 54.4 % pada 2 MSP dan meningkat masing-masing 70.3 % dan 68.8 %
20
pada 4 MSP. Jumlah embrio yang berkecambah terbanyak pada 4 MSP adalah 2.4 buah pada medi 10 µM GA3
Tabel 9 Rata-rata jumlah embrio berkecambah dari inokulum embrio kopi Robusta varietas BP 42 x BP 358 pada media dengan GA3
GA3 (µM) ∑ inokulum embrio Rata-rata kotiledonari /inokulum
Rataan Jumlah Kecambah Inokulum (Persentase Kecambah)
30 MSP 31 MSP 32 MSP 33 MSP
5 50 2.6 0 1.2 (46.9) 2.1 (82.0) 1.8 (70.3)
10 55 3.5 0 1.9 (54.4) 2.6 (74.5) 2.4 (68.8) Hasil percobaan menunjukkan bahwa penambahan GA3 hingga 5 µM GA3 untuk perkecambahan mampu meningkatkan persentase embrio berkecambah. Perlakuan 5µM GA3 memberikan persentase tertinggi terhadap perkecambahan. Hal ini didukung dengan percobaan Oktavia (2003) yang juga menyatakan 5µM GA3 menghasilkan persentase lebih tinggi dari 10 µM GA3. Semakin tinggi konsentrasi GA3, persentase embrio yang berkecambah semakin menurun.Menurut Wattimena (1989) giberelin berpengaruh pada pertambahan panjang batang.
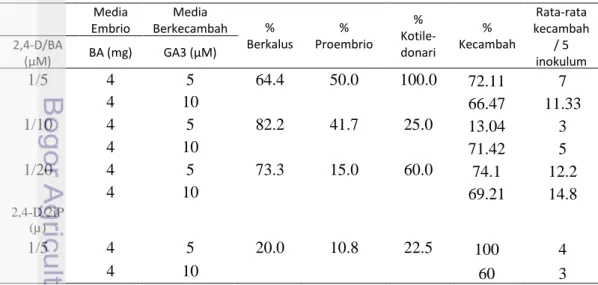
Tabel 10 menunjukkan bahwa persentase eksplan daun kopi Robusta BP 42 x BP 358 membentuk planlet yang dihasilkan dari 45 eksplan. Hasil tertinggi adalah penggunaan media proembrio kombinasi 1 µM dan 20 µM dengan media embrio dengan menggunakan 4 mg BA tanpa auksin 2,4-D serta media berkecambah 10 µM GA3 yaitu 14.8 buah kecambah. Hal ini menunjukkan bahwa dari 45 eksplan berukuran ±0.5 cm dapat menghasilkan 14.8 buah kecambah.
Tabel 10 Persentase eksplan daun kopi Robusta varietas BP 42 x BP 358 yang membentuk planlet melalui proses embriogenesis sel somatik
Media Embrio Media Berkecambah % Berkalus % Proembrio % Kotile-donari % Kecambah Rata-rata kecambah / 5 inokulum 2,4-D/BA (µM) BA (mg) GA3 (µM) 1/5 4 5 64.4 50.0 100.0 72.11 7 4 10 66.47 11.33 1/10 4 5 82.2 41.7 25.0 13.04 3 4 10 71.42 5 1/20 4 5 73.3 15.0 60.0 74.1 12.2 4 10 69.21 14.8 2,4-D/2iP (µ) 1/5 4 5 20.0 10.8 22.5 100 4 4 10 60 3
21
KESIMPULAN
Zat pengatur tumbuh auksin 2,4-D dan sitokinin BA dan 2iP tidak berpengaruh nyata terhadap pembentukan kalus. Interaksi antara auksin 2,4-D dan sitokinin BA dan 2iP juga tidak berpengaruh nyata terhadap pembentukan kalus. Persentase eksplan berkalus tertinggi 86.7 % pada media kombinasi 5 µM 2,4-D dan 20 µM BA. Sitokinin BA dan 2iP berpengaruh nyata terhadap pembentukan proembrio pada 13 MSP. Interaksi antara auksin 2,4-D dan sitokinin BA dan 2iP tidak berpengaruh nyata terhadap pembentukan proembrio. Persentese proembrio tertinggi adalah 81.04 % dengan konsentrasi sitokinin 20 µM BA. Sementara itu, auksin 2,4-D dan sitokinin BA dan 2iP tidak berpangaruh terhadap pembentukan embrio. Interaksi antara media induksi embrio dan media asal proembrio tidak berpengaruh nyata terhadap pembentukan embrio. Media asal proembrio berpengaruh nyata pada 19 MSP dan berpengaruh sangat nyata pada 20 dan 21 MSP terhadap pembentukan embrio. Persentase proembrio membentuk embrio somatik fase kotiledonari tertinggi adalah 33.3% pada kombinasi media 0 mg l-1 2,4-D dan 4 mg l-1BA. Persentase embrio somatik fase kotiledonari berkecambah tertinggi adalah 82 % dengan menggunan media 5 µM GA3. Jumlah kecambah tertinggi diperoleh pada media dengan GA3 10 µM dari proembrio yang berasal dari media kombinasi 1 µM 2,4-D dan 20 µM BA sebesar 14.8 buah.
DAFTAR PUSTAKA
[AEKI] Asosiasi Eksportir Kopi Indonesia. 2012. Ekspor-Impor Kopi Indonesia Berdasarkan Kopi Biji dan Olahannya tahun 2012
[BPPT] Balai Besar Pengkajian dan Pengembangan Teknologi Pertanian
Ernawati, Arief, R.W., Slameto. 2008. Teknologi Budidaya Kopi Poliklonal. Arimarsetiowati, R., 2011. Pengaruh auksin 2,4-D dan sitokinin 2iP terhadap pembentukan embriogenesis sel somatik langsung pada eksplan daun coffea arabica L. Pelita Perkebunan 27(2): 68-77
Berthouly, M. and H. Etienne. 2000. Somatic Embryogenesis of Coffee p.71-90.
In T.Sera, C.R.Soccol, A.Pandey, S.Roussos (eds.). Coffea Biotechnology and Quality. AH. Dordrecht (NL): Kluwer Academic Publishers
Carneiro, M.F. 1997. Coffee biotechnology and its application in genetic transformation. Euphytica 96: 167-172.
Gatica,A.M., G.Arrieta, Ana.M.E. 2008. Direct somatic embryogenesis in Coffea arabica L. CVS. Caturra and Catuai: effect of triacontanol, light condition, and medium concistency. Agronomia Costarricense 32(1): 139-147.
George EF, Sherington PD. 1984. Handbook of Plant Propagation by Tissue Culture. England (GB): Eastern Press Ltd.
Kumar, V., M.M.Naidu, G.A.Ravishankar. 2006. Development in coffee biotechnology - in vitro plant propagation and crop improvement. Plant Cell Tiss Organ Cult 87: 49-65.
Mariska, I. 1996. Embriogenesis sel somatik tanaman kehutanan. Prosiding Kursus Bioteknologi, 4-9 November 1996. Badan Pengkajian dan Penerapan Teknologi. Serpong. 13 hal.
22
Murashige, T., F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15: 473-497
Oktavia, F., Siswanto, A. Budiani, Sudarsono. 2003. Embriogenesis somatik langsung dan regenerasi planlet kopi Arabika (Coffea arabica) dari berbagai eksplan . Menara Perkebunan 71(2): 44-55
Panggabean, E. 2011. Buku Pintar Kopi. Jakarta(ID):AgroMedia Pustaka
Priyono, B. Florin, M. Rigoreau, J. Ducos, U. Sumirat, S. Mawardi, C. Lambot, P.Broun, V.Pe´tiard, T. Wahyudi, D. Crouzillat. 2010. Somatic embryogenesis and vegetative cutting capacity are underdistinct genetic control in Coffea canephora Pierre. Plant Cell Rep 29:343–357
Riyadi, I., Tirtoboma, 2004. Pengaruh 2,4-D terhadap induksi embrio somatik kopi Arabika. Buletin Plasma Nutfah 10(2): 82-89
Santos-Briones,C.D.L. and S. M. T. Hernández-Sotomayor. 2006. Coffee biotechnology. Braz. J. Plant Physiol 18(1):217-227
Wachjar,A., Y. Setiadi, L.W. Mardhikanto. 2002. Pengaruh pupuk organik dan intensitas naungan terhadap pertumbuhan bibit kopi Robusta (Coffea canephora Pierre ex Froehner). Bul. Agronomi 30(1): 6-11
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Bogor (ID): Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. 145 hal
Wattimena, G.A. 1989. Zat Pengatur tumbuh: peran fisiologi dan dasar-dasar pemakaian. Bul. Agronomi (Edisi khusus November): 28-29
Wattimena, G.A, L.W. Gunawan, N.A. Mattjik, E. Syamsuddin, N.M. Armini, A.
Ernawati. 1992. Bioteknologi Tanaman. Bogor (ID): Pusat Antar Universitas
Bioteknologi Institut Pertanian Bogor.
Wintgen, J.N. 2009. Coffee: Growing, Processing, Sustainable, Production.Winheim:WILEY-VCH Verlag GmBH & Co.KgaA. 1040 hal. Yuwono. 2008. Bioteknologi Pertanian. Yogyakarta. (ID): Gadjah Mada
University Press.
Migro.2009.www.migroplus.com/brosur/Budidaya%20kopi.pdf[24Februari 2011]
23
LAMPIRAN
Lampiran 1 Komposisi Murashige dan Skoog (MS) 1962 Jenis
Kandungan Bahan Kimia MS dasar (mg/l)
Unsur makro MgSO4.7H2O 370 KH2PO4 170 CaCl2.2H2O 440 NH4NO3 1650 KNO3 1900 Unsur Mikro NaMoO4.2H2O 0.25 H3BO3 6.2 MnSO4.4H2O 22.3 ZnSO4.7N2O 8.6 CuSO4.5H2O 0.025 KI 0.83 CoCl2.6H2O 0.025 Vitamin Thiamin 0.1 Piridoksin 0.5 As. nikotinat 0.5 Glisin 2 Myo inositol 100 Gula 30000
25 L am p ir an 2 P er se nt as e e ks pl an da un kopi R obus ta va ri et as B P 42 x B P 358 y an g m emb en tu k p la n le t me la lu i p ro se s e mb rio g en es is s el so ma tik Med ia P roe m br y o Med ia E mb ri o Med ia B er k ecam b ah ∑ E k sp lan % A sep ti k % B er k al u s % P roe m br io % K ot il edon ar i % B er k ecam b ah Ra ta -r at a k ecam b ah / 5 inok ul um 2,4 -D (µ) B A (µ) B A ( m g) GA3 ( µ ) 1 5 4 5 45 73.3 64.4 50 100 72.1 7 4 10 66.4 11.3 1 10 4 5 45 93.3 82.2 41.7 25 13.0 3 4 10 71.4 5 1 20 4 5 45 97.8 73.3 15 60 74.1 12.2 4 10 69.2 14.8 2i P (µ) 1 5 4 5 45 77.8 20 10.8 22.5 100 4 4 10 60 3 24
27
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 25 April 1991 di Medan, Sumatera Utara. Penulis merupakan anak kedua dari Bapak Hendarmin Lubis dan Ibu Elly Rosmaini Siregar.
Tahun 2002 penulis lulus dari SD Al-Azhar Medan, kemudian pada tahun 2005 penulis menyelesaikan studi di SMP Harapan 3 Deli Sedang. Selanjutnya penulis lulus dari SMA Harapan 1 Medan pada tahun 2008. Penulis diterima di IPB melalui jalur USMI pada tahun 2008. Penulis diterima sebagai mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Tahun 2009 penulis aktif di BEM A, Fakultas Pertanian sebagai staf divisi
Agriculture Pada tahun 2012 penulis menjadi asisten Dasar-dasar Bioteknologi Tanaman. Penulis juga mengikuti berbagai kepanitiaan baik dalam organisasi maupun non organisasi selama menjadi mahasiswa.