AUKSIN DAN SITOKININ
OLEH
HAFITH FURQONI A24050013
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INDUKSI EMBRIO SOMATIK MELON (
Cucumis melo
L.)
PADA BEBERAPA MEDIA YANG DILENGKAPI DENGAN
AUKSIN DAN SITOKININ
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Hafith Furqoni A24050013
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
HAFITH FURQONI. Induksi Embrio Somatik Melon (Cucumis melo L.)
pada Beberapa Media yang Dilengkapi dengan Auksin dan Sitokinin. (Dibimbing oleh DARDA EFENDI).
Penelitian ini terdiri dari dua percobaan. Percobaan I bertujuan untuk
mengetahui jenis media dan konsentrasi zat pengatur tumbuh picloram (auksin)
yang terbaik dalam induksi embriogenesis somatik pada melon menggunakan
eksplan biji muda. Sedangkan percobaan II bertujuan untuk mengetahui
konsentrasi beberapa jenis auksin (2.4 D dan NAA) dengan BAP (sitokinin) yang
terbaik untuk menginduksi embriogenesis somatik pada melon menggunakan
eksplan hipokotil. Penelitian dilaksanakan di Laboratorium Kultur Jaringan
Departemen Agronomi dan Hortikultura Institut Pertanian Bogor pada bulan
April-September 2009.
Percobaan I dilaksanakan dengan menggunakan Rancangan faktorial yang
disusun dalam Rancangan Acak Kelompok (RAK). Penelitian terdiri dari dua
faktor dengan faktor pertama media tanam terdiri dari tiga taraf media yaitu MS
(Murashige and Skoog), WPM (Woody Plant Medium), dan B5. Konsentrasi
picloram sebagai faktor kedua terdiri dari empat taraf yaitu 0, 0.5, 1.0, 1.5 mg/L.
Percobaan dilakukan dengan 3 ulangan dan setiap ulangan terdapat 5 botol. Setiap
botol terdapat 5 eksplan. Sumber eksplan yang digunakan yaitu biji muda melon
hibrida H7 koleksi Pusat Kajian Buah-Buahan Tropika IPB yang berumur ± 15
Hari Setelah Penyerbukan.
Percobaan II dilaksanakan dengan menggunakan Rancangan faktorial yang
disusun dalam Rancangan Acak Kelompok (RAK). Penelitian terdiri dari dua
faktor yaitu faktor pertama taraf konsentrasi auksin (2.4 D dan NAA)
masing-masing terdiri dari enam taraf yaitu 0, 1, 2, 3, 4, 5 mg/L. Konsentrasi BAP sebagai
faktor kedua yang terdiri dari dua taraf yaitu 0 dan 0.1 mg/L. Percobaan dilakukan
dengan 3 ulangan dan setiap ulangan terdapat 3 botol. Setiap botol terdapat 5
melon hibrida H7 yang dikecambahkan di media MS0 selama ±15 hari. Hipokotil
dipotong kira-kira 1 cm lalu dimasukkan ke dalam media perlakuan.
Pada Percobaan I, embrio somatik tidak terbentuk pada perlakuan jenis
media yang dikombinasikan dengan taraf konsentrasi picloram. Respon yang
muncul yaitu biji berkalus dan berkecambah.
Pada Percobaan II, terdapat interaksi antara taraf konsentrasi auksin (2.4 D
dan NAA) dengan BAP terhadap induksi embrio somatik menggunakan hipokotil.
Embrio somatik dapat diinduksi pada perlakuan 1 mg/L NAA + 0.1 mg/L BAP
dan perlakuan 2 mg/L NAA + 0.1 mg/L BAP. Hasil tertinggi embrio yang
terbentuk yaitu pada perlakuan 1 mg/L NAA + 0.1 mg/L BAP sebesar 0.53
embrio per eksplan. Dan rata-rata jumlah eksplan yang membentuk embrio
DENGAN AUKSIN DAN SITOKININ
Nama : Hafith Furqoni
NRP : A24050013
Menyetujui,
Dosen Pembimbing
Dr Ir Darda Efendi, MSi
NIP : 19630616 198903 1 006
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura
Fakultas Pertanian IPB
Dr Ir Agus Purwito, MSc.Agr
NIP : 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Banyuwangi pada tanggal 13 Januari 1986. Penulis
merupakan anak kedua dari pasangan Bapak Sutrisno dan Ibu Eni Astutik.
Penulis menyelesaikan sekolah dasar pada tahun 1999 dari SDN 1 Cluring
Banyuwangi, kemudian penulis menamatkan sekolah menengah pertama dari
SMPN 1 Cluring Banyuwangi pada tahun 2002. Pada tahun 2002 penulis
melanjutkan sekolah menengah atas di SMAN 8 Malang dan menamatkan jenjang
pendidikan SMA pada tahun 2005.
Tahun 2005 penulis diterima di Institut Pertanian Bogor melalui jalur
Undangan Seleksi Masuk IPB (USMI). Setahun kemudian penulis diterima
sebagai mahasiswa Departemen Agronomi dan Hortikultura sebagai pilihan
pertama dalam pemilihan mayor.
Penulis aktif di beberapa organisasi mahasiswa. Pada awal tahun kuliah
penulis aktif di Dewan Perwakilan Mahasiswa TPB. Setelah itu pada tahun 2008
penulis menjadi pengurus Himpunan Mahasiswa Agronomi (HIMAGRON)
sebagai Ketua Departemen Pengembangan Sumber Daya Manusia. Penulis juga
aktif sebagai asisten praktikum. Pada semester 4-6 penulis menjadi asisten
praktikum mata kuliah Kimia Tingkat Persiapan Bersama. Lalu semester 7 penulis
menjadi asisten mata kuliah Dasar-Dasar Agronomi. Semester 8 penulis
berkesempatan menjadi asisten mata kuliah Teknik Budidaya Tanaman dan Ilmu
Tanaman Perkebunan. Selanjutnya menjadi asisten mata kuliah Kultur Jaringan
Program Diploma pada semester 9. Penulis juga mengikuti program magang
liburan di Kurnia Stroberi Farm untuk belajar budidaya stroberi dan magang di
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberi
kekuatan dan hidayah sehingga penelitian ini dapat diselesaikan dengan baik.
Penelitian ini dilakukan karena minat penulis terhadap kultur jaringan
yang sangat tinggi. Selain itu perbanyakan melon hibrida koleksi PKBT IPB
menggunakan kultur jaringan khususnya dengan embrio somatik masih belum ada
penelitian sebelumnya. Harapannya jika penelitian ini berhasil, perbanyakan
melon hibrida H7 dengan kultur jaringan akan membutuhkan waktu yang lebih
singkat.
Penulis mengucapkan terima kasih kepada
1. Pembimbing skripsi Dr Ir Darda Efendi, MSi karena telah memberikan
masukan selama proses penelitian dan penulisan skripsi. Terima kasih pula
telah membimbing selama penelitian dengan sabar dan selalu menyediakan
waktu untuk penelitian penulis.
2. Dr Ir Agus Purwito, MSc.Agr dan Juang Gema Kartika, SP, MSi yang telah
bersedia menjadi dosen penguji. Terima kasih atas masukan yang telah
diberikan selama sidang, semoga masukan tersebut bermanfaat bagi penulis.
3. Dwi Guntoro, SP, MSi selaku pembimbing akademik. Terima kasih atas
bimbingannya dalam menentukan rencana belajar penulis selama menempuh
pendidikan di Institut Pertanian Bogor.
4. Willy Bayuardi Suwarno, SP, MSi, terima kasih atas bantuan benih melon
hibrida H7 yang telah diberikan. Semoga hasil penelitian ini berguna.
5. Ir Dini Dinarti, MSi, terima kasih atas diskusi yang menarik selama penulis
berada di Lab. Pengalaman yang sangat berharga bagi penulis.
6. Kedua orang tua, mas Titis, Aan, dan Syahrul. Doa dan kasih sayang kalian
semua yang membuat penulis tetap bertahan untuk meneruskan pendidikan.
7. Sahabat terbaikku sejak SMP yang masih selalu mengisi kehidupanku: Ivan,
Dina, Lia. You are always to be my best friends!!!
8. Sahabat-sahabat terbaikku, dash crew: Dita, Dea, Figur, Joko, Pulung,
It’s amazing time for me to know all of you. I hope we are still in touch and
makes great friendship forever!!!
9. Teman satu lab: Feni, Dendih, Mbak Retno, Mbak Anggi, Bi Acih. Terima
kasih atas semua bantuan selama di Lab.
10. Teman-teman seperjuang di Agronomi dan Hortikultura. Its great class that
I’ve ever had, really!!! I’ll never forget best moment that we make together
for almost 4 years!!!Thanks all…
11. Angga, Mita, Hanum, Wewe, Maya, Tyas, Kaka, The Kampretes, Njuz, Feni,
Warno, Umay, Qiqib, Edi, Ulie Ce, Dial, Matthew, Emoth, Oonk, Dini. All of
you make my day colorful, guys!!! Tyas thanks for all experience at language
course (English and Korea)!! No one can do best as you!!!
12. Teman seperjuang The Ohio Program: Eci, Arie, Candra, Melly, Tyas,
Sammy, Kalla, Dito, Feni. Let’s make big move in Agriculture!!!
13. Semua pihak yang telah berjasa dalam penyelesaian skripsi ini.
Semoga hasil penelitian ini dapat ditindak lanjuti untuk selanjutnya dapat
diterapkan dalam perbanyakan melon hibrida H7.
Bogor, 12 Januari 2010
Halaman
PENDAHULUAN………... 1
Latar Belakang………... 1
Tujuan………... 2
Hipotesis………... 2
TINJAUAN PUSTAKA………. 4
Botani Melon (Cucumis melo L.)………... 4
Melon Hibrida H7………..………... 4
Kultur Jaringan………... 4
Embriogenesis Somatik……… 6
Sumber Eksplan……… 8
Media Tanam……… 8
Zat Pengatur Tumbuh………... 9
Kultur Jaringan Melon (Cucumis melo L.)………... 12
BAHAN DAN METODE………... 14
Tempat dan Waktu……… 14
Bahan dan Alat………. 14
Metode Penelitian………. 14
Pelaksanaan Penelitian………... 17
HASIL DAN PEMBAHASAN………... 21
Percobaan I……… 21
Kondisi Umum………... 21
Persentase Biji Berkalus……… 21
Persentase Biji Berkecambah………. 23
Percobaan II……….. 25
Kondisi Umum………... 25
Jumlah Embrio Somatik dan Jumlah Eksplan yang Menghasilkan Embrio Somatik…... 26
Pembentukan Kalus Embriogenik………... 30
Persentase Hipokotil Berakar……… 32
KESIMPULAN DAN SARAN………... 35
Kesimpulan………... 35
Saran………... 35
DAFTAR PUSTAKA………... 36
DAFTAR TABEL
Nomor Halaman
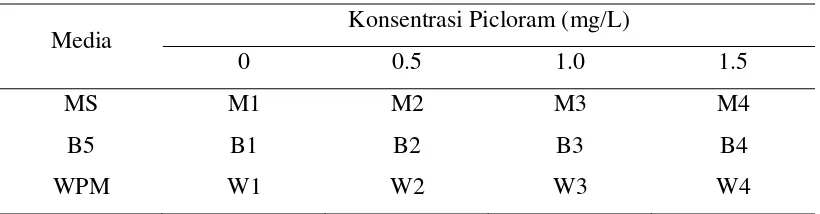
1. Kombinasi Media dan Konsentrasi Picloram……… 15
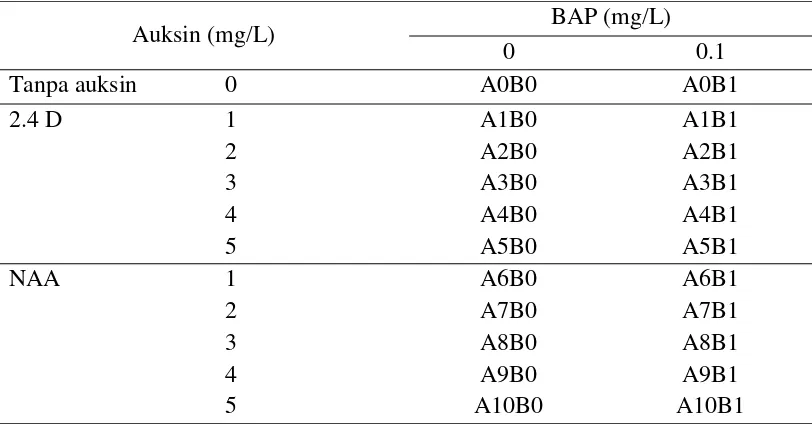
2. Kombinasi Auksin (2.4 D dan NAA) dan BAP………. 16
3. Rekapitulasi Sidik Ragam Persentase Biji Berkalus……….. 22
4. Pengaruh Taraf Konsentrasi Picloram Terhadap Rata-Rata Persentase
Biji Berkalus……….. 22
5. Rekapitulasi Sidik Ragam Persentase Biji Berkecambah ...………… 24
6. Pengaruh Jenis Media terhadap Rata-Rata Persentase Biji Berkecambah... 24
7. Waktu Muncul Embrio Somatik, Jumlah Embrio Somatik, dan Jumlah Eksplan yang Menghasilkan Embrio Somatik………... 27
8. Rekapitulasi Sidik Ragam Jumlah Embrio Somatik per Eksplan dan Rata-Rata Jumlah Eksplan yang Menghasilkan Embrio Somatik saat 72
HST……… 27
9. Pengaruh Taraf Konsentrasi Auksin (2.4 D dan NAA) dengan BAP terhadap Jumlah Embrio Somatik per Eksplan dan Rata-Rata Eksplan yang Menghasilkan Embrio Somatik saat 72 HST……… 29
10. Rekapitulasi Sidik Ragam Pembentukan Kalus Embriogenik………….. 30
11. Pengaruh Taraf Konsentrasi Auksin (2.4 D dan NAA) dengan BAP Terhadap Rata-Rata Persentase Pembentukan Kalus Embriogenik…….. 31
12. Rekapitulasi Sidik Ragam Persentase Hipokotil Berakar……….. 32
AUKSIN DAN SITOKININ
OLEH
HAFITH FURQONI A24050013
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INDUKSI EMBRIO SOMATIK MELON (
Cucumis melo
L.)
PADA BEBERAPA MEDIA YANG DILENGKAPI DENGAN
AUKSIN DAN SITOKININ
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Hafith Furqoni A24050013
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
HAFITH FURQONI. Induksi Embrio Somatik Melon (Cucumis melo L.)
pada Beberapa Media yang Dilengkapi dengan Auksin dan Sitokinin. (Dibimbing oleh DARDA EFENDI).
Penelitian ini terdiri dari dua percobaan. Percobaan I bertujuan untuk
mengetahui jenis media dan konsentrasi zat pengatur tumbuh picloram (auksin)
yang terbaik dalam induksi embriogenesis somatik pada melon menggunakan
eksplan biji muda. Sedangkan percobaan II bertujuan untuk mengetahui
konsentrasi beberapa jenis auksin (2.4 D dan NAA) dengan BAP (sitokinin) yang
terbaik untuk menginduksi embriogenesis somatik pada melon menggunakan
eksplan hipokotil. Penelitian dilaksanakan di Laboratorium Kultur Jaringan
Departemen Agronomi dan Hortikultura Institut Pertanian Bogor pada bulan
April-September 2009.
Percobaan I dilaksanakan dengan menggunakan Rancangan faktorial yang
disusun dalam Rancangan Acak Kelompok (RAK). Penelitian terdiri dari dua
faktor dengan faktor pertama media tanam terdiri dari tiga taraf media yaitu MS
(Murashige and Skoog), WPM (Woody Plant Medium), dan B5. Konsentrasi
picloram sebagai faktor kedua terdiri dari empat taraf yaitu 0, 0.5, 1.0, 1.5 mg/L.
Percobaan dilakukan dengan 3 ulangan dan setiap ulangan terdapat 5 botol. Setiap
botol terdapat 5 eksplan. Sumber eksplan yang digunakan yaitu biji muda melon
hibrida H7 koleksi Pusat Kajian Buah-Buahan Tropika IPB yang berumur ± 15
Hari Setelah Penyerbukan.
Percobaan II dilaksanakan dengan menggunakan Rancangan faktorial yang
disusun dalam Rancangan Acak Kelompok (RAK). Penelitian terdiri dari dua
faktor yaitu faktor pertama taraf konsentrasi auksin (2.4 D dan NAA)
masing-masing terdiri dari enam taraf yaitu 0, 1, 2, 3, 4, 5 mg/L. Konsentrasi BAP sebagai
faktor kedua yang terdiri dari dua taraf yaitu 0 dan 0.1 mg/L. Percobaan dilakukan
dengan 3 ulangan dan setiap ulangan terdapat 3 botol. Setiap botol terdapat 5
melon hibrida H7 yang dikecambahkan di media MS0 selama ±15 hari. Hipokotil
dipotong kira-kira 1 cm lalu dimasukkan ke dalam media perlakuan.
Pada Percobaan I, embrio somatik tidak terbentuk pada perlakuan jenis
media yang dikombinasikan dengan taraf konsentrasi picloram. Respon yang
muncul yaitu biji berkalus dan berkecambah.
Pada Percobaan II, terdapat interaksi antara taraf konsentrasi auksin (2.4 D
dan NAA) dengan BAP terhadap induksi embrio somatik menggunakan hipokotil.
Embrio somatik dapat diinduksi pada perlakuan 1 mg/L NAA + 0.1 mg/L BAP
dan perlakuan 2 mg/L NAA + 0.1 mg/L BAP. Hasil tertinggi embrio yang
terbentuk yaitu pada perlakuan 1 mg/L NAA + 0.1 mg/L BAP sebesar 0.53
embrio per eksplan. Dan rata-rata jumlah eksplan yang membentuk embrio
DENGAN AUKSIN DAN SITOKININ
Nama : Hafith Furqoni
NRP : A24050013
Menyetujui,
Dosen Pembimbing
Dr Ir Darda Efendi, MSi
NIP : 19630616 198903 1 006
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura
Fakultas Pertanian IPB
Dr Ir Agus Purwito, MSc.Agr
NIP : 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Banyuwangi pada tanggal 13 Januari 1986. Penulis
merupakan anak kedua dari pasangan Bapak Sutrisno dan Ibu Eni Astutik.
Penulis menyelesaikan sekolah dasar pada tahun 1999 dari SDN 1 Cluring
Banyuwangi, kemudian penulis menamatkan sekolah menengah pertama dari
SMPN 1 Cluring Banyuwangi pada tahun 2002. Pada tahun 2002 penulis
melanjutkan sekolah menengah atas di SMAN 8 Malang dan menamatkan jenjang
pendidikan SMA pada tahun 2005.
Tahun 2005 penulis diterima di Institut Pertanian Bogor melalui jalur
Undangan Seleksi Masuk IPB (USMI). Setahun kemudian penulis diterima
sebagai mahasiswa Departemen Agronomi dan Hortikultura sebagai pilihan
pertama dalam pemilihan mayor.
Penulis aktif di beberapa organisasi mahasiswa. Pada awal tahun kuliah
penulis aktif di Dewan Perwakilan Mahasiswa TPB. Setelah itu pada tahun 2008
penulis menjadi pengurus Himpunan Mahasiswa Agronomi (HIMAGRON)
sebagai Ketua Departemen Pengembangan Sumber Daya Manusia. Penulis juga
aktif sebagai asisten praktikum. Pada semester 4-6 penulis menjadi asisten
praktikum mata kuliah Kimia Tingkat Persiapan Bersama. Lalu semester 7 penulis
menjadi asisten mata kuliah Dasar-Dasar Agronomi. Semester 8 penulis
berkesempatan menjadi asisten mata kuliah Teknik Budidaya Tanaman dan Ilmu
Tanaman Perkebunan. Selanjutnya menjadi asisten mata kuliah Kultur Jaringan
Program Diploma pada semester 9. Penulis juga mengikuti program magang
liburan di Kurnia Stroberi Farm untuk belajar budidaya stroberi dan magang di
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberi
kekuatan dan hidayah sehingga penelitian ini dapat diselesaikan dengan baik.
Penelitian ini dilakukan karena minat penulis terhadap kultur jaringan
yang sangat tinggi. Selain itu perbanyakan melon hibrida koleksi PKBT IPB
menggunakan kultur jaringan khususnya dengan embrio somatik masih belum ada
penelitian sebelumnya. Harapannya jika penelitian ini berhasil, perbanyakan
melon hibrida H7 dengan kultur jaringan akan membutuhkan waktu yang lebih
singkat.
Penulis mengucapkan terima kasih kepada
1. Pembimbing skripsi Dr Ir Darda Efendi, MSi karena telah memberikan
masukan selama proses penelitian dan penulisan skripsi. Terima kasih pula
telah membimbing selama penelitian dengan sabar dan selalu menyediakan
waktu untuk penelitian penulis.
2. Dr Ir Agus Purwito, MSc.Agr dan Juang Gema Kartika, SP, MSi yang telah
bersedia menjadi dosen penguji. Terima kasih atas masukan yang telah
diberikan selama sidang, semoga masukan tersebut bermanfaat bagi penulis.
3. Dwi Guntoro, SP, MSi selaku pembimbing akademik. Terima kasih atas
bimbingannya dalam menentukan rencana belajar penulis selama menempuh
pendidikan di Institut Pertanian Bogor.
4. Willy Bayuardi Suwarno, SP, MSi, terima kasih atas bantuan benih melon
hibrida H7 yang telah diberikan. Semoga hasil penelitian ini berguna.
5. Ir Dini Dinarti, MSi, terima kasih atas diskusi yang menarik selama penulis
berada di Lab. Pengalaman yang sangat berharga bagi penulis.
6. Kedua orang tua, mas Titis, Aan, dan Syahrul. Doa dan kasih sayang kalian
semua yang membuat penulis tetap bertahan untuk meneruskan pendidikan.
7. Sahabat terbaikku sejak SMP yang masih selalu mengisi kehidupanku: Ivan,
Dina, Lia. You are always to be my best friends!!!
8. Sahabat-sahabat terbaikku, dash crew: Dita, Dea, Figur, Joko, Pulung,
It’s amazing time for me to know all of you. I hope we are still in touch and
makes great friendship forever!!!
9. Teman satu lab: Feni, Dendih, Mbak Retno, Mbak Anggi, Bi Acih. Terima
kasih atas semua bantuan selama di Lab.
10. Teman-teman seperjuang di Agronomi dan Hortikultura. Its great class that
I’ve ever had, really!!! I’ll never forget best moment that we make together
for almost 4 years!!!Thanks all…
11. Angga, Mita, Hanum, Wewe, Maya, Tyas, Kaka, The Kampretes, Njuz, Feni,
Warno, Umay, Qiqib, Edi, Ulie Ce, Dial, Matthew, Emoth, Oonk, Dini. All of
you make my day colorful, guys!!! Tyas thanks for all experience at language
course (English and Korea)!! No one can do best as you!!!
12. Teman seperjuang The Ohio Program: Eci, Arie, Candra, Melly, Tyas,
Sammy, Kalla, Dito, Feni. Let’s make big move in Agriculture!!!
13. Semua pihak yang telah berjasa dalam penyelesaian skripsi ini.
Semoga hasil penelitian ini dapat ditindak lanjuti untuk selanjutnya dapat
diterapkan dalam perbanyakan melon hibrida H7.
Bogor, 12 Januari 2010
Halaman
PENDAHULUAN………... 1
Latar Belakang………... 1
Tujuan………... 2
Hipotesis………... 2
TINJAUAN PUSTAKA………. 4
Botani Melon (Cucumis melo L.)………... 4
Melon Hibrida H7………..………... 4
Kultur Jaringan………... 4
Embriogenesis Somatik……… 6
Sumber Eksplan……… 8
Media Tanam……… 8
Zat Pengatur Tumbuh………... 9
Kultur Jaringan Melon (Cucumis melo L.)………... 12
BAHAN DAN METODE………... 14
Tempat dan Waktu……… 14
Bahan dan Alat………. 14
Metode Penelitian………. 14
Pelaksanaan Penelitian………... 17
HASIL DAN PEMBAHASAN………... 21
Percobaan I……… 21
Kondisi Umum………... 21
Persentase Biji Berkalus……… 21
Persentase Biji Berkecambah………. 23
Percobaan II……….. 25
Kondisi Umum………... 25
Jumlah Embrio Somatik dan Jumlah Eksplan yang Menghasilkan Embrio Somatik…... 26
Pembentukan Kalus Embriogenik………... 30
Persentase Hipokotil Berakar……… 32
KESIMPULAN DAN SARAN………... 35
Kesimpulan………... 35
Saran………... 35
DAFTAR PUSTAKA………... 36
DAFTAR TABEL
Nomor Halaman
1. Kombinasi Media dan Konsentrasi Picloram……… 15
2. Kombinasi Auksin (2.4 D dan NAA) dan BAP………. 16
3. Rekapitulasi Sidik Ragam Persentase Biji Berkalus……….. 22
4. Pengaruh Taraf Konsentrasi Picloram Terhadap Rata-Rata Persentase
Biji Berkalus……….. 22
5. Rekapitulasi Sidik Ragam Persentase Biji Berkecambah ...………… 24
6. Pengaruh Jenis Media terhadap Rata-Rata Persentase Biji Berkecambah... 24
7. Waktu Muncul Embrio Somatik, Jumlah Embrio Somatik, dan Jumlah Eksplan yang Menghasilkan Embrio Somatik………... 27
8. Rekapitulasi Sidik Ragam Jumlah Embrio Somatik per Eksplan dan Rata-Rata Jumlah Eksplan yang Menghasilkan Embrio Somatik saat 72
HST……… 27
9. Pengaruh Taraf Konsentrasi Auksin (2.4 D dan NAA) dengan BAP terhadap Jumlah Embrio Somatik per Eksplan dan Rata-Rata Eksplan yang Menghasilkan Embrio Somatik saat 72 HST……… 29
10. Rekapitulasi Sidik Ragam Pembentukan Kalus Embriogenik………….. 30
11. Pengaruh Taraf Konsentrasi Auksin (2.4 D dan NAA) dengan BAP Terhadap Rata-Rata Persentase Pembentukan Kalus Embriogenik…….. 31
12. Rekapitulasi Sidik Ragam Persentase Hipokotil Berakar……….. 32
Nomor Halaman
1. Penampilan Melon Snow White Meta (H7)……… 5
2. Keseimbangan Auksin dan Sitokinin dalam Proses Morfogenesis (Wattimena et al., 1992)……… 10
3. Struktur molekul kimia (A) 2.4 D; (B) NAA; dan (C) BAP (Evans et al., 2003); (D) Picloram (www.alanwood.com)...………… 11
4. (A) Buah Muda Berumur ±15 Hari Setelah Penyerbukan. (B) Biji Muda yang Telah Dibersihkan………. 19
5. Biji yang Dikecambah Setelah Berumur 15 HST (Hari Setelah Tanam).. 19
6. Biji Berkalus: (A) Perlakuan Media MS + 0 mg/L Picloram saat 56 HST; (B) Perlakuan Media B5 + 0.5 mg/L Picloram saat 56 HST………... 23
7. Biji Berkecambah: (A) Perlakuan Media B5 + 0 mg/L Picloram saat 52 HST; (B) Perlakuan Media MS + 0.5 mg/L Picloram saat 52
HST………..………... 25
8. Embrio Somatik yang Terbentuk pada Perlakuan 1 mg/L NAA + 0.1
mg/L BAP……….. 28
9. Eksplan yang Menghasilkan Embrio: (A) Perlakuan 1 mg/L NAA + 0.1 mg/L BAP saat 52 HST; (B) Perlakuan 2 mg/L NAA + 0.1 mg/L BAP
saat 56 HST………... 29
10. Kalus Embriogenik Perlakuan 1 mg/L NAA + 0.1 mg/L BAP…………. 32
11. Pembentukan Akar: (A) Perlakuan tanpa ZPT; (B) Perlakuan 2 mg/L
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi Media MS……… 40
2. Komposisi Media WPM……… 41
3. Komposisi Media B5………... 42
4. Sidik Ragam Persentase Biji Berkalus………... 43
5. Sidik Ragam Persentase Biji Berkecambah………... 45
6. Sidik Ragam Jumlah Embrio per Eksplan saat 72 HST……… 47
7. Sidik Ragam Rata-Rata Jumlah Eksplan yang Menghasilkan Embrio
saat 72 HST………... 48
8. Sidik Ragam Pembentukan Kalus Embriogenik………... 49
Latar Belakang
Melon (Cucumis melo L.) merupakan tanaman semusim merambat.
Tanaman melon menghasilkan buah yang dapat dikonsumsi segar. Meskipun
termasuk buah, melon dikelompokkan kedalam sayuran karena cara budidaya
yang intensif seperti sayuran. Produksi buah melon di Indonesia pada tahun 2006
sebesar 55 370 ton dan meningkat pada tahun 2007 sebesar 59 814 ton (Deptan,
2008). Peningkatan produksi melon, meningkatkan pula kebutuhan benih melon.
Pemenuhan kebutuhan benih melon perlu diimbangi dengan penyediaan benih
baik jumlah, kualitas benih maupun kontinuitas.
Perbanyakan melon secara umum biasanya dilakukan dengan biji. Biji dari
buah yang sudah matang dapat digunakan sebagai benih untuk musim tanam
selanjutnya. Namun, untuk menghasilkan melon hibrida perlu dilakukan
persilangan antara tetua yang sudah memiliki karakter unggul agar diperoleh
melon hibrida unggul pula. Cara ini lebih lama karena setiap ingin memproduksi
benih hibrida perlu dilakukan penanaman tanaman induk yang selanjutnya
dilakukan persilangan untuk menghasilkan benih hibrida.
Salah satu alternatif dalam perbanyakan tanaman yaitu dengan cara kultur
jaringan. Kultur jaringan memberikan banyak keuntungan diantaranya tanaman
dapat diperbanyak setiap saat tanpa tergantung musim, daya multiplikasi yang
tinggi, memerlukan bahan tanam yang sedikit, tanaman yang dihasilkan seragam,
serta bebas penyakit terutama bakteri dan cendawan (Wattimena et al., 1992).
Perbanyakan secara in vitro dapat pula dilakukan pada tanaman melon.
Perbanyakan dengan cara ini akan memberikan efisiensi waktu dan ekonomi.
Perbanyakan bisa dilakukan kapan saja dalam jumlah banyak serta secara
ekonomi akan menekan biaya produksi penyediaan benih melon.
Penggandabiakan dalam kultur jaringan dapat dilakukan melalui jalur
organogenesis dan embriogenesis somatik. Cara embriogenesis somatik banyak
mendapat perhatian karena jumlah propagula yang dihasilkan banyak dan dapat
2
Faktor-faktor yang mempengaruhi dalam embriogenesis somatik yaitu
jenis eksplan, sumber nitrogen dan gula serta zat pengatur tumbuh
(Purnamaningsih, 2002). Sehingga penentuan komposisi ketiga faktor tersebut
menentukan keberhasilan dalam induksi embriogenesis somatik.
Penelitian ini menggunakan tiga jenis media dasar dan beberapa jenis
auksin dan sitokinin. Percobaan I menggunakan media dasar MS (Murashige and
Skoog), WPM (Woody Plant Medium), dan B5 yang dikombinasikan dengan
empat taraf konsentrasi picloram (auksin). Percobaan II menggunakan enam taraf
konsentrasi auksin (2.4 D dan NAA) yang dikombinasikan dengan dua taraf
konsentrasi sitokinin (BAP).
Tujuan
Percobaan I bertujuan untuk mengetahui jenis media dan konsentrasi zat
pengatur tumbuh picloram yang terbaik dalam induksi embriogenesis somatik
pada melon menggunakan eksplan biji muda. Sedangkan percobaan II bertujuan
untuk mengetahui konsentrasi beberapa jenis auksin (2.4 D dan NAA) dengan
BAP yang terbaik untuk menginduksi embriogenesis somatik pada melon
menggunakan eksplan hipokotil.
Hipotesis
Hipotesis percobaan I yang diajukan yaitu
1. Terdapat media yang optimum untuk induksi embriogenesis melon
menggunakan eksplan biji muda.
2. Terdapat konsentrasi picloram yang optimum untuk induksi embriogenesis
melon menggunakan eksplan biji muda.
3. Terdapat interaksi antara media dan konsentrasi picloram dalam menginduksi
Sedangkan hipotesis percobaan II yang diajukan yaitu
1. Terdapat konsentrasi auksin (2.4 D dan NAA) yang optimum untuk induksi
embriogenesis melon menggunakan eksplan hipokotil.
2. Terdapat konsentrasi BAP yang optimum untuk induksi embriogenesis melon
menggunakan eksplan hipokotil.
3. Terdapat interaksi antara auksin (2.4 D dan NAA) dan BAP dalam
TINJAUAN PUSTAKA
Botani Melon (Cucumis melo L.)
Melon dalam klasifikasi tanaman digolongkan kedalam famili
Cucurbitaceae sama seperti blewah (Cucumis melo L.), semangka (Citrullus
vulgaris Schard), mentimun (Cucumis sativum L.), paria (Momordica charantia
L. Roxb.), dan waluh (Cucurbita moschata). Famili ini terdiri dari sekitar 130
genus, lebih dari 900 spesies, dan hanya sebagian kecil yang dibudidayakan
(Bernadac et al, 2002). Melon merupakan tanaman yang menghasilkan biji
sehingga digolongkan sebagai tanaman Spermatophyta. Biji melon tertutup oleh
bakal buah sehingga termasuk tanaman Angiospermae.
Biji tanaman melon (Cucumis melo L.) terdiri dari dua lembaga sehingga
digolongkan ke dalam kelas tanaman berbiji belah dua (dikotil). Melon
digolongkan ke dalam genus cucumis dan dalam genus tersebut terdapat beberapa
spesies. Dalam genus cucumis terdapat dua spesies yang sering dibudidayakan
dan menjadi tanaman sayuran penting di dunia yaitu melon (Cucumis melo L.) dan
mentimun (Cucumis sativus L.) (Kirkbride, 1994).
Melon Hibrida H7
Melon hibrida H7 merupakan melon hasil rakitan Pusat Kajian
Buah-Buahan Tropika, Institut Pertanian Bogor. Melon hibrida tersebut diberi nama
Snow White Meta. Keunggulan dari melon Snow White Meta adalah warna kulit
buah setelah tua berwarna krem dengan ketebalan daging buah 4 cm (Gambar
1A). Warna daging buah putih dengan tekstur daging buah halus tidak berserat
(Gambar 1B). Aroma buah melon wangi dan memiliki padatan terlarut total 10.5o
brix. Bobot buah rata-rata berkisar 1.0 - 1.5 kg (Sobir, 2007).
Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian dari
tanaman seperti protoplasma, sel, jaringan dan organ, serta menumbuhkannya
dan beregenerasi menjadi tanaman utuh kembali (Gunawan, 1992). Kultur
jaringan bisa juga diartikan sebagai perbanyakan mikro. Menurut Acquaah (2004)
perbanyakan mikro adalah perbanyakan tanaman secara in vitro, yang
memanfaatkan jaringan meristem atau jaringan non meristem yang telah ada.
Terdapat empat metode secara umum dalam kultur jaringan yaitu kultur pucuk,
kultur buku, organogenesis, dan embriogenesis nonzigotik (Acquaah, 2004).
Tujuan pokok penerapan perbanyakan mikro adalah produksi tanaman dalam
jumlah besar dalam waktu yang singkat, terutama untuk varietas-varietas unggul
yang baru dihasilkan (Gunawan, 1992).
A B
Gambar 1. Melon Snow White Meta (H7): (A) Kulit Luar Berwarna Krem; (B) Daging Buah Berwarna Putih
Kultur jaringan memberikan banyak keuntungan dibandingkan
perbanyakan secara konvensional. Perbanyakan tanaman dapat dilakukan dengan
cepat karena siklus perbanyakan yang lebih singkat. Volume perbanyakan yang
dihasilkan lebih besar pada tanaman hias seperti anggrek, tanaman berkayu, dan
tanaman semak. Melalui kultur jaringan, tanaman dapat diperbanyak dalam
jumlah besar dan memudahkan transportasi. Selain itu, perbanyakan tidak
tergantung musim dan dapat memenuhi permintaan pasar dengan cepat (Evans et
al., 2003). Namun ada beberapa tanaman yang tidak menguntungkan bila
dikembangkan dengan kultur jaringan. Misalnya, kecepatan multiplikasinya
rendah, terlalu banyak langkah untuk mencapai tanaman sempurna, atau terlalu
tinggi tingkat penyimpangan genetik (Gunawan, 1992). Pada prinsipnya
6
perkecambahan biji rendah, tanaman hibrida yang berasal dari tetua yang tidak
menunjukkan male sterility, hibrida-hibrida unik, perbanyakan pohon-pohon
bernilai ekonomis, serta tanaman yang selalu diperbanyak secara vegetatif
(Gunawan, 1992).
Teknik perbanyakan secara kultur jaringan dapat dilakukan secara
organogenesis dan embriogenesis. Organogenesis adalah proses terbentuknya
organ seperti pucuk dan akar (Gunawan, 1992). Terdapat dua cara terjadinya
organogenesis yaitu secara langsung atau tidak langsung. Organogenesis langsung
terjadi tanpa terbentuknya kalus terlebih dahulu sedangkan organogenesis tidak
langsung diawali dengan pembentukan kalus lalu muncul organ pada kalus. Kalus
merupakan massa sel yang tidak terdiferensiasi seperti sel meristem (Acquaah,
2004).
Embriogenesis Somatik
Embriogenesis somatik merupakan suatu proses dimana sel somatik (baik
haploid maupun diploid) berkembang membentuk tumbuhan baru melalui tahap
perkembangan embrio yang spesifik tanpa melalui fusi gamet. Embriogenesis
berbeda dengan organogenesis pada regenerasi dan organisasi yang bersifat
bipolar (Loberant, 1998). Sifat bipolar dicirikan dengan mempunyai dua calon
meristem yaitu meristem akar dan meristem tunas (Purnamaningsih, 2002).
Induksi embriogenesis somatik membutuhkan sekali pemberian hormon dalam
pembentukan struktur bipolar untuk menghasilkan planlet yang sempurna,
sedangkan organogenesis membutuhkan dua kali pemberian hormon untuk
menginduksi organ tunas terlebih dahulu lalu menginduksi organ akar (Chawla,
2002). Dengan memiliki struktur tersebut maka perbanyakan melalui
embriogenesis somatik lebih menguntungkan dibandingkan pembentukan tunas
adventif yang unipolar. Selain struktur yang membedakan, perkembangan embrio
somatik menyerupai embrio zigotik. Secara spesifik tahap perkembangan embrio
somatik dan embrio zigotik memiliki pola yang sama yaitu dimulai dari fase
globular, fase scutellar, dan fase coleoptilar untuk tanaman monokotil atau fase
(Gray, 2005). Kontrol terhadap media dan cara subkultur sangat dibutuhkan dalam
memperoleh perkembangan yang sama pada embrio somatik (Loberant, 1998).
Inisiasi dan perkembangan embrio dari jaringan somatik pertama kali
dilaporkan oleh Steward et al. (1958) dan Reinert (1958, 1959) dalam Chawla
(2002) pada tanaman Daucus carota. Sel somatik wortel akan terdiferensiasi
membentuk embrio ketika ditanam dalam media yang mengandung nutrisi dan zat
pengatur tumbuh yang tepat (Caponetti et al., 2005). Embrio somatik dapat
terbentuk melalui dua jalur yaitu secara langsung maupun tidak langsung
(melewati fase kalus). Keberhasilan akan tercapai apabila kalus atau sel yang akan
digunakan bersifat embriogenik yang dicirikan oleh sel yang berukuran kecil,
sitoplasma padat, inti besar, vakuola kecil dan mengandung butir pati
(Purnamaningsih, 2002). Embrio somatik dapat dihasilkan dalam jumlah besar
dari kultur kalus, namun untuk tujuan perbanyakan dalam skala besar, jumlahnya
kadang-kadang dapat lebih ditingkatkan melalui inisiasi sel embrionik dari kultur
suspensi yang berasal dari kalus primer (Wattimena et al., 1992).
Embriogenesis memiliki beberapa tahap spesifik yaitu induksi sel dan
kalus embriogenik, pendewasaan, perkecambahan, dan hardening atau tahap
aklimatisasi. Pada induksi kalus embriogenik, kultur umumnya ditumbuhkan pada
media yang mengandung auksin yang mempunyai daya aktivitas kuat atau dengan
konsentrasi tinggi. Selain auksin biasanya diberikan sitokinin secara bersamaan.
Tahap pendewasaan merupakan tahap perkembangan dari struktur globular
membentuk kotiledon dan primordia akar. Beberapa hasil penelitian menunjukkan
bahwa tahap pendewasaan merupakan tahap paling sulit. Pada tahap ini sering
digunakan auksin pada konsentrasi rendah (Purnamaningsih, 2002).
Tahap perkecambahan merupakan fase dimana embrio somatik
membentuk tunas dan akar. Pada media perkecambahan, konsentrasi zat pengatur
tumbuh yang digunakan sangat rendah bahkan tidak diberikan sama sekali. Tahap
hardening yaitu tahap aklimatisasi bibit embrio somatik dari kondisi in vitro ke
kondisi in vivo dengan penurunan kelembaban dan peningkatan intensitas cahaya
8
Sumber Eksplan
Embrio somatik biasanya dapat diinisiasi dari jaringan juvenil atau
jaringan meristematik. Eksplan yang digunakan dapat berupa daun muda, ujung
tunas, kotiledon, dan hipokotil. Tetapi respon eksplan sangat tergantung dari
genotip tanaman. Jadi untuk spesies tanaman yang berbeda hanya jaringan tertentu
yang dapat digunakan untuk inisiasi embrio somatik (Gray, 2005).
Kageyama et al. (1991), Oridate dan Oosawa (1986) melaporkan
penggunaan biji tua sebagai sumber eksplan dalam induksi embriogenesis melon.
Dalam penelitiannya, Kageyama, Oridate dan Oosawa berhasil menginduksi
embrio. Ezura dan Oosawa (1994) juga melaporkan, penggunaan embrio aksis
dari biji tua melon sebagai sumber eksplan dalam embriogenesis somatik.
Sedangkan penelitian yang sama dilakukan oleh Tabei et al. (1991) menggunakan
eksplan kotiledon dari biji tua, kotiledon dan hipokotil dari biji yang
dikecambahkan, dan daun serta petiol dari planlet muda dalam induksi
embriogenesis melon.
Penelitian pada tanaman segenus telah banyak dilakukan terutama pada
tanaman mentimun (Cucumis sativus L.). Perbanyakan melalui jalur
organogenesis dan embriogenesis telah banyak dilaporkan. Sumber eksplan yang
digunakan dalam induksi embrio somatik yaitu kotiledon dari biji yang
dikecambahkan secara in vitro (Chee, 1990; Ladyman and Girard, 1992),
hipokotil dari biji yang dikecambahkan secara in vitro (Chee, 1990), dan daun
muda dari biji yang dikecambahkan secara in vitro (Kuijpers et al., 1996). Eksplan
yang masih bersifat meristematik umumnya memberikan keberhasilan
pembentukan embrio somatik yang lebih tinggi (Purnamaningsih, 2002).
Media Tanam
Media tanam merupakan salah satu faktor penentu dalam keberhasilan
kultur jaringan. Komposisi unsur makro dan mikro yang tepat akan memberikan
respon terhadap keberhasilan kultur jaringan. Media kultur jaringan mengandung
95% air, unsur makro dan mikro, zat pengatur tumbuh, vitamin, dan gula (Beyl,
Tipe media yang akan digunakan dalam kultur jaringan tergantung dari
jenis tanaman yang akan digunakan. Beberapa spesies sensitif terhadap
kandungan garam yang terlalu tinggi atau membutuhkan zat pengatur tumbuh
yang berbeda. Perkembangan komposisi media kultur jaringan merupakan hasil
dari penelitian dan percobaan yang sistematik. Media Murashige and Skoog (MS)
merupakan media yang sering digunakan dan cocok dalam regenerasi dari kalus
dan jaringan tanaman (Beyl, 2005). Media MS sering digunakan dalam beberapa
kultur yang berbeda-beda. Dalam media MS terkandung garam N dan K yang
sangat tinggi. Untuk mengurangi sensitivitas garam pada tanaman berkayu, maka
Llyod dan McCown membuat Woody Plant Medium (WPM).
Media Gamborg’s B5 ditemukan untuk kultur kalus kedelai. Media ini
memiliki kandungan N yang lebih sedikit dibandingkan media MS. Media B5
juga digunakan dalam kultur sel dan protoplas (Chawla, 2002). Media B5
sebenarnya dibuat untuk kultur suspensi atau induksi kalus, namum media ini juga
baik sebagai media dasar untuk regenerasi semua tanaman (Beyl, 2005).
Embriogenesis somatik mengalami perkembangan morfologi seperti yang
terjadi pada embrio zigotik. Faktor penting dalam induksi embriogenesis somatik
adalah komposisi nutrisi dalam media kultur. Nitrogen merupakan faktor penentu
dalam memacu morfogenesis secara in vitro. Menurut Ammirato (1983) dalam
Purnamaningsih (2002) bentuk nitrogen reduksi dan beberapa asam amino seperti
glutamin dan kaesin hidrosilat sangat penting untuk inisiasi dan perkembangan
embrio somatik. Inisiasi dan pendewasaan embrio somatik diperlukan
keseimbangan yang tepat antara NH4+ dan NO3-. Konsentrasi NO3- yang terlalu
tinggi akan meningkatkan pH media sehingga kalus tidak dapat membentuk
embrio somatik.
Selain nitrogen, gula merupakan komponen organik yang harus diberikan
ke dalam media kultur. Gula berfungsi disamping sebagai sumber karbon, juga
untuk mempertahankan tekanan osmotik media (Purnamaningsih, 2002).
Zat Pengatur Tumbuh
Zat pengatur tumbuh didefinisikan sebagai senyawa organik bukan nutrisi
10
tertentu dari tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana
zat tersebut menimbulkan tanggapan secara biokimia, fisiologis, dan morfologis
(Wattimena, 1988). Zat pengatur tumbuh yang dihasilkan oleh tanaman disebut
fitohormon sedangkan yang sintetik disebut zat pengatur tumbuh tanaman sintetik.
Dalam induksi embriogenesis jenis zat pengatur tumbuh yang digunakan
bervariasi. Pada umumnya induksi embriogenesis memerlukan auksin dan
sitokinin. Perbandingan kedua zat pengatur tumbuh tersebut yaitu nisbah auksin
sitokinin yang tinggi yaitu konsentrasi auksin dalam media lebih tinggi
dibandingkan konsentrasi sitokinin (Wattimena et al., 1992). Auksin yang paling
sering digunakan untuk mendorong pembentukan embrio somatik yaitu 2.4 D
(Wattimena et al., 1992).
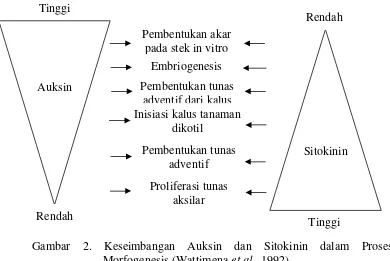
Tinggi
Gambar 2. Keseimbangan Auksin dan Sitokinin dalam Proses Morfogenesis (Wattimena et al., 1992)
Auksin sangat luas digunakan dalam kultur jaringan tanaman yang
dimasukkan ke dalam media tanam. Fungsi utama auksin yaitu untuk merangsang
pemanjangan sel (Evans et al., 2003). Selain itu auksin juga berfungsi untuk
pertumbuhan kalus, suspensi sel, dominan apikal dan pertumbuhan akar
(Wattimena et al., 1992). Namun jika auksin digabung bersama sitokinin dapat
mengatur tipe morfogenesis yang dikehendaki (Gambar 2). Setiap jenis auksin
fisiologi, pergerakan didalam jaringan tanaman, pengikatan didalam sel dan sifat
metabolisme (Wattimena et al., 1992). Penentuan taraf konsentrasi yang
digunakan disesuaikan dengan tipe eksplan, metode kultur jaringan, dan tingkat
kultur jaringan (Wattimena et al., 1992).
Selain 2.4 D jenis auksin yang sering digunakan untuk penelitian in vitro
yaitu picloram. Picloram banyak digunakan untuk induksi kalus (Wattimena et al.,
1992). Namun kekurangan dari jenis auksin ini yaitu kestabilan genetiknya.
Penyimpanan kalus yang lama dalam media yang mengandung picloram akan
menyebabkan meningkatnya keragaman genetik (Wattimena et al., 1992).
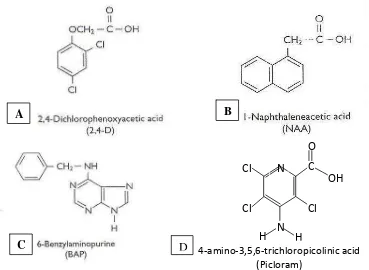
Gambar 3. Struktur Molekul Kimia (A) 2.4 D; (B) NAA; dan (C) BAP (Evans et al., 2003); (D) Picloram (www.alanwood.com)
Sitokinin memiliki peran untuk meningkatkan pertumbuhan dan
perkembangan, menghambat senescence dan bereaksi dengan auksin untuk
mengontrol pertumbuhan (Evans et al., 2003). Zeatin merupakan sitokinin
alamiah yang terdapat dalam tanaman. Biosintesis zeatin terutama di ujung akar
dan dalam biji yang sedang berkembang (Wattimena et al., 1992). Jenis sitokinin
yang sering digunakan dalam kultur jaringan yaitu kinetin, benzylaminopurine
(BAP), zeatin, dan 2iP (Evans et al., 2003). Penggunaan BAP dan kinetin dalam 4‐amino‐3,5,6‐trichloropicolinic acid
12
percobaan kultur jaringan sering digunakan karena lebih murah dan tahan
terhadap degradasi (Wattimena et al., 1992). Gambar 3 menunjukkan struktur
molekul dari zat pengatur tumbuh yang digunakan dalam penelitian.
Kultur Jaringan Melon (Cucumis melo L.)
Penelitian perbanyakan secara in vitro pada tanaman melon telah banyak
dilaporkan. Pada pertengahan tahun 1980 penelitian mengenai embriogenesis
somatik dari kultur suspensi kalus dilaporkan oleh Oridate dan Oosawa (1986).
Penelitian tersebut menggunakan media MS dan kombinasi konsentrasi 2.4 D dan
BA. Penanaman kalus pada media MS ditambahkan 1 mg/L 2.4 D dan 0.1 mg/L
BA menunjukkan respon terbaik untuk embriogenesis. Kageyama et al. (1991)
melaporkan penanaman kotiledon biji tua pada media MS ditambahkan 1 mg/L
2.4 D + 1 mg/L NAA + 0.1 mg/L BA juga berpengaruh terhadap pembentukan
karakteristik embrio somatik.
Tabei et al. (1991) meneliti tentang regulasi auksin untuk organogenesis
dan embriogenesis somatik pada melon (Cucumis melo L.). Hasil penelitian
melaporkan bahwa pembentukan tunas adventif terjadi pada taraf auksin
konsentrasi rendah (0 sampai dengan 0.01 mg/L 2.4 D; 0 sampai dengan 0.1 mg/L
NAA; 0 sampai dengan 1.0 mg/L IAA), dan embrio terbentuk pada taraf auksin
konsentrasi tinggi (1.0 sampai dengan 2.0 mg/L 2.4 D; 3.0 sampai dengan 10.0
mg/L NAA; 20 sampai dengan 100 mg/L IAA). Pemberian IAA lebih efisien
dalam induksi tunas dan embriogenesis dibandingkan auksin lain yang diujikan.
Penelitian tentang ploidi pada melon dilakukan oleh Ezura dan Oosawa
(1994) secara in vitro. Embrio somatik yang dihasilkan bersifat diploid, tetraploid
dan oktoploid. Dari penelitian menunjukkan bahwa kemampuan embrio untuk
berkembang menjadi planlet meningkat dari oktoploid ke tetraploid lalu diploid.
Adelberg dan Rhodes (1994) juga melaporkan tentang pengaruh sumber eksplan
terhadap frekuensi tanaman tetraploid dari perbanyakan secara in vitro pada
melon.
Penggunaan retardan dalam perkembangan tunas secara in vitro dilaporkan
oleh Gaba et al. (1996). Kombinasi ancymidol dan BA menunjukkan
secara terpisah. Kintzios dan Taravira (1997) melaporkan bahwa induksi embrio
somatik dipengaruhi oleh genotip dan intensitas cahaya. Kedua faktor tersebut
berpengaruh nyata terhadap jumlah embrio somatik, pendewasaan embrio, dan
regenerasi planlet. Sehingga jenis perlakuan berbeda disetiap varietas melon.
Penelitian-penelitian lanjutan mengenai kultur jaringan melon terus
dilakukan. Nakagawa et al. (2001) meneliti tentang pengaruh gula dan ABA
terhadap induksi embriogenesis somatik melon dari kotiledon. Sukrosa dapat
menginduksi embrio somatik sedangkan manitol tidak dapat menginduksi
terbentuknya embrio somatik. Embrio somatik tertinggi diperoleh dari perlakuan
0.5 μM ABA ditambah 200 mM sukrosa. Rhimi et al. (2006) melaporkan
penggunaan kombinasi 2.4 D (0.25 mg/L sampai 1.0 mg/L) dan BA (0.10 mg/L
sampai 0.50 mg/L) dalam induksi embriogenesis somatik pada dua melon
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di laboratorium kultur jaringan Departemen
Agronomi dan Hortikultura IPB Darmaga. Penelitian berlangsung dari bulan April
sampai dengan September 2009.
Bahan dan Alat
Bahan yang digunakan dalam penelitian meliputi beberapa jenis media
yaitu media MS (Murashige and Skoog), media B5 (Gamborg B5), dan media
WPM (Woody Plant Medium). Zat pengatur tumbuh yang digunakan meliputi
jenis auksin (2.4 D, picloram, dan NAA) dan jenis sitokinin berupa BAP. Sumber
eksplan menggunakan melon H7 koleksi Pusat Kajian Buah-Buahan Tropika
Institut Pertanian Bogor. Eksplan yang digunakan berupa biji muda yang berasal
dari buah berumur 15 hari setelah penyerbukan dan hipokotil yang berasal dari
biji tua yang telah dikecambahkan. Bahan lain yang digunakan meliputi agar,
gula, bakterisida, fungisida, aquades steril, karet, plastik, alkohol 70%, alkohol
96%, klorox, betadin dan deterjen.
Alat yang digunakan adalah autoclave, botol kultur, gelas piala, erlemeyer,
timbangan, cawan petri, gelas ukur, corong plastik, pH meter, laminar air flow
cabinet, pinset, gunting, scalpel, lampu spirtus, botol sprayer, dan rak kultur.
Metode Penelitian
Penelitian dilaksanakan dengan 2 percobaan. Masing-masing percobaan
dilakukan terpisah.
Percobaan I
Penelitian dilaksanakan dengan menggunakan Rancangan faktorial yang
disusun dalam Rancangan Acak Kelompok (RAK). Penelitian terdiri dari dua
faktor yaitu faktor pertama media tanam terdiri dari tiga taraf yaitu MS, WPM,
dan B5. Konsentrasi picloram sebagai faktor kedua terdiri dari empat taraf yaitu 0,
terdapat 5 botol. Setiap botol terdapat 5 eksplan. Penanaman dilakukan selama 3
hari. Kombinasi media dan picloram yang digunakan adalah sebagai berikut:
Tabel 1. Kombinasi Media dan Konsentrasi Picloram
Media Konsentrasi Picloram (mg/L)
0 0.5 1.0 1.5
MS M1 M2 M3 M4
B5 B1 B2 B3 B4
WPM W1 W2 W3 W4
Model rancangan percobaan yang digunakan dalam penelitian adalah
( )
ij k ijkj = perlakuan taraf konsentrasi picloram
k = 1, 2, 3 (ulangan)
Dimana :
= respon perlakuan
= nilai tengah
= pengaruh perlakuan media tanam
= pengaruh perlakuan taraf konsentrasi picloram
( )
αβ ij = interaksi antara dua faktor perlakuank
δ = pengaruh ulangan ke-k = pengaruh galat percobaan
Data hasil pengamatan dianalisis dengan uji-F. Jika uji-F nyata dilanjutkan
dengan uji DMRT pada taraf 5%.
Percobaan II
Penelitian dilaksanakan dengan menggunakan Rancangan faktorial yang
disusun dalam Rancangan Acak Kelompok (RAK). Penelitian terdiri dari dua
faktor yaitu faktor pertama taraf konsentrasi auksin (2.4 D dan NAA)
masing-masing terdiri dari enam taraf yaitu 0, 1, 2, 3, 4, 5 mg/L. Konsentrasi BAP sebagai
16
dengan 3 ulangan dan setiap ulangan terdapat 3 botol. Setiap botol terdapat 5
eksplan. Penanaman dilakukan selama 3 hari. Kombinasi perlakuan adalah
sebagai berikut:
Tabel 2. Kombinasi Auksin (2.4 D dan NAA) dan BAP
Auksin (mg/L) BAP (mg/L)
Model rancangan percobaan yang digunakan dalam penelitian adalah
( )
ij k ijkj i ijk
Y =μ+α +β + αβ +δ +ε
i = perlakuan taraf konsentrasi 2.4 D dan NAA
j = perlakuan taraf konsentrasi BAP
k = 1, 2, 3 (ulangan)
Dimana :
= respon perlakuan
= nilai tengah
= pengaruh perlakuan taraf konsentrasi 2.4 D dan NAA
= pengaruh perlakuan taraf konsentrasi BAP
( )
αβ ij = interaksi antara dua faktor perlakuank
δ = pengaruh ulangan ke-k = pengaruh galat percobaan
Data hasil pengamatan dianalisis dengan uji-F. Jika uji-F nyata dilanjutkan
Pelaksanaan Penelitian
Sterilisasi Alat
Alat yang digunakan dalam penelitian berupa botol kultur, pinset, scalpel,
cawan petri, dan pisau. Alat dicuci menggunakan sabun sampai bersih lalu
dikeringkan. Setelah itu alat diautoklaf pada suhu 1210C dengan tekanan 1.1
kgcm2 selama 1 jam.
Pembuatan Larutan Stok
Pembuatan larutan stok bertujuan untuk memudahkan dalam pembuatan
media. Larutan stok dibuat berdasarkan komposisi pada masing-masing media.
Komposisi media MS (lampiran 1), Woody Plant Medium (WPM) (lampiran 2),
dan media B5 (lampiran 3). Pembuatan larutan stok selain Fe dimulai dengan
penimbangan bahan kimia sesuai dengan bobot per liter larutan stok yang akan
dibuat. Setelah itu bahan kimia dilarutkan dengan aquades steril sampai larut.
Setelah larut, larutan dimasukkan ke dalam labu takar lalu ditera sampai tanda
tera. Sedangkan pembuatan larutan stok Fe dimulai dengan penimbangan lalu
FeSO4.7H2O dan Na2EDTA dilarutkan masing-masing dengan aquades steril.
Setelah larut, Na2EDTA dipanaskan di atas panci yang berisi air sampai berubah
warna menjadi kuning dan semua bahan larut. Setelah berubah warna, larutan
FeSO4.7H2O dimasukkan ke dalam larutan Na2EDTA sampai tercampur.
Pemanasan hanya dilakukan sampai terjadi perubahan warna menjadi kuning
namun tidak sampai mendidih. Penyimpanan larutan stok dimasukkan ke dalam
botol reagen dan disimpan pada suhu kamar atau suhu ruang kultur.
Pembuatan larutan stok zat pengatur tumbuh tergantung dari sifat zat
pengatur tumbuh tersebut. Golongan auksin (picloram, 2.4 D dan NAA)
merupakan zat pengatur tumbuh yang memiliki sifat asam sehingga perlu
dilarutkan terlebih dahulu dengan KOH atau NaOH 1 N. Sedangkan sitokinin
(BAP) memiliki sifat basa sehingga perlu ditambahkan HCl untuk melarutkannya.
Pembuatan larutan stok zat pengatur tumbuh tergantung dari konsentrasi yang
akan dibuat. Setelah bahan kimia ditimbang ditambahkan KOH atau HCl beberapa
18
ditera dengan aquades steril sampai tanda tera. Penyimpanan larutan stok zat
pengatur tumbuh disimpan di dalam lemari es untuk menjaga agar tidak rusak.
Pembuatan Media
Pembuatan media dilakukan dengan mengambil larutan dari setiap larutan
stok media yang telah dibuat sesuai dengan volume yang diambil. Setelah semua
larutan dimasukkan ke dalam labu takar ditambahkan gula yang telah dilarutkan
dengan konsentrasi 30 g/L. Lalu ditera sampai tanda tera dengan aquades. Setelah
itu dilakukan pengukuran pH dengan kertas pH indikator sampai pH media 6.
Larutan media yang telah diukur pH dimasukkan kedalam panci lalu ditambahkan
agar dengan konsentrasi 7 g/L dan dimasak sampai mendidih agar semua bahan
tercampur. Larutan media lalu dimasukkan ke dalam botol kultur sekitar 25 ml per
botol. Lalu botol ditutup dengan plastik dan diikat dengan karet gelang. Semua
media diautoklaf pada suhu 1210C, tekanan 1.1 kgcm2 selama 25 - 30 menit.
Media yang telah dibuat disimpan didalam ruang kultur.
Penanaman Percobaan I
Bahan tanam yang digunakan dalam percobaan I yaitu biji muda melon
hibrida H7 koleksi Pusat Kajian Buah-Buahan Tropika IPB. Biji berasal dari buah
muda berumur 15 hari setelah penyerbukan. Buah (Gambar 4A) dicuci bersih
dengan sikat dibawah air mengalir lalu direndam dengan larutan fungisida dan
bakterisida dengan konsentrasi masing-masing 2 g/L selama 12 jam. Buah dibilas
dengan air steril lalu direndam dengan larutan klorox 25% selama 20 menit. Buah
dibilas dengan air steril lalu dibelah dan dipisahkan biji dari daging buah. Biji
(Gambar 4B) disterilisasi dengan klorox 10% selama 15 menit. Biji dibilas dengan
air steril sebanyak dua kali yang dicampur dengan 5 tetes betadin pada bilasan
terakhir. Setelah itu biji ditanam dalam media kultur. Biji yang telah ditanam
disimpam dalam ruang gelap dengan suhu 200C. Pengamatan dilakukan 4 hari
sekali agar tidak tertinggal fase perkembangan embrio dari globular, hati, torpedo
B A
Gambar 4. (A) Buah Muda Berumur ±15 Hari Setelah Penyerbukan. (B) Biji Muda yang Telah Dibersihkan
Penanaman Percobaan II
Bahan tanam yang digunakan dalam percobaan II yaitu biji tua yang
berasal dari melon hibrida H7 koleksi Pusat Kajian Buah-Buahan Tropika IPB.
Sumber eksplan yang digunakan yaitu hipokotil yang berasal dari biji yang
dikecambahkan secara in vitro. Biji melon direndam dengan air steril selama 12
jam. Biji yang telah direndam dimasukkan kedalam larutan klorox 10% selama 10
menit lalu dibilas 2 kali menggunakan air steril. Setelah itu biji direndam dengan
larutan klorox 5% selama 5 menit dan dibilas dengan air steril sebanyak 2 kali.
Lalu biji melon dikecambahkan dengan media MS selama 15 hari di dalam ruang
gelap. Biji yang telah berkecambah (Gambar 5), hipokotil dipotong sepanjang ±1
cm lalu ditanam di dalam media perlakuan. Hipokotil yang telah ditanam
disimpan dalam ruang gelap dengan suhu 200C dan dilakukan pengamatan 3 hari
sekali.
20
Pengamatan
Metode pengamatan yang dilakukan yaitu pengamatan langsung terhadap
kultur. Faktor-faktor yang diamati dalam penelitian meliputi:
1. Persentase kultur yang kontaminasi
2. Persentase kultur yang membentuk embrio somatik
3. Persentase kultur yang membentuk kalus
4. Waktu munculnya embrio somatik
5. Persentase kultur berakar dan bertunas
Pengamatan dilakukan terhadap semua eksplan. Eksplan diamati satu per
satu dan dicatat sesuai dengan respon yang muncul. Data setiap perlakuan
diperoleh dari data rata-rata tiap botol. Rata-rata tiap botol diperoleh dengan cara
membagi eksplan yang memberikan respon dengan jumlah total eksplan per botol.
Data setiap ulangan diperoleh dengan menambahkan hasil rata-rata tiap botol
dibagi dengan jumlah total botol tiap ulangan. Jika terdapat botol hilang
disebabkan kontaminasi ataupun hal lain maka data ulangan diperoleh dengan
menambahkan hasil rata-rata tiap botol dibagi dengan jumlah botol yang masih
Percobaan I
Kondisi Umum
Penanaman biji melon muda dilakukan pada tanggal 27, 28, dan 29 April
2009. Kontaminasi awal terjadi disebabkan oleh cendawan dan muncul setelah 3
hari penanaman. Kontaminasi cendawan diduga disebabkan oleh kurang panasnya
botol saat dilakukan penanaman. Persentase kontaminasi pada percobaan I sebesar
2.78%. Respon awal yang muncul dalam percobaan I yaitu biji mulai
berkecambah. Hal ini diduga karena biji muda yang ditanam hampir membentuk
biji sempurna yang dicirikan dengan mulai kerasnya kulit biji.
Perkembangan eksplan yang terjadi yaitu sebagian besar biji berkecambah.
Biji yang tidak berkecambah membentuk kalus pada bagian biji yang disayat.
Sedangkan biji yang telah berkecambah membentuk kalus pada bagian akar dan
kotiledon yang menempel pada media. Pada umumnya setelah terbentuk fase
kalus tahap awal, kalus mengalami pembesaran lalu berhenti perkembangannya.
Kalus awal berwarna kuning dan berubah menjadi coklat setelah tidak mengalami
perkembangan lagi. Setelah tahap ini tidak terjadi perubahan pada eksplan.
Persentase Biji Berkalus
Perlakuan jenis media dengan empat taraf konsentrasi picloram tidak
menunjukkan adanya interaksi. Pembentukan kalus tidak dipengaruhi oleh
interaksi perlakuan jenis media dan taraf konsentrasi picloram. Tabel 3
menunjukkan bahwa taraf konsentrasi picloram berbeda nyata dalam
pembentukan kalus mulai dari 32 HST sampai akhir pengamatan. Sedangkan jenis
22
Tabel 3. Rekapitulasi Sidik Ragam Persentase Biji Berkalus
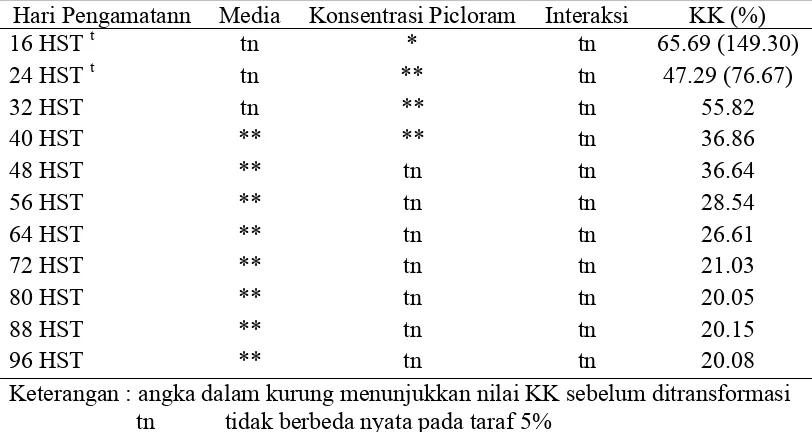
Hari Pengamatan Media Konsentrasi Picloram Interaksi KK (%)
16 HST t tn tn tn 50.70 (313.34)
Keterangan : angka dalam kurung menunjukkan nilai KK sebelum ditransformasi tn tidak berbeda nyata pada taraf 5%
* berbeda nyata pada taraf 5%
** berbeda sangat nyata pada taraf 5% t data ditransformasi dengan rumus x+0.5
Taraf konsentrasi picloram berpengaruh nyata terhadap persentase biji
berkalus. Berdasarkan hasil pengamatan yang disajikan dalam Tabel 4, pada saat
eksplan berumur 96 HST (Hari Setelah Tanam), rata-rata persentase biji berkalus
pada perlakuan taraf konsentrasi picloram 0.5 mg/L memberikan hasil tertinggi
yaitu 97.78%, namun tidak berbeda nyata dengan perlakuan taraf konsentrasi 1.0
mg/L dan 1.5 mg/L yaitu 94.44% dan 92.41%.
Tabel 4. Pengaruh Taraf Konsentrasi Picloram terhadap Rata-Rata Persentase Biji Berkalus
Taraf Picloram
Waktu Pengamatan HST (Hari Setelah Tanam) 32 HST t 48 HST 64 HST 80 HST 96 HST 0 mg/L 11.11 ab 25.00 c 30.83 b 33.75 b 35.56 b 0.5 mg/L 17.78 a 68.89 a 90.56 a 96.11 a 97.78 a 1.0 mg/L 10.56 ab 67.22 a 86.67 a 91.67 a 94.44 a 1.5 mg/L 3.89 b 47.41 b 74.63 a 89.07 a 92.41 a Keterangan : Tanda huruf yang sama pada kolom yang sama menunjukkan tidak
berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) 5%
t
Picloram merupakan jenis auksin yang memiliki fungsi utama untuk
merangsang pemanjangan sel (Evans et al., 2003). Selain itu auksin juga berfungsi
untuk pembentukan kalus, dominan apikal, dan pertumbuhan akar (Wattimena et
al., 1992). Pemberian picloram dalam dosis rendah sudah mampu menginduksi
terbentuknya kalus. Sehingga penggunaan dosis tinggi tidak diperlukan jika ingin
menginduksi kalus.
Purba (2009) melaporkan pemberian picloram secara tunggal yang tidak
dikombinasikan dengan sitokinin pada konsentrasi 0.5 mg/L dan 1.0 mg/L mampu
menginduksi embrio somatik pada tanaman manggis. Pada induksi kalus
embriogenik kultur umumnya ditumbuhkan pada media yang mengandung auksin
yang mempunyai daya aktivitas kuat atau dengan konsentrasi tinggi
(Purnamaningsih, 2002). Namun dalam penelitian ini embrio tidak terbentuk,
hanya terbentuk kalus dan tidak mengalami perkembangan lagi. Kalus yang
terbentuk disajikan dalam Gambar 6.
A B
Gambar 6. Biji Berkalus: (A) Perlakuan Media MS + 0 mg/L Picloram saat 56 HST; (B) Perlakuan Media B5 + 0.5 mg/L Picloram saat 56 HST
Persentase Biji Berkecambah
Kombinasi jenis media dan taraf konsentrasi picloram tidak memberikan
interaksi terhadap persentase biji berkecambah. Tabel 5 menunjukkan bahwa jenis
media berpengaruh nyata terhadap persentase biji berkecambah mulai 40 HST
sampai akhir pengamatan. Sedangkan taraf konsentrasi picloram tidak
24
Tabel 5. Rekapitulasi Sidik Ragam Persentase Biji Berkecambah
Hari Pengamatann Media Konsentrasi Picloram Interaksi KK (%)
16 HST t tn * tn 65.69 (149.30)
Keterangan : angka dalam kurung menunjukkan nilai KK sebelum ditransformasi tn tidak berbeda nyata pada taraf 5%
* berbeda nyata pada taraf 5%
** berbeda sangat nyata pada taraf 5% t data ditransformasi dengan rumus x+0.5
Jenis media memberikan pengaruh nyata terhadap rata-rata persentase biji
berkecambah. Tabel 6 menunjukkan bahwa media B5 memberikan respon terbaik
terhadap rata-rata persentase biji berkecambah sebesar 89.17%. Perlakuan media
B5 berbeda nyata dengan media WPM dan MS yang hanya memberikan hasil
rata-rata persentase biji berkecambah sebesar 70.14% dan 57.50%.
Tabel 6. Pengaruh Jenis Media terhadap Rata-Rata Persentase Biji Berkecambah
Jenis Media Waktu Pengamatan HST (Hari Setelah Tanam) 32 HST 48 HST 64 HST 80 HST 96 HST MS 13.75 24.58 b 37.50 c 50.83 c 57.50 c B5 22.92 50.42 a 67.92 a 84.17 a 89.17 a WPM 14.48 33.61 b 49.69 b 64.86 b 70.14 b Keterangan : Tanda huruf yang sama pada kolom yang sama menunjukkan tidak
berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) 5%
Nitrogen merupakan faktor utama dalam memacu morfogenesis secara in
vitro (Purnamaningsih, 2002). Ketersedian unsur nitrogen di dalam media
disediakan dalam bentuk ion NO3- dan NH4+ (Beyl, 2005). Pemberian nitrogen
media B5 kandungan nitrogren dalam bentuk KNO3 yang tinggi diduga
mempengaruhi persentase biji berkecambah (Lampiran 1-3). Biji yang
berkecambah ditunjukkan pada Gambar 7.
Biji berkecambah tidak diharapkan dalam induksi embrio somatik. Jika biji
berkecambah maka akan menghambat terbentuknya embrio somatik dari eksplan
biji muda. Sehingga media terbaik yang digunakan untuk induksi embrio somatik
yaitu MS.
A B
Gambar 7. Biji Berkecambah: (A) Perlakuan Media B5 + 0 mg/L Picloram saat 52 HST; (B) Perlakuan Media MS + 0.5 mg/L Picloram saat 52 HST
Percobaan II
Kondisi Umum
Percobaan II dilakukan penanaman pada tanggal 1, 2, dan 3 Juli 2009.
Sumber eksplan yang digunakan yaitu hipokotil yang berasal dari biji tua yang
dikecambahkan secara in vitro selama ±15 hari menggunakan media MS0. Biji
yang dikecambahkan disimpan di ruang gelap. Pada 3 HST mulai terjadi
kontaminasi cendawan yang diduga disebabkan kurang panasnya botol dan kurang
ketelitian dalam menanam. Persentase kontaminasi sebesar 1.52%.
Hipokotil yang telah dimasukkan ke dalam media perlakuan sebagian
besar mengalami pembentukan kalus terlebih dahulu. Kalus yang terbentuk
dicirikan dengan mulai membengkaknya hipokotil. Awal pembentukan kalus
26
Setelah itu hipokotil sebagian pecah dan terbentuk kalus yang semakin besar dan
sebagian tidak pecah dan terbentuk kalus di atas hipokotil. Pada sebagian
perlakuan terbentuk kalus berwarna kuning sedangkan pada sebagian perlakuan
kalus pecah dan muncul akar. Perkembangan kalus sangat bervariasi tergantung
dari media perlakuan. Secara umum hipokotil yang ditanam pada media yang
mengandung 2.4 D dan 2.4 D + BAP membentuk kalus berwarna kuning dan
kompak. Hipokotil yang ditanam pada media yang mengandung NAA membentuk
kalus kompak berwarna kuning keputihan dan muncul akar pada bagian kalus.
Sedangkan hipokotil yang ditanam dalam media yang mengandung NAA + BAP
membentuk kalus remah berwarna putih dan berbentuk bulatan-bulatan yang tidak
halus.
Jumlah Embrio Somatik dan Jumlah Eksplan yang Menghasilkan Embrio Somatik
Pembentukan embrio somatik diawali dengan pembentukan kalus
embriogenik terlebih dahulu. Kalus embriogenik akan mengalami perkembangan
membentuk embrio atau tidak mengalami perkembangan lagi. Kalus embriogenik
yang membentuk embrio dimulai dengan fase globular, hati, torpedo, dan planlet
(Gray, 2005). Fase globular yang merupakan fase awal pembentukan embrio tidak
dapat diamati secara langsung dalam penelitian ini. Fase embrio yang dapat
diamati yaitu pada saat fase hati yang telah memiliki struktur yang lebih jelas.
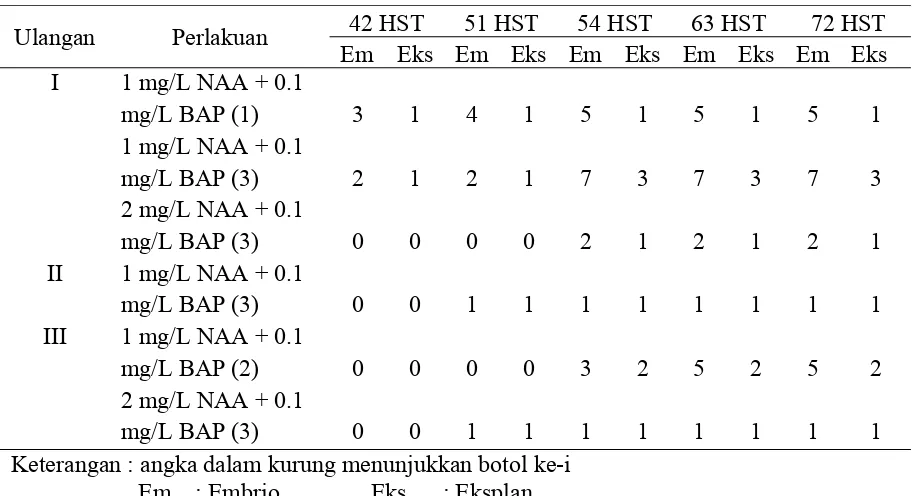
Embrio somatik dapat diinduksi setelah 42 HST (Hari Setelah Tanam). Tabel 7
menunjukkan bahwa pada saat 42 HST masih sedikit embrio yang dapat diinduksi
yaitu sebanyak 5 embrio. Namum jumlah embrio yang diinduksi mengalami
Tabel 7. Waktu Muncul Embrio Somatik, Jumlah Embrio Somatik, dan Jumlah Eksplan yang Menghasilkan Embrio Somatik
Ulangan Perlakuan 42 HST 51 HST 54 HST 63 HST 72 HST Keterangan : angka dalam kurung menunjukkan botol ke-i
Em : Embrio Eks : Eksplan
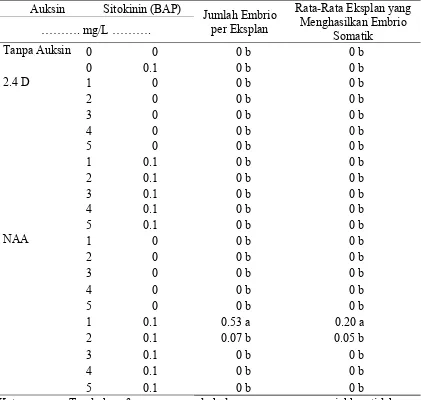
Perlakuan taraf konsentrasi auksin (2.4 D dan NAA) dengan taraf
konsentrasi BAP memberikan interaksi terhadap pembentukan embrio somatik
per eksplan dan rata-rata eksplan yang menghasilkan embrio somatik.
Rekapitulasi sidik ragam disajikan dalam Tabel 8 berikut:
Tabel 8. Rekapitulasi Sidik Ragam Jumlah Embrio Somatik per Eksplan dan Rata-Rata Jumlah Eksplan yang Menghasilkan Embrio Somatik saat 72 HST
Peubah Auksin BAP Interaksi KK (%)
∑ embrio somatik per eksplan t ** tn ** 8.41 (463.15) Rata-rata ∑ eksplan yang menghasilkan
embrio somatik t ** * **
3.15 (340.69) Keterangan : angka dalam kurung menunjukkan nilai KK sebelum ditransformasi
tn tidak berbeda nyata pada taraf 5% * berbeda nyata pada taraf 5%
** berbeda sangat nyata pada taraf 5% t data ditransformasi dengan rumus x+0.5
Penggunaan NAA yang dikombinasikan dengan BAP berpengaruh nyata
28
menginduksi embrio somatik yaitu kombinasi 1 mg/L NAA + 0.1 mg/L BAP dan
kombinasi 2 mg/L NAA + 0.1 mg/L BAP. Perlakuan 1 mg/L NAA + 0.1 mg/L
BAP memberikan hasil tertinggi dibandingkan dengan perlakuan 2 mg/L NAA +
0.1 mg/L BAP dan perlakuan lainnya. Embrio somatik yang terbentuk pada
perlakuan 1 mg/L NAA + 0.1 mg/L BAP sebesar 0.53 embrio per eksplan.
Sedangkan perlakuan 2 mg/L NAA + 0.1 mg/L BAP hanya menghasilkan 0.07
embrio per eksplan. Jumlah embrio somatik total yang dapat diinduksi sebanyak
21 embrio dari 975 eksplan yang ditanam. Embrio somatik yang terbentuk
disajikan dalam Gambar 8.
Gambar 8. Embrio Somatik yang Terbentuk pada Perlakuan 1 mg/L NAA + 0.1 mg/L BAP
Kombinasi perlakuan NAA dan BAP juga berpengaruh nyata terhadap
rata-rata jumlah eksplan yang menghasilkan embrio somatik. Tabel 9
menunjukkan bahwa perlakuan 1 mg/L NAA + 0.1 mg/L BAP memberikan hasil
tertinggi sebesar 0.2 eksplan dan berbeda nyata terhadap perlakuan 2 mg/L NAA
+ 0.1 mg/L BAP yang hanya menghasilkan 0.05 eksplan. Jumlah eksplan yang
menghasilkan embrio somatik sebanyak 9 eksplan dari 975 eksplan yang ditanam.
A B
Gambar 9. Eksplan yang Menghasilkan Embrio: (A) Perlakuan 1 mg/L NAA + 0.1 mg/L BAP saat 52 HST; (B) Perlakuan 2 mg/L NAA + 0.1 mg/L BAP saat 56 HST
Tabel 9. Pengaruh Taraf Konsentrasi Auksin (2.4 D dan NAA) dan BAP terhadap Jumlah Embrio Somatik per Eksplan dan Rata-Rata Eksplan yang Menghasilkan Embrio Somatik saat 72 HST
Auksin Sitokinin (BAP) Jumlah Embrio
per Eksplan