INDUKSI EMBRIO SOMATIK MELON (
Cucumis melo
L.)
PADA BERBAGAI MEDIA DAN ZAT PENGATUR TUMBUH
OLEH
FENI SUKMAWATI A24052279
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Feni Sukmawati
A24052279
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
Feni Sukmawati. Induksi Embrio Somatik Melon (Cucumis melo L.) pada
berbagai Media dan Zat Pengatur Tumbuh. (Dibimbing oleh DARDA EFENDI).
Penelitian ini dilakukan untuk mengetahui pengaruh media kultur dan jenis Zat Pengatur Tumbuh (ZPT) yang tepat untuk pembentukan embrio somatik melon dalam kultur in vitro yang dilaksanakan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penelitian ini terdiri dari 2 percobaan. Pada percobaan 1 eksplan yang digunakan adalah biji melon muda yang berasal dari buah melon hibrida (H-7) yang berumur 15 hari setelah penyerbukan. Biji melon muda ditanam pada 3 jenis media kultur yaitu: MS, B5, dan WPM yang ditambahkan auksin 2,4-Dichloropenoxyacetic acid. Percobaan 1 bertujuan untuk mengetahui jenis media kultur dan konsentrasi 2,4-D yang tepat untuk menginduksi embrio somatik melon. Pada percobaan 2 eksplan yang digunakan adalah kotiledon yang berasal dari biji melon tua H-7. Kotiledon ditanam pada media MS dan diberikan perlakuan kombinasi auksin (2,4-D, picloram, dan NAA) dengan BAP. Tujuan dari percobaan 2 yaitu untuk mengetahui jenis serta konsentrasi auksin dan sitokinin yang tepat untuk menginduksi embrio somatik melon.
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak kelompok 2 faktor. Pada percobaan 1 faktor pertama adalah jenis media kultur yang terdiri dari 3 jenis yaitu: media MS, B5, WPM, dan faktor kedua adalah konsentrasi 2,4-D yang terdiri dari 4 taraf yaitu: 0 mg/l, 0.5 mg/l, 1.0 mg/l, serta 1.5 mg/l. Terdapat 12 kombinasi perlakuan dan setiap perlakuan diulang 3 kali berdasarkan hari penanaman sehingga diperoleh 36 satuan percobaan. Setiap satuan percobaan terdiri dari 5 botol dan 1 botol terdiri dari 4 eksplan.
adalah konsentrasi BAP yang terdiri dari 2 taraf yaitu: 0 dan 0.1 mg/l. Terdapat 14 kombinasi perlakuan dan setiap perlakuan diulang 3 kali berdasarkan hari penanaman sehingga diperoleh 42 satuan percobaan. Setiap satuan percobaan terdiri dari 5 botol dan 1 botol terdiri dari 4 eksplan.
Data pengamatan dianalisis dengan menggunakan uji F, jika terdapat pengaruh yang nyata, maka dilanjutkan dengan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf 5%. Pengolahan data dilakukan dengan perangkat lunak Statistical Analysis System (SAS).
LEMBAR PENGESAHAN
Judul : INDUKSI EMBRIO SOMATIK MELON (Cucumis melo L.) PADA
BERBAGAI MEDIA DAN ZAT PENGATUR TUMBUH Nama : Feni Sukmawati
NRP : A24052279
Menyetujui, Dosen Pembimbing
Dr Ir Darda Efendi, MSi. NIP : 19630616 198903 1 006
Mengetahui.
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr Ir Agus Purwito, MSc. Agr. NIP : 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 7 Februari 1988. Penulis merupakan anak keempat dari Bapak Ir H Elyas dan Ibu Hj Maryati. Tahun 1993 penulis lulus dari TK Margalaksana, Jakarta Timur, kemudian pada tahun 1999 penulis lulus dari SD Malaka Sari 04 Pagi, Jakarta Timur. Penulis menyelesaikan studi di SLTPN 139, Jakarta Timur pada tahun 2002 dan lulus dari SMAN 44, Jakarta Timur pada tahun 2005.
Tahun 2005 penulis diterima sebagai mahasiswa IPB melalui jalur USMI. Selanjutnya diterima sebagai mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberi kekuatan, kesehatan, dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Induksi Embrio Somatik Melon (Cucumis melo L.) pada Berbagai Media dan Zat Pengatur Tumbuh (ZPT)”.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih kepada : 1. Dr. Ir. Darda Efendi, MSi selaku dosen pembimbing skripsi yang telah
memberikan waktu dan membimbing penulis dengan sangat sabarnya serta memberikan arahan dan saran selama penelitian dan penulisan skripsi ini. 2. Dr. Ir. Sandra Arifin A., MS. dan Dr. Dewi Sukma, SP. MS. Yang telah
bersedia menjadi dosen penguji. Terima kasih atas saran dan nasehat yang diberikan kepada penulis sewaktu ujian skripsi.
3. Dr. Ir. Munif Ghulamahdi selaku pembimbing akademik penulis.
4. Seluruh keluarga atas dukungan dan perhatiannya. Penulis sangat bersyukur berada dalam keluarga ini.
5. Seluruh staf pengajar di Departemen Agronomi dan Hortikultura yang sudah membagikan ilmu kepada kami.
6. Willy Bayuardi Suwarno, SP. MSi., terima kasih atas bantuan benih melon hibrida H7 yang telah diberikan. Semoga hasil penelitian ini dapat berguna bagi yang memerlukan.
7. Rekan sepenelitian di laboratorium, Hafith Furqoni dan Dendih Sukmadijaya. Terima kasih atas kebersamaan dan bantuannya dalam melaksanakan penelitian.
8. Rekan-rekan Agronomi dan Hortikultura 42 yang penulis banggakan, mohon maaf tidak bisa penulis sebutkan satu-persatu. Terima kasih atas dukungan dan semangat yang diberikan serta kebersamaan yang sudah kita lewati dalam masa susah dan senang.
9. Mba retno atas bimbingan dan bantuannya selama penulis melaksanakan penelitian di laboratorium.
11.Serta seluruh pihak yang telah membantu penulis dalam penulisan skripsi ini. Terima kasih atas saran dan kritiknya.
Bogor, Januari 2010
DAFTAR ISI
Halaman
PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
Hipotesis 3
TINJAUAN PUSTAKA 5
Botani Melon 5
Kultur Jaringan 6
Eksplan 7
Media Kultur 8
Embriogenesis Somatik 9
Zat Pengatur Tumbuh 10
BAHAN DAN METODE 13
Tempat dan Waktu Penelitian 13
Bahan dan Alat 13
Metode Penelitian 13
Pelaksanaan Penelitian 15
HASIL DAN PEMBAHASAN 20
Kondisi Umum Penelitian 20
Percobaan 1 21
Kondisi Umum 21
Persentase Biji Berkecambah 22 Persentase Biji Berkalus 24
Percobaan 2 27
Kondisi Umum 27
Kalus Embriogenik 29
Jumlah Eksplan yang Menghasilkan Embrio Somatik dan
Jumlah Embrio Somatik 31
Persentase Kotiledon Berakar 34
KESIMPULAN DAN SARAN 38
Kesimpulan 38
Saran 38
DAFTAR PUSTAKA 39
DAFTAR TABEL
Nomor Teks Halaman
1. Rekapitulasi Sidik Ragam Persentase Biji Berkecambah 22
2. Pengaruh Jenis Media Terhadap Rata-rata Persentase Biji
Berkecambah 23
3. Rekapitulasi Sidik Ragam Persentase Biji Berkalus 25
4. Pengaruh Jenis Media Terhadap Rata-rata Persentase Biji Berkalus 25
5. Rekapitulasi Sidik Ragam Persentase Eksplan yang Menghasilkan Kalus Embriogenik 29
6. Interaksi Taraf Auksin (2,4-D, picloram, dan NAA) dengan BAP
Terhadap Persentase Eksplan yang Menghasilkan Kalus Embriogenik 30
7. Rekapitulasi Sidik Ragam Jumlah Embrio per Eksplan dan Jumlah
Eksplan yang Menghasilkan Embrio pada 42 HST 31
8. Interaksi Taraf Konsentrasi Auksin dan BAP Terhadap Jumlah
Eksplan yang Menghasilkan Embrio pada 42 HST 32
9. Pengaruh Jenis dan Konsentrasi Auksin Terhadap Jumlah Embrio per Eksplan 34
10.Rekapitulasi Sidik Ragam Persentase Kotiledon Berakar 35
INDUKSI EMBRIO SOMATIK MELON (
Cucumis melo
L.)
PADA BERBAGAI MEDIA DAN ZAT PENGATUR TUMBUH
OLEH
FENI SUKMAWATI A24052279
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Feni Sukmawati
A24052279
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
Feni Sukmawati. Induksi Embrio Somatik Melon (Cucumis melo L.) pada
berbagai Media dan Zat Pengatur Tumbuh. (Dibimbing oleh DARDA EFENDI).
Penelitian ini dilakukan untuk mengetahui pengaruh media kultur dan jenis Zat Pengatur Tumbuh (ZPT) yang tepat untuk pembentukan embrio somatik melon dalam kultur in vitro yang dilaksanakan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penelitian ini terdiri dari 2 percobaan. Pada percobaan 1 eksplan yang digunakan adalah biji melon muda yang berasal dari buah melon hibrida (H-7) yang berumur 15 hari setelah penyerbukan. Biji melon muda ditanam pada 3 jenis media kultur yaitu: MS, B5, dan WPM yang ditambahkan auksin 2,4-Dichloropenoxyacetic acid. Percobaan 1 bertujuan untuk mengetahui jenis media kultur dan konsentrasi 2,4-D yang tepat untuk menginduksi embrio somatik melon. Pada percobaan 2 eksplan yang digunakan adalah kotiledon yang berasal dari biji melon tua H-7. Kotiledon ditanam pada media MS dan diberikan perlakuan kombinasi auksin (2,4-D, picloram, dan NAA) dengan BAP. Tujuan dari percobaan 2 yaitu untuk mengetahui jenis serta konsentrasi auksin dan sitokinin yang tepat untuk menginduksi embrio somatik melon.
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak kelompok 2 faktor. Pada percobaan 1 faktor pertama adalah jenis media kultur yang terdiri dari 3 jenis yaitu: media MS, B5, WPM, dan faktor kedua adalah konsentrasi 2,4-D yang terdiri dari 4 taraf yaitu: 0 mg/l, 0.5 mg/l, 1.0 mg/l, serta 1.5 mg/l. Terdapat 12 kombinasi perlakuan dan setiap perlakuan diulang 3 kali berdasarkan hari penanaman sehingga diperoleh 36 satuan percobaan. Setiap satuan percobaan terdiri dari 5 botol dan 1 botol terdiri dari 4 eksplan.
adalah konsentrasi BAP yang terdiri dari 2 taraf yaitu: 0 dan 0.1 mg/l. Terdapat 14 kombinasi perlakuan dan setiap perlakuan diulang 3 kali berdasarkan hari penanaman sehingga diperoleh 42 satuan percobaan. Setiap satuan percobaan terdiri dari 5 botol dan 1 botol terdiri dari 4 eksplan.
Data pengamatan dianalisis dengan menggunakan uji F, jika terdapat pengaruh yang nyata, maka dilanjutkan dengan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf 5%. Pengolahan data dilakukan dengan perangkat lunak Statistical Analysis System (SAS).
LEMBAR PENGESAHAN
Judul : INDUKSI EMBRIO SOMATIK MELON (Cucumis melo L.) PADA
BERBAGAI MEDIA DAN ZAT PENGATUR TUMBUH Nama : Feni Sukmawati
NRP : A24052279
Menyetujui, Dosen Pembimbing
Dr Ir Darda Efendi, MSi. NIP : 19630616 198903 1 006
Mengetahui.
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr Ir Agus Purwito, MSc. Agr. NIP : 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 7 Februari 1988. Penulis merupakan anak keempat dari Bapak Ir H Elyas dan Ibu Hj Maryati. Tahun 1993 penulis lulus dari TK Margalaksana, Jakarta Timur, kemudian pada tahun 1999 penulis lulus dari SD Malaka Sari 04 Pagi, Jakarta Timur. Penulis menyelesaikan studi di SLTPN 139, Jakarta Timur pada tahun 2002 dan lulus dari SMAN 44, Jakarta Timur pada tahun 2005.
Tahun 2005 penulis diterima sebagai mahasiswa IPB melalui jalur USMI. Selanjutnya diterima sebagai mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberi kekuatan, kesehatan, dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Induksi Embrio Somatik Melon (Cucumis melo L.) pada Berbagai Media dan Zat Pengatur Tumbuh (ZPT)”.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih kepada : 1. Dr. Ir. Darda Efendi, MSi selaku dosen pembimbing skripsi yang telah
memberikan waktu dan membimbing penulis dengan sangat sabarnya serta memberikan arahan dan saran selama penelitian dan penulisan skripsi ini. 2. Dr. Ir. Sandra Arifin A., MS. dan Dr. Dewi Sukma, SP. MS. Yang telah
bersedia menjadi dosen penguji. Terima kasih atas saran dan nasehat yang diberikan kepada penulis sewaktu ujian skripsi.
3. Dr. Ir. Munif Ghulamahdi selaku pembimbing akademik penulis.
4. Seluruh keluarga atas dukungan dan perhatiannya. Penulis sangat bersyukur berada dalam keluarga ini.
5. Seluruh staf pengajar di Departemen Agronomi dan Hortikultura yang sudah membagikan ilmu kepada kami.
6. Willy Bayuardi Suwarno, SP. MSi., terima kasih atas bantuan benih melon hibrida H7 yang telah diberikan. Semoga hasil penelitian ini dapat berguna bagi yang memerlukan.
7. Rekan sepenelitian di laboratorium, Hafith Furqoni dan Dendih Sukmadijaya. Terima kasih atas kebersamaan dan bantuannya dalam melaksanakan penelitian.
8. Rekan-rekan Agronomi dan Hortikultura 42 yang penulis banggakan, mohon maaf tidak bisa penulis sebutkan satu-persatu. Terima kasih atas dukungan dan semangat yang diberikan serta kebersamaan yang sudah kita lewati dalam masa susah dan senang.
9. Mba retno atas bimbingan dan bantuannya selama penulis melaksanakan penelitian di laboratorium.
11.Serta seluruh pihak yang telah membantu penulis dalam penulisan skripsi ini. Terima kasih atas saran dan kritiknya.
Bogor, Januari 2010
DAFTAR ISI
Halaman
PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
Hipotesis 3
TINJAUAN PUSTAKA 5
Botani Melon 5
Kultur Jaringan 6
Eksplan 7
Media Kultur 8
Embriogenesis Somatik 9
Zat Pengatur Tumbuh 10
BAHAN DAN METODE 13
Tempat dan Waktu Penelitian 13
Bahan dan Alat 13
Metode Penelitian 13
Pelaksanaan Penelitian 15
HASIL DAN PEMBAHASAN 20
Kondisi Umum Penelitian 20
Percobaan 1 21
Kondisi Umum 21
Persentase Biji Berkecambah 22 Persentase Biji Berkalus 24
Percobaan 2 27
Kondisi Umum 27
Kalus Embriogenik 29
Jumlah Eksplan yang Menghasilkan Embrio Somatik dan
Jumlah Embrio Somatik 31
Persentase Kotiledon Berakar 34
KESIMPULAN DAN SARAN 38
Kesimpulan 38
Saran 38
DAFTAR PUSTAKA 39
DAFTAR TABEL
Nomor Teks Halaman
1. Rekapitulasi Sidik Ragam Persentase Biji Berkecambah 22
2. Pengaruh Jenis Media Terhadap Rata-rata Persentase Biji
Berkecambah 23
3. Rekapitulasi Sidik Ragam Persentase Biji Berkalus 25
4. Pengaruh Jenis Media Terhadap Rata-rata Persentase Biji Berkalus 25
5. Rekapitulasi Sidik Ragam Persentase Eksplan yang Menghasilkan Kalus Embriogenik 29
6. Interaksi Taraf Auksin (2,4-D, picloram, dan NAA) dengan BAP
Terhadap Persentase Eksplan yang Menghasilkan Kalus Embriogenik 30
7. Rekapitulasi Sidik Ragam Jumlah Embrio per Eksplan dan Jumlah
Eksplan yang Menghasilkan Embrio pada 42 HST 31
8. Interaksi Taraf Konsentrasi Auksin dan BAP Terhadap Jumlah
Eksplan yang Menghasilkan Embrio pada 42 HST 32
9. Pengaruh Jenis dan Konsentrasi Auksin Terhadap Jumlah Embrio per Eksplan 34
10.Rekapitulasi Sidik Ragam Persentase Kotiledon Berakar 35
DAFTAR GAMBAR
Nomor Teks Halaman
1. (A) Buah Melon Muda Berumur 15 Hari, (B) Biji Melon Muda 16
2. Biji Tua Melon Hibrida H-7 16
3. Sketsa Biji Melon yang Sudah Dipisahkan Kulit Bijinya 18
4. Eksplan yang Terkontaminasi Oleh Cendawan 20
5. Media yang Terkontaminasi Oleh Cendawan 20
6. Biji Berkecambah Pada 2 Minggu Setelah Tanam 21
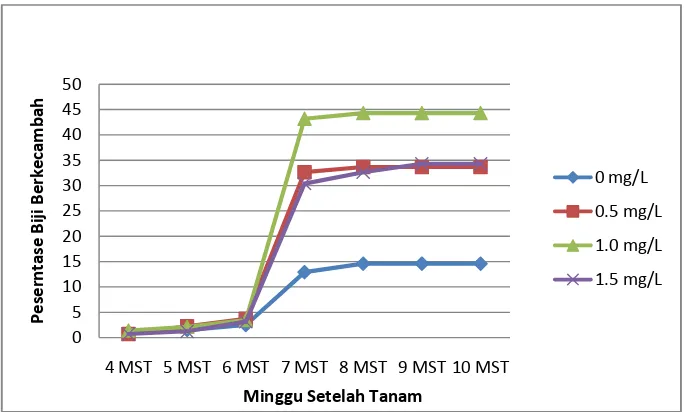
7. Grafik Pengaruh Konsentrasi 2,4-D Terhadap Rata-rata Persentase Biji Berkecambah 24
8. Biji Berkalus Perlakuan Media B5 + 1.0 mg/L 2,4-D Pada 7 MST 24
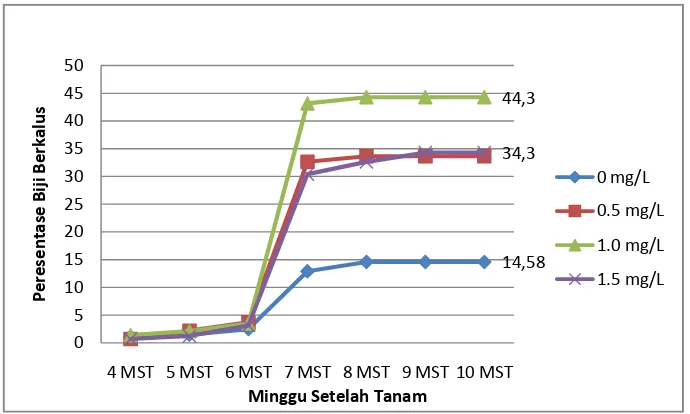
9. Grafik Pengaruh Konsentrasi 2,4-D Terhadap Rata-rata Persentase Biji Berkalus 26
10.Kalus yang Mengalami Organogenesis pada 10 MST 27
11.Kontaminasi Kultur oleh Cendawan 27
12.Kontaminasi Kultur oleh Bakteri 27
13.Perkembangan Eksplan Kotiledon yang Bervariasi 28
14.Embrio Somatik yang Terbentuk pada 42 HST 29
15.Kotiledon yang Membentuk Kalus Embriogenik Pada 39 HST 31
17.Embrio Somatik pada Fase Globular dan Fase Jantung 33
18.Embrio Somatik pada Fase Torpedo dengan Pengamatan Secara
Mikroskopis 33
19.Kotiledon Berakar pada Perlakuan 1.0 mg/L Picloram Secara Tunggal (A) dan Perlakuan (B) 1.0 mg/L Picloram + 0.1 mg/L
BAP pada 18 HST 35
20.Perbedaan Pertumbuhan Akar pada Eksplan: (A) pada Perlakuan Tanpa Auksin, (B) pada Perlakuan Jenis Auksin Picloram Tanpa BAP 36
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi Larutan Stok Media MS 43
2. Komposisi Larutan Stok Media B5 44
3. Komposisi Larutan Stok Media WPM 45
4. Deskripsi Melon Hibrida H-7 46
5. Sidik Ragam Persentase Biji Berkecambah 47
6. Sidik Ragam Persentase Biji Berkalus 49
7. Sidik Ragam Persentase Kalus Embriogenik 50
8. Sidik Ragam Rata-Rata Jumlah Eksplan yang Menghasilkan Embrio saat 42 HST 52
9. Sidik Ragam Jumlah Embrio per Eksplan saat 42 HST 52
10. Sidik Ragam Persentase Kotiledon yang Berakar 53
11. Pengaruh Taraf Konsentrasi 2,4-D Terhadap Rata-rata Persentase Biji Berkecambah 55
Latar Belakang
Tanaman melon (Cucumis melo L.) termasuk dalam suku labu-labuan atau Cucurbitaceae. Tanaman melon berasal dari daerah Mediterania yang merupakan perbatasan antara Asia Barat dengan Eropa dan Afrika. Tanaman ini kemudian menyebar secara luas ke Timur Tengah dan Eropa. Buah melon mulai masuk di Indonesia pada tahun 1980 dan dikenal sebagai buah impor yang dikonsumsi oleh kalangan atas terutama tenaga ahli asing yang tinggal di Indonesia (Prajnanta, 2002). Buah melon biasanya dimakan segar sebagai buah meja atau diiris-iris sebagai campuran es buah. Bagian yang dimakan adalah daging buah (mesokarp). Teksturnya lunak, berwarna putih sampai merah, bergantung pada kultivarnya. Melon juga dikenal sebagai buah yang mengandung vitamin C yang diperlukan tubuh manusia. Buah melon saat ini tidak hanya dikonsumsi sebagai hidangan pencuci mulut, tetapi digunakan sebagai buah untuk terapi kesehatan oleh para ahli gizi karena memiliki khasiat. Khasiat dari buah melon antara lain yaitu untuk membantu sistem pembuangan, antikanker, menurunkan resiko stroke dan penyakit jantung serta mencegah penggumpalan darah. Melon mengandung zat adenosin, yaitu suatu zat antikoagulan yang berfungsi menghentikan penggumpalan keping sel darah.
2
Perbanyakan tanaman melon secara konvensional dikembangkan dengan menggunakan benih (Setiadi dan Parimin, 2001). Namun perbanyakan secara konvensional ini menghadapi kendala yaitu kurangnya ketersediaan benih melon varietas unggul di Indonesia. Umumnya, benih melon yang beredar bukanlah asli Indonesia (benih impor). Para pemulia tanaman saat ini telah berhasil melakukan hibridisasi melon sehingga diperoleh varietas tanaman melon yang memiliki mutu baik (melon hibrida). Varietas melon hibrida memiliki tingkat keseragaman dan kualitas buah yang lebih tinggi, umur genjah, tahan dalam penyimpanan, lebih tahan terhadap hama dan penyakit serta memiliki adaptasi yang luas dengan lingkungan (Bayuardi, 2006). Melon hibrida dihasilkan dengan cara dilakukan persilangan antara tetua jantan dan betina yang memiliki karakter yang baik sehingga diperoleh benih melon yang memiliki sifat unggul. Produksi benih melon hibrida saat ini masih menghadapi kendala yaitu harus dilakukan persilangan untuk mendapatkan benih melon tersebut. Salah satu upaya yang dapat dilakukan untuk membantu permasalahan ini adalah melalui teknik kultur jaringan (in vitro).
Perbanyakan tanaman melalui teknik in vitro diharapkan dapat membantu penyediaan bibit melon dalam jumlah banyak, bebas patogen berbahaya, dan seragam untuk penanaman skala luas tanpa meninggalkan jaminan kualitasnya. Salah satu teknik yang paling banyak digunakan dalam perbanyakan tanaman secara in vitro adalah embriogenesis. Menurut Gunawan (1992), embriogenesis merupakan proses terbentuknya embrio somatik yaitu embrio yang berasal bukan dari zigot, tetapi yang berasal dari sel biasa tubuh tanaman (sel somatik).
perbanyakan lebih cepat, pencapaian hasil dalam mendukung program perbaikkan tanaman lebih cepat, dan jumlah bibit yang dihasilkan tidak terbatas jumlahnya (Mariska, 1996).
Penelitian induksi embrio somatik pada melon telah dilakukan sebelumnya di Jepang. Menurut hasil penelitian Kageyama di Jepang (1991) perkembangan embrio somatik melon terbaik dikulturkan pada media Murashige and Skoog (MS) ditambah hormon 2,4-dichlorophenoxyacetic acid (2,4-D) 1 mg/l, 2-napthaleneacetic acid (NAA) 4 mg/l dan 6-benzylaminopurine (BA) 0,1 mg/l. Penelitian ini menunjukkan bahwa media MS ditambah hormon 2,4-D memberikan pengaruh perkembangan embrio somatik yang normal secara morfogenesis (Kageyama, et al, 1991). Tabei (1991) berhasil melakukan induksi embrio somatik melon pada media MS yang ditambahkan auksin 2,4-D pada konsentrasi yang tinggi yaitu 1.0 – 2.0 mg/l.
Penelitian ini menginduksi embrio somatik melon dengan menggunakan berbagai media (MS, B5 dan Wood Plant Medium (WPM)) dan ZPT (2,4-D, Picloram, NAA dan BAP) pada tingkat konsentrasi yang berbeda- beda.
Tujuan
Percobaan 1 dalam penelitian ini bertujuan untuk mengetahui jenis media kultur dan konsentrasi 2,4-D yang tepat untuk menginduksi embrio somatik melon. Tujuan dari percobaan 2 yaitu untuk mengetahui jenis serta konsentrasi auksin dan sitokinin yang tepat untuk menginduksi embrio somatik melon dalam kultur in vitro.
Hipotesis
Hipotesis percobaan 1 :
1. Terdapat jenis media yang optimum untuk induksi embrio somatik melon. 2. Terdapat konsentrasi 2,4-D yang optimum untuk induksi embrio somatik
4
3. Terdapat interaksi antara jenis media dan konsentrasi 2,4-D untuk induksi embrio somatik melon.
Hipotesis percobaan 2 :
1. Terdapat jenis dan konsentrasi auksin yang optimum untuk induksi embrio somatik melon.
2. Terdapat konsentrasi BAP yang optimum untuk induksi embrio somatik melon.
Botani Melon
Klasifikasi botani tanaman melon adalah sebagai berikut: Kingdom : Plantarum
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledonae Sub-kelas : Sympetalae Ordo : Cucurbitales Keluarga : Cucurbitaceae Genus : Cucumis
Spesies : Cucumis melo L.
Tanaman melon (Cucumis melo L.) merupakan famili cucurbitaceae. Melon termasuk tanaman yang menghasilkan biji sehingga dimasukkan dalam tumbuhan berbiji (Spermatophyta). Biji melon tertutup oleh bakal buah sehingga dimasukkan ke dalam golongan tumbuhan berbiji tertutup (Angiospermae). Tanaman melon terdiri dari dua daun lembaga sehingga dimasukkan dalam kelas tumbuhan berbiji belah (dikotil) dan tergolong dalam genera Cucumis.
6
pada setiap ruas percabangan. Bunga betina memiliki putik, mahkota bunga, dan bakal buah. Bakal buah yang berbentuk bulat lonjong ditopang oleh tangkai buah yang pendek dan tebal. Bunga betina akan gugur apabila 2-3 hari setelah mekar tidak diserbuki.
Biji melon terdapat di antara rongga buah dan terbalut oleh plasenta berwarna putih. Biji melon pada umumnya berwarna cokelat muda, panjang rata-rata 0.9 mm dan diameter 0.4 mm. Dalam satu buah melon terdapat sekitar 500-600 biji. Buah melon memiliki bentuk yang bermacam-macam yaitu bulat, oval dan lonjong. Bentuk buah melon bergantung pada varietasnya. Bentuk buah melon yang bulat terdapat pada varietas Sky Rocket, Jade Dew, Action, Aroma, Sweet Star dan Emerald Sweet. Melon dengan bentuk buah oval terdapat pada varietas Ten Me. Buah melon yang berbentuk lonjong terdapat pada varietas New Century dan Super Salmon. Buah melon memiliki warna kulit buah yang beragam dan bergantung pada varietas. Umumnya melon yang dibudidayakan di Indonesia berwarna hijau muda pada saat masih muda dan berubah menjadi hijau tua ketika matang (Prajnanta, 2002).
Kultur Jaringan
patogen. Torres (1989) menyatakan tujuan utama dari perbanyakan secara in vitro tanaman sayuran meliputi produksi planlet dari tanaman yang sulit diperbanyak dari biji, produksi bahan tanaman bebas virus dan perbaikan tanaman melalui modifikasi genetika.
Werbrounds dan Debergh (1993) menyebutkan bahwa secara umum terdapat lima tahapan dalam kultur jaringan yaitu: tahap persiapan, tahap inisiasi, tahap kultur, tahap pemanjangan tunas, inisiasi akar, dan perkembangan akar serta aklimatisasi. Tujuan utama dari penerapan metode kultur jaringan adalah produksi bibit dalam jumlah besar dan waktu singkat, terutama untuk kultivar-kultivar unggul yang baru dihasilkan.
Eksplan
Eksplan adalah bagian tanaman yang dijadikan bahan perbanyakan awal yang ditanam dalam media, yang akan menunjukkan pertumbuhan dan perkembangan tertentu. Arah pertumbuhan dan perkembangan atau regenerasi ditentukan oleh komposisi media, zat pengatur tumbuh yang digunakan, bagian tanaman yang dijadikan eksplan, genotipe, umur eksplan, letak pada cabang, serta lingkungan tumbuh (Gunawan, 1992). Eksplan dapat berasal dari daun, peduncles,
8
Embrio somatik dapat diinisiasi dari jaringan juvenil atau jaringan meristematik. Eksplan yang dapat digunakan dapat berupa daun muda, ujung tunas, kotiledon, dan hipokotil, tetapi respon eksplan sangat bergantung dari genotipe tanaman. Pada beberapa spesies tanaman hanya jaringan tertentu yang dapat digunakan untuk inisiasi embrio somatik (Gray, 2000).
Penggunaan eksplan yang bersifat meristematik umumnya memberikan keberhasilan pembentukan embrio somatik yang lebih tinggi (Purnamaningsih, 2002). Oridate dan Oosawa (1986) melaporkan embrio somatik berhasil diinduksi dari eksplan yang berasal dari kotiledon pada tanaman melon. Hal yang sama juga dilaporkan oleh Tabei et al. (1991) yang berhasil menginduksi embrio somatik melon dengan menggunakan eksplan yang berasal dari kotiledon biji tua, kotiledon dan hipokotil dari biji yang dikecambahkan, dan daun serta petiol dari planlet muda. Pada tanaman yang segenus yaitu mentimun (Cucumis sativus L.) penelitian mengenai organogenesis dan embriogenesis telah berhasil dilakukan. Sumber eksplan yang digunakan dalam menginduksi embrio somatik yaitu kotiledon dan hipokotil dari biji yang dikecambahkan secara in vitro (Chee, 1990). Hal yang sama juga dilaporkan oleh Ladyman dan Girard (1992), yang berhasil menginduksi embrio somatik dengan menggunakan eksplan kotiledon dari biji yang dikecambahkan secara in vitro. Hasil penelitian Kuijpers et al. (1996) di Belanda, berhasil menginduksi embrio somatik pada tanaman mentimun dengan menggunakan eksplan daun muda dari biji yang dikecambahkan secara in vitro.
Media Kultur
pertumbuhan eksplan. Sukrosa yang pada umumya dalam media kultur berupa gula merupakan sumber karbohidrat untuk menggantikan karbon yang biasanya didapat dari atmosfer melalui proses fotosintesis.
Keberhasilan dalam penggunaan metode kultur jaringan sangat bergantung pada media yang digunakan. (Gunawan, 1992). Menurut George dan Sherrington (1984), jenis media kultur jaringan dibedakan berdasarkan bentuk fisiknya, yaitu media padat dan media cair yang mempunyai kelebihan dan kekurangan masing-masing. Pemilihan jenis media disesuaikan dengan jenis eksplan dan tujuan yang diinginkan. Keuntungan penggunaan media padat antara lain dapat menghasilkan pertumbuhan tunas yang cepat, morfogenesis dari kalus lebih baik, tunas serta akar dapat tumbuh dengan teratur. Kekurangannya yaitu kontak eksplan dengan media sedikit karena potensial air yang rendah.
Media MS (Murashige dan Skoog) merupakan media yang umum digunakan untuk perbanyakan sejumlah besar spesies tanaman. Media MS banyak mengandung unsur nitrogen (KNO3 dan NH4NO3; Tabel Lampiran 1) yang mampu menstimulasi terjadinya inisiasi embriogenesis (Torres, 1989).
Media B5 dikembangkan oleh Gamborg dan Grupnya pada tahun 1968 untuk kultur suspensi kedelai. Pada masa ini media B5 digunakan untuk kultur-kultur lain. Media ini menggunakan konsentrasi NH4+ yang rendah (Tabel
Lampiran 2). Fosfat yang diberikan adalah 1 mM, Ca2+ antara 1 – 4 mM,
sedangkan Mg2+ antara 0,5 – 3 mM (Gunawan, 1992).
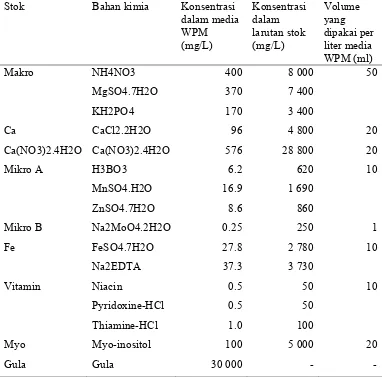
Media WPM (Woody Plant Medium) dikembangkan oleh Llyod dan Mc Cown pada tahun 1981, merupakan media dengan konsentrasi ion yang rendah pada jaman sesudah penemuan media MS. Media ini konsisten dengan media untuk tanaman berkayu yang dikembangkan oleh ahli lain, tetapi sulfat yang digunakan lebih tinggi dari sulfat pada media tanaman berkayu lain (Gunawan, 1992).
Embriogenesis Somatik
10
menyerupai embrio yang berasal dari sel zigot. Tahap pertama dalam terbentuknya embrio somatik yaitu pembelahan sel tunggal secara terus-menerus sehingga terbentuk kumpulan sel, kemudian kumpulan sel tersebut berkembang ke tahap pembentukan proembrio globular lalu tahap jantung, dan terakhir tahap torpedo. Embrio somatik pada tahap torpedo akan berkembang menjadi tanaman muda (Dodds dan Roberts, 2002).
Embrio somatik dapat terbentuk secara langsung atau tidak langsung. Embriogenesis somatik secara tidak langsung dimulai dengan pembelahan sel secara terus-menerus menjadi kalus. Kalus adalah suatu kumpulan sel amorphous yang terjadi dari sel-sel jaringan yang membelah secara terus-menerus (Gunawan, 1992). Kalus biasanya terbentuk setelah eksplan dikulturkan dalam media yang mengandung auksin. Banyak faktor yang mempengaruhi embriogenesis antara lain auksin eksogen, sumber eksplan, komposisi nitrogen yang ditambahkan dalam media dan korbohidrat (sukrosa). Selanjutnya sel membelah terus hingga memasuki tahap globular. Pada tahap globular sel aktif membelah ke segala arah dan membentuk lapisan terluar yang akan menjadi protoderm (bakal epidermis). Kelompok sel yang merupakan prekursor jaringan dasar dan jaringan pembuluh pun mulai terbentuk. Pembelahan sel ke segala arah akan terhenti ketika primordia kotiledon terbentuk, yaitu pada saat embrio matang sudah autotrof. Embrio matang akan berkecambah dan tumbuh menjadi tumbuhan baru pada kondisi yang cocok (Bajaj, 1994; Dodeman et al., 1997; Litz, 1985). Proses pembentukan dan perkembangan embrio (embriogenesis) menentukan pola pertumbuhan, yaitu meristem pucuk ke atas, meristem akar ke bawah, dan pola-pola dasar jaringan lainnya berkembang pada aksis pucuk akar ini, namun terdapat variasi proses embriogenesis pada setiap tumbuhan.
Zat Pengatur Tumbuh
etilen yang masing-masing memiliki ciri khas dan pengaruh yang berlainan terhadap proses fisiologi (Abidin, 1983). Kelima zat pengatur tumbuh ini terdapat di dalam tanaman dalam berbagai bentuk, sehingga sulit untuk mengerti cara kerja masing-masing dengan baik (Wattimena, 1988).
Menurut Wattimena (1988), zat pengatur tumbuh adalah senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (10-6 – 10-5 mM) yang disintesis pada bagian tertentu dari tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis.
Dalam kultur jaringan, ada dua golongan zat pengatur tumbuh yang sangat penting adalah sitokinin dan auksin. Zat pengatur tumbuh ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen, menentukan arah perkembangan suatu kultur. Penambahan auksin atau sitokinin eksogen mengubah level ZPT endogen sel (Gunawan, 1992).
BAHAN DAN METODE
Tempat dan Waktu Pelaksanaan
Kegiatan penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan selama 5 bulan yang terhitung dari bulan Mei sampai dengan bulan September 2009.
Bahan dan Alat
Bahan yang digunakan sebagai eksplan dalam penelitian ini adalah biji melon muda dan biji melon tua H-7 koleksi Pusat Kajian Buah-buahan Tropika IPB. Media kultur MS (Murashige and Skoog), media B5, dan media WPM (Woody Plant Medium), agar-agar sebagai bahan pemadat, sukrosa (gula), zat pengatur tumbuh (2,4-D, picloram, NAA, dan BAP), klorox, alkohol 70%, bakterisida (streptomycin sulfat), fungisida (mankozeb), detergen, betadhine dan air steril.
Alat yang digunakan terdiri dari botol kultur, gelas ukur, gelas piala besar, cawan petri, corong plastik, kompor, autoclave, laminar airflow cabinet, pH meter, lampu spiritus, botol sprayer, rak kultur, plastik gulung dan karet gelang serta peralatan diseksi seperti sudip, pinset, pisau, dan scalpel.
Metode Penelitian
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan perlakuan dua faktor dengan menggunakan rancangan acak kelompok (RAK).
kali berdasarkan hari penanaman sehingga diperoleh 36 satuan percobaan. Setiap satuan percobaan terdiri dari 5 botol dan 1 botol terdiri dari 4 eksplan
Pada percobaan 2 faktor pertama adalah jenis dan konsentrasi auksin yang terdiri dari 7 taraf yaitu: tanpa auksin, 1.0 mg/l 2,4-D, 2.0 mg/l 2,4-D, 1.0 mg/l picloram, 2.0 mg/l picloram, 1.0 mg/l NAA, dan 2.0 mg/l NAA. Faktor kedua adalah konsentrasi BAP yang terdiri dari 2 taraf yaitu: 0 dan 0.1 mg/l. Terdapat 14 kombinasi perlakuan dan setiap perlakuan diulangan 3 kali berdasarkan hasil penanaman sehingga diperoleh 42 satuan percobaan. Setiap satuan percobaan terdiri dari 5 botol dan 1 botol terdiri dari 4 eksplan.
.Uji statistik yang digunakan yaitu analisis sidik ragam. Model rancangan yang digunakan adalah :
Yijk = µ + αi + βj + (αβ)ij + k + ijk
i = perlakuan jenis media (percobaan 1) atau taraf jenis dan taraf konsentrasi
auksin (percobaan 2)
j = perlakuan taraf konsentrasi 2,4-D (perobaan 1) atau taraf konsentrasi BAP (percobaan 2)
k = 1, 2, 3 (ulangan) Yijk = respon perlakuan µ = pengaruh rata-rata umum
αi = pengaruh perlakuan jenis media (percobaan 1) atau jenis dan taraf konsentrasi auksin (percobaan 2) pada taraf ke-i
βj = pengaruh perlakuan konsentrasi 2,4-D (percobaan 1) atau konsentrasi BAP (percobaan 2) pada taraf ke-j
(αβ)ij = pengaruh interaksi antara dua faktor perlakuan k = pengaruh kelompok ke-k
ijk = pengaruh galat percobaan
Pada percobaan 1 : Pada Percobaan 2 :
i = 1,2,3 i = 1,2,3,...,7
j = 1,2,3,4 j = 1,2
14
Data pengamatan diuji dengan menggunakan analisis ragam, jika terdapat pengaruh yang nyata, maka akan dilanjutkan dengan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf 5%. Pengolahan data dilakukan dengan perangkat lunak Statistical Analysis System (SAS).
Pelaksanaan Penelitian
Persiapan dan Sterilisasi Alat
Alat-alat yang digunakan untuk kegiatan penanaman harus dalam keadaan steril. Botol kultur, cawan petri, alat tanam (pinset, pisau dan scalpel) dicuci bersih terlebih dahulu kemudian dikeringkan. Peralatan tanam dan cawan petri tersebut dibungkus dengan kertas. Semua peralatan tersebut disterilisasi dengan
autoclave pada temperatur 1210C dengan tekanan 1.1 kgcm2 selama 1 jam. Perhitungan waktu sterilisasi dimulai setelah tekanan mencapai 1.1 kgcm2.
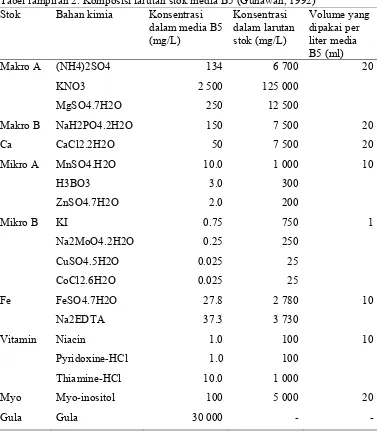
Pembuatan Larutan Stok
Pembuatan larutan stok bahan pembuat media MS, B5 dan WPM bertujuan untuk memudahkan pembuatan media. Larutan stok media dibuat sesuai dengan komposisi media MS, WPM, dan B5 (Tabel Lampiran 1, 2, dan 3) yang disimpan dalam erlenmeyer dengan konsentrasi yang lebih pekat dalam suhu kamar.
Pembuatan Media Kultur Percobaan I :
kemudian ditambahkan agar-agar sebanyak 7 g/l. Media tersebut dipanaskan dan diaduk sehingga agar-agar larut. Setelah mendidih media dituangkan ke dalam botol-botol kultur steril yang telah dipersiapkan. Masing-masing botol kultur diisi sebanyak 20 ml media. Botol segera ditutup rapat dengan menggunakan plastik dan diikat dengan karet gelang lalu disterilkan dengan autoclaf pada suhu 1210C dan tekanan 1.1 kgcm2 selama 30 menit. Selanjutnya media yang sudah disteril disimpan dalam ruang penyimpanan media yang telah dilengkapi dengan pendingin ruangan.
Percobaan II :
P P m P b P P c S P m l Pemilihan E Percobaan I Biji muda, berum Pusat Kajian baik dan utu
Gambar Percobaan II Biji t Pusat Kajian cacat, beruku Sterilisasi E Percobaan I Buah menggunaka larutan ditha A Eksplan : melon muda mur 15 hari n Buah-buah uh.
1. (A) Buah
I :
tua melon (m
n Buah-buah uran normal
Ga
Eksplan :
h melon y an detergen ane dan agre
a sebagai ek setelah pen han Tropika
h Melon Mud
mature seed
han Tropika l, dan seed c
ambar 2. Bij
yang muda n. Buah yan ept,
masing-ksplan diam nyerbukan y a IPB. Biji m
da Berumur
d) yang beras a IPB dipilih
oat bebas da
i Tua Melon
a terlebih ng sudah b -masing 2 g/
B
mbil dari bu yang berasal
melon muda
15 Hari, (B)
sal dari melo h yang berp ari jamur.
n Hibrida
H-dahulu di ersih kemu /l selama 1 j
uah melon h dari kebun harus berp
) Biji Melon
on hibrida H penampilan
7
icuci bersi udian dirend jam. Buah y
disterilkan tersebut kemudian dipindahkan kedalam Laminar Airflow Cabinet. Lalu buah direndam ke dalam clorox 25% selama 20 menit, dibilas dengan aquades steril sebanyak 2 kali. Lalu buah dibelah secara melintang tepat dibagian tengah. Biji melon dipisahkan dari daging buah kemudian satu-persatu biji dibersihkan dari lendir yang menempel dengan menggunakan pinset. Biji yang sudah bersih dari lendir direndam dalam klorox 5% selama 20 menit. Banyaknya biji yang direndam adalah 100 biji per 100 ml larutan klorox.
Percobaan II :
Pada percobaan kedua biji melon tua dipisahkan dari kulit biji sehingga diperoleh kotiledon (Gambar 3). Kotiledon yang diperoleh kemudian direndam dalam larutan fungisida dan bakterisida dengan masing-masing konsentrasi 2 g/l selama 1 jam. Kotiledon lalu dibilas dengan air steril kemudian direndam dalam larutan klorox 10% selama 10 menit lalu direndam kembali dalam larutan klorox 5% selama 5 menit kemudian dibilas dengan air steril sebanyak 2 kali. Banyaknya biji yang direndam adalah 100 biji per 100 ml larutan klorox.
Penanaman Biji
18
Gambar 3. Sketsa Biji Melon yang Sudah Dipisahkan Kulit Bijinya, Bagian Kotiledon Ditanam pada Media Kultur (Gray, 2000).
Pengamatan
Pengamatan dilakukan terhadap beberapa peubah yaitu : 1. Kultur yang terkontaminasi
2. Kultur yang membentuk kalus
3. Kultur yang membentuk embrio somatik 4. Waktu terbentuknya kalus dan embrio somatik 5. Struktur dan warna kalus
6. Kultur yang berkecambah dan berakar
Kondisi Umum Penelitian
Penelitian ini terdiri dari 2 percobaan, percobaan 1 bertujuan untuk mengetahui jenis media kultur dan konsentrasi 2,4-D yang tepat untuk menginduksi embrio somatik melon. Pada percobaan 1 eksplan yang digunakan adalah biji melon muda yang berasal dari buah melon hibrida (H-7) yang berumur 15 hari setelah penyerbukan. Biji melon muda ditanam pada 3 jenis media kultur yaitu: MS, B5, dan WPM yang ditambahkan auksin 2,4-Dichloropenoxyacetic acid dengan konsentrasi 0, 0.5, 1.0, dan 1.5 mg/l. Biji melon muda digunakan sebagai bahan eksplan karena memiliki jaringan muda yang bersifat meristematik. Menurut Purnamaningsih (2002), penggunaan eksplan yang bersifat meristematik umumnya memberikan keberhasilan pembentukkan embrio somatik lebih tinggi, namun pada percobaan 1 ini embrio somatik tidak terbentuk. Respon yang diberikan oleh eksplan yaitu biji berkecambah dan berkalus. Kalus yang dihasilkan merupakan kalus embriogenik. Respon biji berkecambah banyak terjadi pada media B5. Perkecambahan yang terjadi dapat menghambat terbentuknya embrio somatik. Berdasarkan hasil yang didapat induksi embrio somatik lebih tepat bila menggunakan media MS.
20
Percobaan 1 Kondisi Umum
Bahan tanam pada percobaan pertama dalam penelitian ini menggunakan biji melon yang berasal dari buah melon muda berumur 15 hari setelah penyerbukan. Penanaman biji melon muda dilakukan pada tanggal 28, 29 dan 30 April 2009. Biji yang sudah ditanam disimpan dalam ruang gelap dan diamati selama 10 minggu. Tahap sterilisasi pada percobaan satu diduga kurang memadai karena tingkat kontaminasi kultur yang terjadi cukup tinggi yaitu sebesar 34%. Pada umumnya kontaminasi yang terjadi pada percobaan 1 disebabkan oleh cendawan (Gambar 4 dan 5) yang tumbuh pada media maupun eksplan.
Gambar 4. Eksplan yang Terkontaminasi Gambar 5. Media yang Terkontaminasi Oleh Cendawan Oleh Cendawan
embriogenik mulai terhenti, ditandai dengan perubahan warna dari bening kekuningan menjadi coklat. Perubahan warna ini juga sebagai indikator bahwa perkembangan kalus embriogenik sudah berhenti.
Persentase Biji Berkecambah
Biji berkecambah mulai terjadi pada minggu ke-2 setelah tanam (Gambar 6). Hasil uji F pada Tabel 1 memperlihatkan bahwa perlakuan jenis media dan taraf konsentrasi 2,4-D berpengaruh nyata terhadap rata-rata persentase biji berkecambah. Tidak terdapat interaksi antara perlakuan jenis media dan konsentrasi 2,4-D terhadap persentase biji berkecambah.
Gambar 6. Biji Berkecambah pada 2 MST
Tabel 1. Rekapitulasi Sidik Ragam Persentase Biji Berkecambah Minggu Setelah
Tanam (MST) Media
Konsentrasi
2,4-D Interaksi KK (%)
2 t tn * tn 40.70
3 t tn ** tn 32.27
4 tn * tn 25.90
5 * * tn 25.18
6 * tn tn 27.08
7 ** * tn 17.51
8 ** * tn 17.53
9 ** * tn 17.53
10 ** * tn 17.53
Ket : tn tidak berbeda nyata pada taraf 5% *, ** berbeda nyata pada taraf 5% dan 1%
t
data ditransformasi dengan rumus √x 0.5
22
perlakuan media WPM dan MS. Perlakuan media MS dan WPM memberikan hasil tidak berbeda nyata berdasarkan uji lanjut jarak berganda Duncan (DMRT) pada taraf 5% (Tabel 2).
Tabel 2. Pengaruh Jenis Media Terhadap Rata-rata Persentase Biji Berkecambah Jenis Media Waktu Pengamatan Minggu Setelah Tanam (MST)
5 6 7 8 9 10 MS 35.7 b 45.1 b 51.1 b 51.1 b 51.1 b 51.1 b B5 44.4 a 60.7 a 79.8 a 79.8 a 79.8 a 79.8 a WPM 34.7 b 47.6 b 59.1 b 59.6 b 59.6 b 59.6 b
Ket : Tanda huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) 5 %
Berdasarkan hasil yang diperoleh, disajikan pada Tabel 2, dapat dikatakan bahwa media B5 kurang tepat bila digunakan untuk menginduksi embrio somatik karena memacu perkecambahan biji. Biji berkecambah tidak diharapkan dalam induksi embrio somatik. Jika biji berkecambah maka akan menghambat terbentuknya embrio somatik.
Diantara media MS, B5 dan WPM kandungan KNO3- paling tinggi
terdapat pada media B5. Pemberian unsur nitrogen dalam bentuk KNO3
-cenderung mempengaruhi pertumbuhan eksplan. Hal ini diduga mempengaruhi persentase perkecambahan biji. Menurut Purnamaningsih (2002), nitrogen merupakan faktor utama dalam memacu morfogenesis secara in vitro. Ketersediaan unsur nitrogen di dalam media disediakan dalam bentuk NO3- dan
NH4+ (Beyl, 2005).
Gambar 7. Grafik Pengaruh Konsentrasi 2,4-D Terhadap Rata-rata Persentase Biji Berkecambah
Persentase Biji Berkalus
[image:46.612.149.495.78.284.2]Berdasarkan hasil uji F yang disajikan pada Tabel 3, perlakuan jenis media dan taraf konsentrasi 2,4-D berpengaruh nyata terhadap persentase biji berkalus mulai 7 MST sampai akhir pengamatan. Tidak ada interaksi antara perlakuan jenis media dan konsentrasi 2,4-D terhadap persentase biji berkalus. Biji yang berkalus ditunjukkan pada Gambar 8.
Gambar 8. Biji Berkalus pada Media B5 + 1.0 mg/l 2,4-D pada 7 MST
0 5 10 15 20 25 30 35 40 45 50
4 MST 5 MST 6 MST 7 MST 8 MST 9 MST 10 MST
Peser
n
ta
se
Biji
Berkecambah
Minggu Setelah Tanam
0 mg/L
0.5 mg/L
1.0 mg/L
24
Tabel 3. Rekapitulasi Sidik Ragam Persentase Biji Berkalus Minggu Setelah
Tanam (MST) Media
Konsentrasi
2,4-D Interaksi KK (%)
4 t tn tn tn 24.76
5 t * tn tn 32.06
6 t tn tn tn 49.84
7 * ** tn 42.01
8 * ** tn 38.11
9 * ** tn 38.62
10 * ** tn 38.62
Ket : tn tidak berbeda nyata pada taraf 5% *, ** berbeda nyata pada taraf 5% dan 1%
t
data ditransformasi dengan rumus √x 0.5
Berdasarkan hasil uji lanjut Duncan yang disajikan dalam Tabel 4 dapat dilihat bahwa media B5 dan MS memberikan hasil tidak berbeda nyata terhadap rata-rata persentase biji berkalus pada minggu terakhir pengamatan (10 MST), masing-masing sebesar 40.1 dan 30.2%. Sejak pengamatan 8 MST, perlakuan jenis media B5 memberikan hasil yang lebih tinggi terhadap rata-rata persentase biji berkalus dibandingkan dengan perlakuan media WPM yang memberikan persentase biji berkalus terkecil sebesar 24.8%.
Tabel 4. Pengaruh Jenis Media Terhadap Rata-rata Persentase Biji Berkalus Jenis Media Waktu Pengamatan Minggu Setelah Tanam (MST)
7 8 9 10 MS 27.3 b 28.9 b 30.2 ab 30.2 ab
B5 38.4 a 40.1 a 40.1 a 40.1 a WPM 23.5 b 24.8 b 24.8 b 24.8 b
Ket : Tanda huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) 5 %
Berdasarkan hasil yang diperoleh (Tabel 4), dapat dikatakan bahwa media MS dan B5 dapat digunakan untuk menginduksi kalus embriogenik. Bila dihubungkan dengan hasil yang diperoleh pada Tabel 2, maka media MS merupakan media yang baik untuk menginduksi kalus embriogenik dibandingkan media B5.
berkalus yang lebih tinggi dibandingkan dengan taraf konsentrasi 0 mg/l 2,4-D. Hal ini berarti penambahan auksin 2,4-D dengan konsentrasi rendah sudah mampu untuk menginduksi kalus embriogenik.
Gambar 9. Grafik Pengaruh Konsentrasi 2,4-D Terhadap Rata-rata Persentase Biji Berkalus
Auksin berfungsi untuk pertumbuhan kalus, suspensi sel dan pertumbuhan akar. Jenis auksin 2,4-D merupakan jenis auksin yang banyak digunakan untuk induksi kalus, selain itu sering digunakan untuk mendorong pembentukan embrio somatik (Wattimena et al., 1992). Pemberian 2,4-D pada dosis rendah mampu untuk menginduksi kalus sehingga penggunaan dosis yang tinggi tidak diperlukan untuk menginduksi kalus.
Tabei et al. (1991) melaporkan bahwa pemberian 2,4-D secara tunggal pada konsentrasi 1.0 sampai 2.0 mg/l dapat menginduksi embrio somatik pada tanaman melon. Gonsalves et al. (1995) juga melaporkan embrio somatik dapat diinduksi pada media MS yang ditambahkan 2,4-D sebesar 5.0 mg/l pada tanaman
Cucurbita pepo L. Namun, pada percobaan 1 ini embrio somatik tidak terbentuk. Sebagian besar eksplan hanya membentuk kalus embriogenik dan kalus embriogenik tersebut tidak mengalami perkembangan lagi. Hanya terdapat satu kalus yang mengalami organogenesis, membentuk hipokotil dan akar (Gambar 10), yaitu pada perlakuan media MS ditambahkan 1.0 mg/l 2,4-D. Hal ini diduga
14,58 44,3 34,3 0 5 10 15 20 25 30 35 40 45 50
4 MST 5 MST 6 MST 7 MST 8 MST 9 MST 10 MST
Per e sent ase Biji Berkalus Minggu Setelah Tanam
0 mg/L
0.5 mg/L
1.0 mg/L
26
karena eksplan yang dikulturkan memiliki sel atau jaringan yang mampu melakukan morfogenesis atau sel tersebut kompeten untuk beregenerasi menjadi tanaman baru.
Gambar 10. Kalus yang Mengalami Organogenesis Perlakuan Media MS + 1.0 mg/l 2,4-D Pada 10 MST
Percobaan 2 Kondisi Umum
Bahan tanam yang digunakan pada percobaan kedua yaitu kotiledon yang berasal dari biji melon tua. Biji melon tua dikupas kulit bijinya dan sebelum dilakukan penanaman bagian aksis biji dipotong sehingga diperoleh kotiledon. Penanaman dilakukan pada tanggal 25, 26 dan 27 Juni 2009. Eksplan yang sudah ditanam disimpan dalam ruang gelap dan diamati selama 6 minggu. Tingkat kontaminasi yang terjadi pada percobaan 2 cukup tinggi yaitu sebesar 45%. Kontaminasi banyak terjadi pada minggu kelima pengamatan. Pada umumnya sebagian besar kontaminasi kultur yang terjadi di percobaan 2 diakibatkan oleh cendawan (Gambar 11) dan sebagian kecil disebabkan oleh bakteri (Gambar 12).
Pada percobaan 2 respon awal yang muncul yaitu kotiledon membelah menjadi dua kemudian mengalami pembesaran (Gambar 12.A). Pembesaran kotiledon ini terjadi pada hari kedua sampai hari keenam setelah tanam. Perkembangan kotiledon sangat bervariasi bergantung pada perlakuan yang diberikan. Eksplan kotiledon pada media tanpa penambahan auksin tidak membentuk kalus, perkembangan yang terjadi yaitu pertumbuhan hipokotil dan akar (Gambar 12.B). Eksplan yang ditanam pada media kultur yang ditambahkan dengan jenis auksin picloram pada umumnya mengalami pertumbuhan akar dalam jumlah yang banyak (Gambar 12.C), sedangkan eksplan yang ditanam pada media yang ditambahkan jenis auksin 2,4-D dan NAA sebagian besar mampu membentuk kalus embriogenik (Gambar 12.D). Sebagian kalus embriogenik mampu menghasilkan embrio somatik (Gambar 13). Embrio somatik terbentuk pada 42 hari setelah tanam (HST).
Gambar 12. Perkembangan Eksplan Kotiledon yang Bervariasi: (A) Kotiledon Membelah dan Membesar pada 6 HST, (B) Kotiledon Berakar dan Tumbuh Hipokotil pada Perlakuan Media tanpa ZPT pada 15
HST, (C) Kotiledon Berakar Perlakuan 1 mg/l Picloram Tanpa BAP pada 15 HST, (D) Kotiledon Membentuk Kalus Embriogenik Pada Perlakuan 1 mg/l NAA Tanpa BAP.
A B
28
Gambar 13. Embrio Somatik yang Terbentuk Pada 42 HST
Kalus Embriogenik
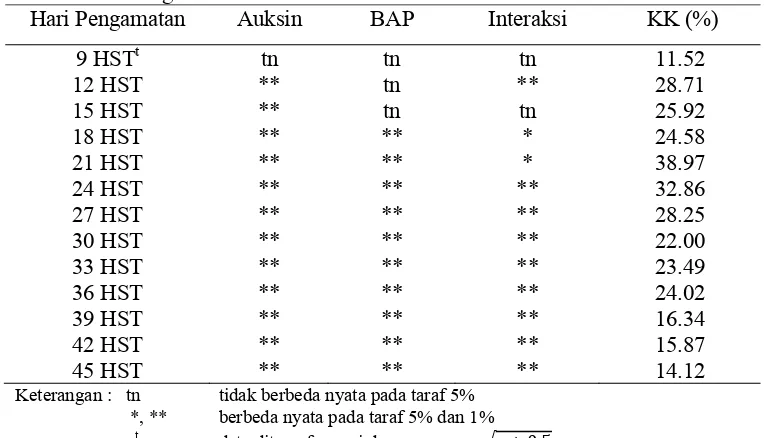
Perlakuan taraf konsentrasi auksin (2,4-D, Picloram dan NAA) dengan taraf konsentrasi sitokinin (BAP) memberikan pengaruh yang nyata terhadap persentase eksplan yang menghasilkan kalus embriogenik (Gambar 14). Hasil uji F yang disajikan pada Tabel 6 menunjukkan bahwa terdapat interaksi antara perlakuan taraf konsentrasi auksin dengan taraf konsentrasi sitokinin terhadap pembentukkan kalus embriogenik. Tabel 6 menunjukkan bahwa interaksi mulai terjadi sejak 18 HST (hari setelah tanam) sampai dengan pada hari terakhir pengamatan yaitu 45 HST.
Tabel 6. Rekapitulasi Sidik Ragam Persentase Eksplan yang Menghasilkan Kalus Embriogenik
Hari Pengamatan Auksin BAP Interaksi KK (%)
9 HSTt tn tn tn 11.52
12 HST ** tn ** 28.71
15 HST ** tn tn 25.92
18 HST ** ** * 24.58
21 HST ** ** * 38.97
24 HST ** ** ** 32.86
27 HST ** ** ** 28.25
30 HST ** ** ** 22.00
33 HST ** ** ** 23.49
36 HST ** ** ** 24.02
39 HST ** ** ** 16.34
42 HST ** ** ** 15.87
45 HST ** ** ** 14.12
Keterangan : tn tidak berbeda nyata pada taraf 5% *, ** berbeda nyata pada taraf 5% dan 1%
t
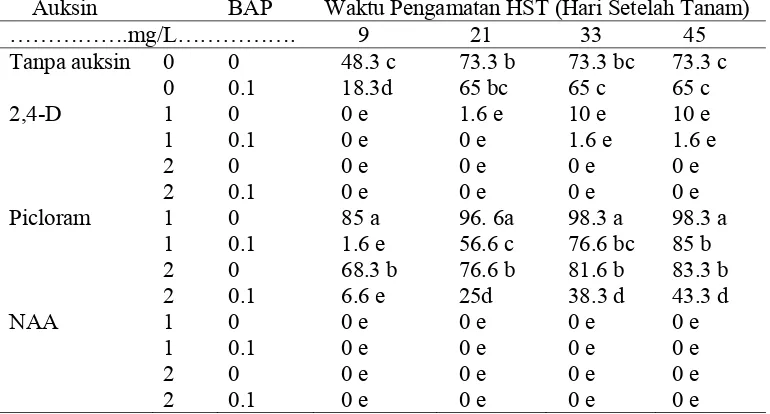
[image:51.612.125.507.478.697.2]Eksplan yang ditanam pada media kultur yang tidak ditambahkan auksin tidak menghasikan kalus embriogenik. Perlakuan media kultur yang ditambahkan auksin tunggal maupun yang dikombinasikan dengan BAP mampu menghasilkan kalus embriogenik dengan persentase bervariasi bergantung dari jenis auksin.
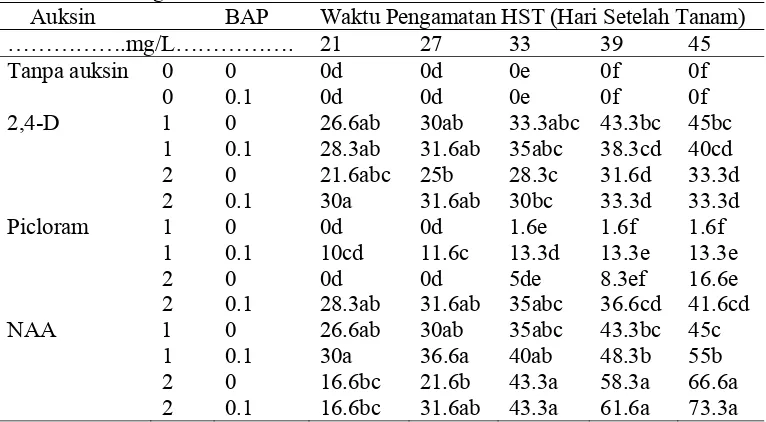
Berdasarkan hasil uji lanjut yang disajikan pada Tabel 7, hasil pembentukan kalus embriogenik terbanyak pada 45 HST terjadi pada perlakuan 2.0 mg/l NAA + 0.1 mg/l BAP sebesar 73.3%, namun hasil ini tidak berbeda nyata dengan perlakuan 2.0 mg/l NAA tanpa BAP yang memberikan hasil sebesar 66.6%.
[image:52.612.129.512.410.621.2]Menurut Wattimena et al. (1992) pada umumnya untuk menginduksi kalus embriogenik diperlukan auksin dan sitokinin. Perbandingan kedua zat pengatur tumbuh tersebut (nisbah auksin dan sitokinin) yaitu konsentrasi auksin dalam media harus lebih tinggi dibandingkan konsentrasi sitokinin. Pada penelitian ini kalus embriogenik dapat dihasilkan dengan pemberian auksin secara tunggal maupun dikombinasikan dengan sitokinin.
Tabel 7. Pengaruh Interaksi Taraf Auksin (2,4-D, Picloram dan NAA) dengan BAP Terhadap Persentase Eksplan yang Menghasilkan Kalus Embriogenik
Auksin BAP Waktu Pengamatan HST (Hari Setelah Tanam)
……….mg/L………. 21 27 33 39 45
Tanpa auksin 0 0 0d 0d 0e 0f 0f
0 0.1 0d 0d 0e 0f 0f
2,4-D 1 0 26.6ab 30ab 33.3abc 43.3bc 45bc
1 0.1 28.3ab 31.6ab 35abc 38.3cd 40cd
2 0 21.6abc 25b 28.3c 31.6d 33.3d
2 0.1 30a 31.6ab 30bc 33.3d 33.3d
Picloram 1 0 0d 0d 1.6e 1.6f 1.6f
1 0.1 10cd 11.6c 13.3d 13.3e 13.3e
2 0 0d 0d 5de 8.3ef 16.6e
2 0.1 28.3ab 31.6ab 35abc 36.6cd 41.6cd
NAA 1 0 26.6ab 30ab 35abc 43.3bc 45c
1 0.1 30a 36.6a 40ab 48.3b 55b
2 0 16.6bc 21.6b 43.3a 58.3a 66.6a
2 0.1 16.6bc 31.6ab 43.3a 61.6a 73.3a
Ket : Tanda huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) 5 %.
30
Gambar 14. Kotiledon yang Membentuk Kalus Embriogenik Pada 39 HST
Jumlah Eksplan yang Menghasilkan Embrio dan Jumlah Embrio
Hasil uji F menunjukkan bahwa perlakuan jenis dan taraf konsentrasi auksin berpengaruh nyata terhadap jumlah eksplan yang menghasilkan embrio dan jumlah embrio per eksplan. Perlakuan kombinasi antara jenis dan taraf konsentrasi auksin dengan taraf konsentrasi BAP saling berinteraksi dan interaksi tersebut memberikan pengaruh terhadap jumlah eksplan yang menghasilkan embrio (Tabel 8). Eksplan menghasilkan embrio pada hari ke-39 setelah tanam (Gambar 15).
Gambar 15. Eksplan yang Menghasilkan Embrio Somatik (Fase Globular) Perlakuan 1.0 mg/l NAA Tanpa BAP Pada 39 HST
Tabel 8. Rekapitulasi Sidik Ragam Jumlah Eksplan yang Menghasilkan Embrio dan Jumlah Embrio per Eksplan Pada 42 HST.
Ket : tn tidak berbeda nyata pada taraf 5 ** berbeda nyata pada taraf 1%
t
data ditransformasi dengan rumus √x 0.5
Peubah Auksin BAP Interaksi KK (%)
Jumlah Eksplan yang
menghasilkan embriot ** tn ** 2.18
Perlakuan kombinasi jenis dan konsentrasi auksin dengan konsentrasi BAP berinteraksi kemudian memberikan pengaruh terhadap jumlah eksplan yang menghasilkan kalus embriogenik. Berdasarkan hasil uji lanjut yang disajikan pada Tabel 9, embrio somatik berhasil diinduksi pada perlakuan 1.0 dan 2.0 mg/l NAA baik secara tunggal maupun dikombinasikan dengan 0.1 mg/l BAP, 2.0 mg/l picloram + 0.1 mg/l BAP, dan 1.0 mg/l 2,4-D + 0.1 mg/l BAP. Penggunaan jenis auksin NAA dengan konsentrasi 1.0 dan 2.0 mg/l memberikan respon tertinggi terhadap jumlah eksplan yang menghasilkan embrio dibandingkan dengan penggunaan jenis auksin 2,4-D dan picloram. Eksplan yang menghasilkan embrio pada perlakuan 1.0 dan 2.0 mg/l NAA tanpa BAP yaitu sebesar 12 eksplan. Perlakuan 1.0 mg/l 2,4-D + 0.1 mg/l BAP menghasilkan jumlah yang terkecil yaitu 1 eksplan. Embrio somatik yang terbentuk ditunjukkan pada gambar 16 dan 17. Data yang disajikan pada Tabel 9 membuktikan bahwa jenis auksin NAA mampu untuk menginduksi terbentuknya embrio somatik tetapi jumlah embrio somatik yang terbentuk masih sangat rendah. Tingkat keberhasilan embrio somatik yang terbentuk pada perlakuan jenis auksin NAA hanya sebesar 7%. Hal ini diduga karena taraf konsentrasi NAA yang digunakan kurang tinggi sehingga embrio somatik yang terbentuk masih sangat sedikit. Menurut Tabei et al. (1991), embrio somatik dapat diinduksi pada tingkat konsentrasi auksin yang tinggi. Berdasarkan hasil penelitiannya embrio somatik dapat terbentuk dari eksplan kotiledon dengan menggunakan 1.0 - 2.0 mg/l 2,4-D, 3.0 - 10.0 mg/l NAA dan 30.0 – 100.0 mg/l IAA.
Tabel 9. Pengaruh Interaksi Taraf Konsentrasi Auksin dan BAP Terhadap Jumlah Eksplan yang Menghasilkan Embrio Pada 42 HST
Auksin BAP (mg/l)
0 0.1
Tanpa auksin 0.70 d (0) 0.70 d (0)
2.4-D 1.0 mg/L 0.70 d (0) 0.71 cd (1/60 eksplan) 2,4-D 2.0 mg/L 0.70 d (0) 0.70 d (0)
Picloram 1.0 mg/L 0.70 d (0) 0.70 d (0)
Picloram 2.0 mg/L 0.70 d (0) 0.74 bc (3/60 eksplan) NAA 1.0 mg/L 0.77 a (6/60 eksplan) 0.75 ab (3/52 eksplan) NAA 2.0 mg/L 0.77 a (6/60 eksplan) 0.73 ab (2/60 eksplan)
32
[image:55.612.271.402.267.430.2]
Gambar 16. Embrio Somatik Pada Fase Globular (A), Fase Jantung (B). Garis pada gambar = 1.00 mm
Gambar 17. Embrio Somatik Pada Fase Torpedo dengan Pengamatan Secara Mikroskopis dengan Menggunakan Mikroskop Cahaya dan Pembesaran 40x. Garis pada gambar = 1.00 mm
Menurut Wattimena et al. (1992), zat pengatur tumbuh auksin maupun sitokinin sangat diperlukan dalam embriogenesis. Perbandingan nisbah auksin dengan sitokinin yaitu konsentrasi auksin dalam media harus lebih tinggi dibandingkan konsentrasi sitokinin. Hal ini sejalan dengan hasil penelitian Oridate
et al. (1986) yang melaporkan bahwa 1.0 mg/l 2,4-D yang dikombinasikan dengan 0.1 mg/l BAP berhasil menginduksi embrio somatik melon dari biji tua. Pada percobaan 2 ini diperoleh hasil yang berbeda dari penelitian yang dilakukan sebelumnya, perlakuan jenis auksin NAA tanpa dikombinasikan dengan sitokinin (BAP) mampu untuk menginduksi embrio somatik. Hal ini diduga bahwa terdapat sitokinin endogen pada eksplan sehingga embrio somatik dapat terbentuk, meskipun media hanya ditambahkan NAA secara tunggal.
Perlakuan jenis auksin (2,4-D, picloram dan NAA) serta taraf konsentrasi auksin berpengaruh nyata terhadap pembentukan embrio somatik. Hal ini di tunjukkan oleh hasil uji lanjut Duncan yang disajikan pada Tabel 10. Pada Tabel 10 dapat dilihat bahwa embrio somatik dapat diinduksi pada perlakuan jenis auksin 2,4-D dengan konsentrasi 1.0 mg/l, jenis auksin picloram dengan konsentrsi 2.0 mg/l dan jenis auksin NAA dengan konsentrasi 1.0 dan 2.0 mg/l. Penggunaan NAA dengan konsentrasi 2.0 mg/l menghasilkan jumlah embrio per eksplan tertinggi dibandingkan penggunaan auksin 2,4-D dan picloram yaitu sebesar 1.47 embrio/8 eksplan. Jumlah embrio terkecil dihasilkan oleh perlakuan 1 mg/l 2,4-D yaitu hanya sebesar 1 embrio/eksplan.
Auksin mendorong pembentukan sel embriogenik, dengan menginisiasi perubahan aktivitas gen dan juga meningkatkan populasi dari sel embriogenik melalui pembelahan sel secara terus-menerus. Perubahan sel dihentikan secara serentak oleh auksin lalu sel akan berkembang menjadi embrio (Gray, 2000).
Tabel 10. Pengaruh Jenis dan Konsentrasi Auksin Terhadap Jumlah Embrio per Eksplan
Jenis dan taraf Auksin Jumlah embrio per Eksplan Tanpa auksin 0.70 d (0)
2,4-D 1 mg/l 0.79 cd (1 embrio/eksplan) 2,4-D 2 mg/l 0.70 d (0)
Picloram 1 mg/l 0.70 d (0)
Picloram 2 mg/l 1.02 bc (1.33 embrio/3 eksplan) NAA 1 mg/l 1.25 ab (1.33 embrio/9 eksplan) NAA 2 mg/l 1.35 a (1.47embrio/8 eksplan)
Ket : Tanda huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) 5%
( ) angka dalam kurung merupakan rata-rata jumlah embrio somatik/total eksplan yang menghasilkan embrio.
Persentase Kotiledon Berakar
34
[image:57.612.128.501.304.538.2]A B
Gambar 18. Kotiledon Berakar Pada Perlakuan 1.0 mg/l Picloram Secara Tunggal dan Perlakuan 1.0 mg/l Picloram + 0.1 mg/l BAP (B) Pada 18 HST
Tabel 11. Rekapitulasi Sidik Ragam Persentase Kotiledon Berakar
Hari Pengamatan Auksin BAP Interaksi KK (%)
3 HSTt ** ** ** 57.97
6 HSTt ** tn tn 32.51
9 HST ** ** ** 31.24
12 HST ** ** ** 22.69
15 HST ** ** ** 17.80
18 HST ** ** ** 20.61
21 HST ** ** ** 25.55
24 HST ** ** ** 18.74
27 HST ** ** ** 17.60
30 HST ** ** ** 19.54
33 HST ** ** ** 17.72
36 HST ** ** ** 17.52
39 HST ** ** ** 17.11
42 HST ** ** ** 17.20
45 HST ** ** ** 17.11
Ket : tn tidak berbeda nyata pada taraf 5% ** berbeda sangat nyata pada taraf 1%
t
data ditransformasi dengan rumus √x 0.5
akar yang tumbuh, pada media tanpa auksin eksplan hanya memiliki 1 sampai 2 akar, namun pada perlakuan media dengan penambahan picloram akar tumbuh dalam jumlah yang sangat banyak (Gambar 19).
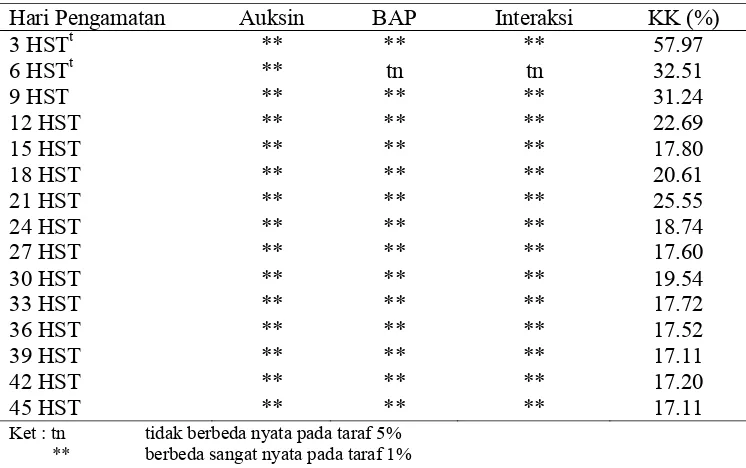
Gambar 19. Perbedaan Pertumbuhan Akar Pada Eksplan: (A) Perlakuan Tanpa Auksin, (B) Perlakuan Jenis Auksin Picloram Tanpa BAP.
Berdasarkan hasil uji lanjut yang disajikan pada Tabel 12, perlakuan 1.0 mg/l picloram tanpa BAP menghasilkan jumlah pembentukkan akar tertinggi dibandingkan dengan perlakuan lainnya. Jumlah eksplan yang berakar pada perlakuan 1.0 mg/l picloram tanpa BAP yaitu sebesar 98.3% mulai 33 HST.
Tabel 12. Interaksi Taraf Konsentrasi Auksin (2,4-D, Picloram dan NAA) dengan Sitokinin (BAP) Terhadap Rata-rata Persentase Kotiledon Berakar Auksin BAP Waktu Pengamatan HST (Hari Setelah Tanam) ……….mg/L………. 9 21 33 45 Tanpa auksin 0 0 48.3 c 73.3 b 73.3 bc 73.3 c
0 0.1 18.3d 65 bc 65 c 65 c 2,4-D 1 0 0 e 1.6 e 10 e 10 e 1 0.1 0 e 0 e 1.6 e 1.6 e 2 0 0 e 0 e 0 e 0 e 2 0.1 0 e 0 e 0 e 0 e Picloram 1 0 85 a 96. 6a 98.3 a 98.3 a
1 0.1 1.6 e 56.6 c 76.6 bc 85 b 2 0 68.3 b 76.6 b 81.6 b 83.3 b 2 0.1 6.6 e 25d 38.3 d 43.3 d NAA 1 0 0 e 0 e 0 e 0 e
1 0.1 0 e 0 e 0 e 0 e 2 0 0 e 0 e 0 e 0 e 2 0.1 0 e 0 e 0 e 0 e
Ket : Tanda huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) pada taraf 5%
36
Kesimpulan
Pada percobaan 1 kombinasi perlakuan jenis media MS, B5, dan WPM dengan taraf konsentrasi 2,4-D: 0, 0.5, 1.0, dan 1.5 mg/L belum mampu untuk menginduksi embrio somatik dari eksplan biji muda. Respon yang diberikan oleh eksplan adalah biji berkecambah dan berkalus. Kalus yang dihasilkan merupakan kalus embriogenik.
Pada percobaan 2 terdapat interaksi antara auksin (2,4-D, picloram, dan NAA) dengan sitokinin (BAP) yang memberikan pengaruh terhadap eksplan yang membentuk kalus embriogenik dan menghasilkan embrio somatik. Jenis auksin NAA dengan konsentrasi 2.0 mg/L secara tunggal maupun dikombinasikan dengan BAP, menginduksi eksplan membentuk kalus embriogenik tertinggi dengan rata-rata persentase kalus embriogenik masing-masing sebesar 66.6 % dan 73.3%. Perlakuan jenis auksin NAA dengan konsentrasi 1.0 mg/L dan 2.0 mg/L baik secara tunggal maupun dikombinasikan dengan 0.1 mg/L BAP, mampu menginduksi embrio somatik dan memberikan hasil yang tidak berbeda nyata. Jumlah eksplan yang menghasilkan embrio somatik tertinggi yaitu pada perlakuan 1.0 mg/L dan 2.0 mg/L NAA tanpa dikombinasikan dengan BAP masing-masing sebesar 6 eksplan. Jumlah embrio per eksplan tertinggi terbentuk pada perlakuan 2.0 mg/L NAA yaitu sebesar 1.35 embrio.
Saran Berdasarkan hasil yang didapat perlu dilakukan :
DAFTAR PUSTAKA
Abidin, Z. 1983. Dasar-dasar Pengetahuan Tentang Zat Pengatur Tumbuh. Angkasa. Bandung. 84 hal.
Ashari, S. 1995. Hortikultura Aspek Budidaya. Edisi Revisi. Universitas Indonesia Press. Jakarta. 490 p.
Bajaj, Y. PS. 1994. Somatic Hybridization in Crop Improvement Spriag Verlag, New York.
Bayuardi, W. 2006. Karakteristik dan Hibridisasi Beberapa Genotip Melon Untuk Pemuliaan Kearah Pembentukkan Varietas Hibrida Unggul. 29 hal.
Beyl, C. A. 2005. Getting started with tissue culture: media preparation, sterile technique, and laboratory equipment, p.19-37. In R. N. Trigiano and D. J. Gray (eds.). Plant Tissue Culture Concepts and Laboratory Exercises. CRC Press. Florida
Chee, P. P. 1990. High frequency of somatic embryogenesis and recovery of fertile cucumber plants. HortSci. 25(7):792-793.
Conger, B. V. 1980. Cloning agricultural plants via in vitro technique. CRC Press Inc. Florida. 11-22 p.
Departemen Pertanian. 2008. Basis Data Produksi Tanaman Hortikultura. Pusat Data dan Informasi Pertanian. [03 Desember 2009]
http://www.dibuah.hortikultura.deptan.go.id.
Dodds, J. H. and L. W. Roberts. 2002. Experiments In Plant Tissue Culture. 3rd Edition. Cambridge University Press. Australia. 101-110 p.
Dodeman V. L. G. Oucreux, and M. Kreis. 1997. Zygotic embryogenesis versus somatic embryogenesis. J. Exp. Bot. 48(313):1493-1509.
Extonet. 1995. Streptomycin.
George, E. F. P. D. Sherrington. 1984. Plant Propagation by Tissue Culture.
Hanbook and Directory of Commercial Laboratories. Exegenics Ltd., England.
Gonsalves, C., B. Xue, dan D. Gonsalves. 1995. Somatic embryogenesis and regeneration from cotyledon explants of six squash cultivars. HortSci. 30(6): 1295-1297
Gray, D. J. 2000. Somatic embryogenesis from seeds of melon. p 205-211.In R. N. Trigiano and D. J. Gray (eds.). Plant Tissue Culture Concepts and Laboratory Exercises. CRC Press. Florida.
Gunawan. L. W. 1992. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan Tanaman. PAU Bioteknologi IPB. Bogor. 252 p.
Hennen, G. 1983. The basic of plant tissue culture. Aroideana. 6(2):43-48.
Kageyama, K., K. Yabe and S. Miyajiyama. 1991. Somatic embryogenesis in suspension culture of mature seed of Cucumis melo L. J. J. Breed. 41:273-278.
Kuijpers, A., H. Bouman, and G. J. Klerk. 1996. Increase of embryogenic callus formation in cucumber by initial culture on high concentration of 2,4- dichloropenoxyacetic acid. Plant Cell, Tissue and Organ Culture. 46:81- 83.
Ladyman, J. A. R and B. Girard. 1992. Cucumber Somatic Embryo Development on Various Gelling Agents and Carbohydrate Sources. HortScience. 27(2):164-165.
Litz, R. E. 1985. Somatic Embryogenesis in Tropical Fruits Trees. In Henke, R.R.,
Hughes, K. W., Costantin. M. J., Hollaender, A. (Eds.) Tissue Culture in Forestry and Agriculture, Plenum Press, New York and London P. 179-193.
Mariska, I. 1996. Embriogenesis somatik tanaman kehutanan. Prosiding Kursus Bioteknologi, 4-9 November 1996. Badan, Pengkajian dan Teknologi. Serpong. 13 hlm.
40
Prajnanta, Final. 2002. Melon. Penebar Swadaya. jakarta. 163 p.
Purnamaningsih, R. 2002. Regenerasi tanaman melalui embryogenesis somatik dan beberapa gen yang mengendalikannya. Bul. Agrobio 5(2):51-58.
Tabei, Y., T. Kanno, and T. Nishio. 1991. Regulation of organogenesis and somatic embryogenesis by auxin in melon, Cucumis melo L. Japan. Plant Cell Reports. 10:225-229
Torres, K. C. 1989. Tissue Culture Techniques for Horticultural Crops. Chapman & Hall. New York. 285 p.
Trigiano, R. N. and D. J. Gray. 1996. Plant Tissue Culture Concepts and Laboratory Exercise, First Edition, CRC Press LCC. Boca Raton, Florida.
Setiadi dan Parimin, 2001. Bertanam Melon(Edisi Revisi). Penebar Swadaya, Jakarta.
Sobir. 2007. Berita Resmi PVT Pendaftaran Varietas Hasil Pemuliaan Tanaman. Departemen Pertanian.
Wattimena, G. A. 1988. Zat Pengatur Tumbuh Tanaman. PAU IPB-LSI IPB. Bogor. 247 p.
Wattimena, G. A., L. W. Gunawan, N. A. Mattjik, E. Syamsudin, N. M. A. Wiendi, A. Ernawati. 1992. Bioteknologi Tanaman. PAU-IPB. Bogor. 309 p
Werbrounds, S. P. O. and P. C. Deberg. 1993. Applied Aspect of plant Regeneration. P. 127-135. In Rickwood, D. and Hames (Eds). 1996. Plant Cell Culture A Practical Approach. Oxford. Univ. Press. Oxford.
Wetherell, D. F. 1982. Pengantar Propagasi Tanaman Secara In Vitro. IKIP. Semarang Press. Semarang. 110 hal
42
[image:65.612.130.511.94.539.2]
Tabel lampiran 1. Komposisi larutan stok media MS (Gunawan, 1992)
Stok Bahan kimia
Konsentrasi d