BERKAS
BERKAS
BERKAS
BERKAS SOAL
SOAL
SOAL
SOAL
BIDANG
BIDANG
BIDANG
BIDANG STUDI
STUDI
STUDI
STUDI :::: KIMIA
KIMIA
KIMIA
KIMIA
MADRASAH
MADRASAH
MADRASAH
MADRASAH ALIYAH
ALIYAH
ALIYAH
ALIYAH
SELEKSI
SELEKSI
SELEKSI
SELEKSI TINGKAT
TINGKAT
TINGKAT
TINGKAT KAPUPATEN/KOTA
KAPUPATEN/KOTA
KAPUPATEN/KOTA
KAPUPATEN/KOTA
KOMPETISI
KOMPETISI
KOMPETISI
KOMPETISI SAINS
SAINS
SAINS
SAINS MADRASAH
MADRASAH
MADRASAH
MADRASAH NASIONAL
NASIONAL
NASIONAL
NASIONAL
2013
Y
ASALSEKOLAH: KABUPATEN/KOTA:
PetunJuk Umum
1.
Pastikan bahwa namadan asal
sekolah,Anda
sudahterfulis pada
setiap halaman lembar j awaban.2.
Anda mempunyai waktuI
jam
30menit
(90 menit) untuk mengerjakan soal.Mulailah ketika aba-aba MLTLAI diberikan.
3.
Tipe soal pada BagianI
TesTeori
Bidang
Kimia
KsM
2013ini
adalah 40pilihan
berganda dengantotal nilai:
160poin.
Pilihlah salah satu jawabanyang paling tepat dan tuliskan dalam remb:ujawaban yang disediakan.
4.
Jawaban yangbenar
diberi nilai 4
poin, jawaban kosongnllainya
0,
dan jawaban yang salahdiberi nitai
-L poin.5.
Gunakan halaman kosong di balik kertas untuk coret-coretan.6.
Jika ada reaksi pada fasa gas, maka perlakukan semuanya sebagai gas ideal.7.
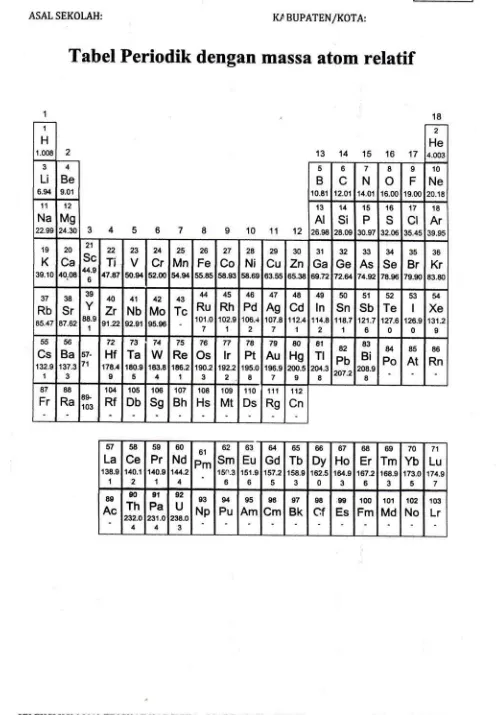
Tabel periodik unsur dan massa atomrelatif
serta tetapan dan rumus yang mungkin diperlukan untuk menyelesaikan soal tersedia di halaman2
dan3.8.
Anda harus segera berhenti bekerja bila aba-abaBERIIENTI
diberikan.Bila
tidak mengindahkan, berkas Anda tidak akan dinilai.9.
Berkas soal dikembalikan ke panitia.10. Apabila ada hal'hal yang kurang jelas atau perlu ditanyakan, silakan langsuug
berknya kepada pengawas ujian.
;
NAMA
:ASAL SEKOLAH: ruBUPATEN/KOTA:
Tabel
Periodik
dengan
massa
atom
relatif
18
I H
1.008 2
13 14 15 16
172 He {.003 3 Li 6.94 4 Be 9.0r
3456789101112
5 B 10.81 6c
12.01 7 N 14.01I
o
16.00I
F 19.00 10 Ne 20.18 11 Na 22.99 12 Mg 24.30 13 AI 26.98 11 Si 28.09 15 P 30.97 16 S 32.06 17cl
35.45 18Ar
39.95 19 K 39.10 20 Ca {0.08 21Sc
14.9 6 22 Ti 17.9t 23V
50.94 24Cr
52.00 25 Mn 54.94 26 Fe 55.85 27 Co 58.St 28 Ni 58.698
Cu 63.55 30Zn
65.38 31 Ga ,9.72 32 Ge n.a4 33As
74-flr2 34 Se 78.96 35Br
79.90 36Kr
83.80 37 Rb 85.47 38Sr
87.62 39Y
88.9 1 40Zr
$.n
41 Nb 92.s1 42 Mo 95.96 43Tc
4
Ru 101.0 7 45 Rh 102.9 1 46 Pd 106.4 2 47Ag
107.8 7 rt8cd
112.4 1 49 ln 114.8 2 50 Sn 1't8.7 1 5l Sb 121.7 6 52Te
127.6 0 53 I 126.9 0 54Xe
131.2I
55 Cs 132.9 I 56 Ba 137.3 3 i7-l1 ?2Hf
178.4 I 73Ta
180.9 5 71W
183.8 1 75 Re 186.2 1 76 Os 190.2 3 77lr
192.2 2 78Pt
'195.0 I 79 Au 196.9 7 80 Hg 200.5 I 8t TI 204.3 I 82 Pb 207.2 83 Bi 208.9 Iu
t:
i
85 861n
87
Fr
88
Ra 89.103 104
Y
105 D-b 108 Sg 107 Bh 108 Hs 109 Mt r10 Ds 111 Rg 112 57 La 138.9 1 58 Ce 140.1 2 59Pr
140.9 1 60 Nd 141.2 4 6'l Pm 62 Sm 150.3 6 63 Eu '15r.9 6 64 Gd 157.2 5 65Tb
r58.9 3 66 Dy 162.5 0 67 Ho t&f.9 3 68Er
167.2 6 69 Tm 168.9 3 70Yb
173.0 5 71 Lu 174.9 7 89t"
90Th
232.O 4 e1 Pa 231.0 4 92 U 238.0 3 03 Np 94'.,
95OT
g6 Cm 97 BK 98cf
;0t) Es .t00 FM 101 Md 102 No 103Lr
ASAL SEKOLAH: KABUPATEN/KOTA:
Tetapan dan
Rumus
Pada
perhinngan
tetapan kcsotimbsngar., sornua konsenuasi dianggap ecbagai konsentrasi standard,yaittr
I
M.
fuiggap
semuo gas bersifat ideal dalam semua soal yang berhubungan dengangas.
Tekanan: 1atm:
101325 Pa;I
bar=
100 kPa.R = 8,314 J.mol-1.Kl = 0,082 L.atm. mol-1.K-1
F = 96485 C.mol-l
Sa= 6,022'!0" mol-' c = 2,9979'108 m.s-l
h = 6,62.10'* J.s (Tetapan Planck) 1eV = L,6022'tO'" J
&
= 1,312. 103 U.mol-l(Tetapan Bohr)p.Y
=n.R.T
LH
=LU
+t(pf)=
L(J+
LnrRT
M
-I-t.
m=-z.F
11
-=--6-+k.t
cl
cAAG=
LGe +R7^lrr.Qlnc,
=tnc)
-
lc't
cr=c)-k.t
LGo:-RfhK
rnk<',) =
k*r,
Eu(
L-
1)
n
\z\
T,)
E
=Ee
-L'!.no
z.F
AGo =
N{o
-TdlS,
hrrrtar
-AHR(l -1']
K
rr^,
.i?
(4
T,)
AGa =
-z.F.Eo
NAMA
:ASAISEKOI.AH: KABUPATEN/KOTA:
Gas
mulia
xenon ditemukan pertamakali
tahun1962,
gas tersebut dapat bersenyawa dengan platina danfluor,
Jika
suatu senyawa tersebut terdiridan 30%xe,44Yo Pt dan 26yoF,maka rumus empiris senyawa tersebut
A.
XePtFB.
XePtFrC.
XePtF5D.
XePtFoE.
XePtFrsebanyak 156,0
g
sampel*nsur
X
dicampur dengansilikon,
membentuk 268,3 g senyawa XlSi+ murni. Massa atomX
adalahA.
48B.
52c.
55D.
s7E.
59senyawa
Lxo3
sebanyak
4t,9020gram dalam keadaan kering dan murnidipanaskan membentuk r,gz00
gram
gas oksigen dan padatanLX
sebanyak 2,982a gram. Jikapadatanrx
ditambahkan AgNo3, terjadi reaksi sempurna membentukAgX
sebanyak 5,7380 gmm. Massa atom relatifL
danX
adalahA.
L=39,10dan X=?0,90
B.
L:39,10
danX:35,45
C.
L:22,99
danX
= 70,90D.
L=22,99
danX
=35,45E.
L=39,10dan
X:79,g0
Suatu sel
elektokimia
disusun dengan menggunakan elekhodacu
dalamlanrtan
cu(ID
dan elektoda
Ni
dalam larutan
N(II)
sedemikian rupa sehingga reaksi redoks terjadi secara spontan. Diketahui:E,*r*l*:
*0,34V
dan
Pr,'*t*,:
-0,25
V.
Jika konsentrasi ionCu(II)
ditingkatkan padasuhu tetap, maka pengaruhnya terhadap E
"7sel elektrokimia tersebut adalah
A.
Tidak ada perubahan pada nilai Eo"7B.
Tidak cukup informasi untuk menentukan perubahan nlraiEr"1
C.
Nilai.E"ar meningkatD.
Nilai
E"a berkurangE.
Nilai
d,,=
gY
ASAL SEKOLAH: KABUPATEN/KOTA;
5
Suatu sel elektrokimia dirangkai sebagaimana gambar di bawah ini.I ti u H(:t I ti H f.{{NAt}:
Diantara femyataan berikut yang tepat mengenai perubahan yang terjadi pada anoda dan katoda ketika sel tersebut dioperasikan adalah
Setengatr-sel oksidasi Setengah sel reduksi
A
massa elekhoda bertambah massa elektroda berkurangB
[HrO.]
bertambah massa elel:troda bertambahC [HgO-] bertambah massa elektroda berkurang
D
tH3O'l
berkurang massa elektroda bertambatrE [HsO-] berkurang massa elekhoda berkurang
Elektolisis
umum
digunakanuntuk
mendapatkan logarnmurni dari
ion-ionnya. Suahr percobaan dilakukan dengan memberikan arus sebesar3 A
selama 2jam
terhadap larutanion
logalnX
yang bermuatan +2.Di
akhirpercobaan, didapatkan logam
X
sebanyak7,Ll
g. LogamX
tersebut adalahA.
BaB.
Ni
C.
SrD.
Cu:
E.
Mn
Persamaan reaksi
kimia
yang teparuntuk
merunjukkan kesetimbangan esdan air pada suhu 0 oC adalah
A.
HzOt'l <+ H2QU <+ HzotetB.
HzO<rl.c+ HzGl + OzG)C.
Hzotrl <+ H2O6f
energiD.
H2O1sy*
energi <+ H2C11E.
H2O1,; <+ H2O111c+ Hz(gl + OzG)NAMA
:ASALSEKOI,AH:
Pada suhu tertentu, dalam wadah bervolum
I
L
12 masing-masing sebanyak 2,0mol.
pada saat mol gas HI.Nilai
IQ reaksi tersebut sebesarA.
5,10x
l0-3B.
8,75x
l0-rC.
3,06x
l0oD.
5,60x
l0r
E.
1,96x
102KABUPATEN/KOTA:
dimasukkan gas Hz dan gas kesetimbangan terdapat 3,5
AHo:
-214kl/mol
AHo:38
kJ/mol9
Kelanrtan molar magnesium hidroksida (/(rp = gx
10-121 dalanr suatu larutanpenyangga dengan pH
=
II
sebesarA.
1,7x
10{M
B.
1,0x
l0-ll
M
C.
8,0x
10-12MD.
8,0'x 10-eME.
8,0x
10-6Ml0
Iz G)*
3 Cl2 61-+
2 ICl3 1.;Iz(r)$
IztelPerubahan entalpi standar pembentukan yod
triklorida
IClr adalahA.
L76kJlmolB.
138 kJ/molC.
-88
kJlmolD.
-138
kJ/motE.
-zl4kJ/mol
1l
Bila 2,3 g dimetil eter(Mr:46)
dibakar pada tekanan tetap, kalor yang dilepaskan adalatr 82,5 kJ. Berdasarkan data ini, kalor pembakaran dimetil eter adalahA.
-413
kJ/molB.
+825 kJ/molC.
-825
kJ/molD.
+1650 kJ/molE.
-1650kl/mot
ASAL SEKOI.AH:
Diketahui peniamaan termokimia berikut
Czfl+tct + 3 O21g1
-+
2 CO2G1 + 2 HzOst2
C2H661+ 7 Ozrc)'+
4
CO2sy+
6WOot
2Hz@)
+
OzG)+
2HzOrr)Perubahan entalpi untuk reakri berikut adalah
Czll+et
+
HzGt
-)
C2H6G;A.
-420
kJB.
-270kJ
c.
-13s
kJD.
+285 kJE.
+420kJKABUPATEN/KOTA:
t2
AHo:
-1400 kJAHo:
-3100 kJAHo:
-570
kJ13
Diketahui energi ikatan:C=C
:
614 kJ/mol;C-Cl :328
kJ./mol;C*C
:348
kJ/mol;Cl-Cl
=
244 kJ/mol;C-H
:413
kJ/molPerubatran entalpi bagi reaksi berikut adalah
H2C=CH21gy
+
Cl21gy-+
CIHzC-CHzCIA.
-31
kJB.
-62W
c.
-93
kJD.
-124H
E.
-146
kJ14
Nitrogen Oksida bereaksi dengan Hidrogen pada suhu tinggi menurut persamaan2NO1O
+
2}{z<s)-+ Nztg)+
2H2O61Jika pada waktu tertentu laju reaksi l{itrogen Oksida 0,36 mol
L
I S'1, maka laju reaksi gas Nitrogen adalahA.
0,09 molUr
S-rB.
0,18 molL-l
S-rC,
0,36 molL'l
S-rD.
0,54 molL'r
S'rE.
0,72 molUr
S'rNAMA
ASALSEKOI..AH: KABUPATEN/KOTA:
Pada reaksi:
H2O2
+
2f
+
2H+ -+
2HzO+
IzJika konsentrasi
H:oz
berubah dari 1,00M
menjadi 0,95M
daramwaktu 100 detik, maka perubahan laju reaksiI-dalam
M.detik-r adalahA.
0,500B.
0,200c.
0,050D.
0,010E.
0,001PadareaksiCl26l
+
2NO61-+
2NOCle)Jika konsenfasi kedua pereaksi diperbesar
2kali
laju reaksi menjadi g kali semula. Jika hanya konsentrasicl2lang
diperbesar2kali,laju
reaksi menjadi 2kali
semula. Maka orde reaksi NO adalahA.0
B.%
c.
I
D.2
E.3
l7
Oksidasi NO menjadi NO2 menwut reaksi 2NO19+
Ozte)-+
2NO21g;Memberikan data berrkut
Nilai X
dalam tabel adalahA.
3,65B.
14,20c.
29,40D.
56,90E.
95,2015
16
SELEKST KSM 2013 TTNGKAT KAB/KOIA - MADRASATI ALTYAH
Percobaan
[oz],
M
[NO],M
Laju NOz (lvl/det)I 0,001 0,001 7,10
2 0,004 0,001 28,40
3 0,004 0,003 255,6
4 0,002 0,002
x
ASAISEKOLAH: KABUPATEN/KOTA:
18
Berdasarkan datatitik
didih berikut, urutan kekuatan interaksi molekularuntuk senyawa-senyawa di bawah
ini
adalatrTitik didih
PC)
Etanol. CzHsOH 78-4
Etilen
slikol.
Cr[L(OH],
197.2Air,
HzO 100,0Dietil
eter. CalLoO 34.5A.
dietil eter < etanol < etilenglikol
< airB.
air < etanol < etilenglikol
< dietil eterC.
dietil eter < etanol < air < etilenglikol
D.
etilenglikol
<dietil
eter < etanol < airE.
etanol < air < dietil eter < etilenglikol
Diketahui struktur molekul XCl3 adalah segiitiga piramida. Pada sistem periodilq unsur
X
berada pada golonganA.3
B.5
c.
13D.
15E.
r7Senyawa di bawah ini yang bersifat polar adalah
A.
NlI4*
B.
SbclsC.
Ir-D.
ClOt
E.
SnCl+Pernyataan berikut berkaitan dengan molekul NHg dan
NFI
1.
NHr
lebih mudah larut dalam air dibandingkan dengan NF32.
Hibridisasi atomN
pada kedua molekul tersebut adalah sp33.
Sudut ikatan pada molekul NH3(ZH-N-H)
lebih kecil dibandingkan dengan molekul NF3(ZF-N-F)
4. Titik
didih molekulNH:
lebih kecil dibandingkan dengan NF3 Pemyataan yang benar adalahA.
1dan2
B.
I
dan3C.
2
dan4D.
3 sajaE.
4 saja 1920
2t
NAMA
:ASALSEKOI,AH: KABUPATEN/KOTA:
22
r
Kelarutan Pbclz dalam larutan HCI lebih besar karenaA.
Efek ion senamaB.
PbClz lebih mudah terionisrsi dalam suasana asamC.
Pembentukan senyawa kompleks[PbCL]2-D.
PbCt2 be,r.iifat basaE.
HCI lebih polar dibandingkan air.Diketahui Ksp
AgI
= 8,3x
10-17 dan Ksp PbI2:
7,9x
10-e. Konsentrasif
minimum yang diperlukan untuk mengendapkan ion Ag* dalam suatu Iarutan yangmengandung campuran ion Ag* (0,1
M)
dan pb2* (0,1M)
adalah
A.
8,30x
10-16M
B.
9,1I
x
10-eM
C.
7,90x
l0'8M
D.
2,80x
104M
E.
1,99x
1O3M
Diketahui K6NH3
:
1,8x
l0-5 dan Ks HC2H3O2=
1,8x l0-5.
Nilai
pH dari lanrtan amonium asetat, NI{4C2H3O2 0,065M
adalahA.
l,1g
B.
2,96c.
7,00D.
I1,06E.
12,91Suatu larutan buffer sebanyak 1 L mengandung campuran 0,14
M
HCzH:Oz dan0,27M
CzHlOf
. DiketahuiK
HCzHrOz=
1,8x
10-s.Nilai
pH lamtan buffer tersebut setelah ditambah 0,025 mol HCI adalahA.
0,85B.
1,15c.
4,92D.
5,03E.
6,74 2324
25
26
ASAL SEKOI,AH: KABUPATEN/KOTA:
Dalam perkembangan teori atom tercatat beberapa hal berikut:
1)
Percobaan Rutherford membuktikan bahwa muatanpositif
terkonsentrasi pada pusat bola atom2)
Postulat Bohr merupakan perumusrrn kuantitatif pertama tentang sfiukttrr atom3)
Data-data spektnrm selain atom hidrogen diperoleh dari hasilpercobaan Bohr
Pernyataan yang benar adalatr
A.
1,2da
3B.
I
dan2C.
2dan3
D.
I
sajaE.
3 sajaBerdasarkan
letaknya
dalam
sistem
periodik,
muatan
dan
jumlahelektronnya, maka urutan ukuran atom/ion isoelektronik di bawah ini adalah
A.
caz*>K*>
Ar
>cl->
s2-B.
s2->cl->Ar>K*>ca2*
c.
s2-> Ca2*>cl->
K*>Ar
D.
Cl->
s2-> ca2*>r*>ar
E.
c**>s2->K->Ar>cl-Pasangan unsur yang mempunyai ukurar/volume atom yang harnpir sama adalah
A.
K,
CaB.
Ti,Zt
c.
K,
RbD.
Ne,Kr
E.
Hf,Zr
29
suatu senyawamurni
terdiri
dari
c,
H, N,
o,
S dan Fe. Jumlah atom Fedalam senyawa tersebut adalah satu.
Kadar
Fe
dalam senyawa tersebut 8,09yo (w/w)- Massa molekur r,:ratif senyawa tersebut adarahA.
56B.
346c.
453D.
692E.
785 2728
NAMA
ASALSEKOI-AH: KABUPATEN/KOTA:
Perhatikan pernyataan berikut:
4)
Titik
didiMeleh uf,sur golotrgan non logam dari bawah ke atas makinbesar sebab kekuatan ikatan van der waals yang terjadi makin kuat
5)
semua senyawa logam memiliki kecenderungan untuk membentukion kompleks
6)
Keelektronegatifan unsur golongan logam dari atas ke bawah makinkecil
Pernyataan di atas benar, kecuali
A.
1,2,3B.
1,2c.
2,3D.
I
sajaE.
3 saja31
Sifat-sifat beri}ut yangbukan
sifat koloid adalahdapat mengalami koagulasi menunjukkan efek Tyndall
jikl.qengldsorpsi
ion, dapat dipisahkan dengan elektroforesisterdiri dari satu fasa menunjukkan gerak Brown
32
Senyawa yang dapat digunakan sebagai penstabil emulsi adalahA.
ZnS2B.
Natrium oleatC.
HCID.
Na2S2O3E.
Natrium asetat33
Di
antaraunsur-rmsl*
di
bawahini
yang
mempunyaiafinitas
elektron terbesar adalahA.
BeB.B
c.c
D.N
E.
NeA.
B. C. D. E.
ASAL SEKOI,AH: KABUPATEN/KOTA:
34
Dalam suasana basa, logamkobalt (Co)
dapat mengalami reaksi oksidasimenjadi Co(OH)3 sementara natrium
hipoklorit,
NaOCl,
dapat dioksidasimenjadi
NaCl.
Apabila
reaksi tersebut disetarakan maka koefisien reaksi kobalt dan NaOCI yaituA.
2
danSB.
I
dan3C.
3
dan?D. I
dzrr,2E.
3danl
35
Hidroge,n sulfat atau ion bisulfat,HSO4
dapat bertindak sebagai asam atau basadi
dalam
air.
Diantara persamaan reaksiberikut,
ion
HSO|
yang bertindak sebagai asam adalah dalam reaksiA.
HSO4 +HzO
)
HzSO+ +OH-B.
HSO4t
H3O+)
SOr + 2HzOC.
HSO+-+OH-
)
HzSOa*
Oz-D.
HSO+-+H2O
)
SO+2-*
H3O+E.
HSOr- + H3O*)
HzSOr + HzOLarutan 0,2
M
natrium klorobenzoat (NaCzH+ClO2)memiliki
pH 8,65.Nilai
pH larutan 0,2M
asam klorohenzoat (HCzILCIOz) adalahA.
5,35B.
8,65c.
2,35D.
3As
E.
3,25Warfarin
digrrnakan sebagai racun tikus. Jumlah pusatkiral
yang terdapat dalarn molekul warfarin di bawahoini adalahA.0
B.
I
c.2
D.3
E.4
36
37
OH
z
{'o
NAMA
:ASALSEKOI,AH:
38 Diantara pasangan senyawa
identik adalah
A
cH3cH2cH2cH2oHB
CH3(CHr4CH3 danKABUPATEN/KOTA:
di
bawahini,
yangmemiliki
,
dan (CH3)2CHCH2OH
(cH3)2cHcH(cHr)z
titik
didih
yangE
\gA-
dan39
Berikutini
adalah sfrukturvitamin C (asam askorbat):Ho-
'tl-
oHHo)
y'or%^
Pernyataan yang tepat menganai jumlah atom karbon
kiral
dan konfigurasi absolut atom C kiral yang terdapat pada cincin adalahA.
l
danRB.
2 danRC.
l
danSD.
2danS
E.
3 danR40
Jumlah isomer, termasuk isomer geomekinya,
yang
dimiliki
senyawaC:tLClz
adalahA.3
B.4
c.5
D.6
E.7
R
.,o..'(-I
cl
dan
cl^/cl