PENDAHULUAN
Ketahanan pangan Indonesia masih menghadapi berbagai macam persoalan seperti produksi pangan yang belum memenuhi kebutuhan nasional, daya saing produk pertanian yang lemah, menyusutnya lahan subur di pulau Jawa sebesar (100.000 ha per-tahun), terbatasnya infrastruktur, perubahan iklim, belum berkembangnya diversifikasi pangan berbasis pangan lokal dan pertumbuhan jumlah penduduk dan meningkatnya konsumsi per kapita (RISTEK, 2013).
Jumlah penduduk Indonesia yang semakin banyak mengakibatkan meningkatnya kebutuhan akan bahan pokok seperti jagung, beras, dan gandum. Gandum merupakan salah satu bahan pokok yang banyak digunakan dalam industri pangan. Volume impor gandum di Indonesia pada 2011 mencapai 5,4 juta ton dan meningkat menjadi 6,2 juta ton pada 2012 (Theresia, 2013).
Penanggulangan impor gandum yang terlalu besar dapat dilakukan dengan mengganti konsumsi tepung gandum dengan tepung sorgum. Sorgum merupakan tanaman lokal Indonesia sehingga memiliki nama yang berbeda di setiap daerah seperti
“cantel” di Jawa. Sorgum dapat tumbuh di Indonesia dengan baik dan dapat bertahan pada tanah yang kering. Sorgum (Sorghum bicolor L.) dianggap sebagai hasil panen yang paling penting di dunia diikuti dengan gandum, beras, jagung, dan jelai (FAO, 1997).
Sorgum merupakan serealia yang memiliki sifat yang unik karena toleransinya terhadap kekeringan dan adaptasinya terhadap ekosistem tropis dan subtropis yang kering. Di Indonesia, sorgum dapat tumbuh dengan baik namun penggunaannya belum optimal sehingga belum digunakan secara luas oleh masyarakat. Hal ini diakibatkan oleh teknologi pasca panen yang belum maju sehingga pengolahan dan distribusi hasil panen tidak optimal. Selama ini sorgum hanya digunakan sebagai pakan ternak dan burung.
Kurangnya variasi asam amino pada tepung sorgum dapat diatasi dengan melakukan modifikasi asam amino melalui fermentasi pada tepung sorgum dengan menggunakan bakteri Lactobacillus plantarum. Fermentasi dengan menggunakan L. plantarum dapat menyeimbangkan kandungan asam amino pada tepung (Au, 1981). Fermentasi sorgum dan penambahan dengan isolat protein kedelai dapat meningkatkan kuantitas dan variasi asam amino yang terkandung di dalam sorgum sehingga dapat meningkatkan kualitas tepung sorgum menjadi seperti tepung terigu yang selanjutnya dapat diolah menjadi berbagai produk pangan. Salah satu produk pangan yang banyak dikonsumsi masyarakat adalah roti.
Sorgum memiliki kandungan antinutrisi yaitu asam fitat dan tanin (Osman, 2004) yang dapat menghambat penyerapan karbohidrat dan protein. Hal ini dapat diatasi dengan melakukan pengecambahan dan fermentasi pada sorgum dengan bakteri L. plantarum. Mikroba ini memiliki aktivitas proteolitik (Mugula et al., 2003) dan amilolitik (Songre-Ouattara et al., 2009). L. plantarum dapat mendegradasi tannin dengan enzim tannase (Molin 2008) sehingga dapat meningkatkan penyerapan karbohidrat dan protein dalam tubuh.
Kualitas dari tepung dan produk yang dihasilkan diharapkan dapat mendekati Standar Nasional Indonesia (SNI). Kualitas tepung sorgum termodifikasi dibandingkan dengan SNI terigu (SNI 3751:2009). Tepung sorgum termodifikasi diaplikasikan pada pembuatan roti tawar, di mana kualitas sensorik dari roti tawar diuji dengan uji organoleptik.
Oleh karena itu, tujuan penelitian ini adalah:
1. Menentukan kondisi optimal dalam proses modifikasi tepung kecambah sorgum berdasarkan kandungan protein terlarut.
2. Membandingkan kadar air, kadar abu, dan protein dari tepung sorgum termodifikasi dengan SNI tepung terigu (SNI 3751:2009).
3. Membandingkan asam amino tepung sorgum termodifikasi dengan yang belum termodifikasi.
METODOLOGI
Bahan dan Piranti
Sampel sorgum (Sorghum bicolor L.), kedelai (Glycine max), biakan Lactobacillus plantarum 3704 diperoleh dari Laboratorium Penelitian Dan Pengujian Terpadu (LPPT) - UGM. Bahan kimia yang digunakan antara lain HCl (J.T Baker, Amerika), NaCl, H2SO4 (Panreac, Spanyol), dietil eter (teknis), CuSO4.5H2O, NaOH, BSA (bovine serum albumin), KNa-tartrat, asam tanat, K3Fe(CN)3, FeCl3.6H2O, H3PO4, gelatin, pepton, natrium metabisulfit. Bahan kimia yang digunakan diproduksi oleh Merck, Jerman.
Piranti yang digunakan adalah piranti gelas, ayakan aperture 250 µm mesh no. 60, drying cabinet, blender dan grinder, waterbath (Memmert WNB14, Jerman), neraca Mettler (Ohaus TAJ602, Amerika; Ohaus PA214, Amerika), moisture analyzer (Ohaus MB-25, Amerika), spektrofotometer (Optizen UV 2120, Korea Selatan), centrifuge (EBA 21 Hettich Zentrifugen, Jerman), furnace (Vulcan A-550, Amerika), high performance liquid chromatography (HPLC)(Shimadzu LC10, Jepang).
Metode
Pengkecambahan Biji dan Pembuatan Tepung Sorgum
Biji sorgum dicuci kemudian direndam dalam larutan Na-metabisulfit 3 g/L selama 12 jam. Biji yang telah direndam diletakkan di atas nampan dengan kain basah di atasnya. Biji dikecambahkan selama 5 hari kemudian dikeringkan dengan drying cabinet. Biji yang telah kering dihancurkan dengan grinder kemudian diayak dengan ayakan 60 mesh.
Optimasi Pembuatan Konsentrat Protein Kedelai (Adepoju et al., 2012 yang dimodifikasi)
Optimasi Fermentasi Modifikasi Tepung Sorgum (Pranoto, 2013 yang dimodifikasi)
Fermentasi dilakukan dengan menimbang 25 g tepung dengan penambahan isolat protein sebesar 2%, 4%, 6%, dan 50 mL larutan PPS (pepton physiological salt) yang mengandung konsentrasi bakteri L. plantarum sebesar 0,25%, 0,5%, dan 0,75%. Optimasi dilakukan dengan variasi waktu fermentasi selama 24 jam, 36 jam, dan 48 jam. Dari masing-masing sampel, diukur kadar protein terlarutnya dengan metode Biuret.
Pengukuran Kadar Protein Terlarut dengan Metode Biuret (AOAC, 1995)
Pengukuran kadar protein dilakukan dengan menambahkan 9 mL akuades dan 1 mL NaOH 1M ke dalam 0,25 g sampel dan dipanaskan dalam waterbath pada suhu 90 °C selama 10 menit, didinginkan, dan dipusingkan. Kemudian, 1 mL supernatan ditambah dengan 4 mL reagen Biuret yang sudah dibuat terlebih dahulu. Larutan diinkubasi selama 30 menit pada suhu ruang. Absorbansi diukur pada panjang gelombang 550 nm. Sebagai standar digunakan BSA dengan 10 variasi konsentrasi dari 10 mg/mL hingga 100 mg/mL. Pengukuran Kadar Air
Kadar air sampel diukur secara gravimetrik dengan menggunakan moisture analyzer Ohaus MB 25.
Pengukuran Kadar Abu (Sudarmadji dkk., 1984)
2 gram tepung sorghum termodifikasi ditimbang dalam cawan porselen yang sudah diketahui bobotnya, tepung sorghum termodifikasi dan cawan porselen dipijarkan dalam furnace pada suhu 800°C selama 1 jam (diperoleh abu berwarna putih) lalu didinginkan dalam desikator kemudian ditimbang.
Pengukuran Kadar Protein Total Metode Semi Mikro Kjeldahl (Sudarmadji dkk.,
1984)
Identifikasi dan Pengukuran Kadar Asam Amino
Preparasi sampel
Sampel sebanyak 60 mg ditambah dengan 4 mL HCl 6M dan dipanaskan selama 24 jam pada suhu 110° C. Sampel dinetralkan dengan NaOH 6M hingga 10 mL dan kemudian disaring dengan kertas saring Whatman 0,2µm. Sampel disaring dengan kertas saring whatman 0,2µl sebanyak 50µL dan ditambah larutan OPA (Orthophalaldehid) sebanyak 300µL diaduk selama 5menit selanjutnya dimasukkan ke injektor HPLC sebanyak 5µL.
Analisis Sampel
Sampel dianalisis diLaboratorium Kimia Organik Jurusan Kimia FMIPA, Universitas Gajah Mada, Yogyakarta dengan kondisi operasional sebagai berikut:
Kolom : LiChrospher-100 Rp - C18 (5µm) LiChroCART 125-4
Mobile phase : A = CH3OH : 50mM natrium asetat : THF (2:96:2) ph 6.8 B = 65% METHANOL
Flow rate : 1.5ml/menit
Detektor : Fluoresens Shimadzu RF 535
Gradien eluen
Time Pump(A)% Pump(B)%
2 100 0
35 0 100
35 0 100
Pengukuran Kadar Tanin (Umiati dkk., 1998 yang dimodifikasi)
2 g sampel dimaserasi dengan menggunakan 100 mL akuades pada suhu 80oC selama 30 menit. 3 mL larutan sampel dimasukkan ke dalam labu ukur 25 mL. Ditambahkan 1 mL larutan K3Fe(CN)3 0,016 M dan 1 mL larutan FeCl3 0,012 M. Larutan dikocok dan diinkubasi selama 15 menit. Selanjutnya, sampel ditambah 3 mL H3PO4 6,03 M. Larutan dikocok dan diinkubasi selama 2 menit. Kemudian, larutan tersebut ditambah 2 mL gelatin 1% dan akuades hingga garis tera. Absorbansi larutan diukur dengan panjang gelombang 650-750 nm. Sebagai standar digunakan asam tanat.
Aplikasi Tepung Sorgum Termodifikasi dalam Pembuatan Roti Tawar
dan garam ditambahkan dan diuleni hingga kalis. Adonan dikempiskan dan ditimbang masing-masing 180 g. Adonan dibentuk bulat dan didiamkan 10 menit. Adonan digiling tipis memanjang kemudian digulung sambil dipadatkan dan ditekan. Adonan diletakkan pada loyang 30×12×12 cm yang diolesi margarin dan dialasi kertas roti. Masing-masing loyang berisi 6 adonan. Adonan didiamkan 75 menit sampai mengembang dalam loyang, lalu dipanggang di dalam oven selama 35 menit dengan suhu 190°C.
Uji Organoleptik (Sukarto, 1985)
Uji organoleptik terhadap roti tawar mencakup warna, rasa, aroma, dan tekstur dengan skala hedonis. Sampel roti tawar diujikan kepada 30 panelis dengan kode tertentu. Skala hedonik untuk masing-masing parameter adalah: 1= sangat tidak suka, 2= tidak suka, 3= agak suka, 4= suka, 5= sangat suka.
Analisis Data
Pada analisis penentuan kondisi fermentasi optimum terdapat 3 faktor kondisi fermentasi yang diuji pengaruhnya terhadap konsentrasi protein terlarut tepung sorghum yang terfermentasi. Masing-masing faktor terdiri dari 3 aras, sehingga data konsentrasi protein terlarut dianalisis menggunakan Rancangan Perlakuan Faktorial 3×3×3 dan rancangan dasar RAK (Rancangan Acak Kelompok) dengan 3 kali pengulangan. Sebagai faktor pertama adalah konsentrasi isolat protein kedelai, 1%, 2%, dan 3%. Faktor kedua adalah konsentrasi L. plantarum, 0,25%, 0,5%, dan 0,75%. Faktor ketiga adalah waktu fermentasi, 24 jam, 36 jam, dan 48 jam. Sebagai kelompok adalah waktu analisis. Pengujian antar perlakuan dilakukan dengan uji Beda Nyata Jujur (BNJ) dengan tingkat kebermaknaan 5% (Steel dan Torrie, 1980)
HASIL DAN PEMBAHASAN
Optimasi Pengendapan Protein Kedelai
Tabel 1. Pengendapan protein kedelai dengan berbagai macam pengendap
Pengendap Rendemen protein (g)
NaOH 1M (pH 8)+MgCl2 (pH 7,1) 6,52
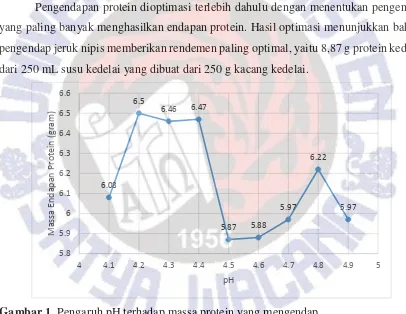
Pengendapan protein dioptimasi terlebih dahulu dengan menentukan pengendap yang paling banyak menghasilkan endapan protein. Hasil optimasi menunjukkan bahwa pengendap jeruk nipis memberikan rendemen paling optimal, yaitu 8,87 g protein kedelai dari 250 mL susu kedelai yang dibuat dari 250 g kacang kedelai.
Gambar 1. Pengaruh pH terhadap massa protein yang mengendap
Pembuatan konsentrat protein dilanjutkan dengan menggunakan pengendap asam sitrat yang merupakan asam yang identik dengan asam yang terkandung dalam air jeruk nipis. Penggunaan asam sitrat lebih efisien dan ekonomis dibandingkan dengan air jeruk nipis. Optimasi Fermentasi
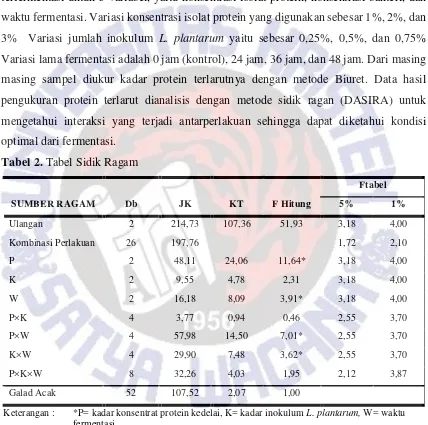
Optimasi dilakukan berdasarkan konsentrasi protein terlarut dari tepung sorgum terfermentasi untuk 3 variabel, yaitu konsentrasi isolat protein, konsentrasi bakteri, dan waktu fermentasi. Variasi konsentrasi isolat protein yang digunakan sebesar 1%, 2%, dan 3% Variasi jumlah inokulum L. plantarum yaitu sebesar 0,25%, 0,5%, dan 0,75% Variasi lama fermentasi adalah 0 jam (kontrol), 24 jam, 36 jam, dan 48 jam. Dari masing masing sampel diukur kadar protein terlarutnya dengan metode Biuret. Data hasil pengukuran protein terlarut dianalisis dengan metode sidik ragan (DASIRA) untuk mengetahui interaksi yang terjadi antarperlakuan sehingga dapat diketahui kondisi optimal dari fermentasi.
Tabel 2. Tabel Sidik Ragam
SUMBER RAGAM Db JK KT F Hitung
Ftabel
5% 1%
Ulangan 2 214,73 107,36 51,93 3,18 4,00
Kombinasi Perlakuan 26 197,76 1,72 2,10
P 2 48,11 24,06 11,64* 3,18 4,00
K 2 9,55 4,78 2,31 3,18 4,00
W 2 16,18 8,09 3,91* 3,18 4,00
P×K 4 3,77 0,94 0,46 2,55 3,70
P×W 4 57,98 14,50 7,01* 2,55 3,70
K×W 4 29,90 7,48 3,62* 2,55 3,70
P×K×W 8 32,26 4,03 1,95 2,12 3,87
Galad Acak 52 107,52 2,07 1,00
Keterangan : *P= kadar konsentrat protein kedelai, K= kadar inokulum L. plantarum, W= waktu fermentasi
Tabel 3. Protein terlarut (x̄ ± SE, %) dari tepung sorgum yang difermentasi pada setiap lama Keterangan :SE = Simpangan Baku Taksiran
W = BNJ 5%
Angka yang diikuti dengan huruf yang sama menunjukkan tidak ada perbedaan signifikan, sedangkan angka yang diikuti dengan huruf yang berbeda menunjukkan adanya perbedaan signifikan. Keterangan ini berlaku juga untuk tabel-tabel selanjutnya.
Tabel 3 menunjukkan bahwa kadar protein terlarut yang paling tinggi berada pada lama waktu fermentasi 36 jam.
Tabel 4. Kadar protein terlarut (x̄ ± SE, %) dari tepung sorgum yang difermentasi pada setiap penambahan konsentrat protein
1% 2% 3%
Tabel 4 menunjukkan adanya peningkatan kadar protein terlarut pada penambahan protein kedelai yang lebih besar namun pada penambahan 3% tidak ada peningkatan kadar protein terlarut pada tepung termodifikasi, karena itu dipilih penambahan 2% konsentrat protein kedelai.
Tabel 5. Kadar protein terlarut (x̄ ± SE, %) dari tepung sorgum yang difermentasi pada penambahan suspensi L. plantarum × lama fermentasi.
protein terlarut lebih tinggi dibandingkan dengan lama fermentasi yang lain. Pembacaan secara vertical menunjukkan adanya pengaruh pada dosis bakteri yang pada 36 jam fermentasi, namun pada lama fermentasi 24 jam dan 36 jam tidak menunjukkan adanya pengaruh penambahan dosis bakteri yang diakibatkan pada 24 jam bakteri belum beradaptasi dengan lingkungannya dan pada 48 jam bakteri mencapai fase stasioner yang diakibatkan oleh habisnya sumber nutrisi yang ditandai dengan penurunan kadar protein terlarut.
Protein terlarut tertinggi ada pada tepung sorgum yang terfermentasi dengan dosis suspensi bakteri sebesar 0,25% dan 0,75% pada 36 jam fermentasi, . Oleh karena itu, kondisi ini merupakan titik optimum fermentasi secara efektif, fermentasi akan menghasilkan kadar protein terlarut optimum pada penggunaan 0,25% suspensi bakteri dengan lama waktu fermentasi 36 jam
Tabel 6. Kadar protein terlarut (x̄ ± SE, %) dari tepung sorgum yang difermentasi pada penambahan protein kedelai × lama fermentasi
24 jam 36 jam 48 jam
pada penambahan konsentrat protein kedelai yang paling kecil dan waktu fermentasi yang paling singkat. Dengan demikian, berdasarkan Tabel 6, kondisi optimum fermentasi adalah selama 24 jam dengan penambahan 2% konsentrat protein kedelai.
Gambar 2. Kadar protein terlarut dari tepung sorgum terfermentasi dengan P1= 1%, P2= 2%, P3= 3% penambahan konsentrat protein kedelai; K1= 0,25%, K2= 0,50%, K3= 0,75% L. plantarum; W1= 24 jam, W2= 36 jam, W3= 48 jam lamanya fermentasi.
Analisis keseluruhan data, seperti yang ditunjukkan oleh Gambar 2, tampak bahwa kadar protein terlarut tertinggi dicapai pada kondisi fermentasi P3K1W2 (3% penambahan konsentrat protein kedelai, 0,25% suspensi bakteri, dan 36 jam lama fermentasi), Akan tetapi, berdasarkan Tabel 3, Tabel 5,dan Tabel 6, kondisi fermentasi P2K1W1, P2K1W2, P2K3W1, P2K3W2 juga menghasilkan tepung sorgum dengan kadar protein terlarut yang sama dengan tepung sorgum terfermentasi pada kondisi P3K1W2. Oleh karena itu, ada 5 kondisi fermentasi optimum untuk tepung sorgum terfortifikasi konsentrat protein kedelai dengan L. plantarum 3704.
Untuk analisis kualitatif dan kuantitatif asam amino dan kadar gizi serta aplikasi tepung sorgum terfermentasi dengan fortifikasi konsentrat protein kedelai, kondisi fermentasi yang diterapkan adalah 36 jam lama fermentasi, 0,25% suspensi bakteri, dan 2% penambahan konsentrat protein dengan kode P2K1W2, dengan dasar bahwa fermentasi yang lebih singkat, yaitu 24 jam, menghasilkan purata kadar protein terlarut yang juga sama dengan fermentasi 48 jam, di mana kadar protein terlarut yang dihasilkannya lebih rendah daripada fermentasi dengan durasi 36 jam (Tabel 3). Selain itu, fermentasi dengan durasi 36 jam ini selaras dengan penelitian yang dilakukan oleh Pranoto (2013) yang juga menggunakan bakteri L. plantarum, di mana IVPD (in vitro protein digestibility) dari sorgum tertinggi ada pada 36 jam fermentasi. Meningkatnya nilai IVPD mengindikasikan nilai kadar protein terlarut semakin meningkat. L. plantarum
memiliki aktivitas proteolitik (Mugula et al., 2003) yang bisa memecah protein menjadi sub unit yang lebih kecil sehingga meningkatkan nilai IVPD dan kadar protein terlarut.
Fortifikasi dengan konsentrat protein kedelai meningkatkan kualitas dan kuantitas dari protein pada tepung sorgum termodifikasi. Puspaningsih (2013) melakukan penelitian mengenai fortifikasi sorgum menggunakan kacang tanah. Hasil penelitian tersebut menunjukkan bahwa pada kondisi optimal fermentasi dengan Rhyzophus oligosporus dan fortifikasi dengan kacang tanah 5%, tepung sorgum memiliki kandungan protein terlarut hanya 6,36%. Nilai ini secara signifikan lebih rendah daripada kadar protein terlarut tepung sorgum terfermentasi oleh L. plantarum dengan fortifikasi protein kedelai sebesar 2%, yakni 11,52%.
Di luar dari penggunaan mikroba yang berbeda yang dapat mempengaruhi proses fermentasi dan menyebabkan perbedaan kadar protein terlarut, penambahan konsentrat protein kedelai lebih efektif dari penambahan kacang tanah karena kandungan protein pada konsentrat protein kedelai (60,05% protein terlarut) lebih besar daripada kacang tanah (25,30% protein total dan 7,92% protein terlarut) (Puspaningsih, 2013).
Kadar Gizi Tepung Sorghum Termodifikasi
Tabel 7. Kadar Gizi tepung sorghum dan tepung sorghum termodifikasi Sampel Karbohidrat
Total
Lemak Abu Air Protein Total
Tepung Sorgum 72.55±0,56 5,27±0,35 1.17±0,11 4.61±0,33 9,03±0,61
Tepung Sorgum
termodifikasi 67.72±0,76 5,13±0,39 1.35±0,20 6.87±1,05 8,59±0,69
SNI Maks 0,7% Maks 14,50% Min 7%
Penurunan kadar karbohidrat total dan protein total pada tepung sorgum termodifikasi di luar dugaan, sebab L. plantarum memiliki sifat proteolitik dan amilolitik yang mampu memecah protein dan pati menjadi molekul-molekulnya yang lebih kecil. Oleh karena itu, terdapat kemungkinan bahwa derajat degradasi pati dan protein yang dilakukan oleh bakteri tersebut selama fermentasi cukup tinggi sehingga molekul-molekul kecil yang dihasilkan digunakan pula untuk menghasilkan energi bagi L. plantarum sendiri.
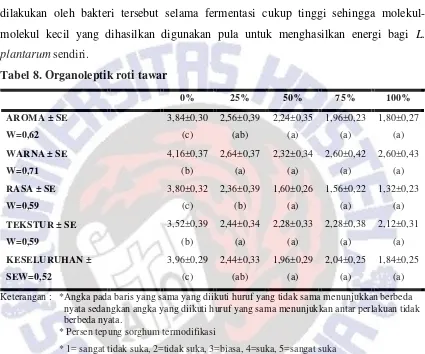
Tabel 8. Organoleptik roti tawar
0% 25% 50% 75% 100%
Keterangan : *Angka pada baris yang sama yang diikuti huruf yang tidak sama menunjukkan berbeda nyata sedangkan angka yang diikuti huruf yang sama menunjukkan antar perlakuan tidak berbeda nyata.
* Persen tepung sorghum termodifikasi
* 1= sangat tidak suka, 2=tidak suka, 3=biasa, 4=suka, 5=sangat suka
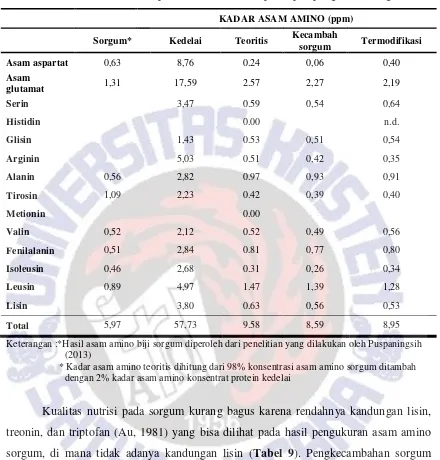
Tabel 9. Kadar 14 asam amino pada kedelai dan setiap tahapan pengolahan sorgum KADAR ASAM AMINO (ppm)
Sorgum* Kedelai Teoritis Kecambah
sorgum Termodifikasi
Asam aspartat 0,63 8,76 0.24 0,06 0,40
Asam
glutamat 1,31 17,59 2.57 2,27 2,19
Serin 3,47 0.59 0,54 0,64
Histidin 0.00 n.d.
Glisin 1,43 0.53 0,51 0,54
Arginin 5,03 0.51 0,42 0,35
Alanin 0,56 2,82 0.97 0,93 0,91
Tirosin 1,09 2,23 0.42 0,39 0,40
Metionin 0.00
Valin 0,52 2,12 0.52 0,49 0,56
Fenilalanin 0,51 2,84 0.81 0,77 0,80
Isoleusin 0,46 2,68 0.31 0,26 0,34
Leusin 0,89 4,97 1.47 1,39 1,28
Lisin 3,80 0.63 0,56 0,53
Total 5,97 57,73 9.58 8,59 8,95
Keterangan :*Hasil asam amino biji sorgum diperoleh dari penelitian yang dilakukan oleh Puspaningsih (2013)
* Kadar asam amino teoritis dihitung dari 98% konsentrasi asam amino sorgum ditambah dengan 2% kadar asam amino konsentrat protein kedelai
Kualitas nutrisi pada sorgum kurang bagus karena rendahnya kandungan lisin, treonin, dan triptofan (Au, 1981) yang bisa dilihat pada hasil pengukuran asam amino sorgum, di mana tidak adanya kandungan lisin (Tabel 9). Pengkecambahan sorgum meningkatkan variasi asam amino seperti serin, glisin, arginin, dan lisin. Fortifikasi dengan konsentrat protein kedelai meningkatkan kuantitas dari asam amino.
penambahan konsentrat protein kedelai turut meningkatkan kuantitas masing-masing asam amino tersebut.
Gambar 2. Kromatogram HPLC asam amino konsentrat protein kedelai
Pada kromatogram HPLC asam amino dari konsentrat protein kedelai terdapat 14 puncak yang terdeteksi. Dua puncak dari 14 puncak yang terdeteksi tidak teridentifikasi yang diakibatkan oleh keterbatasan standar yang digunakan. Keduabelas asam amino tersebut adalah asam aspartate, asam glutamat, serin, glisin, arginin, alanin, tirosin, valin, fenilalanin, isoleusin, leusin, dan lisin.
Gambar 3 menunjukkan adanya 17 puncak yang terdeteksi dan 12 puncak yang dapat diidentifikasi. Kromatogram kecambah sorgum menunjukkan jumlah puncak yang cukup banyak yang bisa diakibatkan oleh tailing pada kromatogram dimana campuran asam amino tidak bisa terpisah dalam proses kromatografi.
Gambar 3. Kromatogram HPLC asam amino tepung sorgum termodifikasi
Gambar 3 menunjukkan kromatogram asam amino tepung sorgum termodifikasi. Pada kromatogram terdeteksi 14 puncak dan 12 puncak yang teridentifikasi. Kedua puncak yang tidak teridentifikasi memiliki waktu retensi 4,804 menit dan 18,645 menit. Kedua puncak yang tidak teridentifikasi tersebut memiliki waktu retensi yang hampir sama dengan waktu retensi kedua puncak yang tidak teridentifikasi pada sampel konsentrat protein kedelai sehingga dapat disimpulkan bahwa kedua puncak tersebut mengindikasikan jenis asam amino yang sama.
Tabel 10. Kadar tanin sorghum setelah melewati proses pengolahan
Sorgum Pengkecambahan Fermentasi
Kecambah
Kadar Tanin (%) 1,65 0,16 0,14
% penurunan 90,30 91,51
dengan penelitian yang dilakukan oleh Puspaningsih pada tahun 2013. Proses fermentasi menurunkan kadar tanin menjadi 0,14% yang disebabkan oleh kemampuan L. plantarum
untuk menghasilkan enzim tannase (Molin, 2008).
KESIMPULAN DAN SARAN
Hasil penelitian menyimpulkan bahwa kondisi optimal untuk fermentasi tepung sorgum adalah pada P2K1W1, P2K1W2, P2K3W1, P2K3W2, dan P3K1W2. Kadar air dan protein dalam tepung sorgum termodifikasi sudah memenuhi standar SNI-3751:2009, sedangkan kadar abu dari tepung sorgum termodifikasi belum memenuhi standar SNI-3751:2009. Proses pengkecambahan dan fortifikasi tepung sorgum meningkatkan variasi dan konsentrasi asam amino sedangkan proses fermentasi tidak meningkatkan kuantitas asam amino pada tepung sorgum. Hasil uji organoleptik pada produk roti tawar yang disubstitusi dengan tepung sorgum menujukkan bahwa penambahan tepung sorgum termodifikasi tidak disukai oleh para panelis karena adanya rasa pahit dan asin
DAFTAR PUSTAKA
Ali, F., Mondor, M., Ippersiel, D. & Lamarche, F., 2011. Production of low-phytate soy protein isolate by membrane technologies: Impact of salt addition to the extract on the purification process. Innovative Food Science and Emerging Technologies, Issue 12, pp. 171-177.
AOAC. 1995. Official Methods of Analysis of The Association of official Analytical Chemists. AOAC, Washington DC
Au, P. M. dan M. L.Fields. 1981. Nutritive Quality of Fermented Sorghum. Journal of Food Science, No.46 :652-654.
FAO, 1997. Production Yearbook. Rome: Food and Agriculture Organization of the United Nations.
Hedge, J.E. dan B.T. Hofreiter. 1962. In Carbohydrate Chemistry, 17 (Eds. Whinstler R.L. and Be. Miller, J.N.). Academic Press, New York.
Umiati, L., E. Milyati, Indrawati. 1998. Kestabilan metoda Prussian blue dalam analisis tannin. Jurnal Kimia Andalas, No. 2 (4) : 104-110
Molin, G., 2008. Lactobacillus plantarum, the role in foods and in human health. In: E. R. Farnworth, ed. Handbook of Fermented Functional Food. Boca Raton: Taylor & Francis Group.
Mugula, J. K., Sørhaug, T. & Stepaniak, L., 2003. Proteolytic activities in togwa, a Tanzanian fermented food. International Journal of Food Microbiology, No. 84 :1-12.
Pranoto, Y., Anggrahini, S. & Efendi, Z., 2013. Effect of natural andLactobacillus plantarum fermentation on in-vitroprotein and starch digestibilities of sorghum flour. Food Bioscience, No. 2 : 46-52.
Puspaningsih, V., 2013. Analisis dan Identifikasi Asam Amino dan Asam Lemak Tak Jenuh Sorgum (Sorghum bicolor L.) Terfortifikasi Kacang Tanah (Arachis hypogaea) Sebagai Pangan Fungsional. Salatiga: Universitas Kristen Satya Wacana.
RISTEK, 2012. Kementrian Riset dan Teknologi. [Online]
Available at: http://ristek.go.id/index.php/module/News+News/id/12015 [Diakses 30 10 2013].
Steel, R.G.D & J.H Torie, 1980. Prinsip dan Prosedur Statistika Suatu Pendekatan Biometrik. Gramedia. Jakarta.
Sudarmadji, S., B. Haryono, dan Suhardi. 1984. Prosedur Analisa untuk Bahan Makanan dan Pertanian. Liberty. Yogyakarta
Sukarto, T. S., 1985. Penilaian Organoleptik. Bharata Aksara. Jakarta.
Theresia, A., 2013. Tempo.co Bisnis. [Online]
Available at:
http://www.tempo.co/read/news/2013/07/24/090499391/Indonesia-Didesak-Kurangi-Impor-Gandum
Lampiran 1. Skema Kerja Penelitian
PEMBUATAN KONSENTRAT PROTEIN KEDELAI
PEMBUATAN TEPUNG KECAMBAH SORGUM
OPTIMASI KONDISI FERMENTASI
TEPUNG KONDISI OPTIMAL YANG
DIPILIH
APLIKASI PADA PRODUK ROTI
TAWAR ANALISA KADAR
GIZI TEPUNG OPTIMAL
ANALISA KANDUNGAN ASAM
AMINO
Lampiran 2. Kurva Standar Metode Protein Terlarut Biuret
Tabel 1. Tabel kurva standar metode Biuret
BSA (mL) Akuades (mL) Konsentrasi
(mg/mL) Biuret (mL) A550nm
0 1 0 4 0,000
0,1 0,9 1 4 0,051
0,2 0,8 2 4 0,097
0,6 0,4 6 4 0,258
0,7 0,3 7 4 0,302
0,8 0,2 8 4 0,356
0,9 0,1 9 4 0,394
1 0 10 4 0,442
Contoh perhitungan konsentrasi:
Pada kurva standar diperoleh konsentrasi
= , 5 �⁄
= , 5 � � ⁄
= , 5 �
, 5� � � ⁄
= , �⁄� � �
� �� � � = , × % = , %
y = 0.043x + 0.0071 R² = 0.9988
0 0.1 0.2 0.3 0.4 0.5
0 2 4 6 8 10 12
A
550
nm
BSA (mg/mL)
Lampiran 4. Analisis Data Kadar Protein Terlarut
K
O
MBINA
S
I P
ERLA
K
U
AN
U1 U2 U3 total
perlakuan
rata-rata
perlakuan dp SD S
2 SE
P1 K1 W1 8,71 8,37 12,14 29,22 9,74 -0,40 2,09 4,36 5,19
P1 K1 W2 8,75 9,19 14,03 31,96 10,65 0,52 2,93 8,57 7,28
P1 K1 W3 8,57 6,62 11,57 26,76 8,92 -1,22 2,49 6,21 6,20
P1 K2 W1 6,38 8,35 10,99 25,73 8,58 -1,56 2,31 5,35 5,75
P1 K2 W2 8,50 2,71 9,21 20,42 6,81 -3,33 3,57 12,74 8,88
P1 K2 W3 9,38 8,86 12,73 30,98 10,33 0,19 2,10 4,41 5,22
P1 K3 W1 8,82 3,72 9,88 22,42 7,47 -2,67 3,30 10,87 8,20
P1 K3 W2 10,58 4,84 11,32 26,74 8,91 -1,22 3,54 12,56 8,82
P1 K3 W3 9,75 10,29 10,28 30,32 10,11 -0,03 0,31 0,09 0,77
P2 K1 W1 9,32 12,16 14,31 35,79 11,93 1,79 2,50 6,26 6,23
P2 K1 W2 11,47 8,37 14,72 34,56 11,52 1,38 3,18 10,10 7,91
P2 K1 W3 9,49 6,49 12,90 28,89 9,63 -0,51 3,21 10,29 7,98
P2 K2 W1 9,47 8,99 14,60 33,06 11,02 0,88 3,11 9,68 7,74
P2 K2 W2 10,66 9,69 13,25 33,60 11,20 1,06 1,84 3,39 4,58
P2 K2 W3 7,51 9,38 13,89 30,79 10,26 0,12 3,28 10,76 8,16
P2 K3 W1 9,67 11,34 14,74 35,75 11,92 1,78 2,58 6,68 6,43
P2 K3 W2 13,72 10,56 13,02 37,30 12,43 2,30 1,66 2,75 4,12
P2 K3 W3 6,55 5,77 9,49 21,82 7,27 -2,87 1,96 3,84 4,87
P3 K1 W1 7,74 8,69 10,94 27,37 9,12 -1,01 1,65 2,71 4,09
P3 K1 W2 13,29 12,12 15,27 40,68 13,56 3,42 1,59 2,53 3,96
P3 K1 W3 10,71 8,27 12,17 31,16 10,39 0,25 1,97 3,88 4,90
P3 K2 W1 10,78 8,10 10,81 29,69 9,90 -0,24 1,55 2,41 3,86
P3 K2 W2 11,00 9,12 9,26 29,39 9,80 -0,34 1,05 1,10 2,61
P3 K2 W3 8,96 9,19 12,63 30,78 10,26 0,12 2,06 4,24 5,12
P3 K3 W1 8,23 7,32 12,06 27,61 9,20 -0,94 2,52 6,33 6,26
P3 K3 W2 11,47 9,74 14,88 36,09 12,03 1,89 2,62 6,85 6,51
P3 K3 W3 9,42 10,62 12,34 32,39 10,80 0,66 1,47 2,16 3,65
Total ulangan 258,91 228,89 333,46 821,26
rata-rata ulangan 9,59 8,48 12,35 10,14
Lampiran 4. Analisis Data Kadar Protein Terlarut (lanjutan)
W1 (∑P1i.dpi) 50,53
W2 (∑P2i.dpi) 83,24
W3(∑P3i.dpi) 63,99
N -24,60
n2 605,03
Ʃdp2 65,92
Ʃdu2 7,95
D 524,24
JK non aditivitas 1,15
FK 8326,81
JK TOTAL 520,00
JK ULANGAN 214,73
JK KOMBINASI PERLAKUAN 197,76
JK GALAT ACAK 107,52
DASIRA NON ADITIF
SUMBER RAGAM Db JK KT F hit F tabel
5% 1%
Ulangan (3) 2 214,73
Kombinasi Perlakuan (27) 26 197,76 Galat Acak (ulangan x
kombinasi) 52 107,52
Non Additivitas 1 3,47 3,47 1,70 4,03 7,16
Sisa 51 104,04 2,04
DASIRA
SUMBER RAGAM Db JK KT F hit F tabel
5% 1%
Ulangan (3) 2 214,73 107,36 51,93 3,18 4,00
Kombinasi Perlakuan (27) 26 197,76 7,61 3,68 1,72 2,10 Galat Acak (ulangan x
kombinasi) 52 107,52 2,07
Lampiran 3. Analisis Data Kadar Protein Terlarut (lanjutan) SE = Simpangan Baku Taksiran
W = BNJ 5%
Angka yang diikuti dengan huruf yang sama menunjukkan tidak ada perbedaan signifikan, sedangkan angka yang diikuti dengan huruf yang berbeda menunjukkan adanya perbedaan signifikan.
Keterangan ini berlaku juga untuk tabel-tabel selanjutnya.
Protein terlarut (x̄ ± SE, %) dari tepung sorgum yang difermentasi pada setiap lama waktu SE = Simpangan Baku Taksiran
W = BNJ 5%
Kadar protein terlarut (x̄ ± SE, %) dari tepung sorgum yang difermentasi pada penambahan suspensi L. plantarum × lama fermentasi.
Kadar protein terlarut (x̄ ± SE, %) dari tepung sorgum yang difermentasi pada penambahan protein kedelai × lama fermentasi
24 jam 36 jam 48 jam
1%
8,60±1,51 (a) (a)
8,79±2,05 (a) (a)
9.79±1,08 (a) (a)
2%
11.62±1,48 (b) (b)
11.72±1,28 (b) (b)
9.05±1,74 (a) (a)
3%
9.41±1,06 (a) (a)
11.80±1,41 (b) (b)
Lampiran 4. Kadar Gizi Tepung Sorgum
Kadar gizi tepung kecambah sorgum
% Ulangan
1
Ulangan 2
Ulangan 3
Rata-rata SD SE
Air 4,55 4,97 4,32 4,61 0,33 0,33
Abu 1,13 1,21 1,16 1,17 0,04 0,12
Lemak 5,14 4,97 5,70 5,27 0,38 0,36
Protein 10,30 8,25 8,54 9,03 1,11 0,61
Karbohidrat 71,51 70,54 69,60 70,55 0,95 0,56
Kadar gizi tepung sorgum optimal
% Ulangan
1
Ulangan 2
Ulangan 3
Rata-rata SD SE
Air 3,68 10,37 6,57 6,87 3,36 1,06
Abu 1,45 1,40 1,21 1,35 0,13 0,21
Lemak 4,60 5,36 5,43 5,13 0,46 0,39
Protein 7,45 10,19 8,14 8,59 1,42 0,69
Lampiran 5. Data Organoleptik
Keterangan : *Angka pada baris yang sama yang diikuti huruf yang tidak sama menunjukkan berbeda nyata sedangkan angka yang diikuti huruf yang sama menunjukkan antar perlakuan tidak berbeda nyata.
* Persen tepung sorghum termodifikasi
Lampiran 6. Contoh Perhitungan organoleptik
A B C D E
TOTAL ULANGAN
TOTAL ULANGAN KUADRAT
RATA-RATA
ULANGAN du W
du Kuadrat
Panelis
1 2 2 2 2 3 11,00 121 1,83 -0,21 6,00 0,04 2 2 2 2 3 4 13,00 169 2,17 0,13 8,32 0,02 3 3 3 3 3 5 17,00 289 2,83 0,79 9,96 0,63 4 3 3 2 4 5 17,00 289 2,83 0,79 10,56 0,63 5 2 2 2 2 3 11,00 121 1,83 -0,21 6,00 0,04 6 2 1 1 2 4 10,00 100 1,67 -0,37 8,20 0,14 7 2 2 2 3 4 13,00 169 2,17 0,13 8,32 0,02 8 3 3 3 3 5 17,00 289 2,83 0,79 9,96 0,63 9 1 1 1 2 3 8,00 64 1,33 -0,71 6,28 0,50 10 2 2 2 3 4 13,00 169 2,17 0,13 8,32 0,02 11 1 2 2 2 3 10,00 100 1,67 -0,37 6,00 0,14 12 2 2 2 2 2 10,00 100 1,67 -0,37 4,08 0,14 13 2 2 1 1 4 10,00 100 1,67 -0,37 7,72 0,14 14 1 1 1 1 4 8,00 64 1,33 -0,71 7,80 0,50 15 2 1 1 1 4 9,00 81 1,50 -0,54 7,80 0,29 16 2 1 1 2 4 10,00 100 1,67 -0,37 8,20 0,14 17 2 2 1 2 4 11,00 121 1,83 -0,21 8,12 0,04 18 2 1 2 2 5 12,00 144 2,00 -0,04 9,92 0,00 19 3 3 2 3 4 15,00 225 2,50 0,46 8,24 0,21 20 1 1 2 2 4 10,00 100 1,67 -0,37 8,00 0,14 21 2 3 3 2 3 13,00 169 2,17 0,13 5,72 0,02 22 3 3 2 4 4 16,00 256 2,67 0,63 8,64 0,39 23 3 3 3 4 4 17,00 289 2,83 0,79 8,44 0,63 24 1 1 1 3 5 11,00 121 1,83 -0,21 10,52 0,04 25 2 2 2 3 5 14,00 196 2,33 0,29 10,24 0,09
TOTAL PERLAKUAN 51,00 49,00 46,00 61,00 99,00 306,00 93.636,00 51,00
RATA-RATA
Lampiran 6. Contoh Perhitungan organoleptik (lanjutan)
N 10,33
∑ du2 5,57
∑ dp2 3,89
D 21,69
JK NON ADDITIVITAS 4,92
FAKTOR KOREKSI 624,24
∑ U/ JK TOTAL 896,00
JK TOTAL 271,76
∑ TOTAL ULANGAN2 3946,00
∑ TOTAL ULANGAN2 : 5 657,67
JK ULANGAN 33,43
TOTAL PERLAKUAN2 2601,00 2401,00 2116,00 3721,00 9801,00
∑ TOTAL PERLAKUAN2 20640,00
∑ TOTAL PERLAKUAN2 : 25 825,60
JK PERLAKUAN 201,36
Lampiran 6. Contoh Perhitungan organoleptik (lanjutan)
SUMBER RAGAM Db JK KT F
HITUNG
ULANGAN (25) 24 33,43
PERLAKUAN (6) 4 201,36
GALAD ACAK 96 36,97 0,39
NON ADDITIVITAS 1 4,92 4,92 14,57
SISA 95 32,06 0,34
*BNJ 5% KT ga ulangan q tabel perlakuan db GA
S x(bar) = (KT GA/ulangan)2
0,39 25,00 4,17 6,00 120,00
W = q (p, v, alfa) x S x(bar)
KT/ulangan (KT/ul)^0.5 w
0,0148 0,1218 0,49924
*tabel hasil bnj W=0,51
perlakuan 0% 25% 50% 75% 100%
rata" perlakuan 3,96±0,29 (c)
2,44±0,33
(ab)
1,96±0,29
(a)
2,04±0,25
(a)
1,84±0,25
OPTIMIZED FERMENTATION OF SORGHUM (Sorghum bicolor L.) FLOUR
FORTIFIED WITH SOY PROTEIN USING Lactobacillus plantarum 3704
*Yoshua Albert Darmawan,Silvia Andini, Sri Hartini, Yohanes Martono, Erlien Giovani
Soeroso,Kiki Fransiska Suharto
Department of Chemistry, Faculty of Science and Mathematics, Satya Wacana Christian University
Jalan Diponegoro 52-60, Salatiga 50711, Jawa Tengah, Indonesia
ABSTRACT
Optimization of sorghum flour fermentation has been conducted to determine the optimal condition of
fermentation based on soluble protein content measured by spectrophotometer at 550 nm using Biuret reagent.
Sorghum flour was fermented by Lactobacillus plantarum 3704. The data of soluble protein contents of sorghum
flour were analyzed using Factorial Treatment Design 3 × 3 × 3 with Randomized Complete Block Design. The
first factor was concentration of soy protein concentrate (1%, 2%, and 3%). The second and third ones were
concentration of L. plantarum suspension (0.25%, 0.5%, 0.75%) and the duration of the fermentation (24 h, 36 h,
and 48 h), respectively. Data were assessed by Tukey’s HSD (Honestly Significant Difference) test with a
significance level of 95%. Result showed that the optimum condition of fermentation was 2% soy protein
concentrate, 0.25% L. plantarum suspension, and 36 h of fermentation. The soluble protein content in the optimum
fermentation condition was 11.52%.
Keywords: sorghum flour, soluble protein, soy protein concentrate, Lactobacillus plantarum
INTRODUCTION
Indonesian food security continues to face various
problems such as insufficient food production, low
competitiveness of agricultural product, shrinking
of arable land in Java island (100,000 acre/year),
lack of infrastructures, climate change,
undeveloped food diversification based on local
product, population growth, and increasing
consumption per-capita (RISTEK, 2013).
The increasing population of Indonesian results in
dependence on imported wheat. Volume of
imported wheat in 2011 reached 5.4 million metric
tons and increased to 6.2 million metric tons in 2012
(Theresia, 2013).
Sorghum is a local Indonesian crop with various
local names. In Java, sorghum is called “canthel”.
Sorghum can be grown well in Indonesia.
Moreover, sorghum is considered as the most
important crop in the world followed by wheat, rice,
content in sorghum does, unfortunately, not come
along with variation of amino acids (Andayani in
Puspaningsih, 2013). The poor amino acid variation
reduces the digestibility of the protein
(Puspaningsih, 2013). Sorghum contains tannin and
phytic acid that inhibit the absorption of
carbohydrates and proteins (Osman, 2004). L.
plantarum has proteolytic (Mugula et al., 2003) and
amilolytic (Songre-Ouattara et al., 2009) activities
thus increasing the digestibility of carbohydrates
and proteins.Fermentation of sorghum flour using
L. plantarum and soy protein fortification would
improve the quality of the sorghum flour by
increasing the protein content and digestibility.
Thus, the aim of this study was to investigate the
optimum fermentation condition of modified
sorghum flour based on soluble protein content.
MATERIALS AND METHODS
The main materials in this study were sorghum
(Sorghum bicolor L.) obtained from Surakarta, soy
bean (Glycine max (L.) Merr.) obtained from
Grobogan, and Lactobacillus plantarum 3074
obtained from PAU Pangan UGM. The chemicals
and medium used in this research were purchased
from Merck, Germany. They were CuSO4.5H2O,
NaOH, BSA, KNa-tartrat, and MRS (deMann,
Rogosa and Sharpe) medium.
Lactobacillus plantarum suspension preparation
Suspension containing 108 CFU/ml determined
using McFarland scale by means of
spectrophotometer UV/VIS (Optizen UV 2120,
South Korea).
Soy Protein Concentrate
The pH of soy milk was adjusted to 4.8 using citric
acid to separate soy protein from the milk. The
protein precipitate was dried in drying cabinet for
24 h in 50°C. Then, it was defatted by Sohxlet
extractor using diethyl ether as solvent.
Sorghum Flour Fermentation Optimization
Sorghum was germinated for 5 days and dried in
drying cabinet for 48 h. Sorghum was milled into
60 mesh flour, and it was fortified with soy protein
concentrate (1%, 2%, 3%). Fermentation was
carried out by mixing 25 g fortified sorghum flour
and 50 mL PPS (peptone physiological salt)
solution containing L. plantarum (0.25%, 0.5% and
0.75%). The slurries were allowed to be fermented
at 37°C for 24 h, 36 h, and 48 h in closed plastic
cups. The slurries were dried in a drying cabinet at
50°C for 48 h. The dried samples were milled using
food processor and stored in plastic bags at 4°C. All
kinds of the flour were analyzed for their soluble
protein content using Biuret reagent measured at
550 nm (AOAC, 1995).
Data analysis
The data of soluble protein content were analyzed
using Factorial Treatment Design 3 × 3 × 3 with
Randomized Complete Block Design. There were
three factors, namely concentration of soy protein
concentrate (1%, 2%, and 3%), concentration of L.
plantarum suspension (0.25%, 0.5%, 0.75%), and
duration of the fermentation (24 h, 36 h, and 48 h).
Data were assessed by Tukey’s HSD (Honestly
Significant Difference) test with a significance level
RESULT AND DISCUSSION
The optimization of fermentation condition data
analysis were followed by a review of the
interaction between each variable (L. plantarum
concentration, soy protein concentrate addition, and
duration of fermentation). The ANOVA analysis
showed significant difference of fermentation
duration (Table 1), soy protein concentrate addition
(Table 2), interaction of bacterial suspension and
fermentation duration (Table 3), soy protein
addition and fermentation duration (Table 4).
Table 1. Soluble protein content (x̄ ± SE, %) of alphabets indicate significant difference between treatment, this applies to all tables represented in this paper.
Table 1 shows that the highest soluble protein
content is in 36 hours of fermentation with
significant difference marked with (ab). Thus, the
optimum duration of fermentation was 36 hours.
Table 2. Soluble protein content (x̄ ± SE, %) of Table 2 indicates a significant difference between
soy protein concentrate addition. The highest
soluble protein content is in 2% and 3% soy protein
concentrate additions, so the lowest addition is
chosen.
Table 3. Soluble protein content (x̄ ± SE, %) of
fermented sorghum flour in soy protein concentrate
addition and duration of fermentation
24 h 36 h 48 h
fermentation. Thus, the optimum fermentation
condition is in 0.25% bacterial suspension and
duration of 36 h.
Table 4. Soluble protein content (x̄ ± SE, %) of
fermented sorghum flour in various concentrations
Table 4 shows that the highest soluble protein
content is obtained by fermentation for 24 h with
2% soy protein concentrate addition. The condition
has been chosen based on the highest soluble
protein content obtained at lower concentration of
However, according to Table 1 and Table 3
showing that the optimum duration of
fermentation is obtained at 36 hours of
fermentation, thus 2% soy protein
concentrate addition and 36 h of
fermentation time in combination with
0.25% bacterial suspension is more likely to
be the optimum fermentation condition
instead of that condition with 24 h of
achieved at fermentation for 36 h. The result
of this study corresponds to the research
conducted by Pranoto (2013) that the highest
IVPD (In vitro protein digestibility) value of
sorghum flour fermented with L. plantarum
bacteria peaked at 36 hours of fermentation.
Thus, increasing number IPVD indicated
that the soluble protein in this sorghum flour
also increased. The L. plantarum has
proteolytic activity (Mugula et al., 2003)
that could break down long protein chains
into smaller protein unit thus increasing the
IPVD and soluble protein content.
Soy protein concentrate fortification
increases the quality and quantity of protein
in modified sorghum. Puspaningsih (2013)
conducted a study of sorghum fortification
using peanut. Peanut only contain 25.3%
total protein and 7.92% soluble protein
compared to soy protein isolate that contain
60.05 soluble protein. The research showed
that at the optimum fermentation condition
using Rhyzophus oligosporus 2.5% , in
which the peanut addition was 5%, the
soluble protein content reached only 6.36%,
lower than soluble protein content (11.52%)
in modified sorghum flour fermented by L. 9.87
plantarum at an optimum condition utilizing
2% soy protein concentrate . Apart from the
distinguished cultures which might affect the
fermentation processes thus causing the
different values of protein content, soy
protein concentrate addition is probably
more effective than peanut addition because
the protein contained in soy protein
concentrate is more higher.
CONCLUSION
Depending on the statistical analysis, it
could be concluded that the optimum
condition for fermentation was 0.25% L.
plantarum, 2% soy protein concentrate, and
36 hours of fermentation.
ACKNOWLEDGEMENT
The author would like to thank the
Directorate General of Higher Education,
Ministry of Higher Education, Ministry of
National Education Republic of Indonesia
for supporting the research through Student
Creativity Program (PKM) Grant 2014.
REFERENCES
Andayani, P. 2008. Isolasi dan Identifikasi Mikrob dari Tempe Sorghum Coklat (Sorghum bicolor) Serta Potensinya Dalam Mendegradasi Pati dan
Protein. Universitas Brawijaya, Malang. FAO, 1997. Production Yearbook.
Rome: Food and Agriculture
Organization of the United Nations.
Mugula, J. K., Sørhaug, T. & Stepaniak, L., 2003.
Proteolytic activities in togwa, a Tanzanian fermented food.
International Journal of Food Microbiology, Issue 84, pp. 1-12.
Pranoto, Y., Anggrahini, S. & Efendi, Z., 2013. Effect of natural and Lactobacillus plantarum fermentation on in-vitro protein and starch
digestibilities of sorghum flour. Food Bioscience, Issue 2, pp. 46-52.
Puspaningsih, V., 2013. Analisis dan Identifikasi Asam Amino dan Asam Lemak Tak Jenuh Sorgum (Sorghum bicolor L.) Terfortifikasi Kacang Tanah (Arachis hypogaea) Sebagai Pangan Fungsional. Salatiga: Universitas Kristen Satya Wacana.
RISTEK, 2012. Kementrian Riset dan Teknologi. [Online]
Available at:
http://ristek.go.id/index.php/m odule/News+News/id/12015 [Accessed 30 10 2013]. Skoch, L. V. et al., 1970. Protein
Fractination of Sorghum Grain.
Cereal Chemistry, Issue 47, pp. 472-481.
fortified with groundnut.
International Journal of Food Microbiology, Issue 130, pp. 258-264.
Theresia, A., 2013. Tempo.co Bisnis.
[Online]
Available at:
http://www.tempo.co/read/new s/2013/07/24/090499391/Indon esia-Didesak-Kurangi-Impor-Gandum