1
KAJIAN MEKANISME REAKSI HIDROLISIS
N-FENIL-3-HIDROKSI PIKOLINAMIDA DALAM KONDISI BASA
MENGGUNAKAN METODE DFT DAN POST-SCF
Hendra Ermawan, Yahmin, Siti Marfu’ah
Jurusan Kimia, FMIPA, Universitas Negeri Malang, Jl. Semarang 5 Malang, e-mail: hendrakimum@yahoo.com
Abstrak: Mekanisme reaksi hidrolisis senyawa N-fenil-3-hidroksi pikolinamida diteliti
menggunakan metode Density Fuctional Theory (DFT). Penelitian dilakukan karena reaksi hidrolisis senyawa yang diteliti memiliki manfaat yang besar dalam bidang medis serta penggunaan yang luas pada industri kimia. Penelitian menggunakan pendekatan teoritis karena terdapat kesulitan dalam mengkaji mekanisme reaksi secara eksperimen. Secara umum keseluruhan reaksi yang diteliti melewati dua tahap yang berkelanjutan: 1. Pemben-tukan zat antara tetrahedral 1 (ZA1), 2. Transformasi dari ZA1 menuju produk akhir. Tiga jalur reaksi tambahan diusulkan pada tahap 2 ini. Jalur 1 adalah proses migrasi proton intramolekuler. Jalur 2 dan Jalur 3 adalah proses migrasi proton intermolekuler yang meli-batkan molekul air dalam reaksinya. Energi aktivasi tiap-tiap jalur reaksi adalah: Jalur 1: 51,534 kkal/mol; Jalur 2: 0,282 kkal/mol; Jalur 3: 0,265 kkal/mol. Pembentukan produk dari ZA1 lebih cepat berlangsung melalui Jalur 2 dan Jalur 3. Penelitian ini menunjukkan pula bahwa transfer proton pada reaksi yang menggunakan air sebagai pelarut mudah berlang-sung.
Kata kunci: N-fenil- 3-hidroksi pikolinamida, mekanisme reaksi, hidrolisis basa, DFT
Turunan dari senyawa amida dan reaksi hidrolisisnya telah dijadikan bahan penelitian dalam kurun waktu yang cukup lama karena sangat bermanfaat khususnya dalam kepentingan medis dan penggunaan secara luas dalam industri kimia. Banyak penelitian terkait sintesis senyawa baru dari turunan senyawa amida seperti 3-hidroksi-N-oktilpikolinamida; N-fenil-hidroksi benzamida; N-fenil-3-hidroksipikolinamida; 2-hidroksi-N-oktilbenzamida telah ditemukan (Husniati, 2008:30). Namun penelitian ini berhenti pada hasil sintesis empat senyawa tersebut sedangkan untuk mekanisme reaksi-reaksinya masih belum diteliti lebih lanjut, dikarenakan adanya berbagai kendala dalam eksperimen khususnya pada reaksi hidrolisisnya.
bahan-bahan yang bersifat radioaktif seperti contoh senyawa pikolinat radioaktif yang berbahaya dan sangat mahal, untuk meneliti mekanisme reaksi hidrolisis senyawa N-fenil-3-hidroksi pikolinamida tidak memerlukan peralatan yang rumit dan berbahaya serta waktu yang lebih cepat. Kimia komputasi merupakan penghubung hasil-hasil eksperimen di laboratorium. Suatu molekul dapat dimodelkan sesuai hasil penelitian para ilmuwan sebelumnya sedangkan perhitungan dilakukan berdasarkan metode tertentu sesuai dengan ketersediaan waktu dan keakuratan hasil yang diinginkan. Sifat-sifat molekul yang diteliti akan lebih mudah untuk dipelajari. Penelitian di bidang komputasi dilakukan untuk mendukung penelitian di bidang eksperimen.
Dengan mempertimbangkan hal ini, penelitian ini meneliti salah satu senyawa dari empat senyawa hasil sintesis Husniati sebagai bentuk pengembangan dari penelitian yang telah dilakukan. Penelitian yang dilakukan terbatas hanya pada satu senyawa disebabkan keterbatasan waktu dan instrumen yang tersedia. Senyawa yang akan diteliti tersebut adalah N-fenil-3-hidroksi pikolinamida dan fokus penelitiannya adalah pada mekanisme reaksi hidrolisisnya. Dengan mempelajari mekanisme reaksi hidrolisisnya, para kimiawan dapat mengetahui tahapan-tahapan reaksi dan halangan-halangan yang mungkin terjadi. Hal ini dapat menjadi tolak ukur bagi para kimiawan dalam merancang teknik optimalisasi proses. Oleh karena itu, diharapkan sintesis senyawa tersebut dan reaksi hidrolisisnya dapat lebih mudah dilakukan dengan prediksi keberhasilan yang besar.
Jin dkk., (2011) telah melakukan penelitian teoritik mengenai dua kemungkinan tahapan proses reaksi hidrolisis kondisi basa senyawa N-(2-metoksifenil) benzamida. Tahapan yang pertama adalah pembentukan zat antara tetrahedral akibat serangan nukleofilik dari atom karbon pada gugus karbonil oleh ion hidroksida, dan tahap ke dua adalah transformasi dari zat antara 1 menjadi produk akhir. Pada tahap yang kedua ini juga terdapat tiga jalur mekanisme yang mungkin terjadi. Jalur yang pertama adalah proses migrasi proton intramolekuler, sedangkan jalur kedua dan ketiga adalah proses migrasi proton intermolekuler. Yamabe dkk., (2013) telah melakukan penelitian secara teoritis pula mengenai mekanisme reaksi hidrolisis senyawa etil benzoat dan N-etil benzamida. Penelitian tersebut menggunakan metode perhitungan Density Functional Thory (DFT). Fungsi koreksi yang digunakan adalah tiga parameter Becke (B3LYP) pada himpunan basis 6-31+G(d). Berdasarkan hasil penelitian sebelumnya, diduga reaksi hidrolisis N-fenil-3-hidroksi pikolinamida melalui beberapa mekanisme yang hampir sama khususnya seperti penelitian yang dilakukan Jin dkk., (2011). Dugaan ini berdasarkan kemiripan senyawa yang telah diteliti dengan senyawa pada penelitian ini.
Dari beberapa tahapan mekanisme yang diusulkan dan juga berdasarkan pene-litian sebelumnya, diteliti tahap yang paling sesuai, pengaruh dan aktivitas pelarut air, dan energi-energi yang menyertai reaksi tersebut. Metode yang digunakan adalah DFT (Density Functional Theory). Metode ini dipilih karena dapat mengurangi masalah interaksi elektron yang rumit menjadi cukup mudah untuk diselesaikan. Metode DFT juga memerlukan waktu perhitungan lebih singkat dan kapsitas penyimpanan lebih sedikit dibandingkan metode lain seperti Ab initio (Foreshmen & Frish, 1996).
METODE
Gaussian 09. Metode DFT menggunakan perhitungan B3LYP dengan himpunan basis 6-31G (d) dipilih sebagai metode yang digunakan. Pemilihan metode dilakukan ber-dasarkan pertimbangan ketersediaan hard ware, soft ware dan alokasi waktu yang tersedia. Sedangkan untuk mengetahui pengaruh air sebagai pelarut dalam reaksi hidrolisis digunakan simulasi Polarizes Continuum Model (PCM).
Dalam pendekatan teoritis dipelajari struktur reaktan, produk, zat antara, dan keadaan transisi dari reaksi hidrolisis senyawa N-fenil-3-hidroksi pikolinamida. Hal pertama yang dilakukan adalah menggambar semua struktur senyawa yang akan dianalisis yang terdiri dari reaktan yaitu N-fenil-3-hidroksi pikolinamida dan nukleofil OH- dan semua struktur zat antara yang terbentuk. Semua struktur tersebut kemudian di-optimasi dengan pelarut air dan selanjutnya dilakukan perhitungan frekuensi imajinernya pada keadaan dasar. Hasil yang harus didapatkan adalah nol untuk imajiner frekuensi reaktan dan zat antara serta satu nantinya untuk keadaan transisi. Langkah selanjutnya yang dilakukan adalah mencari struktur keadaan transisi dengan metode QST3 dan intrinsic reaction coordinate (IRC) dan menghitung energi dengan meng-gunakan metode MP2.
Data yang dihasilkan dari perhitungan kimia komputasi adalah parameter struktur senyawa yang meliputi panjang ikatan, energi potensial, dan energi aktivasi. Kesesuaian data eksperimen dengan data perhitungan merupakan parameter yang digunakan dalam menentukan kualitas metode perhitungan yang dilakukan.
HASIL
Pertimbangan awal yang digunakan adalah menentukan struktur reaktan, produk dan zat antara dalam kondisi paling stabil sehingga dapat ditentukan struktur keadaan transisi masing-masing jalur reaksi. Dari struktur keadaan transisi yang ditemukan tersebut, dapat dianalisis mekanisme reaksi yang sesuai.
A. Mekanisme Pembentukan Zat Antara 1
Struktur 3D
(a) (b)
(c)
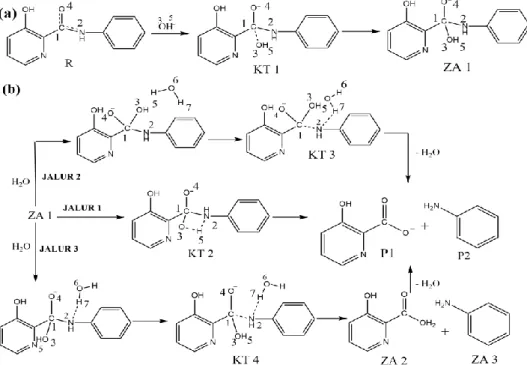
Gambar 2 Struktur Hasil Optimasi Frekuensi dari Reaktan (a), Zat Antara 1 (b) dan Keadaan Transisi 1 (c).
B. Bagian Reaksi dari Zat Antara 1 Menuju ke Produk 1 dan Produk 2 1. Proses Migrasi Proton Intra Molekuler – Jalur 1
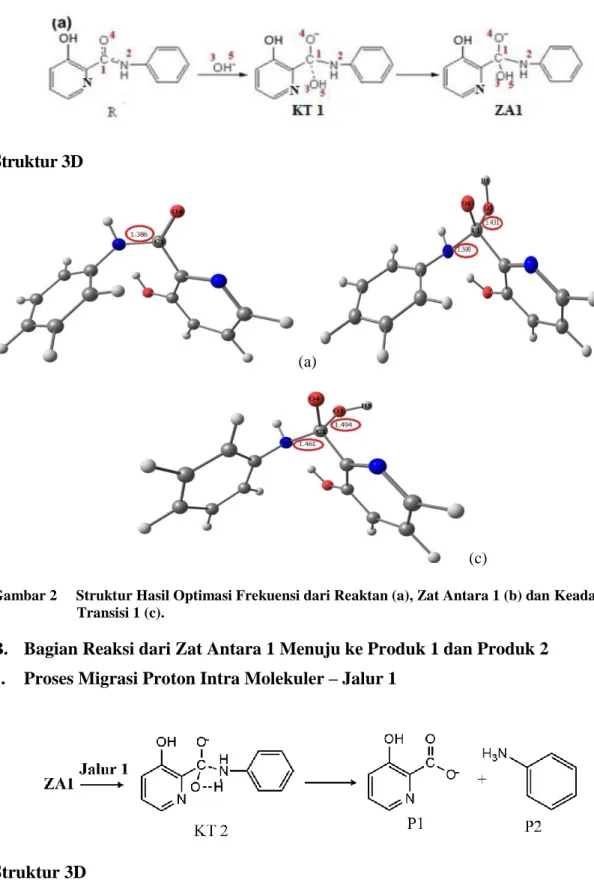
(a) (b) Gambar 3 Struktur Hasil Optmasi Frekuensi dari Zat Antara Tetrahedral 1 (a) dan Keadaan
Transisi 2 (b).
2. Proses Migrasi Proton Inter Molekuler – Jalur 2
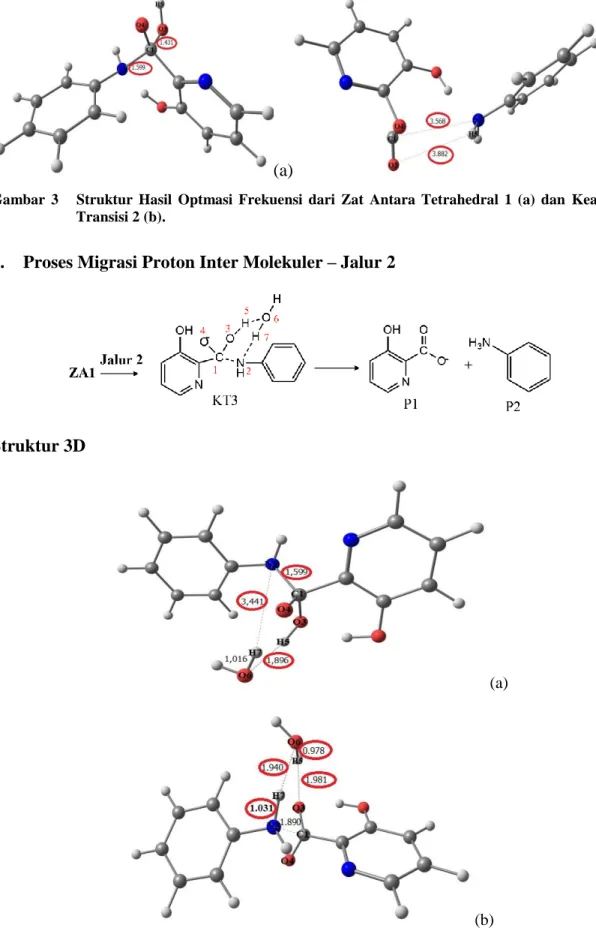
Struktur 3D
(a)
(b)
3. Proses Migrasi Proton Inter Molekuler – Jalur 3
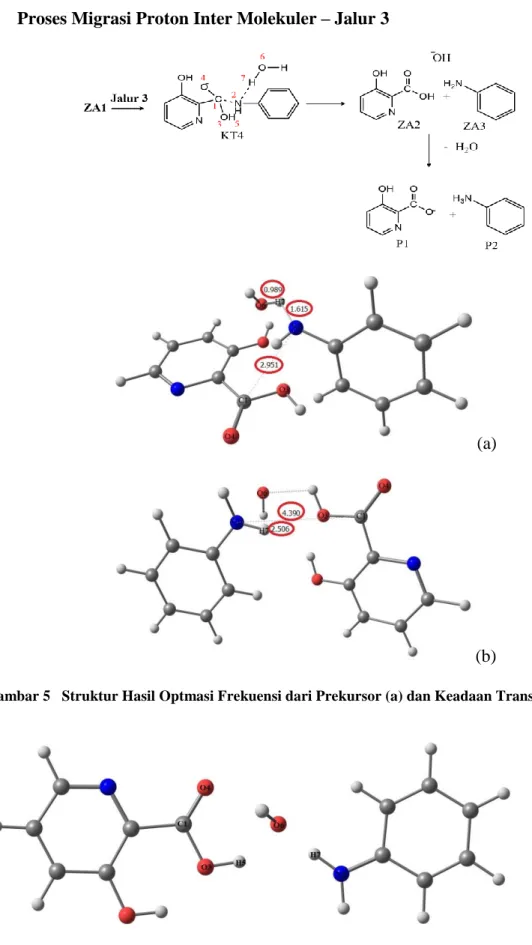
(a)
(b)
Gambar 5 Struktur Hasil Optmasi Frekuensi dari Prekursor (a) dan Keadaan Transisi 4 (b).
Zat antara 2 (ZA2) Zat antara 3 (ZA3)
PEMBAHASAN
Secara umum, terdapat dua proses dari hidrolisis senyawa N-fenil-3-hidroksi piko-linamida dalam suasana basa. Proses yang pertama adalah pembentukan zat antara te-trahedral (ZA1) akibat serangan nukleofilik dari atom karbon pada gugus karbonil dari ion hidroksida, seperti ditunjukkan pada Gambar 1a. Proses yang kedua adalah transformasi dari ZA1 menuju ke produk akhir (P1 dan P2), pada proses ini terdapat tiga prediksi jalur yang mungkin terjadi, ditunjukkan pada Gambar 1b.
Pembentukan Zat Antara Tetrahedral 1
Pada proses pembentukan KT 1, nukleofil OH- mendekat ke senyawa
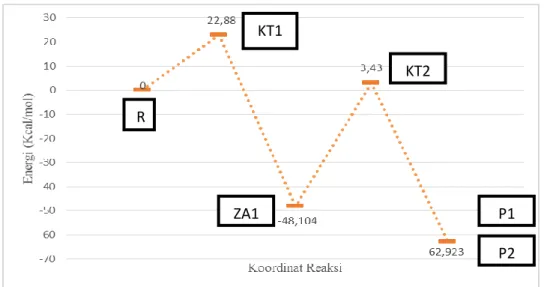
N-fenil-3-hidroksi pikolinamida dengan menyerang atom C gugus karbonil pada proses perubahan KT 1 menjadi ZA 1. Panjang ikatan antara C1—O3 mengalami penurunan sebesar 0.063 Å, panjang ikatan C1—N2 mengalami kenaikan dari R ke ZA1 sebesar 0.214 Å. Data tersebut menunjukkan bahwa ikatan amida mulai putus (Gambar 2). Penjelasan ini diperkuat dengan data bahwa panjang ikatan C1—N2 pada KT 1 (yaitu 1.461) ekuivalen dengan panjang ikatan C=N yaitu 1.35 Å (Jin dkk., 2011) ditunjukkan pada Gambar 2. Selain itu, penjelasan tersebut diperkuat dengan data bahwa panjang ikatan C1—N2 pada ZA1 (yaitu 1.599) ekuivalen dengan ikatan C—N pada umumnya yaitu 1.48 Å (Jin dkk., 2011). Hal ini me-nunjukkan bahwa pembentukan ZA 1 juga merupakan proses dekomposisi ikatan amida dari ikatan rangkap 2 menjadi ikatan tunggal. Energi aktivasi pada tahap ini adalah sebesar 22,88 kkal/mol.
Pada beberapa referensi sebelumnya, keadaan transisi pada tahap yang pertama ini cenderung diabaikan akibat kompleks pra reaksi yang mempengaruhi keadaan transisi (Cheshmedzhieva dkk., 2008). Penelitian kimia komputasi umumnya dilakukan pada fasa gas, atau sedikit molekul air yang ditambahkan dan hasilnya menunjukkan bahwa energi dari keadaan transisi lebih rendah dari pada reaktan. Tetapi setelah efek pelarut ditambahkan dengan model PCM, energi relatif dari keadaan transisi menjadi lebih tinggi dan kompleks pra reaktif tidak lagi mempengaruhi keadaan transisi. Hasil yang didapatkan tersebut menunjukkan bahwa pelarut memiliki efek yang besar.
Bagian Reaksi dari ZA1 Menuju ke P1 dan P2
Dalam lingkungan basa, asam 3-hidroksi-pikolinat (P1) berada pada bentuk anionnya dengan satu proton lepas dari atom oksigen, jumlah atom hidrogen pada N2 bertambah dari satu menjadi dua pada P2. Transformasi tersebut dapat terjadi melalui salah satu dari dua proses yaitu proses transformasi intramolekuler atau proses trans-formasi intermolekuler. Sebagai akibat dari proses tersebut, zat antara tetrahedral dapat bertransformasi menuju produk akhir melewati tiga jalur yang diusulkan seperti terlihat pada Gambar 1 (b). Jalur 1 adalah transfer proton intramolekuler dan jalur 2 dan 3 adalah proses migrasi proton intermolekuler dimana molekul air berpartisipasi pada reaksi tersebut. Faktanya, transformasi dari ZA1 menuju P1 dan P2 seperti proses pemutusan ikatan tunggal C1—N2. Masing-masing jalur tersebut dibahas sebagai berikut :
Proses Migrasi Proton Intra Molekuler – Jalur 1
menunjukkan bahwa ikatan amida hamipr putus. Selain itu, panjang ikatan antara N2— H5 pada keadaan transisi 2 adalah 1.018 Å (Gambar 3). Ikatan O3—H5 putus dan ter-bentuk ikatan hidrogen baru antara N2—H5. Hal ini terjadi karena atom N lebih kompe-titif dalam menarik proton karena bersifat nukleofilik. Penjelasan ini diperkuat dengan nilai muatan negatif berdasarkan persamaan mulliken adalah -0.1709 untuk atom N dan -0.2168 untuk atom O. Sebagai konsekuensinya proton H5 tertarik ke atom N2 dan menghasilkan produk akhir.
Energi keadaan transisi pada tahap (KT2) ini adalah sekitar 3,43 kkal/mol dan energi zat antara 1 adalah sekitar -48,104 kkal/mol sehingga energi aktivasi yang dihasilkan adalah sekitar 51,534 kkal/mol (Gambar 7), lebih rendah dari pada langkah yang pertama. Rata-rata energi dari produk (P1 dan P2) menunjukkan nilai yang lebih rendah dari pada reaktan, hal ini mengindikasikan bahwa reaksi bersifat eksotermis.
Pada jalur pertama telah dibahas tentang migrasi proton intramolekuler, akan tetapi proton dapat pula bermigrasi ke atom N melalui proses migrasi proton intermo-lekuler. Berdasarkan analisis tersebut dapat disimpulkan bahwa air tidak hanya bertin-dak sebagai pelarut, tetapi juga terlibat di dalam reaksi, dan selanjutnya dua tambahan jalur reaksi dapat terbentuk.
Gambar 7 Kurva Energi Jalur 1. Proses Migrasi Proton Intermolekuler – Jalur 2 dan Jalur 3 Jalur 2
Untuk jalur 2, suatu prekursor terbentuk dengan pergerakan dari molekul air menuju ZA1. Kemudian atom hidrogen H7 pada H2O secara perlahan berpindah ke N2.
H5 berpindah dari O3 menuju O6, ikatan amida dari C1—N2 mulai putus pada keadaan transisi 3. Setelah itu, molekul air terbentuk kembali, dan produk akhir P1 dan P2 juga terbentuk.
Panjang ikatan antara O6—H5 menjadi pendek (dari 1.896 Å menjadi 0.978 Å), begitu pula dengan N2—H7 (dari 1.599 Å menjadi 1.890 Å). Panjang ikatan antara C1—N2 pada keadaan transisi 3 (1.890 Å), lebih panjang dari pada prekursor (1.599 Å) (Gambar 4). Hal ini mengindikasikan bahwa interaksi antara kedua atom menjadi lemah.
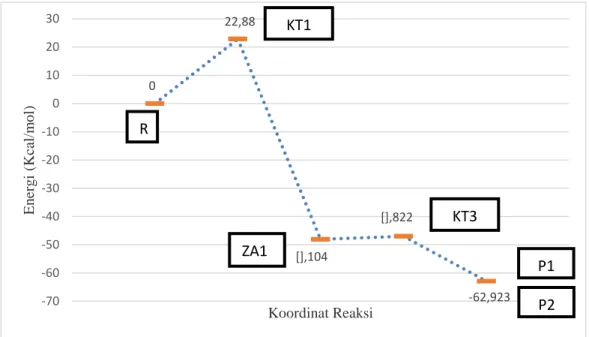
Energi keadaan transisi 3 dari jalur 2 ini adalah sekitar -47,822 kkal/mol dan energi zat antara 1 adalah sekitar -48,104 kkal/mol sehingga energi aktivasi yang
diperoleh sekitar 0,282 kkal/mol (Gambar 8). Energi aktivasi ini lebih rendah dari langkah yang pertama. Oleh karena itu, pembentukan P1 dan P2 dari ZA1 melalui jalur 2 lebih mudah berlangsung.
0 22,88 [],104 [],822 -62,923 -70 -60 -50 -40 -30 -20 -10 0 10 20 30 E n er g i (Kca l/m o l) Koordinat Reaksi
Gambar 8 Kurva Energi Jalur 2.
Jalur 3
Jalur 3 hampir sama dengan jalur 2. Pada jalur 3 ZA1 berinteraksi dengan molekul air sebelum berpindahnya proton dari H2O. Pada keadaan transisi 4 (KT4),
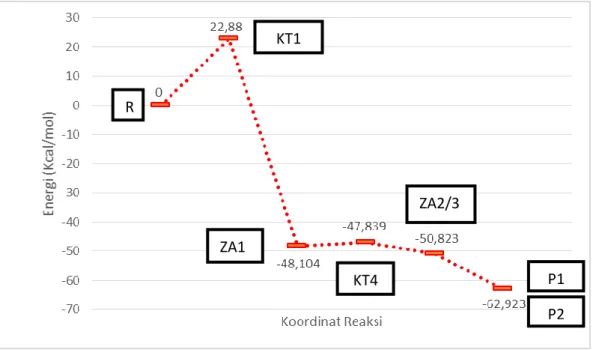
panjang ikatan dari O6—H7 mengalami kenaikan sebesar 1.517 Å (Gambar 5). Sementara itu, panjang ikatan antara C1—N2 adalah sebesar 4.390 Å. Hal ini me-ngindikasikan bahwa ikatan amida hampir putus. Setelah itu, proton H7 secara per-lahan-lahan berpindah ke N2, panjang ikatan C1—N2 bertambah kemudian ikatan amida putus. Zat antara 2 dan 3 (ZA2 & ZA3) terbentuk setelah proses ini. Selanjutnya, ion hidroksida pada ZA5 akan segera menetralkan asam 3-hidroksi pikolinat (ZA2), kemudian produk akhir (P1 dan P2) segera dihasilkan seperti pada jalur 1 dan jalur 2.
Energi keadaan transisi dari langkah ini (KT4) adalah sekitar -47,839 kkal/mol dan energi zat antara 1 (ZA1) adalah sekitar -48,104 kkal/mol sehingga energi aktiva-sinya adalah 0,265 kkal/mol (Gambar 9). Energi aktivasi tersebut juga lebih rendah dari pada energi aktivasi jalur 1. Karena itu, laju pembentukan P1 dan P2 melalui jalur 3 hampir sama seperti pada jalur 2.
Dari ketiga jalur reaksi yang telah dibahas, dapat kita simpulkan bahwa energi aktivasi yang diperlukan untuk jalur dua adalah 0,282 kkal/mol sedangkan jalur tiga adalah 0,265 kkal/mol. Energi aktivasi tersebut lebih rendah dari pada jalur satu yaitu 51,534 kkal/mol. Pembentukan produk dari ZA1 lebih cepat berlangsung melalui jalur 2 dan 3. Energi keadaan transisi pada jalur 2 (KT3) dan jalur 3 (KT4) lebih rendah
sehingga cenderung lebih mudah terjadi. Penelitian ini menunjukkan pula bahwa transfer proton pada reaksi yang menggunakan air sebagai pelarut mudah berlangsung. Hal ini dikarenakan air mampu menyetabilkan struktur, terbukti dengan energi yang lebih rendah pada struktur keadaan transisi dan zat antara pada jalur dua dan jalur tiga.
Gambar 9 Kurva Energi Jalur 3.
KESIMPULAN
Penelitian ini mengkaji tentang mekanisme reaksi hidrolisis N-fenil-3-hidroksi piko-linamida pada kondisi basa secara teoritis menggunakan kimia komputasi dengan metode Density Functional Theory (DFT) B3LYP pada himpunan basis 6-31G (d). Keseluruhan reaksi yang dikaji melewati dua tingkatan proses yang berkelanjutan, proses yang pertama adalah pembentukan zat antara tetrahedral ZA1, dan proses yang kedua adalah transformasi dari ZA 1 menuju produk akhir. Pada proses yang pertama, terjadi dekomposisi dari ikatan rangkap dua pada reaktan menjadi ikatan tunggal pada zat antara 1. Ikatan tunggal tersebut akhirnya putus pada proses yang kedua. Tiga jalur reaksi tambahan dari proses yang kedua diusulkan setelah mempelajari dan mempertimbangkan efek pelarut air yang ditimbulkan. Jalur yang pertama adalah proses migrasi proton intramolekuler sedangkan jalur dua dan tiga adalah proses migrasi proton intermolekuler yang melibatkan molekul air dalam reaksinya. Pada jalur 2 terdapat proses migrasi dua proton yaitu H5 dan H7 secara perlahan yang menyertai putusnya ikatan amida. Pada jalur 3, proton H7 berikatan pada N2 dan ikatan amida putus pada waktu yang bersamaan.
Keseluruhan struktur senyawa yang terlibat telah dioptimasi menggunakan metode DFT pada himpunan basis B3LYP/ 6-31G(d) dalam pelarut air menggunakan model PCM, energi potensial tiap proses juga telah di sertakan. Jalur 2 dan 3 terbukti memiliki energi aktivasi yang rendah sehingga lebih mudah untuk terjadi, dan jalur 2 lebih mungkin karena energi keadaan transisi pada jalur 2 lebih rendah dari pada jalur 3. Penelitian ini menunjukkan pula bahwa transfer proton pada reaksi dengan pelarut air memiliki proses yang mudah. Hal ini terbukti dengan energi dari keseluruhan proses reaksi pada ketiga jalur yang diusulkan tidak memiliki nilai yang tinggi. Khususnya apabila dibandingkan dengan hidrolisis pada kondisi netral pada penelitian sebelumnya (Jin dkk, 2011). Oleh karena itu, reaksi ini dapat dengan mudah terjadi pada suhu kamar dan reaksi bersifat eksotermis.
SARAN
Berdasarkan kesimpulan hasil penelitian, maka saran untuk penelitian
selanjutnya adalah sebagai berikut: (1) Dalam mengkaji mekanisme reaksi khususnya reaksi hidrolisis amida bisa digunakan himpunan basis yang lebih tinggi agar akurasi perhitungan lebih besar, (2) Bisa dikembangkan lebih lanjut tentang mekanisme reaksi senyawa turunan amida lain, (3) Bisa dilakukan penelitian eksperimen yang mengacu pada hasil penelitian teoritis ini agar hasilnya bisa saling mendukung dan mampu menutupi kelemahan masing-masing metode.
DAFTAR RUJUKAN
Cheshmedzhieva, D., Ilieva, S., Hadjieva, B. & Galabov, B. 2008. The mechanism of alkaline hydrolysis of amides: a comparative computational and experimental study of hydrolysis of N-methylacetamide, N-methylbenzamide, and acetanilide. Journal of Physical Organic Chemistry, 22 (2008): 619-631.
Foreshmen, J. B. & Frisch, A. 1996. Exploring Chemistry with Electronic Structures Methods. Pittsburgh: Gaussian, Inc.
Husniati. 2008. Sintesis Senyawa Analog UK-3A dan Uji Bioaktivitas Secara In Vitro Terhadap Sel Kanker Murine Leukemia P-388. Disertasi tidak diterbitkan. Jakarta: FMIPA UI.
Jin, Y., Zhu, Y. & Tang, M. 2011. Theoretical analysis on alkaline hydrolysis
mechanisms of N-(2-methoxyphenyl) benzamide. Journal of Computational and Theoretical Chemistry, 963 (2011): 268-272.
Sim, Y. L., Ariffin, A. & Khan, M. N. 2008. Kinetics and mechanism of large rate enhancement in the alkaline hydrolysis of N-Morpholino-N-(2-methoxyphenyl) phtalamide. Journal of Organic Chemistry, 73 (2008): 3730-3737.