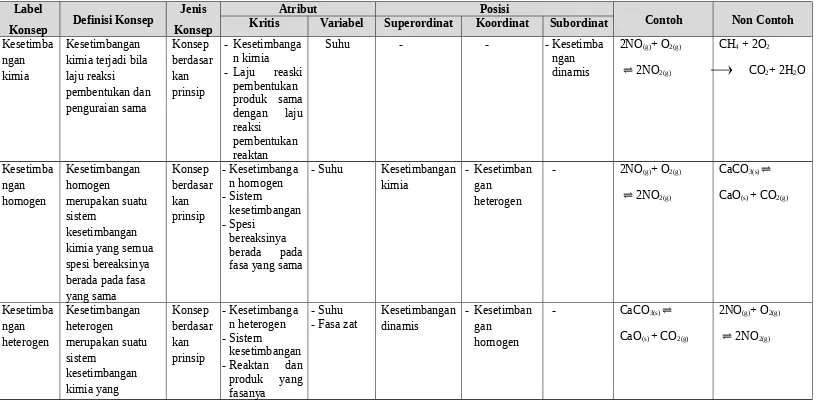
Label
Konsep Definisi Konsep
Jenis Konsep
Atribut Posisi
Contoh Non Contoh Kritis Variabel Superordinat Koordinat Subordinat
Kesetimba ngan kimia
Kesetimbangan kimia terjadi bila laju reaksi
pembentukan dan penguraian sama
Konsep berdasar kan prinsip
- Kesetimbanga n kimia
- Laju reaski pembentukan produk sama dengan laju reaksi
pembentukan reaktan
Suhu - - - Kesetimba
ngan dinamis
2NO(g)+ O2(g)
⇌ 2NO2(g)
CH4 + 2O2
CO2+ 2H2O
Kesetimba ngan homogen
Kesetimbangan homogen
merupakan suatu sistem
kesetimbangan kimia yang semua spesi bereaksinya berada pada fasa yang sama
Konsep berdasar kan prinsip
- Kesetimbanga n homogen - Sistem
kesetimbangan - Spesi
bereaksinya berada pada fasa yang sama
- Suhu Kesetimbangan
kimia
- Kesetimban gan
heterogen
- 2NO(g)+ O2(g)
⇌ 2NO2(g)
CaCO3(s) ⇌
CaO(s) + CO2(g)
Kesetimba ngan heterogen
Kesetimbangan heterogen
merupakan suatu sistem
kesetimbangan kimia yang
Konsep berdasar kan prinsip
- Kesetimbanga n heterogen - Sistem
kesetimbangan - Reaktan dan
produk yang fasanya
- Suhu - Fasa zat
Kesetimbangan dinamis
- Kesetimban gan
homogen
- CaCO3(s) ⇌
CaO(s) + CO2(g)
2NO(g)+ O2(g)
Konsep Konsep
melibatkan reaktan danproduk yang fasanya berbeda
berbeda
Tetapan kesetimba ngan (K)
Tetapan
kesetimbangan (K) diperoleh dari perbandingan hasil kali konsentrasi atau tekanan parsial produk dipangkatkan koefisiennya dengan hasil kali konsentrasi atau tekanan parsial reaktan
dipangkatkan koefisiennya
Konsep berdasar kan prinsip
- Tetapan
kesetimbangan - Perbandingan
hasil kali
konsentrasi atau tekanan parsial produk dengan hasil kali
konsentrasi atau tekanan parsial reaktan dipangkatkan koefisiennya
- Konsentra si
- Tekanan - Fasa zat - Suhu - Koefisien
reaksi
Kesetimbangan kimia
- - Kc
- Kp
2NO(g)+ O2(g)
⇌ 2NO2(g)
K= [NO2]
2
[
O2]
[NO]2K= tetapan kesetimbangan
2NO(g)+ O2(g)
⇌ 2NO2(g)
k =
v
[
O2]
x[NO]yk=konstanta laju reaksi
Kc Tetapan
kesetimbangan berdasarkan
konsentrasi (Kc)
menunjukkan perbandingan hasil kali konsentrasi produk dengan
Konsep berdasar kan prinsip
- Tetapan kesetimbangan berdasarkan konsentrasi (Kc)
- perbandingan hasil kali konsentrasi produk dengan hasil kali
- Konsentra si
- Fasa zat - Koefisien
reaksi - Suhu
Tetapan
kesetimbangan (K)
Kp - 2NO(g)+ O2(g)
⇌ 2NO2(g)
Kc=
2NO(g)+ O2(g)
⇌ 2NO2(g)
Konsep Konsep
hasil kali
konsentrasi reaktan dipangkatkan koefisiennya
konsentrasi reaktan dipangkatkan koefisiennya
kesetimbangan (K) menunjukkan perbandingan hasil kali tekanan parsial produk dengan hasil kali tekanan parsial reaktan dipangkatkan koefisiennya
Konsep berdasar
- Perbandingan hasil kali tekanan parsial produk dengan hasil kali tekanan parsial reaktan
dipangkatkan koefisiennya
- Tekanan - Fasa zat - Koefisien
reaksi - Suhu
Tetapan
kesetimbangan (K)
Pergeseran kesetimbangan kimia merupakan perubahan susunan zat-zat dalam kesetimbangan karena pengaruh perlakuan dari luar
Konsep berdasar kan prinsip
- Pergeseran kesetimbangan - Perubahan
susunan zat dalam
kesetimbangan - Pengaruh
perlakuan dari luar
- Konsentra si
- Tekanan - Suhu - Volume - Katalis
Kesetimbangan kimia
- Azas Le
Chatelier
Reaksi bergeser ke arah produk jika tekanan diperbesar
Reaksi tidak bergeser jika tekanan diperbesar
Azas Le Chatelier
Azas Le Chatelier menunjukkan bahwa bila
Konsep berdasar
- Reaksi Pergeseran kesetimbangan - - Konsentrasi
- Tekanan
Konsep Konsep
terhadap suatu kesetimbangan dilakukan suatu tindakan (aksi), maka sistem itu akan mengadakan reaksi
prinsip kesetimbangan
dilakukan tindakan (aksi) sistem akan mengadakan reaksi
- Suhu - Volume - Katalis
+H2O(g)
ΔH = -890 kJ
-Jika suhu diturunkan, kesetimbangan akan bergesar
ke arah CO2
dan H2O.
-Jika suhu dinaikan, kesetimbangan akan bergeser
ke arah CH4
dan O2.
+H2O(g)
ΔH = -890 kJ
Perubahan entalpi standar
pembakaran CH4 ialah 890 kJ
Konsentra si
Konsentrasi mempengaruhi kesetimbangan yaitu apabila konsentrasi zat pereaksi diperbesar maka
kesetimbangan akan bergeser ke arah zat hasil reaksi
Konsep berdasar kan prinsip
-Konsentrasi -Konsentrasi zat
pereaksi diperbesar maka
kesetimbanga n akan bergeser ke arah zat hasil reaksi
- Konsentra
si zat
pereaksi - Konsentra
si zat hasil reaksi
Azas Le Chatelier
- Tekanan - Suhu - Volume - Katalis
- CH4(g) + 2O2(g)
CO
⇌ 2(g)
+H2O(g)
- Jika
konsentrasi
CH4 atau O2
diperbesar, maka reaksi akan bergeser
CH4(g) + 2O2(g)
CO
⇌ 2(g)
+H2O(g)
Konsep Konsep
dan bila konsentrasi zat pereaksi diperkecil maka
kesetimbangan akan bergeser ke arah zat pereaksi
-Konsentrasi zat pereaksi diperkecil maka
kesetimbanga n akan bergeser ke arah zat pereaksi
ke arah CO2
dan H2O
- Jika
konsentrasi
CH4 atau O2
diperkecil, maka reaksi akan bergeser
ke arah CH4
dan O2
- Jika tekanan diperkecil akan bergeser ke arah pereaksi
Tekanan Tekanan
mempengaruhi kesetimbangan yaitu apabila tekanan diperbesar (volum diperkecil), kesetimbangan akan bergeser ke arah yang jumlah koefisiennya paling kecil. Sedangkan jika tekanan diperkecil (volum diperbesar), kesetimbangan akan bergeser ke
Konsep berdasar kan prinsip
- Tekanan - Tekanan
diperbesar (volum diperkecil), kesetimbangan akan bergeser ke arah yang jumlah koefisiennya paling kecil - Tekanan
diperkecil (volum diperbesar), kesetimbangan akan bergeser ke arah yang
- Tekanan
- Koefisien Azas Le Chatelier - Konsentrasi- Suhu
- Volume - Katalis
- CH4(g) + 2O2(g)
CO
⇌ 2(g)
+H2O(g)
- Jika tekanan diperbesar, reaksi akan bergeser ke arah hasil reaksi
- Jika tekanan diperkecil akan bergeser ke arah pereaksi
CH4(g) + 2O2(g)
CO
⇌ 2(g)
+H2O(g)
- Jika
konsentrasi
CH4 atau O2
diperbesar, maka reaksi akan bergeser
ke arah CO2
dan H2O
- Jika
konsentrasi
CH4 atau O2
Konsep Konsep
arah yang jumlah koefisiennya paling besar
jumlah koefisiennya paling besar
maka reaksi akan bergeser
ke arah CH4
dan O2
Volume Volume
mempengaruhi kesetimbangan yaitu apabila volume diperbesar, kesetimbangan akan bergeser ke arah yang jumlah koefisiennya paling besar. Sedangkan jika volume diperkecil, kesetimbangan akan bergeser ke arah yang jumlah koefisiennya paling kecil
Konsep berdasar kan prinsip
- Volume - Volume
diperbesar, kesetimbangan akan bergeser ke arah yang jumlah koefisiennya paling besar - Volume
diperkecil, kesetimbangan akan bergeser ke arah yang jumlah koefisiennya paling kecil
- Volume - Koefisien
Azas Le Chatelier
- Konsentrasi - Tekanan - Suhu - Katalis
- CH4(g) + 2O2(g)
CO
⇌ 2(g)
+H2O(g)
- Jika volume diperbesar, reaksi akan bergeser ke arah pereaksi
- Jika volume diperkecil, reaksi akan bergeser ke arah hasil reaksi
CH4(g) + 2O2(g) diturunkan, kesetimbangan akan bergesar
ke arah CO2
dan H2O.
-Jika suhu dinaikan, kesetimbangan akan bergeser
ke arah CH4
dan O2.
Suhu Suhu
mempengaruhi kesetimbangan
Konsep berdasar kan
- Suhu - Suhu
dinaikkan, maka reaksi
- Suhu - Endoterm - Eksoterm
Azas Le Chatelier
- Konsentrasi - Tekanan - Volume - Katalis
Konsep Konsep
yaitu apabila suhu dinaikkan, maka reaksi akan bergeser ke pihak reaksi endoterm. Sedangkan jika suhu diturunkan, maka reaksi akan bergeser ke pihak reaksi eksoterm
prinsip akan bergeser
ke pihak reaksi endoterm - Suhu
diturunkan, maka reaksi akan bergeser ke pihak reaksi eksoterm
ΔH = -890 kJ
-Jika suhu diturunkan, kesetimbangan akan bergesar
ke arah CO2
dan H2O.
-Jika suhu dinaikan, kesetimbangan akan bergeser
ke arah CH4
dan O2.
- Jika volume diperbesar, reaksi akan bergeser ke arah pereaksi
- Jika volume diperkecil, reaksi akan bergeser ke arah hasil reaksi
Katalis Katalis dalam
reaksi
kesetimbangan tidak
mempengaruhi pergeseran kesetimbangan, tapi hanya berfungsi untuk mempercepat laju reaksi dengan cara
Konsep berdasar kan prinsip
- Katalis - Tidak
mempengaruhi pergeseran kesetimbangan - Hanya
berfungsi untuk
mempercepat laju reaksi - Energi aktivasi
- Laju reaksi - Energi
aktivasi
Azas Le Chatelier
- Konsentrasi - Tekanan - Suhu - Volume - Katalis
- Pembuatan
amoniak menggunakan katalis Fe untuk mempercepat terbentuknya produk
Konsep Konsep