KATA PENGANTAR
Puji syukur marilah kita panjatkan kepada Tuhan Yang Maha Esa, Allah SWT, yang senantiasa memberikan nikmat-Nya kepada hamba-Nya.Atas berkat dan rahmat-Nya lah, penulis dapat menyelesaikan tugas makalah yang berjudul “Alkana dan Sikloalkana” ini.
Terimakasih penulis sampaikan kepada Dosen Satuan Poses Ibu Idha Silviyati yang telah memberikan bimbingan guna menyelesaikan tugas makalah ini.
Penyusunan makalah ini dimaksudkan untuk memenuhi penilaian mata kuliah Satuan Proses.Harapan penulis, makalah ini dapat menambah perbendaharaan ilmu pengetahuan yang bermanfaat bagi kita semua, karena pada masa globalisasi ini, ilmu pengetahuan mutlak diperlukan.Melalui upaya belajar marilah kita bersama-sama mempersiapkan diri menjemput era mutu pendidikan yang lebih berkualitas.
Tentu saja dalam penyusunan makalah ini mungkin disana-sini masih terdapat banyak kekurangan baik di dalam penyajiannya maupun teknis penyusunannya.Oleh sebab itu, kritik dan saran yang sifatnya membangun senantiasa penulis harapkan.Tentu saja guna penyempurnaan pada makalah berikutnya.
Palembang , 05 Maret 2017
BAB I
LATAR BELAKANG
Dalam bidang kimia, hidrokarbon adalah sebuah senyawa yang terdiri dari senyawa karbon yang hanya tersusun dari atom hidrogen (H) dan atom karbon (C) .Seluruh hidrikarbon memiliki rantai karbon dan atom-atom hydrogen yang berikatan dengan rantai tersebut.Senyawa hidrokarbon merupakan senyawa karbon yang paling sederhana.Dalam kehidupan sehari-hari banyak kita temui senyawa hidrokarbon misalnya minyak tanah, bensin, gas alam, plastik dan lain-lain.
Sampai saat ini terdapat kurang dua juta senyawa hidrokarbon.Sifat senyawa-senyawa hidrikarbon ditentukan oleh struktur dan jenis ikatan kovalen antar atom karbon. Oleh karena itu untuk memudahkan mempelajari senyawa hidrikarbon yang begitu banyak, para ahli melakukan pergolongan hidrikarbon berdasarkan strukturnya dan jenis ikatan koevalen antar atom karbon dalam molekulnya
Berdasarkan susunan atom karbon dalam molekulnya, senyawa karbon terbagi dalam 2 golongan besar, yaitu senyawa alifatik dan senyawa siklik.
1. Senyawa hidrokarbon alifatik adalah senyawa karbon yang rantai C nya terbuka dan rantai C itu memungkinkan bercabang.
a. Senyawa alifatik jenuh adalah senyawa alifatik yang rantai C nya hanya berisi ikatan-ikatan tunggal saja. Golongan ini dinamakan alkana.
b. Senyawa alifatik tak jenuh adalah senyawa alifatik yang rantai C nya terdapat ikatan rangkap dua atau rangkap tiga. Jika memiliki rangkap dua dinamakan alkena dan memiliki rangkap tiga dinamakan alkuna.
2.Senyawa hidrokarbon siklik adalah senyawa karbon yang rantai C nya melingkar dan lingkaran itu mungkin juga mengikat rantai samping. Golongan ini terbagi lagi menjadi senyawa alisiklik dan aromatic. Senyawa alisiklik yaitu senyawa karbon alifatik yang membentuk rantai tertutup pada pembahasan kali ini kita akan membahas senyawa alisiklik.
Alkana biasa disebut dengan senyawa hidrokarbon jenuh.Disebut hidrokarbon karena di dalamnya hanya terkandung atom karbon dan hidrogen.Disebut jenuh karena hanya memiliki ikatan tunggal C-H dan C-C saja.Alkana memiliki rumus umum CnH2n+2, di mana n adalah bilangan asli yang menyatakan jumlah atom karbon. Alkana juga sering disebut
sebagai senyawa alifatik (Yunani = aleiphas yang berarti lemak). Hal ini dikarenakan lemak-lemak hewani mengandung karbon rantai panjang yang mirip dengan alkana.
Sikloalkana adalah senyawa hidrokarbon jenuh yang memiliki sekurang-kurangnya 1 cincin atom karbon, dengan rumus umum umum CnH2n. Selain alkana dengan rantai terbuka, di alam juga terdapat alkana dalam bentuk cincin. Senyawa tersebut dinamakan sikloalkana atau senyawa alisiklik (alifatik siklik). Apabila cincin sikloalkana adalah –CH2– maka senyawa tersebut memiliki rumus umum (CH2)n atau CnH2n.
ALKANA Struktur Alkana Rumus (CnH2n+2) Nama Struktur CH 4 Metana CH4 C 2 H 6 Etana CH3-CH3 C 3 H 8 Propana CH3-CH2-CH3 C 4 H 10 Butana CH3-CH2-CH2-CH3 C 5 H 12 Pentana CH3-CH2-CH2-CH2-CH3 C 6 H 14 Heksana CH3-CH2-CH2-CH2-CH2-CH3 C 7 H 16 Heptana CH3-CH2-CH2-CH2-CH2-CH2-CH3 C 8 H 18 Oktana CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 C 9 H 20 Nonana CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 C 10 H 22 Dekana CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 A. Pengertian Alkana
Alkana biasa disebut dengan senyawa hidrokarbon jenuh.Disebut hidrokarbon karena di dalamnya hanya terkandung atom karbon dan hidrogen.Disebut jenuh karena hanya memiliki ikatan tunggal C-H dan C-C saja.Alkana memiliki rumus umu CnH2n+2, di mana n adalah bilangan asli yang menyatakan jumlah atom karbon. Alkana juga sering disebut sebagai senyawa alifatik (Yunani = aleiphas yang berarti lemak).
Hal ini dikarenakan lemak-lemak hewani mengandung karbon rantai panjang yang mirip dengan alkana Alkana dengan satu formula dapat membentuk beberapa struktur molekul.Misalnya alkana dengan empat atom karbon dapat\ membentuk normal butana dan isobutana, keduanya sama-sama memiliki rumus molekul C4H10. Hal yang sama juga terjadi untuk C5H12, dan seterusnya. Suatu senyawa yang memiliki jumlah dan macam atom sama tetapi berbeda dalam penataannya disebut dengan isomer. Isomer berasal dari bahasa Yunani; isos + meros yang berarti terbuat dari bagian yang sama. Senyawa seperti butana dan isobutana hanya berbeda pada urutan atom yang terikat satu sama lainnya, disebut isomer konstitusional. Isomer konstitusional tidak terbatas hanya untuk alkana, tetapi juga pada sebagian besar senyawa organik. Isomer konstitusional bias berbeda pada susunan kerangka atom karbon (seperti pada butane dan isobutana), perbedaan gugus fungsi (seperti pada etanol dan dimetil eter), atau berbeda pada penempatan gugus fungsi (isopropilamina dan propilamina). Meskipun memiliki formula yang sama, sifat-sifat fisika kimia dari isomer biasanya berbeda. Alkana dapat digambarkan dengan menggunakan struktur terkondensasi.Semua ikatan dalam molekul diabaikan/ dihilangkan.
Jika ada tiga atom hidrogen terikat pada satu karbon, digambar dengan CH3, jika dua hidrogen digambar dengan CH2, dan seterusnya. Dengan demikian kita dapat menggambar butane dengan struktur CH3CH2CH2CH3 atau CH3(CH2)2CH3. Alkana diberi nama berdasarkan jumlah atom karbonnya. Penamaan diambil dari bahasa Yunani, kecuali untuk satu hingga empat atom karbon, yaitu metana, etana, propana, dan butana. Akhiran ana ditambahkan pada akhir tiap nama untuk memberikan ciri bahwa senyawa tersebut adalah alkana. Selanjutnya, pentane berarti terdiri dari lima atom karbon, heksana terdiri dari enam karbon, dan seterusnya.
Alkana dengan satu formula dapat membentuk beberapa struktur molekul.Misalnya alkana dengan empat atom karbon dapat membentuk normal butana dan isobutana, keduanya sama-sama memiliki rumus molekul C4H10. Hal yang sama juga terjadi untuk C5H12, dan seterusnya. Suatu senyawa yang memiliki jumlah dan macam atom sama tetapi berbeda dalam penataannya disebut dengan isomer. Isomer berasal dari bahasa Yunani; isos + meros yang berarti terbuat dari bagian yang sama. Senyawa seperti butana dan isobutana hanya berbeda pada urutan atom yang terikat satu sama lainnya,disebut isomer konstitusional.
Isomer konstitusional tidak terbatas hanya untuk alkana, tetapi juga pada sebagian besar senyawa organik.Isomer konstitusional bisa berbeda pada susunan kerangka atom karbon (seperti pada butana dan isobutana), perbedaan gugus fungsi (seperti pada etanol dan dimetil eter), atau berbeda pada penempatan gugus fungsi (isopropilamina dan propilamina). Meskipun memiliki formula yang sama, sifat-sifat fisika kimia dari isomer biasanya berbeda. Alkana dapat digambarkan dengan menggunakan struktur terkondensasi.Semua ikatan dalam molekul diabaikan/ dihilangkan. Jika ada tiga atom hidrogen terikat pada satu karbon, digambar dengan CH3, jika dua hidrogen digambar dengan CH2, dan seterusnya. Dengan demikian kita dapat menggambar butana dengan struktur CH3CH2CH2CH3 atau CH3(CH2)2CH3.
Alkana diberi nama berdasarkan jumlah atom karbonnya. Penamaan diambil dari bahasa Yunani, kecuali untuk satu hingga empat atom karbon, yaitu metana, etana, propana, dan butana. Akhiran ana ditambahkan pada akhir tiap nama untuk memberikan ciri bahwa senyawa tersebut adalah alkana. Selanjutnya, pentana berarti terdiri dari lima atom karbon, heksana terdiri dari enam karbon, dan seterusnya.
Deret Homolog Alkana adalah suatu golongan atau kelompok senyawa karbon dengan rumus umum yang sama, mempunyai sifat yang mirip dan antar suku-suku berturutannya mempunyai beda CH2 .
B. Tahap Dalam Pemberian Nama Alkana
Tahap satu: Temukan rantai utama hidrokarbon
a. Rantai utama adalah rantai hidrokarbon terpanjang yang ada dalam molekul.
Contoh penamaan suatu alkane
b. Jika ada dua rantai yang sama panjang, pilih salah satu yang memiliki substituen lebih banyak
Pemilihan rantai terpanjang
Tahap dua: Nomori atom-atom dalam rantai utama
a. Mulailah dari ujung rantai yang paling dekat dengan rantai samping untuk memberi nonor urut pada rantai utama.
Penomoran rantai utama
b. Jika ada rantai samping dengan urutan yang sama darikedua ujung, pilih salah satu ujung yang memiliki rantai samping kedua yang lebih dekat.
Tahap tiga: dentifikasi tiap substituent
a. Beri nama rantai samping berdasarkan nomor urut dalam rantai utama.
Penamaan rantai samping
Penamaan alkana lengkap dengan substituennya
C. Sifat-sifat Alkana
Alkana kadang kala diacu untuk parafin (Latin; prum affinis) yang berarti memiliki afinitas rendah.Hal ini sesuai dengan sifat alkana, yaitu memiliki afinitas yang rendah terhadap senyawa lain, dan relatif inert. Meskipun demikian, alkana dapat bereaksi dengan senyawa lain dalam kondisi yang sesuai. Alkana bereaksi dengan oksigen selama proses pembakaran, produknya adalah karbondioksida dan air serta membebaskan sejumlah energi dalam bentuk panas. Contohnya metana (gas alam) bereaksi dengan oksigen menurut reaksi:
Reaksi pembakaran metana
Selain itu, alkana juga dapat bereaksi dengan Cl2 ketika campuran keduanya diradiasi dengan sinar ultraviolet.Tergantung pada jumlah kedua reaktan dan lama reaksi, produk substitusi hidrogen alkana oleh atom klorida menghasilkan campuran produk klorinasi. Contohnya, metana bereaksi dengan Cl2 menghasilkan campuran produk yang terdiri dari
CH3Cl, CH2Cl2, CHCl3, dan CCl4
Reaksi metana dengan Cl2
Alkana memperlihatkan peningkatan titik didih dan titik lebur sesuai dengan peningkatan bobot molekulnya.Hal tersebut terjadi karena adanya energi dispersi yang lemah antar molekul.Energi dispersi meningkat sesuai dengan peningkatan ukuran molekul.Akibatnya titik didih dan titik lebur meningkat dengan semakin panjangnya rantai alkana.
Faktor lain yang mempengaruhi titik didih alkana adalah adanya rantai samping (cabang). Misalnya pentana, tanpa cabang memiliki titik didih 36.10C, titik didih isopentana (2-metil butana) 27.850C, sedangkan untuk neopentana (2,2-dimetilpropana) memiliki titik didih 9.50C. Adanya rantai samping membuat molekul memiliki luas permukaan yang lebih kecil, akibatnya memiliki energi disperse rendah.
SIKLOALKANA a. Pengertian Sikloalkana
Alkana merupakan senyawa organic hidrokarbon yang hanya mempunyai ikatan kimia tunggal pada struktur kimianya.Selain alkana dengan rantai terbuka, di alam juga terdapat alkana dalam bentuk cincin (rantai tertutup).Senyawa tersebut dinamakan sikloalkana atau senyawa alisiklik (alifatik siklik) yang merupakan sebuah tipe alkane yang mempunyai satu atau lebih cincin atom karbon pada stuktur kimia molekulnya. Sikloalkana sendiri hanya terdiri dari atom karbon (C) dan hydrogen (H) dan merupakan senyawa jenuh karena tidak ada ikatan C-C rangkap umtuk bias ditambahkan hydrogen.
Dalam pemberian nama sikloalkana selalu digunakan awalan siklo-. Sebagai contoh, sikloalkana yang mengandung 3 atom C dinamakan siklopropana, yang mengandung 4 atom C dinamakan siklobutana, dan seterusnya. Pada sikloalkana yang mengandung substituen, pemberian namanya adalah dengan terlebih dahulu menyebut nama substituen tersebut, diikuti dengan nama sikloalkananya. Sebagai contoh, siklopentana yang mengandung sebuah substituen metil diberi nama metilsiklopentana. Bila substituennya lebih dari sebuah diperlukan penomoran dan dengan memperhatikan urutan alfabetik huruf pertama
masing-masing substituen. Sebagai contoh, 1,4-dimetilsikloheksana, 4-etil-1-metilsikloheksana, dan 1-tersierbutil-4-metilsikloheksana.
Kestabilan (ketidakreaktifan) sikloalkana pada mulanya dijelaskan dengan “teori regangan Baeyer” (Baeyer’s strain theory).Menurut teori ini, senyawa siklik seperti halnya sikloalkana membentuk cincin datar. Bila sudut-sudut ikatan dalam senyawa siklik menyimpang dari sudut ikatan tetrahedral (109,50) maka molekulnya mengalami regangan. Makin besar penyimpangannya terhadap sudut ikatan tetrahedral, molekulnya makin regang, dan berakibat molekul tersebut makin reaktif.
Sikoalkana memiliki kereaktifan yang sangat mirip dengan alkana, kecuali untuk sikloalkana yang sangat kecil – khususnya siklopropana.Siklopropana jauh lebih reaktif dibanding yang mungkin kita kira. Alasannya karena sudut-sudut ikatan dalam cincin. Normalnya, apabila karbon membentuk empat ikatan tunggal, maka sudut-sudut ikatannya adalah sekitar 109,5°. Pada siklopropana sudut ini sebesar 60°.
Jika ditinjau dari segi regangan cincinnya, yang dihitung berdasarkan harga kalor pembakaran, terbukti bahwa harga regangan total cincin yang terbesar adalah pada siklopropana, disusul dengan siklobutana, dan siklopentana. Pada sikloheksana harganya = 0, yang sama dengan harga senyawa rantai terbuka. Besarnya harga regangan pada siklopropana tersebut disebabkan oleh adanya regangan sudut dan regangan sterik.Makin besar penyimpangannya dari sudut tetrahedral, makin besar pula regangan sudutnya.
Dalam usaha mengurangi regangan agar diperoleh kestabilan, molekul sikloalkana mengalami konformasi.Pada siklopentana konformasinya mengakibatkan keempat atom karbonnya berada dalam satu bidang dan atom karbon kelima membentuk ikatan bengkok. Pada sikloheksana konformasinya mengakibatkan semua ikatan C-C-C mempunyai sudut 109,50. Salah satu dari konformasi pada sikloheksana dinamakan konformasi kursi, yang ditandai oleh adanya dua macam orientasi ikatan C-H, yaitu enam buah ikatan C-H aksial dan enam buah ikatan C-H ekuatorial.Dikenal pula adanya konformasi perahu pada sikloheksana, yang kestabilannya lebih rendah daripada konformasi kursi. Jika satu atom H pada sikloheksana diganti oleh gugus –CH3 atau gugus lain, maka gugus –CH3/ gugus lain tersebut dapat berposisi aksial/ ekuatorial. Dalam hal ini konformasi yang lebih stabil adalah konformasi dengan gugus –CH3 berposisi ekuatorial.
Bila sikloalkana mengikat substituen pada dua atau lebih atom karbon, maka terjadi isomer cis-trans. Salah satu contohnya adalah pada 1,2-dimetilsiklopentana. Dalam penggambaran strukturnya, cincin siklopentana digambarkan sebagai segilima datar, dengan ketentuan bila kedua substituennya terletak pada sisi yang sama dari bidang cincin dinamakan isomer cis, sedangkan bila berseberangan dengan bidang cincin dinamakan isomer trans. Pada sikloheksana juga dijumpai isomer-isomer cis-tans, yang bila digambarkan dengan konformasi kursi, yang masing-masing substituen dapat berposisi aksial atau ekuatorial. Sifat-sifat fisika dan kimia sikloalkana hampir sama dengan alkana, yaitu nonpolar, titik didih dan titik leburnya sebanding dengan berat molekulnya, dan inert (lambat bereaksi dengan senyawa lain). Reaksi sikloalkana dengan oksigen dapat menghasilkan CO2 dan H2O, sedangkan dengan halogen terhadi reaksi substitusi atom H oleh atom halogen.Khusus untuk siklopropana dan siklobutana, dengan kondisi reaksi khusus, dapat mengalami pemutusan cincin.
Di alam sikloalkana terkandung dalam minyak bumi bersama-sama dengan alkana.Kandungan sikloalkana dalam minyak bumi berkaitan erat dengan tempat mendapatkannya minyak bumi tersebut.Sebagai contoh, minyak bumi yang berasal dari California banyak mengandung sikloalkana. Dalam industri minyak bumi, sikloalkana dikenal dengan nama naftalena.
Untuk membuat sikloalkana, dapat digunakan bahan dasar senyawa alifatik, atau senyawa aromatik. Sebagai contoh, siklopropana dibuat dengan reaksi Freud, yaitu dengan mereaksikan 1,3-dibromopropana dengan logam seng. Untuk membuat sikloheksana dapat ditempuh dengan cara hidrogenasi benzena dengan katalis Ni, pada suhu dan tekanan tinggi.Sikloalkana paling sederhana adalah siklopropana yang memiliki 3 atom C dengan konformasi berbentuk planar. Sedangkan pada sikloalkana dengan jumlah atom C penyusun cincin lebih dari 3 memiliki bentuk yang tidak planar dan melekuk, membentuk suatu konformasi yang paling stabil (memiliki energi paling rendah), ingat bentuk molekul gula yang berbentuk segi enam, berupa pelana kuda dan bentuk kursi adalah bentuk yang stabil. Tabel di bawah ini menyajikan beberapa bentuk sikloalkana.
Sikloalkana juga hanya mengandung ikatan C-H dan ikatan tunggal C-C, hanya saja atom-atom karbon tergabung dalam sebuah cincin.Sikloalkana yang paling kecil adalah siklopropana.
Jika menghitung jumah karbon dan hidrogen pada gambar di atas, akan terlihat bahwa jumlah atom C dan H tidak lagi memenuhi rumus umum CnH2n+2. Dengan tergabungnya atom-atom karbon dalam sebuah cincin, ada dua atom hidrogen yang hilang.
Dua atom hidrogen yang hilang memang tidak diperlukan lagi, sebab rumus umum untuk sebuah sikloalkana adalah CnH2n.
Sikloalkana juga mempunyai gugus cincin. Sikloheksana misalnya, memiliki sebuah struktur cincin yang sebagai "cincin yang berkerut".terlihat seperti ini:
Struktur ini dikenal sebagai bentuk "kursi" dari sikloheksana – sesuai dengan bentuknya yang sedikit menyerupai sebuah kursi.
Tata Nama Sikloalkana 1) tentukan Jenis Sikloalkana
Hidrokarbon siklis dapat diberi nama sama dengan hidrokarbon nonsiklis, hanya perlu penambahan awalan Siklo- pada namyanya. Contohnya : untuk karbon dengan panjang 3 rantai siklis, diberi nama Siklopropana, 5 rantai siklis Pentana. Contohnya :
2) Jika Satu Substituen
Jika hidrokarbon siklis dengan satu bstituen, maka tidak perlu memberikan angka lokasi substituennya.Contoh : bromosiklopropana, metilsiklopentana, dll.
3) Jika Substituen Lebih Panjang Dari Siklik
Jika substituent memiliki rantai karbon yang lebih panjang dari pada cincin kabon, maka cincin karbon adalah substituennya, bukan rantai utamanya.Penamaannya mengikuti aturan penamaan alkane, alkena atau alkuna dengan substituennya akil siklik. Berikut adalah nama untuk beberapa gugus/subsstituen alkil dan contoh senyawanya :
4) Jika Terdapat Dua Substitun
Jika terdapat dua substituent dalam etilen karbon, maka dilakukan penomoran dengan urutan alphabet.Nomor satu ialah pada substituent dengan huruf awal lebih dulu dari alphabet, kemudian perhitungan secara memutar dilakukan sesuai dengan cabang kedua terdekat dari nomor satu. Contoh ( 1-Etil-3-metilsikloheksana)
5) Hitung Jumlah Substituen
Tambahkan imbuhan di-, tri-, tetra-, dst untuk menunjukkan jumlah substituuen pada hidrokarbon siklik tersebut.
6) Urutan Penyebutan Substituen
Selain alkana dengan rantai terbuka, di alam juga terdapat alkana dalam bentuk cincin.Senyawa tersebut dinamakan sikloalkana atau senyawa alisiklik (alifatik siklik). Apabila cincin sikloalkana adalah –CH2- maka senyawa tersebut memiliki rumus umum (CH2)n atau CnH2n.Senyawa-senyawa alosiklik dengan cincin berbeda terdapat berlebihan di alam. Contohnya, prostaglandin, hormon yang mengatur secara luas bermacam fungsi fisiologis manusia termasuk agregasi platelet darah, dilatasi bronkus, dan penghambatan sekresi gastrin, memiliki cincin karbon lima anggota (siklopenatana).
Struktur prostaglandin E1
Steroid, seperti kortison, mengandung cincin-cincin yang terikat satu sama lain, tiga cincin dengan enam anggota (sikloheksana) dan satu cincin lima anggota (siklopentana).
Struktur kortison
1. Penamaan sikloalkana a. Temukan rantai utama
Hitung jumlah atom karbon penyusun cincin dan jumlah karbon dalam substituennya. Jika jumlah karbon dalam cincin sama dengan jumlah karbon dalam
substrituen, maka senyawa tersebut diberi nama sebagai sikloalkana tersubstitusi alkil. Akan tetapi jika jumlah karbon dalam substituen lebih banyak dari pada karbon dalam cincin maka senyawa tersebut diberi nama sebagai alkana tersubstitusi sikloalkil.
Contoh penamaan suatu sikloalkana
b. Jumlah substituen dan beri nama
Sikloalkana tersubstitusi alkil atau halogen, mulailah penomoran dari atom karbon yang mengikat substituen tersebut.Untuk substituent kedua dan seterusnya diberi nomor sekecil mungkin.
ETER
Pengertian Eter
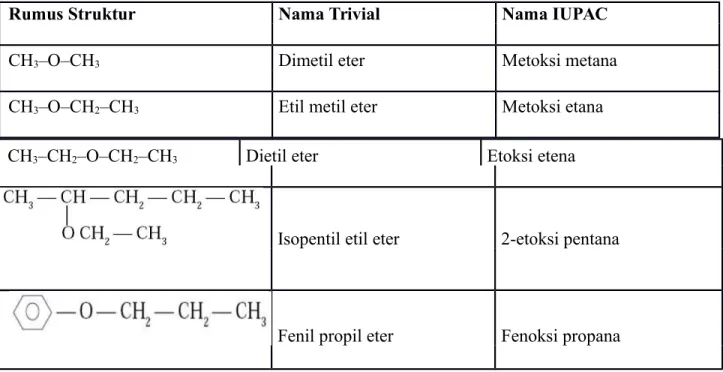
Eter adalah suatu senyawa organic yang mengandung gugus R-O-R ,dengan R dapat berupa akil maupun aril. Contoh senyawa eter yang paling umum adalah pelarut dan anestetik dietil eter (etoksietana, CH3-CH2-O-CH2-CH3).Eter sangat umum ditemukan dalam kimia organic dan biokimia, karena gugus ini merupakan gugus penghubung pada senyawa karbohidrat dan lignin.
Rumus Umum
Eter atau alkoksi alkana adalah golongan senyawa yang mempunyai dua gugus alkil yang terikat pada satu atom oksigen. Dengan demikian eter mempunyai rumus umum : R–O– R1 dimana R dan R1 adalah gugus alkil, yang boleh sama boleh tidak.
Contoh :
CH3–CH2–O–CH2–CH3 R = R1(eter homogen) CH3–O–CH2–CH2–CH3
R - R1(eter majemuk) Tata Nama Eter
Ada dua cara penamaan senyawa-senyawa eter, yaitu : a. IUPAC
1) Nama sistematik eter adalah alkoksi alkana. Alkil terkecil dianggap sebagai alkoksi, dan yang terbesar dianggap alkana.Contoh :
3) Gugus alkoksi merupakan salah satu substituen , sehingga penulisan namanya harus berdasarkan urutan abjad huruf pertama nomor substituent. Contoh :
4) Awalan di-, tri-, sek-, ters-, tidak perlu diperhatikan dalam penentuan urutan abjad sedangkan awalan yang tidak dipisahkan dengan tanda hubung (antara lain : iso-, dan neo-) diperhatikan dalam penentuan urutan abjad. Contoh :
b. Trivial
2 Tambahkan akhiran “eter” setelah nama-nama subtituen. Contoh :
Tabel 1. Penataan Nama Eter Menurut Trivial dan IUPAC
Rumus Struktur Nama Trivial Nama IUPAC
CH3–O–CH3 Dimetil eter Metoksi metana
CH3–O–CH2–CH3 Etil metil eter Metoksi etana
CH3–CH2–O–CH2–CH3 Dietil eter Etoksi etena
Isopentil etil eter 2-etoksi pentana
O
1100
Dimetil eter
CH3
CH3
R
O
R
Rumus umum suatu eter
atau
R’
O
R
C
O
C
Gugus fungsional suatu eterCH2
H2C
O
Etilen oksidaO
Tetrahidrofuran (THF)Struktur dan Ikatan
Eter memiliki ikatan C-O-C yang bersudut ikat sekitar 110° dan jarak C-O sekitar 140 pm. Sawar rotasi ikatan C-O sangatlah rendah. Menurut teori ikatan valensi, hibridisasi oksigen pada senyawa eter adalah sp3.
Oksigen lebih elektronegatif daripada karbon, sehingga hidrogen yang berada pada posisi alfa relatif terhadap eter bersifat lebih asam daripada hidrogen senyawa hidrokarbon. Walau demikian, hidrogen ini kurang asam dibandingkan dengan alfa hidrogen keton.
Struktur Eter
• Eter berbeda dari alkohol, dimana atom oksigen dari suatu eter terikat pada dua atom karbon. Gugus hidrokarbon dapat berupa alkil, alkenil, vinil, atau aril.
• Eter memiliki rumus umum R-O-R atau R-O-R’ dimana R’ adalah gugus alkil yang berbeda dari gugus R.
Eter Primer, Sekunder dan Tertier
Bentuk perkataan "eter primer", "Eter sekunder", dan "eter tertiar (peringkat ketiga) " adalah penggunaan bermusim dan merujuk kepada atom karbon bersebelahan dengan oksigen eter . Dalam eter primer karbon ini dikaitkan hanya kepada karbon lain seperti dalam dietil eter
CH3-CH2-O-CH2-CH3. salah Satu contoh eter sekunder adalah diisopropil eter (CH3)2CH-O-CH(CH3)2 dan contoh ether tertiar adalah di-tert-butil eter (CH3)3C-O-C(CH3)3.
Eter sekunder (diisopropil eter) Eter tertiar (di-tert-butil eter)
Dimetil eter, satu eter primer, satu sekunder dan satu tertiar.
Dietil eter, yang juga dikenal sebagai eter dan etoksi etana, adalah cairan mudah terbakar
yang jernih, tak berwarna, dan bertitik didih rendah serta berbau khas. Anggota paling umum dari kelompok campuran kimiawi yang secara umum dikenal sebagai eter ini merupakan sebuah isomernya butanol. Berformula CH3-CH2-O-CH2-CH3, dietil eter digunakan sebagai
pelarut biasa dan telah digunakan sebagai anestesi umum. Eter dapat dilarutkan dengan menghemat di dalam air (6.9 g/100 mL).
Dietil eter merupakan sebuah pelarut laboratorium yang umum dan memiliki kelarutan terbatas di dalam air, sehingga sering digunakan untuk ekstrasi cair-cair. Karena kurang rapat bila dibandingkan dengan air, lapisa eter biasanya berada paling atas. Sebagai salah satu pelarut umum untuk reaksi Grignard, dan untuk sebagian besar reaksi yang lain melibatkan berbagai reagen organologam, Dietil eter sangat penting sebagai salah satu pelarut dalam produksi plastik selulosa sebagai selulosa asetat.[4] Dietil eter memiliki angka setana yang tinggi, 85 sampai 96, digunakan sebagai salah satu cairan awal untuk mesin diesel dan bensin[5] karena keatsiriannya yang tinggi dan temperatur autosulutan.
Sebagian besar dietil eter diproduksi sebagai produk sampingannya fase-uap hidrasinyaetilena
untuk menghasilkan etanol. Proses ini menggunakan dukungan solid katalis asam fosfat dan bisa disesuaikan untuk menghasilkan eter lebih banyak lagi.[4] Fase-uap dehidrasinya etanol pada sejumlah katalis alumina bisa menghasilkan dietil eter sampai 95%[9] .
Dietil eter bisa dipersiapkan di dalam labolatorium dan pada sebuah skala industri oleh sintesis eter asam. Etanol dicampur dengan asam yang kuat, biasanya asam sulfat, H2SO4. Disosiasi
asam menghasilkan ion hidrogen, H+. Sebuah ion hidrogen memprotonasi atom oksigen
elektronegatifnyaetanol, memberikan muatan positif ke molekul etanol: CH3CH2OH + H+ → CH3CH2OH2+
Sebuah atom oksigen nukleofilnya etanol tak terprotonasi mengsubsitusi molekul air (elektrofil), menghasilkan air, sebuah ion hidrogen dan dietil eter.
CH3CH2OH2+ + CH3CH2OH → H2O + H+ + CH3CH2OCH2CH3
Reaksi ini harus berlangsung pada suhu yang lebih rendah dari 150°C agar tidak menghasilkan sebuah produk eliminasi (etilena). Pada temperatur yang lebih tinggi, etanol akan terdehidrasi untuk membentuk etilena. Reaki menghasilkan dietil eter adalah kebalikannya, sehingga pada akhir reaksi akan tercapai kesetimbangan antara reaktan dengan produk. Untuk menghasilkan eter yang bagus maka eter harus disuling dari campuran reaksi sebelum eter kembali menjadi etanol, dengan memanfaatkan prinsip Le Chatelier .
Reaksi lainnya yang bisa digunakan untuk mempersiapkan eter adalah sintesis eter Williamson, dimana sebuah alkoksida (yang dihasilkan dengan memisahkan/menguraikan sebuah logam alkali di dalam alkohol) melakukan substitusi nukleofilik di sebuah alkil halida (haloalkana).
Struktur Serupa
Eter tidak boleh disamakan dengan gugus-gugus sejenis berikut yang mempunyai stuktur serupa - R-O-R.
Senyawa aromatik seperti furan di mana oksigen adalah sebahagian daripada sistem aromatik.
Senyawa dengan atom-atom karbon yang bersebelahan dengan oksigen terikat dengan oksigen, nitrogen, atau sulfur:
Ester R-C(=O)-O-R Asetal R-CH(-O-R)-O-R Aminal R-CH(-NH-R)-O-R Anhidrida R-C(=O)-O-C(=O)-R
SIFAT-SIFAT ETER - Sifat-sifat fisika
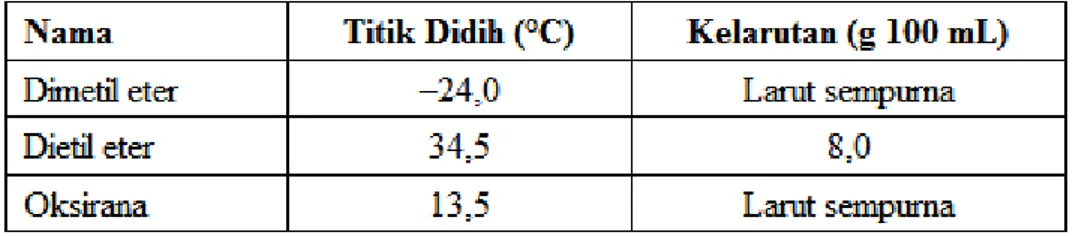
Molekul-molekul eter tidak dapat berikatan hidrogen dengan sesamanya, sehingga mengakibatkan senyawa eter memiliki titik didih yang relatif rendah dibandingkan dengan alkohol.
Eter bersifat sedikit polar karena sudut ikat C-O-C eter adalah 110 derajat, sehingga dipol C-O tidak dapat meniadakan satu sama lainnya. Eter lebih polar daripada alkena, namun tidak sepolar alkohol, ester, ataupun amida. walau demikian, keberadaan dua pasangan elektron menyendiri pada atom oksigen eter, memungkinkan eter berikatan hidrogen dengan molekul air.Eter dapat dipisahkan secara sempurna melalui destilasi.
Eter siklik seperti tetrahidrofuran dan 1,4-dioksana sangat larut dalam air karena atom oksigennya lebih terpapar ikatan hidrogen dibandingkan dengan eter-eter alifatik lainnya.
Beberapa alkil eter
Eter Struktur Titik
lebur (°C) Titik didih (°C) Kelarutan dalam 1 L H2O Momen dipol (D)
Dimetil eter CH3-O-CH3 -138,5 -23,0 70 g 1,30
Dietil eter
CH3CH2-O-CH2CH3 -116,3 34,4 69 g 1,14
Tetrahidrofuran O(CH2)4 -108,4 66,0 Larut pada semua perbandingan 1,74
perbandingan
SIFAT-SIFAT ETER 1 Sifat Fisik
Titik didih rendah sehingga mudah menguap Sulit larut dalam air, karena kepolarannya rendah
Sebagai pelarut yang baik senyawa-senyawa organik yang tak larut dalam air Mudah terbakar
Pada umumnya bersifat racun Bersifat anastetik (membius)
Eter sukar bereaksi, kecuali dengan asam halida kuat (HI dan H Br)
2 Sifat Kimia a Oksidasi
Oksidasi suatu eter dengan campuran kalium bikromat dan asam sulfat akan menghasilkan aldehida.
Contoh:
b Reaksi dengan asam sulfat. Eter dapat bereaksi dengan asam sulfat menghasilkan suatu alcohol dan asam alkana sulfonat. Contoh :
c Reaksi dengan asam iodide. Eter dapat bereaksi dengan asam iodide menghasilkan campuran alcohol dengan akil halide. Contoh :
d Hidrolisis.
Hidrolisis dengan asam sulfat suatu eter akan menghasilkan alcohol. Contoh :
e Halogenasi
Eter dapat mengalami reaksi substitusi oleh halogen. Substitusi terjadi pada atom Hα. Contoh :
Reaksi Eter
Ester adalah golongan senyawa organic yang memiliki rumus umum R-O-R’. Beberapa reaksi dari eter diantaranya adalah :
a Pembakaran
Eter mudah terbakar membentuk gas karbon dioksida dan uap air.Contoh :
b Reaksi dengan Logam Aktif
c Reaksi dengan PCL5
Eter bereaksi dengan PCL5 tetapi tidak membebaskan HCL.
d Reaksi dengan Hidrogen Halida (HX)
Eter terurai oleh asam halide, terutama oleh HI. Jika asam halide terbatas :
asam halide berlebih :
SIFAT DAN KEGUNAAN ETER
Tidak seperti alkohol, eter tidak memiliki ikatan hidrogen antar molekul sehingga titik didih eter di bawah titik didih alkohol untuk jumlah atom karbon yang sama, misalnya etanol dan dimetil eter. Etanol berisomer dengan dimetil eter (C2H6O), tetapi wujudnya berbeda. Pada suhu kamar, dimetil eter berwujud gas, sedangkan etanol berwujud cair.
Eter kurang larut di dalam pelarut air dibandingkan alkohol. Hal ini disebabkan eter memiliki kepolaran rendah. Walaupun sesama molekul eter tidak terjadi antaraksi, tetapi eter dapat berantaraksi dengan air dan alkohol. Makin tinggi rantai alkil dalam eter makin kurang kelarutannya di dalam air.
asam dan basa, eter cenderung stabil, kecuali pada suhu tinggi. Karena itu, eter sering digunakan sebagai pelarut untuk reaksi-reaksi organik.
Tabel Sifat Fisika Eter (Titik Didih dan Kelarutan)
Penggunaan eter harus hati-hati karena mudah terbakar. Umumnya eter dibuat dari dehidrasi alkohol. Dietil eter dapat dibuat melalui pemanasan etanol dengan asam sulfat pekat pada suhu sekitar 140 °C hingga reaksi dehidrasi sempurna.
Sintesis eter secara besar-besaran dengan metode illiamson, yaitu reaksi antara alkil halida dengan alkoksi atau fenoksi, persamaan reaksinya secara umum:
EPOKSIDA
Pengertian Epoksida
Epoksida adalah senyawa eter siklik dengan cincin yang memiliki tiga anggota. Struktur dasar dari sebuah epoksida berisi sebuah atom oksigen yang diikat pada dua atom karbon berdekatan yang berasal dari hidrokarbon. Tegangan dari cincin dengan tiga anggota ini membuat senyawa epoksida menjadi lebih reaktif daripada eter asiklik.
Struktur epoksida
O
C
C
Suatu
epoksida
O
CH
2
H
2
C
IUPAC: Oksirana
Umum: Etilena oksida
1
2 3
Metode yang paling umum digunakan untuk mensintesa epoksida adalah reaksi dari suatu alkena dengan suatu asam peroksi organik, yaitu suatu proses yang disebut epoksidasi.
RCH CHR
+
R'C O
O
OH
EpoksidasiO
CHR
RHC
R'C OH
O
+
Suatu epoksida (atau oksirana) Suatu alkena Suatu asamKarakteristik dari senyawa epoksida adalah gugus oksiran yang terbentuk oleh oksidasi dari senyawa olefinik atau senyawa aromatik ikatan ganda.
Senyawa epoksida merupakan senyawa yang sangat penting sama seperti produk kimia lainnya, misalnya resin. Epoksida minyak, yang produksinya mencapai sekitar level 50.000 ton per tahun, memiliki fungsi utama sebagai plastisizer dan stabilisator pada PVC (Gunstone, 1996).
Bentuk gugus epoksi, antara lain : Terminal
Internal
Gugus epoksi dapat pula menjadi bagian dalam sebuah struktur cincin, seperti:
Senyawa epoksida dapat dibuka dengan mudah, di bawah kondisi asam atau basa. Contohnya, hidrolisis propilen oksida yang dikatalis dengan senyawa asam atau basa untuk menghasilkan propilen glikol.
Epoksida merupakan gugus yang sangat reaktif, terutama dalam larutan asam karena akan menaikkan kecepatan pembukaan cincin oksida dengan cara protonasi kepada atom oksigen dan berinteraksi dengan berbagai macam reagen nukleofilik (Gunstone, 1996).
Salah satu produk penting industri petrokimia yang dapat dihasilkan dari minyak nabati adalah senyawa polihidroksi trigliserida. Senyawa ini banyak digunakan sebagai bahan poliuretan, bahan aditif plastik, pelumas, surfaktan, dll sehingga kebutuhan akan senyawa ini menjadi sangat tinggi. Senyawa polihidroksi trigliserida dihasilkan melalui reaksi hidroksilasi. Reaksi hidroksilasi meliputi dua tahap reaksi, yaitu reaksi epoksidasi dan reaksi pembukaan
cincin oksiran. Pada penelitian ini akan dibahas lebih mendalam mengenai reaksi epoksidasi. Karena kereaktifan yang tinggi dari cincin oksiren, epoksida dapat berlaku sebagai bahan baku untuk sintesis berbagai macam varietas kimia, seperti alkohol, glikol, alkanolamin, komponen karbonil, komponen olefin, dan polimer, seperti poliester, poliuretan, dan resin epoksi (Dinda et al, 2008).
Reagen (produk): HX = H2 (alkohol), H2O (diol), ROH (alkoksi alkohol), RCOOH (asiloksi alkohol), RCONH2 (asilamino alkohol), H2S (merkapto alkohol), HCN (cyano alkohol), HBr (bromo alkohol). Reaksi epoksidasi (terutama yang berasal dari triasilgliserol) dengan alkohol polihidrik menghasilkan komponen polihidroksi yang mana dapat direaksikan
dengan diisosianat untuk menghasilkan poliuretan. Epoksida dapat dikonversi menjadi keton melalui reaksi dengan natrium iodida dalam polietilen glikol (Gunstone, 1996).
Sebagai kesimpulan, epoksida diproduksi bukan hanya sebagai produk akhir, tetapi juga sebagai intermediet karena epoksida merupakan komponen yang sangat bernilai dalam sintesis kimia organik. Sekarang ini, beberapa usaha telah dilakukan agar reaksi dapat berlangsung secara selektif dengan penggunaan katalis (Brown et al., 2009).
Reaksi Epoksidasi
A. Oksidasi alkena dengan asam peroksikarboksilat
Metode laboratorium yang paling umum untuk sintesis epoksida dari alkena adalah oksidasi dengan asam peroksikarboksilat (Brown et al., 2009). Epoksidasi biasanya terjadi melalui reaksi dengan suatu asam peroksi yang seringkali disiapkan secara in situ. Asam-asam peroksi ini merupakan hasil dari reaksi dari Asam-asam karboksilat atau suatu gugus asil yang lain dengan hidrogen peroksida bersama dengan katalis asam jika diperlukan (Gunstone, 1996). Telah diketahui bahwa urutan efektifitas katalis yaitu, asam sulfat, asam fosfat, asam nitrat, dan asam klorida (Dinda et al., 2008). Reaksi yang terjadi adalah sebagai berikut:
Asam peroksiformat atau asam peroksiasetat secara luas digunakan dalam skala industri, tetapi asam peroksi yang lain kadang-kadang lebih bagus digunakan dalam skala laboratorium, seperti asam peroksitrifluoroasetat, asam peroksilaurat, asam peroksibenzoat, asam 3-kloroperoksibenzoat, dan asam monoperoksi yang merupakan turunan dari asam suksinat, asam maleat atau asam phtalat anhidrid (Gunstone, 1996).
B. Epoksidasi Asimetris Sharpless
Satu dari reaksi organik yang sangat bermanfaat telah diketahui pada beberapa dekade terakhir adalah epoksidasi asimetris dari alil alkohol dengan katalis titanium yang dikembangkan oleh Professor Barry Sharpless, Universitas Stanford. Reagen yang digunakan
Bentuk dari asam tartrat yang digunakan dalam epoksidasi Sharpless adalah (+)-dietil tartrat atau enantiomernya, (-)-dietil tartrat (Brown et al., 2009).
C. Substitusi nukleofilik internal oleh halohidrin
Salah satu metode untuk persiapan epoksida dari alkena yaitu melibatkan pemberian perlakuan terhadap alkena dengan klorin atau bromin dalam air untuk membentuk klorohirdrin atau bromohidrin kemudian diikuti oleh perlakuan halohidrin dengan basa agar terjadi pemindahan Cl- secara intramolekular. Di bawah ini merupakan langkah-langkah untuk mengubah propena menjadi 1-kloro-2-propanol, kemudian menjadi metiloksiren (propilen oksid).
Konversi halohidrin menjadi epoksida dengan suatu basa merupakan stereoselektif dan dapat ditinjau sebagai reaksi SN2. Ion hidroksida atau basa lainnya memisahkan proton dari grup hidroksil halohidrin untuk membentuk ion alkoksida, suatu nukleofil yang bagus, yang menggantikan halogen yang terdapat pada karbon terdekat. Sebagaimana semua reaksi SN2, penyerangan nukleofil adalah dari arah belakang ikatan C-X dan menyebabkan inversi dari konfigurasi rantai karbon pada bagian yang terjadi substitusi.
Pada kasus ini, penggantian alkoksida dan penghilangan ion halida terjadi pada atom-atom karbon yang berdekatan (Brown et al., 2009).
D. Epoksidasi dengan molekul oksigen menggunakan katalis perak
Etilen oksid merupakan salah satu dari sedikit epoksida yang disintesis dalam skala industri, dilakukan dengan cara melewatkan etilen dan udara melalui katalis perak (Brown et al., 2009). Epoksidasi dengan katalis perak merupakan metode yang paling murah dan paling ramah lingkungan. Akan tetapi, kegunaan metode ini seringkali terbatas pada beberapa substrat, seperti etilen dan butadien, sementara untuk alkena yang lain akan memberikan hasil yang sangat rendah (Dinda et al., 2008).