BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Jeruk Bali Merah
2.1.1 Morfologi Jeruk Bali Merah (Citrus maxima Merr.)
Tanaman jeruk bali merah berbentuk pohon dan berkayu. Tingginya tergantung varietas dan umur tanaman. Jeruk ini yang berumur 16 tahun tingginya sekitar 5 m. Batang tanaman keras, kuat dan bengkok-bengkok. Diameternya sekitar 10-15 cm. Batang diselimuti oleh oleh kulit batang yang cukup tebal. Batangnya ada yang berduri dan ada yang mulus tidak berduri. Daun berbentuk bulat telur dan lebih besar dari jenis lain. Tepi daunnya agak rata, sedang dekat ujungnya agak berombak dan ujungnya tumpul. Bunganya merupakan bunga tunggal atau majemuk yang bertandan. Tiap tangkai jeruk bali menghasilkan satu buah dan bakal buah berkerucut. Setelah tua buah berubah menjadi bulat besar. Berat buahnya bervariasi antara 0,75-1,5 kg per buah dengan diameter 10-20 cm. Ketebalan kulit buah bergantung pada varietasnya. Kulit buah jeruk ini terbagi menjadi tiga lapisan, yaitu kulit luar, kulit bagian tengah dan kulit bagian dalam. Kulit luar ada yang berwarna hijau, hijau kekuningan atau kuning. Sedang kulit buah bagian tengah berwarna putih bersih dan kulit bagian dalam berwarna pink muda. Tiap buah jeruk ini biasanya berisi 11-16 ruang atau sisir. Di dalam kulit buah bagian dalam inilah bias dijumpai daging buahnya yang segar dan banyak mengandung air. Daging buah ada yang putih, merah muda dan merah (Ade,2000).
2.1.2 Manfaat Jeruk Bali Merah
Manfaat dari jeruk bali merah pada beberapa literatur yaitu dinyatakan memiliki kandungan flavonoida yang mempunyai aktivitas sebagai poliferation, sitotoksik dan apoptosis terhadap kanker colon (Daniel et all, 1999). Literatur lain juga melaporkan bahwa flavonoida yang terkandung dalam tumbuhan jeruk (Citrus) mempunyai aktivitas sebagai antikanker (Evans, 1998).
2.1.3 Sistematika Jeruk Bali Merah (Citrus maxima Merr.)
Sistematika buah jeruk bali merah adalah sebagai berikut : Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae Ordo : Rutales
Genus : Citrus
Spesies : Citrus maxima Merr. Nama Lokal : Jeruk Bali Merah
2.2 Tumbuhan Jeruk Bali
Jeruk Besar dalam bahasa Inggris disebut pummelos, bahasa Indonesia jeruk besar dan bahasa Jawa jeruk gulung. Jenis jeruk ini dapat tumbuh dengan baik didataran rendah hingga ketinggian 1.000 meter di atas permukaan laut. Jenis jeruk ini lebih menyukai daerah yang bertopografi datar (tidak bervariasi), permukaan air tanahnya dalam dan tidak tergenang air. Jenis jeruk berasal daerah kepulauan Polynesia sampai semenanjung Malaka. Berarti jenis jeruk ini asli berasal dari Indonesia. Setiap pohon yang besar dapat menghasilkan buah sebanyak 200 buah dalam satu musim. Waktu berbunga sama seperti jenis jeruk lain. Waktu pembentukan bunga sampai buah masak membutuhkan waktu sekitar 7-8 bulan. Jeruk besar terdiri dari berbagai macam jenis,
Jeruk Silempang, Jeruk Oyod Gondong, Jeruk Delima Kepyar (Kanisius, 1994), Jeruk Nambangan-Madiun, Jeruk Bali, Jeruk Gulung, Jeruk Pandanwangi (Soelarso, 1996).
Pomelo adalah sebutan untuk jeruk besar. Di Indonesia lebih dikenal sebagai jeruk bali atau jeruk gulung. Meskipun popular dengan sebutan jeruk bali, sentra jeruk ini bukan dipulau Bali, melainkan di Nambangan, Magetan (Jawa Timur). Tanaman jeruk bali tidak hanya terdapat di Nambangan. Tanaman asli Indonesia sudah menyebar di Iran, Pakistan, India, Malaysia, RRC dan Australia. Salah satu varietasnya, yaitu pomelo sudah dikembangkan di Negara-negara subtropis dan popular dengan sebutan grapefruit. Ukuran grapefruit sedikit lebih kecil dari jeruk bali dan kegunaannya hanya untuk konsentrat. Konsentrat grapefruit yang didinginkan biasa diminum pada pagi hari sebelum masyarakat menyantap roti, kentang, daging dan sarapan lainnya.
Jeruk bali merupakan terna pohon dengan pertumbuhan cabang mulai dari pangkal batang. Ketinggian tajuk hanya sekitar 10 m. Batang jeruk bali berkayu keras dan liat. Daun jeruk bali berbentuk jorong dengan ujung meruncing dan bersayap pada bagian tangkainya. Warna daun hijau muda, tebal dan mengilap. Bunga berwarna putih dan dan beraroma sangat harum, tumbuh pada ujung ranting. Bentuk buah bervariasi mulai dari bundar agak pipih hingga bundar sempurna. Warna kulit buah bervariasi dari hijau gelap sampai hijau kekuningan setelah masak. Diameter buah rata-rata sekitar 20 cm. Biji berukuran sekitar 1 cm. Daging buah mudah diurai, berwarna mulai dari putih, kekuningan merah jambu dan merah tua. Rasanya bervariasi dari masam, manis masam, manis sampai manis bercampur getir (agak pahit). Menteri pertanian RI melepas tujuh varietas jeruk bali. Ketujuh varietas tersebut adalah nambangan, nambangan merah, nambangan putih, nagetan tanpa biji, srinyonya, ades duku dan gulung (Rahardi, 2004).
2.3 Klasifikasi Bahan Alam
Bahan alam didefenisikan di sini sebagai senyawa organik dengan bobot molekul antara 100 hingga 2000. Dalam arti yang lebih luas, istilah bahan alam juga dapat digunakan untuk senyawa ruahan dari alam, seperti bahan tanaman mentah, bahan makanan, resin dan eksudat tanaman atau ekstrak bahan tanaman (Heinrich, 2005).
Senyawa kimia bermolekul besar merupakan bagian utama dalam organ tanaman kering. Senyawa bermolekul besar ini berfungsi sebagai pembentuk struktur tanaman (selulosa, kitin, lignin dan pektin), sebagai cadangan makanan amilum, protein, lipoprotein) atau untuk memenuhi fungsi metabolisme penting lainnya (protein dan enzim). Senyawa kimia dari tanaman yang berbeda-beda dapat disari dengan pelarut umum; berupa senyawa kimia tanaman dengan molekul kecil. Sejumlah kelompok bahan alam dapat dibuat dari asam amino fenilalanin, terutama fenilpropana, lignin, kumarin dan flavonoid, semuanya memiliki substruktur umum yang berbasis cincin 6-karbon aromati (unit C6) dengan rantai 3-karbon (unit C3) yang melekat pada cincin aromatik. Dengan meningkatnya jenis dan tipe senyawa yang ditentukan didalam berbagai bahan alam, senyawa yang terdapat dalam tumbuhan adalah senyawa metabolit primer dan senyawa metabolit sekunder (Heinrich, 2005).
2.3.1 Senyawa Metabolit Primer
Polisakarida, protein, lemak dan asam nukleat merupakan penyusun utama dari makhluk hidup, karena itu disebut metabolit primer. Keseluruhan proses sintesis dan perombakan zat-zat ini, yang dilakukan oleh organisme untuk kelangsungan hidupnya, disebut proses-proses metabolisme primer. Metabolisme primer dari semua organisme sama, meskipun sangat berbeda genetiknya (Manitto, 1981).
2.3.2 Senyawa Metabolit Sekunder
Proses-proses kimia jenis lain terjadi hanya pada spesies tertentu sehingga memberikan produk yang berlainan, sesuai dengan spesiesnya. Reaksi yang demikian nampaknya tidak merupakan proses yang terpenting bagi eksistensi dari suatu organisme, karena itu disebut proses metabolisme sekunder. Produk-produk metabolisme sekunder, serupa dengan yang semula disebut sebagai produk alami oleh para ahli kimia organik (Manitto, 1981).
Senyawa kimia bermolekul besar merupakan bagian utama dalam organ tanaman kering. Senyawa bermolekul besar ini berfungsi sebagai pembentuk struktur tanaman ( selulosa, kitin, lignin dan pektin), sebagai cadangan makanan amilum, protein, lipoprotein) atau untuk memenuhi fungsi metabolisme penting lainnya (protein dan enzim). Senyawa kimia dari tanaman yang berbeda-beda dapat disari dengan pelarut umum; berupa senyawa kimia tanaman dengan molekul kecil. Di antara senyawa kimia tanaman bermolekul kecil ini terdapat sekelompok senyawa kimia yang banyak dijumpai dalam semua tanaman; dan kelompok senyawa kimia yang khas untuk tanaman tertentu. Senyawa kimia molekul kecil dari kelompok yang disebut terakhir dengan penyebaran terbatas; selanjutnya kelompok ini disebut sebagai metabolit sekunder. Berikut ini beberapa penggolongan metabolit sekunder ; minyak atsiri, alkaloid, flavonoid, tanin, resin, glikosida, kumarin, terpenoid dan steroid (Midian, 2007).
Metabolit sekunder meskipun tidak sangat penting bagi eksistensi suatu individu, sering berperan pada kelangsungan hidup suatu spesies dalam perjuangan menghadapi spesies-spesies lain. Misalnya: zat kimia untuk pertahanan, penarik seks dan feromon (Manitto, 1981).
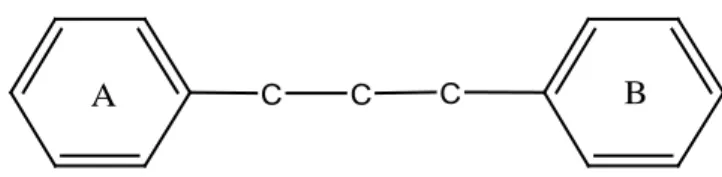
Senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15 atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh rantai linear yang terdiri dari tiga atom karbon. Kerangka ini dapat ditulis sebagai C6 -C3-C6. Jadi senyawa flavonoida adalah senyawa 1,3 diarilpropana, senyawa isoflavonoida adalah senyawa 1,2 biarilpropana, sedang senyawa-senyawa neoflavonoida adalah senyawa 1,1 diarilpropana (Manitto, 1992).
Senyawa flavonoid diturunkan dari unit C6 – C3 (fenilpropana) yang bersumber dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA, yang bergabung dengan unit C6 – C3 ( sebagai KoA tioester) untuk membentuk unit awal triketida. Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida.
Unit awal triketida mengalami siklisasi oleh enzim kalkon sintase untuk membentuk gugus kalkon pada flavonoid. Kemudian terjadi siklisasi untuk menghasilkan cincin piranon yang mengandung inti flavanon, yang dapat memiliki ikatan C2 – C3 teroksidasi (tak jenuh) untuk menghasilkan gugus flavon, atau dihidroksilasi pada posisi C3 cincin piranon untuk menghasilkan gugus flavanol pada flavonoid. Flavanol ini selanjutnya dioksidasi untuk menghasilkan antosianin, yang memberikan warna biru terang pada bunga dan anggur merah gelap (Heinrich, 2005).
Adapun struktur dari flavonoida adalah struktur yang mempunyai dua cincin aromatik yang dihubungkan dengan tiga karbon yang membentuk suatu cincin yang terdapat gugus eter (C-O-C) dan satu karbonil (C=O) yang dinotasikan cincin C. Kedua cincin aromatik ini dinotasikan cincin A dan B. Pada cincin A dan B ada dijumpai atau terdapat substituent hidroksil (OH) atau metoksi, juga gugus gula yang bentuk C-glikosida atau O-glikosida. Tapi ada juga senyawa flavonoida tanpa adanya gugus C=O yang disebut senyawa flavan (Ikan, 1969).
Flavonoid merupakan kandungan khas tumbuhan hijau dengan mengecualikan alga. Flavonoid sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit,tepung sari, nektar, bunga, buah dan biji. Hanya sedikit saja catatan yang
melaporkan adanya flavonoid pada hewan, misalnya dalam kelenjar bau berang-berang, ‘propopolis’ (sekresi lebah) dan didalam sayap kupu-kupu ; itupun dengan anggapan bahwa flavonoid tersebut berasal dari tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis didalam tubuh mereka (Markham, 1988).
Flavonoid mengandung sistem aromatik yang terkonyugasi dan karena itu menunjukkan pita serapan kuat pada daerah spektrum UV dan spektrum tampak. Akhirnya flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan aglikon flavonoida yang mana pun mungkin saja terdapat dalam satu tumbuhan dalam beberapa bentuk kombinasi glikosida. Flavonoid terdapat dalam semua tumbuhan berpembuluh, tetapi beberapa kelas lebih tersebar daripada yang lainnya : flavon dan flavonol terdapat disemesta, sedangkan isoflavon dan biflavon hanya terdapat pada beberapa suku tumbuhan (Harborne, 1996).
Struktur cincin flavonoid dan isoflavonoid berasal dari biosintesis campuran, cincin A yang berasal dari tiga unit asetat dari kepala ke ekor, sedangkan cincin b dan tiga karbon dari cincin pusat yang berasal dari asam sinamat. Sebagai unit asetat terlebih dahulu dikonversikan ke malonyl CoA kedua asetat-malonat dan jalur asam sikimat berkontribusi terhadap biosintesis flavonoid (Vickery, 1981).
Dalam tubuh manusia, flavonoid dapat berguna untuk mengobati gangguan sirkulasi perifer, menurunkan tekanan darah dan meningkatkan aquaresis. Banyak juga obat-obat mengandung flavonoid yang dipasarkan di berbagai negara sebagai obat anti-inflamasi, antispasmodik, antialergi dan antivirus ( Catherine, 1998).
2.4.1 Struktur Dasar senyawa Flavonoida
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat yang dihubungkan dengan tiga satuan karbon yang dapat atau tidak dapat membentuk cincin ketiga. Struktur dasar flavonoida dapat digambarkan sebagai berikut :
C C C
A B
Gambar 2.1 Kerangka dasar senyawa flavonoida
( Sastrohamidjojo, 1988)
2.4.2 Kegunaan Flavonoida
Bagi tumbuhan untuk menarik serangga, yang membantu proses penyerbukan dan untuk menarik perhatian binatang yang membantu penyebaran biji. Bagi manusia dalam dosis kecil, flavon bekerja sebagai stimulan pada jantung, hesperidin mempengaruhi pembuluh darah kapiler. Flavon terhidroksilasi bekerja sebagai diuretik dan sebagai antioksidan pada lemak (Midian,2007).
Senyawa flavonoid juga berperan dalam memberikan banyak warna lain di alam, terutama daun mahkota kuning dan jingga, bahkan flavonoid tidak berwarna mengabsorb cahaya pada spektrum UV (karena banyak memiliki gugus kromofor) dan dapat dilihat oleh banyak serangga. Senyawa ini diduga memiliki manfaat ekologi yang besar di alam berkat warnanya sebagai penarik serangga dan burung untuk membantu penyerbukan tanaman. Flavonoid tertentu juga mempengaruhi rasa makanan secara signifikan; misalnya beberapa tanaman memiliki rasa pahit dan kesat seperti flavanon naringin, pada kulit grapefruit ( Citrus paradisi ). Senyawa flavonoid diduga sangat bermanfaat dalam makanan karena, berupa senyawa fenolik, senyawa ini yang bersifat antioksidan kuat. Banyak kondisi penyakit yang diketahui bertambah parah oleh adanya radikal bebas seperti superoksida dan hidroksil. Dan flavonoid memiliki kemampuan untuk menghilangkan dan secara efektif ‘menyapu’ spesies pengoksidasi yang merusak ini. Oleh karena itu, makanan yang kaya flavonoid dianggap penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung ( Heinrich, 2005).
Ada juga beberapa literatur melaporkan bahwa senyawa flavonoida ini mempunyai aktivitas sebagai antioksidan (Nessa et all, 2004), sebagai inhibitor aktivitas cyclcooxcigenase-2 (Dae et all, 2002), sebagai anti mikroba (Leo et all, 2004), sebagai sitotoksi (Shi et all, 2001), memiliki aktivitas sebagai anti HIV ( Meralgeman et all, 2001 ), sebagai poliferation, sitotoksik dan apoptosis terhadap kanker colon (Daniel et all, 1999).
2.4.3 Klasifikasi Senyawa Flavonoida
1. Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoid O-glikosida; pada senyawa tersebut satu gugus hidroksil flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air (cairan),misalnya 7-hidroksil pada flavon, isoflavon dan dihidroflavon. 2. Flavonoida C-glikosida
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam. Glikosida yang demikian disebut C-glikosida. Sekarang gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid. Misalnya galaktosa, ramnosa, xilosa dan arabinosa.
3. Flavonoida Sulfat
Golongan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat atau lebih yang terikat padahidroksil fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam. Banyak yang berupa glikosida bisulfat, bagian bisulfat terikat pada hidroksil fenol yang mana saja yang masih bebas atau pada suatu gula.
4. Biflavonoida
Biflavonoid adalah flavonoid dimer walaupun prosianidin dimer biasanya tidak dimasukkan kedalam golongan ini. Flavonoid yang biasanya terlibat ialah flavon dan flavanon yang secara biosintesis mempunyai biosintesis yang
sederhana 5,7,4’ dan ikatan antar flavonoida berupa ikatan karbon-karbon atau ikatan eter. Monomer flavonoid yang digabungkan menjadi golongan biflavonoid yang satu jenis atau berbeda dan letak ikatannya berbeda-beda. Banyak sifat fisika dan kimia biflavonoid menyerupai sifat monoflavonoid pembentuknya misalnya spektrum UV-tampak, uji warna dan lain-lain. Biflavonoid jarang ditemukan sebagai glikosida dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
5. Aglikon Flavonoida
Sejumlah aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik. Yang termasuk dalam golongan flavonoid ini ialah flavanon, dihidroflavonol , katekin, pterokarpan, rotenoid dan beberapa biflavonoid (Markham, 1988).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu flavonol, flavon, isoflavon, flavanon, dihidrofavonol, katekin, leukoantosianidin, antosianidin, khalkon dan auron (Robinson, 1995).
1. Flavanon
Struktur senyawa ini terdiri dari 2 cincin aromatik (A dan B), cincin ini dihubungkan dengan satu cincin siklis yang memiliki gugus eter dan keton dan pada atom C-2 dan C-3 tidak terdapat ikatan rangkap (jenuh) yang disebut dengan cincin C. Spektrum UV dari flavanon pada metanol terletak pada panjang gelombang band I 300-303 nm dan band II 270-295 nm.
O
O
1 2 3 4 5 6 1' 2' 3' 4' 5' 6' 7 8 FlavanonA
B
C
(Bhat, 2005)Flavanon biasanya sebagai glikosida, terdapat dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus Prunus dan buah jeruk , dua glikosida yang paling lazim adalah naringin dan hesperetin, terdapat dalam buah anggur dan jeruk (Sastrohamidjojo, 1996).
2. Flavon
Struktur senyawa ini juga terdiri dari 2 cincin aromatik (A dan B) dan dihubungkan dengan cincin C, strukturnya cincin C nya sama dengan flavanon kecuali pada atom C-2 dan C-3 terdapat ikatan rangkap yang disebut cincin tak jenuh. Senyawa flavon ini mempunyai panjang gelombang (λmax) pada metanol dimana band I 304 nm dan band II 240-285 nm.
O
O
1 2 3 4 5 6 1' 2' 3' 4' 5' 6' 7 8 FlavonA
B
C
(Bhat, 2005) Flavon merupakan senyawa yang paling tersebar luas dari semua pigmen tumbuhan kuning, beberapa flavon secara ekonomi masih penting dan luteolin barangkali zat warna pertama yang dipakai di Eropa. Kuersetin adalah salah satu senyawa yang paling umum pada tumbuhan berpembuluh, diikuti oleh kamferol (Robinson, 1991).Titik lebur senyawa ini 99-1000C tidak larut dalam air, larut dalam pelarut organik. Dapat diisolasi dari Primula pulverulenta, P. japonica, P. imperialis, daun seribu (Achillea millefolium), Ginje (Thevetia peruviana), pada biji jagung (Zea mays) dan pada rambut (Midian, 2007).
3. Flavonol
Struktur senyawa ini mirip dengan struktur dari struktur flavon, kecuali dibedakan dari cincin C pada atom C-3 adanya gugus hidroksil (OH) atau disebut juga Flavon-3-O-l. Senyawa Flavonol ini mempunyai serapan UV pada metanol (λmax) pada band I 352 nm dan band II pada 240-285 nm.
O
O
1 2 3 4 5 6 1' 2' 3' 4' 5' 6' 7 8OH
FlavonolA
C
B
(Bhat, 2005) Flavonol lazim sebagi konstituen tanaman tinggi dan terdapat dalam berbagai bentuk terhidroksilasi. Flavonol alami yang paling sederhana adalah galangin, 3, 5, 7- tri-hidroksiflavon, sedangkan yang paling rumit, hibissetin adalah 3, 5, 7, 8, 3’, 5’- heptahidrosiflavon. Dua flavonol yang paling lazim yaitu kaempferol dan quersetin. Flavanon pada umumnya terdistribusi melalui famili tanaman tinggi, genus melicope mengandung melisimpleksin dan ternatin. Dan genus Citrus mengandung nobiletin, tangeretin dan 3’, 4’, 5, 6, 7-pentametoksiflavon (Sastrohamijdojo, 1996).4. Dihidroflavanol
Struktur dari senyawa ini mirip dengan struktur dari flavanon, kecuali pada cincin C pada atom C-3 ada gugus hidroksil (-OH). Senyawa ini memberikan absorbsi pada UV dengan (λmax) dalam metanol pada band I 300-320 nm band 270-295 nm. Senyawa ini disebut juga Flavanon 3-O-1 ( Bhat, 2005).
O O 1 2 3 4 5 6 1' 2' 3' 4' 5' 6' 7 8 OH Dihidroflavonol
A
C
B
5. Isoflavon
Struktur senyawa ini sama dengan struktur flavon kecuali pada cincin B terikat pada cincin C pada atom C-3. Ini mungkin terjadi proses migrasi dari gugus aril dan ini juga sebagai isomer dari senyawa Flavon. Senyawa ini menunjukkan serapan UV (λmax) pada metanol dimana band I 300-340 nm dan band II 245-270 nm (Bhat,2005).
O
O
1 2 3 4 5 6 1' 2' 3' 4' 5' 6' 7 8 IsoflavonA
C
B
Senyawa-senyawa isoflavon terutama terdapat dalam spesies-spesies dari famili Leguminosae, mereka tidak bewarna. Mereka semua menunjukkan daya estrogenik lemah, karena terdapat bagian struktur stilbena fenolik. Ada dua senyawa isoflavonoid yaitu senyawa-senyawa rotenoid dan senyawa homoisoflavonoid. Gugus hidroksil pada kedudukan 2’ pada struktur isoflavon menyebabkan organisme mampu untuk merubah struktur isoflavon menjadi lebih lanjut, misalnya senyawa-senyawa pterokarpana seringkali dihasilkan sebgai fitoaleksin, yaitu senyawa anti fungi yang dihasilkan oleh tumbuhan akibat serangan virus atau zat-zat jamur (Manitto, 1981). Isoflavon menunjukkan aktivitas sebagai estrogeni, insektisida, beberapa diantaranya berguna untuk racun ikan (Midian, 2007).
6. Auron
Senyawa ini terdiri dari cincin aromatik (A dan B) tetapi dihubungkan dengan satu cincin yang mengandung gugus eter dan karbonil juga dengan satu ikatan rangkap. Senyawa ini memberikan serapan pada UV dengan λmax pada metanol dengan band I 370-430 nm dan band II 240-300 nm (Bhat, 2005).
1 2 3 5 6 1' 2' 3' 4' 5' 6' 7 8 O O C H Auron
A
C
B
Auron berupa pigmen kuning emas terdapat dalam bunga tertentu dan bryofita. Dikenal hanya lima aglikon, tetapi pola hidroksilasi senyawa ini umumnya serupa dengan pola pada flavonoid lain begitu pula bentuk yang dijumpai ialah bentuk glikosida dan eter metal. Dalam larutan basa senyawa ini menjadi merah ros (Robinson, 1991).
7. Kalkon
Kalkon ini juga turunan dari senyawa fenolik dan ini adalah sebagai prekursor metabolisme untuk senyawa flavonoid. Struktur ini tidak terdiri dari sebuah cincin γ – pyron dan terdapat cincin terbuka yang terdiri dari 3 atom karbon α, β karbonil tak jenuh yang menghubungkan cincin aromatik. Senyawa ini menunjukkan serapan UV pada (λmax) dalam metanol pada band I 340-390 nm band II 220-270 nm (Bhat, 2005).
O
1 2 3 4 5 6 1' 2' 3' 4' 5' 6' KalkonA
B
Polihidroksi kalkon terdapat dalam sejumlah tanaman, namun terdistribusi dialam tidak lazim. Alasan pokok bahwa kalkon cepat mengalami isomerisasi menjadi flavanon dalam satuan keseimbangan. Kalkon terdapat dalam tanaman terutama sebagai pigmen daun bunga bewarna kuning, dalam kebanyakan terdapat dalam tanaman Heliantheaetribe, Coreopsidinae subtribe dan family Compositae (Sastrohamidjojo, 1996).
8. Katekin
Katekin adalah senyawa flavon-3-ol yang paling banyak terdapat dalam alam dan mudah sekali didapatkan dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering mengandung senyawa ini sekitar 30%, 60 % nya mengandung epigalokatekin-3-galat, 15% adalah epikatekin 3-galat dan epikatekin. Dalam kebanyakan buah, hanya satu flavan-3-ol yang sering ditemukan (Manitto, 1981).
O HO OH OH OH OHO 9. Leukoantosianidin
Leukoantosianidin merupakan senyawa tanpa warna, terutama terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol.
O
HO OH OH
Leukoantosianidin
10. Antosianidin
Antosianin ialah pigmen daun bunga merah samapi biru yang biasa, banyaknya sampai 30% bobot kering dalam beberapa bunga. Antosianin terdapat juga dalam
bagian lain tumbuhan tinggi dan diseluruh dunia tumbuhan kecuali fungi. Antosianin paku-pakuan dan lumut, khas berupa glukosida apigeninidin dan luteolinidin. Stafnorubin adalah antosianin yang tidak biasa yang terdapat dalam dinding sel membran sphagnum dalam musim gugur (Robinson, 1991).
O
OH
Antosianin
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana semua flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan semuanya mempunyai sejumlah sifat yang sama yakni:
Tabel 2.1. Golongan-golongan flavonoida menurut Harborne
Golongan flavonoida Penyebaran Ciri khas
Antosianin pigmen bunga merah marak,dan biru juga dalam daun dan jaringan lain.
larut dalam air, λmaks 515-545 nm, bergerak dengan BAA pada kertas.
Proantosianidin terutama tan warna, dalam daun tumbuhan berkayu.
menghasilkan antosianidin bila jaringan dipanaskan dalam HCl 2M selama setengah jam.
Flavonol terutama ko-pigmen tanwarna dalam bunga sianik dan asianik; tersebar luas dalam daun.
setelah hidrolisis, berupa bercak kuning murup pada kromatogram Forestal bila disinari sinar UV;
setelah hidrolisis, berupa bercak coklat redup pada kromatogram Forestal; Glikoflavon seperti flavonol maksimal spektrum pada 330-350 nm.
mengandung gula yang terikat melalui ikatan C-C; bergerak dengan
pengembang air, tidak seperti flavon biasa.
pada kromatogram BAA beupa bercak redup dengan RF tinggi .
dengan amonia berwarna merah, maksimal spektrum 370-410 nm.
Biflavonil tanwarna; hampir
seluruhnya terbatas pada gimnospermae
pada kromatogram BAA beupa bercak redup dengan RF tinggi .
dengan amonia berwarna merah, Khalkon dan auron pigmen bunga kuning,
kadang-kadang terdapat juga dalam jaringan lain
maksimal spektrum 370-410 nm. berwarna merah kuat dengan Mg/HCl; kadang – kadang sangat pahit .
Flavanon tanwarna; dalam daun dan buah( terutama dalam Citrus )
bergerak pada kertas dengan pengembang air;
Isoflavon tanwarna; sering kali
dalam akar.
2.4.4 Sifat Kelarutan Senyawa Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia seperti fenol yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi bila didiamkan dalam larutan basa dan disamping itu terdapat banyak oksigen maka akan banyak yang terurai. Karena mempunyai sejumlah gugus hidroksil yang tak tersulih atau suatu gula, flavonoid merupakan senyawa polar maka pada umumnya flavonoida larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformadida, air dan lain-lain. Adanya gula yang terikat pada flavonoida cenderung menyebabkan flavonoida lebih mudah larut dalam air. Dengan demikian campuran pelarut diatas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, flavon serta flavanol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.5 Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang diinginkan dalam keadaan murni, agar tidak bercampur dengan komponen-komponen lainnya (Muldja, 1995).
2.5.1 Ekstraksi
Ekstraksi adalah suatu proses pemisahan substansi atau zat dari campurannya dengan menggunakan pelarut yang sesuai. Ekstraksi dapat digolongkan berdasarkan bentuk campuran yang diekstraksi dan proses pelaksanaanya.
a. Bentuk campurannya
Berdasarkan bentuk campuran yang diekstraksi, suatu ekstraksi dibedakan menjadi padat – cair dan ekstraksi cair-cair.
1. Ekstraksi Padat-cair ; zat yang diekstraksi terdapat didalam campuran yang berbentuk padatan. Ekstraksi jenis ini banyak dilakukan didalam usaha mengisolasi zat berkhasiat yang terkandung didalam bahan alam seperti steroid, hormon, antibiotika dan lipida pada biji-bijian.
2. Ekstraksi Cair-cair ; zat yang diekstraksi terdapat didalam campuran yang berbentuk cair. Ekstraksi cair-cair sering juga disebut ekstraksi pelarut banyak untuk memisahkan zat seperti iod atau logam-logam tertentu dalam larutan air.
b.Proses pelaksanaannya
Menurut proses pelaksanaannya ekstraksi dibedakan menjadi ekstraksi berkesinambungan (kontinyu) dan ekstraksi bertahap.
1. Ekstraksi kontinyu (Continues Extraction)
Pada ekstraksi kontinyu, pelarut yang sama digunakan secara berulang-ulang sampai proses ekstraksi selesai. Tersedia berbagai alat dari jenis ekstraksi seperti ini seperti alat soklet atau Craig Countercurent.
2. Ekstraksi Bertahap (Batch)
Pada ekstraksi bertahap, setiap kali ekstraksi selalu digunakan pelarut yang baru sampai proses ekstraksi selesai. Alat yang biasa digunakan adalah berupa corong pisah (Estien, 2005).
2.5.2 Kromatografi
Kromatografi merupakan suatu proses pemisahan yang mana analit-analit dalam sampel terdistribusi antara dua fase, yaitu fase diam dan fase gerak. Fase diam dapat berupa bahan padat atau porus dalam bentuk molekul kecil, atau dalam bentuk cairan yang dilapiskan pada pendukung padat atau dilapiskan pada dinding kolom. Fase gerak dapat berupa gas atau cairan. Jika gas digunakan sebagai fase gerak, maka prosesnya dikenal sebagai kromatografi gas. Dalam kromatografi cair dan juga kromatografi lapis tipis, fase gerak yang digunakan selalu cair (Rohman, 2009).
Pemisahan secara kromatografi dilakukan dengan cara melihat langsung beberapa sifat fisika umum dari molekul. Sifat utama yang terlibat ialah:
1) kecenderungan molekul untuk melarut dalam cairan, 2) kecenderungan molekul untuk melekat pada permukaan serbuk halus dan 3) kecenderungan molekul untuk menguap atau berubah kekeadaan uap (Gritter, 1991).
2.5.2.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis adalah kromatografi cair yang paling sederhana, yang mana fase geraknya berupa zat cair dan fase padatnya berupa padatan yang disokong pada sebuah penyangga (Gritter, 1991). KLT merupakan salah satu metode yang paling banyak digunakan dan paling mudah untuk memurnikan sejumlah kecil komponen. Metode ini menggunakan lempeng kaca atau aluminium yang telah dilapisi dengan penyerap (misalnya silika gel) dengan ketebalan tertentu tergantung pada jumlah bahan yang akan dimuat kedalam lempeng. Pelapisan ke dalam lempeng analis biasanya memiliki ketebalan 0,2 mm. Campuran senyawa diisikan 1-2 cm dari tepi dasar lempeng berupa bercak ataupun pita memanjang. Lempeng kemudian dimasukkan ke dalam bejana kromatografi berisi pelarut yang telah ditentukan sebelumnya yang akan meresap naik di dalam lempeng dan memisahkan campuran senyawa berdasarkan polaritas komponennya (Heinrich, 2005).
Kelebihan KLT ialah keserbagunaan, kecepatan dan kepekaannya. Keserbagunaannya dapat menggunakan sejumlah penyerap yang berbeda-beda yang disapitkan pada pelat kaca atau penyangga lain seperti, silika gel, aluminium oksida, kalium hidroksida, magnesium pospat dan lain sebagainya. Kecepatan KLT yang lebih besar disebabkan oleh sifat penyerap yang lebih padat bila disaputkan pada plat dan merupakan keuntungan apabila kita menelaah senyawa labil. Kepekaan dari KLT adalah dapat memisahkan bahan yang jumlahnya lebih sedikit dari ukuran µg (Harborne, 1973).
Metode ini memiliki sejumlah keuntungan untuk analisis dan isolasi bahan alam yang aktif secara biologis :
• Biayanya murah dibandingkan metode instrumental dan hanya butuh sedikit pelatihan atau pengetahuan tentang kromatografi.
dengan isolasi cepat bahan alam dalam jumlah milligram hingga gram. • Fleksibilitas pilihan fase gerak dan fase diam.
• Pemisahan mudah dioptimalisasi dengan ‘membidik’ satu komponen dan metode dapat segera dikembangkan.
• Secara praktis semua pemisahan dapat dicapai dengan fase gerak dan fase diam yang tepat.
• Sejumlah besar sampel dapat dianalisis atau dipisahkan secara simultan (Heinrich, 2005).
Untuk mengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan dengan harga Rf senyawa pembanding, yang mana harga Rf diidentifikasikan sebgai perbandingan antara jarak perambatan suatu zat dengan jarak perambatan pelarut yang dihitung dari titik penotolan pelarut zat (Sastrohamidjojo,1985).
Laju pergerakan linarut Rf =
Laju pergerakan pelarut (Gritter, 1991)
Faktor-faktor yang mempengaruhi gerakan noda dalam KLT yang juga mempengaruhi harga Rf (Sastrohamijdojo, 1985) :
1. Struktur kimia dari senyawa yang dipisahkan 2. Sifat dari penyerap dan derajat aktivasi 3. Tebal kerataan dan lapisan penyerap 4. Pelarut dan derajat kemurnian fase gerak 5. Derajat kejenuhan dari uap
6. Jumlah cuplikan yang digunakan 7. Suhu
8. Kesetimbangan
2.5.2.2 Kromatografi Kolom
Dengan menggunakan cara ini skala isolasi flavonoid dapat ditingkatkan hampir ke skala industri. Pada dasarnya, cara ini meliputi penempatan campuran flavonoid
(berupa larutan) diatas kolom yang berisi serbuk penyerap (seperti selulosa, silika atau poliamida), dilanjutkan dengan elusi beruntun setiap komponen memakai pelarut yang cocok (Markham, 1988).
Kromatografi cair yang dilakukan didalam kolom besar merupakan metode kromatografi terbaik untuk pemisahan campuran dalam jumlah besar. Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam atau bahkan tabung plastik. Pelarut (fase gerak) dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari atas kolom. Fase diam yang digunakan adalah silika gel. Penyerap dapat dikemas kedalam tabung, baik dengan cara basah maupun dengan cara kering. Pada umumnya, cara basah lebih mudah dan lebih sering dipakai untuk silika gel, sedangkan cara kering lebih baik untuk alumina.
Pada cara basah, selapisan kapas dimasukkan ke dalam kolom dan tabung diisi sepertiganya dengan pelarut. Pelarut yang dipakai dalam proses pengemasan mungkin sama dengan pelarut yang akan dipakai untuk kromatografi atau mungkin pelarut yang kepolarannya lebih rendah. Pelarut itu tidak boleh polar. Penyerap lumpuran dengan bagian lain dari pelarut dan lumpuran ini dituangkan ke dalam pelarut dalam tabung. Selama proses pengendapan, tabung dapat diketuk-ketuk pada semua sisi secara perlahan-lahan agar diperoleh lapisan yang seragam. Lumpuran dapat dimasukkan bagian demi bagian atau sekaligus. Keran dapat dibuka dan ditutup selama penambahan asal permukaan pelarut tetap diatas permukaan penyerap (Gritter, 1991).
2.5.2.3 Kromatografi Lapis Tipis Preparatif
Pada KLT preparatif, cuplikan yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi pelat lapisan besar (Gritter, 1991), ketebalan yang paling sering dipakai ialah 0,5-2 mm, ukuran platnya biasanya 20x20 cm.
Penotolan Cuplikan
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat KLTP. Pelarut yang yang baik ialah pelarut atsiri, karena jika pelarut kurang atsiri terjadi pelebaran pita. Konsentrasi cuplikan harus sekitar 5-10%. Cuplikan ditotolkan berupa pita yang harus sesempit mungkin karena pemisahan bergantung pada lebar pita. Penotolan dapat dilakukan dengan tangan (pipet) tetapi lebih baik dengan penotol otomatis. Untuk pita yang terlalu lebar, dapat dilakukan pemekatan dengan cara pengembangan memakai pelarut polar sampai kira-kira 2 cm diatas tempat penotolan. Kemudian pelat dikeringkan dan dielusi dengan pelarut yang diinginkan (Marston, 1986) dan dapat dikembangkan secara tegak lurus pada garis cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Pita ditampakkan dengan cara yang tidak merusak jika senyawa itu tanpa warna, dan penyerap yang mengandung pita dikerok dari pelat kaca. Kemudian cuplikan dielusi dari penyerap dengan pelarut polar (Gritter, 1991). Penyerap yang paling umum ialah silika gel (Marston, 1986).
Cara ini berguna untuk memisahkan campuran reaksi sehingga diperoleh senyawa murni untuk telaah pendahuluan, untuk menyiapkan cuplikan analisis, untuk meneliti bahan alam yang lazimnya berjumlah kecil dan campurannya rumit dan untuk memperoleh cuplikan yang murni untuk mengkalibrasi KLT kuantitatif (Gritter, 1991).
2.6 Teknik Spektroskopi
Penentuan struktur kimia senyawa organik secara spektroskopi dapat dilakukan jika senyawa organik tersebut diperoleh dalam keadaan murni, adanya pengotor akan dihasilkan spektra yang lebih kompleks sehingga akan menyulitkan dalam interpretasi spektra. Selanjutnya dari spektra massa dan NMR akan diperoleh rumus formula dan derajat ketidakjenuhan atau juga dikenal dengan ekuivalensi ikatan rangkap. Spektra NMR, infra merah dan UV-Vis akan memberikan informasi adanya gugus fungsional, selain itu dari spektra NMR akan memberikan adanya bagian-bagian struktur pembentuk senyawa tersebut.
2.6.1 Spektrofotometer Ultraviolet- Visibel (UV-Vis)
Asas
Radiasi ultraviolet dan sinar tampak diabsorpsi oleh molekul organik aromatik, molekul yang mengandung elektron-π terkoyugasi dan atom yang mengadung elektron-n, menyebabkan transisi elektron di orbit terluarnya dari tingkat enersi elektron dasar ke tingkat enersi elektron tereksitasi lebih tinggi (Satiadarma, 2004). Penyerapan sinar ultraviolet dan tampak oleh suatu molekul organik akan menghasilkan transisi diantara tingkat energi elektronik pada molekul tersebut , dan karenanya sering dinamakan Spektrometri elektronik. Transisi tersebut pada umumnya antara orbital ikatan atau orbital pasangaan elektron bebas ke orbital anti ikatan. Supaya elektron dalam ikatan sigma tereksitasi maka diperlukan energi paling tinggi dan akan memberikan serapan pada panjang gelombang 120-200 nm. Panjang gelombang di atas 200 nm merupakan daerah eksitasi elektron dari orbital π dan orbital d ,terutama untuk sistem ikatan π terkonyugasi, pengukurannya relatif mudah dan spektrumnya memberikan banyak keterangan, maka spektrometri ultraviolet tampak biasa dilakukan pada α di atas 200 nm. Kegunaan spektrofotometer ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik didalam suatu molekul (Unang, 2010).
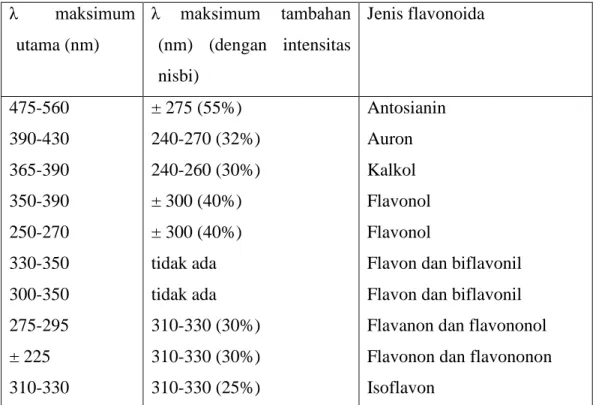
Cara Spektroskopi Ultraviolet- Visibel (UV-Vis) merupakan cara tunggal yang paling berguna untuk menganalisis struktur flavonoid, untuk membantu mengidentifikasi jenis flavonoid dan menentukan pola oksigenasinya. Spektrum flavonoid biasanya ditentukan dalam larutan dengan pelarut metanol atau etanol. Spektrum khas terdiri atas dua maksima pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I). Kedudukan yang tepat dan kekuatan nisbi maksima tersebut memberikan informasi yang berharga mengenai sifat dan pola oksigenasinya. Ciri khas spektrum adalah kekuatan nisbi yang rendah pada pita I dalam dihidroflavon, dihidroflavonol dan isoflavon serta kedudukan pita I pada spektrum khalkon, auron dan antosianin yang terdapat pada panjang gelombang yang tinggi. Petunjuk mengenai rentang maksima utama yang diperkirakan untuk setiap jenis flavonoida adalah sebagai berikut :
Tabel 2.2 Rentang serapan spektrum UV-tampak flavonoida λ maksimum utama (nm) λ maksimum tambahan (nm) (dengan intensitas nisbi) Jenis flavonoida 475-560 390-430 365-390 350-390 250-270 330-350 300-350 275-295 ± 225 310-330 ± 275 (55%) 240-270 (32%) 240-260 (30%) ± 300 (40%) ± 300 (40%) tidak ada tidak ada 310-330 (30%) 310-330 (30%) 310-330 (25%) Antosianin Auron Kalkol Flavonol Flavonol
Flavon dan biflavonil Flavon dan biflavonil Flavanon dan flavononol Flavonon dan flavononon Isoflavon
(Markham,1988)
2.6.2 Spektrofotometer Infra Merah (FT-IR)
Asas
Apabila radiasi inframerah tengah mengenai molekul organik, frekuensi tertentu yang enersinya sesuai dengan frekuensi energi vibrasi dan rotasi atom/gugus atom dalam molekul, akan diabsorpsi dan digunakan untuk eksitasi pada tingkat enersi vibrasi dan rotasi khas dari molekul. Spektrum absorpsi radiasi yang terbentuk, khas untuk molekul senyawa organik yang bersangkutan (Satiadarma, 2004).
Spektrum Infra Merah hasil dari penyerapan energi yang mempengaruhi mode getaran atom yang terikat satu sama lain. Untuk molekul organik yang khas, harus ada banyak pita penyerapan, masing-masing dihasilkan oleh salah satu dari banyak kelompok yang berbeda dari atom. karena hampir semua senyawa organik mengandung obligasi C-C dan C-H , banyak pita-pita dalam spektrum IR akan umum untuk sebagian besar
substansi dan karena itu tidak informatif. Spektroskopi IR sangat berguna untuk mengetahui kelompok gugus fungsional yang terdapat dalam molekul (Thomas, 1998).
Pancaran infra-merah di julat antara 10.000-10 / cm (1-100µm), diserap oleh sebuah molekul organik dan diubah menjadi energi getaran molekul. Penyerapan ini juga tercatu , namun spektrum getaran tampak bukan sebagai garis melainkan berupa pita-pita. Hal itu disebabkan perubahan energi getaran tunggal selalu disertai sejumlah energi putaran. Terdapat dua macam getaran molekul, yaitu getaran ulur dan getaran tekuk. Getaran ulur adalah suatu getaran berirama di sepanjang sumbu ikatan sehingga jarak antar atom bertambah atau berkurang. Getaran tekuk dapat terjadi karena perubahan sudut-sudut ikatan antara ikatan-ikatan pada sebuah atom atau karena gerakan sebuah gugusan atom terhadap sisa molekul tanpa gerakan nisbi atom-atom didalam gugusan (Silverstein, 1986).
2.6.3 Spektrofotometri Resonansi Magnetik Inti Proton (1H-NMR)
Spektroskopi RMI proton pada hakikatnya merupakan sarana untuk menentukan struktur senyawa organik dengan mengukur momen magnet atom hidrogennya. Pada kebanyakan senyawa, atom hidrogen terikat pada gugus yang berlainan dan spektrum RMI proton merupakan rekaman sejumlah atom hidrogen yang berada dalam keadaan lingkungan yang berlainan tersebut. Tetapi, tidak dapat memberikan keterangan langsung mengenai sifat kerangka karbon molekul tersebut. Pelarut untuk pengukuran RMI harus lembam dan tanpa proton.
Dalam praktek, larutan cuplikan dalam pelarut lembam ditempatkan diantara kutub magnet yang kuat, dan proton mengalami geser kimia yang berlainan sesuai dengan lingkungan molekulnya didalam molekul, biasanya menggunakan tetrametilsilan (TMS), yaitu senyawa lembam yang dapat ditambahkan kedalam larutan cuplikan tanpa ada kemungkinan terjadi reaksi kimia (Harborne, 1973).
Spektroskopi NMR didasarkan pada penerapan gelombang radio oleh inti tertentu dalam molekul organik, bila molekul ini berada dalam magnet yang sangat kuat dan homogen . Dari spektra resonansi magnet inti proton akan diperoleh informasi tentang jenis hidrogen, jumlah hidrogen dan lingkungan hidrogen dalam suatu senyawa (Unang, 2010)
Terperisai dan tak terperisai merupakan istilah relatif. Untuk memperoleh pengukuran yang kuantitatif diperlukan suatu titik rujukan. Senyawa yang dipilih untuk rujukan adalah Tetrametilsilana (CH3)4Si, yang proton-protonnya menyerap pada ujung kanan spektrum NMR (Fessenden, 1982).
Pada beberapa apektrum NMR akan terlihat sinyal TMS pada angka nol sehingga sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standart karena :
1. TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai lingkungan kimia yang sama, sehingga menghasilkan singlet yang kuat karena banyak mengandung atom hidrogen
2. Elektron-elektron pada ikatan C-H dalam senyawa ini berada dekat dengan hidrogen jika dibanding dengan senyawa lain. Ini berarti inti hidrogen sangat terlindungi dari medan magnet eksternal sehingga dibutuhkan medan magnet yang besar untuk membawa atom hidrogen ke kondisi resonansi (Dachriyanus, 2004).