BAB 2
TINJAUAN PUSTAKA
2.1Minyak Cengkeh
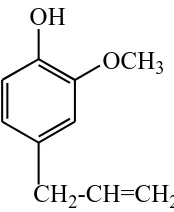
Minyak cengkeh merupakan minyak atsiri yang berasal dari tanaman cengkeh (Gambar 2.1). Indonesia merupakan salah satu negara penghasil minyak atsiri yang cukup penting di dunia. Diantaranya minyak atsiri yang terkenal adalah minyak cengkeh (Anonim, 2005).
Gambar 2.1 Foto Tanaman Cengkeh (Syzigium aromaticum)
Senyawa yang paling penting dalam minyak cengkeh adalah senyawa eugenol, sehingga kualitas minyak cengkeh ditentukan oleh kandungan senyawa tersebut. Dalam persyaratan mutu minyak daun cengkeh SNI 06-2387-2006 kandungan eugenol adalah 78% (Anonim, 2006). Sistematika tanaman cengkeh (Syzigium aromaticum) adalah sebagai berikut:
Divisio : Spermatophyta Sub-divisio : Angiospermae Klas : Dicotyledoneae Sub-klas : Choripetalae Ordo : Myrtales Family : Eugenia
Spesies : Eugenia Carryophyllus
5-6%. Komponen utama minyak cengkeh adalah eugenol yaitu sekitar 70-90% dan merupakan cairan tak berwarna atau kuning pucat, bila terkena cahaya matahari berubah menjadi coklat hitam yang berbau spesifik (Bulan,2004). Selain eugenol, minyak cengkeh juga mengandung senyawa lain seperti asetil eugenol ( Gambar 2.2) dan beta-caryophyllene (Gambar 2.3). Minyak cengkeh dapat diperoleh dari tanaman cengkeh bagian daun, batang/gagang dan bunga (Guenther,1987).
O
OCH3
CH2
C CH3 O
CH CH2
Gambar 2.2 Struktur asetil eugenol (Sastrohamidjojo,2004)
Gambar 2.3 Struktur beta-caryophyllene (Sastrohamidjojo, 2004)
Minyak cengkeh yang diperoleh dari bunga, batang maupun daun dari tanaman cengkeh mampu menghambat pertumbuhan organisme, termasuk diantaranya mikroba, serangga dan tanaman pengganggu ( Taufik dkk,2011).
2.2Eugenol
Gambar 2.4 Struktur Eugenol (Sastrohamidjojo,2004)
Nama : eugenol
Rumus molekul : C10H12O2
Berat molekul :164,20 g/mol
Penampilan fisik : cairan tidak berwarna hingga kekuningan Titik leleh : -9,20C
Titik didih : 2550C Indeks bias : 1.537 Densitas : 1.0663 g/ml (Anonimous,1976).
2.2.1 Reaksi-Reaksi Kimia Terhadap Eugenol
Dalam senyawa eugenol terkandung beberapa gugus fungsional, yaitu metoksi
(-OCH3), alil (-CH2-CH=CH2), fenol(-OH) dan cincin aromatik. Cincin aromatik dapat
mengalami reaksi substitusi elektrofilik pada posisi orto terhadap gugus hidroksi, pada posisi para terhadap metoksi atau posisi orto terhadap propilen, begitu juga dengan gugus olefin yang dapat ditransformasi menjadi gugus lain melalui reaksi adisi, reduksi, oksidasi dan epoksidasi. Ketiga senyawa aktif tersebut dengan menggunakan pereaksi-pereaksi tertentu dapat ditransformasi menjadi gugus-gugus lain membentuk senyawa-senyawa lain seperti isoeugenol, eugenol asetat, isoeugenol asetat, benzil alkohol, benzil isoeugenol, metil eugenol, eugenol etil eter, vanillin dan sebagainya (Sastrohamidjojo,1981 dan Tohawa, 2012). Beberapa reaksinya adalah sebagai berikut:
1. Reaksi Oksidasi Terhadap Eugenol
Vanilin dapat diperoleh melalui reaksi oksidasi terhadap eugenol (Gambar 2.6). Eugenol terlebih dahulu di isomerisasi dengan menggunakan KOH dalam glikol menghasilkan
OH
OCH3
isoeugenol (Gambar 2.5). Isoeugenol yang diperoleh dioksidasi dengan menggunakan nitribenzena dalam dimetilsulfoksida (Sastrohamidjojo, 2004).
OH
Gambar 2.5 Reaksi Pembuatan Vanilin (Sastrohamidjojo,2004) 2. Reaksi Asetilasi Terhadap Eugenol
Asetilasi eugenol (Gambar 2.6) dapat dilakukan dengan menggunakan pereaksi anhidrida asetat yang direfluks pada suhu 1300C selama 3 jam
CH3
Eugenol Anhidrida asetat asetil eugenol Asam asetat
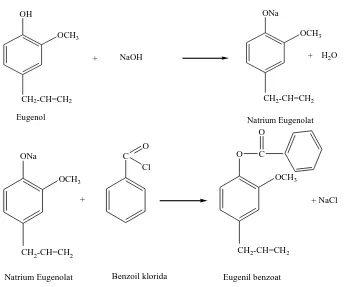
3. Reaksi Asilasi Terhadap Eugenol Dengan Menggunakan Benzoil Klorida
Asilasi eugenol dilakukan mula-mula dengan reaksi penggaraman membentuk garam eugenolat, kemudian ditambahkan benzoil klorida dan campuran direfluks pada suhu 1200C selama 1 jam sehingga diperoleh eugenil benzoat ( Gambar 2.7).
OH
Gambar 2.7 Pembuatan Eugenil benzoat (Sastrohamidjojo,2004)
2.2.2 Metil Eugenol
Senyawa metil eugenol merupakan turunan eugenol yang dipergunakan sebagai atraktan (penarik/pemikat untuk datang) untuk menarik lalat jantan dalam pengendalian populasi lalat buah Bactrocera dorsalis (Kardinan et al., 1998).
Berikut ini struktur (Gambar 2.9), sifat fisik dan sifat kimia dari metil eugenol secara umum.
OCH
3OCH
3CH
2-CH=CH
2Nama : metil eugenol Rumus molekul : C11H4O2
Berat molekul : 178,23 g/mol
Penampilan fisik : cairan tak berwarna hingga kekuningan Titik leleh : 160C
Titik didih : 2620C Berat jenis : 1,04 g/cm3
Titik nyala : 72300C (Anonimous,1976).
Menurut vargas et al., 2010, penggunaan atraktan metil eugenol merupakan cara pengendalian yang ramah lingkungan dan terbukti efektif, dimana pengendalian hama lalat buah dilakukan dalam tiga cara yaitu, mendeteksi atau memonitor populasi lalat buah, menarik lalat buah kedalam perangkap kemudian disterilkan atau dimatikan dan mengacaukan lalat buah dalam perkawinan,berkumpul dan cara makan. Pada penyelidikan yang telah dilakukan di Hawai, senyawa ini mampu digunakan sebagai atraktan terhadap lalat buah oriental Dacus dorsalis Handel jantan. Pemakaian secara kombinasi antara metil eugenol dengan insektisida juga dapat membunuh lalat buah oriental dalam kurun waktu beberapa bulan. Metil eugenol dibuat dengan mereaksikan eugenol dengan dimetilsulfat (Gambar 2.9) dalam suasana basa.
OH
OCH3
CH2-CH=CH2
Eugenol
OCH3
OCH3
CH2-CH=CH2
Metil Eugenol NaOH (CH, 3)2SO4
Gambar 2.9 Reaksi Pembuatan Metil Eugenol (Purba,2000).
2.3Metil Nitrat
Metil nitrat (Gambar 2.10) dapat dihasilkan melalui cara destilasi campuran dari asam nitrat dan metanol.
Gambar 2.10 Metil Nitrat (http://en.wikipedia.metil-nitrat.org.com)
Namun, pembuatan metil nitrat dengan cara mendestilasi campuran asam nitrat dan metanol tidak disarankan karena sekali-kali dapat menimbulkan ledakan kecil kemudian terdekomposisi memberikan warna violet.
HNO3 CH3NO3 + H2O CH3OH +
Metanol Asam nitrat Metil nitrat
Selain itu, metil nitrat juga dapat disintesis dengan reaksi substitusi asam nitrat terhadap metanol dengan menggunakan asam sulfat sebagai katalis. Reaksi yang terjadi adalah reaksi substitusi elektrofilik. Substitusi elektrofilik terjadi ketika reagen yang berperan adalah suatu elektrofil. Elektrofil adalah molekul yang dapat menerima pasangan elektron (Fessenden, 1986). Pada pembuatannya dengan menggunakan asam sulfat, mula-mula asam nitrat dan asam sulfat dicampurkan kemudian didinginkan. Setelah itu diwadah yang lain juga dicampurkan asam sulfat dan metanol dan didinginkan. Campuran asam sulfat dan metanol ditambahkan ke dalam campuran asam sulfat dan asam nitrat sedikit demi sedikit dan diaduk dengan konstan pada suhu 100C. Campuran hasil reaksi dicuci dengan air dingin dan larutan natrium klorida jenuh. Kemudian lapisan esternya ataupun lapisan atas ditambahkan dengan agen pengering. Metil nitrat yang diperoleh langsung digunakan dan tidak dapat disimpan. Reaksinya dapat digambarkan sebagai berikut:
CH3-OH HNO3
H2SO4 CH3-NO3
metanol metil nitrat
Metil nitrat sangat bersifat explosive yang biasanya digunakan sebagai bahan bakar roket. Secara umum sifat-sifat metil nitrat adalah memiliki berat molekul 77,04 g/mol, larut pada alkohol dan eter,tidak larut dengan air dan memiliki titik didih 64,60C (Anonimous,1976).
2.4Pembuatan Eter
Sintesa eter dapat dilakukan melalui beberapa metode diantaranya adalah : 1. Dehidrasi alkohol untuk membuat dialkil eter
Sintesa dengan metode ini biasanya digunakan untuk mensintesa eter simetrik seperti dietil eter, dipropil eter maupun diisopropil eter. Suatu dialkil eter yang diperoleh melalui pemanasan alkohol primer maupun alkohol sekunder dengan asam sulfat pada temperatur 1400C. Pada sintesa ini pemanasan tidak boleh dilakukan pada suhu terlalu tinggi untuk mencegah terjadinya senyawa alkena dengan reaksi seperti berikut :
2 CH3CH2OH H2SO4
1400C CH3CH2-O-CH2CH3 + H2O
CH3CH2OH H2SO4 1800C
CH2=CH2 + H2O
Dalam metode ini alkohol tersier tidak dapat digunakan sebab alkohol tersier bila dipanaskan dengan asam sulfat tidak akan menghasilkan ditersier eter melainkan memberikan suatu olefin yang dihasilkan dari dehidrasi :
(CH3)3CHOH
1400C (CH3)2C=CH2 + H2O H+
Sedangkan senyawa fenol untuk reaksi ini tidak dapat memberikan eter karena sulfonasi fenol mudah terjadi pada temperatur di bawah 1400C dan fenol mempunyai densitas elektron lebih rendah pada atom oksigennya sehingga permulaan protonasi tidak mudah terjadi.
2. Reaksi anion alkoksida atau fenoksida dengan dialkil sulfat
R-OH + Na RO- Na+ + 1/2 H2
OH
+ NaOH
O-Na+
+ H2O
Anion hidroksida dapat menyerang gugus alkil pada dimetil sulfat,CH3-OSO2O-CH3 atau
dimetil sulfat, CH3CH-OSO2O-CH2CH3 melalui reaksi SN2. Kedua gugus alkil pada dimetil
sulfat tersebut dapat mengalami penyerangan tetapi yang kedua memerlukan kondisi yang lebih kuat berhubung karena hal tersebut menyangkut serangan muatan negatif anion fenoksida terhadap muatan negatif anion sulfat.
3. Reaksi Suatu Senyawa Alkil Halida dengan Suatu Anion Alkoksida atau Fenoksida (Sintesa Williamson)
Sintesa Williamson sangat penting karena kemudahannya untuk mensintesa eter yang tidak simetrik dan eter simetrik. Alkoksida dapat dibuat dengan mereaksikan alkohol dengan logam alkali seperti Na atau K sedangkan fenoksida dapat dibuat dari reaksi suatu fenol dengan natrium hidroksida atau dengan kalium karbonat.
CH3CH2OH + Na CH3CH2O-Na+ + 1/2 H2
(CH3)3COH + K (CH3)3CO-K+ + 1/2 H2
Dalam sintesa ini vinil halida dan aril halida tidak dapat digunakan karena keraktifannya yang rendah terhadap substitusi nukleofilik, kecuali terdapat gugus NO2 ( gugus penarik
elektron lainnya yang cukup kuat) pada posisi orto atau para untuk aril halida terhadap halogen pada cincin. Alkil halida berupa metil atau alkil halida primer memberikan hasil yang cukup baik sedangkan alkil halida sekunder dan tersier akan menghasilkan alkena. Alkoksida yang digunakan dapat berupa metil, primer, sekunder , alil atau aril. Alkoksida yang besar ukurannya dapat menghalangi reaksi substitusi, akibatnya akan terjadi reaksi eliminasi terhadap alkil halidanya (Griffin, Jr. 1969).
4. Reaksi Alkilasi Senyawa Alkohol atau Fenol dengan Senyawa Diazo
CH2N2 + R-OH HBF4 R-O-CH3 + N2
Pembentukan metil eter melalui metoda ini memberikan hasil yang cukup kuantitatif serta dapat dilakukan dalam jumlah yang kecil (mg) dengan memberikan rendemen yang tinggi. Reaksi diazometan dengan senyawa- senyawa alkohol dapat berlangsung dengan menggunakan katalis HBF4 atau AlCl3 sedangkan untuk senyawa- senyawa fenol disebabkan
senyawa tersebut asam, reaksinya berjalan dengan baik pada temperatur kamar tanpa menggunakan suatu katalis (March,J. 1984).
5. Pemanasan Alkil Halida dengan Perak oksida kering
Metode ini hanya digunakan untuk membentuk eter simetri.
Cl
2CH3CH2 + Ag2O CH3CH2 O CH2CH3 + 2AgCl dietil eter
etil klorida
6. Alkoksimerkurasi-demerkurasi dari Alkena
Reaksi alkena dengan alkohol dengan adanya merkuri (II) trifluoroasetat dapat membentuk eter.
dapat direduksi , eliminasi maupun reaksi-reaksi dengan basa. Bila senyawa eter dipanaskan dengan asam kuat seperti HI atau HBr akan mengalami reaksi substitusi dan menghasilkan suatu alkil halida atau alkohol. Bila digunakan asam yang berlebih alkohol yang terbentuk dapat bereaksi lebih jauh menghasilkan alkil halida (Fessenden, 1983).
CH3CH2-O-CH2CH3 + HI panas CH3CH2I + HOCH2CH3
HI
CH3CH2I
Identifikasi gugus eter dalam spektrum inframerah memperlihatkan vibrasi ulur C-O-C. Di dalam spektrum serapan yang paling khas ialah sebuah pita pada daerah frekuensi 1150-1085 cm-1 untuk eter alifatik dan pada frekuensi 1270-1200 cm-1untuk senyawa eter aromatik. Pemeriksaan dengan spektroskopi massa senyawa-senyawa eter dapat mengalami fragmentasi dengan terjadinya pemutusan pada ikatan C-C yang bersebelahan dengan atom oksigen dan juga fragmentasi pada ikatan C-O posisi beta terhadap cincin serta ion yang mula-mula terbentuk selanjutnya dapat mengalami fragmentasi dan diikuti dengan puncak khas aromatik pada m/e 78 dan 77 (Silverstein, 1986).
2.5Fourier Transform Infrared Spectroscopy (FTIR)
Instrumen yang digunakan untuk mengukur resapan radiasi inframerah pada berbagai panjang gelombang disebut spektrofotometer inframerah. Penyerapan radiasi inframerah sesuai dengan perubahan energi yang memiliki orde dari 2 hingga 10 Kkal/mol (Sastrohamidjojo,1990). Spektrofotometer inframerah pada umumnya digunakan untuk menentukan gugus fungsi suatu senyawa organik dan mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya. Frekuensi inframerah biasanya dinyatakan dalam satuan bilangan gelombang (wave number), yang didefenisikan sebagai banyaknya gelombang per sentimeter. Instrumen biasa memindai (scan) pada kisaran 700 sampai 5000 cm-1. Spektroskpi inframerah terutama bermanfaat untuk menetapkan jenis ikatan atom-atom yang ada dalam molekul (Hart,2003).
4000 – 200 cm -1. Metode ini sangat berguna untuk mengidentifikasi senyawa organik dan organometalik (Sagala,2013). Keadaan vibrasi dari ikatan terjadi pada keadaaan tetap , atau berkuantitas, tingkat – tingkat energi. Panjang gelombang eksak dari absorbsi oleh suatu tipe ikatan tertentu, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan (C-H, C-C, O-H, dan sebagainya) menyerap radiasi inframerah pada panjang gelombang dengan karakteristik yang berlainan. Banyaknya energi yang diabsorbsi oleh suatu ikatan bergantung pada perubahan dalam momen ikatan seperti vibrasi atom-atom yang saling berikatan lebih besar perubahan dalam momen ikatan mengakibatkan absorbsi sejumlah energi juga lebih besar (Fessenden,1992). Identifikasi gugus eter dalam spektrum infra merah memperlihatkan vibrasi ulur C-O-C. di dalam spektrum serapan yang paling khas adalah sebuah pita pada daerah frekuensi 1150-1085 cm-1 untuk eter alifatik dan frekuensi 1270-1200 cm-1 untuk senyawa eter aromatik (Silverstein, 1986).
2.6Kromatografi Gas/Spektrometri Massa 2.6.1 Kromatografi Gas
Kromatografi gas sebagai instrumen untuk analisis fisiko-kimia menduduki posisi yang sangat penting dan banyak dipakai, apa sebabnya:
1. Aliran fase mobil (gas)sangat terkontrol dan kecepatannya cepat
2. Sangat mudah terjadi pencampuran uap sampel ke dalam aliran fase mobil
3. Pemisahan fisik terjadi di dalam kolom yang jenisnya banyak sekali, panjang dan temperaturnya dapat diatur
4. Banyak sekali macam detektor yang dapat dipakai pada kromatografi gas
5. Kromatografi gas sangat mudah digabung dengan instrumen fisiko-kimia lainnya contohnya MS ( Mulja,1995).
2.6.2 Spektrometri Massa
Spektrometri massa adalah suatu metode analisis instrumental yang dapat dipakai untuk identifikasi dan penentuan struktur dari komponen sampel dengan cara menunjukkan masssa relatif dari molekul komponen dan massa relatif hasil pemecahannya. Pemakaian metode spektometri massa secara tersendiri antara lain ditujukan untuk :
1. Penentuan struktur molekul
2. Pembuktian isotop-isotop stabil dalam penelitian reaksi-reaksi biologi
3. Analisis kualitatif dan kuantitatif terhadap komponen yang telah diisolasi dan dimurnikan (Mulja,1995).
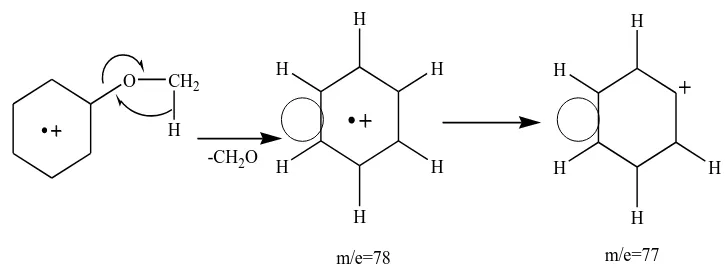
Oleh karena itu dari segi praktis, spektrum massa ialah suatu rekaman dari masssa partikel versus kelimpahan relatif partikel itu. Bagaimana suatu molekul atau ion pecah menjadi fragmen-fragmen bergantung pada kerangka karbon dan gugus fungsional yang ada. Oleh karena itu, struktur dan masssa fragmen memberikan petunjuk mengenai struktur molekul induknya (Fessenden,1982). Pemeriksaan dengan spektroskopi massa senyawa-senyawa eter dapat mengalami fragmentasi dengan terjadinya pemutusan pada ikatan C-C yang bersebelahan dengan atom oksigen dan juga fragmentasi pada ikatan C-O. Untuk senyawa-senyawa eter aromatik pemutusan terjadi pada ikatan C-O posisi beta terhadap cincin serta ion-ion yang mula-mula terbentuk selanjutnya dapat mengalami fragmentasi dan diikuti dengan puncak-puncak khas aromatik pada m/e 78 dan 77 (Silverstein, 1986). Contoh fragmentasi dari senyawa eter aromatik (Gambar 2.11) tersebut adalah sebagai berikut:
O CH3
- CH3
O O
+
anisol m/e=93
m/e=93
atau
O CH2
H
-CH2O H
H
H
H
H
H
m/e=78
H
H
H
H H
m/e=77
Gambar 2.11 Fragmentasi Anisol (Silverstein, 1986)
Anisol yang merupakan senyawa eter aromatik dengan puncak ion molekul m/e = 108 memberikan fragmentasi dengan puncak-puncak ion pada m/e =93 atau (M-CH3)+, 65 atau
(M-CH3-CO)+ dan diikuti dengan puncak-puncak khas aromatik pada m/e =78 atau