ISOLASI DAN UJI POTENSI BAKTERI PENDEGRADASI
ISOLASI DAN UJI POTENSI BAKTERI PENDEGRADASI
MINYAK SOLAR DARI LAUT BELAWAN
MINYAK SOLAR DARI LAUT BELAWAN
T E S I S T E S I S
Oleh
Oleh
BUNGARIA NABABAN
BUNGARIA NABABAN
067030003/BIO
067030003/BIO
SEKOLAH PASCASARJANA
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
UNIVERSITAS SUMATERA UTARA
M E D A N
M E D A N
2008
2008
S SEE K K OO L L A A H H P P A A S S C C AA S S AARRJJAA N NAAISOLASI DAN UJI POTENSI BAKTERI PENDEGRADASI
ISOLASI DAN UJI POTENSI BAKTERI PENDEGRADASI
MINYAK SOLAR DARI LAUT BELAWAN
MINYAK SOLAR DARI LAUT BELAWAN
T E S I S
T E S I S
Untuk Memperoleh Gelar Magister Sains Untuk Memperoleh Gelar Magister Sains
dalam Program Studi Biologi dalam Program Studi Biologi
pada Sekolah Pascasarjana Universitas Sumatera Utara pada Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
Oleh
BUNGARIA NABABAN
BUNGARIA NABABAN
067030003/BIO
067030003/BIO
SEKOLAH PASCASARJANA
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
UNIVERSITAS SUMATERA UTARA
M E D A N
M E D A N
2008
2008
Judul
Judul Tesis Tesis ::ISOLASI DAN UJI POTENSI BAKTERI ISOLASI DAN UJI POTENSI BAKTERI PENDEGRADASIPENDEGRADASI
MINYAK SOLAR DARI LAUT BELAWAN MINYAK SOLAR DARI LAUT BELAWAN
Nama
Nama Mahasiswa Mahasiswa : : Bungaria Bungaria NababanNababan
Nomor
Nomor Pokok Pokok : : 067030003067030003
Program
Program Studi Studi : : BiologiBiologi
Menyetujui Menyetujui Komisi Pembimbing Komisi Pembimbing
(Prof. Dr. Erman Munir, M.Sc)
(Prof. Dr. Erman Munir, M.Sc) (Dr. Dwi Suryanto, M. Sc.)(Dr. Dwi Suryanto, M. Sc.)
Ketua Anggota
Ketua Anggota
Ketua
Ketua Program Program Studi, Studi, Direktur,Direktur,
(Dr.
(Dr. Dwi Dwi Suryanto, Suryanto, M. M. Sc.) Sc.) (Prof. (Prof. Dr. Dr. Ir. Ir. T. T. Chairun Chairun Nisa Nisa B. B. M.Sc.)M.Sc.)
Tanggal lulus
Telah diuji pada
Tanggal : 26 September 2008
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Erman Munir, M.Sc.
Anggota : 1. Dr. Dwi Suryanto, M.Sc.
2. Prof. Dr. Ing. Ternala A. Barus 3. Dr. Delvian, SP, MP.
ABSTRAK
Isolasi dan uji potensi bakteri pendegrasi minyak solar dari laut Belawan telah dilakukan di laboratorium Mikrobiologi Departemen Biologi FMIPA USU Medan dari bulan Pebruari sampai Agustus 2008. Penelitian ini berguna untuk mendapatkan isolat bakteri pendegrasi minyak solar. Lima isolat bakteri pendegradasi minyak solar telah diisolasi dari tempat pelelangan ikan (TPI) Gabion Belawan Medan melalui dua tahapan seleksi. Kemampuan isolat dalam mendegradasi minyak solar diuji pada konsentrasi 1% (1,5 ml), 2% (3 ml) dan 3% (4,5 ml) dan ditentukan berdasarkan kadar minyak sisa setelah pengkulturan melalui analisis Gravimetri. Dari semua isolat tunggal yang diujikan tampak bahwa semua isolat mampu mendegradasi minyak solar dan perlakuan isolat campuran menunjukkan kemampuan menguraikan minyak solar yang paling tinggi dengan minyak sisa pada konsentrasi 1,5 ml sebesar 0,26 ml (17,3%), pada konsentrasi 3 ml sebesar 0,69 ml (23%) dan konsentrasi minyak 4,5 ml sebesar 2,11 ml (49,1%). Hal ini mengindikasikan bahwa degradasi lengkap minyak solar dapat terjadi dengan adanya kerjasama isolat bakteri. Secara umum semua isolat bakteri memiliki kemampuan menghasilkan biosurfaktan untuk mengemulsi minyak solar. BN3 pada konsentrasi minyak 1,5 ml, menghasilkan biosurfaktan sebesar 0,30 ml dan isolat konsorsium merupakan isolat penghasil biosurfaktan yang terbesar yaitu pada konsentrasi 3 ml menghasilkan biosurfaktan sebesar 0,70 ml dan pada konsentrasi minyak 4,5 ml, isolat konsorsium mampu menghasilkan biosurfaktan sebesar 0,30 ml. Kemampuan isolat-isolat bakteri ini dalam mendegradasi minyak solar kemungkinan disebabkan karena kemampuannya dalam menghasilkan biosurfaktan.
ABSTRACT
Study of degradation of diesel oil by sea bacteria has been done in laboratory at Microbiology Department of Biology, Faculty of Mathematic and Natural Science, University of Sumatera Utara from February to August 2008. Bacteria were isolated from Belawan Sea. Five isolates of diesel degrading bacteria were isolated by two phase of selection. The ability of isolate to degrade the diesel was tested in 1% (1,5 ml), 2% (3 ml), and 3% (4,5 ml) concentration and analyzed on the basis of the concentration of remain oil. All isolates were able to degrade the gasoline. The consortium isolate showed the highest ability in degrading diesel with remain oil concentration are 0,26 ml from 1,5 ml, 0,69 ml from 4,5 ml, and 4,5 ml from 2,11 ml. This indicates that the complete diesel degradation occured through the cooperation of bacterial isolates. Then, all isolates have the ability to produce biosurfactant to emulsify the oil. BN 3 grown in 1,5 ml oil emulsified 0,3 ml, consortium grown in 3 ml oil emulsified 0,7 ml, and consortium grown in 4,5 ml emulsified 0,3 of diesel oil. The high ability of these isolates to degrade is probably caused by the ability to produce biosurfactant.
KATA PENGANTAR
Besar kasihMu, agung dan mulia namaMu,Yehowa kota bentengku dan kubu pertahananku; terpujilah Engkau kekal sampai selamanya. Karena kasihMu saya dapat mengikuti perkuliahan di Universitas Sumatera Utara pada Sekolah Pasca Sarjana dan karena kuasaMu saya dapat menyelesaikan Penelitian dengan judul “Isolasi Dan Uji Potensi Bakteri Pendegradasi Minyak Solar Dari Laut Belawan”. Penelitian ini diajukan dalam rangka memenuhi Kurikulum Sekolah Studi Biologi pada Sekolah Pascasarjana, Universitas Sumatera Utara.
Untuk menyelesaikan penelitian ini, banyak pihak yang telah membantu saya hingga penelitian ini dapat diselesaikan. Pada kesempatan ini saya mengucapkan terima kasih kepada :
1. Pemerintah Provinsi Sumatera Utara lewat BAPPEDA Provinsi Sumatera Utara yang memberikan kesempatan dan bantuan finansial selama perkuliahan Penulis. 2. Ibu Prof. Dr. Ir. T. Chairun Nisa, B.MSc, selaku Direktur Sekolah Pascasarjana
Universitas Sumatera Utara
3. Bapak Dr. Dwi Suryanto, MSc, selaku ketua Program Studi Biologi yang telah membimbing dan mengarahkan saya dalam menyelesaikan penelitian ini.
4. Bapak Prof.Dr. Erman Munir, MSc, selaku ketua komisi pembimbing dan Kepala Laboratorium FMIPA Universitas Sumatera Utara, yang memberi saya kesempatan melakukan penelitian dan yang telah membimbing serta mengarahkan saya dalam menyelesaikan penelitian ini.
5. Bapak Dr. Delvian,SP,MP; Bapak Prof.Dr.Ing.Ternala Barus MSc dan Ibu Dr, Ir.Herla Rusmarilin MS selaku Dosen dan penguji yang telah banyak memberikan masukan saran untuk penyelesaian tesis ini agar lebih baik, terima kasih buat dukungannya.
7. Untuk Ibu Ipid, Laboran Mikrobiologi; anak-anakku Asisten laboratorium Mikrobiologi, Netty, Ginta, Ansen, Siska, Atika, Lidya, Novel, Fahrul, Dian dan juga anakku Desy, Asisten Laboratorium Kimia, terima kasih atas bantuannya selama di laboratorium.
8. Bundaku T.Agustina Marbun, tiada terbalas segala doa dan dukunganmu sehingga ananda dapat menyelesaikan tugas, dan juga Ayahandaku Wilson Edwar Nababan, kanda Edwin Nababan dan dinda Lyliace Nababan terima kasih untuk doamu.
9. Suamiku, kekasihku Drs. Diapari Situmeang, tanpa dukungan yang kau berikan niscaya saya tidak akan dapat menyelesaikan perkuliahan, penelitian dan penulisan tesis ini, terima kasih buatmu; cinta kasih kita tetap abadi, saling mengisi, saling mendukung, satu pengharapan dan cita. Anandaku, mahkotaku Frederik, Hyacintha dan Aditya, kalian merupakan motivasi terbesar dalam hidupku, Mama bangga pada kalian, terima kasih sayang untuk bantuan, pengertian dan doa yang diberi untuk Mama, juga buat Lita, terimakasih untuk doamu sayang.
10. Kepala sekolah Drs.Ir A. Pasaribu MPd, segenap rekan guru dan pegawai SMA Perguruan Kristen Immanuel, istimewa Dra. O. Sihite, Msi, Dra M.B. Simanjuntak dan Dra. N. Tindaon, Bapak Pendeta Robert Pandiangan MTh dan Rudolf Pasaribu STh, terima kasih untuk semua dukungan dan doa serta semangat yang diberikan pada saya.
11. Temanku tersayang di S2 Biologi 06, Sri, Dewi, Desy, Ros, Yusuf, Iche, Nur, Parasian, Eriza, Kaniwa, Dermawan, kalian adalah temanku, adikku, saudaraku, terima kasih untuk persahabatan kita yang selalu mesra, juga temanku di Biologi 07 dan 08, terima kasih atas dukungannya.
12. Pak Min, Pak Poci, Herois, Johan dan Maya terima kasih untuk semua dukungan dan perhatian yang diberikan pada saya.
Melalui kesempatan ini, saya sampaikan semoga Tuhan Yang Maha Kuasa selalu memberikan pahala, nikmat dan rahmat yang tiada taranya.
Saya menyadari sepenuhnya bahwa Penelitian ini masih banyak kekurangan, oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan demi kesempurnaan penulisan Penelitian ini serta berharap Penelitian ini dapat digunakan sebagai bahan referensi bagi penelitian berikutnya.
Medan Agustus 2008
RIWAYAT HIDUP
Dalam Nama Tuhan Yang Maha Kuasa
Bungaria M Nababan, lahir dan dibesarkan di Medan Sumatera Utara pada tanggal 28 April 1959. Anak kedua dari tiga bersaudara dari pasangan Bapak Wilson Edwar Nababan dan Ibunda T. Augustina Marbun
Berkat didikan orangtua dan kakanda Edwin Nababan serta kerja keras akhirnya dapat menyelesaikan pendidikan SD Swasta Parulian tahun 1965-1970, SMP Swasta Parulian tahun 1971-1973, SMA Negeri 5 Medan tahun 1974-1977, Sarjana Muda Biologi di Fakultas Eksakta IKIP Medan tahun 1977-1980. Tahun 1982 masuk Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam IKIP Medan dan lulus tahun 1984 sebagai Sarjana Pendidikan Biologi, pada tahun 2006-2008 masuk sekolah Pascasarjana pada Program Studi Biologi Universitas Sumatera Utara.
Sebelum memasuki Fakultas Ilmu Pendidikan Matematika dan Ilmu Pengetahuan Alam, pada tahun 1980 mengawali jenjang karir sebagai tenaga pendidik di SMF Pharmaca Medan dan SMA Kristen I Medan. Pada tahun 1984 sampai saat ini mengajar di SMA Swasta Kristen Immanuel Medan. Pada tanggal lima belas bulan Juli tahun 1983 penulis menikah dengan Drs. Diapari MT Situmeang dan saat ini telah dikaruniai tiga orang anak yaitu Frederik B.I Situmeang, M.Sc, Hyacintha A.T Situmeang, S.H. dan Aditya Y.M.P Situmeang.
DAFTAR ISI
Halaman
ABSTRAK ... ... ... i
ABSTRACT ... ... ... ii
KATA PENGANTAR... ... iii
RIWAYAT HIDUP ... ... ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... ... ... ix DAFTAR GAMBAR ... ... ... x DAFTAR LAMPIRAN ... ... ... xi BAB I PENDAHULUAN ... ... 1 1.1. Latar Belakang ... ... 1 1.2. Permasalahan... 2 1.3. Tujuan Penelitian... ... 3 1.4. Hipotesis ... ... ... 3 1.5. Manfaat Penelitian... ... 3
BAB II TINJAUAN PUSTAKA... ... 4
2.1. Solar... 4
2.2. Pencemaran Minyak Bumi di Lautan ... 5
2.3. Faktor Pembatas Biodegradasi ... ... 5
2.4. Mikroorganisme ... ... 7
2.5. Degradasi Aerob ... ... 8
2.6. Degradasi Anaerob ... ... 11
2.7. Biosurfaktan ... ... 12
2.8. Dampak Pencemaran Minyak Bumi/Petroleum ... 13
BAB III BAHAN DAN METODA ... ... 15
3.3 Sampel Percobaan ... ... 16
3.4 Isolasi dan Pemurnian Bakteri... 16
3.5 Pembuatan Suspensi Isolat Bakteri 10-8 sel/ml Untuk Pengujian ... ... ... 17
3.6 Uji Kemampuan Isolat Bakteri Dalam Mendegradasi Minyak Solar... 18
3.7 Analisis Kadar Minyak Bumi Secara Gravimetri... 18
3.8 Estimasi Kepadatan Sel Isolat Bakteri Dengan Cara Standard Plate Count ... 19
3.9 Uji Kemampuan Biosurfaktan Dalam Mengemulsi Minyak Solar... 20
3.10 Metoda Penelitian... ... 21
BAB IV HASIL DAN PEMBAHASAN ... ... 22
4.1. Isolasi dan Seleksi Bakteri Pendegradasi Minyak Solar ... 22
4.2. Uji Kemampuan Isolat Bakteri Dalam Mendegradasi Minyak Solar ... ... 25
4.3. Pertumbuhan Sel Selama Pengkulturan... 30
4.4. Kemampuan Biosurfaktan Dalam Mengemulsi Minyak Solar... 35
BAB V KESIMPULAN DAN SARAN ... ... 38
5.1. Kesimpulan... 38
5.2. Saran... 38
DAFTAR TABEL
Nomor Judul Halaman
1. Spesifikasi minyak solar dengan minyak tanah... 5 2. Karakterisasi isolat bakteri pendegradasi minyak solar yang
diperoleh dari TPI Gabion Belawan, Medan... 23 3. Kadar minyak sisa setelah inkubasi selama 7 hari (ml) ... 26 4. Kadar minyak sisa setelah inkubasi selama 14 hari (ml) ... 26 5. Rataan pertumbuhan sel isolat bakteri pada hari ke-7 dalam (1010
sel/ml)... 32 6. Rataan pertumbuhan sel isolat bakteri pada hari ke-14 dalam (1010
sel/ml)... 32 7. Rataan volume minyak solar hasil emulsi (ml) ... 37
DAFTAR GAMBAR
Nomor Judul Halaman
1. Degradasi alkana oleh Acinetobacter sp... 9
2. Degradasi benzena secara aerob... ... 10
3. Degradasi senyawa hidrokarbon dalam kondisi anaerob ... 11
4. Isolat bakteri BN 1 dan BN 5 setelah 5 hari... 23
5. Uji biokimia sederhana pada BN1,a = uji TSIA, b = uji gelatin, c = uji SIM, d = uji sitrat ... ... 25
6. Kadar Minyak sisa pada perlakuan A, 1%;B, 2%;C, 3% setelah diinkubasi dengan isolat selama 7 hari... .. 27
7. Kadar Minyak sisa pada perlakuan A, 1%;B, 2%;C, 3% setelah diinkubasi dengan isolat selama 14 hari... . 28
8. Pertumbuhan sel isolat bakteri secara SPC dengan konsentrasi minyak A, 1%;B, 2%;C, 3% pada hari ke-7 ... 33
9. Pertumbuhan sel isolat bakteri secara SPC dengan konsentrasi minyak A, 1%;B, 2%;C, 3% pada hari ke-14 ... 34
10. Kemampuan biosurfaktan dalam mengemulsi minyak (a) Analisis kadar minyak secara gravimetri (b) Uji kemampuan isolat konsorsium ... ... ... 36
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Pembuatan suspensi isolat bakteri 10-8 suspensi isolat
bakteri 10-8 sel/ml untuk pengujian ... ... 44 2 Alur kerja isolasi bakteri pendegradasi minyak solar
tahap 1 ... ... .... 45 3 Alur kerja mendapatkan minyak sisa degradasi isolasi
tahap 2 ... ... ... 46 4 Alur kerja karakterisasi sifat morfologi dan biokimia
isolat ... ... ... 47 5 Alur kerja estimasi kepadatan sel isolat dengan cara
SPC ... ... ... 48 6 Uji kemampuan isolat bakteri dalam mendegradasi minyak
solar ... ... ... 49 7 Alur kerja analisis kadar minyak solar secara gravimetri ... 50 8 Uji kemampuan biosurfaktan dalam mengemulsi minyak
solar(ml) ... ... ... 51 9 Data nilai kadar minyak solar sisa 1%, 2% dan 3% oleh bakteri
terhadap waktu pengamatan ... ... 52 10 Rataan pertumbuhan sel isolat bakteri dengan kadar
minyak 1%, 2% dan 3% (10-10 sel/ml) ... 54 11 Data nilai kemampuan biosurfaktan yang dihasilkan
isolat bakteri dalam mengemulsi minyak solar 1%, 2% dan
3%(ml)... ... .... 56 12 Kepadatan sel isolat bakteri dengan cara spc pada
konsentrasi minyak solar 1%, 2%, 3% ... 59 13 Hasil degradasi minyak solar setelah dianalisis secara
gravimetri ... ... ... 60 14 Isolat BN1, BN2, BN5... ... 61 15 Uji biokimia... ... 62
BAB I
PENDAHULUAN
1.1 Latar Belakang
Minyak solar merupakan salah satu fraksi dari minyak bumi yang diperoleh dengan cara destilasi yang dipisahkan berdasarkan titik didih dengan atom karbon per molekulnya C15-C18 dan titik didih 300o-400oC (Pertamina, 2005). Umumnya minyak
solar digunakan sebagai bahan bakar bagi mesin diesel kendaraan bermotor, pada industri dapur kecil, dan juga pada bahan bakar mesin diesel kapal. Salah satu penyebab kerusakan ekosistem adalah akibat tumpahan minyak bumi dan produk petrokimia (campuran kompleks dari hidrokarbon). Adanya minyak pada ekosistem laut dapat berasal dari kebocoran instalasi penyulingan minyak, tumpahan minyak dari tanker, dari kapal tangki, tongkang dan kapal-kapal nelayan.
Kecelakaan kapal memberikan dampak yang serius di lingkungan sekitarnya; konsekuensinya luas dan berdampak jangka panjang pada ekosistem laut, darat, dan kesehatan manusia (Cookson, 1995 dalam Plohl et al., 2001). Kira-kira 5 juta ton dari minyak mentah dan dari hasil penyulingan masuk ke lingkungan ekosistem dalam bentuk tumpahan minyak (Hinchee et al., 1995). Bila hal ini tidak segera ditanggulangi, maka dalam waktu singkat laju pencemaran laut semakin tidak terkendali (Fahruddin, 2004). Tumpahan minyak di perairan dan di darat perlu karena hal ini dapat membantu ahli lingkungan untuk memprediksi sifat minyak dan memprediksi dampaknya pada lingkungan.
Pembersihan tumpahan minyak bumi di laut dapat dilakukan dengan cara fisik yaitu dengan menggunakan bahan kimia seperti pelarut organik dengan atau tanpa surfaktan. Campuran-campuran bahan pelarut minyak dikumpulkan dengan metoda penyaringan, secara mekanik dengan menggunakan penyerap minyak yang membantu merubah minyak menjadi bentuk yang dapat diangkut untuk penyimpanan jangka pendek dan secara fisikokimia dengan menggunakan agen-agen kimia. Hal ini dapat mengakibatkan keracunan pada organisme air dan juga dapat meningkatkan biaya pemulihan. Selain cara di atas, metoda lain yang dapat dipakai dalam proses pembersihan tempat-tempat yang tercemar minyak adalah secara biologi yaitu biodegradasi. Metoda ini lebih murah, lebih aman, dan tidak menghasilkan senyawa toksik ke lingkungan (Kittel et al., 1994)
1.2 Permasalahan
Di antara beragamnya polutan organik, hidrokarbon yang berasal dari petroleum dan hidrokarbon halogen dianggap paling berbahaya bagi lingkungan laut. Tumpahan minyak solar di perairan sering terjadi karena kebocoran, tumpahan minyak dari tanker, pencucian maupun kecelakaan kapal yang berakibat buruk pada ekosistem laut dan pantai. Meskipun demikian apabila hidrokarbon tersebut masuk ke dalam lingkungan laut dapat dikurangi melalui berbagai proses fisika, kimiawi dan upaya penanggulangan pencemaran minyak oleh aktivitas mikroba secara biologis yaitu dengan cara biodegradasi merupakan yang terbaik. Dalam penelitian ini dikaji
pendegradasi minyak berjumlah sedikit dan berkembang lebih lambat, itu sebaBN ya perlu dilakukan isolasi bertahap untuk mendapatkan isolat bakteri yang mampu mendegradasi solar lebih lengkap.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk :
a. memperoleh isolat bakteri yang mampu mendegradasi minyak solar secara lebih lengkap
b. mengetahui kemampuan isolat bakteri biakan tunggal dan campuran dalam mendegradasi minyak solar
c. mengetahui karakter isolat bakteri yang mampu mendegradasikan minyak solar
1.4 Hipotesis
a. Terdapat beberapa isolat bakteri pendegradasi minyak solar
b. Terdapat kemampuan yang berbeda antara isolat tunggal dengan isolat konsorsium dalam mendegradasi minyak solar
1.5 Manfaat Penelitian
a. Sebagai sumber informasi mengenai bakteri pendegradasi minyak solar b. Sebagai informasi untuk pengembangan penelitian lebih lanjut
BAB II
TINJAUAN PUSTAKA
2.1 Solar
Hidrokarbon merupakan penyusun minyak yang digunakan sebagai bahan bakar, bahan pelarut, bahan baku tekstil, farmasi dan industri.Golongan bahan kimia ini dihasilkan dari proses penyulingan petrolium (Azman, 2005). Minyak solar merupakan salah satu produk penyulingan bahan bakar jenis distilat yang berwarna kuning kecoklatan yang jernih berupa cairan dalam suhu rendah, yang biasa disebut juga Gas Oil , atau High Speed Diesel (Pertamina, 2005)
Solar seperti halnya juga minyak tanah tergolong dalam satu kumpulan besar bahan kimia yang dikenal sebagai hidrokarbon yang merupakan bahan organik yang mengandung atom karbon dan hidrogen. Solar adalah bahan bakar minyak untuk mesin diesel, lebih kental daripada minyak tanah. Minyak solar atau High Speed Diesel (HSD) merupakan BBM yang memiliki angka performa cetane number 45. Jenis BBM ini umumnya digunakan untuk mesin transportasi mesin diesel yang umum dipakai dengan sistem injeksi pompa mekanik dan injeksi elektronik, dalam kendaraan bermotor transportasi dan mesin industri (Pertamina, 2005).
Spesifikasi adalah batasan minimum atau maksimum daripada sifat-sifat tertentu bahan bakar minyak yang ditetapkan (Pertamina, 1998). Perbedaan spesifikasi solar dengan minyak tanah dapat dilihat pada tabel 1 berikut ini.
Tabel 1. Spesifikasi minyak solar dengan minyak tanah
Sifat Solar Minyak Tanah
Gravitasi pada 60/60oF min : 0,820 max : 0,870
min : − max : 0,835 Destilasi recovery at 300oc recovery at 200oc
min : 40% min : 18%
Kadar Air max : 0,05% −
Sedimen max : 0,01% −
Kadar Sulfur max : 0,5% max : 0, 20%
Titik Didih min : 150of min : 100of
2.2 Pencemaran Minyak Bumi di Lautan
Pencemaran minyak di laut bukan hanya akibat kecelakaan kapal, tetapi juga bersumber dari transportasi minyak di laut oleh kapal-kapal, pencucian, dan juga kegiatan-kegiatan pemuatan dan pembongkaran di pelabuhan (Fahruddin, 2004).
Di laut terdapat mikroorganisme yang mampu mendegradasi tumpahan minyak, tetapi bila zat pencemar terdapat pada konsetrasi yang tinggi menyebabkan kemampuan mikroorganisme untuk mendegradasikan zat tersebut berkurang.
2.3 Faktor Pembatas Biodegradasi
Pertumbuhan bakteri dipengaruhi beberapa faktor sehingga proses biodergradasi juga dipengaruhi oleh faktor yang sama. Faktor-faktor yang dapat mempengaruhi proses biodegradasi antara lain suhu, pH, keadaan nutrisi, keter-sediaan O2 ( Plohl et al., 2001).
Kondisi lingkungan yang terutama adalah :
a) Suhu
Pada suhu rendah viskositas minyak meningkat dan volatilitas senyawa toksik menurun sehingga menghambat proses biodegradasi (Atlas, 1981). Hidrokarbon rantai pendek alkana lebih mudah larut pada suhu rendah, tetapi pada suhu tinggi senyawa aromatik lebih mudah larut (Foght & Westlake, 1987). Secara umum dengan menaikkan suhu sampai batas tertentu maka laju biodegradasi juga akan meningkat. Laju biodegradasi laut dapat dicapai pada suhu 15 - 20oC (Walker & Colwell, 1974).
b) pH
Berbagai studi menghasilkan fakta bahwa biodegradasi minyak lebih cepat dengan peningkatan pH. Kecepatan optimum terjadi pada pH alkalin (Foght & Westlake, 1987)
c) Nutrisi
Bila terjadi tumpahan minyak ke laut, maka suplai karbon ke dalam air laut akan meningkat. Pada saat ini komposisi nutrient dalam air laut menjadi tidak seimbang (C meningkat sehingga C/N/P menjadi meningkat melebihi komposisi normal bagi kebutuhan mikroba). Untuk meningkatkan jumlah mikroba maka diperlukan penambahan nutrient N dan P pada tingkat proporsi C/N/P sebelum tertumpah minyak. Petrolium dapat didegradasi oleh sejumlah mikroba dengan penambahan jumlah nutrisi organik seperti nitrogen, karbon dan fosfor (Odu, 1978)
d) Oksigen
Ketersediaan oksigen sangat penting dalam proses biodegradasi hidrokarbon jenuh dan aromatik (Cerniglia, 1992). Benzena, toluena, etilbenzena dan xylena dapat didegradasi tanpa O2 di air tanah yang terkontaminasi (Johnson et al., 2003;
Coates et al., 2002)
2.4 Mikroorganisme
Dalam ekosistem terdapat mikroba yang mampu melakukan biodegradasi sehingga kondisi lingkungan dapat bersifat lebih baik (Capelli et al., 2001; Richard & Vogel, 1999; Kim et al., 2005). Hidrokarbon petroleum dapat didegradasikan oleh mikroba seperti bakteri, jamur, yeast, dan alga mikro (Riser-Roberts, 1992; Bundy et al., 2004). Mikroorganisme tersebut diisolasi berdasarkan kemampuan mereka untuk memetabolisme berbagai sumber karbon, seperti komponen alifatik dan aromatik. Bakteri mempunyai peran yang terbaik dalam degradasi hidrokarbon, alasan utama karena bakteri tersebut menggunakan hidrokarbon dari minyak sebagai sumber nutrisi untuk pertumbuhan dan energi. Dari sejumlah besar penelitian dilaporkan bahwa: alkana dengan bobot molekul rendah lebih cepat didegradasi dan kultur campuran lebih cepat melakukan degradasi daripada biakan murni (Ghazali et al., 2004; Oteyza et al., 2005; Sun et al., 2004; Gerdes et al., 2004).
Beberapa jenis bakteri yang merupakan pendegradasi hidrokarbon yang efektif di lingkungan alami telah diisolasi antara lain Pseudomonas aeruginosa, P. putida, Bacillus subtilis, B. cereus, B. laterospor (Cybulski et al., 2003; Carvalho &
Fonseca, 2005). Ada beberapa keuntungan yang didapat dari mikroorganisme pendegradasi minyak, antara lain populasi alami sudah beradaptasi dan berkembang dengan baik di lingkungannya dan kemampuan untuk menggunakan hidrokarbon telah disebarkan dalam populasi mikroba, populasi ini terbentuk secara alamiah dan di daerah tercemar yang jumlah mikroorganismenya cukup tidak perlu lagi ditambahkan mikroorganisme untuk membantu degradasi (Ghazali et al., 2004).
2.5. Degradasi Aerob
Mikroorganisme yang menggunakan petrolium sebagai sumber karbon dan energi ada yang bersifat aerob dan ada yang bersifat anaerob. Mikroorganisme aerob cepat dan paling efisien dalam mendegradasi karena reaksi aerob memerlukan lebih sedikit energi bebas untuk inisiasi dan menghasilkan lebih banyak energi. Hidrokarbon akan didegradasi secara beruntun oleh sejumlah enzim, oksigen bertindak sebagai akseptor eksternal. Adapun tahap degradasi alkana melibatkan pambentukan alkohol, aldehid dan asam lemak. Asam lemak dipecah, CO2dilepaskan
dan membentuk asam lemak baru yang merupakan 2 unit karbon yang lebih pendek dari molekul induk, proses ini dikenal sebagai beta oksidasi (Hamme et al., 2003).
Degradasi aerob alkana oleh Acinetobacter menggunakan alkana monook-sigenase untuk merubah hidrokarbon menjadi alkohol (Gambar.1).
Gambar 1. Degradasi alkana oleh Acinobacter sp (Hamme et al., 2003)
Strain Pseudomonas yang mampu mendegradasikan hidrokarbon secara aerob antara lain: P. putida ATCC 17484, P. boreopolis, P. denitrificans, P. mira, P. resinovorans CA 10, Pseudomonas sp. Strain PP2 (Pieper et al., 2004). Dari hasil penelitian dapat diketahui bahwa degradasi petrolium lebih cepat dalam kondisi aerob, penggunaan mikroorganisme ini membutuhkan biaya yang besar.
2.6 Degradasi Anaerob
Pada tahun 1980 yang lalu telah ditemukan mikroorganisme yang mampu mendegradasikan hidrokarbon pada kondisi anaerob (Gambar 2), yang mekanisme biokimianya berbeda dari metabolisme hidrokarbon aerob (Riser-Roberts, 1992 ).
Gambar 3. Degradasi senyawa hidrokarbon dalam kondisi anaerob (Townsend et al., 2004)
Biodegradasi anaerob relatif lebih murah, karena mikroorganime ini bersifat insitu yang dapat digunakan untuk dekontaminasi tanah, sedimen dan air bawah tanah yang terkontaminasi hidrokarbon petroleum. Proses pemecahan senyawa hidrokarbon secara anaerob belum sepenuhnya diteliti. Diketahui bahwa benzena, toluene, etil benzena dan xylen (BTEX) dapat didegradasi tanpa O2 di air tanah yang
terkontaminasi (Johnson et al., 2003; Coates et al., 2002). Senyawa ini bersifat karsinogenik dan mutagenik pada manusia sehingga sangat berbahaya bagi kesehatan. Senyawa hidokarbon ini juga dapat mengganggu fungsi organ-organ tubuh manusia seperti otak, system saraf, hati, dan jantung. Senyawa ini juga bersifat rekalisitran, artinya sulit mengalami perombakan di alam, baik di darat ataupun di air, sehingga dapat membahayakan biota laut (Fahruddin, 2004).
2.7 Biosurfaktan
Biosurfaktan merupakan senyawa amfifilik yang dihasilkan oleh mikroorganisme yang merupakan senyawa komplek dengan struktur bermacam-macam. Biosurfaktan dapat dihasilkan oleh mikroorganisme prokariot maupun eukariot. Bakteri penghasil biosurfaktan antara lain Pseudomonas aeruginosa, P. fluorescens, Bacillus cereus, B. thuringiensis, B. sphaericus. Biosurfaktan ini diha-silkan pada permukaan sel mikroba atau diekskresikan ke lingkungan yang dapat membantu melepaskan senyawa hidrokarbon dalam senyawa organik dan meningkatkan konsentrasi senyawa hidrokarbon dalam air melalui pelarutan ataupun
berfungsi menurunkan tegangan permukaan molekul (Banat,1995). Produksi biosurfaktan oleh bakteri sering dikaitkan dengan kemampuan bakteri dalam menggunakan senyawa hidrokarbon sebagai substratnya. Mikroorganisme dengan produksi biosurfaktan yang besar pada umumnya mempunyai kemampuan yang besar juga dalam menguraikan senyawa hidrokarbon; mikroorganisme yang demikian sangat berpotensi untuk digunakan dalam mengurangi cemaran minyak yang terdapat di laut (Fiechter, 1992). Bakteri hidrokarbonoklastik merupakan bakteri yang mampu menghasilkan biosurfaktan dan menggunakan hidrokarbon petroleum sebagai satu-satunya sumber karbon dan energi (Cerniglia, 1992).
2.8 Dampak Pencemaran Minyak Bumi/Petroleum
Solar mempunyai berat jenis lebih kecil dari air, akibatnya bila solar tertumpah di perairan, lapisan solar mengapung dan menutupi permukaan air. Peristiwa ini dapat menghalangi penetrasi cahaya matahari dan menghambat difusi oksigen. Oksigen sangat dibutuhkan oleh biota air untuk respirasi dan cahaya matahari untuk proses fotosintesis.
Tumpahan minyak tanah di darat juga sangat mencemaskan dan menjadi masalah yang serius karena difusi oksigen dalam tanah terganggu. Beberapa mikro-organisme tanah akan mati, merusak perakaran tumbuhan, dan mencemari air tanah (Merasbi et al., 2003; Atlas & Bartha, 1981), bila pencemaran ini tidak segera diatasi, dampaknya akan sangat besar dan sangat merugikan bagi biota air dan juga biota darat seperti tumbuhan, burung pemakan ikan dan juga manusia (Jatam, 2000). Jadi
jelas dampak dari pencemaran yang diakibatkan solar, meskipun dalam jumlah kecil, dapat mempengaruhi kehidupan secara luas, dari tumbuhan, hewan dan manusia.
BAB III
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilakukan dari bulan Februari sampai Agustus 2008 bertempat di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Alam, Universitas Sumatera Utara.
3.2 Bahan dan Alat
Media pertumbuhan yang digunakan untuk percobaan ini adalah Stone Mineral Salt Solution extract yeast (SMSSe) yang terdiri dari CaCO3, NH4NO3,
Na2HPO4.7H2O, KH2PO4, MgSO4.7H2O, MnCl2.7 H2O, bacto agar, ekstrak ragi.
Bahan yang diperlukan untuk percobaan ini adalah minyak solar, air laut, n-hexan hasil pemurnian, akuades, alkohol 70%, desinfektan, media uji biokimia Sulphite Indole Moltility (SIM) untuk uji moltility, Simon Citrate Agar (SCA) untuk uji sitrat, Triple Sugar Iron Agar (TSIA) untuk uji TSIA, Gelatin untuk uji hidrolisis gelatin, H2O2 3% untuk uji katalase, kristal violet, safranin, acetone alkohol, iodone untuk uji
pewarnaan Gram, anti jamur (Nipagin 0,05%).
Alat-alat yang dipergunakan adalah tabung reaksi, cawan petri, tabung winkler, jarum ose, Bunsen, gelas beaker, corong, corong pisah, erlenmeyer, gelas ukur, Spatula, pipet volum, propipet, kertas saring, hot plate, vortex, magnetic stirrer ,
autoclave, hockey stick , alat destilasi, oven, shaker , inkubator, kulkas, timbangan elektrik, timbangan analitik, desikator dan inkubator.
3.3 Sampel Percobaan
Isolat bakteri laut yang digunakan diambil dari laut di daerah TPI Gabion Belawan; minyak Solar untuk pengujian diperoleh dari Stasiun Pengisian Bahan Bakar Umum (SPBU) Pertamina wilayah Sumatera Utara.
3.4 Isolasi dan Pemurnian Bakteri
Sumber isolat diambil dari Tempat Pelelangan Ikan (TPI) Gabion Belawan Medan, di daerah yang terkena tumpahan minyak dari 3 stasiun yang berbeda. Isolasi dilakukan dalam 2 tahap. Medium basal yang digunakan adalah Stone Mineral Salt Solutiont (SMSS) yang terdiri dari 0,5 g CaCO3; 0, 25 g NH4NO3; 0, 1 g Na2 HPO-4.7H2O; 0,05 g KH2PO4; 0,05 g MgSO4.7H2O; dan 0,02 g MnCl2.7 H2O yang
dilarutkan dalam 200 ml air laut. Ekstrak ragi sebanyak 0,01% (b/v) ditambahkan ke dalam medium SMSS sebagai sumber Nitrogen dalam bentuk asam amino dan growth factor tambahan, maka untuk mempermudah penyebutannya SMSS yang mengandung ekstrak ragi ini selanjutnya disebut SMSSe. Ke dalam medium tersebut ditambahkan minyak solar sebanyak 2% (b/v) sebagai sumber karbon, dan pH medium ini adalah 6,8-7 (Sharpley, 1966 dalam Pikoli et al., 2000)
minyak solar 2% (b/v) diinkubasi selama 7 hari pada suhu ruang dengan digoyang di atas shaker pada kecepatan 120 rpm. Untuk keperluan isolasi, sampel diambil pada hari ke-1,3,5 dan hari ke-7. Isolasi dilakukan dengan metode pengenceran dengan menggunakan pengenceran 10-5 dengan air laut steril, isolat diambil sebanyak 1 ml untuk dibiakkan di atas lempeng agar SMSSe yang mengandung solar 2% (b/v) dan 2% bacto agar sebagai pemadat dengan metode cawan sebar dengan menggunakan hockey stick lalu diinkubasi pada suhu 35oC selama 2 hari. Setiap koloni yang berbeda dimurnikan kembali pada medium padat yang serupa. Untuk melakukan isolasi tahap II, kita tetap menggunakan sampel air laut yang terkena tumpahan minyak dan dilakukan dengan prosedur dan kondisi yang sama, tetapi medium pengisolasinya (SMSSe) diperkaya dengan minyak sisa degradasi (MSD) tahap sebelumnya yang diperoleh dengan cara mendinginkan media tahap I di dalam kulkas pada suhu 5oC selama ± 15 menit lalu lapisan minyak pada bagian atas media diambil dengan Spatula. Isolasi tahap II menggunakan MSD I, Isolat bakteri yang diperoleh kemudian dikarakterisasi melalui pengamatan morfologi koloni, sel, dan sejumlah uji biokimia (Cappucino, 1987 dalam Pikoli et al., 2000).
3.5 Pembuatan Suspensi Isolat Bakteri 10-8 sel/ml Untuk Pengujian
Bakteri yang digunakan dalam pengujian dibuat dalam bentuk suspensi. Dengan menggunakan jarum ose diambil 1-2 ose biakan lalu dimasukkan ke dalam tabung reaksi steril yang telah berisi larutan NaCl fisiologis 0,85%. Campuran
kemudian dihomogenkan dengan vortex, kekeruhan campuran dibandingkan dengan kekeruhan Mac Farland 0,5 Standard yang setara dengan 10-8 CFU/ml (Lampiran 1).
3.6 Uji Kemampuan Isolat Bakteri Dalam Mendegradasi Minyak Solar
Masing-masing isolat bakteri yang telah dimurnikan sejumlah 10-5 sel/ml, diambil 1 ml lalu ditambahkan ke dalam medium SMSSe cair (150 ml) yang mengandung minyak solar 1% (1,5 ml), 2% (3 ml) dan 3% (4,5 ml) secara terpisah. Kultur diinkubasi pada suhu ruang dan digoyang di atas shaker dengan kecepatan 120 rpm selama 24 jam, lalu dilakukan analisis kadar minyak solar tersisa dan estimasi kepadatan bakteri pada hari ke-0, 7 dan 14. Hal yang sama dilakukan untuk perlakuan dengan menggunakan isolat konsorsium (campuran dari seluruh isolat) serta untuk perlakuan tanpa penambahan isolat sebagai kontrol (Lampiran 6 ).
3.7 Analisis Kadar Minyak Bumi Secara Gravimetri
Analisis kadar minyak bumi secara Gravimetri dapat dilakukan dengan cara media SMSSe yang mengandung minyak solar 2% (b/v) hasil perlakuan dimasukkan ke dalam corong pisah, ditambahkan 5 ml HCl 3 N dan 60 ml n-heksan hasil pemurnian dengan destilasi bertingkat pada suhu 60oC, kemudian dikocok selama ± 15 menit lalu didiamkan sampai n-heksan terpisah. Terdapat 3 lapisan yaitu minyak solar, n-heksan dan air. Air dibuang, lapisan minyak solar dan n-heksan disaring dengan kertas saring yang telah diolesi ± 0,5 g Na2SO4 ke dalam gelas kimia 100 ml
didih n-heksan) sampai n-heksan habis, airnya habis menguap dan yang tersisa hanya minyak(APHA, 1981). Gelas kimia tersebut diangkat dan didiamkan sampai dingin lalu ditimbang dan dicatat beratnya (Lampiran 7 ).
Dihitung kadar minyak solar dengan cara : Kadar minyak (g) = (W2 – W1)
Keterangan: W1 = berat gelas kimia kering (g)
W2 = berat gelas kimia dengan kadar minyak yang diperoleh (g)
3.8. Estimasi Kepadatan Sel Isolat Bakteri Dengan Cara Standard Plate Count
Kepadatan sel isolat bakteri masing-masing perlakuan dihitung dengan cara Standard Plate Count (SPC) dengan menggunakan colony counter pada hari ke- 0, 7 dan 14, dengan metode cawan tuang. Sampel hasil perlakuan pada pengenceran 10-10 dengan air laut steril diambil 1 ml dan dimasukkan ke dalam cawan petri steril lalu dimasukkan media SMSSe yang mengandung minyak solar 1%, 2% dan 3% (b/v) yang masih cair dan dihomogenkan dengan cara digoyang (Lampiran 5 ). Kultur diinkubasi selama 2 hari pada suhu 32oC dan dihitung kepadatan sel bakterinya dengan cara: (sel/ml) Pengeceran 1 x koloni Jumlah
3.9 Uji Kemampuan Biosurfaktan Dalam Mengemulsi Minyak Solar
Kemampuan biosurfaktan dalam melarutkan minyak solar, diamati dengan cara menambahkan minyak solar (1 ml) ke dalam cairan fermentasi (4 ml) yang diperoleh dari media SMSSe cair hasil pengujian hari ke-14 setelah terlebih dahulu disentrifugasi pada kecepatan 3500 rpm selama ± 15 menit dan diambil larutan supernatannya, dengan perbandingan antara cairan fermentasi dan minyak solar sebesar 4:1 (v/v) (De Cassia et al., 2007). Campuran tersebut dikocok, kemudian didiamkan. Tingkat kelarutan minyak diamati secara fisual dengan mengamati perubahan perbandingan volume minyak dan cairan fermentasi. Setelah didiamkan beberapa menit sebagai pembanding, dipergunakan cairan kondensat hasil fermentasi dan air akuades steril (Lampiran 8), kadar minyak teremulsi dihitung dengan cara:
Kadar minyak solar (ml) = (V1 – V2)
Keterangan: V1 = Volume awal minyak solar sebelum perlakuan
3.10 Metoda Penelitian
Percobaan dilakukan dengan menggunakan Rancangan Acak Lengkap dengan faktor tunggal yaitu jenis bakteri yang terdiri dari:
Kontrol : Tanpa isolat
BN 1 : Spesies 1
BN 2 : Spesies 2
BN 3 : Spesies 3
BN 4 : Spesies 4
BN 5 : Spesies 5
Isolat Konsorsium : Campuran seluruh isolat bakteri
Parameter yang diamati adalah kadar minyak yang tersisa, kepadatan jumlah sel yang diamati pada hari ke 0, 7,14 dan pengelmusian minyak solar pada hari ke-14. Data hasil penelitian yang diperoleh dianalisis varian dan bila didapatkan perbedaan yang nyata atau sangat nyata akan dilanjutkan dengan uji Duncan Multiple Range Test (DMRT).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Isolasi dan Seleksi Bakteri Pendegradasi Minyak Solar
Dari hasil isolasi yang telah dilakukan, diperoleh 5 isolat bakteri pendegradasi minyak solar yang berbeda berdasarkan pengamatan warna, bentuk, tepi, elevasi koloni dan penataan sel, serta sejumlah uji bio kimia sederhana yaitu uji katalase dengan menggunakan H2O2, uji sitrat dengan menggunakan media SCA, uji
karbohidrat dengan menggunakan media TSIA, uji motilitas dengan menggunakan media SIM, uji hidrolisis gelatin dengan menggunakan media gelatin dan pewarnaan Gram. Hasil dari pengujian ini digunakan untuk pencirian dan identifikasi mikroorganisma (Cappuccino &Sherman 1983).
Pengamatan dilakukan terhadap warna, pinggiran/tepi, sifat permukaan dan bentuknya, pengamatan aktivitas metabolisme diketahui dari kemampuan mikroorganisma untuk menggunakan dan menguraikan molekul yang kompleks seperti zat pati, lemak, protein, asam nukleat dan juga dilakukan pada molekul yang sederhana seperti asam amino dan sakarida. Isolat BN 1 didapatkan dari peng-isolasian tahap 1 dari stasiun 2 hari ke-1; isolat BN 2 didapatkan dari pengpeng-isolasian tahap 1 dari stasiun 1 hari ke-1; isolat BN 3 dan isolat BN 4 didapatkan dari pengisolasian tahap 2 dari stasiun 1 hari ke-1 dan isolat BN 5 didapatkan dari pengisolaian tahap 2 stasiun 3 hari ke-3. Hasil selengkapnya ciri morfologi, uji
biokimia sederhana dan pewarnaan Gram dari masing-masing koloni isolat bakteri pendegradasi minyak solar dapat dilihat pada Tabel 2 berikut:
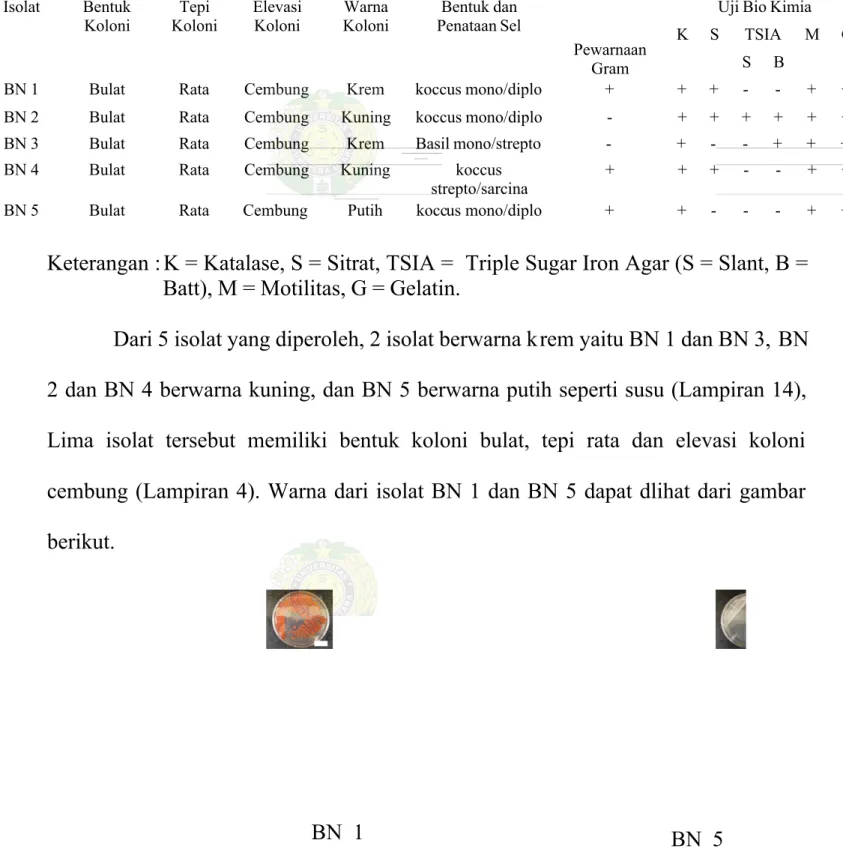
Tabel 2. Karakterisasi Isolat Bakteri Pendegradasi minyak Solar yang Diperoleh dari TPI Gabion Belawan, Medan
Uji Bio Kimia TSIA Isolat Bentuk Koloni Tepi Koloni Elevasi Koloni Warna Koloni Bentuk dan Penataan Sel Pewarnaan Gram K S S B M G
BN 1 Bulat Rata Cembung Krem koccus mono/diplo + + + - - + +
BN 2 Bulat Rata Cembung Kuning koccus mono/diplo - + + + + + +
BN 3 Bulat Rata Cembung Krem Basil mono/strepto - + - - + + +
BN 4 Bulat Rata Cembung Kuning koccus
strepto/sarcina
+ + + - - + +
BN 5 Bulat Rata Cembung Putih koccus mono/diplo + + - - - + +
Keterangan : K = Katalase, S = Sitrat, TSIA = Triple Sugar Iron Agar (S = Slant, B = Batt), M = Motilitas, G = Gelatin.
Dari 5 isolat yang diperoleh, 2 isolat berwarna k rem yaitu BN 1 dan BN 3, BN 2 dan BN 4 berwarna kuning, dan BN 5 berwarna putih seperti susu (Lampiran 14), Lima isolat tersebut memiliki bentuk koloni bulat, tepi rata dan elevasi koloni cembung (Lampiran 4). Warna dari isolat BN 1 dan BN 5 dapat dlihat dari gambar berikut.
Gambar 4. Isolat Bakteri BN 1 dan BN 5 setelah 5 hari
Dengan uji katalase yang dilakukan menunjukkan bahwa 5 isolat memiliki enzim katalase. Hal ini ditandai dengan terbentuk gelembung udara di sekitar koloni dengan penambahan 3% H2O2 (Cappuccino & Sherman., 1983). Hasil pengujian
dengan SCA menunjukkan bahwa 2 isolat yaitu BN 3 dan BN 5 tidak mampu menggunakan sitrat, sedangkan 3 isolat yaitu BN 1, BN 2 dan BN 4 mampu menggunakan sitrat sebagai sumber karbon. Hal ini ditandai dengan berubahnya medium dari hijau menjadi biru karena adanya peningkatan pH dalam media. Dari uji TSIA dapat dilihat bahwa BN 2 mampu memfermentasikan laktosa dan sukrosa; BN 3 mampu memfermentasikan glukosa, dan 3 isolat lainnya tidak mampu memfer-mentasikan karbohidrat. Menurut Cappuccino & Sherman (1983), uji TSIA ditandai dengan bagian atas berwarna kuning dan bagian bawah berwarna kuning yang menunjukkan laktosa dan sukrosa mampu difermentasikan. Apabila bagian atas berwarna merah dan bagian bawah berwarna kuning, hanya glukosa saja yang mampu difermentasikan tetapi bila bagian atas berwarna merah dan bagian bawah juga berwarna merah menunjukkan ketidak mampuan isolat memfermentasikan karbohidrat. Uji motilitas terhadap isolat menunjukkan bahwa 5 isolat bersifat motil, ditandai dengan adanya jejak pergerakan bakteri dalam media. Hasil pengujian gelatin menunjukkan bahwa 5 isolat mampu menghidrolisis gelatin ditandai dengan medium gelatin yang tetap cair setelah dimasukkan ke dalam lemari pendingin selama ± 30 menit (Cappuccino & Sherman., 1983). Gambar 4 menunjukkan uji biokimia sederhana isolat BN 1.
Gambar 5. Uji Biokimia sederhana pada BN 1, a = uji TSIA, b = uji geleatin, c = uji SIM, d = uji sitrat
4.2 Uji Kemampuan Isolat Bakteri Dalam Mendegradasi Minyak Solar
Sebanyak 5 isolat bakteri pendegradasi minyak solar yang telah diisolasi dan diseleksi selanjutnya dilakukan pengujian kemampuan isolat tersebut dalam mende-gradasikan minyak. Hal yang sama juga dilakukan pada perlakuan isolat kontrol dan konsorsium. Setelah didegradasi warna minyak solar mengalami perubahan warna dari berwarna kuning dan cair menjadi berwarna kuning kecoklatan dan sedikit kental (Lampiran 13 ).
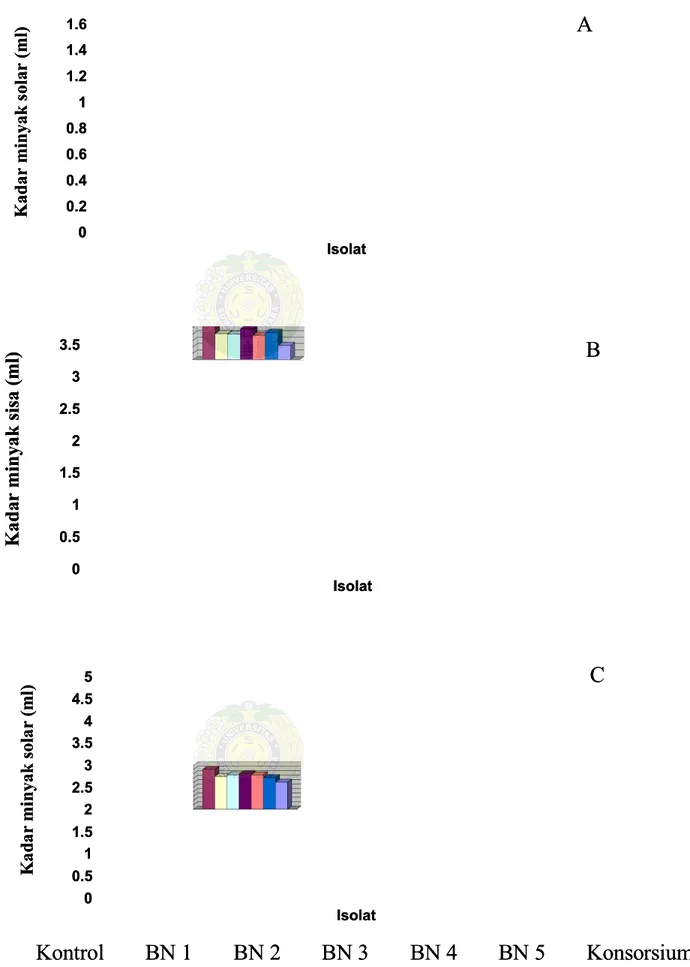
Dari pengujian kemampuan isolat bakteri dalam mendegradasi minyak solar dengan 3 jenis konsentrasi minyak yang diuji yaitu 1% (1,5 ml), 2% (3 ml) dan 3% (4,5 ml) diperoleh nilai kemampuan isolat yang bervariasi (Lampiran 9). Hasil selengkapnya dapat dilihat pada Tabel 3 dan Gambar 6 berikut ini:
a b
c d
Tabel
Tabel 3. 3. Kadar Kadar minyak minyak sisa sisa setelah setelah inkubasi inkubasi selama selama 7 7 hari hari (ml)(ml)
.. Kadar Minyak (ml) Kadar Minyak (ml) Isolat Isolat 1% 2% 3% 1% 2% 3% Kontrol
Kontrol 1.50a 1.50a 3.00a 3.00a 4.50a4.50a BN BN 1 1 1.01b 1.01b 2.01bc 2.01bc 3.70a3.70a BN BN 2 2 1.08b 1.08b 1.98bc 1.98bc 3.88a3.88a BN BN 3 3 1.18b 1.18b 2.38b 2.38b 3.99a3.99a BN BN 4 4 1.19b 1.19b 1.89bc 1.89bc 3.87a3.87a BN BN 5 5 0.96b 0.96b 2.12bc 2.12bc 3.56a3.56a Konsorsium 0.55c 1.11c 3.05b Konsorsium 0.55c 1.11c 3.05b Keterangan:
Keterangan: Angka-angka yAngka-angka yang ang diikuti diikuti dengan dengan huruf huruf yang yang sama sama pada pada kolom ykolom yangang sama tidak berbeda nyata pada taraf 5%
sama tidak berbeda nyata pada taraf 5%
Tabel
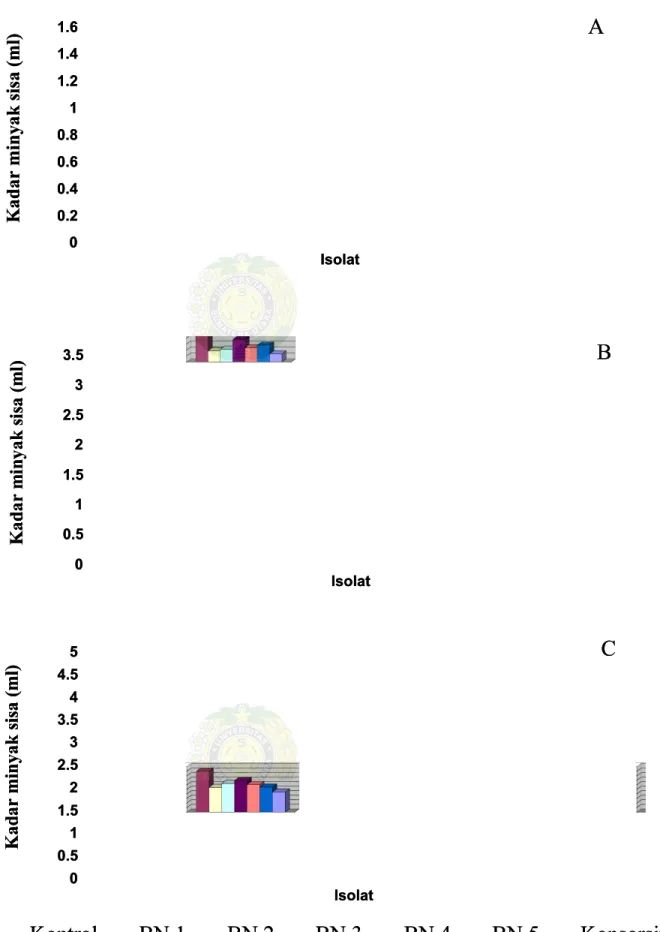
Tabel 4. 4. Kadar Kadar minyak minyak sisa sisa setelah setelah inkubasi inkubasi selama selama 14 14 hari hari (ml)(ml)
Kadar Minyak (ml) Kadar Minyak (ml) Isolat Isolat 1% 2% 3% 1% 2% 3% Kontrol
Kontrol 1.50a 1.50a 3.00a 3.00a 4.50a4.50a BN
BN 1 1 0.63b 0.63b 0.94b 0.94b 2.72a2.72a BN
BN 2 2 0.73b 0.73b 1.07b 1.07b 3.15a3.15a BN
BN 3 3 0.79a 0.79a 1.87b 1.87b 3.48a3.48a BN
BN 4 4 0.84a 0.84a 1.19b 1.19b 3.04a3.04a BN
BN 5 5 0.60b 0.60b 1.40b 1.40b 2.75a2.75a Konsorsium
Konsorsium 0.26c 0.26c 0.69b 0.69b 2.21b2.21b Keterangan:
Keterangan: Angka-angka yang diikuti dengan huruf yAngka-angka yang diikuti dengan huruf yang sama pada kolom yangang sama pada kolom yang sama tidak bebeda nyata pada taraf 5%
0 0 0.2 0.2 0.4 0.4 0.6 0.6 0.8 0.8 1 1 1.2 1.2 1.4 1.4 1.6 1.6 K K aad d aarr m m iin n yyaa k k ssoo llaa rr ((m m ll)) Isolat Isolat 0 0 0.5 0.5 1 1 1.5 1.5 2 2 2.5 2.5 3 3 3.5 3.5 K K aad d aarr m m iin n yyaa k k ssii ssaa ((m m ll)) Isolat Isolat 0 0 0.5 0.5 1 1 1.5 1.5 2 2 2.5 2.5 3 3 3.5 3.5 4 4 4.5 4.5 5 5 K K aad d aarr m m iin n yyaa k k ssoo llaa rr ((m m ll)) Isolat Isolat K
Koonnttrrool l BBN N 1 1 BBN N 2 2 BBN N 3 3 BBN N 4 4 BBN N 5 5 KKoonnssoorrssiiuumm Gambar 6. Kadar Minyak sisa pada perlakuan A, 1%;B, 2%;C,
Gambar 6. Kadar Minyak sisa pada perlakuan A, 1%;B, 2%;C, 3% setelah3% setelah diinkubasi dengan isolat selama 7 hari
diinkubasi dengan isolat selama 7 hari
A A B B C C
0 0 0.2 0.2 0.4 0.4 0.6 0.6 0.8 0.8 1 1 1.2 1.2 1.4 1.4 1.6 1.6 K K aad d aarr m m iin n yyaa k k ssii ssaa ((m m ll)) Isolat Isolat 0 0 0.5 0.5 1 1 1.5 1.5 2 2 2.5 2.5 3 3 3.5 3.5 K K aad d aarr m m iin n yyaa k k ssii ssaa ((m m ll)) Isolat Isolat 0 0 0.5 0.5 1 1 1.5 1.5 2 2 2.5 2.5 3 3 3.5 3.5 4 4 4.5 4.5 5 5 K K aad d aarr m m iin n yyaa k k ssii ssaa ((m m ll)) Isolat Isolat K
Koonnttrrool l BBN N 1 1 BBN N 2 2 BBN N 3 3 BBN N 4 4 BBN N 5 5 KKoonnssoorrssiiuumm
Gambar 7. Kadar Minyak sisa pada perlakuan A, 1%;B,
Gambar 7. Kadar Minyak sisa pada perlakuan A, 1%;B, 2%;C, 3% setelah2%;C, 3% setelah A A B B C C
Dari tabel dan gambar dapat dilihat bahwa seluruh isolat menunjukkan kemampuan dalam mendegradasi minyak solar. Dari hasil penelitian diperoleh bahwa pada hari ke-7 isolat tunggal tidak berbeda nyata dalam kemampuan mendegradasi minyak, tetapi isolat konsorsium merupakan isolat yang terbaik dalam mendegradasi minyak pada kadar 1,5ml dengan sisa 0,55ml yaitu sebesar 36,7%, pada kadar minyak 3ml dengan sisa 1,11ml yaitu sebesar 37% dan pada kadar minyak 4,5ml menghasilkan sisa minyak 3,05ml sebesar 67,8%. Sisa minyak hasil degradasi di hari ke-14 pada konsentrasi 1% oleh isolat konsorsium juga sangat berbeda nyata dibanding isolat tunggal lainnya. Pada konsentrasi 2% kemampuan mendegradasi minyak pada isolat tunggal dan konsorsium tidak berbeda nyata, tetapi pada kadar minyak 3% kembali isolat konsorsium yang terbaik dalam mendegradasi minyak dengan sisa minyak 2,21ml yaitu sebesar 49,1%. Hal ini disebabkan karena pada isolat konsorsium tersebut di hasilkan jumlah biosurfaktan yang lebih besar.
Produksi biosurfaktan yang tinggi pada umumnya mempunyai hubungan dengan kemampuan yang tinggi dalam menguraikan senyawa hidrokarbon. Penambahan jumlah inokulum bakteri penghasil biosurfaktan diketahui dapat menaikkan tingkat degradasi dan menyebabkan terdegradasinya senyawa alifatik, senyawa aromatik dan sikloalkana yang diketahui sulit terdegradasi (Jennings & Tanner, 2000). Hal lain mungkin disebabkan karena enzim yang dihasilkan lebih bervariasi dalam jenis dan tingkat penguraian serta jumlah enzim yang lebih banyak dibanding dengan biakan tunggal sehingga penguraian lebih cepat (Plohl et al., 2002).
Kemampuan bakteri mendegradasikan minyak solar juga disebabkan karena bakteri menghasilkan enzim yang mampu memecah senyawa organik kompleks menjadi senyawa yang lebih sederhana. Enzim monooksigenase dan enzim dioksigenase yang dihasilkan oleh bakteri mampu membuka ikatan karbon pada cincin aromatik dan menghasilkan alkohol primer. Dengan menggunakan dua molekul oksigen, enzim dioksigenase yang dihasilkan oleh bakteri mendegradasi PAH dan membentuk cis-dihidrodiol. Senyawa ini kemudian didehidrogenasi untuk membentuk dihidroksi-PAH yang merupakan substrat untuk enzim membuka cincin. Melalui pemberian satu molekul oksigen maka enzim monooksigenase juga dapat mendegradasi PAH dan membentuk arene oksida, dengan penambahan ion H+ dan OH- maka enzim hidrolase mengkatalisis arene oksida membentuk trans-dihidrodiol, selanjutnya molekul-molekul ini akan digunakan oleh mikroba sebagai sumber nutrisi untuk pertumbuhan dan energi (Munir, 2006).
4.3. Pertumbuhan Sel Selama Pengkulturan
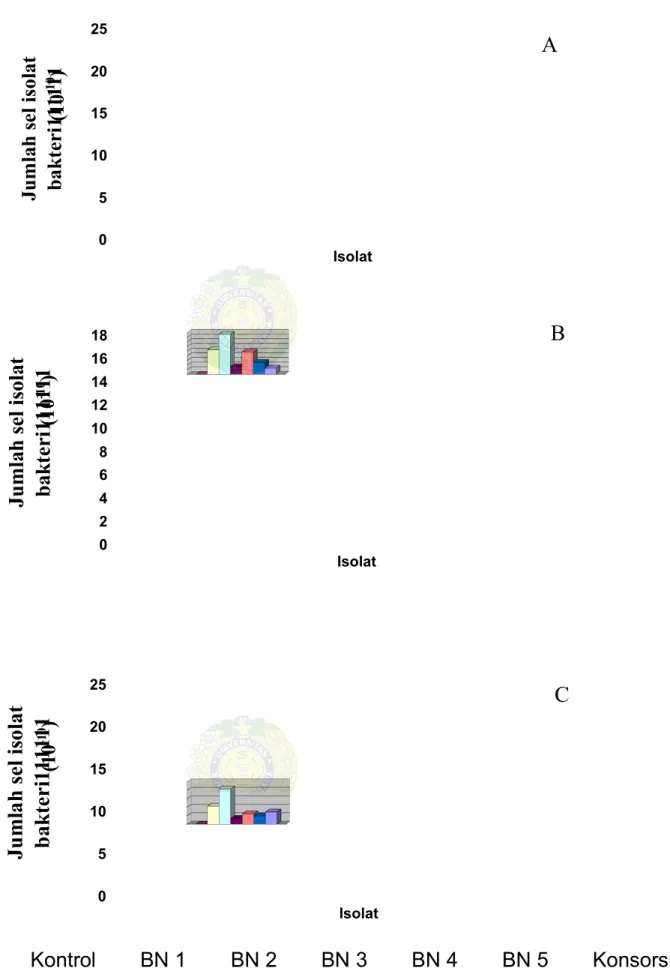
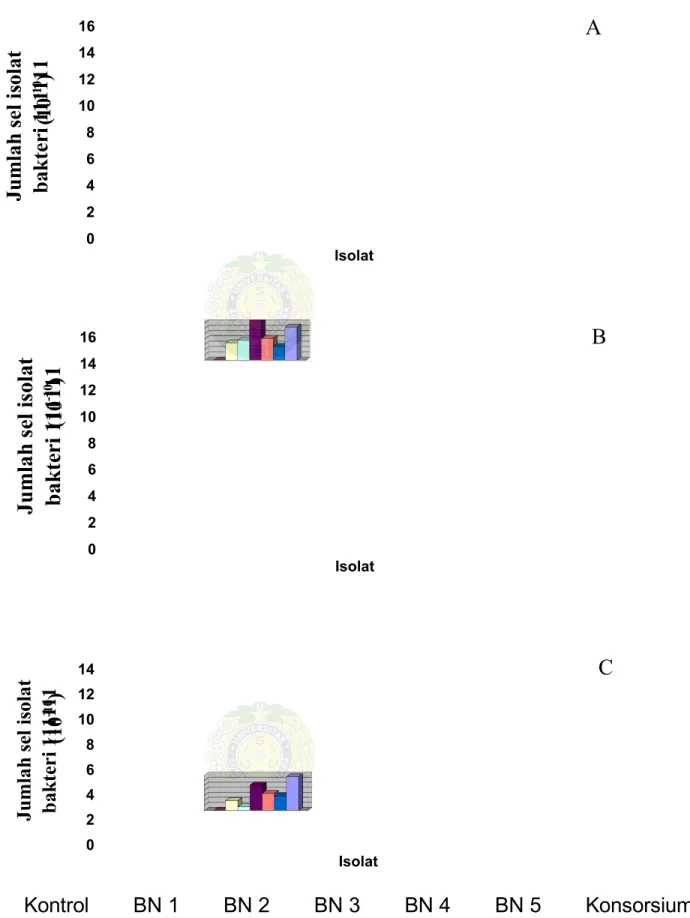
Pertumbuhan sel isolat bakteri masing-masing perlakuan dihitung dengan cara SPC dengan menggunakan colony counter dengan pengenceran 10-10 pada hari ke-0, ke-7 dan ke-14. Dari Tabel 5 dan Gambar 8 di bawah ini kita dapat melihat pertumbuhan isolat hari ke-7 dan hari ke-14.
Pertumbuhan isolat BN 2 pada konsentrasi 1% dan 3% di hari ke-7 berbeda nyata dengan isolat lainnya. Pertumbuhannya cepat, yaitu di kadar 1% sebesar 24,44x1010 sel/ml dan pada kadar 2% sebesar 20,80x1010 sel/ml. Pada kadar minyak 2% pertumbuhan semua isolat sama besar, tidak berbeda nyata antara isolat yang satu dengan isolat yang lain. Pada hari ke-14 pertumbuhan masing-masing isolat tidak berbeda nyata kecuali isolat konsorsium, pertumbuhannya sangat cepat kemungkinan hal ini disebabkan karena pada isolat konsorsium terdapat dua kelompok bakeri, yaitu bakteri pendegradasi senyawa alifatik dan bakteri pendegradasi senyawa aromatik (Lampiran 10).
Diantara hidrokarbon, alkana adalah jenis yang paling mudah didegradasi oleh mikroorganisme melalui jalur metabolisme aerob. Oleh karena kelarutan hidrokarbon dalam fase cair sangat rendah menyebabkan ketersediaan senyawa tersebut menjadi faktor pembatas apabila digunakan sebagai sumber nutrisi bagi mikroorganisme. Subtrat yang memiliki sifat yang demikian apabila digunakan sebagai media pertumbuhan akan dapat berpengaruh pada aktivitas metabolisme mikroorganisme, pengaruh tersebut antara lain dapat berupa waktu generasi yang lebih panjang. Kemungkinan lain, hal ini dapat disebabkan karena bakteri menggunakan minyak bumi, fosfor dan nitrogen yang terkandung dalam media sebagai nutrisi untuk pertumbuhan selnya; dan juga menggunakan minyak bumi sebagai sumber energinya dengan cara memotong rantai hidrokarbon minyak bumi menjadi komponen organik untuk kelangsungan hidup mikroba dibawah kondisi stabil (Ferguson, 2003).
Tabel 5. Rataan pertumbuhan sel isolat bakteri pada hari ke-7 dalam (10-10sel/ml) Kadar Minyak (ml) Isolat 1% 2% 3% Kontrol 0.00 0.00 0.00 BN 1 14.18ab 10.50a 10.60b
BN 2 24.44a 17.18a 20.80a
BN 3 2.78d 3.19b 3.40cd
BN 4 8,94bc 9.54ab 6.08bcd
BN 5 6.32c 5.12b 4.88bcd
Konsorsium 2.21d 2.65bc 7.18bc
Keterangan: Angka-angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5%
Tabel 6.Rataan pertumbuhan sel isolat bakteri pada hari ke-14 dalam (10-10sel/ml)
Kadar Minyak Isolat 1% 2% 3% Kontrol 0.00 0.00 0.00 BN 1 9.33a 6.51abc 3.84c BN 2 12.51a 7.48abc 1.44d BN 3 15.08a 15.36a 10.10b BN 4 14.82a 8.20abc 6.76bc BN 5 4.92b 5.18abc 5.72bc
Konsorsium 12.40a 12.44ab 13.45a
Keterangan: Angka-angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5%
0 5 10 15 20 25 Ju m la h se li so la t b ak te ri 11 11 11 Isolat 0 2 4 6 8 10 12 14 16 18 Ju m la h se li so la t b ak te ri 11 11 11 Isolat 0 5 10 15 20 25 Ju m la h se li so la t b ak te ri 11 11 11 Isolat Kontrol BN 1 BN 2 BN 3 BN 4 BN 5 Konsorsium
Gambar 8. Pertumbuhan sel isolat bakteri secara SPC dengan konsentrasi minyak A, 1%;B, 2%;C, 3% pada hari ke -7
A B C (1 0 -1 0) (1 0 -1 0) (1 0 -1 0)
0 2 4 6 8 10 12 14 16 Ju m la h se li so la t b ak te ri 11 11 11 Isolat 0 2 4 6 8 10 12 14 16 Ju m la h se li so la t b ak te ri 11 11 11 Isolat 0 2 4 6 8 10 12 14 Ju m la h se li so la t b ak te ri 11 11 11 Isolat Kontrol BN 1 BN 2 BN 3 BN 4 BN 5 Konsorsium
Gambar 9. Pertumbuhan sel isolat bakteri secara SPC dengan konsentrasi minyak A, 1%;B, 2%;C, 3% pada hari ke-14 A B C (1 0 -1 0) (1 0 -1 0) (1 0 -1 0)
4.4 Kemampuan Biosurfaktan Dalam Mengemulsi Minyak Solar
Biosurfaktan dalam mengemulsi minyak solar akan dianalisis melalui media uji SMSSe cair hasil perlakuan bakteri yang dihasilkan pada hari ke-14. Biosurfaktan dapat membantu melepaskan senyawa hidrokarbon dalam senyawa organik dan meningkatkan konsentrasi senyawa hidrokarbon dalam air melalui pelarutan atau emulsifikasi. Hal ini selanjutnya akan meningkatkan laju transfer senyawa hidrokarbon ke dalam mikroorganisme (Kim e t. al , 2005). Kemampuan bakteri untuk mengasimilasi senyawa hidrokarbon yang bersifat hidrofob dan tidak larut dalam air sangat didukung oleh peranan senyawa pengemulsi yang di hasilkan oleh bakteri tersebut, senyawa pengemulsi tersebut dapat diekskresikan oleh bakteri kedalam medium pertumbuhannya atau tetap berada pada permukaan sel bakteri. Kondisi tersebut pada gilirannya akan dapat membantu sel bakteri untuk mendegradasi minyak solar. Isolat konsorsium merupakan isolat penghasil biosurfaktan yang terbesar, itu sebabnya tingkat degradasi minyak solar dengan menggunakan isolat konsorsium jauh lebih cepat karena dengan dihasilkan senyawa yang bersifat pengemulsi tersebut memungkinkan senyawa hidrokarbon dapat lebih tersedia secara biologis terhadap mikroorganisme (Wackcet & Hereshberger, 2001)
Melalui Gambar10 dan Tabel 7 di bawah ini kita dapat melihat biosurfaktan yang dihasilkan oleh isolat dalam mengemulsi minyak solar.
Gambar 10. Kemampuan biosurfaktan dalam mengemulsi minyak (a) Analisis kadar minyak secara gravimetri (b) Uji kemampuan isolat konsorsium
Isolat Kons. 1 % Isolat Kons.3% Isolat Kons. 2 % a b
Tabel 7. Rataan volume minyak solar hasil emulsi (ml) Kadar Minyak Kultur isolat 1 % 2 % 3 % Kontrol H-14 BN 1 H-14 BN 2 H-14 BN 3 H-14 BN 4 H-14 BN 5 H-14 Konsorsium H-14 0,000 0,100a 0,100a 0,300a 0,150a 0,075a 0,125a 0,000 0,150a 0,250a 0,100a 0,250a 0,350a 0,700a 0,000 0,100b 0,100b 0,075c 0,100b 0,075c 0,300a
Dari tabel tersebut dapat dilihat bahwa secara umum seluruh isolat menghasilkan biosurfaktan dalam proses penguraian minyak solar yang dilakukannya, karena senyawa ini dibutuhkan untuk mengurangi tegangan permukaan minyak solar (Lampiran 11). Biosurfaktan dapat membantu melepaskan senyawa hidrokarbon dalam senyawa organik dan meningkatkan konsentrasi senyawa hidrokarbon dalam air melalui pelarutan ataupun emulsifikasi dengan demikian laju transfer senyawa hidrokarbon kedalam mikro organisma semakin meningkat (Gautam & Tyagi, 2006).
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan mengenai isolat bertahap dan uji potensi bakteri laut pendegradasi minyak solar, maka dapat disimpulkan sebagai berikut :
1. Sebanyak 5 isolat bakteri laut pendegradasi minyak solar telah diisolasi dan diseleksi 5 isolat yang memiliki bentuk koloni, tepi koloni dan elevasi koloni yang sama tetapi warna dan sifat biokimia berbeda.
2. Secara keseluruhan sel isolat bakteri mampu tumbuh dalam media dengan konsentrasi minyak 1%, 2%, dan 3%.
3. Semua isolat mampu mendegradasi minyak solar, dan yang terbaik dalam mendegradasi minyak adalah isolat konsorsium.
5.2. Saran
Isolat bakteri pendegradasi minyak solar yang didapat di daerah TPI, Belawan dapat digunakan untuk mengurangi terjadinya polusi air akibat tumpahan minyak solar di laut.
DAFTAR PUSTAKA
APHA. 1981. Standart and Methoda.7 th Edition. California:Cumming Publishing Company Inc.
Atlas, RM, & Bartha R.. 1981. Microbiology Ecology, Fundamentals and Applications. Addison Wesley Publishing Company, Inc.
Azman, WZ, 2005. Bahaya Minyak Solar. Pusat Racun Negara. USM, Malaysia.http://www,pm2.usm.my/mainsite/bulletin/racun/1997/um6.html (20 Agustus 2005).
Banat, IM, 1995. ”Biosurfactants Production and Possible Uses in Microbial-Enchanced Oil Recovery and Oil Pollution Remediation: A Review” Bioresource Technology, 51:1-12.
Bundy JG, Paton G I & Cambell CD. 2004. Combined Microbial Community Level and Single Species Biosensor ReSponses to Monitor Recovery of Oil Polluted Soil . Soil Biology & Biochemistry. 36:1149-1159.
Capelli, SM, PJ Busalmen, & De Sánchez RS. 2001. Hydrocarbon Bioremediation Of A Mineral-Base Contaminated Waste From Crude Oil Extraction By Indegnious Bacteria. International Biodeterioration and Biodegradation. 47:233-238.
Cappucino, JG. & Sherman N.1983. Microbiology a Laboratory Manual. 4th ed. Menlo Park:Addison-Wesley Publishing Company, Inc.
Carvalho C, & Da Fonseca MR. 2005. Degradation of Hydrocarbons and Alkohols at Different Suhues and Salinities by Rhodococcus erythropolis DCL14. FEMS Microbiology Ecology. 51 : 389-399.
Cerniglia, CE, 1992. Biodegradation Of Polyclyclic Aromatik Hydrocarbons. Biode-gradation. 3 : 351-360.
Cerniglia, CE & Sutherland, JB, 2001. Bioremediation of polycyclic aromatik hydrocarbons by ligninolytic and non-ligninolytic fungi. In: Fungi in Bioremediation, ed. G.M. Gadd, Cambridge University Press, Cambridge, pp. 136-187.
Coates DJ, Chakraborty R, & McInerney JM. 2002. Anaerobic Benzene Biodegradation-A New Era. Research in Microbiology. 153 : 621-628.
Cylbulski Z, Dziurla E, Kaczorek E, & Olszanowski A. 2003. The Influence Of Emulcifiers On Hydrocarbon Biodegradation By Pseudomonadacia And Bacillacea Strains. Spill Science and Technology Bulletin. 8:503-507
De Cassia, Rita. 2007. Biodegradation of Diesel Oil by Yeast Isolatd from the Vicinity of Suape Port in the State of Pernambuco, Brazil. Brazil:Departemento de Antibióticos, Universidade Federal de Pernambuco.
Dong R, & Wu S. 1995. Substrate Effetcts on enchanced biotransformation of polychlorinated hydrocarbons under anaerobic condition. DhemoSphere. 30 : 1499-1511.
Fahruddin. 2004 Dampak Tumpahan Minyak pada Biota Laut. http://cdc.eng.ui.ac.id/articleview/1078/1/2. (25 Mei 2005).
Fardiaz, S. 1992. Mikrobiologi Pangan. Jakarta: Gramedia Pestaka Utama.
Ferguson HS, Franzmann DP, Revill SI, & Rayner LJ. 2003. The effects of nitrogen and water on mineralisation of hydrocarbons in diesel-contamineted terrestial Antarctic soils. Cold Regions Science and Technology. 37:197-212.
Fiechter, A. 1992. Biosurfactant;Moving Towards Industrial Application. Tibtech; 10:pp.208.
Foght, JM & Westlake, D.W.S. 1987. Bioremediation of hydrocarbons in freshwater. In : Vandermeulen & Hrudey (Ed). Oil in Freshwater : Chemistry, Biology, Countermeasure Technology. Pergamon Press, New York, 213-217.
Gautam KK & VK Tyagi. 2006. Microbial Surfactans : A Review, Journal of Oleo Science.
Gerdes B, Brinkmeyer R, Deckman G, & Helmke E. 2005. Influence of Cude Oil on Changes of Bacterial Communities in Artic Sea-ice. FEMS Microbiology Ecology. 53 : 129-139.
Ghazali MF, Zaliha NR, Abdul RN, Salleh AB, & Basri M. 2004. Biodegradation of Hdrocarbons in Soil by Microbial Consortium. International Biodeterioration and Biodegradation. 54 : 61-67.
Hamme DJ,Singh A,& Ward PO. 2003. Recent advances in Petroleum Microbiology. Microbiology and Molecular Biology Reviews. 67 : 503-548.
Heitkamp, Michael A, & Cerniglia Carl E., 1988. Mineralization of Ploycycli Aromatik Hydrocarbons by a Bacterium Isolatd from Sediment below an Oil Field.
Hinchee ER, Kitte AJ, & HJ. 1995. Applied Bioremediation of Petroleum Hydrocarbons. Columbus (OH): Battelle Press.
Jatam. 2000. Tumpahan Minyak Solar PT. NTT Mencemari Teluk Benete. http://www.jatam.org./indonesia/berita/uploaded.docbrt20.html.(20 Mei 2005) Jennings, EM & Tanner RS, 2000. Biosurfactant-Producing Bacteria Found In
Contaminated And Uncontaminated Soils. University of Oklamoma Dept. of Botany and Microbiology.
Johnson JS,Woolhouse JK, Prommer H, Barry AD & Christofi N. 2003. Contribution of anaerobic microbial activity to natural attenuation of benzene in groundwater. Engineering Geology. 70 : 343-349.
Kim SJ, Choi DH, Sim DS & Oh YS, 2005, Evaluation of bioremediation effectiveness on crude oil-contaminated sand. ChemoSphere. 59 : 845-852. Kittel, JA, Hoepel RE. 1994. “Bioslurping Vacuum Enchanced Free Product
Recovery Coupled With Bioventing”. A Case Study. Proceeding of the Join NWWA/API. Petroleum Hydrocarbon Conference. Houston,Texas : 1-15
Leppchen, Kathrin. 2006. Microbial De-emulsification: A Highly Efficient Procedure for the Extractive Workup of Whole-Cell Biotransformations. Institute of Technical Chemistry, Freiberg University of Technology Fierberg Germany. Merasbi M.R. 2003. Biodegradation of Petroleum Hydrocarbons in Soil. Iranian
Health Public Journal : 28-32
Munir E. 2006. Pemanfaatan mikroba dalam bioremediasi: Suatu Teknologi Alternatif Untuk Pelestarian Lingkungan. Universitas Sumatera Utara Medan Odu, CTI 1978. The effects of nutrient application and aeration on oil degradation in
Oteyza de TG, Grimald JO, Lliros M. & Esteve I. Microsom Experiment of Oil Degradation by Microbial Mats. Science of the Total Environtment Article in Press.
Pertamina, Direktorat PPDN. 1998. Spesifikasi Bahan Bakar Minyak dan Gas.
Pertamina, 2005. Industrial Diesel Oil (Minyak Diesel).
http://www.pertamina.com/indonesia/head-office/hilir-ppdn/product/prd-solar.html. (12 Mei 2005)
Pieper HD, Dos Santos MV, & Golyshin NP. Genomic and Mechanistic Insight into the Biodegradation of Organic Pollutants. Current Opinion in Biotechnology. 15:215-224
Pikoli, MR, P. Aditiawati & DI Astuti. 2000. Isolasi Bertahap dan Indentifikasi Isolat Bakteri Termofilik Pendegradasi Minyak Bumi dari Sumur Banko. Laporan
Penelitian Jurusan Biologi, ITB, Bandung.
http://www.ip.itb.ac.id/product/vol32no2/mega.html (24 Maret 2000)
Plohl, K., H. Lescovsek & Bricelj M. 2001. Biological Degradation of Motor Oil in Water. Acta chim. 49:279-280.
Richard JY, & Vogel MT. 1999. Characterization of a Soil Bacterial Cosortium Capable of Degrating Diesel Fuel. International Biodeterioration & Biodegradation. 44:93-100
Riser-Roberts E. 1992. Biormediation of Petroleum Conaminated Sites. Bocaraton (FL):CRC Press, Inc.
Townsend GT, Prince CR, & Suflita MJ. 2004. Anaerobic biodegradation of alicyclic constituents of gasoline and natural gas condensate by bacteria from an anoxic aquifer . FEMS Microbiology Ecology. 49:129-135.
Sun Y, Chen Z, Xu S, & Cai P. 2005. Stable Carbon and Hydrocarbon Isotopic Fractionation of Individual n-alcanes accompanying Biodegradation: evidence from a group of progressively biodegraded oils. Organic Geochemistry. 36:225-238
Suryanto, D & Suwanto A 2000. Seleksi dan Isolasi Bakteri Pengurai Senyawa Hidrocarbon Aromatik. Jurnal Mikrobiologi Indonesia : 39-42
Wackett. PL, & Hershberger LD. 2001. Physiological Procesces, In: Biocatlysis And Biodegradation Microbial Transformation of Organic Compounds. American Society For Microbiology, Washington., pp. 95-109.
Walker, JD, & RR Colwell, 1974. Microbial degradation of model petroleum at low suhues. Microb. Ecol.. 1: 63-95.
Lampiran 1 : Pembuatan Suspensi Isolat Bakteri 10-8 sel/ml Untuk Pengujian
Isolat bakteri
Dimasukkan ke dalam larutan NaCl 0,85% Diambil 1-2 ose
Dihomogenkan dalam vortex
Dibandingkan dengan kekeruhan Mac Farland 0,5 standard yang setara dengan 10-8 CFU/ml
Lampiran 2 : Alur Kerja Isolasi Bakteri Pendegradasi Minyak Solar Tahap I
Sampel air laut
Dimasukkan dalam media cair SMSSe steril yang mengandung 2% b/v solar
Diinkubasi dan digoyang di atas shaker pada kec. 120 rpm selama 7 hari
Diisolasi bakteri pada hari ke-1, 3, 5, 7 menggnakan air laut steril pada pengenceran 10-5dengan metoda cawan tuang
Dibiakkan dalam cawan petri steril yang berisi media SMSSe padat yang mengandung 2% b/v solar
Diinkubasi selama 2 hari pada suhu ruang 32oC
Pengisolasian tahap 1 dan 2 dilakukan pada masa inkubasi pada hari ke-1, 3, 5, 7 untuk masing-masing tahap. Pengisolasian tahap 2 dilakukan dengan cara yang sama seperti tahap 1. Namun media pengisolasiannya diperkaya dengan minyak sisa degradasi tahap 1 untuk pengisolasian tahap 2
Isolat tumbuh
Biakan murni
Isolat bakteri
Dimasukkan dalam kulkas pada suhu 5oCselama ± 15
menit
Diambil lapisan minyak pada bagian paling atas media SMSSe cair dengan Spatula
Dimasukkan dalam gelas ukur 10 ml
Lampiran 3 : Alur Kerja Mendapatkan Minyak Sisa Degradasi Isolasi Tahap 2
Lampiran 4 : Alur Kerja Karakterisasai Sifat Morfologi Dan Biokimia Isolat
Isolat terpilih
Karakterisasi
Pewarnaan Gram Uji biokimia sederhana Morfologi Hasil Pengamatan Bentuk koloni Warna koloni Tepi koloni Elevasi koloni
Bentuk dan penataan sel
Uji mortalitas Uji sitrat Uji gelatin Uji katalase Uji TSIA
Sampel hasil perlakuan
Diambil 1 ml pada pengenceran 10-10dengan menggunakan air laut steril
Dimasukkan ke dalam cawan petri steril
Dimasukkan media SMSSe yang masih cair yang mengandung minyak solar 1%, 2% dan 3% (b/v)
Kepadatan Sel Isolat
Lampiran 5 : Alur Kerja Estimasi Kepadatan Sel Isolat dengan Cara SPC
Dihomogenkan dengan cara digoyang membentuk angka delapan
Diinkubasi selama 2 hari pada suhu 32oC Dihitung kepadatan sel iasolat
Dilakukan estimasi kepadatan sel isolat dengan cara SPC pada hari ke-0, 7 dan 14 untuk masing-masing perlakuan
Isolat
Dimasukkan dalam media SMSSe cair (150 ml)
Kadar Minyak Solar Sisa
Lampiran 6 : Uji Kemampuan Isolat Bakteri Dalam Mendegradasi Minyak Solar
Digoncang dengan kecepatan 120 rpm selama 7 dan 14 hari
Ditambahkan minyak solar 1% (1,5 ml), 2% (3ml), dan 3% (4,5ml)
100 ml media SMSSe yang mengandung minyak solar 1%, 2% dan 3% Dimasukan ke dalam corong pisah
Ditambahkan 5 ml HCl 3 N
Kepadatan Sel Isolat
Lampiran 7 : Alur Kerja Analisis Kadar Minyak Solar Secara Gravimetri
Ditambahkan 60 ml n-heksan hasil pemurnian dengan destilasi bertingkat pada suhu 60oC
Dikocok selama 15 menit
Didiamkan sampai n-heksan terpisah
Dibuang lapisan air yang diperoleh
Disaring lapisan solar dan n-heksan murni dengan kertas saring yang telah diolesi ±0,5 g Na2SO4
Dimasukkan ke dalam gelas kimia 100 ml yang telah ditimbang
Dipanaskan pada suhu 60oC sampai n-heksan habis Diangkat dan didiamkan sampai dingin
Ditimbang dan dicatat beratnya
Analisis kadar minyak solar secara gravimetri dilakukan pada hari ke-0, 7 dan 14 untuk masing-masing perlakuan
Larutan Media Hasil Pengujian
Disentrifugasi pada 3500 rpm selama 15 menit
Hasil
Lampiran 8 : Uji Kemampuan Biosurfaktan dalam Mengemulsi Minyak Solar (ml)
Cairan fermentasi diambil 4 ml
Dimasukkan ke dalam gelas ukur dengan perbandingan 4:1 (v/v) antara larutan dengan minyak
Ditambah minyak 1 ml Dikocok