1 BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
Dari analisis data dan pembahasan secara deskriptif dan statistik, hasil penelitian dapat disimpulkan sebagai berikut:
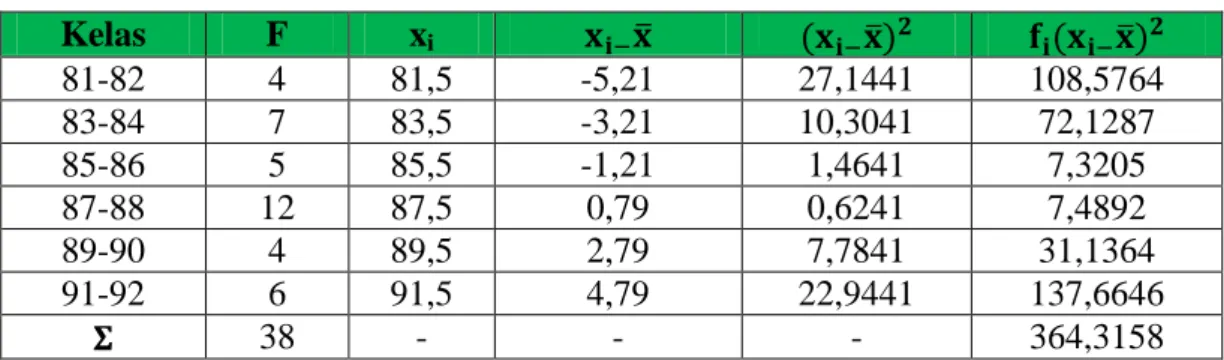
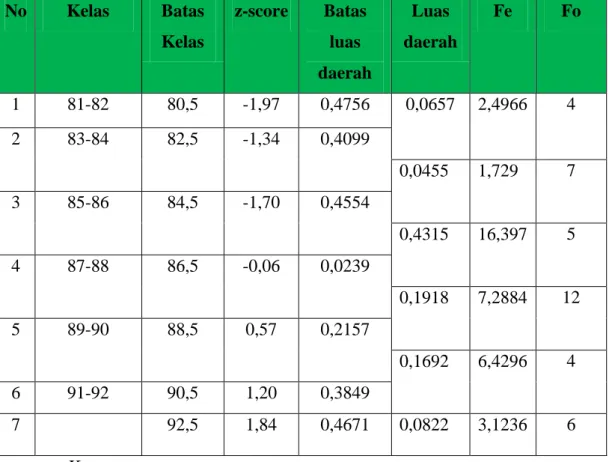
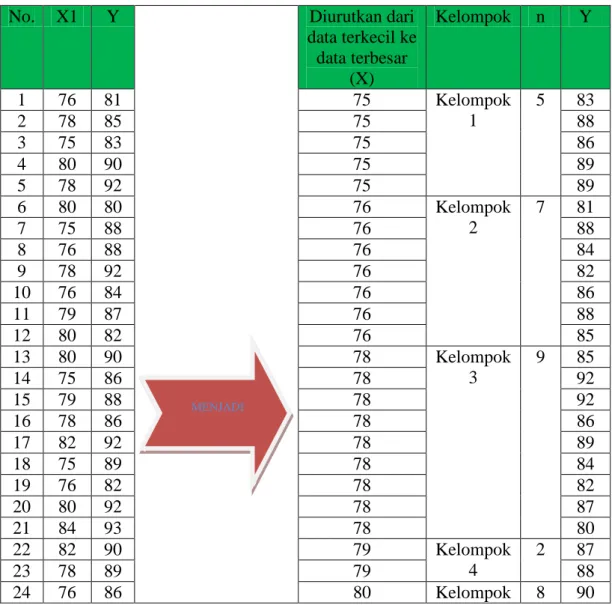
1. Pembelajaran dengan menerapkan Pendekatan Discovery Learning efektif diterapkan pada pembelajaran kimia dengan materi pokok termokimia siswa kelas XI IPA 2 SMAN 5 Kupang. Secara rinci dapat disimpulkan sebagai berikut:
a. Guru mampu dalam mengelola kegiatan pembelajaran dengan menerapkan Pendekatan Discovery Learning pada materi pokok termokimia yang ditunjukkan oleh skor rata-rata 3,62 termasuk dalam kategori baik.
b. Ketuntasan Indikator hasil belajar dengan menerapkan Pendekatan Discovery Learning meliputi:
1) Ketuntasan indikator hasil belajar sikap spiritual (KI-1) diperoleh dari rata-rata angket dan observasi sebesar 0,92 dan 0,92 dinyatakan tuntas.
2) Ketuntasan indikator hasil belajar sikap sosial (KI-2) diperoleh dari rata-rata angket dan observasi sebesar 0,90 dan 0,90 dinyatakan tuntas.
2
3) Ketuntasan indikator hasil belajar kognitif (KI-3) dinyatakan tuntas dengan proporsi rata-rata sebesar 0,91.
4) Ketuntasan indikator hasil belajar keterampilan (KI-4) diperoleh dari rata-rata indikator psikomotor, presentasi, portofolio dan THB proses sebesar 0,90, 0,89, 0,87, dan 0,83 dinyatakan tuntas. c. Ketuntasan hasil belajar dengan menerapkan Pendekatan Discovery
Learning meliputi:
1) Ketuntasan hasil belajar sikap spiritual (KI-1) dinyatakan tuntas dengan nilai rata-rata sebesar 92,88651.
2) Ketuntasan hasil belajar sikap sosial (KI-2) dinyatakan tuntas dengan nilai rata-rata sebesar 90,28783.
3) Ketuntasan hasil belajar pengetahuan (KI-3) dinyatakan tuntas dengan nilai rata-rata sebesar 82,64145.
4) Ketuntasan hasil belajar keterampilan (KI-4) dinyatakan tuntas dengan nilai rata-rata sebesar 87,33075.
2. Keterampilan proses siswa kelas XI IPA 2 SMAN 5 Kupang baik dengan presentase rata-rata tes keterampilan proses sebesar 78,66%.
3. Kemampuan berpikir kritis siswa kelas XI IPA 2 SMAN 5 Kupang tinggi dengan presentase rata-rata tes Kemampuan berpikir kritis sebesar 76,86%.
4. a. Ada hubungan yang signifikan antara keterampilan proses dengan hasil belajar kimia yang menerapkan Pendekatan Discovery Learning pada
3
materi pokok termokimia siswa kelas XI IPA 2 SMAN 5 Kupang tahun pelajaran 2016/2017 dengan korelasi Pearson Product Moment diperoleh nilai rX1Y = 0,468 dan nilai thitung ≥ ttabel (3,177 > 2,021). b. Ada hubungan yang signifikan antara kemampuan kritis dengan
hasil belajar kimia yang menerapkan Pendekatan Discovery Learning pada materi pokok sistem koloid siswa kelas XI IPA 2 SMAN 5 Kupang tahun pelajaran 2016/2017 dengan korelasi Pearson Product Moment rX2Y= 0,397 dan nilai thitung ≥ ttabel (3,367
> 2,021).
c. Ada hubungan yang signifikan antara keterampilan proses dan kemampuan berpikir kritis terhadap hasil belajar kimia yang menerapkan Pendekatan Discovery Learning pada materi pokok termokimia siswa kelas XI IPA 2 SMAN 5 Kupang tahun pelajaran 2016/2017 dengan korelasi ganda diperoleh nilai rX1X2Y = 0,514
dan nilai Fhitung ≥ Ftabel (6,297 > 3,23).
5. a. Ada pengaruh yang signifikan antara keterampilan proses terhadap hasil belajar kimia dengan menerapkan Pendekatan Discovery Learning pada materi pokok termokimia siswa kelas XI IPA 2 SMAN 5 Kupang tahun pelajaran 2016/2017 yang diperoleh dari persamaan garis regresi sederhana Ῡ = 45,690 + 0,5191X1 dan nilai
4
b. Ada pengaruh yang signifikan antara kemampuan berpikir kritis terhadap hasil belajar kimia dengan menerapkan Pendekatan Discovery Learning pada materi pokok termokimia siswa kelas XI IPA 2 SMAN 5 Kupang tahun pelajaran 2016/2017 yang diperoleh dari persamaan regresi sederhana Ῡ = 59,468+ 0,351X2 dan nilai
Fhitung ≥ Ftabel ( > 3,23).
c. Ada pengaruh yang signifikan antara keterampilan proses dan kemampuan berpikir kritis terhadap hasil belajar kimia dengan menerapkan Pendekatan Discovery Learning pada materi pokok termokimia siswa kelas XI IPA 2 SMAN 5 Kupang tahun pelajaran 2016/2017 yang diperoleh dari persamaan garis regresi gandan Ῡ = 38,646 + 0,403X1 + 0,210X2 dan nilai Fhitung ≥ Ftabel ( > ) B. Saran
1. Bagi guru perlu memperhatikan dan meningkatkan keterampilan proses dan kemampuan berpikir kritis agar siswa memiliki kemampuan yang kritis, kreatif dan inovatif dalam kegiatan pembelajaran yang nantinya akan mendukung dalam meningkatkan hasil belajar.
2. Penerapan Pendekatan Discovery Learning dalam mata pelajaran kimia materi termokimia, sangat baik dan efektif dalam pembelajaran sehingga dapat diterapkan untuk materi pokok lain yang sesuai.
5
3. Dalam rangka penyempurnaan perangkat pembelajaran yang menerapkan Pendekatan Discovery Learning dalam mata pelajaran yang menerapkan mata pelajaran kimia termokimia, maka perlu dilakukan penelitian lanjutan dengan pokok bahasan yang sesuai dengan model pembelajaran yang digunakan atau model pembelajaran lainnya.
4. Bagi para pengajar atau guru kimia, untuk materi termokimia sebaiknya diterapkan model pembelajaran yang sesuai agar terciptanya pembelajaran yang berkualitas dan bermutu.
6
DAFTAR PUSTAKA
Amalia,nunug dan Susiakiningsih Endang.Pengembangan Instrumen Penilaian Berpikir Kritis pada Materi termokimia.Semarang : Universitas Negeri Semarang.
Asmara,stella,et al. Pengaruh Metode Konsep Bertingkat Berbantuan Question Box Terhadap Peningkatan Kemampuan Berpikir Kritis.ISSN : 2252 – 6609 (diakses 20 -08 -2016)
Asummta, Maria. 2015. Pengaruh Kepercayaan Diri Dan Berpikir Kritis Terhadap Hasil Belajar Kimia Dengan Menerapkan Pendekatan Berbasis Masalah
(Problem Based Learning) Pada Materi Pokok Sistem Koloid Siswa Kelas
XI IPA 2 SMAN 5 Kupang Tahun Ajaran 2014/2015, Skripsi Sarjana yang Tidak Dipublikasikan, Kupang :Universitas Katolik Widya Mandira.
Dahar,silis Ratna.2011.Teori –Teori Belajar dan Pembelajaran.Bandung : Erlangga
Desmita. 2014. Psikologi Perkembangan Peserta Didik. Bandung: PT. Remaja Rosdakarya
Dhiu, Margaretha. 2012. Pengantar Pendidikan. Yogyakarta: Nusa Indah
Dimyati dan Mudjiono. 2000. Belajar dan Pembelajaran. Jakarta: Rineka Cipta
Eggen,paul dan Kauchak Don.2012. Strategi dan Model Pembelajaran.Jakarta : Indeks
7
Ekawati,risma,et.al.Peningkatan Hasil Belajar dan Kemampuan Berpikir Kritis dengan Model Pembelajaran Cooperative Intergrated Reading and
Composition (CIRC).ISSN : 242 – 3750 (diakses 08 – 07 – 2016)
Feldman A. Daniel. 2010. Berpikir Kritis Strategi untuk Pengambilan Keputusan. Jakarta: PT. Indeks
Fisher, Alec. 2008. Berpkir Kritis. Jakarta: PT. Erlangga.
Gunawan, W. Adi. 2006. Genius Learning Strategy. Jakarta: PT. Gramedia Pustaka Utama.
Kalsum, Siti, dkk. 2009. Kimia 2 SMA/MA Kelas XI. Jakarta: Departemen Pendidikan Nasional.
Kemendikbud. 2014. Materi Pelatihan Guru Implementasi Kurikulum 2013.Kemendikbud. Jakarta.
Kemendikbud. 2015. Model-model Pembelajaran SMA. Kemendikbud. Jakarta
Khodijah,nyanyu.2014.Psikologi Pendidikan.Jakarta : Grafindo Persada.
Prayoga,zumisa.2013.Kemampuan Berpikir Kritis Siswa Pada Pembelajaran
Pengelolaan Lingkungan dengan Pendekatan Keterampilan
8
Rahayu, et al.2013.Pembelajaran Sains dengan Pendekatan Keterampilan Proses Untuk Meningkatkan Hasil Belajar dan Kemampuan Berpikir Kreatif
Siswa.ISSN : 1693 – 1246 (diakses 20-02-2016)
Redhan,wayan.2002.Meningkatkan Keterampilan Berpikir Kritis Siswa Melalui Pembelajaran Kooperative dengan Strategi Pemecahan Masalah. Semarang : Universitas Negeri Semarang.
Riduwan dan Akdon. 2013. Rumus dan Data dalam Analisis Statistika. Bandung: Alfabeta.
Slameto. 2013. Belajar dan Faktor-faktor yang Mempengaruhi. Jakarta: Rineka Cipta.
Sugiyono. 2014. Metode Penelitian Pendidikan. Bandung: Alfa Beta.
Sukestiyarno. 2013. Statistika Dasar. Semarang: PT. Andi.
Suryabrata,sumandi.2004.Psikologi Pendidikan.Jakarta : Grafindo Persada
Sudjana,nana.1989.Penilaian Hasil Proses Belajar Mengajar.Bandung : Remaja Rosdakrya.
Sugiyono.2012.Metode Penilitian Pendidikan.Bandung : Alfabeta
9
Soyomukti,Nurani.2010.Teori – Teori Pendidikan.Yogyakarta : Ar – Ruzz Media Group.
Watoni,haris.2015.Kimia Untuk SMA/MA Kelas XI.Bandung : Yrama Widya.
Wibowo, ayu aranda rosela.2014.Meningkatkan Keterampilan Proses Dasar IPA Menggunakan Pendekatan Keterampilan Proses pada Siswa Kelas IV SD
Negeri 1 Kiyaran II Cangkringan Sileman Yogyakrta.Yogyakrta : Universitas Negeri Yogyakarta.
Yuniastuti,Euis.2012.Peningkatan Keterampilan Proses, Motivasi dan Hasil Belajar Biologi dengan Strategi Pembelajaran Inkuiri Terbimbing Pada Siswa Kelas
11
SILABUS MATA PELAJARAN KIMIA
(Peminatan Bidang MIPA)
Satuan Pendidikan : SMA
Kelas : XI
Kompetensi Inti
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya
KI 2 : Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan proaktif, dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia
KI 3 : Memahami, menerapkan, dan menganalisis pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah
KI 4 : Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai kaidah keilmuan
Kompetensi Dasar Materi Pokok Pembelajaran Penilaian Alokasi Waktu Sumber Belajar
1.1 Menyadari adanya keteraturan dari sifat hidrokarbon, termokimia, lajureaksi,
kesetimbangan kimia, larutan dan koloid sebagai wujud kebesaran Tuhan YME dan pengetahuan tentang adanya keteraturan tersebut sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
Reaksi eksoterm dan reaksi endoterm Perubahan entalpi reaksi - Kalorimeter - Hukum Hess - Energi ikatan Mengamati (Observing)
Menggali informasi dengan cara membaca/ mendengar/mengamati/sistem dan lingkungan, perubahan suhu, kalor yang dihasilkan pada pembakaran bahan bakar, dan dampak
pembakaran tidak sempurna dari berbagai bahan bakar
Menanya (Questioning)
Mengajukan pertanyaan yang berkaitan dengan: reaksi eksoterm dan endoterm dalam
kehidupan sehari-hari, bagaimana menentukan perubahan entalpi reaksi
Mengumpulkan data (Eksperimenting)
Mendiskusikan pengertian sistem dan lingkungan
Tugas
Merancang percobaan reaksi eksoterm, reaksi endoterm dan mengkaitkannya dengan peristiwa sehari-hari Merancang percobaan penentuan perubahan entalpi dengan Kalorimeter dan mengkaitkannya dengan peristiwa sehari-hari Merancang percobaan kalor pembakaran 3 mgg x 4 jp - Buku kimia kelas XI - Lembar kerja - Berbagai sumber lainnya 1.2 Mensyukuri kekayaan alam Indonesia berupa
minyak bumi, batubara dan gas alam serta berbagai bahan tambang lainnya sebagai anugrah Tuhan YME dan dapat dipergunakan untuk kemakmuran rakyat Indonesia.
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif,
12
Kompetensi Dasar Materi Pokok Pembelajaran Penilaian Alokasi Waktu Sumber Belajar
demokratis, komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
Mendiskusikan macam-macam perubahan entalpi
Merancang dan mempresentasikan rancangan percobaan
- Reaksi Eksoterm dan Reaksi Endoterm - Penentuan Perubahan Entalpi dengan
Kalorimeter
-Penentuan Kalor Pembakaran Bahan Bakar
Melakukan percobaan reaksi eksoterm dan reaksi endoterm; penentuan perubahan entalpi dengan Kalorimeter dan penentuan kalor pembakaran bahan bakar
Mengamati dan mencatat hasil percobaan
Mengasosiasi (Associating)
Menganalisis data untuk membuat diagram siklus dan diagram tingkat
Mengolah data untuk menentukan harga perubahan entalpi (azas Black)
Membandingkan perubahan entalpi pembakaran sempurna dengan pembakaran tidak sempurna melalui perhitungan
Menghubungkan perubahan entalpi reaksi dengan energi ikatan
Menghitung perubahan entalpi berdasarkan hukum Hess dan energi ikatan
Mengkomunikasikan (Communicating) Membuat laporan hasil percobaan dengan
menggunakan tata bahasa yang benar.
Mempresentasikan hasil percobaan dengan menggunakan tata bahasa yang benar.
bahan bakar
Observasi
Sikap ilmiah dalam melakukan percobaan dan presentasi, misalnya: melihat skala volume dan suhu, cara
menggunakan pipet, cara menimbang, keaktifan, kerja sama, komunikatif, dan peduli lingkungan, dsb)
Portofolio
Laporan percobaan
Tes tertulis uraian Pemahaman reaksi
eksoterm dan reaksi endoterm
Membuat diagram siklus dan diagram tingkat berdasarkan data
Menentukan
perubahan entalpi ( H) reaksi
2.2 Menunjukkanperilaku kerjasama, santun, toleran, cintadamai dan peduli lingkungan serta hemat dalam memanfaatkan sumber daya alam. 2.3 Menunjukkan perilaku responsifdan pro-aktif
serta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuat keputusan 3.1 Membedakan reaksi eksoterm dan reaksi
endoterm berdasarkan hasil percobaan dan diagram tingkat energi.
3.2 Menentukan H reaksi berdasarkan hukum Hess, data perubahan entalpi pembentukan standar, dan data energi ikatan.
4.1 Merancang, melakukan, menyimpulkan serta menyajikan hasil percobaan reaksi eksoterm dan reaksi endoterm.
4.2 Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan penentuan H suatu reaksi.
Lampiran 2a
194
RENCANA PELAKSANAAN PEMBELAJARAN (RPP 01)
Satuan Pendidikan : SMAN 5 Kupang
Mata Pelajaran : Kimia
Kelas/Semester : XI/I (Ganjil)
Materi Pokok : Termokimia
Pertemuan ke- : I
Alokasi Waktu : 1 x pertemuan (3 x 45 menit)
A. Kompetensi Inti `
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya
KI 2: Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
KI 3 : Memahami,menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat danminatnya untuk memecahkan masalah. KI 4 :Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak
terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metoda sesuai kaidah keilmuan.
B. Kompetensi Dasar dan Indikator KD dari KI 1
1.1Menyadari adanya keteraturan struktur partikel materi sebagai wujud kebesaran Tuhan Yang Maha Esa (YME) dan pengetahuan tentang struktur
Lampiran 2a
195
partikel materi sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
Indikator :
Sikap Spiritual
Mengagungkan kebesaran Tuhan YME dengan berdoa sebelum menjalankan proses pembelajaran
Mengagungkan kebesaran Tuhan YME dengan berdoa sesudah menjalankan pembelajaran
Mengagungkan kebesaran Tuhan YME menurut keyakinan dan kep ercayaanya masing-masing
Mengagungkan kebesaran Tuhan YME dengan sikap yang sopan Bersyukur kepada Tuhan YME atas rahmat dan karunia-Nya dalam
proses pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan YME adalah yang terbaik bagi kita melalui pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan lewat pengetahuan yang diperoleh bersifat tentative.
KD dari KI 2
2.1Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif ) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.2Menunjukkan perilaku kerjasama,santun, toleran, cinta damai dan peduli lingkungan serta hemat dalam memanfaatkan sumber daya alam.
Indikator :
Sikap Sosial:
Rasa ingin tahu dalam mengelola bahan ajar dan sumber informasi dari buku sumber lainnya dalam kegiatan pembelajaran tentang materi Termokimia
Lampiran 2a
196
Jujur dalam mengerjakan menganalisis data selama diskusi dan eksperimen.
Tanggung jawab dalam diskusi kelompok, menjaga keselamatan alat-alat praktikum, dan mengerjakan laporan praktikum.
Proaktif dalam diskusi dengan mencari tahu informasi yang dibutuhkan dalam kelompok
Dapat bekerja sama dengan baik antara teman dalam menyelesaikan tugas kelompok.
Dapat menunjukkan sifat peduli lingkungan saat kegiatan pembelajaran.
Menunjukkan sikap proaktif dalam memecahkan masalah dan membuat keputusan.
KD dari KI 3
Membedakan reaksi eksoterm dan reaksi endoterm berdasarkan hasil percobaan dan diagram tingkat energi
Indikator :
1. Menjelaskan pengertian energi 2. Menjelaskan pengertian entalpi
3. Menjelaskan pengertian sistem pada reaksi eksoterm dan endoterm 4. Menjelaskan pengertian lingkungan pada reaksi eksoterm dan
endoterm
5. Membedakan reaksi eksoterm dan endoterm berdasarkan hasil percobaan
6. Membandingkan reaksi eksoterm dan endoterm berdasarkan diagram tingkat energi
7. Membedakan reaksi eksoterm dan endoterm berdasarkan diagram tingkat energi
KD dan KI 4
Merancang, melakukan, menyimpulkan serta menyajikan hasil percobaan reaksi eksoterm dan reaksi endoterm
Lampiran 2a 197 Proses 1. Merumuskan masalah 2. Merumuskan hipotesis 3. Melakukan eksperimen 4. Mengumpulkan data
5. Menganalisis data percobaan 6. Membuat kesimpulan
Psikomotor
1. persiapan percoabaan 2. pelaksanaan percobaan 3. kegiatan akhir percobaan
C. Tujuan pembelajaran
Mengagungkan kebesaran Tuhan YME dengan berdoa sebelum menjalankan proses pembelajaran
Mengagungkan kebesaran Tuhan YME dengan berdoa sesudah menjalankan pembelajaran
Mengagungkan kebesaran Tuhan YME menurut keyakinan dan keperc ayaanya masing-masing
Mengagungkan kebesaran Tuhan YME dengan sikap yang sopan Bersyukur kepada Tuhan Yang Maha Esa atas rahmat dan
karunia-Nya dalam proses pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan YME adalah yang terbaik bagi kita melalui pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan lewat pengetahuan yang diperoleh bersifat tentative.
Rasa ingin tahu dalam mengelola bahan ajar dan sumber informasi dari buku sumber lainnya dalam kegiatan pembelajaran.
Jujur dalam mengerjakan menganalisis data selama diskusi dan eksperimen.
Tanggung jawab dalam diskusi kelompok, menjaga keselamatan alat-alat praktikum, dan mengerjakan laporan praktikum.
Lampiran 2a
198
Toleransi dengan cara menerima masukkan, kritik dan saran dari kelompok lain.
Gotong royong dengan cara membantu teman dalam melakukan praktikum dan menyelesaikan soal-soal yang diberikan.
Santun dalam menanggapi dan memberikan saran ketika teman lain mempresentasikan hasil diskusi serta santun dalam memberikan ide selama diskusi.
Teliti dalam mengolah dan menganalisis data (melakukan pembuktian tentang hidrokarbon).
Menjelaskan pengertian energi Menjelaskan pengertian entalpi
Menjelaskan pengertian sistem pada reaksi eksoterm dan endoterm Menjelaskan pengertian lingkungan pada reaksi eksoterm dan
endoterm
Membandingkan reaksi eksoterm dan endoterm berdasarkan diagram tingkat energi
Membedakan reaksi eksoterm dan endoterm berdasarkan diagram tingkat energi
D. MATERI PEMBELAJARAN Asas Kekekalan Energi Entalpi Molar
E. PENDEKATAN DAN METODE PEMBELAJARAN Pendekatan : Discovery Learning
Metode : Diskusi, Tanya jawab dan eksperimen.
F. MEDIA DAN SUMBER BELAJAR
Buku kimia untuk SMA dan MA kelompok peminatan Kelas XI Michael Purba, Penerbit: Erlangga.
LKPD.
Alat dan bahan percobaan LCD
Lampiran 2a
199 G. KEGIATAN PEMBELAJARAN
Kegiatan Model –model Discovery Learning
Deskripsi Kegiatan Alokasi waktu Pendahuluan stimulation
(pemberian rangsangan)
Guru memberi salam kemudian menyuruh salah satu peserta didik untuk memimpin doa sebagai wujud kebesaran Tuhan YME.
Guru mengecek kehadiran peserta didik
Guru menyampaikan topik, sub topik dan tujuan pembelajaran
Guru menyampaikan penilaian otentik yang akan diambil saat pembelajaran kepada peserta didik.
Sebagai apersepsi untuk mendorong rasa ingin tahu dan berpikir kritis, guru mengajukan pertanyaan “Ketika kayu atau minyak tanah dibakar, dihasilkan sejumlah kalor. Kalor yang dihasilkan kayu atau minyak tanah yang terbakar mengakibatkan keadaan sekitarnya menjadi panas. Namun, ketika api sudah padam keadaan akan menjadi normal kembali. Kemanakah kalor yang dihasilkan dari proses pembakaran kayu atau minyak iotu tadi? Apakah kalor itu hilang?” Jawab: Asas kekekalan energi
menyatakan bahwa energi
Lampiran 2a
200
tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk lain. Jadi, kalor yang dihasilkan pada pembakaran kayu atau minyak tanah, bukannya hilang tetapi diserap oleh molekul-molekul udara
atau benda-benda lain
disekitarnya dan diubah menjadi bentuk energi lainnya misalnya menjadi energi kinetik.
Peserta didik menerima informasi kompetensi dari materi Termokimia yang akan dilaksanakan.
Guru membagi peserta didik dalam beberapa kelompok minimal 5 kelompok (1 kelompok 7 atau 8 orang), untuk melakukan percobaan serta menjelaskan LKPD tentang reaksi eksoterm dan endoterm (Pada tahap ini, guru mengarahkan Peserta didik agar tetap berada di dalam kelompok, memusatkan perhatian pada diskusi mengenai materi dalam LKPD).
Lampiran 2a
201 Kegiatan Inti Problem
statement (identifikasi masalah)
Mengamati (Observing)
Guru mendemonstrasikan tentang reaksi eksoterm dan reaksi endoterm
HCl CH3COOH
NaOH (s) NaHCO3 (s)
1 2
Guru meminta Peserta didik yang lain mengamati demonstrasi/infomasi yang dilakukan guru (untuk menumbuhkan rasa ingin tahu
Peserta didik) dari kegiatan tersebut.
Menanya (Questioning):
Peserta didik diminta
mengemukakan sebanyak mungkin pertanyaan yang berkaitan dengan hasil pengamatannya.
Contoh pertanyaan:
Mengapa pada gelas kimia 1 terasa panas sedangkan pada gelas kimia 2 terasa dingin? Dari kedua reaksi tersebut
mana yang merupakan reaksi
eksoterm dan reaksi
endoterm?Peserta didik
menjawab pertanyaan yang diberikan
Lampiran 2a
202 Data collection /pengumpulan data.
Mengumpulkan data (eksperimen) Guru memperkenalkan praktikum
yang akan dilakukan.
Guru memperkenalkan alat dan bahan dan bahan yang ada dalam LKPD.
Guru menjelaskan dan mempertegas prosedur kerja yang terdapat pada LKPD.
Guru meminta perwakilan dari setipa kelompok untuk mengambil alat dan bahan yang sudah ada dalam LKPD.
Guru membimbing Peserta
didik untuk melakukan praktikum untuk mengidentifikasi reaksi eksoterm dan endoterm berdasarkan
langkah-langkah pada LKPD
(Peserta didik diharapakan aktif melakukan praktikum dan tanggung
jawab dalam menjaga
keselamatan alat praktikum, dalam kegiatan alat praktikum.
Guru membimbing Peserta
didik dalam melakukan pengamatan.
Peserta didik mencatat hasil percobaan (Peserta didik diharapkan menunjukan perilaku jujur dan teliti
dalam mencatat data hasil pengamatan, disiplin selama kegiatan praktikum, serta dalam kegiatan ini guru menilai
Lampiran 2a 203 Data procesing /pengolahan data. Verifikasi (pembuktian)
keterampilan Peserta didik).
Mengasosiasi (Associating)
Peserta didik menganalisis data pengamatan tentang mengindentifika
si reaksi eksoterm dan
endoterm.dan membandingklan teori dalam bahan ajar atau sumber lain untuk menjawab dan membuktikan kebenaran hipotesis (Peserta didik diharapkan dapat bekerjasama dan
aktif dalam menyelesaikan soal-soal pada LKPD).
Peserta didik menyimpulkan
pengamatan tentang mengindentifika si reaksi eksoterm dan endoterm.
Peserta didik mencatat semua hasil diskusi kelompoknya
Peserta didik menghubungkan hasil diskusi kelompoknya dengan dasar teori.
Mengkomunikasikan
Peserta didik membuat laporan sementara. Pada tahap ini Peserta didik diharapkan pro-aktif dalam kegiatan diskusi dan diharapkan mampu bekerja sama dengan sesama teman.
Guru memberikan kesempatan
Lampiran 2a
204
diwakili oleh seorang Peserta didik untuk maju ke depan membacakan hasil diskusi di depan kelas (Peserta didik diharapkan bertanggung jawab mempresentasikan data hasil pengamatan dengan menggunakan bahasa yang baku dala presentasi hasil percobaan serta dalam kegiatan ini guru menilai presentasi Peserta didik).
Guru memberikan kesempatan
kepada kelompok lain untuk mendengar dan menanggapi hasil
diskusi kelompok yang
mempresentasikan (Peserta didik diharapkan menunjukan perilaku
pro-aktif)
Guru memberikan pengahargaan kepada kelompok yang sudah berkinerja baik dan memberikan motivasi kepada Peserta didik yang belum berkinerja baik
Guru memberikan penegasan
kembali atas jawaban yang telah disampaikan oleh Peserta didik.
Guru mempersilakan Peserta didik untuk duduk kembali ke tempat semula.
Guru memberikan penjelasan singkat tentang materi dengan menggunakan media PPT.
Lampiran 2a
205
“Menilai”
Guru memberikan waktu untuk peserta didik untuk membaca kembali bahan ajar yang telah diberikan
Guru memberikan kuis.
Penutup Generalization( membuat kesimpulan)
Guru melakukan refleksi tentang kegiatan yang telah dilaksanakan
Guru membimbing peserta didik untuk membuat kesimpulan akhir.
Guru memberikan tugas rumah kepada peserta didik
Guru mengingatkan Peserta didik
untuk mempelajari materi
pembelajaran untuk pertemuan berikutnya
Guru mengakhiri pertemuan dengan doa penutup dan meminta salah satu peserta didik untuk memimpin doa (guru mengajarkan Peserta didik untuk mengagungkan kebesa ran TYME melalui berdoa sesudah kegiatan pembelajaran,berdoa dengan sikap santun, dan berdoa sesuai dengan ajaran agama yang dianut).
Guru menberikan salam penutup
Lampiran 2a
206 H. PENILAIAN HASIL PEMBELAJARAN
1. Penilaian Sikap KI 1 : Kisi – Kisi dan Lembar Observasi Sikap Spiritual, Kisi – Kisi dan Angket Penilaian Diri Sikap Spiritual
2. Penilaian Sikap KI 2 : Kisi – Kisi dan Lembar Observasi Sikap Sosial, Kisi - Kisi dan Angket Penilaian Sikap Sosial.
3. Penilaian Pengetahuan (KI 3) : Tugas individu,kuis
4. Penialaian Keterampilan (KI 4) : Kisi – Kisi dan Lembar Observasi Aspek Psikomotorik Kisi – Kisi dan Lembar Observasi Portofolio ,Kisi – Kisi dan Lembar Observasi Presentasi Kelas , Kisi – Kisi Penilaian Keterampilan Kisi – Kisi dan THB Proses.
RENCANA PELAKSANAAN PEMBELAJARAN (RPP 02)
Satuan Pendidikan : SMAN 5 Kupang
Mata Pelajaran : Kimia
Kelas/Semester : XI/I (Ganjil)
Materi Pokok : Termokimia
Pertemuan ke- : 2
Alokasi Waktu : 1 x pertemuan (2 x 45 menit)
I. Kompetensi Inti `
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya
KI 2: Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
KI 3 : Memahami,menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat danminatnya untuk memecahkan masalah. KI 4 :Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak
terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metoda sesuai kaidah keilmuan
Lampiran 2a
208 J. Kompetensi Dasar dan Indikator
KD dari KI 1
1.2Menyadari adanya keteraturan struktur partikel materi sebagai wujud kebesaran Tuhan Yang Maha Esa dan pengetahuan tentang struktur partikel materi sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
Indikator :
Sikap Spiritual
Mengagungkan kebesaran Tuhan YME dengan berdoa sebelum menjalankan proses pembelajaran
Mengagungkan kebesaran Tuhan YME dengan berdoa sesudah menjalankan pembelajaran
Mengagungkan kebesaran Tuhan YME menurut keyakinan dan kep ercayaanya masing-masing
Mengagungkan kebesaran Tuhan YME dengan sikap yang sopan Bersyukur kepada Tuhan YME atas rahmat dan karunia-Nya dalam
proses pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan YME adalah yang terbaik bagi kita melalui pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan lewat pengetahuan yang diperoleh bersifat tentative.
KD dari KI 2
2.3Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif ) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.4Menunjukkan perilaku kerjasama,santun, toleran, cinta damai dan peduli lingkungan serta hemat dalam memanfaatkan sumber daya alam.
Lampiran 2a
209 Indikator :
Sikap Sosial:
Rasa ingin tahu dalam mengelola bahan ajar dan sumber informasi dari buku sumber lainnya dalam kegiatan pembelajaran tentang materi Termokimia
Jujur dalam mengerjakan menganalisis data selama diskusi dan eksperimen.
Tanggung jawab dalam diskusi kelompok, menjaga keselamatan alat-alat praktikum, dan mengerjakan laporan praktikum.
Proaktif dalam diskusi dengan mencari tahu informasi yang dibutuhkan dalam kelompok
Dapat bekerja sama dengan baik antara teman dalam menyelesaikan tugas kelompok.
Dapat menunjukkan sifat peduli lingkungan saat kegiatan pembelajaran.
Menunjukkan sikap proaktif dalam memecahkan masalah dan membuat keputusan.
KD dari KI 3
Menentukan H reaksi berdasarkan hukum Hess, data perubahan entalpi pembentukan standar, dan data energi ikatan.
Indikator :
1. Menjelaskan persamaan termokimia
2. Menjelaskan perbedaan persamaan termokimia dan stoikiometri 3. Menuliskan persamaan termokimia
4. Menjelaskan jenis-jenis perubahan entalpi reaksi ( H) 5. Menjelaskan kalor jenis air
6. Menjelaskan kapasitas kalor
7. Menentukan nilai H reaksi menggunakan kalorimeter 8. Menentukan nilai H reaksi menggunakan hukum hess
Lampiran 2a
210
10. Menentukan nilai H reaksi berdasarkan data energi ikatan
KD dan KI 4
Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan penentuan H suatu reaksi.
Indikator: Proses 1. Merumuskan masalah 2. Merumuskan hipotesis 3. Melakukan eksperimen 4. Mengumpulkan data
5. Menganalisis data percobaan 6. Membuat kesimpulan
Psikomotor
1. persiapan percoabaan 2. pelaksanaan percobaan 3. kegiatan akhir percobaan
K. Tujuan pembelajaran
Mengagungkan kebesaran Tuhan YME dengan berdoa sebelum menjalankan proses pembelajaran
Mengagungkan kebesaran Tuhan YME dengan berdoa sesudah menjalankan pembelajaran
Mengagungkan kebesaran Tuhan YME menurut keyakinan dan keperc ayaanya masing-masing
Mengagungkan kebesaran Tuhan YME dengan sikap yang sopan Bersyukur kepada Tuhan Yang Maha Esa atas rahmat dan
karunia-Nya dalam proses pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan YME adalah yang terbaik bagi kita melalui pembelajaran.
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan lewat pengetahuan yang diperoleh bersifat tentative.
Lampiran 2a
211
Rasa ingin tahu dalam mengelola bahan ajar dan sumber informasi dari buku sumber lainnya dalam kegiatan pembelajaran.
Jujur dalam mengerjakan menganalisis data selama diskusi dan eksperimen.
Tanggung jawab dalam diskusi kelompok, menjaga keselamatan alat-alat praktikum, dan mengerjakan laporan praktikum.
Toleransi dengan cara menerima masukkan, kritik dan saran dari kelompok lain.
Gotong royong dengan cara membantu teman dalam melakukan praktikum dan menyelesaikan soal-soal yang diberikan.
Santun dalam menanggapi dan memberikan saran ketika teman lain mempresentasikan hasil diskusi serta santun dalam memberikan ide selama diskusi.
Teliti dalam mengolah dan menganalisis data (melakukan pembuktian tentang hidrokarbon).
Menjelaskan persamaan termokimia
Menjelaskan perbedaan persamaan termokimia dan stoikiometri Menuliskan persamaan termokimia
Menjelaskan jenis-jenis perubahan entalpi reaksi ( H) Menjelaskan kalor jenis air
Menjelaskan kapasitas kalor
Menentukan kapasitas kalor suatu reaksi berdasarkan data percobaan Menentukan nilai H reaksi menggunakan kalorimeter
Menentukan nilai H reaksi menggunakan hukum Hess
Menentukan nilai H reaksi berdasarkan data H pembentukan standar
Lampiran 2a
212 L. MATERI PEMBELAJARAN
Penentuan Entalpi reaksi Energi Bahan Bakar
M. PENDEKATAN DAN METODE PEMBELAJARAN Pendekatan : Discovery Learning
Metode : Diskusi, Tanya jawab dan eksperimen.
N. MEDIA DAN SUMBER BELAJAR
Buku kimia untuk SMA dan MA kelompok peminatan Kelas XI Michael Purba, Penerbit: Erlangga.
LKPD.
Alat dan bahan percobaan LCD
O. KEGIATAN PEMBELAJARAN Kegiatan Model –model
Discovery Learning
Deskripsi Kegiatan Alokasi waktu Pendahuluan stimulation
(pemberian rangsangan)
Guru memberi salam kemudian menyuruh salah satu peserta didik untuk memimpin doa sebagai wujud kebesaran Tuhan YME.
Guru mengecek kehadiran peserta didik
Guru menyampaikan topik, sub topik dan tujuan pembelajaran
Guru menyampaikan penilaian otentik yang akan diambil saat pembelajaran kepada peserta didik.
Sebagai apersepsi untuk mendorong rasa ingin tahu dan berpikir kritis, guru mengajukan pertanyaan “Pada pertemuan sebelumnya, kita telah
Lampiran 2a
213
mempelajari mengenai reaksi eksoterm dan reaksi endoterm. Suatu reaksi dapat dikatakan reaksi eksoterm ataupun reaksi endoterm jika dilihat dari perubahan entalpinya (∆H). Dimana jika ∆H positif berarti reaksi endoterm dan jika negatif berarti reaksi eksoterm. Bagaimanakah cara menentukan nilai perubahan entalpi suatu reaksi berdasarkan jumlah mol atau koefisien reaksinya?”
Peserta didik menerima informasi kompetensi dari materi Termokimia yang akan dilaksanakan.
Guru membagi peserta didik dalam beberapa kelompok minimal 5 kelompok (1 kelompok 7 atau 8 orang), untuk melakukan percobaan serta menjelaskan LKPD tentang reaksi eksoterm dan endoterm (Pada tahap ini, guru mengarahkan Peserta didik agar tetap berada di dalam kelompok, memusatkan perhatian pada diskusi mengenai materi dalam LKPD).
Kegiatan Inti Problem statement (identifikasi masalah)
Mengamati (Observing)
Guru menuliskan beberapa reaksi 1. 2C + H2 → C2H2 ∆H= + 227 kJ 2. 2H2O → 2H2 + O2 ∆H= - 571,1 kJ 3. H2O (s) → H2O (l) ∆H= - 36,4 kJ
Lampiran 2a 214 Data collection /pengumpulan data. 4. C + O2 → CO2 ∆H= - 393,52 kJ
Guru meminta Peserta didik yang lain mengamati reaksi yang dituliskan guru (untuk menumbuhkan rasa ingin tahu Peserta didik) dari kegiatan tersebut.
Menanya (Questioning):
Peserta didik diminta
mengemukakan sebanyak mungkin pertanyaan yang berkaitan dengan hasil pengamatannya.
Contoh pertanyaan:
Termasuk reaksi apakah reaksi tersebut?
Apakah reaksi stoikiometri atau reaksi termokimia? Mengapa demikian?
Dan reaksi nomor berapakah yang termasuk dalam entalpi pembentukan, penguraian, pembakaran dan entalpi pelarutan?
Peserta didik menjawab pertanyaan yang diberikan
Mengumpulkan data (eksperimen) Guru memperkenalkan praktikum
yang akan dilakukan.
Lampiran 2a
215
bahan dan bahan yang ada dalam LKPD.
Guru menjelaskan dan mempertegas prosedur kerja yang terdapat pada LKPD.
Guru meminta perwakilan dari setipa kelompok untuk mengambil alat dan bahan yang sudah ada dalam LKPD.
Guru membimbing Peserta
didik untuk melakukan praktikum untuk menentukan perubahan entalpi reaksi berdasarkan langkah-langkah
pada LKPD (Peserta didik
diharapakan aktif
melakukan praktikum dan tanggung
jawab dalam menjaga
keselamatan alat praktikum, dalam kegiatan alat praktikum.
Guru membimbing Peserta
didik dalam melakukan pengamatan.
Peserta didik mencatat hasil percobaan (Peserta didik diharapkan menunjukan perilaku jujur dan teliti
dalam mencatat data hasil pengamatan, disiplin selama kegiatan praktikum, serta dalam kegiatan ini guru menilai
Lampiran 2a 216 Data procesing /pengolahan data. Verifikasi (pembuktian) Mengasosiasi (Associating)
Peserta didik menganalisis data pengamatan tentang menentukan perubahan entalpi reaksi dan membandingkan dengan teori dalam bahan ajar atau sumber lain untuk
menjawab dan membuktikan
kebenaran hipotesis (Peserta didik diharapkan dapat bekerjasama dan
aktif dalam menyelesaikan soal-soal pada LKPD).
Peserta didik menyimpulkan
pengamatan tentang menentukan perubahan entalpi reaksi.
Peserta didik mencatat semua hasil diskusi kelompoknya
Peserta didik menghubungkan hasil diskusi kelompoknya dengan dasar teori.
Mengkomunikasikan
Peserta didik membuat laporan sementara. Pada tahap ini Peserta didik diharapkan pro-aktif dalam kegiatan diskusi dan diharapkan mampu bekerja sama dengan sesama teman.
Guru memberikan kesempatan
kepada masing-masing kelompok diwakili oleh seorang Peserta didik untuk maju ke depan membacakan
Lampiran 2a
217
hasil diskusi di depan kelas (Peserta didik diharapkan bertanggung jawab mempresentasikan data hasil pengamatan dengan menggunakan bahasa yang baku dala presentasi hasil percobaan serta dalam kegiatan ini guru menilai presentasi Peserta didik).
Guru memberikan kesempatan
kepada kelompok lain untuk mendengar dan menanggapi hasil
diskusi kelompok yang
mempresentasikan (Peserta didik diharapkan menunjukan perilaku
pro-aktif)
Guru memberikan penghargaan kepada kelompok yang sudah berkinerja baik dan memberikan motivasi kepada Peserta didik yang belum berkinerja baik
Guru memberikan penegasan
kembali atas jawaban yang telah disampaikan oleh Peserta didik.
Guru mempersilakan Peserta didik untuk duduk kembali ke tempat semula.
Guru memberikan penjelasan singkat tentang materi dengan menggunakan media PPT.
Lampiran 2a
218
“Menilai”
Guru memberikan waktu untuk peserta didik untuk membaca kembali bahan ajar yang telah diberikan
Guru memberikan kuis.
Penutup Generalization( membuat kesimpulan)
Guru melakukan refleksi tentang kegiatan yang telah dilaksanakan
Guru membimbing peserta didik untuk membuat kesimpulan akhir.
Guru memberikan tugas rumah kepada peserta didik
Guru mengingatkan Peserta didik
untuk mempelajari materi
pembelajaran untuk pertemuan berikutnya
Guru mengakhiri pertemuan dengan doa penutup dan meminta salah satu peserta didik untuk memimpin doa (guru mengajarkan Peserta didik untuk mengagungkan kebesa ran TYME melalui berdoa sesudah kegiatan pembelajaran,berdoa dengan sikap santun, dan berdoa sesuai dengan ajaran agama yang dianut).
Guru memberikan salam penutup
Lampiran 2a
219 P. PENILAIAN HASIL PEMBELAJARAN
1. Penilaian Sikap KI 1 : Kisi – Kisi dan Lembar Observasi Sikap Spiritual, Kisi – Kisi dan Angket Penilaian Diri Sikap Spiritual
2. Penilaian Sikap KI 2 : Kisi – Kisi dan Lembar Observasi Sikap Sosial, Kisi - Kisi dan Angket Penilaian Sikap Sosial.
3. Penilaian Pengetahuan (KI 3) : Tugas individu,kuis
4. Penialaian Keterampilan (KI 4) : Kisi – Kisi dan Lembar Observasi Aspek Psikomotorik Kisi – Kisi dan Lembar Observasi Portofolio ,Kisi – Kisi dan Lembar Observasi Presentasi Kelas , Kisi – Kisi Penilaian Keterampilan Kisi – Kisi dan THB Proses.
Lampiran 03
220 1. Energi dan Entalpi
Dalam setiap materi terkandung energi dengan kualitas dan kuantitas yang berbeda-beda. Misalnya energi yang terkandung dalam suatu materi digunakan untuk menggerakkan partikel-partikel atau energi digunakan untuk mengadakan interaksi dalam suatu molekul. Dengan demikian energi merupakan suatu kemampuan untuk melakukan usaha atau kerja. Melalui proses kimia, energi dapat diudah menjadi energi bentuk lain, tetapi energi tidak dapat dimusnakan atau diciptakan sebagaimana hukum kekekalan energi. Contohnya energi listrik yang dapat diubah menjadi energi gerak, ataupun energi gerak yang dapat diubah menjadi energi cahaya.
Jumlah total energi kalor yang terkandung dalam suatu materi disebut juga dengan entalpi yang dinyatakan dengan notasi H (heat contents), yang didefinisikan sebagai kandungan kalor suatu zat. Besarnya entalpi yang terkandung dalam setiap zat tidak dapat diukur, tetapi perubahan entalpi yang menyertai suatu reaksilah yang dapat diukur. Perubahan entalpi standar yang menyertai suatu reaksi ditanyakan dengan notasi ∆H (delta H). Dengan kata lain ∆H merupakan penambahan atau pengurangan energi suatu zat dalam proses perubahan energi yang berlangsung pada tekanan tetap.
Untuk hal ini berlaku rumus:
Contoh:
1. H2O(s) → H2O (l)
∆H reaksi = H hasil – H reaktan
∆H reaksi = H H2O(l) – H H2O(s)
2. CH4 (g) + 2 O2(g) → CO2(g) + 2 H2O(g)
∆H reaksi = H hasil – H reaktan
∆H reaksi = (H CO2(g) + 2. H H2O (g) ) – (H CH4 (g) + 2. H O2(g) ) 2. Reaksi Eksoterm dan Reaksi Endoterm
a. Sistem dan Lingkungan
Energi dapat dapat mengalami perpindahan dari sistem ke lingkungan atau sebaliknya. Sistem merupakan segala sesuatu yang menjadi pusat perhatian yang diteliti perubahan energinya. Sementara lingkungan merupakan segala sesuatu diluar
Lampiran 03 221 sistem Kalor Kalor Kalor Kalor sistem. Contohnya ialah air panas yang berada dalam gelas. Air panas merupakan sistem, sementara gelas sebagai wadahnya termasuk lingkungan.
Berdasarkan interaksinya dengan lingkungan sistem digolongkan menjadi jenis berikut ini
1) Sistem Terbuka
Merupakan suatu sistem yang memungkinkan terjadinya pertukaran kalor dan materi antara sistem dan lingkungan. Contohnya air panas dalam gelas atau wadah yang tidak tertutup.
2) Sistem Tertutup
Merupakan suatu sistem yang memungkinkan terjadinya pertukaran kalor antara sistem dan lingkungannya, tetapi tidak terjadi pertukaran materi. Contohnya air panas dalam gelas atau wadah yang tertutup.
3) Sistem Terisolasi atau Tersekat
Merupakan sistem yang tidak memungkinkan
terjadinya pertukaran kalor dan materi antara sistem dan lingkungan. Contohnya air panas dalam termos.
b. Reaksi Eksoterm
Dalam reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan. Dalam hal ini dapat diartikan bahwa kalor dilepas atau dibebaskan ke lingkungan sehingga lingkungan menjadi lebih panas. Dengan demikian, reaksi eksoterm adalah reaksi yang membebaskan atau menghasilkan kalor. Reaksi eksoterm akan membebaskan energi atau mengalami penurunan energi kimia sistem sehingga entalpi sistem berkurang. Oleh karena itu, ∆H
reaksi eksoterm bertanda negatif (_).
Contoh reaksi eksoterm ialah reaksi antara kalsium (CaO) dan air yang menghasilkan kalsium hidroksida (Ca(OH)2) melalui persamaan berikut:
Lampiran 03
222
Jika reaksi dilakukan pada tabung reaksi, tangan Anda dapat merasakan panas yang dilepaskan oleh reaksi ini.
Dimana tangan Anda yang merupakan lingkungan akan menerima panas dari sistem yang bereaksi tersebut.
c. Reaksi Endoterm
Dalam reaksi endoterm terjadi perpindahan kalor dari lingkungan ke sistem. Dalam hal ini dapat diartikan bahwa kalor diserap atau diterima oleh sistem sehingga suhu lingkungan turun dan menjadi lebih dingin. Dengan demikian, reaksi endoterm adalah reaksi yang menyerap atau menerima kalor. Reaksi endoterm akan menyerap sejumlah energi sehingga entalpi sistem bertambah. Oleh karena itu, ∆H reaksi endoterm bertanda positif (+).
Contoh reaksi endoterm ialah reaksi antara barium hidroksida (Ba(OH)2) dan
kristal amonium klorida (NH4Cl) dengan beberapa tetes air yang menghasilkan
barium klorida (BaCl2) dan amonium hidroksida (NH4OH) melalui persamaan
berikut:
Ba(OH)2 + 2NH4Cl → BaCl2 + NH4OH
Jika reaksi dilakukan pada tabung reaksi, tangan Anda dapat merasakan dinginnya tabung karena
sistem menyerap kalor dari tangan Anda yang merupakan lingkungan.
d. Diagram Reaksi
Perubahan entalpi dapat digambarkan melalui diagram reaksi. Diagram reaksi untuk reaksi eksoterm dapat dilihat pada gambar berikut:
Kalor Kalor Kalor sistem Kalor H Reaktan ∆H= -a
Panas dilepas oleh sistem ke lingkungan
Produk
Lampiran 03
223
Pada diagram reaksi eksoterm di atas dapat dijelaskan bahwa, entalpi hasil reaksi (produk) lebih kecil daripada entalpi pereaksi (reaktan).
Diagram untuk reaksi endoterm dapat dilihat pada gambar dibawah ini:
Pada diagram reaksi endoterm di atas dapat dijelaskan bahwa, entalpi hasil reaksi (produk) lebih besar daripada entalpi pereaksi (reaktan).
Contoh
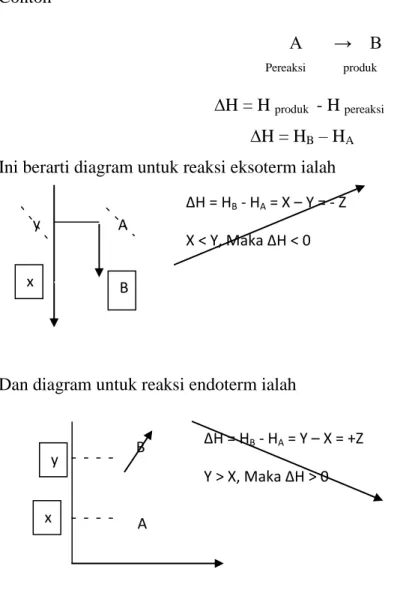
A → B
Pereaksi produk
∆H = H produk - H pereaksi
∆H = HB – HA
Ini berarti diagram untuk reaksi eksoterm ialah
Dan diagram untuk reaksi endoterm ialah Produk
Reaktan H
∆H= +a
Panas diserap oleh sistem dari lingkungan
∆H produk > ∆H reaktan ∆H = HB - HA = X – Y = - Z X < Y, Maka ∆H < 0 y A x B B ∆H = HB - HA = Y – X = +Z Y > X, Maka ∆H > 0 x y A
Lampiran 03
224 3. Reaksi Eksoterm dan Reaksi Endoterm
a. Sistem dan Lingkungan
Energi dapat dapat mengalami perpindahan dari sistem ke lingkungan atau sebaliknya. Sistem merupakan segala sesuatu yang menjadi pusat perhatian yang diteliti perubahan energinya. Sementara lingkungan merupakan segala sesuatu diluar sistem. Contohnya ialah air panas yang berada dalam gelas. Air panas merupakan sistem, sementara gelas sebagai wadahnya termasuk lingkungan.
Berdasarkan interaksinya dengan lingkungan sistem digolongkan menjadi jenis berikut ini
1. System terbuka
Merupakan suatu system yang memungkinkan terjadinya pertukaran kalor dan materi antar system ke lingkungan. Contohnya air panas dalam gelas atau wadah yang tidak tertutup.
2. System tertutup
3. System terisolasi atau tersekat
b. Persamaan Termokimia
Persamaan termokimia berbeda dengan persamaan kimia stoikiometri. Persamaan termokimia merupakan persamaan reaksi kimia yang melibatkan kalor. Pada persamaan termokimia, koefisien reaksi menunjukkan perbandingan jumlah molekul dan juga menyatakan jumlah mol yang bereaksi. Dan pada persamaan ini, juga disertai nilai perubahan entalpinya. Sedangkan pada persamaan kimia stoikiometri, koefisien reaksinya hanya menunjukkan perbandingan jumlah molekul.
Perhatikan persamaan reaksi berikut: a. 2H2 (g) + O2 (g) → 2H2O (g)
b. 2H2 (g) + O2 (g) → 2H2O (g) ∆H = - 484 kJ
Persamaan reaksi a, merupakan persamaan reaksi stoikiometri. Hal ini disebabkan karena perbandingan jumlah mol H2 : jumlah mol O2 : jumlah mol H2O = 2 : 1 : 2. Yang
dapat dinyatakan sebagai berikut:
2 mol H2 : 1 mol O2 : 2 mol H2O
Lampiran 03
225
Ketika reaksinya diubah menjadi H2 (g) + O2 (g) → H2O (g) , perbandingan jumlah mol H2 : jumlah mol O2 : jumlah mol H2O tetaplah 2 : 1 : 2. Yang dapat dinyatakan sebagai
berikut:
1 mol mol H2 : mol O2 : 1 mol H2O
Persamaan reaksi b, merupakan persamaan reaksi termokimia. Hal ini disebabkan karena pada persamaan reaksi b memiliki makna bahwa 2 mol gas H2 bereaksi dengan 1
mol gas O2 menghasilkan 2 mol H2O dalam bentuk gas dan melepaskan kalor sebesar 484
kJ. Dan ketika koefisien reaksi b diubah menjadi setengah dari koefisien awal (koefisien dibagi 2) sebagaimana reaksi berikut:
H2 (g) + O2 (g) → H2O (g) maka ∆H =
= - 242 kJ
Hal ini berarti, 1 mol gas H2 bereaksi dengan mol gas O2 menghasilkan 1 mol H2O
dalam bentuk gas dan melepaskan kalor sebesar 242 kJ
Penulisan dan interpretasi persamaan termokimia diatur dalam pedoman sebagai berikut:
Koefisien stoikiometri menunjukkan jumlah mol suatu materi
2 CaCO3 → 2 CaO + 2 CO2 ∆H = +357 kJ
(huruf tebal dan tercetak miring merupakan koefisien stoikiometri)
Jika letak reaktan dan produk pada persamaan dibalik, tanda ∆H-nya berubah menjadi kebalikannya
Jika koefisien persamaan digandakan atau dibagikan, nilai ∆H juga harus digandakan atau dibagikan sesuai dengan perubahan koefisien persamaan
Demikian halnya jika koefisien persamaan yang menunjukkan jumlah mol dibagikan maka nilai ∆H juga harus dibagikan
4. Jenis – Jenis Entalpi Reaksi (∆H)
Perubahan entalpi selalu dipengaruhi oleh suhu dan tekanan. Semakin tinggi suhu suatu zat, semakin besar perubahan entalpinya. Data termokimia pada umumnya ditetapkan pada tekanan 1 atm dan suhu 250C. Kondisi ini dikenal dengan kondisi standar.
Lampiran 03
226
Merupakan perubahan entalpi yang diperlukan atau dilepaskan pada pembentukan 1 mol senyawa dari unsur-unsurnya pada suhu dan tekanan standar. Yang dinotasikan dengan ∆Hof. f berasal dari kata formation yang berarti pembentukan.
b. Entalpi Penguraian Standar ( Hod)
Merupakan perubahan entalpi yang diperlukan atau dilepaskan pada penguraian 1 mol senyawa menjadi unsur-unsurnya pada suhu dan tekanan standar. Yang dinotasikan dengan ∆Hod. d berasal dari kata decomposition yang berarti peguraian. c. Entalpi pembakaran standar ( Ho c)
Merupakan perubahan entalpi yang diperlukan atau dilepaskan pada pembakaran 1 mol senyawa dengan oksigen diudara pada suhu dan tekanan standar. Yang dinotasikan dengan ∆Hoc. c berasal dari kata combustion yang berarti pembakaran. d. Entalpi pelarutan standar ( Hos)
Merupakan perubahan entalpi yang diperlukan atau dilepaskan pada pelarutan 1 mol zat pada suhu dan tekanan standar. Yang dinotasikan dengan ∆Hos. s berasal dari
kata sovation yang berarti pelarutan.
5. Penentuan Nilai Perubahan Entalpi a. Kalor Jenis dan Kapasitas Kalor
Kalor jenis merupakan kalor yang dibutuhkan oleh 1 gram zat untuk menaikkan suhunya sebesar 10C
Kapasitas kalor merupakan kalor yang dibutukan untuk menaikkan suhu suatu zat sebesar 10C
Hubungan kapasitas kalor dan kalor jenis antara lain:
C = m x c
Dimana, C merupakan kapasitas kalor (J.0C-1); m merupakan massa zat (gram); dan c merupakan kalor jenis (J. g-1.0C-1 )
Jika suatu reaksi terjadi perubahan suhu (∆t), perubahan kalor atau entalpi yang terjadi dapat dirumuskan sebagai berikut:
Dimana, q merupakan kalor yang dibebaskan atau diserap (Joule), dan ∆t merupakan perubahan suhu (t akhir – t awal ) 0C.
b. Penentuan ∆H Reaksi Menggunakan Kalorimeter Tekanan Tetap q= m x c x ∆t
Lampiran 03
227
Kalorimeter marupakan suatu sistem terisolasi sehingga tidak terjadi pertukaran energi dan meteri antara sistem dan lingkungan.
Pada tekanan tetap terjadi perpindahan kalor antara sistem dan lingkungan
Kalor yang diserap atau dilepas oleh kalorimeter disebut dengan kapasitas kalor kalorimeter (Ckalorimeter).
Yang secara keseluruhan dirumuskan:
Dengan: Ckalorimeter = kapasitas kalor kalorimeter ( J 0C-1 atau J K-1)
∆t = perubahan suhu (0C atau K)
Jumlah perubahan entalpi (∆H) dapat dihitung menggunakan kalorimeter dengan persamaan:
c. Penentuan ∆H Reaksi Menggunakan Hukum Hess
Selain melalui percobaan, entalpi reaksi dapat ditentukan berdasarkan data entalpi suatu reaksi. Perhitungan perubahan entalpi pada suatu reaksi dari data entalpi reaksi yang berhubungan dilakukan menggunakan hukum Hess.Hukum Hess berkaitan dengan reaksi-reaksi yang dapat dilakukan dua/ lebih cara. Hukum Hess dikemukakan oleh Germain Hendry Hess (1802-1805), seorang ahli kimia berkebangsaan Swiss, Germain Henry Hess (1802-1850).
Bunyi Hukum Hess: Kalor reaksi yang dibebaskan atau diperlukan pada suatu reaksi tidak bergantung pada jalannya reaksi, tetapi hanya bergantung pada keadaan awal dan akhir reaksi atau dengan kata lainPerubahan entalpi suatu reaksi tetap sama, baik langsung dalam satu tahap maupun beberapa tahap.
d. Penentuan ∆H Reaksi Menggunakan Data Pembentukan Standar q reaksi + q kalorimeter + q air = q sistem
q reaksi + q kalorimeter + q air = 0
atau
q reaksi = - (q kalorimeter + q air)
q kalorimeter = Ckalorimeter x ∆t
∆H=
Lampiran 03
228
+
Cara lain untuk menghitung nilai perubahan entalpi reaksi adalah berdasarkan perubahan entalpi pembentukan dasar. Pada cara ini data entalpi yang diketahui harus berupa data entalpi pembentukan.
Zat-zat pereaksi dianggap mengalami reaksi penguraian dan zat-zat hasil reaksi dianggap mengalami reaksi pembentukan. Entalpi penguraian suatu zat sama dengan entalpi pembentukannya tetapi memiliki tanda berlawanan.
Perhatikan penjelasan berikut :
C3H0 (g)→ 3C3 + 4H2(g) ΔH1 = ΔHdo C3H8(g) 3C(3) + 3O2(g) → 3CO2 ΔH2 = 3 x ΔHof CO2(g) 4H2(g) + 2O2(g) → 4H2O(l) ΔH3 = 4 x ΔHof H2O(s) C3H8(s) + SO2(g) → 3CO2(g) + 4H2O(l) ΔHr = ΔH1 + ΔH2 + ΔH3 ΔHreaksi = ΔH1 + ΔH2 + ΔH3 = ΔHdo C3H8(g) + 3 x ΔHof CO2(g) + 4 x ΔHof H2O(s) = (3 x ΔHo f CO2 + 4 ΔHof H2O) – (4Hof C3H8)
CO2(g) dan H2O merupakan hasil reaksi sedangkan C3H8(g) merupakan pereaksi.
Maka :
ΔHreaksi = ΔH of reaksi - ΔH of pereaksi
ΔHf o
O2 diikutsertakan dalam perhitungan entalpi sebab entalpi unsur dalam bentuk
yang paling stabil sama dengan nol.
Secara umum perhitungan dapat dilakukan sebagai berikut : pA + qB → rC + sD ; ΔH = …. ?
ΔHreaksi = ΔHof hasilreaksi - ΔHof pereaksi
= (rΔHof C + 2 s ΔHfo D) – (rΔHof A + 2 s ΔHof B)
e. Penentuan ∆H Reaksi Menggunakan Data Energi Ikatan
Suatu unsur atau senyawa kimia terbentuk melalui ikatan antar atom penyusunnya. Ikatan-ikatan antara atom ini memiliki harga energi ikatan tertentu. Biasanya energi ini berbanding lurus dengan kekuatan ikatan. Makin kuat ikatan, makin makin besar energi untuk memisahkan atom-atom dalam molekul.
Lampiran 03
229
Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan suatu molekul dalam bentuk gas sebanyak 1 mol. Energi ikatan dinyatakan dengan satuan kJ mol-1 dan dilambangkan dengan huruf “D”.
Misalkan Reaksi : CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔHr = …. ?
Reaksi pemutusan ikatan pada CH4(g) dan 2O2(g) adalah :
Reaksi (2) : 2 O = O ΔH2 = 2 x DO = O
Reaksi pembentukan ikatan pada senyawa CO2(g) dan 2 H2O(l) adalah
Reaksi(3) : C = 2 O O = C = O ΔH3 = 2 x DC = O Reaksi(4) : 4 H + 2 O 2 H – O – H ΔH4 = 4 x DO – H
Jadi :
Secara umum, perhitungan ΔH reaksi menggunakan data energi ikatan dapat dirumuskan sebagai berikut :
Energi Ikatan Rata-Rata
Jika molekul terdiri atas tiga atau lebih atom, maka digunakan energi ikatan rata-rata. Energi ikatan rata-rata adalah energi rata-rata yang diperoleh dari hasil pemutusan ikaan 1 mol senyawa dalam wujud gas.
Energi ikatan rata-rata dihitung dari energi ikatan molekul senyawa yang memiliki beberapa struktur ikatan yang sama. Misalnya : energi ikatan rata-rata C – H merupakan harga nilai-nilai rata-rata dari empat ikatan C – H pada senyawa CH4. Demikian pula
halnya energi ikatan rata-rata C – Cl (pada senyawa CCl4) dan C – Br (pada senyawa
Lampiran 03
230
Energi ikatan rata-rata dihitung dengan membagi ΔH reaksi dengan jumlah ikatannya. Misalkan reaksi penguraian gas NH3 menjadi atom-atom bebasnya adalah :
Pada reaksi tersebut terjadi pemutusan ikatan dan tidak terjadi pembentukan ikatan. Dalam molekul NH3 terdapat tiga ikatan N – H sehingga :
1 392 3 1176 3 kJmol mol kJ mol reaksi H EN H
Lampiran 4
Kuis 01
Azas Kekekalan energi dan Entalpi Molar
1. Jelaskan pengertian dari sistem dan lingkungan!
2. Jelaskan apa yang dimaksudkan dengan entalpi!
3. Jelaskan apa yang dimaksudkan dengan reaksi eksoterm dan reaksi endoterm!
Jawaban kuis 01
No. Jawaban Skor
1. Pengertian dari:
a. Sistem merupakan sesuatu yang menjadi pusat perhatian atau
pusat pengamatan.
b. Lingkungan merupakan daerah diluar system atau segala sesuatu
yang berada disekitar system yaitu dengan apa system tersebut berinteraksi.
10
2. Yang dimaksudkan dengan entalpi adalah jumlah total energy kalor
yang terkandung dalam suatu materi.
5
3. Yang dimaksudkan dengan:
a. Reaksi eksoterm merupakan reaksi kimia yang menghasilkan
kalor.
b. Reaksi endoterm merupakan reaksi kimia yang menyerap
atau menerima kalor.
10
Lampiran 4
Kuis 2
Penentuan Entalpi Reaksi dan Energi Bahan Bakar
1. Jelaskan apa yang dimaksudkan dengan energi ikatan!
2. Tuliskan bunyi Hukum Hess!
Jawaban kuis 02
No. Jawaban Skor
1. Yang dimaksud dengan energy ikatan adalah energi yang diperlukan untuk memutuskan satu mol ikatan dari suatu molekul dalam wujud gas.
5 2. Bunyi Hukum Hess :
“Kalor reaksi yang dibebaskan atau diperlukan pada suatu reaksi
tidak bergantung pada jalannya reaksi, tetapi hanya bergantung
pada keadaan awal dan keadaan akhir reaksi”.
15
Lampiran 4
Tugas 01
Azas Kekekalan energi dan Entalpi Molar
1. Jelaskan pengertian dari energi?
2. Jelaskan pengertian dari entalpi?
3. Dari reaksi berikut, tentukan persamaan perubahan entalpinya!
a. S (s) + O2 (g) → SO2 (g)
b. CH4 (g) + 2 O2 (g) → CO2(g) + 2 H2O(g)
4. Jelaskan pengertian dari sistem dan lingkungan dalam suatu reaksi
termokimia!
5. Dari gambar berikut ini manakah yang merupakan sistem terbuka, sistem
tertutup dan sistem terisolasi? Jelaskan!
Gambar A: Gambar B: Gambar C:
6. Jelaskan perbedaan dari reaksi eksoterm dan reaksi endoterm.
7. Tentukan nilai ∆H dan jenis reaksi berdasarkan grafik tingkat energi:
P → R
Q → P
8. Termasuk reaksi apakah reaksi berikut, Jelaskan!
I2 (s)→ I2 (g) ∆H = +62,66 kJ H2 (g) + Cl2 (g) → HCl2 (g) ∆H = - 92,31 kJ Q P 40 80 H
Lampiran 4
Jawaban
No. Jawaban Skor
1. Energi merupakan suatu kemampuan untuk melakukan usaha atau kerja
5 2. Entalpi merupakan jumlah total energi kalor yang terkandung dalam
suatu materi yang dinyatakan dengan notasi H (heat contents)
5 3. Persamaan perubahan entalpinya
a. S (s) + O2 (g) → SO2 (g) ∆H = H produk - H pereaksi ∆H = H SO2 (g)– ( HS(s) + H O2(g) ) b. CH4 (g) + 2 O2 (g) → CO2(g) + 2 H2O(g) ∆H = H produk - H pereaksi ∆H = ( H CO2 (g) + 2 H H2O(g) ) – ( HCH4(s) + 2 H O2(g) ) 10
4. a. Sistem merupakan segala sesuatu yang menjadi pusat perhatian
yang diteliti perubahan energinya.
b. Lingkungan merupakan segala sesuatu diluar system
10 5. Gambar A, merupakan sistem terisolasi.
Karena tidak memungkinkan terjadinya pertukaran kalor dan materi antara sistem dan lingkungan.
Gambar B, merupakan sistem terbuka.
Karena memungkinkan terjadinya pertukaran kalor dan materi antara sistem dan lingkungan
Gambar C, merupakan sistem tertutup.
Karena memungkinkan terjadinya pertukaran kalor antara sistem dan lingkungannya, tetapi tidak terjadi pertukaran materi.
15
6. Perbedaannya ialah Reaksi eksoterm merupakan reaksi yang membebaskan atau menghasilkan kalor, dalam reaksi ini terjadi
perpindahan kalor dari sistem ke lingkungan oleh karena itu, ∆H
reaksi eksoterm bertanda negatif (_). Sedangkan Reaksi endoterm
merupakan reaksi yang menyerap atau menerima kalor, dalam reaksi endoterm terjadi perpindahan kalor dari lingkungan ke sistem Oleh
karena itu, ∆H reaksi endoterm bertanda positif (+).
10
7. a. P → R
∆H = H produk - H pereaksi
Lampiran 4
∆H = H R - H P
= 120 – 40 = +80
Karena ∆H > 0, Maka merupakan reaksi endoterm
b. Q → P
∆H = H produk - H pereaksi
∆H = H P - H Q
= 40 – 80 = -40
Karena ∆H < 0, Maka merupakan reaksi eksoterm
8 a. Reaksi tersebut merupakan reaksi endoterm, Karena menyerap
sejumlah energi sehingga entalpi sistem bertambah yang ditandai dengan tanda positif (+)
b. Reaksi tersebut merupakan reaksi eksoterm, Karena
membebaskan sejumlah energi sehingga entalpi sistem berkurang yang ditandai dengan tanda negatif (-)
10