i
LAPORAN PENELITIAN
KOMPARASI RECIST 1.0 DAN RECIST 1.1 PADA NON SMALL CELL LUNG CANCER STADIUM LANJUT YANG MENDAPAT KEMOTERAPI
BERBASIS PLATIN DAN IMMUNOTERAPI RACOTUMUMAB PENGAMATAN DI INSTALASI RADIODIAGNOSTIK RSUD DR SOETOMO SURABAYA PERIODE JANUARI – DESEMBER 2015
Oleh : dr. Mayla Yahya
Pembimbing :
dr. Rosy Setiawati, Sp. Rad (K) dr. Paulus Rahardjo Sp.Rad (K)
PROGRAM PENDIDIKAN DOKTER SPESIALIS I RADIOLOGI DEPARTEMEN/SMF RADIOLOGI FK UNAIR- RSUD DR SOETOMO
SURABAYA 2016
ii KARYA AKHIR PENELITIAN
KOMPARASI RECIST 1.0 DAN RECIST 1.1 PADA NON SMALL CELL LUNG CANCER STADIUM LANJUT YANG MENDAPAT KEMOTERAPI
BERBASIS PLATIN DAN IMMUNOTERAPI RACOTUMUMAB PENGAMATAN DI INSTALASI RADIODIAGNOSTIK RSUD DR SOETOMO SURABAYA PERIODE JANUARI – DESEMBER 2015
Sebagai sebagian syarat untuk memperoleh gelar spesialis radiologi
dr. Mayla Yahya
NIM: 011181717
PROGRAM PENDIDIKAN DOKTER SPESIALIS I RADIOLOGI FAKULTAS KEDOKTERAN UNIVERSITAS AIRLANGGA
2016
LAPORAN PENELITIAN KOMPARASI RECIST 1.0 ... MAYLA YAHYA
v
KATA PENGANTAR
Puji syukur kami panjatkan ke hadirat Allah SWT atas rahmat dan
karunia-Nya sehingga saya dapat menyelesaikan laporan penelitian ini
sebagai karya akhir PPDS I Radiologi tepat waktu tanpa ada hambatan
yang berarti.
Adapun laporan tugas akhir yang berjudul “KOMPARASI
RECIST 1.0 DAN RECIST 1.1 PADA NON SMALL CELL LUNG
CANCER STADIUM LANJUT YANG MENDAPAT KEMOTERAPI
BERBASIS PLATIN DAN IMMUNOTERAPI RACOTUMUMAB” ini
merupakan salah satu persyaratan untuk menyelesaikan Program
Pendidikan Dokter Spesialis I Radiologi di Departemen/SMF Radiologi
Fakultas Kedokteran Universitas Airlangga RSUD dr. Soetomo Surabaya.
Laporan penelitian ini secara umum terdiri dari : latar belakang
masalah, rumusan masalah, tujuan penelitian, manfaat penelitian serta
tinjauan kepustakaan yang berkaitan dengan topik masalah tersebut. Di
dalam laporan penelitian ini disertakan kerangka konseptual yang
merupakan ringkasan dari konsep metodologi penelitian. Hasil pengolahan
data disajikan dalam bentuk tabel dan grafik yang untuk selanjutnya
vi
Peneliti sangat menyadari bahwa laporan penelitian ini masih jauh
dari kata sempurna, untuk itu dengan segala kerendahan hati, kami
mengaharapkan saran dan kritik dalam upaya perbaikan dan
penyempurnaan laporan ini.
Surabaya, April 2016
vii
UCAPAN TERIMA KASIH
Dengan mengucapkan puji syukur kehadirat Allah SWT atas
rahmat dan karunia-Nya sehingga kami dapat menyelesaikan karya akhir
ini sebagai syarat untuk menyelesaikan Program Pendidikan Dokter
Spesialis I Radiologi di Departemen/SMF Radiologi Fakultas Kedokteran
Universitas Airlangga - RSUD dr. Soetomo Surabaya.
Dengan hati yang tulus dan ikhlas kami menghaturkan terima kasih
dan penghargaan yang setingi-tingginya kepada semua pihak yang telah
membantu baik secara moral maupun material selama mengikuti Program
Pendidikan Dokter Spesialis I Radiologi.
Pada kesempatan ini dengan kerendahan hati kami menyampaikan
terima kasih yang sebesar-besarnya kepada yang terhormat :
1. Dekan Fakultas Kedokteran Universitas Airlangga Surabaya atas
kesempatan yang telah diberikan kepada saya untuk mengikuti dan
menyelesaikan Pendidikan di bidang Radiologi.
2. Direktur Rumah Sakit Umum Daerah dr. Soetomo Surabaya atas
kesempatan yang telah diberikan kepada saya sehingga dapat bekerja
dan menimba ilmu di Rumah Sakit ini.
3. dr. Budi Laraswati, Sp. Rad (K) selaku Kepala Departemen/SMF
Radiologi Fakultas Kedokteran Universitas Airlangga Surabaya -
RSUD Dr. Soetomo Surabaya yang telah membimbing dan mendidik
viii
4. dr. Lies Mardiyana, Sp. Rad (K) selaku Ketua Program Studi
Radiologi Fakultas Kedokteran Universitas Airlangga Surabaya yang
telah membimbing dan mendidik kami selama masa Pendidikan
Dokter Spesialis I Radiologi.
5. dr. G.A. Indirawati, Sp.Rad (K) selaku Ketua Program Studi
Radiologi Fakultas Kedokteran Universitas Airlangga Surabaya
periode sebelumnya yang telah membimbing dan mendidik kami
selama masa Pendidikan Dokter Spesialis I Radiologi.
6. dr. Rosy Setiawati, Sp.Rad (K) selaku Sekretaris Program Studi
Radiologi Fakultas Kedokteran Universitas Airlangga Surabaya yang
telah membimbing dan mendidik kami selama masa Pendidikan
Dokter Spesialis I Radiologi.
7. dr. M. Yamin, Sp. Rad (K) selaku Kepala Instalasi Radiodiagnostik
RSUD Dr. Soetomo Surabaya yang telah menyediakan fasilitas,
membimbing serta mendidik selama masa Pendidikan Dokter
Spesialis I Radiologi.
8. dr. Rosy Setiawati, Sp.Rad (K) dan dr. Paulus Rahardjo, Sp. Rad (K)
selaku pembimbing dan tim penguji yang telah meluangkan waktu di
sela kesibukannya untuk membimbing dan membantu dalam
menyusun karya akhir ini.
9. Seluruh staf pengajar SMF Radiologi Fakultas Kedokteran
Universitas Airlangga - RSUD dr. Soetomo Surabaya yang telah
sabar dan tekun mendidik dan membimbing selama masa
ix
10. Seluruh staf dan karyawan Radiologi Fakultas Kedokteran
Universitas Airlangga - RSUD dr. Soetomo Surabaya atas bantuan
dan dukungannya selama masa pendidikan.
11. Abah dan Mama tercinta serta Suami dan Anak ku tersayang yang
selalu memberikan doa, dukungan dan pengertiannya selama masa
pendidikan.
12. Semua teman dan sahabat serta pihak yang telah membantu baik
secara moral maupun material selama menyelesaikan pendidikan dan
karya akhir ini yang tidak bisa saya sebutkan satu persatu.
Saya menyadari sepenuhnya bahwa penelitian ini masih jauh dari kata
sempurna, oleh karena itu saya sangat mengharapkan kritik dan saran yang
membangun untuk menyempurnakan karya akhir ini.
Surabaya, April 2016
Penyusun
x
COMPARISON OF THE RECIST 1.0 AND RECIST 1.1 IN ADVANCED NON SMALL CELL LUNG CANCER TREATED WITH PLATINUM
BASED CHEMOTHERAPHY AND RACOTUMUMAB IMMUNOTHERAPHY
Mayla Yahya1, Rosy Setiawati2, Paulus Rahardjo3
1Radiology Resident, Airlangga University – Soetomo Hospital
2Radiology Residency Program Staff, Airlangga University – Soetomo Hospital 3Radiology Residency Program Staff, Airlangga University – Soetomo Hospital Abstract
Objective : to compare the impact of RECIST 1.1 with RECIST 1.0 on the
selection of target lesions and assesment of tumor response in patients with
advanced NSCLC who received platinum based chemotherapy and
immunotheraphy.
Methods: We retrospectively reviewed medical records MDCT scan thorax of patients with advanced NSCLC who received platinum based chemotherapy and immunotheraphy between January and December 2015. Tumor measurements and response assessment were performed using RECIST 1.0 and RECIST 1.1. The number of target lesions and tumor response were compared between RECIST 1.1and RECIST 1.0
.Results: A total of 32 samples who had at least one target lesion according to the
RECIST 1.0 were included in the study. The number of target lesions by the RECIST 1.1 was significantly lower than that by the RECIST 1.0. When adopting the RECIST 1.1 instead of the RECIST 1.0. 26 samples (81,25 %) showed a the two criteria, which were all due to the change of the lymph node criteria.
Conclusion: RECIST 1.1 provided concordant response assessment with a decreased
number of target lesions compared with RECIST 1.0 in advanced NSCLC patients who received platinum based chemotherapy and immunotheraphy. The new lymph node criteria were the major cause of the reduction of target lesions and reclassification of the tumor response.
xi
KOMPARASI RECIST 1.0 DAN RECIST 1.1 PADA NON SMALL CELL LUNG CANCER STADIUM LANJUT YANG MENDAPAT KEMOTERAPI
BERBASIS PLATIN DAN IMMUNOTERAPI RACOTUMUMAB
Mayla Yahya1, Rosy Setiawati2, Paulus Rahardjo3
1PPDS I Program Studi Ilmu Radiologi FK UNAIR-RSUD Soetomo 2Staf Pengajar Departemen Radiologi FK UNAIR-RSUD Soetomo 3Staf Pengajar Departemen Radiologi FK UNAIR-RSUD Soetomo
Tujuan: untuk membandingkan RECIST 1.1 dengan RECIST 1.0 pada pemilihan
lesi target dan penilaian respon tumor pada pasien NSCLC stadium lanjut yang menerima kemoterapi berbasis platin dan immunoterapi.
Metode: Kami meninjau data rekam medis MDCT scan thorax pasien NSCLC stadium lanjut yang mendapat kemoterapi berbasis platin dan immunoterapi antara Januari dan Desember 2015. Pengukuran tumor dan penilaian respon dilakukan menggunakan RECIST 1.0 dan RECIST 1.1. Jumlah lesi target dan respon tumor dibandingkan antara RECIST 1.1 dan RECIST 1.0.
Hasil: Sebanyak 32 sampel yang memiliki setidaknya satu sasaran lesi menurut
RECIST 1.0 dilibatkan dalam penelitian ini. Jumlah lesi target oleh RECIST 1.1 secara signifikan lebih rendah dibandingkan dengan RECIST 1.0. Ketika mengadopsi RECIST 1.1, sebanyak 26 sampel (81,25%) menunjukkan penurunan jumlah lesi target. Penurunan lesi target dengan mengadopsi RECIST 1.1 terutama disebabkan oleh perubahan kriteria respon. Sebanyak 28 sampel (81,25 %) memiliki respon tumor yang sama antara RECIST 1.0 dan RECIST 1.1. Respon tumor menunjukkan tingkat kesesuaian antara RECIST 1.0 dan RECIST 1.1, dengan nilai kappa 0.614. Enam pasien (18,75%) menunjukkan ketidaksesuaian respon tumor antara dua kriteria, yang semuanya karena perubahan kriteria lymph
node pada RECIST 1.1.
Kesimpulan: RECIST 1.1 menunjukkan penurunan jumlah lesi sasaran secara
signifikan dibandingkan dengan RECIST 1.0 dan memiliki tingkat kesesuaian dengan RECIST 1.0 dalam penilaian respon tumor pada pasien NSCLC stadium lanjut yang mendapat kemoterapi berbasis platin dan immunoterapi. Kriteria lymph node baru pada RECIST 1.1 merupakan penyebab utama dari pengurangan lesi target dan reklasifikasi respon tumor.
xii
DAFTAR ISI
COVER ...i
PRASYARAT GELAR ... ii
LEMBAR PENGESAHAN ... iii
SURAT PERNYATAAN ...iv
1.4 ManfaatPenelitian ... 3
1.4.1 Manfaat Klinis ... 3
xiii
2.3 Metode RECIST ... 10
2.3.1 Panduan RECIST versi 1.0 ... 10
2.3.2 Panduan RECIST versi 1.1 ... 14
2.3.2.1 Pengukuran Tumor di Waktu Awal ... 18
2.3.2.2 Spesifikasi Metode Pengukuran ... 20
2.3.2.3 Metode Pengukuran ... 20
2.3.2.4 Kriteria Respon Tumor Lesi Target ... 20
2.3.2.5 Kriteria Respon Tumor Lesi Non Target ... 21
2.3.2.5 Respon Evaluasi Secara Keseluruhan ... 21
BAB III KERANGKA KONSEP DAN HIPOTESIS ... 24
3.1 KerangkaKonsep ... 24
3.2 PenjelasanKerangkaKonsep ... 25
3.3 Hipotesis ... 25
BAB IV METODE PENELITIAN ... 26
4.1 Jenis dan Rancangan penelitian ... 26
4.2 Populasi dan Sampel Penelitian ... 26
4.2.1 Populasi Penelitian ... 26
4.2.2 Sampel Penelitian ... 26
4.3 Kriteria Inklusi dan Ekslusi ... 26
4.3.1 Kriteria Inklusi ... 26
4.3.2 Kriteria Eksklusi ... 27
4.4 Variabel Penelitian dan Definisi Operasional ... 27
4.4.1 Variabel Penelitian ... 27
4.4.2 Definisi Operasional ... 27
4.5 Alur Penelitian ... 29
4.6 Lokasi dan Waktu Penelitian ... 30
4.7 Cara Mengolah dan Analisa Data ... 30
4.8 Etika Penelitian ... 31
BAB V HASIL PENELITIAN ... 32
5.1 Karakteristik Pasien ... 32
5.1.1 Distribusi sampel berdasarkan usia ... 33
5.1.2 Distribusi sampel berdasarkan jenis kelamin ... 33
5.1.3 Distribusi sampel berdasarkan histopatologis ... 34
xiv
5.2 Jumlah Lesi Target ... 35
5.3 Respon Tumor ... 37
BAB VI PEMBAHASAN ... 40
BAB VII KESIMPULAN DAN SARAN ... 46
xv
DAFTAR GAMBAR
Gambar 1. Diagram ilustrasi sistem staging TNM edisi ke 7 untuk kanker paru. . 9
Gambar.2 Ukuran lesi berdasarkan Response Evaluation Criteria in Solid Tumor
(RECIST) ... 11
Gambar.3 Lesi yang tidak diukur berdasarkan Response Evaluation Criteria in Solid Tumor (RECIST) ... 12
Gambar. 4 Lesi target dengan ukurannya ... 13
Gambar 5 Penilaian respon. ... 13
Gambar 6 Jumlah lesi target berdasarkan revisi RECIST versi 1.1 terdapat pengurangan jumlah lesi target per organ menjadi dua. ... 15
Gambar 7. Jumlah lesi target berdasarkan revisi RECIST versi 1.1 terdapat pengurangan jumlah lesi target per organ menjadi lima ... 16
Gambar 8. Penilaian kelenjar getah bening patologis pada RECIST versi 1.1 .... 17
Gambar 9. Penjelasan mengenai progresivitas penyakit.. ... 17
xvi
DAFTAR BAGAN
Bagan 1. Kerangka Konsep ... 23
xvii
DAFTAR TABEL
Tabel 1. Evaluasi dari lesi target dan non – target berdasarkan Response
Evaluation Criteria in Solid Tumor (RECIST) 1.0 (Nishino, 2010) ... 14
Tabel 2. Evaluasi dari lesi target dan non – target berdasarkan Response
Evaluation Criteria in Solid Tumor (RECIST)1.1 (Chalian et al, 2011) ... 22
Tabel 3. Kategori respon keseluruhan dari penyakit dengan menggunakan kriteria
xviii
DAFTAR SINGKATAN
CT : Computed Tomography
RECIST : Respon Evaluation Criteria In Solid Tumors
NSCLC : Non Small Cell Lung Cancer
SCLC : Small Cell Lung Cancer
EGFR : Epidermal Growth Factor Receptor
TNM : Tumor Node Metastasis
FDG : Fluoro-Deoxy-Glucose
MDCT : Multislice Detector Computed Tomography
PET : Possitron Emission Tomography
MRI : Magnetic Resonance Imaging
CR : Complete Response
PR : Partial Response
SD : Stable Disease
1
BAB I
PENDAHULUAN
1.1Latar Belakang
Sekitar 80% pasien dengan tumor paru NSCLC datang pada stadium lanjut
dan tidak dapat dioperasi karena adanya ekstensi tumor ke locoregional,
metastasis ke organ lain atau kondisi fisik pasien yang buruk, sehingga pilihan
terapinya bukan lagi operasi, melainkan kemoterapi atau radioterapi. Pasien
dengan tumor paru NSCLC stadium lanjut tidak memiliki pilihan pengobatan
kuratif, oleh karena itu, terapi yang diberikan harus memperpanjang
kelangsungan hidup dan meningkatkan kualitas hidup.
Radiologi mempunyai peran yang sangat penting dalam monitoring respon
tumor terhadap terapi pada pencitraan onkologi. Studi pencitraan memainkan
peranan yang vital dan objektif dalam menghitung kuantitas respon tumor
terhadap berbagai variasi terapi. Computed tomography (CT) merupakan
teknik pencitraan yang efektif
untuk menilai respon terhadap pengobatan pada pasien dengan tumor padat.
Kebanyakan penilaian bergantung pada Kriteria Respon Evaluasi pada Tumor
Padat (RECIST).
Secara teori, demarkasi batas massa pada potongan Computed tomography
(CT) sangat menentukan dalam mengukur lesi target. Pemilihan tepi antara
jaringan neoplastik dan normal, bisa menstabilkan bias dari waktu ke waktu
untuk memudahkan penilaian perubahan respon tumor. Pada pasien NSCLC
2
terkait dengan penyakit paru komorbiditas, sehingga secara radiologis hal ini
merupakan tantangan yang sangat besar untuk menentukan lesi target secara
tepat karena akan memberikan dampak yang sangat besar terhadap penilaian
respon tumor.
Pedoman Kriteria Respon Evaluasi Tumor Padat (RECIST) yang
diterbitkan pada tahun 2000 mendefinisikan ukuran minimum lesi yang dapat
diukur, jumlah lesi yang diukur, teknik pencitraan yang akan digunakan, dan
kebutuhan untuk pengukuran uni-dimensional daripada bi-dimensional untuk
evaluasi beban tumor (Therasse et al, 2000). Namun, sejumlah pertanyaan dan
masalah muncul yang telah menyebabkan pengembangan pedoman RECIST
yang direvisi (versi 1.1) (Eisenhauer et al, 2009).
Di instalasi radiologi RSUD Dr Soetomo Surabaya sampai saat ini belum
ada standar pengukuran yang objektif untuk penilaian respon tumor padat
terutama tumor paru. Padahal untuk menilai respon tumor diperlukan adanya
suatu standar pengukuran yang objektif. Data-data yang didapat pada
penelitian ini diharapkan dapat memberikan suatu dasar untuk ditetapkannya
penggunaan standar pengukuran tumor padat di instalasi radiologi RSUD Dr
Soetomo Surabaya.
Pada penelitian ini, peneliti ingin membandingkan hasil pengukuran CT
scan dan penilaian respon tumor RECIST 1.0 dan RECIST 1.1 pada tumor
paru NSCLC stadium lanjut yang mendapat kemoterapi berbasis platin dan
3
1.2Rumusan Masalah
Apakah ada perbedaan penilaian respon tumor RECIST 1.0 dan RECIST
1.1 pada tumor paru NSCLC stadium lanjut yang mendapat kemoterapi
berbasis platin dan immunoterapi racotumumab?
1.3Tujuan
1.3.1 Tujuan Umum
Tujuan penelitian ini adalah untuk membandingkan penilaian respon
tumor RECIST 1.0 dan RECIST 1.1 pada tumor paru NSCLC stadium lanjut
yang mendapat kemoterapi berbasis platin dan immunoterapi racotumumab.
1.3.2 Tujuan Khusus
1. Mengetahui gambaran respon tumor berdasarkan RECIST 1.0
2. Mengetahui gambaran respon tumor berdasarkan RECIST 1.1
3. Mengetahui gambaran perbandingan respon tumor RECIST 1.0 dan
RECIST 1.1
1.4Manfaat
1.4.1 Manfaat Klinis
4
2. Untuk membuat suatu standar pengukuran yang objektif pada tumor
padat.
3. Memberi masukan kepada klinisi tentang metode pengukuran respon
tumor paru NSCLC stadium lanjut.
4. Untuk menentukan prognosa pasien tumor paru NSCLC stadium lanjut
sehingga dapat mengurangi angka mortalitas tumor paru.
1.4.2 Manfaat Teoritis
1. Mengetahui perubahan morfologis yang terjadi pada tumor paru tipe
NSCLC stadium lanjut.
2. Sebagai dasar atau bahan rujukan untuk melakukan penelitian
5
BAB II
TINJAUAN PUSTAKA
2.1 Kanker paru
2.1.1 Prevalensi
Menurut data GLOBOCAN (IARC) tahun 2012 kanker paru merupakan
jenis kanker dengan kasus baru tertinggi yaitu sebesar 13,6% atau sekitar
1.824.701 kasus di seluruh dunia dan kematian akibat kanker paru sebesar 11,1%.
(Ferlay et al, 2013).
Kanker paru merupakan penyebab kematian yang utama dari seluruh
kematian karena kanker di dunia, pada tahun 2012 angka mortalitas akibat kanker
paru pada laki-laki sekitar 29% dan pada wanita sekitar 26%. Pasien kanker paru
tanpa metastasis mempunyai angka harapan hidup 5 tahun sebesar 52,2% dan
pasien kanker paru dengan metastasis mempunyai angka harapan hidup 5 tahun
hanya sebesar 3,7%. Angka harapan hidup ini mencakup baik small cell lung
cancer (SCLC) dan non-small cell lung cancer (Hall et al, 2013).
2.1.2 Definisi dan Patologi
Kanker paru adalah penyakit yang timbul akibat pertumbuhan sel yang
tidak terkontrol pada jaringan paru. Kebanyakan kanker paru yang terjadi
merupakan kanker primer, dimana kanker tumbuh dari sel epitelial paru (Fong et
al, 2003).
6
Penyebab utama timbulnya kanker paru adalah pajanan yang lama pada
rokok atau asap rokok. Penyebab lainnya adalah faktor genetik, gas radon,
asbestos, dan polusi udara termasuk perokok pasif (Alberg et al, 2010)
2.1.4 Gejala dan Tanda
Gejala-gejala kanker paru yang paling sering ditemui adalah batuk
(termasuk batuk darah), turunnya berat badan secara signifikan dan sesak napas.
Gejala lainnya termasuk nyeri dada, demam, kelelahan, disfagia, sindrom vena
cava superior dan nyeri pada tulang. Kanker paru paling sering metastasis ke otak,
tulang, hati dan kelenjar adrenal (Collins et al, 2007).
2.1.5 Klasifikasi
Secara histologis, kanker paru terbagi menjadi dua tipe utama, yaitu small
cell lung carcinoma (SCLC) dan non small cell lung carcinoma (NSCLC) (Maitra,
2007).
Pada SCLC, sel-sel nya mengandung granula-granula neurosecretory
(vesicula mengandung hormon neuroendokrin), yang biasanya menyebabkan
endokrin/sindrom paraneoplastic pada kanker paru tipe ini. SCLC terbanyak
ditemukan pada bronchus primer dan sekunder. Kanker jenis ini tumbuh dengan
cepat dan sering metastase pada stadium awal (Lu et al, 2008).
NSCLC terbagi menjadi 3 sub tipe, yaitu adenocarcinoma, squamous cell
7
dari seluruh kanker paru, squamous cell carcinoma sekitar 30% dari seluruh
kanker paru dan large cell carcinoma sekitar 9% dari kanker paru (Lu et al, 2008).
2.1.6 Diagnosa dan Terapi
Kanker paru dapat di diagnosa dengan modalitas foto polos thorax dan CT
scan thorax. Diagnosis dikonfirmasi dengan pemeriksaan biopsi. Biopsi dapat
dilakukan dengan bronchoscopy atau CT-guided biopsy. Terapi dan prognosa
kanker paru tergantung pada tipe histologis kanker, stadium penyakit dan keadaan
umum pasien. Terapi kanker paru pada umumnya meliputi operasi, kemoterapi
dan radioterapi (Collins et al, 2007).
Terapi pada SCLC menggunakan kemoterapi dan radioterapi. SCLC
sangat sensitive terhadap kemoterapi dan radioterapi, sehingga kombinasi
kemoterapi dan radioterapi pada stadium awal SCLC sangat direkomendasikan.
Namun, kombinasi ini ditentukan oleh staging penyakit dan performance status
penderita (Herbst, 2008).
NSCLC relatif tidak sensitif terhadap kemoterapi, jika memungkinkan
NSCLC di terapi dengan operasi (reseksi tumor) disertai terapi kuratif intensif,
walaupun demikian kemoterapi tetap digunakan baik sebelum maupun sesudah
operasi (Herbst, 2008).
Jika NSCLC terdiagnosa pada stadium awal (early stage) maka terapi
pilihannya adalah operasi, disertai kemoterapi sebelum dan sesudah operasi. Jika
NSCLC terdiagnosa pada stadium lanjut (advanced stage) maka terapi pilihannya
8
Meskipun pengobatan agresif dengan operasi, radiasi dan kemoterapi,
kelangsungan hidup jangka panjang untuk pasien kanker paru-paru masih rendah.
Bahkan mereka dengan penyakit "tahap awal" sering menyerah pada kanker
paru-paru karena perkembangan metastasis. Akibatnya, terapi sistemik telah menjadi
komponen yang diperlukan pada manajemen kanker paru-paru (Raez et al, 2005).
Dalam dekade terakhir, telah terjadi pemahaman yang lebih baik tentang
bagaimana kanker berinteraksi dengan sel-sel kekebalan tubuh dan bahwa kanker
telah menemukan cara untuk menghindari sistem kekebalan tubuh, sehingga era
baru protokol immunoterapi kanker diharapkan dapat membantu dalam mengatasi
keterbatasan strategi terapi konvensional (Hannahan et al, 2011).
Kemungkinan hubungan antara infeksi / peradangan / aktivasi kekebalan
dan hasil pasien kanker dari kedua penyebab dan titik hasil pandang telah lama
didalilkan. Kemajuan substansial dalam pemahaman tumor terkait antigen /
epitop, subpopulasi seluler kekebalan tubuh, jalur sitokin / ekspresi, lingkungan
mikro tumor, dan keseimbangan antara penekanan tumor-imun dan stimulasi telah
dilakukan pada dekade sebelumnya. Hal ini telah menyebabkan dikembangkannya
sebuah imunoterapi tumor memanfaatkan vaksin, penghambatan kekebalan tubuh,
dan virus oncolytic. Meskipun kemajuan yang signifikan di era molekuler
sekarang dengan targeted theraphy seperti inhibitor EGFR tirosin kinase dan
inhibitor ALK fusi protein yang secara signifikan telah meningkatkan
subpopulasi kanker paru-paru tertentu, secara keseluruhan kelangsungan hidup 5
tahun untuk kanker paru-paru (NSCLC) masih < 20% (Morris, 2014).
9
Sistem klasifikasi TNM (tumor-node-metastasis) untuk kanker paru
merupakan pedoman yang sangat penting dalam menentukan terapi dan prognosis
penyakit. Sistem klasifikasi TNM edisi ke-7 memberikan gambaran beberapa
revisi, antara lain kategori tumor subdivisi berdasarkan ukuran, perbedaan antara
penyakit metastasis lokal intrathoracic dan penyakit metastasis jauh,
rekategorisasi penyakit pleura maligna atau penyakit pericardial dari stadium III
sampai stadium IV, reklasifikasi dari nodul tumor yang terpisah pada paru atau
lobus yang sama dengan tumor primer dari T4 sampai T3 dan reklasifikasi dari
beberapa nodul tumor terpisah pada paru yang sama tapi pada lobus yang berbeda
dari tumor primer mulai M1 sampai T4 (Uybico et al, 2010).
10 Gambar 2. Thoracic lymph node station
2.2 Pencitraan CT scan pada Kanker Paru
Radiologi memiliki peranan yang penting baik dalam screening, diagnosis
serta evaluasi post terapi pada kanker paru (Bouchard et al, 2002).
. Berbagai modalitas pencitraan di bidang radiologi yang dapat digunakan
meliputi foto polos, CT scan, PET dan MRI (Mc Cloud & Boiselle, 2010).
Sampai saat ini, CT scan masih merupakan modalitas pencitraan pilihan
baik untuk screening, diagnosa dan evaluasi post terapi pada kanker paru (Laurent
et al, 2006).
CT scan merupakan gold standart untuk mendeteksi nodul pada paru.
11
CT scan juga digunakan sebagai modalitas untuk menentukan stadium pada
kanker paru, karena stadium pada kanker paru sangat menentukan pilihan terapi
dan prognosa (Laurent et al, 2006).
CT scan dapat mengetahui ukuran tumor, bentuk dan batas tumor,
kalsifikasi, cavitasi dan nodul dengan adanya karakteristik enhancement pada
densitas dan kontras (Bouchard 2002, Laurent 2006).
Evaluasi secara radiologis pada pasien setelah diterapi juga tidak kalah
pentingnya. Untuk banyak klinisi, CT scan setelah terapi dilakukan secara berkala
pada bulan ke 3, 6 dan 12 dan setelah itu dilakukan tiap tahun, terutama pada
kanker paru yang potensial untuk metastasis (Laurent et al, 2006).
Pada pasien kanker paru yang dilakukan kemoterapi, efektivitas terapi
sangat penting. Metode yang terpilih untuk mengukur respon terapi adalah dengan
menggunakan RECIST (Respon Evaluation Criteria in Solid Tumors) (Laurent et
al, 2006) (Padhani, 2001) .
Parameter yang sangat penting pada gambaran CT scan untuk evaluasi
tumor yang optimal dengan menggunakan RECIST adalah anatomi yang
menyeluruh, administrasi kontras, ketebalan potongan dan interval rekonstruksi
(Laurent et al, 2006).
2.3 Metode RECIST
Ukuran perubahan pada tumor merupakan evaluasi klinis yang sangat
penting pada terapi kanker. Respon tumor dan perkembangan tumor menjadi
12
kedua hal tersebut hanya bermanfaat jika dapat diterima secara luas dan telah
diaplikasikan sebagai kriteria standar berdasarkan anatomi perubahan tumor. Pada
tahun 2000, telah dipublikasikan suatu kriteria respon tumor yang telah
distandarisasi, dikenal sebagai RECIST (Respon Evaluation Criteria in Solid
Tumors) (van Meerten, 2010). Hal-hal kunci dalam RECIST mencakup : definisi
ukuran minimum lesi yang dapat diukur, instruksi berapa banyak lesi yang harus
di follow-up (sampai 10 lesi, maksimal 5 setiap organ), dan penggunaan ukuran
unidimensional, mengukur evaluasi keseluruhan dari tumor (Eisenhauer, 2009).
2.3.1Panduan RECIST versi 1.0
Pada panduan RECIST versi 1.0 pertama, dibahas mengenai lesi target
yang diukur dan yang tidak diukur. Pada versi ini, pengukuran lesi berdasarkan
diameter terbesar lebih besar sama dengan satu sentimeter dengan ketebalan
kurang sama dengan 5 mm pada potongan gambar CT, atau diameter terbesar
lebih besar sama dengan 2 cm pada non – helical CT dengan ketebalan lebih dari
10 mm, atau diameter tebesar lebih besar sama dengan 2 cm pada radiografi
thorax (Gambar.1) (Nishino, 2010).
13 A. CT scan thorax, laki – laki, 64 tahun dengan tumor di colon, didapatkan multiple nodul metastasis di lobus inferior paru kiri dengan diameter terbesar 2,1 cm (tanda panah). Dimana berdasarkan kriteria, ukuran lesi tersebut lebih dari 1 cm.
B. CT scan abdomen, wanita, 75 tahun dengan tumor paru; didapatkan lesi metastasis di hepar dengan diameter terbesar 2,1 cm (tanda panah). Dimana berdasarkan kriteria, ukuran lesi tersebut lebih dari 1 cm.
C. Chest X ray, dengan proyeksi PA, wanita, 52 tahun yang didapakan gambaran massa dengan diameter terbesar 4,2 cm (tanda panah). Menunjukan adanya tumor paru. Dimana berdasarkan kriteria, ukuran lesi pada foto konvensional tersebut lebih dari 2 cm.
Sedangkan lesi yang tidak diukur memiliki kriteria sebagai berikut, yaitu
lesi kecil yang berdiameter kurang dari 1 cm, metastasis pada tulang tanpa
keterlibatan komponen soft tissue, ascites, efusi pleura, penyebaran secara
limfogen, penyakit leptomeningeal, penyakit inflamasi pada payudara, lesi kistik
atau nekrosis, lesi yang berada para area yang tidak diradiasi, dan lesi pada ruang
14 Gambar.2 Lesi yang tidak diukur berdasarkan Response Evaluation Criteria in Solid Tumor (RECIST)
A. CT scan thorax, wanita, 52 tahun dengan tumor paru menunjukkan multiple nodul kecil di kedua lapang paru dengan ukuran kurang dari 1 cm. Gambaran ini sesuai dengan proses metastasis tipe milier
B. CT scan pada basis paru, wanita, 59 tahun dengan kanker payudara menunjukkan adanya proses metastasis pada corpus vertebra (tanda panah).
C. CT scan abdomen, laki – laki, 45 tahun dengan tumor gaster menunjukkan adanya ascites yang massif. Berdasarkan hasil sitology didapatkan gambaran sel – sel ganas.
D. CT scan thorax, wanita, 70 tahun dengan tumor paru didapatkan penebalan ireguler dari septum interlobular dan cabang – cabang bronkovaskular di lobus inferior paru. Gambaran ini sesuai dengan proses metastasis tipe lymphangitic spread
Kedua, lesi target yang dijadikan sebagai landasan dasar pengukuran harus
dijumlahkan total ukurannya dengan target lesi sejumlah lima hingga sepuluh per
organ. Lesi yang diukur tersebut harus tergambar pada imaging dan digunakan
sebagai penilaian yang objektif dari respons suatu tumor.Pengukuran pada lesi
non-target tidak dibutuhkan.Ada tidaknya lesi non-target seharusnya dilaporkan
pada acuan dasar pelaporan dan evaluasi selanjutnya(Nishino,2010).
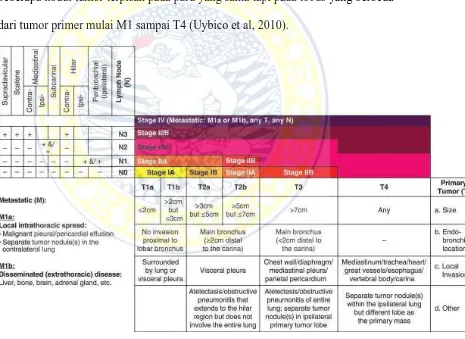
Gambar. 3 Lesi target dengan ukurannya. A-C. Ct scan abdomen, wanita, 49 tahun dengan tumor ovarium
metastasis yang menunjukkan tiga ukuran lesi target di hepar, peritoneal, dan pembesaran kelenjar getah
bening di illiaca dengan diameter masing – masing 1,9 cm, 1,6 cm, dan 3,1 cm. Total semua ukuran tersebut
adalah 6 cm
Tanda RECIST meliputi empat kategori dari suatu respon, yaitu complete
response (CR), partial response (PR), stable disease (SD), progressive disease
(PD). Kriteria dalam mengevaluasi lesi target dan non target diringkas pada tabel.
15
berdasarkan hasil evaluasi lesi target dan non-target yang diikuti dan pengukuran
lesi tersebut tergambar pada imaging (Nishino, 2010).
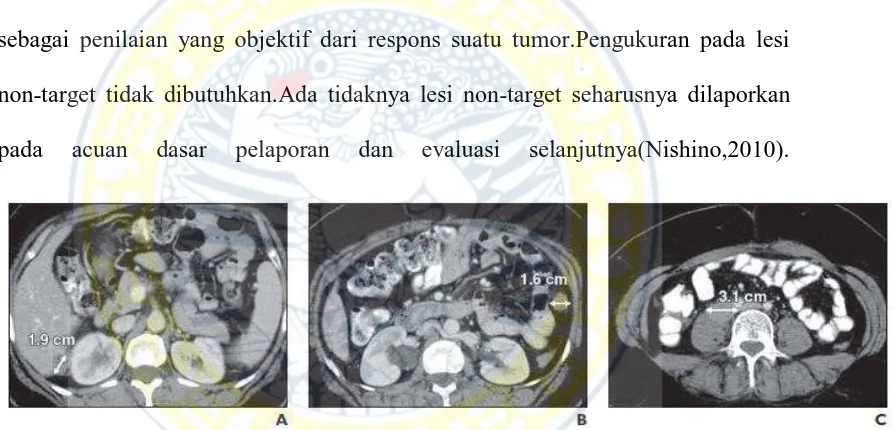
Gambar. 4 Penilaian respon
A dan B, CT scan abdomen awal, laki – laki, 68 tahun dengan tumor colon menunjukkan dua buah lesi target di hepar (tanda panah). Ukuran lesi tersebut berdasarkan RECIST adalah 4,6 cm dan 5,4 cm dengan jumlah total 10 cm.
C dan D, CT scan abdomen evaluasi setelah terapi inisiasi menunjukkan penurunan ukuran lesi berdasarkan RECIST adalah 3,3 cm dan 2,7 cm dengan jumlah total 6 cm. Apabila dibandingkan dengan foto sebelumnya didapatkan penguran jumlah total ukuran lesi target sebesar 40%. Sehingga RECIST pada lesi target termasuk kategori PR (partial response).
Tabel 1. Evaluasi dari lesi target dan non – target berdasarkan Response Evaluation
Criteria in Solid Tumor (RECIST) (Nishino, 2010).
16
Evaluasi lesi target
CR (complete response) Semua lesi target tidak ada
PR (partial response) Pengurangan jumlah total diameter lesi target lebih
besar sama dengan 30% dibandingkan lesi target
pada imaging sebelumnya
PD (progressive
disease)
Penambahan jumlah total diameter lesi target lebih
besar dari 20% dibandingkan lesi target yang
tergambar pada imaging sebelumnya atau terdapat
satu/ lebih lesi baru
SD (stable disease) Tidak termasuk PR atau PD
Evaluasi lesi
non-tumor marker di atas nilai normal yang menetap pada
tiap evaluasi
PD Adanya satu atau lebih lesi dan atau adanya
penambahan dari lesi non –target yang sudah ada sebelumnya
2.3.2 Panduan RECIST versi 1.1
RECIST dapat diterima secara luas sebagai standard yang objektif dalam
pengukuran respons tumor terhadap terapi dan perkembangan tumor dari waktu ke
waktu, terutama pada uji klinis di bidang onkologi. Walaupun RECIST memiliki
keterbatasan, ini dapat dimininimalkan dengan kemajuan teknologi imaging yang
17
Pada bulan Januari 2009, dikenalkanlah revisi dari panduan RECIST versi
1.1 berdasarkan uji klinis dari lebih dari 6500 data pasien dan lebih dari 18000
lesi target (Nishino, 2010).
Perubahan besar dari RECIST versi 1.1 dikaitkan dengan imaging, yaitu
pertama, jumlah lesi target; kedua, penilaian terhadap kelenjar getah bening yang
patologis; ketiga, penilaian terhadap progresivitas penyakit; keempat, penilaian
terhadap perbedaan progresivitas pada lesi non-target; dan kelima, peran F-FDG
PET pada deteksi lesi baru (Nishino, 2010).
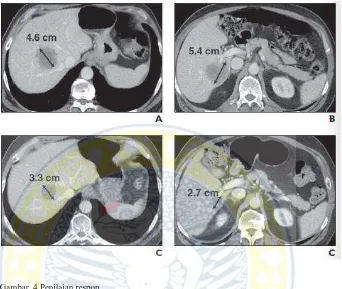
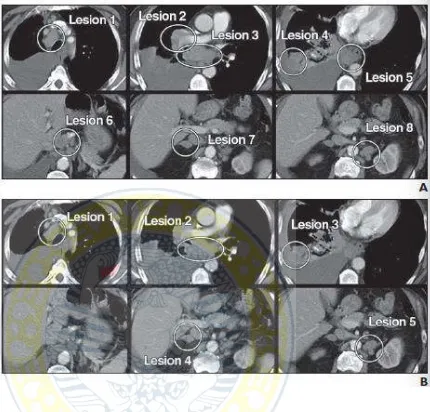
Gambar. 6 Jumlah lesi target berdasarkan revisi RECIST versi 1.1 terdapat pengurangan jumlah lesi target per organ menjadi dua.
A. CT scan abdomen, wanita 72 tahun dengan tumor pankreas menunjukkan massa pancreas (panah hitam) disertai multiple lesi metastasis di hepar. Berdasarakan RECIST versi 1.0 ditampilkan minimal lima lesi target dengan ukuran masing – masing diameter dari lesi target (panah bolak – balik).
18 Gambar 7. Jumlah lesi target berdasarkan revisi RECIST versi 1.1 terdapat pengurangan jumlah lesi target per organ menjadi lima.
A. CT scan thorax, laki laki, 74 tahun, dengan kanker paru small cell stadium lanjut disertai multipel pembesaran kelenjar getah bening di cavum thorax dan abdomen bagian atas, lesi pada lobus kanan paru, dan metastasis kelenjar adrenal bilateral. Berdasarkan RECIST versi 1.0 dibutuhkan maksimal sepuluh lesi target, dimana pada gambar ini didapatkan delapan lesi target.
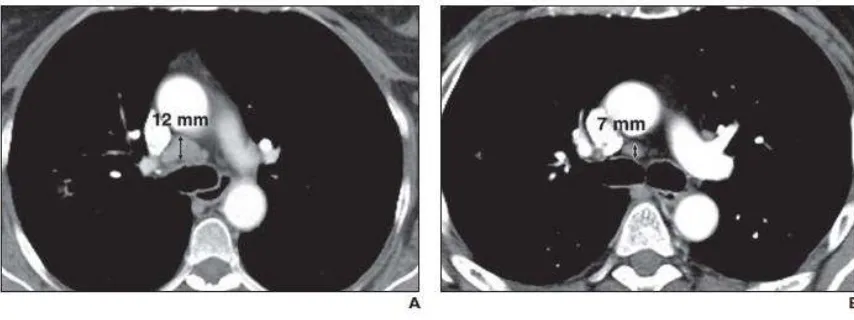
19 Gambar. 8 Penilaian kelenjar getah bening patologis pada RECIST versi 1.1
A. CT scan thorax, pasien dengan tumor paru, terdapat kelenjar getah bening subcarina dengan axis yang pendek sebesar 1,2 cm (tanda panah); dimana berdasarkan RECIST versi 1.1, kelenjar getah bening tersebut merupakan lesi non – target.
B. CT scan thorax, pasien dengan tumor paru, didapatkan kelenjar getah bening pericarina dengan axis pendek sebesar 0,7 cm. Dimana berdasarkan RECIST versi 1.1, kelenjar getah bening tersebut merupan lesi non patologis.
Gambar 9. Penjelasan mengenai progresivitas penyakit.
A. Lesi target awal sebelum pemberian terapi dengan diameter tiga cm.
B. Setelah pemberian terapi terdapat penurunan diameter lesi menjadi satu cm dengan persentase sebesar 67% dibandingkan lesi awal.
20 D. Jika pada evaluasi berikutnya terjadi penambahan ukuran lesi tersebut lebih dari lima mm dibandingkan evaluasi pertama setelah pemberian terapi; maka berdasarkan RECIST versi 1.1 dapat dikategorikan sebagai PD.
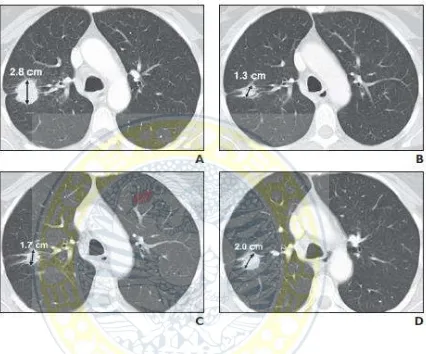
Gambar. 10 Penjelasan mengenai progresivitas penyakit pada wanita, usia 55 tahun dengan non – small cell tumor paru yang diterapi dengan epidermal growth factor receptor inhibitor erlotinib.
A. CT scan thorax yang menunjukkan lesi target yang spiculated dengan diameter terpanjang 2,8 cm. B. Evaluasi imaging setelah pemberian terapi sebanyak satu siklus, didapatkan pengurangan ukuran
lesi tersebut menjadi 1,3 cm dengan persentase pengurangan sebesar 54%. Sehingga penilaian tumor berdasar RECIST tergolong sebagai PR.
C. Evaluasi setelah pemberian terapi, didapatkan pertumbuhan yang lambat dari sel tumor dengan diameter terbesar tumor saat ini 1,7 cm dan bila dibandingkan dengan foto sebelumnya terdapat pertambahan ukuran sebesar 4 mm yang setara dengan 30%. Jika menggunakan panduan RECIST versi 1.0 dapat digolongkan sebagai PD sehingga terapi dapat dihentikan; tetapi berdasarkan panduan RECIST versi 1.1 penambahan kurang dari lima mm digolongkan sebagai SD.
D. Evaluasi CT scan thorax selanjutnya terjadi penambahan ukuran diameter lesi menjadi 2 cm dimana pertambahan ukuran ini bila dibandingkan dengan CT scan evaluasi pada pemberian terapi setelah satu siklus terjadi penambahan ukuran sebesar 7 mm (setara 54%) sehingga berdasarkan RECIST versi 1.1 dikategorikan sebagai PD.
21
Pada waktu awal, lesi tumor atau nodul limfatik dikategorikan menjadi
measurable atau non-measurable (Eisenhauer, 2009).
Measurable tumor lesion : harus dapat diukur secara akurat dalam satu
dimensi (diameter terpanjang pada bidang datar pengukuran yang dapat diukur)
dengan ukuran minimum (Eisenhauer, 2009) :
- 10 mm dengan menggunakan CT scan (dengan ketebalan potongan CT
scan < 5 mm)
- 10 mm ukuran caliper dengan pemeriksaan klinis (lesi yang tidak dapat
diukur secara akurat dengan caliper dimasukkan ke dalam non
measurable)
- 20 mm dengan menggunakan foto thorax konvensional
Nodul limfatik maligna : dipertimbangkan membesar secara patologis dan
dapat diukur bila > 15 mm dalam axis pendek ketika dilihat pada CT scan
(dengan ketebalan potongan CT scan < 5 mm). Pada waktu awal dan follow up,
hanya axis pendek yang diukur dan dipantau (Eisenhauer, 2009).
Non-measurable : semua lesi lainnya, termasuk lesi yang kecil (diameter
terpanjang < 10 mm atau nodul limfatik patologis dengan axis pendek > 10 mm
dan < 15 mm). Lesi yang termasuk dalam non measurable adalah penyakit
leptomeningeal, ascites, efusi pleura atau pericardial, penyakit inflamasi payudara,
penyebaran limfatik pada kulit atau paru, massa abdomen/organomegali abdomen
yang teridentifikasi pada pemeriksaan klinis namun tidak dapat diukur pada teknik
22
Lesi target adalah satu atau lebih lesi (total semua lesi maksimal 5 lesi , atau
maksimal 2 lesi tiap organ) yang dapat diukur (measurable lesion) yang ada pada
awal waktu pengukuran (Eisenhauer, 2009).
Lesi non target adalah semua lesi lainnya termasuk nodul limfatik patologis
dan seharusnya didokumentasikan pada awal waktu pengukuran. Lesi non target
tidak dilakukan pengukuran, hanya direpresentasikan sebagai ada atau tidak ada
(Eisenhauer, 2009).
2.3.2.2 Spesifikasi metode pengukuran
Semua pengukuran seharusnya diukur dengan notasi metrik, menggunakan
penggaris jika diperiksa secara klinis. Semua pengukuran awal harus dilakukan
sedekat mungkin dengan waktu dimulainya terapi dan tidak lebih dari 4 minggu
sebelum dimulainya terapi (Eisenhauer, 2009).
2.3.2.3 Metode Pengukuran
Metode pengukuran yang sama dan teknik pengukuran yang sama harus
digunakan untuk menggambarkan dan melaporkan setiap lesi pada waktu
pengukuran awal dan selama follow up. Evaluasi berdasarkan imaging sebaiknya
selalu dilakukan dibandingkan dengan evaluasi secara klinis kecuali lesi yang
dievaluasi tersebut tidak dapat digambarkan melalui imaging, hanya melalui
evaluasi klinis (Eisenhauer, 2009).
23
Complete Response (CR) : hilangnya seluruh lesi target. Jika terdapat
nodul limfatik patologis (target atau non target) maka harus berkurang sampai <
10 mm pada axis pendek nya (Eisenhauer, 2009).
Partial Response (PR) : Paling sedikit berkurang sebanyak 30% pada
diameter lesi target, berdasarkan pada diameter pada waktu pengukuran awal
(Eisenhauer, 2009).
Progressive Disease (PD) : Paling sedikit bertambah sebanyak 20% pada
diameter lesi target, dimana yang diambil sebagai patokan adalah diameter
terkecil pada pengukuran awal. Sebagai tambahan, meningkat sebanyak 20%
harus dibuktikan dengan pertambahan absolut diameter paling sedikit 5 mm
(munculnya 1 atau lebih lesi baru juga dikatakan progressive) (Eisenhauer, 2009).
Stable Disease (SD) : Tidak adanya kriteria yang mencukupi untuk
dimasukkan pada PR atau PD, dimana yang diambil sebagai patokan adalah
diameter terkecil pada pengukuran awal (Eisenhauer, 2009).
2.3.2.5 Kriteria respon tumor pada lesi non target
Complete Response : hilangnya seluruh lesi non target dan level tumor
marker kembali normal. Semua ukuran nodul limfatik adalah non patologis (< 10
mm axis pendek) (Eisenhauer, 2009).
Non-CR atau non-PD : persistensi satu atau lebih lesi non target dan atau
24
Progressive Disease (PD) : Unequivocal progression pada lesi non target
yang ada (munculnya 1 atau lebih lesi baru juga dikatakan progressive)
(Eisenhauer, 2009).
2.3.2.6 Respon evaluasi secara keseluruhan
Respon secara keseluruhan yang terbaik adalah respon terbaik yang diukur
sejak awal dimulainya terapi hingga terapi berakhir. Kadang kala suatu respon
tidak didokumentasikan hingga berakhirnya terapi, seharusnya secara protokol
terapi, pengukuran sesudah terapi sangat menentukan dalam respon evaluasi
secara keseluruhan. Respon evaluasi terbaik pasien tergantung pada temuan lesi
target dan non target serta mempertimbangkan ada atau tidaknya lesi baru
(Eisenhauer, 2009).
Tabel 2. Evaluasi dari lesi target dan non – target berdasarkan Response Evaluation
Criteria in Solid Tumor (RECIST) 1.1 (Chalian et al, 2011).
Penilaian Respon Panduan RECIST versi 1.1 Evaluasi lesi target
CR (complete response) Semua lesi target tidak ada, ditambah dengan
pengurangan pada diameter short-axis pada lymph
node yang patologis sampai < 10 mm
PR (partial response) Pengurangan jumlah total diameter lesi target lebih
25
PD (progressive
disease)
Penambahan jumlah total diameter lesi target lebih
besar dari 20% (penambahan sebesar lebih dari atau
sama dengan 5 mm) dibandingkan lesi target yang
tergambar pada imaging sebelumnya atau terdapat
satu/ lebih lesi baru
SD (stable disease) Tidak termasuk PR atau PD
Evaluasi lesi non-target
CR (complete response) Hilangnya semua lesi non target dan hasil tumor
marker yang normal, pengurangan pada diameter
short-axis pada semua lymph node sampai < 10 mm
Non-complete Response
atau non-progressive
disease
Masih ada satu atau lebih lesi target, dan atau hasil
tumor marker di atas nilai normal yang menetap pada
tiap evaluasi
PD (progressive
disease)
Adanya satu atau lebih lesi baru, atau adanya
penambahan ukuran pada satu atau lebih lesi non – target, penambahan ukuran pada lesi non-target yang
mengakibatkan penambahan keseluruhan beban tumor
Tabel 3. Kategori Respon Keseluruhan dari Penyakit dengan menggunakan
kriteria RECIST (Chalian, 2011).
Status Lesi Target Status Lesi non-target Adanya lesi
baru
Respon
26
A. Kriteria RECIST 1.0 dan RECIST 1.1
Complete Response
B. Kriteria Tambahan pada RECIST 1.1
27
BAB III
KERANGKA KONSEPTUAL
28
3.2 Penjelasan Kerangka Konseptual
Pada penelitian ini diambil sampel NSCLC yang dilakukan pemeriksaan
MDCT scan thorax untuk menentukan staging tumor berdasarkan AJCC tahun
2010. Sampel NSCLC yang diambil adalah NSCLC stadium lanjut yang
non-operable yang kemudian mendapat kemoterapi serial berbasis platin dan
immunoterapi racotumumab. Mengidentifikasi lesi yang dapat diukur, pada
evaluasi awal (baseline) semua lesi harus dikategorikan sebagai lesi terukur dan
tidak terukur. Setelah semua lesi yang dikategorikan sebagai lesi terukur dan tidak
terukur, lalu diidentifikasi lesi target. Menurut kriteria RECIST 1.0, sepuluh lesi
sasaran (lima per organ) harus dipilih dari antara lesi terukur .Menurut kriteria
RECIST 1.1, lima lesi sasaran (dua per organ) harus dipilih dari antara lesi terukur
. Meskipun lesi dengan diameter terpanjang pada awal (baseline) mungkin
mencerminkan beban tumor secara keseluruhan, lesi terbesar belum tentu lesi
target yang terbaik. Semua lesi selain lesi target yang dianggap lesi non
target.Pada evaluasi follow up, jumlah dari diameter terpanjang dari lesi target
harus dihitung dan dicatat. Lesi target yang sama diukur pada setiap evaluasi.Lesi
non target tidak dilakukan pengukuran, hanya direpresentasikan sebagai ada atau
tidak ada baik pada awal (baseline) maupun pada evaluasi follow up. Kemudian
dievaluasi penilaian respon tumor dengan menggunakan metode RECIST 1.0 dan
RECIST 1.1. Kedua kriteria RECIST 1.0 dan 1.1 mendefinisikan empat kategori
respon : complete response (CR), partial response (PR), stable disease (SD), dan
29
dan RECIST 1.1 dibandingkan untuk mengetahui apakah ada perbedaan diantara
keduanya.
3.3Hipotesis
Terdapat perbedaan penilaian respon tumor dengan menggunakan metode
RECIST 1.0 dan RECIST 1.1 pada NSCLC stadium lanjut yang mendapat
30
BAB IV
METODE PENELITIAN
4.1 Jenis dan Rancangan Penelitian
Penelitian ini adalah penelitian observasional analitik yang dilakukan
secara retrospektif menggunakan data sekunder yang berasal dari rekam medik.
4.2 Populasi, Besar Sampel dan Teknik Pengambilan Sampel
4.2.1 Populasi Penelitian
Penelitian ini menggunakan studi populasi . Populasi penelitian ini adalah
semua hasil rekam medik MDCT Scan Thorax dengan diagnosa kanker paru tipe
non small cell lung cancer (NSCLC) minimal stadium 3A non-operable yang
memenuhi kriteria penerimaan sampel di RSUD Dr Soetomo pada periode Januari
2015 - Desember 2015.
4.2.2 Sampel penelitian
Sampel penelitian adalah semua hasil rekam medik MDCT Scan Thorax
dengan diagnosa kanker paru tipe non small cell lung cancer (NSCLC) minimal
stadium 3A non-operable yang memenuhi kriteria penerimaan sampel di RSUD
Dr Soetomo pada periode Januari 2015 - Desember 2015.
4.2.2.1 Kriteria Penerimaan Sampel/Inklusi
Semua hasil rekam medik MDCT Scan Thorax pasien dengan diagnosa
kanker paru tipe non small cell lung cancer (NSCLC) minimal stadium 3A
31
laboratoris, radiologis dan patologi anatomi, serta telah menjalani kemoterapi
serial berbasis platin dan mendapatkan immunoterapi racotumumab.
4.2.2.2 Kriteria Penolakan Sampel/Eksklusi
Semua hasil rekam medik MDCT Scan Thorax pasien dengan diagnosa
kanker paru tipe non small cell lung cancer (NSCLC) minimal stadium 3A
non-operable yang datanya tidak lengkap.
4.3 Definisi Operasional
- Tumor paru tipe NSCLC stadium 3A : secara histologis telah terbukti sebagai
NSCLC dengan ketentuan staging T1-T2, N2, M0, atau T1-T3, N2, M0 atau T4,
N0-N1, M0 (menurut staging TNM edisi ke 7).
- Terapi Kemoterapi : kemoterapi standar platinum based sebanyak 4 siklus.
- Terapi immunoterapi : immunoterapi dengan racotumumab
- CT scan serial : Hasil pemeriksaan CT scan yang dilakukan sebelum dan
sesudah pemberian kemoterapi standar platinum based sebanyak 4 siklus dan
immunoterapi racotumumab di instalasi Radiodiagnostik RSUD Dr.Soetomo
Surabaya.
- Metode RECIST 1.0 dan RECIST 1.1 : Pedoman Kriteria Respon Evaluasi
Tumor Padat mencakup lesi measurable dan non measurable serta lesi target dan
non-target.
- Pada waktu awal, lesi tumor atau nodul limfatik dikategorikan menjadi
32
a.Measurable tumor lesion : harus dapat diukur secara akurat dalam satu dimensi
(diameter terpanjang pada bidang datar pengukuran yang dapat diukur) dengan
ukuran minimum 10 mm dengan menggunakan CT scan (dengan ketebalan
potongan CT scan < 5 mm). Nodul limfatik maligna : dipertimbangkan membesar
secara patologis dan dapat diukur bila > 15 mm dalam axis pendek ketika dilihat
pada CT scan (dengan ketebalan potongan CT scan < 5 mm). Pada waktu awal
dan follow up, hanya axis pendek yang diukur dan dipantau.
b. Non-measurable : semua lesi lainnya, termasuk lesi yang kecil (diameter
terpanjang < 10 mm atau nodul limfatik patologis dengan axis pendek > 10 mm
dan < 15 mm). Lesi yang termasuk dalam non measurable adalah penyakit
leptomeningeal, ascites, efusi pleura atau pericardial, penyakit inflamasi payudara,
penyebaran limfatik pada kulit atau paru, massa abdomen/organomegali abdomen
yang teridentifikasi pada pemeriksaan klinis namun tidak dapat diukur pada teknik
imaging.
- Lesi target adalah satu atau lebih lesi (total semua lesi maksimal 5 lesi , atau
maksimal 2 lesi tiap organ) yang dapat diukur (measurable lesion) yang ada pada
awal waktu pengukuran.
- Lesi non target adalah semua lesi lainnya termasuk nodul limfatik patologis dan
seharusnya didokumentasikan pada awal waktu pengukuran. Lesi non target tidak
dilakukan pengukuran, hanya direpresentasikan sebagai ada atau tidak ada.
33
a. Complete Response (CR) : hilangnya seluruh lesi target. Jika terdapat nodul
limfatik patologis (target atau non target) maka harus berkurang sampai < 10 mm
pada axis pendek nya.
b.Partial Response (PR) : Paling sedikit berkurang sebanyak 30% pada diameter
lesi target, berdasarkan pada diameter pada waktu pengukuran awal.
c. Progressive Disease (PD) : Paling sedikit bertambah sebanyak 20% pada
diameter lesi target, dimana yang diambil sebagai patokan adalah diameter
terkecil pada pengukuran awal. Sebagai tambahan, meningkat sebanyak 20%
harus dibuktikan dengan pertambahan absolut diameter paling sedikit 5 mm
(munculnya 1 atau lebih lesi baru juga dikatakan progressive).
d.Stable Disease (SD) : Tidak adanya kriteria yang mencukupi untuk dimasukkan
pada PR atau PD, dimana yang diambil sebagai patokan adalah diameter terkecil
pada pengukuran awal.
4.4Alur Penelitian
Rekam medik MDCT Scan Thorax pasien dengan diagnosa kanker paru tipe non small cell lung cancer (NSCLC) minimal stadium 3A non-operable yang masuk kriteria inklusi di Instalasi
Radiodiagnostik RSUD Dr.Soetomo Surabaya (Periode Januari 2015 – Desember 2015)
Studi Penilaian berdasarkan metode RECIST 1.0
Studi Penilaian berdasarkan metode RECIST 1.0
Identifikasi dan pemilihan lesi target dan lesi non-target
Identifikasi dan pemilihan lesi target dan lesi non-target
Mengukur diameter lesi target dan mencatat adanya lesi non target
Mengukur diameter lesi target dan mencatat adanya lesi non target
Menentukan respon tumor berdasarkan metode RECIST 1.0
Menentukan respon tumor berdasarkan metode RECIST 1.1
34
4.3.1 KeteranganAlur Penelitian
Semua hasil rekam medik MDCT scan thorax pasien dengan diagnosa
kanker paru tipe non small cell lung cancer (NSCLC) minimal stadium 3A
non-operable yang masuk kriteria penerimaan sampel di Instalasi Radiodiagnostik
RSUD Dr.Soetomo Surabaya periode Januari 2015 – Desember 2015, dilakukan
studi penilaian berdasarkan metode RECIST 1.0 dan RECIST 1.1. Pada MDCT
scan thorax baseline dilakukan identifikasi dan pemilihan lesi target dan
non-target masing-masing berdasarkan metode RECIST 1.0 dan RECIST 1.1.
Kemudian dilakukan pengukuran lesi target dan pencatatan lesi non-target.
Selanjutnya pada MDCT scan thorax post-treatment dilakukan follow-up pada lesi
target dan non-target yang telah diukur sebelumnya pada MDCT scan thorax
baseline dan menilai apakah ada lesi baru. Lalu dilakukan penilaian respon tumor
berdasarkan RECIST 1.0 dan RECIST 1.1. Respon tumor antara RECIST 1.0 dan
35
4.7 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan selama bulan Februari 2016 – April 2016 di
Instalasi Radiodiagnostik RSUD Dr Soetomo Surabaya.
4.8 Cara Mengolah dan Analisa Data
- Pada MDCT scan thorax baseline dilakukan identifikasi dan pemilihan lesi
target dan non-target masing-masing berdasarkan metode RECIST 1.0 dan
RECIST 1.1
- Kemudian dilakukan pengukuran lesi target dan pencatatan lesi non-target pada
MDCT scan thorax baseline.
- Pada MDCT scan thorax post-treatment dilakukan follow-up pada lesi target
dan non-target yang telah diukur sebelumnya pada MDCT scan thorax baseline
dan menilai apakah ada lesi baru.
- Menilai respon tumor berdasarkan metode RECIST 1.0 dan RECIST 1.1
- Membandingkan respon tumor berdasarkan metode RECIST 1.0 dan RECIST
1.1
4.9 Etika Penelitian
Penulis mengajukan persetujuan penelitian ke Komisi Etik Fakultas
36
BAB V
HASIL PENELITIAN
5.1 Karakteristik Pasien
Pada penelitian ini, total ada 32 pasien dengan tumor paru tipe NSCLC stadium
lanjut yang mendapat kemoterapi lini pertama berbasis platin dan regimen
immunoterapi racotumumab.
Karakteristik pasien pada baseline dapat dilihat pada tabel 1.
Karakteristik Jumlah Pasien %
37
5.1.1 Distribusi sampel berdasarkan usia
Pada penelitian ini diperoleh 32 sampel berusia 32 – 83 tahun dengan rerata usia
56,5 tahun. Kelompok usia terbanyak pada usia 51-60 tahun dan 61-70 tahun
dengan masing-masing kelompok sebanyak 12 sampel (37,5 %). Pada kelompok
usia 31-40 tahun didapatkan 1 sampel (3,1 %), usia 41-50 tahun sebanyak 6
sampel (18,8 %) dan usia > 80 tahun sebanyak 1 sampel (3,1 %).
Gambar 5.1.1 Distribusi sampel berdasarkan kelompok usia.
5.1.2 Distribusi sampel berdasarkan jenis kelamin
Pada penelitian ini didapatkan sampel laki-laki sebanyak 20 orang (62,5 %) dan
perempuan 12 orang (37,5 %).
Umur
38
Gambar 5.1.2 Distribusi sampel berdasarkan kelamin.
5.1.3 Distribusi sampel berdasarkan histopatologis
Karakteristik histopatologis terbanyak yang didapatkan pada 32 sampel adalah
adenocarcinoma sebanyak 25 pasien (78,1 %) dan squamous cell carcinoma
sebanyak 7 pasien (21,9 %).
Jenis Kelamin
Laki-laki Perempuan
Histopatologi
Adenocarcinoma
39
Gambar 5.1.3 Distribusi sampel berdasarkan histopatologis.
5.1.4 Distribusi sampel berdasarkan staging tumor
Pada penelitian ini, dari 32 sampel, sebanyak 9 orang dengan staging tumor III A
(28,1 %), 9 orang dengan staging tumor III B (28,1 %) dan 14 orang dengan
staging tumor IV (43,8 %).
5.2 Jumlah lesi target
Jumlah lesi target berdasarkan RECIST 1.1 secara signifikan lebih sedikit
dibandingkan dengan jumlah lesi target berdasarkan RECIST 1.0 (p < 0,05).
Rerata jumlah lesi target pada RECIST 1.0 adalah 3 (kisaran 1-6), dan pada
RECIST 1.1 adalah 2 (kisaran 1-6). Pada baseline sebanyak 13 pasien (40,6 %)
menunjukkan pengurangan jumlah lesi target dengan menggunakan RECIST 1.1.
Sebanyak 14 pasien (43,75%) menunjukkan pengurangan lesi target dikarenakan
kriteria baru lymph node yang digunakan pada RECIST 1.1.
Staging
40
Pada paska terapi sebanyak 26 pasien (81,25 %) menunjukkan
pengurangan jumlah lesi target dengan menggunakan RECIST 1.1. Pengurangan
lesi target dikarenakan kriteria baru lymph node yang digunakan pada RECIST
1.1.
Gambar 5.2. Perbandingan Jumlah Lesi Target antara RECIST 1.0 dan RECIST
1.1 pada baseline
0 1 2 3 4 5 6 7
41
Gambar 5.2. Perbandingan Jumlah Lesi Target antara RECIST 1.0 dan RECIST
1.1 pada post treatment.
TABEL 5.2 Independent Sample Test
0 1 2 3 4 5 6 7
42
5.3 Respon Tumor
Persentase respon tumor dengan menggunakan RECIST 1.0 dan RECIST 1.1
dapat dilihat pada tabel dibawah ini.
TABEL 5.3. RESPON TUMOR PASIEN RECIST 1.0
Frequency Percent
.002 .967 2.103 62 .040 .65625 .31205 .03248 1.28002
2.103 61.844 .040 .65625 .31205 .03245 1.28005
.383 .538 3.485 62 .001 1.1875 .34076 .50633 1.86867
3.485 61.307 .001 1.1875 .34076 .50618 1.86882
.065 .799 2.096 62 .040 .65625 .31305 .03046 1.28204
2.096 61.700 .040 .65625 .31305 .03040 1.28210
.685 .411 3.625 62 .001 1.1875 .32756 .53272 1.84228
43 TABEL 5.3. RESPON TUMOR PASIEN RECIST 1.1
Frequency Percent
Tabel. Komparasi Respon Tumor berdasarkan RECIST 1.0 dan RECIST 1.1
Respon Tumor
Berdasarkan RECIST
1.0
Respon Tumor Berdasarkan RECIST 1.1 Total
CR PR SD PD
Sebanyak 6 pasien (18,75 %) menunjukkan ketidaksesuaian respon tumor antara
44
pada RECIST 1.0 di re-klasifikasi menjadi complete response (CR) karena lymph
node dengan diameter short axis < 10 mm dikategorikan normal sesuai dengan
kriteria RECIST 1.1. Tiga pasien dengan progressive disease (PD) pada RECIST
1.0 di re-klasifikasi sebagai partial disease (PR) dan dua pasien dengan
progressive disease (PD) pada RECIST 1.0 di re-klasifikasi sebagai stable disease
(SD) dikarenakan pengukuran lymph node yang < 10 mm pada diameter
short-axis tidak memenuhi kriteria lymph node yang patologis pada RECIST 1.1.
Komparasi respon tumor antara dua kriteria RECIST ditunjukkan pada tabel 4.
Hasil perhitungan statistik dengan tes Mann-Whitney U untuk respon tumor
antara RECIST 1.0 dan RECIST 1.1 berbeda namun tidak signifikan dengan nilai
45
N of Valid Cases 32
Respon tumor menunjukkan kesesuaian (level of concordance) antara RECIST 1.0
dan RECIST 1.1, dengan nilai koeffisien kappa sebesar 0,614 dengan nilai p <
46
BAB VI
PEMBAHASAN
Pada penelitian ini dilakukan komparasi respon tumor antara RECIST 1.0
dan RECIST 1.1 pada pasien NSCLC stadium lanjut yang mendapatkan
kemoterapi berbasis platin dan immunoterapi racotumumab.
Data yang didapatkan pada penelitian ini menunjukkan bahwa RECIST
1.1 secara signifikan mengurangi jumlah lesi target yang diukur untuk
menentukan respon tumor dibandingkan dengan RECIST 1.0 (nilai p < 0,05
dengan menggunakan independent samples test). Pengurangan lesi target dengan
menggunakan metode RECIST 1.1 sebagian besar disebabkan oleh perubahan
pada kriteria evaluasi lymph node. RECIST 1.0 tidak memberikan rekomendasi
tertentu untuk penilaian lymph node. RECIST 1.1 memberikan pedoman khusus
untuk penilaian lymph node : lymph node dengan diameter short-axis kurang dari
10 mm dianggap normal, lymph node dengan diameter short-axis minimal 10 mm
tapi kurang dari 15 mm dianggap sebagai lesi non-target, dan lymph node dengan
diameter short-axis 15 mm atau lebih dianggap sebagai lesi target.
Walaupun jumlah sampel pada penelitian ini relatif sedikit (n = 32),
namun pada uji statistik menunjukkan bahwa terdapat perbedaan respon tumor
antara RECIST 1.0 dan RECIST 1.1, namun tidak signifikan dengan nilai p > 0,05
47
Respon tumor menunjukkan kesesuaian (level of concordance) antara
RECIST 1.0 dan RECIST 1.1, dengan nilai koeffisien kappa sebesar 0,614 dengan
nilai p < 0,001. Sebanyak 28 sampel (81,25 %) memiliki respon tumor yang sama
antara RECIST 1.0 dan RECIST 1.1. Hal ini menunjukkan bahwa terdapat
kesesuaian antara pedoman RECIST 1.0 dan RECIST 1.1 dalam menilai respon
tumor paru tipe non-small cell cancer stadium lanjut yang mendapatkan
kemoterapi berbasis platin dan immunoterapi racotumumab.
Temuan ini sesuai dengan hasil penelitian yang dilakukan oleh Nishino et
al (2010) yang membandingkan RECIST 1.0 dan RECIST 1.1 pada pasien tumor
paru NSCLC stage IV dengan EGFR mutasi yang mendapat terapi inhibitor
EGFR tirosin kinase , Choi et al (2015) yang membandingkan RECIST 1.0 dan
RECIST 1.1 pada pasien tumor paru NSCLC stage III B – IV yang mendapat
kemoterapi sitotoksik, dan Kim et al (2015) yang membandingkan RECIST 1.0
dan RECIST 1.1 pada pasien dengan kanker metatasis.
Perbedaan yang signifikan antara RECIST 1.0 dan RECIST 1.1 selain
jumlah lesi target yang lebih sedikit dan kriteria baru penilaian lymph node,
adalah adanya perbedaan dalam definisi progressive disease. Perubahan ini pada
RECIST 1.1 antara lain adalah peningkatan ukuran lesi target ≥ 5 mm selain
peningkatan 20% untuk kriteria respon progressive disease, diharapkan dapat
memberikan penilaian respon klinis yang lebih relevan pada pasien yang diterapi
dengan agen target molekular (molecular targeting agents) yang efektif.
Contoh kasus pada pasien, tumor awalnya cenderung memberikan respon
yang baik untuk terapi yang ditargetkan dan ukuran akan berkurang secara
48
dengan mudah memenuhi kriteria peningkatan 20% didefinisikan sebagai
penyakit progresif (PD) oleh RECIST 1.0 meskipun pasien tetap asimtomatik dan
ukuran tumor lebih kecil dari ukuran pada baseline. Misalnya, pasien dengan lesi
5,0 cm pada awal memberikan respon yang baik dengan terapi target yang efektif
dan lesi berukuran 1,0 cm pada studi follow-up; jika lesi berukuran 1,2 cm pada
follow-up berikutnya, pasien ini memenuhi kriteria untuk penyakit progresif (PD)
menurut RECIST 1,0. Namun, perbedaan 2 mm merupakan perubahan lesi yang
sangat kecil, mungkin saja suatu variabilitas pengukuran bukan perubahan ukuran
yang sebenarnya. Pasien yang sama, menurut RECIST 1.1, tidak memenuhi
kriteria untuk PD karena peningkatan mutlak dalam ukuran kurang dari 5 mm.
Respon tumor dapat dinilai dengan mudah dengan menggunakan RECIST
1.1. Namun, kriteria terutama tergantung pada perubahan ukuran tumor. Kriteria
ini tidak mencerminkan morfologi lainnya (nekrosis tumor, perdarahan, dan
kavitasi), fungsional, atau perubahan metabolik yang mungkin terjadi dengan
kemoterapi ditargetkan (targeted chemotheraphy) atau bahkan dengan kemoterapi
konvensional. Hal ini merupakan salah satu kelemahan pada kriteria ini (Kang et
al, 2012).
Peran modalitas pencitraan saat ini memungkinkan pengukuran yang lebih
akurat dan reproduksi volume tumor. Oleh karenanya dapat mengukur volume
bukan hanya diameter satu dimensi tumor. Seperti disebutkan sebelumnya, lesi
terbesar mungkin tidak selalu menjadi lesi target terbaik. Lesi besar mungkin
sebagian nekrotik atau mengandung kavitasi dan mungkin tidak menurun dalam
ukuran pada tingkat yang sama dengan lesi kecil yang respon terhadap
49
perubahan kistik pada tumor padat tanpa tentu menyebabkan penyusutan tumor
(Kang et al, 2012).
Lee et al. (2011) mengusulkan bahwa kriteria respon CT terbaru dirancang
dengan pertimbangan konstituen tumor (padat dan komponen GGO), kehadiran
kavitasi dan redaman perubahan dalam lesi target dapat digunakan untuk evaluasi
respon pada pasien kanker paru-paru non-small cell lung cancer (NSCLC ) yang
menjalani terapi reseptor faktor pertumbuhan epidermal (EGFR) TKI (Gbr. 5)
karena kriteria yang mencerminkan karakteristik morfologi tambahan pada lesi
sasaran yang direproduksi dan memiliki hubungan yang signifikan secara statistik
dengan kelangsungan hidup pasien secara keseluruhan.
Gambar 5. Diagram yang menggambarkan sasaran lesi pengukuran dengan metode RECIST dan kriteria respon baru (31). Menurut pengukuran RECIST, ukuran target lesi diukur dengan termasuk baik padat dan komponen ground glass opacity (x). Menurut pengukuran Lee, ukuran target lesi diukur dengan termasuk komponen padat sendirian dan dengan menilai ukuran gambar pada