UJI POTENSI ANTIBAKTERI FRAKSI KLOROFORM- ETANOL-ASAM ASETAT DARI EKSTRAK KLOROFORM KULIT BATANG KEMIRI
[Aleurites moluccana (L.) Willd] TERHADAP Staphylococcus aureus
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
M. Yohani Cahya Pratiwi NIM : 038114073
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
Buatlah dirimu menjadi berkah bagi seseor ang
Senyummu yang tulus dan tepukan di bahu
mungkin bisa menarik seseorang dari tepi jurang (Carmelia Elliot)
Ora n g la in m u n gkin a d a u n tu k m e m b a n tu kita , m e n o lo n g kita ,
m e m b im b in g kita , m e la n gka h d ija la n kita . Ta p i p e la ja ra n ya n g d ip e la ja ri s e la lu m ilik kita
( Me lo d y Be a ttie )
“
Marilah kepadaKu semua yang letih, lesu dan berbeban berat,
Aku akan memberi kelegaan kepadamu”
(Matius 11:28)
Kupersembahkan karya ini untuk :
Tuhan Yesus dan Bunda Maria
Bapak dan Ibuku tercinta
Mbak-ku (Yosi) dan
Adik-ku “Yogi” (Bogel)☺tersayang
INTISARI
Kulit batang kemiri (Aleurites moluccana L. Willd) merupakan salah satu tanaman obat yang berkhasiat mengobati disentri, urus-urus, luka infeksi dan sembelit. Tujuan penelitian ini untuk mengetahui potensi antibakteri fraksi kloroform-etanol-asam asetat dari ekstrak kloroform kulit batang kemiri terhadap
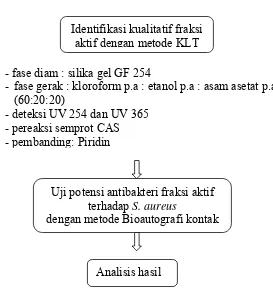
Staphylococcus aureus. Penelitian ini termasuk penelitian eksperimental murni. Metode ekstraksi yang digunakan adalah remaserasi kinetik menggunakan pelarut kloroform, kemudian dilanjutkan pemisahan dengan Kromatografi Kolom menggunakan fase gerak kloroform-etanol-asam asetat. Uji potensi menggunakan difusi sumuran untuk mendapatkan fraksi aktif. Uji potensi fraksi aktif ekstrak serbuk kulit batang kemiri terhadap S. aureus dilakukan dengan menggunakan metode bioautografi kontak. Uji identifikasi kualitatif fraksi aktif dilakukan dengan Kromatografi Lapis Tipis (KLT).
Hasil penelitian menunjukkan fraksi [kloroform - etanol - asam asetat (90:5:5)] memiliki diameter zona hambat terbesar dan fraksi ini ditetapkan sebagai fraksi aktif. Pada uji KLT diperoleh dugaan kandungan senyawa aktifnya yaitu alkaloid indol. Pengujian potensi menggunakan metode bioautografi kontak tidak menunjukkan adanya potensi antibakteri dari alkaloid.
ABSTRACT
Candelnut (Alleurites moluccana L. Willd) bark is one of medicine plant used to diarrhea, purgative, infection wound, and constipation. The purpose of this research is know antibacterial potency of chloroform-ethanol-acetic acid fraction from chloroform extract of candelnut bark againts Staphylococcus aureus. This experiment was pure experimental research.
Extraction method that is used is kinetics remaseration with chloroform solvent. Then, it is cointinued by separation with Coloum Chromatography, and using a moving phase chloroform-ethanol-acetic acid. A potential test by using diffusion method to get active fraction. The active fraction potential test of candelnut bark powder extract againts S. aureus is done by using contact bioautography method. The qualitatif identification test of active fraction is done by using Thin Layer Chromatography (TLC) method.
The result shows that [chloroform – ethanol – acetic acid (90:5:5)] fractions have the biggest blocked zone diameter and this fraction determined as an active fraction. In TLC test, it is estimated that the active compound is indole alkaloida. Potential testing by using contact bioautography method does not show any antibacterial potency of alkaloid.
Keywords : candelnut bark, chloroform extract, chloroform – ethanol – acetic acid fraction, Coloum Chromatography, bioautography, Staphylococcus aureus, Thin Layer Chromatography, alkaloid.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, atas berkat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul UJI POTENSI ANTIBAKTERI FRAKSI KLOROFORM- ETANOL-ASAM ASETAT DARI EKSTRAK KLOROFORM KULIT BATANG KEMIRI [Aleurites moluccana (L.) Willd] TERHADAP Staphylococcus aureus. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S. Farm) Program Studi Ilmu Farmasi Universitas Sanata Dharma.
Skripsi ini dapat berjalan dan diselesaikan dengan baik berkat bantuan, dukungan dan kerjasama dari berbagai pihak. Oleh karena itu, penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Ign. Y. Kristio Budiasmoro, M.Si selaku dosen pembimbing yang telah meluangkan waktu untuk memberi bimbingan dan motivasi.
3. Ibu Erna Tri Wulandari, M.Si., Apt selaku dosen penguji yang telah meluangkan waktu untuk menguji dan memberikan masukan, kritik dan saran kepada penulis. 4. Ibu Yustina Sri Hartini, M.Si., Apt selaku dosen penguji yang telah meluangkan
waktu untuk menguji dan memberikan masukan, kritik dan saran kepada penulis. 5. Bapak dan Ibuku tercinta, terima kasih atas segala doa dan dukungan, semangat
6. Kakakku tersayang “Mba Yosi” dan adikku “Yogi” terima kasih atas segala doa, dorongan semangat dan dukungan yang selama ini telah diberikan.
7. Geraldus Yudhanto Sigit R. S. yang selalu memberikan semangat dan mengajariku untuk selalu mandiri dan pantang menyerah, serta atas semua kasih sayangnya sehingga dapat terselesaikannya skripsi ini.
8. Sahabatku Risma, Lia, Essther terimakasih atas persahabatan yang sampai saat ini telah terjalin.
9. Teman-temanku Essy, Fani, Silih, Endah, Nia, Dessy, Tata yang senantiasa memberiku semangat. “Aan” terima kasih editannya.
10.Teman seperjuangan dilab mikro Vian, Rosa, Tina, Nella, dll.
11.Mas Wagiran, Mas Sigit, Mas Sarwanto, Mas Andri, Mas Otok dan semua laboran yang telah banyak membantu selama penelitian ini dilaksanakan sehingga skripsi ini dapat terselesaikan.
12.Teman-teman kelas B angkatan 2003 khususnya kelompok praktikum D terima kasih atas tahun-tahun yang indah selama masa perkuliahan.
13.Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu penulis dalam menyelesaikan skripsi ini.
Semoga Tuhan Yang Maha Esa melimpahkan berkat dan kasih-Nya kepada semua pihak
yang telah membantu penulis dalam menyelesaikan skripsi ini.
Yogyakarta, 3 Juni 2007 Penulis
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAM PERSETUJUAN PEMBIMBING... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
INTISARI ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 2
2. Keaslian Penelitian ... 3
3. Manfaat Penelitian ... 3
B. Tujuan Penelitian ... 4
BAB II. PENELAAHAN PUSTAKA ... 5
1. Nama Tanaman ... 5
2. Pertelaan Morfologi ... 5
3. Kandungan Kimia ... 6
4. Khasiat dan Kegunaan ... 6
B. Alkaloid ... 6
C. Staphylococcus aureus ... 7
D. Penyarian ... 8
1. Penyarian dengan Pemanasan ... 8
2. Penyarian Dingin ... 9
E. Fraksinasi ... 1. Pengendapan ... 10
2. Ekstraksi pelarut-pelarut ... 10
3. Destilasi ... 11
4. Dialisis ... 11
5. Elektroforesis ... 11
6. Kromatografi ... 12
F. Kromatografi Lapis Tipis ... 13
G. Metode Pengukuran Potensi Antibakteri ... 14
1. Metode Dilusi ... 14
2. Metode Difusi ... 15
H. Metode Bioautografi ... 16
I. Landasan Teori ... 17
BAB III. METODOLOGI PENELITIAN ... 20
A. Jenis dan Rancangan Penelitian ... 20
B. Variabel Penelitian dan Definisi Operasional ... 20
1. Variabel Penelitian ... 20
11.Uji Senyawa Aktif Dari Fraksi Aktif dengan Metode Bioautografi Kontak ...
E. Analisis Hasil ……….. 31
29 BAB IV. HASIL DAN PEMBAHASAN ……….. 33
A. Identifikasi Tanaman ……….. 33
B. Pengumpulan Bahan ………... 33
C. Pengeringan dan Pembuatan Serbuk ………... 33
D. Ekstraksi Serbuk Kulit Batang Kemiri ... 34
E. Fraksinasi Dengan Kromatografi Kolom ... 37
F. Uji potensi antibakteri fraksi hasil kromatografi kolom dan pemilihan fraksi aktif ... G. Identifikasi kualitatif fraksi aktif dengan metode KLT ... 41
40 H. Uji potensi antibakteri fraksi aktif (fraksi V) terhadap Staphylococcus aureus dengan metode Bioautografi Kontak... 48
BAB V. KESIMPULAN DAN SARAN ... 51
A. Kesimpulan ... 51
B. Saran ... 51
DAFTAR PUSTAKA ... 53
LAMPIRAN ... 55
DAFTAR TABEL
Halaman 35 Tabel I. Hasil pengamatan uji tabung ekstrak kulit batang kemiri ...
Tabel II. Hasil fraksi kromatografi kolom serbuk kulit batang kemiri... 39 Tabel III. Rerata diameter zona hambat fraksi I, III, V terhadap
Staphylococcus aureus ... 41 Tabel IV. Hasil identifikasi fraksi kloroform p.a : etanol p.a : asam asetat
p.a (90:5:5) (fraksi V) alkaloid tersier dengan fase gerak
kloroform p.a : etanol p.a : asam asetat p.a (60:20:20) ... 43 Tabel V. Hasil identifikasi fraksi kloroform p.a : etanol p.a : asam asetat
p.a (90:5:5) (fraksi V) alkaloid kuartener dengan fase gerak
kloroform p.a : etanol p.a : asam asetat p.a (60:20:20)... 43 Tabel VI. Hasil Uji potensi antibakteri fraksi aktif (fraksi V) terhadap
Staphylococcus aureus dengan metode Bioautografi Kontak...
DAFTAR GAMBAR
Halaman 28 Gambar 1. Skema uji kualitatif fraksi aktif dengan metode KLT ...
Gambar 2. Skema penelitian uji potensi antibakteri fraksi kloroform-etanol-asam asetat dari ekstrak kloroform kulit batang
kemiri terhadap Staphylococcus aureus ... 30 Gambar 3. Reaksi pembentukan senyawa kompleks CAS dan alkaloid
indol ... 44 Gambar 4. Reaksi piridin dengan CAS ... 45 Gambar 5. Kromatogram fraksi V [kloroform p.a : etanol p.a : asam
asetat p.a (90:5:5)] alkaloid tersier ... 46 Gambar 6. Kromatogram fraksi V [kloroform p.a : etanol p.a : asam
asetat p.a (90:5:5)] alkaloid kuartener ...
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat Pengesahan Determinasi ………. 55 Lampiran 2. Foto Tanaman Kemiri [Aleurites moluccana (L.) Willd] .... 56 Lampiran 3. Foto Hasil Uji Potensi Antibakteri Fraksi Hasil
Pemisahan Kromatografi Kolom Terhadap
Staphylococcus aureus Secara Difusi Sumuran ... 57 Lampiran 4. Foto Hasil Uji Potensi Antibakteri Piridin sebagai Kontrol
Positif Terhadap Staphylococcus aureus Secara Difusi
Sumuran ... 58 Lampiran 5. Foto Hasil Kromatografi Lapis Tipis (KLT) Piridin
Dengan Fase Gerak Kloroform : Etanol : Asam Asetat
Glasial (60:20:20) ... 59 Lampiran 6. Foto Hasil Kromatografi Lapis Tipis (KLT) Alkaloid
tersier Dengan Fase Gerak Kloroform : Etanol : Asam
Asetat Glasial (60:20:20) ... 60 Lampiran 7. Foto Hasil Kromatografi Lapis Tipis (KLT) Alkaloid
Kuartener Dengan Fase Gerak Kloroform : Etanol : Asam
Asetat (60:20:20) ... 61 Lampiran 8. Hasil Uji Potensi antibakteri Alkaloid Tersier fraksi V
[Kloroform : Etanol : Asam Asetat Glasial (60:20:20)] Kulit Batang Kemiri Dengan Metode Bioautografi
Kontak Terhadap S. aureus ... 62 Lampiran 9. Hasil Uji Potensi antibakteri Alkaloid Kuartener fraksi V
[Kloroform : Etanol : Asam Asetat Glasial (60:20:20)] Kulit Batang Kemiri Dengan Metode Bioautografi
BAB I PENGANTAR A. Latar Belakang
Staphylococcus aureus merupakan bakteri patogen utama bagi manusia dan menjadi penyebab infeksi nosokomial. Staphylococcus cepat menjadi resisten terhadap banyak zat antimikroba sehingga menimbulkan masalah dalam pengobatan (Jawetz et al., 1995) dan sampai saat ini Staphylococcus aureus sudah resisten terhadap antibiotik golongan penisilin (MRSA). Untuk mengatasi masalah tersebut saat ini banyak dikembangkan obat baru. Salah satunya berasal dari tanaman obat yang berpotensi sebagai antibakteri.
Salah satu tanaman di Indonesia yang potensial sebagai tanaman obat adalah kemiri (Hutapea et al., 1993). Biji kemiri berkhasiat menyuburkan, menghitamkan rambut dan sebagai bumbu dapur. Sedangkan kulit batangnya untuk mengobati disentri, urus-urus, luka infeksi dan sembelit (Kardono et al., 2003).
Penelitian lain kulit batang kemiri yang telah dilakukan Melinda (2005) menyatakan bahwa fraksi etanol dan fraksi etil asetat kulit batang kemiri mengandung alkaloid golongan piridin–piperidin, dan didapat KHM fraksi etil asetat sebesar 10 mg/ml.
Penelitian ini merupakan serangkaian penelitian yang mengacu penelitian sebelumnya Melinda (2005). Penelitian ini menggunakan kloroform sebagai pelarut dalam remaserasi karena alkaloid mudah larut dalam kloroform (Mursyidi, 1990) sehingga diharapkan alkaloid dapat tersari secara optimal.
Ekstrak kloroform difraksinasi menggunakan tiga pelarut yang merupakan campuran dari kloroform-etanol-asam asetat dengan perbandingan yang berbeda. Fraksinasi dilakukan dengan metode kromatografi kolom. Fraksinasi ini dilakukan dengan harapan ekstrak akan terpisah menjadi beberapa fraksi. Sehingga dari fraksi ini dapat diketahui pelarut mana yang lebih optimal dalam menyari senyawa yang berpotensi antibakteri terhadap S. aureus.
Metode difusi sumuran digunakan untuk mengetahui potensi antibakteri fraksi hasil pemisahan kromatografi kolom yaitu fraksi kloroform p.a : etanol p.a (95:5), fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:8:2), dan fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) sedangkan metode bioautografi kontak digunakan untuk mengetahui zona hambat dari bercak senyawa-senyawa pada fraksi aktif yang berpotensial antibakteri sebagai hasil pemisahan Kromatografi Lapis Tipis (KLT).
Berdasarkan latar belakang diatas, maka penelitian tentang uji potensi antibakteri fraksi kloroform-etanol-asam asetat dari ekstrak kloroform kulit batang kemiri terhadap Staphylococcus aureus dapatlah dilakukan.
1. Permasalahan
Permasalahan dari penelitian ini adalah :
a. Apakah fraksi kloroform p.a : etanol p.a (95:5), fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:8:2), dan fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) dari ekstrak kloroform serbuk kulit batang kemiri mempunyai potensi antibakteri terhadap Staphylococcus aureus?
c. Identitas senyawa apakah yang terdapat dalam fraksi aktif antibakteri
Staphylococcus aureus?
d. Apakah dengan metode bioautografi kontak alkaloid yang terdapat dalam fraksi aktif mempunyai potensi antibakteri terhadap Staphylococcus aureus? 2. Keaslian Penelitian
Sejauh penelusuran yang dilakukan oleh penulis, penelitian tentang uji potensi antibakteri fraksi kloroform-etanol-asam asetat dari ekstrak kloroform kulit batang kemiri terhadap Staphylococcus aureus belum pernah dilakukan. 3. Manfaat Penelitian
a. Manfaat Teoritis
Penelitian ini diharapkan mampu memberi informasi yang berguna untuk mengembangkan ilmu pengetahuan khususnya dibidang kesehatan tentang senyawa aktif dalam kulit batang kemiri yang berpotensi sebagai antibakteri. b. Manfaat praktis
B. Tujuan Penelitian Penelitian ini bertujuan :
a. Mengetahui potensi antibakteri fraksi kloroform p.a : etanol p.a (95:5), fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:8:2), dan fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) dari ekstrak kloroform serbuk kulit batang kemiri terhadap Staphylococcus aureus.
b. Mengetahui fraksi mana yang aktif terhadap Staphylococcus aureus.
c. Mengetahui identitas senyawa yang terdapat dalam fraksi aktif antibakteri
Staphylococcus aureus.
BAB II
PENELAAHAN PUSTAKA
A. Deskripsi Tanaman 1. Nama Tanaman
Kemiri [Aleurites moluccana (L.) Willd] memiliki sinonim Aleurites triloba Forst.; A. javanica Gand,. Kemiri termasuk dalam suku Euphorbiaceae (Hutapea et al., 1993).
Nama umum/dagang: kemiri. Nama daerah di Sumatera: kereh (Aceh), Hambiri (Batak), Buah Koreh (Minangkabau), Kemiri (melayu). Di Jawa: Muncang (Sunda), Kemiri (Jawa), Komere (Madura). Di Bali: Kameri. Di Nusa Tenggara: Kawilu. Di Sulawesi: Sapiri (Makasar), Ampiri (Bugis), Bintalo dudulaa (Gorontalo). Di Maluku: Sekete (Ternate), Hagi (Buru) (Hutapea et al., 1993)
2. Pertelaan Morfologi
Pohon kemiri mempunyai tinggi 25-30 m. batangnya tegak, berkayu, permukaan banyak lentisel, percabangan simpodial, pada batang sebelah atas terdapat tonjolan bekas melekatnya tangkai daun, coklat. Daunnya tunggal, berseling, lonjong, tepi rata, bergelombang, ujung runcing, pangkal tumpul, pertulangan menyirip, permukaan atas licin, bawah halus, panjang 18-25 cm, lebar 7-11 m, tangkai silindris, panjang 10-15 cm, hijau. Bunga majemuk, bentuk malai, berkelamin dua, diujung cabang, tangkai silindris, panjang 2-3, 5 cm, hijau kecoklatan, kelopak lonjong, permukaan bersisik rapat, hijau, benang sari jumlah 5-8 buah, tangkai sari bulat, merah, kepala sari bentuk kerucut, merah, putik bulat, putih,
mahkota putih. Buahnya kotak, bulat telur, beruas-ruas, panjang ± 7 cm, lebar ± 6,5 cm, masih muda hijau setelah tua coklat, berkeriput. Biji bulat, berkulit keras, berusuk atau beralur, diameter ± 3,5 cm, berdaging, berminyak, putih kecoklatan. Akar tunggang, coklat (Hutapae et al., 1993).
3. Kandungan Kimia
Fraksi etanol dan fraksi etil asetat kulit batang kemiri mengandung alkaloid golongan piridin–piperidin (Melinda, 2005)
4. Khasiat dan kegunaan
Kulit batang kemiri digunakan dalam pengobatan secara tradisional, diantaranya sebagai obat disentri, urus-urus, luka infeksi, sembelit (Kardono et al., 2003).
B. Alkaloid
Alkaloid adalah senyawa basa nitrogen organik yang terdapat dalam tumbuhan. Kebanyakan alkaloid menunjukkan aktifitas fisiologis tertentu sehingga metabolit sekunder ini banyak digunakan sebagai obat. Isolasi alkaloid dari simplisia pada umumnya dilakukan dengan cara penyarian menggunakan pelarut organik tak campur air, misal kloroform atau eter (Mursyidi, 1990)
dalam pelarut organik. Alkaloid dapat mengendap antara lain dengan penambahan pereaksi Dragendroff dan Mayer. Sifat ini banyak digunakan sebagai salah satu cara identifikasi alkaloid (Mursyidi, 1990).
Alkaloid yang terkandung dalam suku Euphorbiaceae antara lain alkaloid tropan, piperidin, dan alkaloid indol. Alkaloid golongan indol, steroid, kinolin, dan piridin-piperidin merupakan golongan alkaloid yang mempunyai aktivitas antibakteri yang lebih sensitif pada bakteri Gram positif dibanding bakteri Gram negatif (Roberts, 1998).
C. Staphylococcus aureus
Staphylococcus aureus termasuk familia Micrococcaceae (Salle, 1961).
S. aureus merupakan bakteri Gram positif, berbentuk coccus dengan diameter 0,5 – 1,5 µm, bersifat anaerob fakultatif dan non motil, dan tidak membentuk spora, dinding selnya mengandung peptidoglikan dan asam teikoat (Pelczar & Chan, 1986).
S. aureus membentuk koloni berwarna abu-abu sampai kuning emas tua, menghasilkan katalase dan menghasilkan bentuk koagulase-positif, hal ini membedakannya dari spesies lain. Bakteri S. aureus memberikan hemolisis tipe β, leukosidin, eksotoksin, selain itu juga dapat melisiskan gumpalan fibrin (Jawetz et al., 1995).
Staphylococcus aureus merupakan jenis bakteri yang sudah resisten terhadap antibiotik golongan penisilin, sering disebut sebagai MRSA (Methicilin-resistant
beberapa tipe infeksi S. aureus sepanjang hidupnya, bervariasi mulai dari keracunan makanan atau infeksi kulit ringan sampai infeksi berat (Jawetz et al., 1995).
D. Penyarian
Pada umumnya penyarian dibagi menjadi dua yaitu penyarian dengan pemanasan dan penyarian dingin
1. Penyarian dengan pemanasan a. Infundasi
Infundasi merupakan proses penyarian yang umumnya digunakan untuk menyari kandungan zat aktif yang larut dalam air, berasal dari bahan-bahan nabati. Hasil penyarian secara infundasi disebut infus. Infus dibuat dengan cara membasahi dan menambah bahan simplisia dengan air sebanyak dua kali bobot bahan, dipanaskan selama 15-20 menit pada suhu 90-98°C. Karena penyarian menggunakan air maka hasil penyarian tidak stabil dan mudah tercemar oleh kapang dan jamur, oleh sebab itu sari ini tidak boleh disimpan lebih dari 24 jam (Anonim, 1986b).
b. Penyarian berkesinambungan
pelarut yang relatif konstan. Jumlah pelarut yang digunakan juga relatif sedikit. (Anonim, 1986b).
2. Penyarian dingin a. Maserasi
Maserasi merupakan cara penyarian simplisia yang memakai pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan. Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari. Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol atau pelarut lain (Anonim, 1986b).
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Kerugian cara maserasi adalah pengerjaannya lama dan penyariannya kurang sempurna. Pada penyarian dengan cara maserasi perlu dilakukan pengadukan. Pengadukan diperlukan untuk meratakan konsentrasi larutan diluar butir serbuk simplisia (Anonim, 1986b).
b. Perkolasi
E. Fraksinasi
Komponen yang berada dalam campuran, seperti ekstrak yang berasal dari organisme hidup dapat dipisahkan ke dalam beberapa kelompok yang mempunyai persamaan karakter fisika-kimianya. Proses ini disebut fraksinasi dan dapat dilakukan dalam berbagai metode. Metode yang digunakan antara lain :
1. Pengendapan
Campuran dapat diendapkan dengan berbagai metode. Pengendapan dapat digunakan untuk memindahkan bahan yang tidak diinginkan dan mempertahankan bahan yang penting dalam larutan. Metode yang paling sederhana adalah dengan menurunkan temperatur larutan. Komponen yang kurang larut dapat diendapkan dan dipisahkan dengan sentrifugasi atau filtrasi. Cara lainnya yaitu dengan mengubah polaritas pelarut dengan menambahkan pelarut yang dapat bercampur dengan polaritas yang berbeda. Salting out juga merupakan salah satu cara fraksinasi dengan pengendapan yaitu dengan menambahkan ekstrak berair dengan larutan elektrolit yang sangat larut air sehingga bahan non-ionik akan terendapkan (Houghton, 1988) 2. Ekstraksi pelarut-pelarut
mengandung air contohnya pelarut kloroform dan diklorometan. Sehingga penggunaan pelarut ini sebaiknya dihindari, namun bila tetap digunakan sebaiknya campuran digojog dengan lembut (Houghton, 1988).
3. Destilasi
Pemisahan campuran yang mengandung komponen volatile efektif dipisahkan dengan destilasi. Alat yang digunakan pada fraksinasi ini adalah destilator. Cara ini dilakukan secara ekstensif dalam industri, namun penggunaannya terbatas untuk fraksinasi ekstrak tanaman dan hanya dapat dipakai untuk minyak
volatile (minyak esensial) (Houghton, 1988). 4. Dialisis
Dialisis merupakan metode pemisahan komponen dari suatu campuran berdasarkan ukuran molekulnya. Bagian yang penting dari prosedur ini adalah membran semipermeabel yang tipis yang mengandung polimer dengan pori-pori tertentu yang memberikan jalan untuk molekul kecil (massa molekul < 1000 dalton). Molekul dengan ukuran yang lebih besar tidak mungkin dapat lewat. Tekanan osmotik yang mendekati molekul berukuran kecil dalam suatu campuran mampu melewati membran sedangkan molekul yang lebih besar tertinggal (Houghton, 1988). 5. Elektroforesis
metode analisis suatu campuran dalam jumlah kecil yang mengandung molekul bermuatan terutama protein, peptida dan asam amino (Houghton, 1988).
6. Kromatografi
Prosedur kromatografi merupakan teknik yang digunakan secara luas pada fraksinasi ekstrak. Teknik ini tidak diragukan lagi untuk isolasi banyak senyawa alam. Kromatografi terdiri dari dua fase yaitu fase diam dan fase gerak. Fase diam untuk prosedur fraksinasi biasanya berupa padatan. Proses kromatografi terjadi akibat adanya kesetimbangan dinamik zat terlarut pada dua fase.
Berdasarkan distribusinya, kromatografi dibagi menjadi dua yaitu adsorpsi dan partisi. Adsorpsi merupakan distribusi senyawa diantara permukaan padat dan cairan, sedangkan partisi merupakan distribusi senyawa diantara dua cairan yang tidak saling campur.
F. Kromatografi Lapis Tipis (KLT)
Kromatografi Lapis Tipis (KLT) ialah metode pemisahan fisikokimia. Prinsip Kerja KLT yaitu berupa lapisan yang memisahkan terdiri atas bahan berbutir-butir (fase diam), ditempatkan pada penyangga berupa pelat gelas, logam atau lapisan yang cocok. Campuran yang akan dipisahkan berupa larutan, ditotolkan berupa bercak atau pita. Kemudian pelat atau logam ditaruh di dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak) pemisahan terjadi selama pengembangan. Senyawa yang tidak berwarna harus ditampakkan (Stahl, 1985). KLT dipakai dengan dua tujuan. Pertama, dipakai sebagai metode untuk mencapai hasil kualitatif, kuantitatif atau preparatif. Kedua dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom (Gritter et al., 1991).
Pada dasarnya KLT melibatkan dua peubah : sifat fase diam dan sifat fase gerak. Fase diam dapat berupa serbuk halus yang berfungsi sebagai permukaan penyerap (kromatografi cair-padat) atau berfungsi sebagai penyangga untuk lapisan zat cair (kromatografi cair-cair). Fase diam yang paling umum dipakai adalah silika gel (asam silikat), alumina (alumunium oksida), kiselgur (tanah diatome), dan selulosa (Gritter, 1991).
bergerak didalam fase diam karena adanya gaya kapiler sehingga menghasilkan pemisahan senyawa berdasarkan sifat kepolarannya (Stahl, 1985).
Menurut Cordell (1981) sistem KLT untuk alkaloid golongan piridin biasanya menggunakan fase gerak Kloroform : Metanol : Asam asetat ( 60:10:1) dan fase diam yang digunakan adalah Silika Gel G.
Identifikasi dari senyawa-senyawa yang terpisah dikerjakan dengan pereaksi kimia dan reaksi-reaksi warna. Identifikasi senyawa menggunakan harga Rf, harga Rf didefinisikan sebagi berikut:
Harga-harga Rf untuk senyawa-senyawa murni kemudian dibandingkan dengan harga-harga standar (Sastrohamidjojo, 2002).Angka Rf berjarak antara 0,00 dan 1,00 dan hanya dapat ditentukan dua desimal (Stahl, 1985).
G. Metode Pengukuran Potensi Antibakteri Metode pengukuran antibakteri dapat dibedakan menjadi 2 yaitu: 1. Metode dilusi
2. Metode difusi
Dilakukan dengan cara menempatkan obat pada media padat yang telah ditanami dengan biakan bakteri. Metode difusi ada beberapa cara :
a. Cara Kirby Bauer
Metode ini dilakukan dengan mengoleskan permukaan media agar dengan kapas yang telah dicelupkan ke dalam suspensi bakteri, kemudian diletakkan kertas samir yang mengandung antibakteri diatasnya, diinkubasikan pada 37°C selama 18-24 jam. Hasilnya dibaca berupa zona radikal dan irradikal. Zona radikal adalah suatu daerah di sekitar kertas samir (disk) yang tidak ditemukan sama sekali pertumbuhan bakteri. Sedangkan zona irradikal adalah suatu daerah sekitar disk yang pertumbuhan bakteri dihambat tetapi tidak dimatikan (Anonim, 1986a).
b. Cara sumuran
Penyiapan dilakukan seperti cara Kirby Bauer. Setelah biakan siap, dibuat sumuran dengan diameter tertentu dan tegak lurus terhadap permukaan media, ke dalam sumuran ini diteteskan larutan uji lalu diinkubasi selama 24-48 jam pada suhu 37°C. Hasilnya dibaca sama seperti cara Kirby Bauer (Anonim, 1986a).
c. Cara pour plate
H. Metode Bioautografi
Dalam mengevaluasi campuran antibakteri pada KLT, ada 2 metode yang digunakan untuk mengetahui bercak atau komponen yang aktif dan juga yang tidak aktif sebagai antibakteri, kedua metode tersebut adalah: deteksi mikrobiologi (bioautografi) dan deteksi kimia dengan reaksi warna spesifik. Bioautografi merupakan metode universal untuk mengetahui antibiotik yang belum diketahui komponennya. Keuntungan metode deteksi kimia yaitu waktu pengerjaannya yang lebih cepat dibanding bioautografi (bioautografi membutuhkan waktu 6-16 jam tergantung dari pertumbuhan mikroorganisme), namun metode deteksi kimia tidak dapat menunjukkan aktifitas biologi dari campuran dan metode deteksi kimia hanya dapat dilakukan apabila ditemukan reagen yang cocok. Deteksi kimia dengan reaksi warna spesifik digunakan sebagai pembanding hasil bioautografi sehingga kedua metode diatas saling melengkapi (Stahl, 1969).
Dalam prakteknya, kromatogram diletakkan pada permukaan media agar di dalam petri yang telah telah diinokulasi dengan mikroorganisme yang sensitif untuk antibiotik yang dipelajari. Setelah diinkubasi selama 15-20 jam pada temperatur kira-kira 37°C akan tampak zona hambat pada lapisan media agar, dimana antibiotik berdifusi ke lapisan tersebut dan menghambat pertumbuhan mikroorganisme. Sedangkan lapisan media agar yang ditumbuhi mikroorganisme akan tampak buram. Cara ini disebut bioautografi kontak (Zweig dan Whitaker, 1971).
diinkubasi, kemudian media agar dibiarkan beberapa waktu. Daerah yang ditumbuhi oleh organisme akan berwarna merah sedangkan daerah hambatan akan berwarna jernih. Selain larutan tersebut dapat juga digunakan larutan 2,3,5-trifeniltetrazolium klorida dan larutan 2,6-diklorofenol indofenol setelah 4 jam diinkubasi. Kemudian media tersebut diinkubasi lagi selama 30 menit. Zona hambat akan berwarna biru (Zweig dan Whitaker, 1971 ; Wagman dan Weinstein, 1973).
Larutan tetrazolium digunakan untuk mendeteksi zona hambat pada metode bioautografi immersi dan bioautografi langsung. Dimana pada bioautografi immersi
kromatogram ditutup dengan agar yang masih cair. Setelah agar memadat kemudian diinkubasi. Kekurangan dari bioautografi immersi yaitu adanya pengenceran antibakteri pada lapisan agar selama agar masih berbentuk cair sehingga zona hambat yang terjadi dapat menyebar (Choma, 2005).
Bioautografi langsung dilakukan dengan mencelupkan atau menyemprot suspensi bakteri yang dicampur dengan larutan tetrazolium. Kemudian plat diinkubasi. Cara ini yang paling rumit dan alat yang digunakan lebih mahal dibandingkan bioautografi kontak (Choma, 2005).
I. Landasan teori
Kulit batang kemiri digunakan dalam pengobatan secara tradisional, diantaranya sebagai obat disentri, urus-urus, luka infeksi, sembelit (Kardono et al., 2003).
Hampir setiap orang akan mengalami beberapa tipe infeksi S. aureus sepanjang hidupnya, bervariasi mulai dari keracunan makanan atau infeksi kulit ringan sampai infeksi berat (Jawetz et al., 1995).
Fraksi etil asetat kulit batang kemiri mengandung alkaloid golongan piridin– piperidin sebagai antibakteri pada Staphylococcus aureus dengan KHM sebesar 10 mg/ml dan dapat diisolasi dengan metode KLT (Melinda, 2005). Piridin-piperidin merupakan golongan alkaloid yang mempunyai aktivitas antibakteri yang kuat maupun lemah ( Roberts, 1998).
Remaserasi kinetik digunakan sebagai metode penyarian. Dengan metode remaserasi, senyawa yang terdapat dalam serbuk kulit batang kemiri dapat tersari seluruhnya karena adanya pengulangan maserasi dengan penggantian pelarut setiap 24 jam. Dengan adanya kinetik dapat mengoptimalkan jumlah senyawa yang dapat larut dalam kloroform. Selain itu metode ini mudah dan sederhana (Mursyidi, 1990). Penggunaan kloroform diharapkan mampu menyari alkaloid dari kulit batang kemiri yang berpotensi sebagai antibakteri.
etanol p.a : asam asetat p.a (90:5:5). Etanol digunakan sebagai pengganti metanol karena metanol bersifat toksik. Karena metanol mempunyai nilai kepolaran 5,1 dan etanol 5,2 maka perbandingan jumlah etanol yang digunakan lebih sedikit. Hal ini bertujuan supaya kepolaran pelarut mendekati kepolaran fase gerak kloroform : metanol : asam asetat (60:10:1) sehingga alkaloid tersari di fase gerak ini.
Metode bioautografi kontak adalah metode yang dapat digunakan untuk mendeteksi bercak pada kromatogram hasil KLT yang punya potensi antibakteri. Bercak yang mempunyai potensi antibakteri dapat dideteksi dengan membandingkan harga Rf antara zona hambat yang terbentuk dengan harga Rf pembanding (piridin).
J. Hipotesis
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan rancangan penelitian acak lengkap pola searah. Penelitian ini dilakukan di laboratorium Farmakognosi Fitokimia dan Laboratorium Mikrobiologi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
a. Variabel bebas
Beberapa fraksi hasil pemisahan kromatografi kolom. b. Variabel tergantung
Diameter zona hambat terhadap pertumbuhan S. aureus.
c. Variabel terkendali
Umur tanaman kemiri ± 6 tahun diambil dari lingkungan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta, kondisi tempat tumbuh tanaman, waktu remaserasi 3 x 24 jam, waktu inkubasi bakteri uji 24 jam, suhu inkubasi bakteri uji 370C, volume dan jenis media pertumbuhan mikroba uji yaitu nutrien agar (NB dan NA).
2. Definisi Operasional
a. Potensi antibakteri adalah kemampuan fraksi kloroform p.a : etanol p.a (95:5), fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:8:2), dan fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) dari ekstrak kloroform kulit batang kemiri untuk menghambat atau membunuh bakteri Staphylococcus aureus dalam biakan murni NA.
b. Kulit batang kemiri adalah kulit batang dari tanaman kemiri yang berumur ± 6 tahun yang merupakan bagian luar dari bagian kayu yang berbatasan dengan kambium batang.
c. Ekstrak Kloroform adalah semua zat yang terkandung dalam kulit batang kemiri yang tersari dalam kloroform dengan ekstraksi menggunakan metode remaserasi kinetik.
d. Fraksi adalah hasil pemisahan dari kromatografi kolom dalam berbagai variasi perbandingan pelarut yaitu fraksi I [kloroform p.a : etanol p.a (95:5)], fraksi III [kloroform p.a : etanol p.a : asam asetat p.a (90:8:2)], dan fraksi V [kloroform p.a : etanol p.a : asam asetat p.a (90:5:5)].
e. Fraksi aktif adalah fraksi yang didapat dari pemisahan dengan kromatografi kolom yang mempunyai zona hambat terhadap pertumbuhan S. aureus terbesar di sekitar sumuran.
g. Difusi sumuran adalah metode yang digunakan untuk menguji potensi antibakteri fraksi kloroform p.a : etanol p.a (95:5), fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:8:2), dan fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) dari ekstrak kloroform kulit batang kemiri terhadap S. aureus.
h. Bioautografi kontak adalah metode untuk mendeteksi bercak senyawa pada kromatogram hasil KLT fraksi aktif yang mempunyai potensi sebagai antibakteri terhadap bakteri S. aureus.
C. Bahan dan alat Penelitian 1. Bahan
Bahan-bahan yang digunakan dalam penelitian ini yaitu kulit batang kemiri yang didapat dari lingkungan fakultas farmasi Universitas Sanata Dharma Yogyakarta; Kultur murni S. aureus didapat dari laboratorium mikrobiologi Fakultas Farmasi Universitas Gadjah Mada Yogyakarta; Medium Nutrien Agar (NA) (Oxoid); Medium Nutrien broth (NB); DMSO; Petroleum eter t.k; kloroform t.k; aquadest steril; fase diam : silica gel GF 254 p.a. (E. Merck); NaSO4 anhidrat; larutan standar Mac Farland II (setara dengan kepadatan bakteri 6.108 (CFU/ml); fase gerak kloroform p.a : etanol p.a (95:5); fase gerak kloroform p.a : etanol p.a : asam asetat p.a (90:8:2); fase gerak kloroform p.a : etanol p.a : asam asetat p.a (90:5:5); pereaksi semprot Cerium Amonium Sulfat.
2. Alat
spreader dan piring petri; pelubang sumuran; platform shaker (Innova 2100, New Brunswick Scientific); seperangkat alat kromatografi kolom; corong buchner (New Cartle, Staffs, England); penangas air (Mammert); rotaevaporator (Janke dan Kunkel, Ika-Labotecchnik, RV 05-ST); autoclave (Model KT-40, ALP Co. Ltd Hamurasi Tokyo Japan); inkubator (Mammert, tipe BE 400, GmbH+CoKG-D91126, Swahaban FRG Germany);oven (memmert); microbiological safety cabinet, neraca analitik (Scaltec Instruments Heiligen Stadt Germany); lampu spiritus; jarum ose, spreader; batang pengaduk; flakon dan cawan porselen; tempat pengembangan (Chamber) KLT; pipa mikro kapiler; kertas saring dan penyemprot reagen penampak; lampu UV 254 dan UV 365 nm.
D. Tata Cara Penelitian 1. Identifikasi Tanaman
Identifikasi tanaman dilakukan secara makroskopis di Laboratorium Kebun Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta dengan cara mencocokkan hasil determinasi tanaman (bagian bunga dan daun) dengan pustaka (Kardono, 2003). Identifikasi dilakukan di laboratorium Farmakognosi Fitokimia, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Pengumpulan Bahan
batang dicuci dengan air mengalir kemudian ditiriskan untuk menghilangkan sisa-sisa air cucian. Selanjutnya dipotong kecil-kecil.
3. Pengeringan dan Pembuatan Serbuk
Kulit batang dikeringkan dengan menggunakan oven pada suhu 60°C selama ± 2 hari. Pengeringan dilakukan hingga kulit batang tersebut mudah dipatahkan. Lalu diserbuk dan diayak hingga didapat serbuk yang halus.
4. Uji Tabung a. Uji alkaloid
Dua gram serbuk kulit batang dipanaskan dalam tabung reaksi dengan 10 ml HCL 1%. Selama 30 menit di waterbath. Suspensi disaring dengan kapas ke dalam tabung reaksi A, larutan A dibagi tiga sama banyak, lalu kedalam larutan A1 ditambah 5 tetes dragendroff LP, larutan A2 ditambah 5 tetes mayer LP dan pada larutan A3 ditambah 5 tetes bouchardat LP . Bila terbentuk endapan dengan ketiga pereaksi tersebut berarti menunjukkan adanya alkaloid.
b. uji polifenol
Dua gram serbuk kulit batang kemiri dipanaskan dengan 10 ml air selama 10 menit dengan waterbath. Disaring panas-panas, setelah dingin ditambah 3 tetes pereaksi besi (III) klorida. Bila didapatkan warna hijau-biru menunjukkan adanya polifenol.
5. Pembuatan Ekstrak Kloroform
selama 1 jam. Lalu disaring dengan corong buchner, filtrat dibuang, ampas dikeringkan dengan oven pada suhu 30°C hingga bau petroleum eter hilang. Ampas dimaserasi menggunakan kloroform sebanyak 350 ml, digojog dengan shaker (170 rpm) selama 24 jam. Disaring dengan corong buchner hingga didapat filtrat I dan ampas I. Ampas I dimaserasi ulang dengan menggunakan kloroform seperti cara diatas. Campuran disaring dengan corong buchner hingga didapat filtrat II dan ampas II. Ampas II dimaserasi ulang dengan menggunakan kloroform kembali seperti cara diatas kemudian disaring, didapat filtrat III. Filtrat I, II dan III dijadikan satu kemudian diuapkan dengan rotaevaporator, setelah itu dipekatkan diatas penangas air hingga didapat ekstrak kental kloroform.
6. Preparasi Sampel dan Penyiapan Kolom Kromatografi
Larutan berupa ekstrak kental, diencerkan dengan kloroform. Kolom dicuci dengan aquadest dan dibilas dengan kloroform. Kolom dipasang pada statif setinggi ± 20 cm lalu kran ditutup.
7. Preparasi Fase diam, dan Fase Gerak Kromatografi Kolom
8. Fraksinasi Ekstrak Kloroform dengan Kromatografi Kolom
Sample sebanyak 1,0 ml dimasukkan ke dalam kolom. Tunggu sampel hampir masuk semua kedalam fase gerak kemudian fase gerak kloroform p.a : etanol p.a (95:5) dialirkan melalui dinding kolom. Fase gerak dialirkan kembali sehingga diatas fase diam selalu terdapat eluen ± 1 cm. Menampung eluen didalam erlenmeyer sebanyak 90 ml (fraksi I), dipisahkan. Kemudian fase gerak diganti dengan kloroform p.a : etanol p.a : asam asetat p.a (90:8:2). Fase gerak kloroform p.a : etanol p.a : asam asetat p.a (90:8:2) dialirkan, alirkan fase gerak kembali hingga selalu terdapat ± 0,5 cm fase gerak. Eluen ditampung di dalam erlenmeyer sebanyak 20 ml (fraksi II), dipisahkan. Fase gerak kloroform p.a : etanol p.a : asam asetat p.a (90:8:2) dialirkan kembali hingga selalu terdapat ± 0,5 cm fase gerak. Eluen ditampung hingga didapat 90 ml (fraksi III), dipisahkan. Fase gerak diganti dengan kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) kemudian dialirkan hingga selalu terdapat ± 0,5 cm fase gerak. Eluen ditampung di dalam erlenmeyer yang berbeda hingga didapat eluen sebanyak 20 ml (fraksi IV), dipisahkan. Fase gerak kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) dialirkan kembali dan selalu terdapat ± 0,5 cm fase gerak. Eluen ditampung di dalam erlenmeyer hingga didapat 90 ml (fraksi V), dipisahkan. Semua fraksi dipekatkan diatas waterbath hingga didapat fraksi kental.
9. Uji Potensi Antibakteri Tiap fraksi dan Pemilihan Fraksi Aktif a. Pembuatan Suspensi bakteri S. aureus
Bakteri uji dari kultur murni diambil 1 ose lalu diinokulasikan dalam 5 ml NB
dengan larutan standar Mc Farland II (setara dengan kepadatan bakteri 6.108 CFU/ml).
b. Pembiakan bakteri uji secara pour plate
Sebanyak 1,0 ml suspensi bakteri diinokulasikan ke dalam erlenmeyer yang berisi agar cair yang telah disterilisasi dan didinginkan pada suhu 45°C. Kemudian divortex untuk menghomogenkan bakteri, campuran dituang ke dalam cawan petri steril dan dibiarkan memadat.
c. Pengujian dan Penentuan Fraksi Aktif
Dibuat lubang sumuran pada media agar yang telah diinokulasikan bakteri
Staphylococcus aureus. Fraksi diencerkan dengan DMSO, kedalam lubang sumuran dimasukkan berbagai macam fraksi yang telah diencerkan (fraksi I, III, dan V), kontrol positif, kontrol negatif dan kontrol kerja yang berupa tambalan media NA. Inkubasi selama 24 jam pada suhu 37°C. Setelah 24 jam, diamati zona hambat yang terbentuk. Zona hambat dengan diameter terbesar dipilih sebagai fraksi aktif.
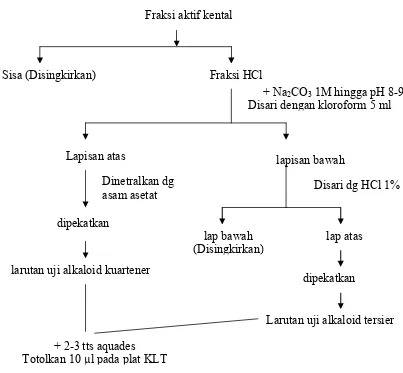
10. Uji Kualitatif Fraksi Aktif Dengan Metode KLT
Fraksi aktif kental disari dengan HCl 1% sebanyak 5 ml diatas waterbath
kental alkaloid tersier dan kuartener tersebut dilarutkan menggunakan 2-3 tetes aquades. Larutan uji ditotolkan 10 µl pada plat KLT yang telah diaktifkan, kemudian dikembangkan menggunakan fase gerak kloroform p.a : etanol p.a : asam asetat p.a (60:20:20) hingga mencapai 5 cm, plat diangkat kemudian diangin-anginkan sampai kering. Setelah kering plat dikembangkan sekali lagi hingga mencapai batas 10 cm kemudian diamati pada UV 245 nm dan 365 nm. Dilakukan uji identifikasi senyawa hasil KLT dengan pereaksi warna CAS, kemudian hasilnya dibandingkan dengan pembanding.
lapisan bawah
Sisa (Disingkirkan) Fraksi HCl
Lapisan atas Totolkan 10 µl pada plat KLT
+ Na2CO3 1M hingga pH 8-9
11. Uji Senyawa Aktif Dari Fraksi Aktif Dengan Metode Bioautografi Kontak Masing-masing fraksi kental alkaloid tersier dan kuartener dilarutkan menggunakan 2-3 tetes aquades. Fase gerak yang digunakan adalah kloroform p.a : etanol p.a : asam asetat p.a (60:20:20). Senyawa ditotolkan 10 µl kemudian dikembangkan mencapai batas 5 cm, plat diangkat kemudian diangin-anginkan sampai bau fase gerak hilang. Setelah itu plat dikembangkan sekali lagi hingga mencapai batas 10 cm. Fase gerak dikeringkan selama 24 jam didalam oven pada suhu 40°C, masing-masing plat (alkaloid tersier dan kuartener) ditempelkan pada permukaan media agar di dalam petri yang telah diinokulasi dengan bakteri uji yaitu
Pembuatan ekstrak kloroform
Fraksinasi ekstrak kloroform dengan kromatografi kolom
Uji potensi antibakteri tiap fraksi dengan metode sumuran - fase diam : silika gel GF 254
- fase gerak :
1. kloroform p.a : etanol p.a (95:5)
2. kloroform p.a : etanol p.a : asam asetat p.a (90:8:2) 3. kloroform p.a : etanol p.a : asam asetat p.a (90:5:5)
Maserasi menggunakan pelarut kloroform Uji tabung
- uji alkaloid - uji polifenol
- Pengeringan dengan oven 600C - Pengayakan dan Penyerbukan Pengeringan dan pembuatan serbuk
- diameter 4-12 cm Identifikasi tanaman
Identifikasi kualitatif fraksi
Uji potensi antibakteri fraksi aktif terhadap S. aureus
dengan metode Bioautografi kontak
Analisis hasil
Gambar 2. Skema Penelitian uji potensi antibakteri fraksi kloroform-etanol-asam asetat dari ekstrak kloroform kulit batang kemiri terhadap Staphylococcus aureus
E. Analisis Hasil
tidaknya zona hambat yang ditimbulkan oleh bercak kromatogram yang diletakkan pada media NA yang telah diinokulasi bakteri uji S. aureus.
BAB IV
HASIL DAN PEMBAHASAN
A. Identifikasi Tanaman
Identifikasi tanaman dilakukan pada awal penelitian. Pengidentifikasian ini bertujuan untuk memastikan bahwa tanaman yang digunakan benar-benar merupakan tanaman yang dimaksud, yaitu kemiri [Alleurites moluccana (L.) Willd]. Identifikasi dilakukan dengan menggunakan buku panduan monografi dan deskripsi tanaman (Kardono et al., 2003).
B. Pengumpulan Bahan
Bahan yang digunakan adalah kulit batang pohon kemiri yang berumur ± 6 tahun. Kulit batang diambil dari cabang berdiameter 4-12 cm, karena diharapkan cabang yang berdiameter 4-12 cm sudah cukup tua dan kandungan alkaloid di dalamnya cukup banyak. Pencucian kulit batang dengan air mengalir bertujuan untuk membersihkan kulit batang dari kotoran-kotoran yang menempel. Penggunaan air mengalir untuk mencegah menempelnya kembali kotoran pada kulit batang kemiri. Sisa air ditiriskan kemudian kulit batang dipotong-potong supaya proses pengeringan menjadi cepat dan merata pada setiap bahan.
C. Pengeringan dan Pembuatan Serbuk
Kulit batang dipotong kemudian dikeringkan dalam oven pada suhu 60°C selama ± 2 hari. Pengeringan dilakukan untuk mengurangi kadar air yang ada dalam simplisia. Kadar air tersisa kurang lebih 10%, ditandai dengan kulit batang yang
mudah dipatahkan sehingga simplisia tidak mudah rusak dan dapat disimpan dalam waktu yang cukup lama (Anonim,1985). Pengurangan kadar air ini bertujuan untuk menghindari tumbuhnya jamur, kapang, atau bakteri yang dapat merusak simplisia, selain itu dapat menekan terjadinya peruraian senyawa kimia akibat reaksi enzimatis yang bisa menimbulkan perubahan senyawa aktif (Anonim, 1986b).
Setelah dikeringkan, kulit batang diserbuk dan diayak dengan ayakan yang tiap 1 inchinya terdapat 28 lubang. Penyerbukan dan pengayakan dilakukan untuk memperkecil ukuran partikel bahan, karena dengan kecilnya ukuran partikel maka akan memperluas permukaan partikel yang kontak dengan cairan penyari, sehingga diharapkan penyarian akan lebih efektif.
D. Ekstraksi Serbuk Kulit Batang Kemiri
ditambah 5 tetes pereaksi mayer (mengandung merkuri). Pengujian dengan reagen bouchardat (mengandung iodin) juga menunjukkan kulit batang kemiri positif mengandung alkaloid, hal ini ditunjukkan dengan terbentuknya endapan berwarna coklat kemerahan. Pada uji polifenol didapatkan hasil positif dengan terbentuknya warna hijau kebiruan.
Tabel I. Hasil pengamatan uji tabung ekstrak kulit batang kemiri
No. PENGUJIAN PENGAMATAN HASIL
1
Uji Alkaloid
FiltratA1 + dragendroff LP Filtrat A2 + mayer LP Filtrat A3 + bouchardat LP
Terbentuk endapan coklat
Filtrat + FeCl3 Hijau kebiruan +
Uji polifenol merupakan uji pendahuluan yang digunakan untuk mengetahui adanya gugus fenol. Penelitian ini memfokuskan pada alkaloid, karena mengacu penelitian yang pernah dilakukan (Melinda, 2005) bahwa alkaloid golongan piridin-piperidin kulit batang kemiri diduga merupakan fraksi aktif yang berpotensi antibakteri terhadap S. aureus.
petroluem eter (Mursyidi, 1990). Penyarian kedua menggunakan kloroform selama 3 x 24 jam. Larutan kloroform digunakan sebagai penyari karena alkaloid mudah larut dalam cairan penyari ini (Mursyidi, 1990). Dengan menggunakan larutan penyari ini diharapkan alkaloid akan tersari seluruhnya.
Metode ekstraksi yang dilakukan adalah remaserasi kinetik. Remaserasi bertujuan untuk menyari senyawa yang mudah larut dalam cairan penyarinya dengan perbandingan cairan penyari dan serbuk yang sudah diketahui, sehingga senyawa yang tersari benar-benar senyawa yang diinginkan. Keuntungan dari metode remaserasi yaitu senyawa yang terdapat dalam serbuk kulit batang kemiri dapat tersari seluruhnya karena adanya pengulangan maserasi dengan penggantian pelarut setiap 24 jam dan dengan kinetik dapat mengoptimalkan jumlah senyawa yang dapat larut dalam kloroform. Kerugian metode ini yaitu volume pelarut yang digunakan cukup banyak. Maserasi dilakukan dengan cara merendam serbuk dengan cairan penyari dimana cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan zat aktif di luar sel, maka larutan yang terpekat akan didesak keluar. Selama proses penyarian serbuk beserta larutan penyari diletakkan di dalam erlenmeyer dan ditutup dengan kertas plastik dan
sebelumnya agar zat-zat aktif yang tersari benar-benar tersari dalam pelarut yang diinginkan.
Hasil remaserasi kinetik diperoleh ekstrak kloroform dalam bentuk ekstrak kental. Berat ekstrak kental yang didapat dari ± 250 gram serbuk kering adalah 1,32 gram ekstrak kental. Hasil remaserasi yang berupa ekstrak kental ini kemudian dilarutkan seluruhnya dalam kloroform dan dipisahkan dengan kromatografi kolom dengan tiga macam fase gerak yang berbeda agar diperoleh pemisahan zat aktif yang lebih baik.
E. Fraksinasi Dengan Kromatografi Kolom
Perbedaan perbandingan fase gerak dilakukan dengan tujuan untuk memisahkan senyawa sesuai dengan kepolarannya terhadap masing-masing fase gerak. Urutan kepolaran fase gerak dari yang lebih non-polar sampai yang lebih polar yaitu fase gerak pertama lebih non polar dari fase gerak kedua, dan fase gerak kedua lebih non polar dari fase gerak ketiga. Fase gerak pertama dikatakan lebih non polar daripada fase gerak kedua dan ketiga karena jumlah kloroforom yang digunakan lebih banyak dibandingkan pada fase gerak kedua dan ketiga.
Kromatografi kolom ini temasuk dalam kromatografi fase normal, karena fase gerak yang digunakan bersifat lebih non polar dibanding fase diamnya yaitu silika gel GF 254. Dengan fase gerak dan fase diam yang digunakan ini, diharapkan senyawa akan terpisah dengan baik berdasarkan kepolarannya. Dimana senyawa yang lebih non polar akan lebih terikat dengan fase gerak dan senyawa yang lebih polar akan terikat pada fase diam.
Keuntungan menggunakan kromatografi kolom dalam penelitian ini yaitu didapat pemisahan senyawa-senyawa menjadi beberapa fraksi berdasarkan kepolarannya terhadap fase gerak dan fase diam, sehingga proses pengidentifikasian senyawa menjadi lebih mudah. Kerugian dari kromatografi kolom ini yaitu waktu yang dibutuhkan cukup lama dan fase gerak yang digunakan cukup banyak.
dengan terbukanya pori-pori maka senyawa dapat lebih mudah berikatan dengan silika gel sehingga pemisahan lebih sempurna.
Kolom diketuk-ketuk untuk membantu kekompakan pengepakan dan homogenitas kolom serta menghilangkan gelembung udara, karena adanya gelembung udara akan menggangu proses pemisahan senyawa. Bagian atas kolom ditambah NaSO4 anhidrat dengan tujuan menyerap O2 sehingga mencegah kolom terisi oleh udara dan uap air.
Tabel II. Hasil fraksi kromatografi kolom serbuk kulit batang kemiri Fraksi Berat fraksi kental (mg)
I 134,3 III 26,4
V 15,5
Fraksi-fraksi yang didapat dari hasil pemisahan dengan kromatografi kolom selanjutnya diuji aktifitas antibakterinya. Dari lima fraksi yang didapat, hanya fraksi I, III, dan V yang diujikan pada bakteri S. aureus karena fraksi ini berasal dari fase gerak kloroform p.a : etanol p.a (95:5) sebagai fase gerak pertama, kloroform p.a : etanol p.a : asam asetat p.a (90:8:2) sebagai fase gerak kedua, dan kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) sebagai fase gerak ketiga.
F. Uji potensi antibakteri fraksi hasil kromatografi kolom dan pemilihan fraksi aktif
Ada tiga fraksi yang diujikan pada bakteri S. aureus yaitu fraksi I, III, dan V. Pengujian antibakteri dilakukan secara difusi sumuran. Uji potensi antibakteri ini dilakukan untuk mengetahui fraksi mana yang lebih aktif dalam menghambat pertumbuhan bakteri S. aureus. Hasilnya ditunjukkan dengan terbentuknya zona hambat terbesar di sekitar lubang sumuran. Bakteri S. aureus dipilih sebagai bakteri uji karena merupakan salah satu bakteri gram positif yang bersifat patogen (Jawetz et al, 1995) dan bakteri S. aureus merupakan bakteri yang saat ini sudah banyak resisten terhadap golongan antibiotik penisilin (MRSA) (Anonim, 2006). Berdasarkan penelitian (Melinda, 2005) konsentrasi 10 mg/ml merupakan konsentrasi terkecil yang masih dapat menghambat pertumbuhan bakteri S. aureus, sehingga pada penelitian ini konsentrasi yang digunakan adalah 10 mg/ml.
Metode pembiakan bakteri secara pour plate dipilih karena bakteri S. aureus
bersifat anaerob fakultatif sehingga pertumbuhannya dapat merata pada seluruh media tidak hanya pada bagian atas media, dan metode difusi sumuran dipilih karena dengan metode ini senyawa tidak hanya terdifusi pada bagian atas media tetapi akan terdifusi juga sampai ke dalam media sehingga akan menghambat pertumbuhan bakteri lebih maksimal. Fraksi aktif yang akan diujikan bersifat non polar, sedangkan media agar yang digunakan mempunyai sifat polar. DMSO disini digunakan sebagai pelarut dan berfungsi sebagai surfaktan, dengan adanya surfaktan ini maka diharapkan senyawa dapat berdifusi lebih mudah ke dalam media.
mengandung alkaloid golongan piridin-piperidin sebagai antibakteri, selain itu piridin-piperidin merupakan golongan alkaloid yang mempunyai aktivitas antibakteri yang kuat maupun lemah (Roberts, 1998). DMSO digunakan sebagai kontrol negatif karena merupakan pelarut fraksi I, III, dan V. Setelah dilakukan inkubasi selama 24 jam diperoleh zona hambat di sekitar sumuran.
Hasil uji fraksi I, III, dan V terhadap S. aureus menggunakan metode sumuran adalah sebagai berikut :
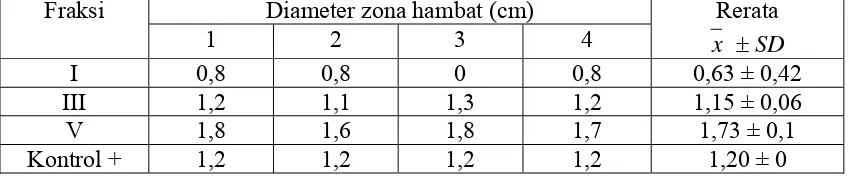
Tabel III. Rerata diameter zona hambat fraksi I, III, V terhadap Staphylococcus aureus
Dari data hasil pengujian potensi antibakteri (tabel III), fraksi aktif yang dipilih adalah fraksi V karena mempunyai rerata diameter zona hambat terbesar yaitu 1,73 cm yang lebih besar dibandingkan diameter fraksi I dan fraksi III.
Rerata zona hambat fraksi V lebih besar dari rerata zona hambat kontrol positif, sehingga fraksi ini mempunyai potensi untuk dikembangkan. Fraksi aktif ini kemudian akan diidentifikasi kualitatif menggunakan Kromatografi Lapis Tipis.
G. Identifikasi kualitatif fraksi aktif dengan metode KLT
mengetahui kandungan senyawa yang terkandung di dalamnya. Analisis kualitatif ini dilakukan dengan metode Kromatografi Lapis Tipis (KLT) dengan fase gerak dan fase diam yang sesuai sehingga dihasilkan pemisahan bercak yang baik dan dapat dideteksi dengan sinar tampak, sinar UV dan pereaksi semprot. Dari hasil orientasi, fraksi kental tidak dilarutkan dalam DMSO melainkan menggunakan aquades karena apabila dilarutkan dalam DMSO kemudian dikembangkan, diperoleh bercak yang mengekor setelah proses elusi. Hal ini mungkin disebabkan karena adanya pengotor yang terdapat dalam DMSO yang menyebabkan bercak tampak mengekor.
Sistem KLT yang digunakan berbeda dengan pustaka yang ada (Cordell, 1981). Walaupun berbeda namun dari hasil orientasi, fase gerak kloroform p.a : etanol p.a : asam asetat p.a (60:20:20) dan fase diam silika gel p.a. G 254 mampu memisahkan senyawa-senyawa yang terkandung dalam fraksi V dengan baik dan jelas. Kromatografi pada KLT ini merupakan kromatografi fase normal dimana fase gerak yang digunakan lebih non polar dibandingkan dengan fase diamnya. Deteksi bercak dilakukan dengan pengamatan dibawah sinar UV 254 nm, 365 nm dan juga dengan menggunakan pereaksi semprot Cerium Amonium Sulfat (CAS)
Penjenuhan bejana dan pengaktifan lempeng silika gel dilakukan terlebih dahulu sebelum digunakan. Tujuan dari penjenuhan ini adalah agar proses elusi dapat berjalan dengan sempurna.
Penambahan Na2CO3 akan membebaskan alkaloid basa yang larut dalam kloroform. Alkaloid kuartener tidak akan tersari oleh kloroform dan tetap pada fase air. Masing-masing larutan uji (alkaloid tersier dan kuartener) dilarutkan dalam 2-3 tetes aquades kemudian ditotolkan sebanyak 10 µl pada lempeng KLT dan dikembangkan dua kali. Pengembangan pertama berjarak 5 cm dan pengembangan kedua berjarak 10 cm sehingga total jarak pengembangan yang digunakan adalah 15 cm, pengembangan dua kali dilakukan agar bercak dapat terpisah lebih baik. Pembanding yang digunakan dalam KLT ini adalah piridin hasil sintesis.
Tabel IV. Hasil identifikasi fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) (fraksi V) alkaloid tersier dengan fase gerak kloroform p.a : etanol p.a : asam asetat p.a (60:20:20)
Deteksi warna Nama senyawa Rf
UV 365 UV 254 CAS
Alkaloid tersier 0,59 Kuning terang Ungu kehitaman
Coklat muda kekuningan Piridin 0,47 Tidak tampak Ungu
kehitaman Tidak berwarna Tabel V. Hasil identifikasi fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) (fraksi V) alkaloid kuartener dengan fase gerak kloroform p.a : etanol p.a : asam asetat p.a (60:20:20)
Deteksi warna Nama senyawa Rf
UV 365 UV 254 CAS
Alkaloid
kuartener 0,55 Tidak tampak
Setelah disemprot dengan CAS, bercak alkaloid tersier (lampiran 6) berwarna coklat muda kekuningan sedangkan bercak pada lempeng KLT untuk alkaloid kuartener berwarna coklat sangat muda (lampiran 7). Untuk identifikasi,
harga Rf ditentukan dari bercak yang timbul pada deteksi menggunakan UV 254 nm karena bercak alkaloid kuartener setelah disemprot CAS sulit terlihat.
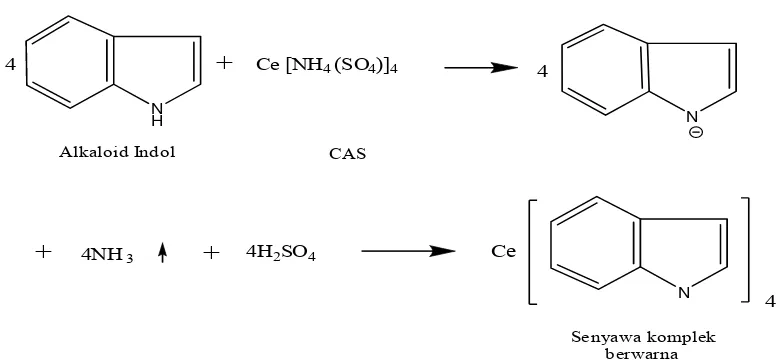
Warna coklat yang timbul disebabkan karena adanya ikatan antara logam berat pada pereaksi semprot (logam Ce pada CAS) dengan alkaloid membentuk senyawa kompleks (gambar 3).
4NH3
Gambar 3. reaksi pembentukan senyawa kompleks CAS dan alkaloid indol
kekuningan yang berada dalam rentang warna kuning-jingga, sehingga dapat dipastikan alkaloid yang terdapat dalam kulit batang kemiri diduga adalah alkaloid indol.
Piridin sebagai kontrol positif tidak terbentuk warna setelah disemprot dengan CAS karena piridin merupakan ligan yang lebih lemah dibandingkan alkaloid indol (gambar 4). Piridin memiliki satu atom N dengan pasangan elektron bebas (PEB) (Cordell, 1981), karena struktur ini maka piridin mempunyai sifat penarik elektron yang lebih kuat dibandingkan alkaloid indol. Piridin akan lebih menyetabilkan cincin aromatisnya sehingga sulit memberikan PEB untuk membentuk komplek.
N
+
piridin CAS
Ce[NH4(SO4)]4 tidak bereaksi
tidak terbentuk kompleks warna
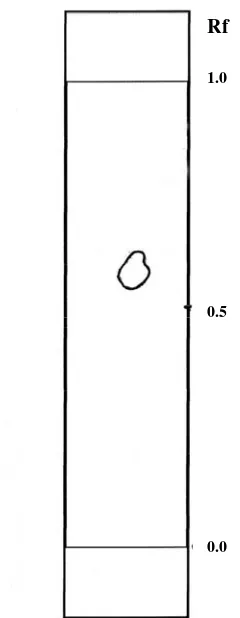
Pada masing-masing kromatogram, baik alkaloid tersier (gambar 5), maupun alkaloid kuartener (gambar 6 ) hanya terdapat satu bercak.
1.0
0.0 0.5 Rf
Fase gerak : kloroform p.a : etanol p.a : asam asetat p.a (60:20:20) Fase diam : Silika gel p.a. G 254
Deteksi : uv 254 nm
1.0
0.0 0.5 Rf
Fase gerak : kloroform p.a : etanol p.a : asam asetat p.a (60:20:20) Fase diam : Silika gel p.a. G 254
Deteksi : uv 254 nm
Gambar 6. Kromatogram fraksi V [kloroform p.a : etanol p.a : asam asetat p.a (90:5:5)] alkaloid kuartener
Karena alkaloid kuartener bersifat lebih polar dibandingkan alkaloid tersier maka alkaloid kuartener lebih terikat pada fase diam silika gel dan harga Rf alkaloid kuartener lebih kecil dibandingkan alkaloid tersier.
N ..
N+
alkaloid tersier alkaloid kuartener
Gambar 7. Struktur gugus amin pada alkaloid tersier dan kuartener
H. Uji potensi antibakteri fraksi aktif (fraksi V) terhadap Staphylococcus aureus dengan metode Bioautografi Kontak
bakteri, bakteri tidak tumbuh karena adanya kontak langsung antara bakteri dan senyawa aktif. Metode pembiakan bakteri yang digunakan pada uji ini sama dengan pada saat uji penentuan fraksi aktif yaitu metode pour plate, supaya dihasilkan kondisi pertumbuhan yang homogen.
Plat kromatogram yang telah ditotolkan kemudian dikembangkan dua kali, pengembangan pertama berjarak 5 cm dan pengembangan yang kedua berjarak 10 cm. Sebelum ditempelkan pada media agar, plat dikeringkan terlebih dahulu di dalam oven selama 24 jam pada suhu 40°C. Tujuannya supaya fase gerak yang menempel pada plat kromatogram hilang karena bisa berpengaruh pada saat penempelan dimana hasil yang diperoleh bukan merupakan aktifitas senyawa aktif, melainkan aktifitas fase gerak. Plat ditempel pada media agar selama ± 30 menit kemudian diangkat dan diinkubasi selama 24 jam pada suhu 37°C. Apabila terjadi hambatan pertumbuhan bakteri, maka akan terlihat zona hambat di sekitar bercak yang menandakan adanya aktifitas dari senyawa aktif.
(tabel VI). Hal ini tampak dari tidak munculnya zona hambat pada lempeng agar yang telah ditumbuhi bakteri Staphylococcus aureus.
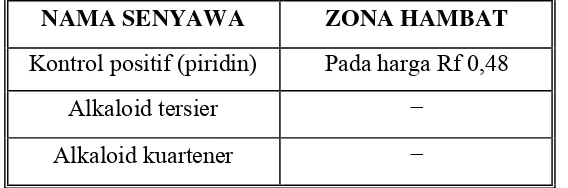
Tabel VI. Hasil Uji potensi antibakteri fraksi aktif (fraksi V) terhadap Staphylococcus aureus dengan metode Bioautografi Kontak
NAMA SENYAWA ZONA HAMBAT
Kontrol positif (piridin) Pada harga Rf 0,48
Alkaloid tersier −
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Fraksi kloroform - etanol (95:5), fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:8:2), dan fraksi kloroform p.a : etanol p.a : asam asetat p.a (90:5:5) dari ekstrak kloroform serbuk kulit batang kemiri mempunyai potensi antibakteri terhadap S. aureus.
2. Fraksi [kloroform - etanol - asam asetat (90:5:5)] ekstrak serbuk kulit batang kemiri merupakan fraksi aktif terhadap S. aureus.
3. Senyawa yang terdapat dalam fraksi aktif [kloroform - etanol - asam asetat (90:5:5)] antibakteri S. aureus kemungkinan merupakan alkaloid golongan indol. 4. Dengan metode bioautografi kontak alkaloid yang terdapat dalam fraksi aktif
[kloroform - etanol - asam asetat (90:5:5)] tidak mempunyai potensi antibakteri terhadap S. aureus.
B. Saran
1. Perlu penelusuran identitas senyawa lain yang berpotensi antibakteri dari ekstrak kloroform serbuk kulit batang kemiri
2. Perlu dilakukan penelitian tentang potensi antibakteri ekstrak kloroform serbuk kulit batang kemiri terhadap jenis bakteri Staphylococcus aureus yang saat ini telah resisten terhadap antibiotik metisilin.
DAFTAR PUSTAKA
Anonim, 1985, Cara Pembuatan Simplisia, 10-22, 36, Departemen Kesehatan RI, Jakarta
Anonim, 2006, Staphylococcus aureus, http://en.wikipedia.org/wiki/Methicillin-resistant_Staphylococcus_aureus. Diakses pada 9 Februari 2007
Anonim, 1986a, Dasar-dasar Pemeriksaan Mikrobioogi, 4-17, 27-49, 115-117, Bagian Mikrobiologi Fakultas Kedokteran UGM, Yogyakarta.
Anonim, 1986b, Sediaan Galenik, 5-12, Departemen Kesehatan Republik Indonesia, Jakarta.
Backer, C., dan Bakhuizen Van den Brink, R., C., 1965, Flora of Java, Vol 1, 441-443 ,477-478, NVP Noordhoff Gruningen, Netherlands
Brunetom, J., 1994, Pharmacognosy Phytochemistry Medicinal Plants, 2nded, 791, Lavoiser Publishing inc, New York.
Choma, I., 2005, The Use of Thin-Layer Chromatography with Direct Bioautography for Antimicrobial Analysis, http//www.lcgceurope.com /lcgceurope/ articel/ articel Detail. Diakses pada 19 Septembar 2005.
Cordell, Geoffrey, A., 1981, Introduction to Alkaloids; A Biogenetic Approach, 8, 11, 17-18, University of Illionois, United State of America
Gritter, R., J., et al., 1991, Pengantar Kromatografi, Edisi kedua, 108-169, Penerbit ITB, Bandung.
Hutapea, J.R., et al.., 1993, Inventaris Tanaman Obat Indonesia II, Departemen Kesehatan RI Badan Penelitian Dan Pengembangan Kesehatan, Jakarta. Houghton, P., J., Raman, A., 1998, Laboratory Handbook for The Fractionation of
Natural Extract, 74-84, 1st ed, Thomson Publishing, london.
Jawetz, E., Melnick, J.L., Adelberg, E.A., 1995, Medical Microbiology, 20th, 211-213, diterjemahkan oleh Edi Nugroho, R.F.Mulany, Penerbit Buku Kedokteran EGC, Jakarta
Kardono, I., Areanti, N., Dewiyanti, I., dan Basuki, T., 2003, Selected Medical Plant Monographic and Description, 56-63, PT Gramedia Widiasarana Indonesia, Jakarta.
Melinda, 2005, Potensi Antibakteri Fraksi Etil Asetat dan Fraksi Etanol Kulit Batang Kemiri [Alleurites moluccana (L.) Willd] Terhadap Staphylococcus aureus
dan Eschericia coli, Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta
Mursyidi, A., 1990, Analisis Metabolit Sekunder, cetakan pertama, 63-71, Pusat Antar Universitas Bioteknologi Universitas Gadjah Mada, Yogyakarta. Roberts, Margaret, F., and Wink, Michael, 1998, Alkaloid: Biochemistry, Ecology,
and Medicinal Applications, 87-105, 416, 421-423, Plenum Press, New York.
Salle, A. J., 1961, Fundamental Principles of Bacteriology, Edisi VI, 401-431, McGrow-Hill Book Company Inc., New York.
Sastrohamidjojo, H., 2002, Kromatografi, Edisi kedua, Cetakan ketiga, 34-35, Liberty, Yogyakarta.
Stahl, E., 1969, Thin Layer Chromatography a Laboratory Handbook, 2nd Ed, 4–17, 568, Springer-Verlag Berlin, New York.
Stahl, E., 1985, Analisis Obat Secara Kromatografi dan Mikroskopi, 3, 16-17, diterjemahkan oleh Kosasih Padmawinata, Penerbit ITB, Bandung.
Sudirman, I, L., 2005, Deteksi Senyawa Antimikroba Yang Diisolasi Dari Beberapa Lentinus Tropis Dengan Metode Bioautografi, 12, 67 – 72, Majalah Hayati, Penerbit IPB, Bogor,
Pelczar, M, J., and Chan, E, C, S., 1986, Dasar-dasar Mikrobiologi, Jilid I, 99-265, 317-408, Diterjemahkan oleh Hadioetomo, R, S., Penerbit UI, Jakarta Wagman, G.H., dan Weinstein, M.J., 1973, Chromatography of Antibiotic, Volume I,
Eliver Scientific Publishing Company, 7-11, Amsterdam-London, New York.
Lampiran 3. Foto Hasil Uji Potensi Antibakteri Fraksi Hasil Pemisahan Kromatografi Kolom Terhadap Staphylococcus aureus Secara Difusi Sumuran
Keterangan :
FI : fraksi I [kloroform p.a : etanol p.a (95:5)]
FIII : fraksi III [kloroform p.a : etanol p.a : asam asetat p.a (90:8:2)]
FV : fraksi V [kloroform p.a : etanol p.a : asam asetat p.a (90:5:5)]
KK : Kontrol Kerja
Lampiran 4. Foto Hasil Uji Potensi Antibakteri Piridin sebagai Kontrol Positif Terhadap Staphylococcus aureus Secara Difusi Sumuran
Keterangan :
Piridin: kontrol positif
KT : kontrol kerja
Lampiran 5. Foto Hasil Kromatografi Lapis Tipis (KLT) Piridin Dengan Fase Gerak Kloroform : Etanol : Asam Asetat (60:20:20)
I II
Keterangan:
Fase diam = Silika Gel G 254 nm
I. Piridin sebagai pembanding alkaloid tersier dengan UV 254 nm
Lampiran 6. Foto Hasil Kromatografi Lapis Tipis (KLT) Alkaloid tersier Dengan Fase Gerak Kloroform : Etanol : Asam Asetat Glasial (60:20:20)
I II III
Keterangan:
Fase diam = Silika Gel G 254 nm
Deteksi dengan :
I. UV 254 nm
II. UV 365 nm